专题4第二单元硫及其化合物的相互转化同步练习 (含解析)2022-2023学年上学期高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 专题4第二单元硫及其化合物的相互转化同步练习 (含解析)2022-2023学年上学期高一化学苏教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 513.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-27 10:53:45 | ||
图片预览



文档简介
专题4第二单元硫及其化合物的相互转化同步练习
一、单选题
1. 用下列两种途径制取某些反应条件和产物已省略,下列有关说法不正确的是
途径:途径:
A. 途径中反应仅体现了浓硝酸的强氧化性
B. 途径中可通过控制反应条件,将直接氧化为
C. 由途径和分别制取,理论上均消耗共转移电子
D. 途径比途径更能体现“绿色化学”的理念,因为途径的污染相对于途径更小
2. 下列有关不同价态含硫化合物的说法中错误的是
A. 工业接触法制备硫酸涉及到的转化为
B. 实验室制备乙炔中的硫化氢杂质可用溶液除去
C. 黄铁矿的主要成分为,该化合物中阴阳离子个数比为:
D. 硫在过量氧气中燃烧能够生成
3. 某工业脱硫过程如图所示不溶于水。下列说法正确的是 ( )
A. 过程发生复分解反应,由强酸反应得到弱酸
B. 过程中,发生反应的离子方程式为:
C. 过程中,每有参加反应转移电子数
D. 脱硫过程总反应为
4. 下列说法错误的是( )
A. 氯气使溶液变黄,被还原
B. 将铁屑放入稀中证明比活泼
C. 、的某些单质或两元素之间形成的某些化合物可作水的消毒剂
D. 使溴水褪色与乙烯使溶液褪色的原理相同
5. 苹果汁中含有,是一种补铁饮料。现榨的苹果汁在空气中会由淡绿色逐渐变为棕黄色。若榨汁时加入维生素,可以防止这种现象发生。这说明维生素具有( )
A. 还原性 B. 氧化性 C. 碱性 D. 酸性
6. 下列关于铝热反应的说法不正确的是 ( )
A. 该反应中做还原剂
B. 该反应中氧化产物与还原产物的物质的量之比为
C. 该反应中冶炼转移电子
D. 该反应可用于焊接钢轨
7. 高温时,在催化剂作用下还原氮氧化物可应用于烟气脱硝化,一种反应原理如图所示。下列说法正确的是
A. 反应前后的总物质的量发生改变
B. 在该过程中起催化作用,铁元素价态未发生变化
C. 反应的总方程式为
D. 反应过程中,每产生,转移电子
8. 实验室利用制取高锰酸钠的相关反应的离子方程式如下:
Ⅰ:;
Ⅱ:;
Ⅲ:。
下列说法错误的是
A. 反应Ⅰ中氧化产物和还原产物的物质的量比为
B. 酸性条件下的氧化性:
C. 可与盐酸发生反应:
D. 制得高锰酸钠时,理论上消耗氯酸钠的物质的量为
9. 用表示阿伏加德罗常数的值,下列叙述中正确的是( )
A. 分子结构:中的共价键数目为
B. 碳正离子中含有电子数为
C. 与完全反应,反应中转移的电子数介于和之间
D. 在常温常压下,和的混合气体,其体积大于
10. 天然气因含有少量等气体开采应用受限,菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是
A. 该脱硫过程中可循环利用
B. 由脱硫过程可知,氧化性:
C. 该过程每消耗标准状况下能脱除
D. 副产物硫单质可以用来制硫酸及杀虫剂等
11. 一种以黄铁矿主要成分是,设杂质均不参与反应为原料生产硫酸的简要流程图如图:
下列说法正确的是
A. 黄铁矿“煅烧”时反应的化学方程式为
B. 依据上述流程,当最终生成时,共转移电子
C. “吸收”时若用水吸收三氧化硫会在酸雾产生
D. 标准状况下,中含有的原子总数为
12. 下列化学方程式正确,且符合含硫物质的性质描述的是( )
A. 非金属硫单质具有氧化性:
B. 是一种酸性氧化物,可与碱性氧化物反应生成盐:
C. 具有还原性,可吸收:
D. 浓硫酸不易挥发,能用于制取挥发性酸:浓
13. 环境科学刊发了我国科研部门采用零价铁活化过硫酸钠,其中为价去除废水中的正五价砷的硏究成果,其反应机制模型如图所示、表示自由基。设阿伏加德罗常数的值为,下列叙述错误的是( )
A. 过硫酸钠中价氧与价氧的个数比为
B. 若参加反应,被还原的小于个
C. 碱性条件下硫酸根自由基发生反应的方程式为
D. 越小,越有利于去除废水中的正五价砷
14. 向暗红色固体表面喷洒酒精会剧烈反应,生成绿色固体,同时有具有刺激性气味的乙醛生成。下列判断错误的是( )
A. 该反应说明乙醛既有氧化性又有还原性
B. 若有乙醇参加反应,转移电子的物质的量为
C. 由此反应可知,酒精严禁与强氧化性试剂混合存放
D. 上述反应的化学方程式为
15. 去除废水中含氮离子造成的污染是目前水质改善的热点研究课题,常见的化学方法是用还原为氮气或先用臭氧、双氧水、次氯酸钠等氧化,再用还原剂除去。去除废水中含有的、的一种原理如下:,。下列说法不正确的是( )
A. 氧化性由强至弱的顺序为
B. 用镁将水中的还原成的离子方程式为
C. 根据上述资料可知与不共存,反应为
D. 等物质的量分别与臭氧、双氧水、次氯酸钠完全反应转移电子数之比为
二、填空题
16. 利用“价一类”二维图是研究、推测元素的单质、化合物化学性质的重要学习手段。如下图是硫元素的“价类”二维图,请回答下列问题:
从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有___________填化学式。
将的溶液与混合反应,该反应中氧化剂与还原剂的物质的量之比为___________。
的浓溶液与单质在加热条件下可以发生化学反应生成,该反应的化学方程式为___________。
是重要的化工原料。从氧化还原反应的角度分析,下列制备的方案理论上可行的是___________填字母。
A.
的浓溶液具有强的氧化性、吸水性和脱水性,常可作干燥剂,则下列气体可用乙干燥的是___________
A. 氨气
已知能被氧化为,则的溶液与的溶液恰好反应时,元素在还原产物中的化合价为___________。
17. A、、、、五种物质有如图所示的转化关系部分反应物产物及反应条件略去,且物质是一种淡黄色的固体,的相对分子质量为。
回答下列问题:
写出下列物质的化学式:_________,_________。
实验室中常用_________填试剂名称来检验的存在,利用的是的________性。
的浓溶液在常温下为黏稠的油状液体。
将溶液敞口放置在空气中其质量会增加,溶质的质量分数会________填“增大”“减小”或“不变”。
的浓溶液可作干燥剂,下列物质可用的浓溶液干燥的是________填字母。
氨气 氢气 二氧化硫 氧气 氯化氢
将通入的溶液中,产生的现象为_________________________________,写出对应的化学反应方程式__________________________________。
三、实验题
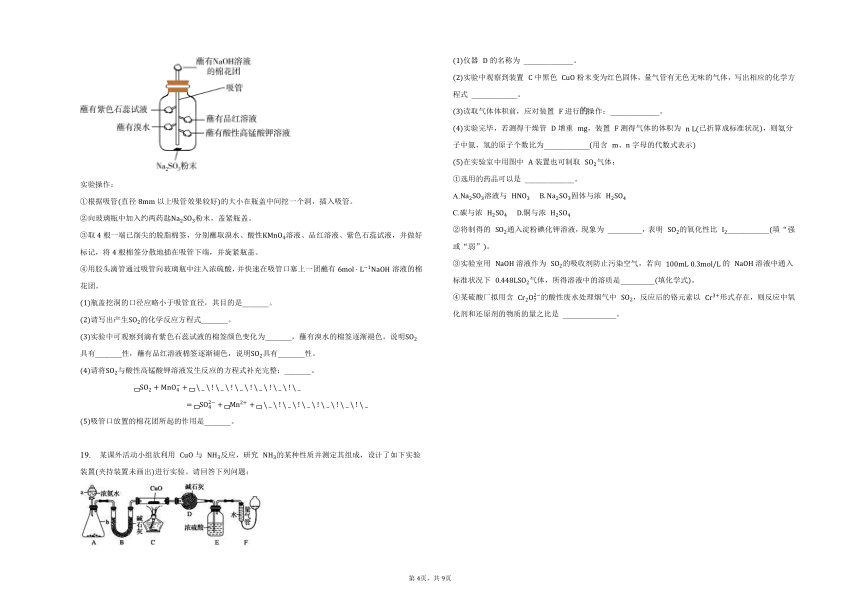
18. 某化学兴趣小组践行绿色化学理念,通过改进后的微型实验装置如图,制备并验证的相关性质。
实验操作:
根据吸管直径以上吸管效果较好的大小在瓶盖中间挖一个洞,插入吸管。
向玻璃瓶中加入约两药匙粉末,盖紧瓶盖。
取根一端已削尖的脱脂棉签,分别蘸取溴水、酸性溶液、品红溶液、紫色石蕊试液,并做好标记,将根棉签分散地插在吸管下端,并旋紧瓶盖。
用胶头滴管通过吸管向玻璃瓶中注入浓硫酸,并快速在吸管口塞上一团蘸有溶液的棉花团。
瓶盖挖洞的口径应略小于吸管直径,其目的是_______。
请写出产生的化学反应方程式_______。
实验中可观察到滴有紫色石蕊试液的棉签颜色变化为_______,蘸有溴水的棉签逐渐褪色,说明具有_______性,蘸有品红溶液棉签逐渐褪色,说明具有_______性。
请将与酸性高锰酸钾溶液发生反应的方程式补充完整:_______。
吸管口放置的棉花团所起的作用是_______。
19. 某课外活动小组欲利用 与 反应,研究 的某种性质并测定其组成,设计了如下实验装置夹持装置未画出进行实验。请回答下列问题:
仪器 的名称为 _____________。
实验中观察到装置 中黑色 粉末变为红色固体,量气管有无色无味的气体,写出相应的化学方程式 ____________。
读取气体体积前,应对装置 进行操作:_____________。
实验完毕,若测得干燥管 增重 ,装置 测得气体的体积为 已折算成标准状况,则氨分子中氮、氢的原子个数比为____________用含 、字母的代数式表示
在实验室中用图中 装置也可制取 气体:
选用的药品可以是 _____________。
A.溶液与 固体与浓
C.碳与浓 铜与浓
将制得的 通入淀粉碘化钾溶液,现象为 _________,表明 的氧化性比 ___________填“强或“弱”。
实验室用 溶液作为 的吸收剂防止污染空气,若向 的 溶液中通入标准状况下 气体,所得溶液中的溶质是_________填化学式。
某硫酸厂拟用含 的酸性废水处理烟气中 ,反应后的铬元素以 形式存在,则反应中氧化剂和还原剂的物质的量之比是 ______________。
答案和解析
1.【答案】
【解析】
【分析】
本题主要考查的是物质的性质及氧化还原反应,意在考查学生的分析能力和知识应用能力,把握发生的反应中元素的化合价变化为解答的关键。
【解答】
A.途径与浓硝酸反应生成硫酸、二氧化氮和水,氮元素全部降低,则该反应中只体现了浓硝酸的强氧化性,故A正确;
B.和反应只能生成,不会因为氧气的浓度等条件变化将直接氧化为,故B错误;
C.途径和都是由来制备,的化合价从价升高到价,制取,理论上各消耗,均共转移电子,故C正确;
D.途径与浓硝酸反应生成硫酸、二氧化氮和水,有副产物二氧化氮,而且二氧化氮会污染大气,所以途径与途径相比更能体现“绿色化学”的理念,且原子利用率,故D正确。
故选B。
2.【答案】
【解析】
【分析】
本题考查硫及其化合物的转化,题目难度不大,熟练掌握元素的化合物的性质是解答本题的关键,侧重基础知识的考查。
【解答】
A.结合图可知,为,为,为,为,与氧气反应生成氧化铁和二氧化硫,二氧化硫与氧气反应生成,与水反应生成硫酸,故A正确;
B.实验室制备乙炔中的硫化氢杂质可用溶液除去的方程式为,故B正确;
C.中阳离子为,阴离子为,故该化合物中阴阳离子个数比为:,故C正确;
D.硫在过量氧气中依然生成二氧化硫,故D错误。
3.【答案】
【解析】略
4.【答案】
【解析】A.发生反应,氯气中由价降到价,被还原,A正确;
B.将铁屑放入稀中会生成,不能生成,不能证明比活泼,B错误;
C.、、等均可作水的消毒剂,C正确;
D.使溴水褪色与乙烯使溶液褪色,都是氧化还原反应,和都具有还原性,D正确;
故选B。
5.【答案】
【解析】略
6.【答案】
【解析】由题中化学方程式可知,反应中元素的化合价由降为,则冶炼应转移电子。
7.【答案】
【解析】
【分析】
本题以在催化剂作用下还原氮氧化物的反应机理为载体,考查了化合价、化学方程式、氧化还原反应等,题目难度中等。
【解答】
A.是反应的催化剂,故反应前后总物质的量不变,错误。
B.在反应中起催化剂作用,参与了反应,价态发生了变化,错误。
C.反应的总方程式是,错误。
D.生成,参加反应,转移电子数为,正确。
8.【答案】
【解析】
【分析】
本题考查氧化还原反应,掌握对氧化还原反应关系的分析判断及计算是解答的关键,题目难度一般。
【解答】
A.反应Ⅰ中还原剂是、氧化剂是,由方程式可知,还原剂的氧化产物和氧化剂的还原产物的物质的量比为,故A正确;
B.反应Ⅱ是在碱性条件下进行,则不能得出酸性条件下的氧化性:,故B错误;
C.由反应Ⅲ可得酸性条件下氧化性:,又知高锰酸钾可与浓盐酸反应制氯气,则可与盐酸发生反应:,故C正确;
D.由题干反应可得:,制得即 高锰酸钠时,理论上消耗氯酸钠的物质的量为,故D正确。
9.【答案】
【解析】
【分析】
略
【解答】
A.的物质的量为,分子结构:中的共价键数目为,A错误;
B.每个 中含有电子数为,碳正离子中含有电子数为,B错误;
C.的物质的量为,与完全反应,钠反应后变为价,反应中转移的电子数,C错误;
D.标况的条件是温度为、压强为千帕,和的混合气体,体积为;在常温常压下,即温度升高,和的混合气体,其体积大于,D正确;
答案选D。
10.【答案】
【解析】
【分析】
本题考查天然气催化脱硫,通过读图可知脱硫过程:氧化硫化氢,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,脱硫过程间接氧化是解答关键,侧面考查了学生的读图、分析和理解能力,题目难度不大。
【解答】
A.氧化硫化氢,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,为催化剂,可循环使用;
B.脱硫过程直接氧化生成,氧化硫化氢生成,氧化性强弱:;
C.该过程总反应为,每消耗氧气,可消耗硫化氢,氧气为,则消耗硫化氢为,能脱除;
D.副产物具有杀菌消毒作用可做杀虫剂,还可以用来制硫酸等;
11.【答案】
【解析】
【分析】
本题考查硫酸工业,难度一般,掌握硫及其化合物的性质和转化,硫酸的工业制备即可解答。
【解答】
A.黄铁矿“煅烧”时反应生成三氧化二铁和二氧化硫,化学方程式为,故A错误;
B.依据上述流程,当最终生成时,消耗,由价生成价,失去电子,由价升高到价,失去电子,共转移电子,由于二氧化硫不能完全转化为三氧化硫,需要生成更多的二氧化硫,则转移电子大于,故B错误;
C.“吸收”时若用水吸收三氧化硫,水的沸点低,挥发气化,再吸收三氧化硫在酸雾产生,故C正确;
D.标准状况下, 为非气体,不能计算物质的量,故D错误。
12.【答案】
【解析】
【分析】
本题主要考查的是化学反应方程式正误的判断,解题的关键是掌握硫及其化合物的性质。
【解答】
A.硫与铁反应方程式为 ,故A错误;
B.过氧化钠不是碱性氧化物,故B错误;
C.具有还原性,能被氯气氧化为硫酸钠:,故C错误;
D.难挥发性的酸能制取易挥发性的酸,浓 ,故D正确。
13.【答案】
【解析】略
14.【答案】
【解析】由题目信息可写出该反应的化学方程式为,在该反应中为还原剂,乙醛是氧化产物,根据该反应无法说明乙醛既有氧化性又有还原性,项错误,项正确;根据该反应的化学方程式可知,若有乙醇参加反应,则转移电子,项正确;由此反应可知,乙醇易被强氧化性物质氧化,且生成的乙醛易挥发,蒸气能与空气形成爆炸性混合物,故酒精严禁与强氧化性物质混合存放,项正确。
15.【答案】
【解析】略
16.【答案】、、
: 浓
【解析】
【分析】由硫元素的“价类”二维图可知,为,为,为。
【小问详解】
当含硫化合物中硫元素处于中间价态,该化合物既有氧化性又有还原性,图中、、中硫元素处于价,硫元素处于中间价态,这些化合物既有氧化性又有还原性,故答案为:、、;
【小问详解】
由图可知,为,为,两者混合,可生成淡黄色固体,反应的化学方程式为,则氧化剂为,还原剂为,该反应中氧化剂与还原剂的物质的量之比为:,故答案为::;
【小问详解】
的浓溶液为浓硫酸,与浓硫酸在加热的条件下反应生成二氧化硫和水,则该反应的化学方程式为浓 ,故答案为:浓 ;
【小问详解】
中硫元素化合价为价,根据氧化还原反应原理,在反应过程中既要有元素化合价的升高,也要有元素化合价的降低,据此分析解题:
A.若和生成,中硫元素由价升高到价,硫单质中硫元素由价上升到价,只有化合价的升高,不合题意;
B.和生成,中硫元素由价下降到价,硫单质中硫元素由价上升到价,符合氧化还原反应原理,符合题意;
C.若和生成,中硫元素由价下降到价,中硫元素由价下降到价,只有化合价的降低,不合题意;
D.若和生成,中硫元素由价下降到价,中硫元素由价下降到价,只有化合价的降低,不合题意;
故答案为:;
【小问详解】
A.为,具有还原性,浓硫酸可以氧化,不能干燥,不选;
B.浓硫酸不能氧化,可以干燥,选;
C.氨气可以和硫酸发生中和反应,不能干燥,不选;
D.具有还原性,浓硫酸可以氧化,不能干燥,不选;
故选B;
【小问详解】
已知 能被 氧化为 ,则 的 溶液与 的 溶液恰好反应时,设元素在还原产物中的化合价为价,根据氧化还原反应中得失电子总数相等可知,,解得,故答案为:。
17.【答案】;
品红溶液;漂白
减小
生成黄色沉淀;
【解析】
【分析】
本题考查含硫化合物之间的性质与相互转化关系,涉及化学式、化学反应方程式的书写,二氧化硫、浓硫酸的性质等知识,题目难度一般。
【解答】
由物质是一种淡黄色的固体可知,为硫单质;结合题干中的转化关系和的相对分子质量为可知,为、为、为;由的浓溶液在常温下为黏稠的油状液体,且铜与反应生成二氧化硫,则为硫酸,据此解答:
由以上分析可知,的化学式为;的化学式为;
二氧化硫具有漂白性,能使品红溶液褪色,实验室中常用此方法检验二氧化硫的存在;
由以上分析可知,的浓溶液为浓硫酸;
将浓硫酸溶液具有吸水性,敞口放置在空气中其质量会增加,溶质的质量分数会减小;
浓硫酸溶液可作干燥剂,常用于干燥酸性气体和非还原性气体;
氨气能与硫酸反应生成硫酸铵,不能用浓硫酸干燥,故错误;
氢气不能与浓硫酸反应,可以用浓硫酸干燥,故正确;
二氧化硫为酸性气体,不能与浓硫酸反应,可以用浓硫酸干燥,故正确;
氧气不能与浓硫酸反应,可以用浓硫酸干燥,故正确;
氯化氢是酸性气体,不能与浓硫酸反应,可以用浓硫酸干燥,故正确;
通入的溶液中,发生氧化还原反应生成黄色沉淀单质;根据元素守恒与电荷守恒可知,化学反应方程式为。
18.【答案】保证装置气密性良好防止气体外泄,避免污染空气合理即可
由紫色变为红色 还原性 漂白性
吸收多余,防止污染环境
【解析】
【分析】
本实验利用浓硫酸和亚硫酸钠固体反应制备二氧化硫,方程式为:,再验证二氧化硫的一系列性质。
瓶盖挖洞的口径应略小于吸管直径,其目的是:保证装置气密性良好防止气体外泄,避免污染空气合理即可;
根据分析可知,制备二氧化硫的化学方程式为:;
二氧化硫溶于水溶液显酸性,能使紫色石蕊试液变红,故滴有紫色石蕊试液的棉签颜色变化为:由紫色变为红色;二氧化硫与溴水发生氧化还原反应生成硫酸和氢溴酸,体现还原性,故能使蘸有溴水的棉签逐渐褪色,具有还原性;二氧化硫能使蘸有品红溶液棉签逐渐褪色,说明具有漂白性;
与酸性高锰酸钾溶液发生反应的方程式:;
二氧化硫是一种污染性气体,故吸管口放置的棉花团所起的作用是吸收多余,防止污染环境。
19.【答案】球形干燥管;
;
调整装置,使两边液面相平;
;
;无明显现象;弱;和;:。
【解析】【解析】
本题考查了氨气的实验室制备,性质验证和反应现象分析判断判断,装置流程分析,量气装置的使用方法,测定元素物质的量之比的计算,掌握实验原理和操作为解题关键,题目难度中等,侧重考查分析能力和实验能力。
【解答】
装置中仪器为球形干燥管;
实验中观察到装置中黑色粉末变为红色固体,量气管有无色无味的气体,说明氨气和氧化铜反应生成铜和氮气与水,化学方程式为:;
读取气体体积前,应对装置进行的操作是慢慢上下移动右边漏斗,使左右两管液面相平,保持压强平衡再读数;
若测得干燥管增重,则水的物质的量,装置测得气体的体积为已折算成标准状况为,物质的量,依据元素守恒得到氮原子和氢原子物质的量之比:,则氨分子中氮、氢的原子个数比为;
装置为固液不加热型反应装置,所以制取二氧化硫应选择固体与浓;
项中硝酸有强氧化性,能氧化二氧化硫,故错误;、需要加热才能发生,故错误;
故选B;
不能和反应,所以将制得的通入淀粉碘化钾溶液,无明显现象,不能将氧化成,表明的氧化性比 弱;
故答案为:无明显现象;弱;
将通到溶液中,发生的反应先是:,::时恰好完全反应生成;然后是:,总反应为:,::时恰好完全反应生成,根据题给信息, ,,:::,介于:和:之间,则所得溶质为和;
故答案为:和;
氧化还原反应中有元素化合价升高,同时有元素化合价降低。根据题意,的化合价变化为:,为氧化剂, 得电子;则被氧化为,为还原剂,的化合价变化为:,失电子,根据电子得失守恒,氧化剂和还原剂的物质的量之比为::;
故答案为::。
第1页,共1页
一、单选题
1. 用下列两种途径制取某些反应条件和产物已省略,下列有关说法不正确的是
途径:途径:
A. 途径中反应仅体现了浓硝酸的强氧化性
B. 途径中可通过控制反应条件,将直接氧化为
C. 由途径和分别制取,理论上均消耗共转移电子
D. 途径比途径更能体现“绿色化学”的理念,因为途径的污染相对于途径更小
2. 下列有关不同价态含硫化合物的说法中错误的是
A. 工业接触法制备硫酸涉及到的转化为
B. 实验室制备乙炔中的硫化氢杂质可用溶液除去
C. 黄铁矿的主要成分为,该化合物中阴阳离子个数比为:
D. 硫在过量氧气中燃烧能够生成
3. 某工业脱硫过程如图所示不溶于水。下列说法正确的是 ( )
A. 过程发生复分解反应,由强酸反应得到弱酸
B. 过程中,发生反应的离子方程式为:
C. 过程中,每有参加反应转移电子数
D. 脱硫过程总反应为
4. 下列说法错误的是( )
A. 氯气使溶液变黄,被还原
B. 将铁屑放入稀中证明比活泼
C. 、的某些单质或两元素之间形成的某些化合物可作水的消毒剂
D. 使溴水褪色与乙烯使溶液褪色的原理相同
5. 苹果汁中含有,是一种补铁饮料。现榨的苹果汁在空气中会由淡绿色逐渐变为棕黄色。若榨汁时加入维生素,可以防止这种现象发生。这说明维生素具有( )
A. 还原性 B. 氧化性 C. 碱性 D. 酸性
6. 下列关于铝热反应的说法不正确的是 ( )
A. 该反应中做还原剂
B. 该反应中氧化产物与还原产物的物质的量之比为
C. 该反应中冶炼转移电子
D. 该反应可用于焊接钢轨
7. 高温时,在催化剂作用下还原氮氧化物可应用于烟气脱硝化,一种反应原理如图所示。下列说法正确的是
A. 反应前后的总物质的量发生改变
B. 在该过程中起催化作用,铁元素价态未发生变化
C. 反应的总方程式为
D. 反应过程中,每产生,转移电子
8. 实验室利用制取高锰酸钠的相关反应的离子方程式如下:
Ⅰ:;
Ⅱ:;
Ⅲ:。
下列说法错误的是
A. 反应Ⅰ中氧化产物和还原产物的物质的量比为
B. 酸性条件下的氧化性:
C. 可与盐酸发生反应:
D. 制得高锰酸钠时,理论上消耗氯酸钠的物质的量为
9. 用表示阿伏加德罗常数的值,下列叙述中正确的是( )
A. 分子结构:中的共价键数目为
B. 碳正离子中含有电子数为
C. 与完全反应,反应中转移的电子数介于和之间
D. 在常温常压下,和的混合气体,其体积大于
10. 天然气因含有少量等气体开采应用受限,菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是
A. 该脱硫过程中可循环利用
B. 由脱硫过程可知,氧化性:
C. 该过程每消耗标准状况下能脱除
D. 副产物硫单质可以用来制硫酸及杀虫剂等
11. 一种以黄铁矿主要成分是,设杂质均不参与反应为原料生产硫酸的简要流程图如图:
下列说法正确的是
A. 黄铁矿“煅烧”时反应的化学方程式为
B. 依据上述流程,当最终生成时,共转移电子
C. “吸收”时若用水吸收三氧化硫会在酸雾产生
D. 标准状况下,中含有的原子总数为
12. 下列化学方程式正确,且符合含硫物质的性质描述的是( )
A. 非金属硫单质具有氧化性:
B. 是一种酸性氧化物,可与碱性氧化物反应生成盐:
C. 具有还原性,可吸收:
D. 浓硫酸不易挥发,能用于制取挥发性酸:浓
13. 环境科学刊发了我国科研部门采用零价铁活化过硫酸钠,其中为价去除废水中的正五价砷的硏究成果,其反应机制模型如图所示、表示自由基。设阿伏加德罗常数的值为,下列叙述错误的是( )
A. 过硫酸钠中价氧与价氧的个数比为
B. 若参加反应,被还原的小于个
C. 碱性条件下硫酸根自由基发生反应的方程式为
D. 越小,越有利于去除废水中的正五价砷
14. 向暗红色固体表面喷洒酒精会剧烈反应,生成绿色固体,同时有具有刺激性气味的乙醛生成。下列判断错误的是( )
A. 该反应说明乙醛既有氧化性又有还原性
B. 若有乙醇参加反应,转移电子的物质的量为
C. 由此反应可知,酒精严禁与强氧化性试剂混合存放
D. 上述反应的化学方程式为
15. 去除废水中含氮离子造成的污染是目前水质改善的热点研究课题,常见的化学方法是用还原为氮气或先用臭氧、双氧水、次氯酸钠等氧化,再用还原剂除去。去除废水中含有的、的一种原理如下:,。下列说法不正确的是( )
A. 氧化性由强至弱的顺序为
B. 用镁将水中的还原成的离子方程式为
C. 根据上述资料可知与不共存,反应为
D. 等物质的量分别与臭氧、双氧水、次氯酸钠完全反应转移电子数之比为
二、填空题
16. 利用“价一类”二维图是研究、推测元素的单质、化合物化学性质的重要学习手段。如下图是硫元素的“价类”二维图,请回答下列问题:
从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有___________填化学式。
将的溶液与混合反应,该反应中氧化剂与还原剂的物质的量之比为___________。
的浓溶液与单质在加热条件下可以发生化学反应生成,该反应的化学方程式为___________。
是重要的化工原料。从氧化还原反应的角度分析,下列制备的方案理论上可行的是___________填字母。
A.
的浓溶液具有强的氧化性、吸水性和脱水性,常可作干燥剂,则下列气体可用乙干燥的是___________
A. 氨气
已知能被氧化为,则的溶液与的溶液恰好反应时,元素在还原产物中的化合价为___________。
17. A、、、、五种物质有如图所示的转化关系部分反应物产物及反应条件略去,且物质是一种淡黄色的固体,的相对分子质量为。
回答下列问题:
写出下列物质的化学式:_________,_________。
实验室中常用_________填试剂名称来检验的存在,利用的是的________性。
的浓溶液在常温下为黏稠的油状液体。
将溶液敞口放置在空气中其质量会增加,溶质的质量分数会________填“增大”“减小”或“不变”。
的浓溶液可作干燥剂,下列物质可用的浓溶液干燥的是________填字母。
氨气 氢气 二氧化硫 氧气 氯化氢
将通入的溶液中,产生的现象为_________________________________,写出对应的化学反应方程式__________________________________。
三、实验题
18. 某化学兴趣小组践行绿色化学理念,通过改进后的微型实验装置如图,制备并验证的相关性质。
实验操作:
根据吸管直径以上吸管效果较好的大小在瓶盖中间挖一个洞,插入吸管。
向玻璃瓶中加入约两药匙粉末,盖紧瓶盖。
取根一端已削尖的脱脂棉签,分别蘸取溴水、酸性溶液、品红溶液、紫色石蕊试液,并做好标记,将根棉签分散地插在吸管下端,并旋紧瓶盖。
用胶头滴管通过吸管向玻璃瓶中注入浓硫酸,并快速在吸管口塞上一团蘸有溶液的棉花团。
瓶盖挖洞的口径应略小于吸管直径,其目的是_______。
请写出产生的化学反应方程式_______。
实验中可观察到滴有紫色石蕊试液的棉签颜色变化为_______,蘸有溴水的棉签逐渐褪色,说明具有_______性,蘸有品红溶液棉签逐渐褪色,说明具有_______性。
请将与酸性高锰酸钾溶液发生反应的方程式补充完整:_______。
吸管口放置的棉花团所起的作用是_______。
19. 某课外活动小组欲利用 与 反应,研究 的某种性质并测定其组成,设计了如下实验装置夹持装置未画出进行实验。请回答下列问题:
仪器 的名称为 _____________。
实验中观察到装置 中黑色 粉末变为红色固体,量气管有无色无味的气体,写出相应的化学方程式 ____________。
读取气体体积前,应对装置 进行操作:_____________。
实验完毕,若测得干燥管 增重 ,装置 测得气体的体积为 已折算成标准状况,则氨分子中氮、氢的原子个数比为____________用含 、字母的代数式表示
在实验室中用图中 装置也可制取 气体:
选用的药品可以是 _____________。
A.溶液与 固体与浓
C.碳与浓 铜与浓
将制得的 通入淀粉碘化钾溶液,现象为 _________,表明 的氧化性比 ___________填“强或“弱”。
实验室用 溶液作为 的吸收剂防止污染空气,若向 的 溶液中通入标准状况下 气体,所得溶液中的溶质是_________填化学式。
某硫酸厂拟用含 的酸性废水处理烟气中 ,反应后的铬元素以 形式存在,则反应中氧化剂和还原剂的物质的量之比是 ______________。
答案和解析
1.【答案】
【解析】
【分析】
本题主要考查的是物质的性质及氧化还原反应,意在考查学生的分析能力和知识应用能力,把握发生的反应中元素的化合价变化为解答的关键。
【解答】
A.途径与浓硝酸反应生成硫酸、二氧化氮和水,氮元素全部降低,则该反应中只体现了浓硝酸的强氧化性,故A正确;
B.和反应只能生成,不会因为氧气的浓度等条件变化将直接氧化为,故B错误;
C.途径和都是由来制备,的化合价从价升高到价,制取,理论上各消耗,均共转移电子,故C正确;
D.途径与浓硝酸反应生成硫酸、二氧化氮和水,有副产物二氧化氮,而且二氧化氮会污染大气,所以途径与途径相比更能体现“绿色化学”的理念,且原子利用率,故D正确。
故选B。
2.【答案】
【解析】
【分析】
本题考查硫及其化合物的转化,题目难度不大,熟练掌握元素的化合物的性质是解答本题的关键,侧重基础知识的考查。
【解答】
A.结合图可知,为,为,为,为,与氧气反应生成氧化铁和二氧化硫,二氧化硫与氧气反应生成,与水反应生成硫酸,故A正确;
B.实验室制备乙炔中的硫化氢杂质可用溶液除去的方程式为,故B正确;
C.中阳离子为,阴离子为,故该化合物中阴阳离子个数比为:,故C正确;
D.硫在过量氧气中依然生成二氧化硫,故D错误。
3.【答案】
【解析】略
4.【答案】
【解析】A.发生反应,氯气中由价降到价,被还原,A正确;
B.将铁屑放入稀中会生成,不能生成,不能证明比活泼,B错误;
C.、、等均可作水的消毒剂,C正确;
D.使溴水褪色与乙烯使溶液褪色,都是氧化还原反应,和都具有还原性,D正确;
故选B。
5.【答案】
【解析】略
6.【答案】
【解析】由题中化学方程式可知,反应中元素的化合价由降为,则冶炼应转移电子。
7.【答案】
【解析】
【分析】
本题以在催化剂作用下还原氮氧化物的反应机理为载体,考查了化合价、化学方程式、氧化还原反应等,题目难度中等。
【解答】
A.是反应的催化剂,故反应前后总物质的量不变,错误。
B.在反应中起催化剂作用,参与了反应,价态发生了变化,错误。
C.反应的总方程式是,错误。
D.生成,参加反应,转移电子数为,正确。
8.【答案】
【解析】
【分析】
本题考查氧化还原反应,掌握对氧化还原反应关系的分析判断及计算是解答的关键,题目难度一般。
【解答】
A.反应Ⅰ中还原剂是、氧化剂是,由方程式可知,还原剂的氧化产物和氧化剂的还原产物的物质的量比为,故A正确;
B.反应Ⅱ是在碱性条件下进行,则不能得出酸性条件下的氧化性:,故B错误;
C.由反应Ⅲ可得酸性条件下氧化性:,又知高锰酸钾可与浓盐酸反应制氯气,则可与盐酸发生反应:,故C正确;
D.由题干反应可得:,制得即 高锰酸钠时,理论上消耗氯酸钠的物质的量为,故D正确。
9.【答案】
【解析】
【分析】
略
【解答】
A.的物质的量为,分子结构:中的共价键数目为,A错误;
B.每个 中含有电子数为,碳正离子中含有电子数为,B错误;
C.的物质的量为,与完全反应,钠反应后变为价,反应中转移的电子数,C错误;
D.标况的条件是温度为、压强为千帕,和的混合气体,体积为;在常温常压下,即温度升高,和的混合气体,其体积大于,D正确;
答案选D。
10.【答案】
【解析】
【分析】
本题考查天然气催化脱硫,通过读图可知脱硫过程:氧化硫化氢,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,脱硫过程间接氧化是解答关键,侧面考查了学生的读图、分析和理解能力,题目难度不大。
【解答】
A.氧化硫化氢,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,为催化剂,可循环使用;
B.脱硫过程直接氧化生成,氧化硫化氢生成,氧化性强弱:;
C.该过程总反应为,每消耗氧气,可消耗硫化氢,氧气为,则消耗硫化氢为,能脱除;
D.副产物具有杀菌消毒作用可做杀虫剂,还可以用来制硫酸等;
11.【答案】
【解析】
【分析】
本题考查硫酸工业,难度一般,掌握硫及其化合物的性质和转化,硫酸的工业制备即可解答。
【解答】
A.黄铁矿“煅烧”时反应生成三氧化二铁和二氧化硫,化学方程式为,故A错误;
B.依据上述流程,当最终生成时,消耗,由价生成价,失去电子,由价升高到价,失去电子,共转移电子,由于二氧化硫不能完全转化为三氧化硫,需要生成更多的二氧化硫,则转移电子大于,故B错误;
C.“吸收”时若用水吸收三氧化硫,水的沸点低,挥发气化,再吸收三氧化硫在酸雾产生,故C正确;
D.标准状况下, 为非气体,不能计算物质的量,故D错误。
12.【答案】
【解析】
【分析】
本题主要考查的是化学反应方程式正误的判断,解题的关键是掌握硫及其化合物的性质。
【解答】
A.硫与铁反应方程式为 ,故A错误;
B.过氧化钠不是碱性氧化物,故B错误;
C.具有还原性,能被氯气氧化为硫酸钠:,故C错误;
D.难挥发性的酸能制取易挥发性的酸,浓 ,故D正确。
13.【答案】
【解析】略
14.【答案】
【解析】由题目信息可写出该反应的化学方程式为,在该反应中为还原剂,乙醛是氧化产物,根据该反应无法说明乙醛既有氧化性又有还原性,项错误,项正确;根据该反应的化学方程式可知,若有乙醇参加反应,则转移电子,项正确;由此反应可知,乙醇易被强氧化性物质氧化,且生成的乙醛易挥发,蒸气能与空气形成爆炸性混合物,故酒精严禁与强氧化性物质混合存放,项正确。
15.【答案】
【解析】略
16.【答案】、、
: 浓
【解析】
【分析】由硫元素的“价类”二维图可知,为,为,为。
【小问详解】
当含硫化合物中硫元素处于中间价态,该化合物既有氧化性又有还原性,图中、、中硫元素处于价,硫元素处于中间价态,这些化合物既有氧化性又有还原性,故答案为:、、;
【小问详解】
由图可知,为,为,两者混合,可生成淡黄色固体,反应的化学方程式为,则氧化剂为,还原剂为,该反应中氧化剂与还原剂的物质的量之比为:,故答案为::;
【小问详解】
的浓溶液为浓硫酸,与浓硫酸在加热的条件下反应生成二氧化硫和水,则该反应的化学方程式为浓 ,故答案为:浓 ;
【小问详解】
中硫元素化合价为价,根据氧化还原反应原理,在反应过程中既要有元素化合价的升高,也要有元素化合价的降低,据此分析解题:
A.若和生成,中硫元素由价升高到价,硫单质中硫元素由价上升到价,只有化合价的升高,不合题意;
B.和生成,中硫元素由价下降到价,硫单质中硫元素由价上升到价,符合氧化还原反应原理,符合题意;
C.若和生成,中硫元素由价下降到价,中硫元素由价下降到价,只有化合价的降低,不合题意;
D.若和生成,中硫元素由价下降到价,中硫元素由价下降到价,只有化合价的降低,不合题意;
故答案为:;
【小问详解】
A.为,具有还原性,浓硫酸可以氧化,不能干燥,不选;
B.浓硫酸不能氧化,可以干燥,选;
C.氨气可以和硫酸发生中和反应,不能干燥,不选;
D.具有还原性,浓硫酸可以氧化,不能干燥,不选;
故选B;
【小问详解】
已知 能被 氧化为 ,则 的 溶液与 的 溶液恰好反应时,设元素在还原产物中的化合价为价,根据氧化还原反应中得失电子总数相等可知,,解得,故答案为:。
17.【答案】;
品红溶液;漂白
减小
生成黄色沉淀;
【解析】
【分析】
本题考查含硫化合物之间的性质与相互转化关系,涉及化学式、化学反应方程式的书写,二氧化硫、浓硫酸的性质等知识,题目难度一般。
【解答】
由物质是一种淡黄色的固体可知,为硫单质;结合题干中的转化关系和的相对分子质量为可知,为、为、为;由的浓溶液在常温下为黏稠的油状液体,且铜与反应生成二氧化硫,则为硫酸,据此解答:
由以上分析可知,的化学式为;的化学式为;
二氧化硫具有漂白性,能使品红溶液褪色,实验室中常用此方法检验二氧化硫的存在;
由以上分析可知,的浓溶液为浓硫酸;
将浓硫酸溶液具有吸水性,敞口放置在空气中其质量会增加,溶质的质量分数会减小;
浓硫酸溶液可作干燥剂,常用于干燥酸性气体和非还原性气体;
氨气能与硫酸反应生成硫酸铵,不能用浓硫酸干燥,故错误;
氢气不能与浓硫酸反应,可以用浓硫酸干燥,故正确;
二氧化硫为酸性气体,不能与浓硫酸反应,可以用浓硫酸干燥,故正确;
氧气不能与浓硫酸反应,可以用浓硫酸干燥,故正确;
氯化氢是酸性气体,不能与浓硫酸反应,可以用浓硫酸干燥,故正确;
通入的溶液中,发生氧化还原反应生成黄色沉淀单质;根据元素守恒与电荷守恒可知,化学反应方程式为。
18.【答案】保证装置气密性良好防止气体外泄,避免污染空气合理即可
由紫色变为红色 还原性 漂白性
吸收多余,防止污染环境
【解析】
【分析】
本实验利用浓硫酸和亚硫酸钠固体反应制备二氧化硫,方程式为:,再验证二氧化硫的一系列性质。
瓶盖挖洞的口径应略小于吸管直径,其目的是:保证装置气密性良好防止气体外泄,避免污染空气合理即可;
根据分析可知,制备二氧化硫的化学方程式为:;
二氧化硫溶于水溶液显酸性,能使紫色石蕊试液变红,故滴有紫色石蕊试液的棉签颜色变化为:由紫色变为红色;二氧化硫与溴水发生氧化还原反应生成硫酸和氢溴酸,体现还原性,故能使蘸有溴水的棉签逐渐褪色,具有还原性;二氧化硫能使蘸有品红溶液棉签逐渐褪色,说明具有漂白性;
与酸性高锰酸钾溶液发生反应的方程式:;
二氧化硫是一种污染性气体,故吸管口放置的棉花团所起的作用是吸收多余,防止污染环境。
19.【答案】球形干燥管;
;
调整装置,使两边液面相平;
;
;无明显现象;弱;和;:。
【解析】【解析】
本题考查了氨气的实验室制备,性质验证和反应现象分析判断判断,装置流程分析,量气装置的使用方法,测定元素物质的量之比的计算,掌握实验原理和操作为解题关键,题目难度中等,侧重考查分析能力和实验能力。
【解答】
装置中仪器为球形干燥管;
实验中观察到装置中黑色粉末变为红色固体,量气管有无色无味的气体,说明氨气和氧化铜反应生成铜和氮气与水,化学方程式为:;
读取气体体积前,应对装置进行的操作是慢慢上下移动右边漏斗,使左右两管液面相平,保持压强平衡再读数;
若测得干燥管增重,则水的物质的量,装置测得气体的体积为已折算成标准状况为,物质的量,依据元素守恒得到氮原子和氢原子物质的量之比:,则氨分子中氮、氢的原子个数比为;
装置为固液不加热型反应装置,所以制取二氧化硫应选择固体与浓;
项中硝酸有强氧化性,能氧化二氧化硫,故错误;、需要加热才能发生,故错误;
故选B;
不能和反应,所以将制得的通入淀粉碘化钾溶液,无明显现象,不能将氧化成,表明的氧化性比 弱;
故答案为:无明显现象;弱;
将通到溶液中,发生的反应先是:,::时恰好完全反应生成;然后是:,总反应为:,::时恰好完全反应生成,根据题给信息, ,,:::,介于:和:之间,则所得溶质为和;
故答案为:和;
氧化还原反应中有元素化合价升高,同时有元素化合价降低。根据题意,的化合价变化为:,为氧化剂, 得电子;则被氧化为,为还原剂,的化合价变化为:,失电子,根据电子得失守恒,氧化剂和还原剂的物质的量之比为::;
故答案为::。
第1页,共1页
