第3章 物质的性质与转化 单元测试 (含解析)高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 第3章 物质的性质与转化 单元测试 (含解析)高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 488.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-27 10:55:04 | ||
图片预览


文档简介
第3章物质的性质与转化 单元测试
上学期高一化学鲁科版(2019)必修第一册
一、单选题
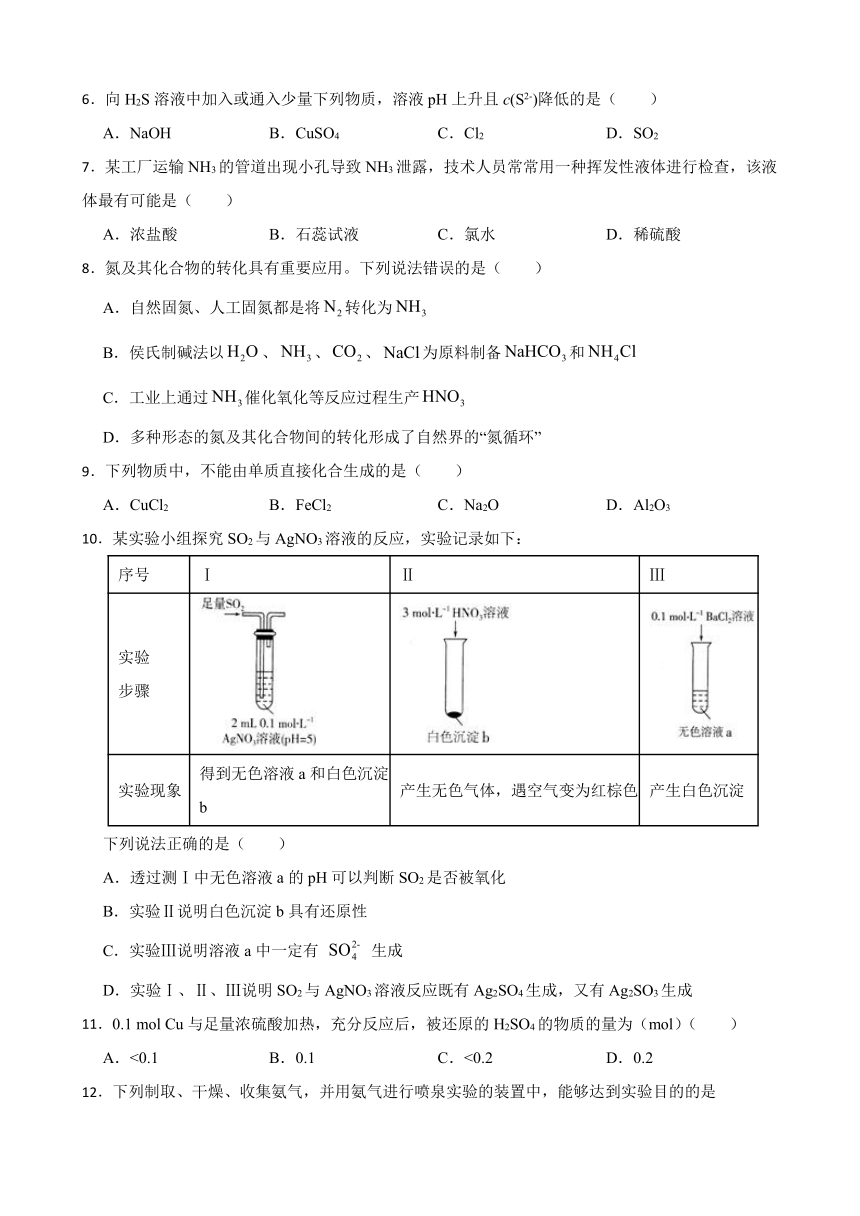
1.向溶液中依次通入过量的下列气体,第一次无沉淀,第二次有沉淀的组合是( )
选项 A B C D
第一次
第二次 NO
A.A B.B C.C D.D
2.2022年北京冬奥会是一届科技冬奥、绿色冬奥。下列冬奥会期间实行的措施是为了防止白色污染的是( )
A.“飞扬”火炬采用氢气作为燃料
B.冬奥会所有场馆100%采用太阳能、风能供电
C.“冰丝带”制冰用二氧化碳代替传统的氟利昂作制冷剂
D.冬奥会使用以玉米、秸秆等为原料合成的可降解高分子材料制作餐具
3.空气质量报告中,不包含的指标是( )
A.CO2含量 B.SO2含量
C.氮氧化合物含量 D.可吸入颗粒物
4.化学与生产、生活密切相关,下列说法正确的是( )
A.蓝矾可用于饮用水的杀菌消毒
B.纯碱能除去物品表面的油污
C.回收处理废旧电池,主要是为了变废为宝
D.燃煤时加入生石灰可以减少酸雨的形成及温室气体的排放
5.检验某溶液中是否含有SO42-时,为防止Ag+、CO32-、SO32-等离子的干扰,下列实验方案比较严密的是( )
A.先加稀HCl将溶液酸化,再滴加BaCl2溶液,看是否生成白色沉淀;
B.先加稀HNO3将溶液酸化,再滴加BaCl2溶液,看是否生成白色沉淀;
C.向溶液中滴加稀盐酸酸化的BaCl2溶液,看是否生成白色沉淀;
D.向溶液中滴加稀硝酸酸化的BaCl2溶液,看是否生成白色沉淀;
6.向H2S溶液中加入或通入少量下列物质,溶液pH上升且c(S2-)降低的是( )
A.NaOH B.CuSO4 C.Cl2 D.SO2
7.某工厂运输NH3的管道出现小孔导致NH3泄露,技术人员常常用一种挥发性液体进行检查,该液体最有可能是( )
A.浓盐酸 B.石蕊试液 C.氯水 D.稀硫酸
8.氮及其化合物的转化具有重要应用。下列说法错误的是( )
A.自然固氮、人工固氮都是将转化为
B.侯氏制碱法以、、、为原料制备和
C.工业上通过催化氧化等反应过程生产
D.多种形态的氮及其化合物间的转化形成了自然界的“氮循环”
9.下列物质中,不能由单质直接化合生成的是( )
A.CuCl2 B.FeCl2 C.Na2O D.Al2O3
10.某实验小组探究SO2与AgNO3溶液的反应,实验记录如下:
序号 Ⅰ Ⅱ Ⅲ
实验 步骤
实验现象 得到无色溶液a和白色沉淀b 产生无色气体,遇空气变为红棕色 产生白色沉淀
下列说法正确的是( )
A.透过测Ⅰ中无色溶液a的pH可以判断SO2是否被氧化
B.实验Ⅱ说明白色沉淀b具有还原性
C.实验Ⅲ说明溶液a中一定有 生成
D.实验Ⅰ、Ⅱ、Ⅲ说明SO2与AgNO3溶液反应既有Ag2SO4生成,又有Ag2SO3生成
11.0.1 mol Cu与足量浓硫酸加热,充分反应后,被还原的H2SO4的物质的量为(mol)( )
A.<0.1 B.0.1 C.<0.2 D.0.2
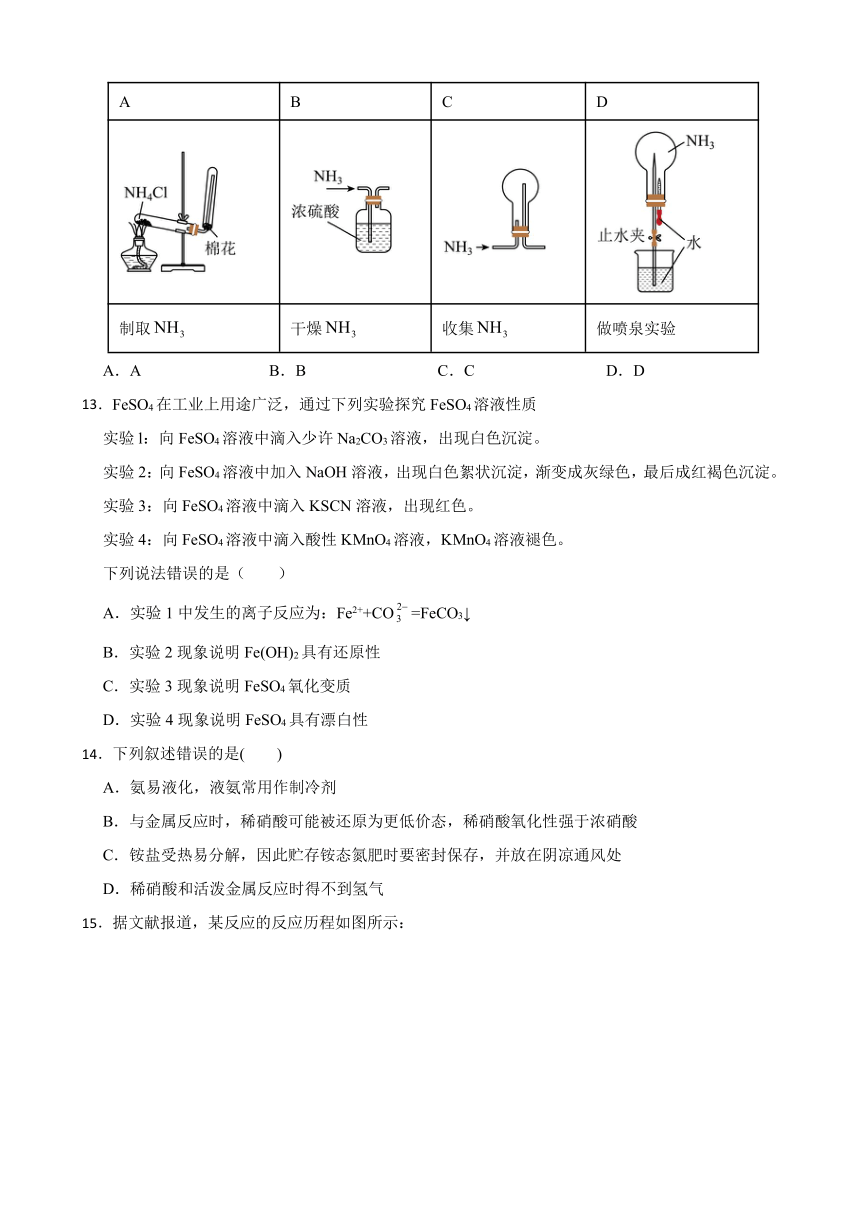
12.下列制取、干燥、收集氨气,并用氨气进行喷泉实验的装置中,能够达到实验目的的是
A B C D
制取 干燥 收集 做喷泉实验
A.A B.B C.C D.D
13.FeSO4在工业上用途广泛,通过下列实验探究FeSO4溶液性质
实验l:向FeSO4溶液中滴入少许Na2CO3溶液,出现白色沉淀。
实验2:向FeSO4溶液中加入NaOH溶液,出现白色絮状沉淀,渐变成灰绿色,最后成红褐色沉淀。
实验3:向FeSO4溶液中滴入KSCN溶液,出现红色。
实验4:向FeSO4溶液中滴入酸性KMnO4溶液,KMnO4溶液褪色。
下列说法错误的是( )
A.实验1中发生的离子反应为:Fe2++CO=FeCO3↓
B.实验2现象说明Fe(OH)2具有还原性
C.实验3现象说明FeSO4氧化变质
D.实验4现象说明FeSO4具有漂白性
14.下列叙述错误的是( )
A.氨易液化,液氨常用作制冷剂
B.与金属反应时,稀硝酸可能被还原为更低价态,稀硝酸氧化性强于浓硝酸
C.铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉通风处
D.稀硝酸和活泼金属反应时得不到氢气
15.据文献报道,某反应的反应历程如图所示:
下列有关该历程的说法错误的是( )
A.总反应化学方程式为4NH3+3O2 2N2+6H2O
B. 是中间产物
C. 是催化剂
D. 属于分解反应
16.下列“类比”或“对比”不合理的是( )
A.Mg在中点燃反应生成MgO和C则Ca在中点燃反应生成CaO和C
B.NaClO溶液与反应生成和HClO,则溶液与少量反应生成CaCO3和HClO
C.与盐酸反应生成NaCl和,则与盐酸反应生成和
D.NaOH溶液与少量溶液反应生成和,则氨水与少量溶液反应最终生成和
二、综合题
17.非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
(1)若A常温下为淡黄色固体,B是无色有刺激性气味的气体,可作漂白剂,其漂白原理与氯水的漂白原理 (填“相同”或“不同”)。
(2)若A在常温下是气体,C是红棕色气体。
①A的化学式是 ;
②D的浓溶液在常温下可与铜反应并生成C气体,该反应的化学方程式为 ,若有3.2克铜完全参加反应,则被还原的D的物质的量为 。
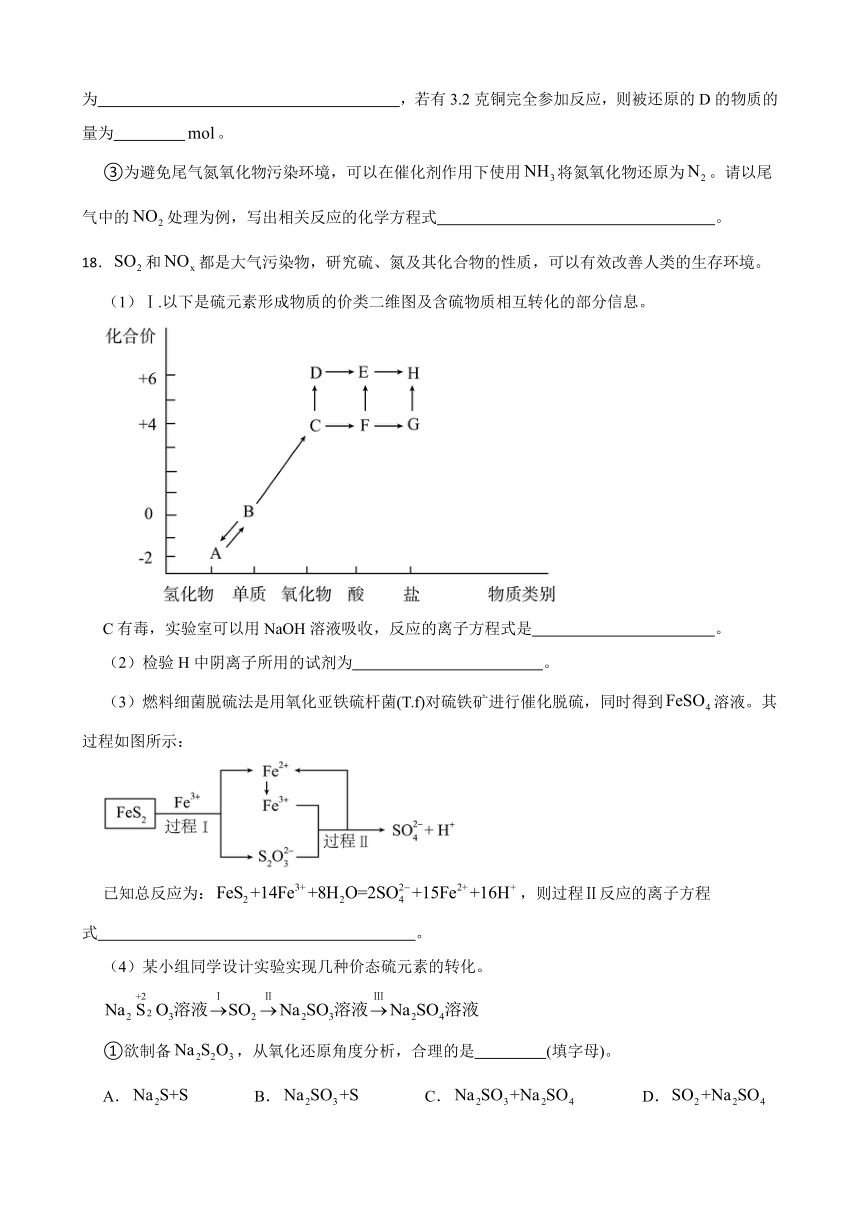
③为避免尾气氮氧化物污染环境,可以在催化剂作用下使用将氮氧化物还原为。请以尾气中的处理为例,写出相关反应的化学方程式 。
18.和都是大气污染物,研究硫、氮及其化合物的性质,可以有效改善人类的生存环境。
(1)Ⅰ.以下是硫元素形成物质的价类二维图及含硫物质相互转化的部分信息。
C有毒,实验室可以用NaOH溶液吸收,反应的离子方程式是 。
(2)检验H中阴离子所用的试剂为 。
(3)燃料细菌脱硫法是用氧化亚铁硫杆菌(T.f)对硫铁矿进行催化脱硫,同时得到溶液。其过程如图所示:
已知总反应为:,则过程Ⅱ反应的离子方程式 。
(4)某小组同学设计实验实现几种价态硫元素的转化。
①欲制备,从氧化还原角度分析,合理的是 (填字母)。
A. B. C. D.
②转化Ⅲ可以通入氧气来实现,写出相应化学反应方程式 。
19.铁是人体内一种微量元素,以Fe2+的形式存在。回答下列问题:
(1)下列微粒中,只有还原性的是_________(填字母)。
A.Fe B.Fe2+ C.Fe3+
(2)维生素C可使食物中的Fe3+转化为Fe2+,在此过程中维生素C的作用是 。
(3)某种麦片中含有微量的细小铁粉,食用该麦片后,铁粉与胃酸(HCl)反应的离子方程式 。
20.工业上处理污水中NO常采用还原法。
(1)I.不同密度的HNO3与Fe反应(相同温度)时还原产物成分分布情况如图示。
硝酸的密度越大,高含量产物中N元素的化合价越 。
(2)已知:硝酸的密度小于1.1g·cm-3时,Fe元素转化生成Fe2+。写出硝酸密度小于1.1g·cm-3时发生的主要反应的离子方程式 。
(3)II.工业上利用铝粉(掺少量炭粉)处理酸性污水中的硝酸盐,脱硝率可达94%,其反应过程原理如图所示。
铝粉脱硝的过程可描述为 。
(4)酸性过强,不利于脱硝的原因是 。
三、推断题
21.A为两种金属组成的合金,发生如下图所示的变化:
试填写以下空白:
(1)合金A由 和 组成。
(2)写出下列变化的离子方程式。
C→E ;
D→F 。
22.已知、、、均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物略去)。请回答下列问题:
(1)若为常见的非金属单质,常温下为固体,、、均为气体。与的反应需要在高温下进行,则二者反应的化学方程式为 。
(2)若、、的溶液均显碱性,常用于培制糕点的发酵粉的主要成分之一,也可以作为抗酸药剂,则的俗名为 ,与反应生成的离子方程式为 。
(3)若为用量最大、用途最广泛的金属单质。它的一种氧化物为红棕色固体,可用作颜料。是一种黄绿色气体,则的化学式为 ,与Cu反应的离子方程式为 ,与反应生成B的化学反应方程式为 。
答案解析部分
1.C
【解答】A.CO2、NO与BaCl2溶液都不反应,所以两次都无沉淀,A不符合题意;
B.CO2、SO2与BaCl2溶液都不反应,所以两次都无沉淀,故B不符合题意;
C.向BaCl2溶液中先通入SO2,无沉淀生成,再通入NO2,NO2氧化溶解的SO2生成H2SO4,会有BaSO4沉淀生成,故C符合题意;
D.CO2、NO2与BaCl2溶液都不反应,所以两次都无沉淀,故D不符合题意;
故答案为C。
A.CO2、NO均不能与BaCl2溶液反应;
B.CO2、SO2均不能与BaCl2溶液反应;
D. NO2与BaCl2溶液中的水反应生成硝酸和NO气体,CO2与BaCl2溶液不反应。
2.D
【解答】A.“飞扬”火炬采用氢气作为燃料,可减少二氧化碳的排放,故A不选;
B.冬奥会所有场馆100%采用太阳能、风能供电,减少化石燃料的使用,可减少二氧化碳的排放,故B不选;
C.“冰丝带”制冰用二氧化碳代替传统的氟利昂作制冷剂,减少氟利昂对臭氧层空洞造成的影响,故C不选;
D.冬奥会使用以玉米、秸秆等为原料合成的可降解高分子材料制作餐具,减少塑料的使用,可防止白色污染,故D符合题意;
故答案为:D。
要先明确,所谓的白色污染指的是塑料垃圾,目前采用的可降解高分子材料作为餐具,可以有效减少塑料的使用。
3.A
【解答】A.二氧化碳无毒,不属于“城市空气质量日报”报道的物质,故A选;
B.二氧化硫为有害气体,属于“城市空气质量日报”报道的物质,故B不选;
C.氮氧化物为有害气体,属于“城市空气质量日报”报道的物质,故C不选;
D.可吸入颗粒物危害人体的呼吸道,属于有害物质,属于“城市空气质量日报”报道的物质,故D不选;
故答案为:A。
空气质量日报的主要内容包括“空气污染指数”“首要污染物”“空气质量级别”“空气质量状况”,根据目前计入空气污染指数的项目分析判断。
4.B
【解答】A.蓝矾是CuSO4·5H2O,Cu2+是重金属离子,能使蛋白质变性,因此蓝矾不能用于饮用水的杀菌消毒,故A不符合题意;
B.纯碱水溶液显碱性,能除去物品表面的油污,故B符合题意;
C.重金属离子能使蛋白质变性,旧电池中含有重金属离子,如果随处丢弃,能污染环境,因此回收处理废旧电池,防止污染环境,故C不符合题意;
D.燃煤中加入生石灰,可以减少SO2的排放,减少酸雨的形成,但不能减少温室气体的排放,故D不符合题意;
故答案为B。
A.蓝帆是CuSO4·5H2O,重金属离子有毒;
B.油污在碱性条件下发生水解;
C.旧电池中含有重金属离子,如果随处丢弃会污染环境;
D.燃煤中加入生石灰,可以减少SO2的排放。
5.A
【解答】检验溶液中是否含有SO42-,应先加入过量稀盐酸酸化,排除溶液中CO32-、SO32-和Ag+的干扰;再加入BaCl2溶液,若有白色沉淀产生,则说明溶液中含有SO42-,反之则不含有SO42-,A符合题意;
故答案为:A
此题是对SO42-检验的考查,结合SO42-的检验方法分析。
6.D
【解答】A.向H2S溶液中加入NaOH,生成硫化钠,溶液酸性减弱,pH上升,但c(S2-)升高,故A不符合题意;
B.CuSO4和H2S反应:CuSO4+H2S=CuS↓+ H2SO4,H2SO4是强电解质,H2S是弱电解质,所以氢离子浓度增大,溶液pH减小,故B不符合题意;
C.Cl2+H2S=S↓+2HCl,氯化氢是强电解质,H2S是弱电解质,所以氢离子浓度增大,溶液pH减小,故C不符合题意;
D.H2S溶液中通入SO2发生反应:SO2+2H2S=3S↓+2H2O,溶液酸性减弱,pH上升,c(S2-)降低,故D符合题意。
故答案为:D。
加入二氧化硫产生硫单质与水,符合题意。
7.A
【解答】A.浓盐酸具有挥发性,能和氨气之间反应产生白烟,可以检验NH3泄漏,A符合题意;
B.石蕊试液没有挥发性,不符合要求,B不符合题意;
C.氯水不稳定,难保存,C不符合题意;
D.稀硫酸没有挥发性,不符合要求,D不符合题意;
故答案为:A。
NH3可以使用挥发性酸检验。
8.A
【解答】A.自然固氮是将N2转化为含氮化合物,不一定是转化为NH3,比如大气固氮是将N2会转化为NO,A符合题意;
B.侯氏制碱法以H2O、NH3、CO2、NaCl为原料制备NaHCO3和NH4Cl,反应的化学方程式为H2O+NH3+CO2+NaCl=NaHCO3↓+NH4Cl,B不符合题意;
C.工业上通过NH3催化氧化等反应过程生产HNO3,相关的化学反应方程式为4NH3+5O24NO+6H2O、2NO+O2=2NO2、3NO2+H2O=2HNO3+NO、4NO2+O2+2H2O=4HNO3,C不符合题意;
D.氮元素在自然界中既有游离态又有化合态,多种形态的氮及其化合物间可相互转化,从而实现了自然界的“氮循环”,D不符合题意;
故答案为:A。
B.侯氏制碱法以H2O、NH3、CO2、NaCl为原料制备NaHCO3和NH4Cl;
C.氨气与氧气在催化条件下发生反应生成一氧化氮,一氧化氮可生成二氧化氮,二氧化氮和水、氧气反应生成硝酸;
D.氮元素在自然界中既有游离态又有化合态,多种形态的氮及其化合物间可相互转化。
9.B
【解答】A.Cu在Cl2中加热生成CuCl2,A不符合题意;
B.Fe在Cl2中加热生成FeCl3,两种单质直接化合得不到FeCl2,B符合题意;
C.Na与O2不加热能生成Na2O,C不符合题意;
D.Al与O2能生成Al2O3,D不符合题意;
故答案为:B。
A.铜在氯气中燃烧生成氯化铜;
B.铁在氯气中燃烧生成氯化铁;
C.钠与氧气常温下反应生成氧化钠;
D.铝与氧气反应生成氧化铝。
10.B
【解答】A.实验Ⅰ中,将SO2通入AgNO3溶液(pH=5)中得到无色溶液a,该溶液中可能含有亚硫酸,亚硫酸为中强酸,所以测定无色溶液a的pH无法判断二氧化硫是否被氧化,故A不符合题意;
B.实验Ⅱ中,取白色沉淀B,加入3mol/LHNO3,产生的无色气体遇空气变成红棕色,说明硝酸被还原为NO,证明该沉淀B中含有还原性的物质存在,故B符合题意;
C.实验Ⅲ中,检验硫酸根离子应先加入盐酸酸化,目的是排除Ag+等,以免干扰硫酸根的检验,直接向溶液a中加入BaCl2,产生的沉淀可能为氯化银,不一定是硫酸根离子,故C不符合题意;
D.由于实验Ⅰ、Ⅱ、Ⅲ不能证明产物中含有硫酸根,因此不能确定产物中含有Ag2SO4生成,故D不符合题意;
故答案为:B。
此题是对SO2性质的考查, 结合SO2的氧化性、还原性、酸性氧化物、漂白性等性质进行分析。
11.B
【解答】Cu与足量浓硫酸加热完全反应生成硫酸铜、二氧化硫和水,反应的化学方程式为Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,由方程式可知,硫酸起酸和氧化剂的作用,0.1 mol Cu完全反应生成0.1 mol SO2,则被还原的H2SO4的物质的量为0.1mol,
故答案为:B。
由铜与硫酸反应的化学方程式Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O可知,其中,1分子硫酸被还原为SO2显示其氧化性,1分子硫酸则显酸性。
12.D
【解答】A.NH4Cl加热分解生成氨气和氯化氢,氨气和氯化氢在试管上部又会重新化合为氯化铵,氨气不能逸出,不能用于制取氨气,故A不能达到实验目的;
B.氨气是碱性气体,浓硫酸能和氨气反应,不能用浓硫酸干燥氨气,故B不能达到实验目的;
C.氨气密度比空气小,应用向下排空气法收集氨气,故C不能达到实验目的;
D.氨气极易溶于水,可利用这点性质做喷泉实验,故D能达到实验目的;
故答案为:D。
A.加热氯化铵分解生成氨气和氯化氢,氨气和氯化氢在试管口遇冷又化合成氯化铵;
B.氨气为碱性气体,不能用浓硫酸干燥;
C.氨气的密度小于水。
13.D
【解答】A.实验1中二价铁和碳酸根离子生成沉淀,离子方程式为:Fe2++CO=FeCO3↓,A不符合题意;
B.白色沉淀是氢氧化亚铁,红褐色沉淀为氢氧化铁,该反应为氢氧化亚铁转化为氢氧化铁,铁的化合价升高,B不符合题意;
C.滴入KSCN溶液,出现红色,说明二价铁被氧化为三价铁,则说明FeSO4氧化变质,C不符合题意;
D.KMnO4溶液褪色,是溶液中的二价铁和高锰酸钾发生了氧化还原反应,体现了FeSO4具有还原性,D符合题意;
故答案为:D。
A.实验1中亚铁离子和碳酸根结合生成碳酸亚铁;
B. Fe(OH)2能被氧化成Fe(OH)3;
C.Fe3+与KSCN溶液反应生成红色络合物;
D.实验4体现FeSO4的还原性。
14.B
【解答】A.根据氨气的物理性质:NH3易液化,通常液氨常用作制冷剂,故不选A;
B.氧化性的强弱和得电子的能力有关,和得电子的多少无关,浓HNO3氧化性强于稀HNO3,故选B;
C.受热易分解的物质储存时,要密封保存,并放在阴凉通风处,故不选C;
D.硝酸具有强氧化性,金属和稀硝酸反应的还原产物一般是一氧化氮等低价态的含氮化合物,不会产生氢气,故不选D;
故答案为:B
易错选项BD,注意(1)氧化性的强弱和得电子的能力有关,和得电子的多少无关(2)硝酸为氧化性酸,与金属反应不可能生成H2。
15.A
【解答】A.读图可知,反应物有氨气、氧气和一氧化氮,生成物是氮气和水,符合题意
B. 读图可知 是中间产物,不符合题意
C. 在整个反应过程产假了反应,但质量和性质未变是催化剂
D. ,反应物只有一种,生成物多种是分解反应
故答案为:A
易错点:注意观察图一氧化氮也是生成物
16.D
【解答】A.由于还原性Ca>Mg,因此Mg能将CO2还原为C,则Ca也能将CO2还原为C,A不符合题意;
B.由于酸性H2CO3>HClO>HCO3-,因此NaClO溶液与CO2反应生成NaHCO3和HClO,但由于Ca(HCO3)2不稳定,在水溶液中浓度较大时能发生分解反应,生成CaCO3,因此Ca(ClO)2溶液与CO2反应只生成CaCO3和HClO,不生成Ca(HCO3)2,B不符合题意;
C.Na3N能与H2O反应生成NaOH和NH3,进一步与盐酸反应,生成NaCl和NH4Cl,Mg3N2与H2O反应生成Mg(OH)2和NH3,进一步与盐酸反应生成MgCl2和NH4Cl,C不符合题意;
D.NaOH溶液与少量AgNO3溶液反应生成AgOH沉淀,AgOH不稳定,分解成Ag2O。若氨水为少量AgNO3反应,由于氨水过量,反应生成的AgOH继续与氨水反应,形成[Ag(NH3)2]OH,不产生Ag2O,D符合题意;
故答案为:D
A、根据还原性Ca>Mg分析;
B、根据酸性H2CO3>HClO>HCO3-,但Ca(HCO3)2不稳定,在水溶液中也易分解;
C、金属氮化物能与H2O反应生成金属氢氧化物和NH3;
D、NaOH过量,与AgNO3溶液反应生成Ag(NH3)2+;
17.(1)不同
(2);;;
【解答】(1)若A常温下为淡黄色固体, B是能使品红溶液褪色的有刺激性气味的无色气体,则A是S单质,B是SO2,C是SO3,D是H2SO4;二氧化硫的漂白原理是SO2与有色物质结合生成不稳定的无色物质,漂白可逆;氯水的漂白原理是利用HClO的强氧化性,漂白不可逆;
答案为不同;
(2)若A在常温下是气体,C是红棕色气体,则C为NO2,B为NO,A为N2,D为HNO3;
①A的化学式是N2;
②D的浓溶液浓硝酸在常温下可与铜反应并生成C气体NO2,反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;反应中只有一半的HNO3作氧化剂被还原,若有3.2克铜(即0.05mol)完全参加反应,根据反应可知,被还原的D的物质的量为0.1;
③为避免尾气氮氧化物污染环境,可以在催化剂作用下使用将氮氧化物还原为。相关反应的化学方程式为。
(1)二氧化硫的漂白原理是SO2与有色物质结合生成不稳定的无色物质,漂白可逆;氯水的漂白原理是利用HClO的强氧化性,漂白不可逆;
(2)
①依据流程图,利用物质的性质判断;
②依据浓硝酸在常温下可与铜反应生成硝酸铜、水和NO2;
③根据反应物和产物的化学式,利用电子得失守恒、原子守恒书写。
18.(1)
(2)稀盐酸、溶液
(3)
(4)B;
【解答】
(1)根据分析C为SO2,与氢氧化钠溶液反应的离子方程式为:;
(2)H为硫酸盐,阴离子为硫酸根,检验硫酸根时先用稀盐酸酸化,无明显现象,再加氯化钡溶液,产生白色沉淀即可证明有硫酸根,
故答案为:用的试剂为:稀盐酸、溶液;
(3)由图可知过程II为铁离子和硫代硫酸根反应生成硫酸根、亚铁离子和氢离子,根据得失电子守恒和原子守恒,反应的离子离子方程式为:;
(4)①A.中硫元素的价态分别为-2和0价,不能生成+2价的Na2S2O3,A不正确;
B.中硫元素的价态分别为+4和0价,可能生成+2价的Na2S2O3,B正确;
C.中硫元素的价态分别为+4和+6价,不能生成+2价的Na2S2O3,C不正确;
D.中硫元素的价态分别为+4和+6价,不能生成+2价的Na2S2O3,D不正确;
故答案为:B。
②转化Ⅲ是亚硫酸钠溶液被氧气氧化成硫酸钠,化学反应方程式为:。
由图可知,A为H2S,B为S,C为SO2,D为SO3,E为H2SO4,F为H2SO3,亚硫酸被氧化可得到硫酸,H为硫酸盐,G为亚硫酸盐,亚硫酸盐被氧化可得到硫酸盐。
19.(1)A
(2)还原剂
(3)Fe+2H+=Fe2++H2↑
【解答】(1) 一种元素的化合价处于最低价态时则只具有还原性,所以铁元素的三种粒子A项的Fe原子则只具有还原性,故故答案为:A。(2) 食物中的Fe3+转化为Fe2+,化合价降低被还原,所以在此过程中维生素C的作用是还原剂。(3) 铁粉与胃酸(HCl)反应的化学方程式是Fe+2HCl=FeCl2+H2↑,故其离子方程式是Fe+2H+=Fe2++H2↑ 。
(1)化合价处于最低价态时只具有还原性;
(2)Fe3+得电子转化为Fe2+,发生还原反应,是氧化剂,维生素C是还原剂;
(3)根据Fe+2HCl=FeCl2+H2↑分析;
20.(1)高
(2)4Fe+10H++NO=4Fe2++NH+3H2O
(3)Al失去电子生成Al3+,NO在酸性条件下得到电子生成N2
(4)酸性过强,Al与H+反应生成H2
【解答】(1)根据图示,随硝酸密度增大,NO2的含量增大,硝酸的密度越大,高含量产物中N元素的化合价越高;
(2)硝酸的密度小于1.1g·cm-3时,Fe元素转化生成Fe2+,硝酸的还原产物主要是,硝酸密度小于1.1g·cm-3时发生的主要反应的离子方程式为4Fe+10H++NO=4Fe2++NH+3H2O;
(3)根据图示,Al失去电子生成Al3+,NO在酸性条件下得到电子生成N2;
(4)酸性过强,Al与H+反应生成H2,不利于脱硝。
(1)硝酸的密度越大,高含量产物中N元素的化合价越高;
(2)硝酸的密度小于1.1g·cm-3时,Fe生成Fe2+,硝酸的还原产物主要是;
(3)Al失去电子生成Al3+,NO在酸性条件下得到电子生成N2;
(4) 酸性过强 ,Al与H+反应生成H2。
21.(1)Al;Fe
(2)Al3++4OH-=AlO +2H2O;Fe(OH)3+3H+=Fe3++3H2O
【解答】A为两种金属组成的合金,A和盐酸反应生成浅绿色溶液B,B中含有亚铁离子,B中通入氯气得到棕黄色溶液C,向C中加入过量NaOH,生成红褐色沉淀D,D为Fe(OH)3,D和盐酸反应生成棕黄色溶液F,F中的溶质为FeCl3,无色滤液E中加入盐酸,得到白色沉淀G,因铝离子和过量氢氧化钠反应生成NaAlO2无色溶液,NaAlO2与适量盐酸反应可以生成Al(OH)3白色沉淀,所以E中含有偏铝酸根离子,G为Al(OH)3,根据原子守恒可知,A为Al、Fe两种金属组成的合金,B中溶质为FeCl2、AlCl3,C中溶质为AlCl3、FeCl3。(1). 由上述分析可知,合金A由Al、Fe两种金属组成,故答案为:Al;Fe;(2). C→E是氯化铝和过量氢氧化钠反应生成偏铝酸钠和水,离子方程式为Al3++4OH =AlO2 +2H2O,D→F是氢氧化铁和盐酸反应生成氯化铁和水,离子方程式为Fe(OH)3+3H+=Fe3++3H2O,故答案为:Al3++4OH =AlO2 +2H2O;Fe(OH)3+3H+=Fe3++3H2O。
特殊颜色的沉淀有:红褐色沉淀是氢氧化铁、蓝色沉淀为氢氧化铜。溶液中特殊颜色的离子:为蓝色、黄色、为浅绿色,为紫色。
22.(1)
(2)纯碱或苏打;
(3);;
【解答】(1)若为常见的非金属单质,常温下为固体,、、均为气体,与的反应需要在高温下进行,则A、B、C、D分别是C、CO、CO2、O2,则C、CO2反应的化学方程式为。
(2)若、、的溶液均显碱性,常用于培制糕点的发酵粉的主要成分之一,也可以作为抗酸药剂,C是碳酸氢钠,则A、B、D分别是NaOH、Na2CO3、CO2,的俗名为纯碱或苏打,NaOH与NaHCO3反应生成Na2CO3的离子方程式为;
(3)若为用量最大、用途最广泛的金属单质,它的一种氧化物为红棕色固体,可用作颜料,则D是Fe;是一种黄绿色气体,A是Cl2;铁和氯气反应生成氯化铁,的化学式为,和铁反应生成氯化亚铁,则C是;与Cu反应生成氯化亚铁和氯化铜,反应的离子方程式为,Cl2与反应生成的化学反应方程式为。
充分利用好题目中的关键信息以及转化关系进行解答;满足这样转化的有:C-CO-CO2;Na-Na2O-Na2O2;N-NO-NO2;Fe-Fe2+-Fe3+,结合先关信息进行解答即可
上学期高一化学鲁科版(2019)必修第一册
一、单选题
1.向溶液中依次通入过量的下列气体,第一次无沉淀,第二次有沉淀的组合是( )
选项 A B C D
第一次
第二次 NO
A.A B.B C.C D.D
2.2022年北京冬奥会是一届科技冬奥、绿色冬奥。下列冬奥会期间实行的措施是为了防止白色污染的是( )
A.“飞扬”火炬采用氢气作为燃料
B.冬奥会所有场馆100%采用太阳能、风能供电
C.“冰丝带”制冰用二氧化碳代替传统的氟利昂作制冷剂
D.冬奥会使用以玉米、秸秆等为原料合成的可降解高分子材料制作餐具
3.空气质量报告中,不包含的指标是( )
A.CO2含量 B.SO2含量
C.氮氧化合物含量 D.可吸入颗粒物
4.化学与生产、生活密切相关,下列说法正确的是( )
A.蓝矾可用于饮用水的杀菌消毒
B.纯碱能除去物品表面的油污
C.回收处理废旧电池,主要是为了变废为宝
D.燃煤时加入生石灰可以减少酸雨的形成及温室气体的排放
5.检验某溶液中是否含有SO42-时,为防止Ag+、CO32-、SO32-等离子的干扰,下列实验方案比较严密的是( )
A.先加稀HCl将溶液酸化,再滴加BaCl2溶液,看是否生成白色沉淀;
B.先加稀HNO3将溶液酸化,再滴加BaCl2溶液,看是否生成白色沉淀;
C.向溶液中滴加稀盐酸酸化的BaCl2溶液,看是否生成白色沉淀;
D.向溶液中滴加稀硝酸酸化的BaCl2溶液,看是否生成白色沉淀;
6.向H2S溶液中加入或通入少量下列物质,溶液pH上升且c(S2-)降低的是( )
A.NaOH B.CuSO4 C.Cl2 D.SO2
7.某工厂运输NH3的管道出现小孔导致NH3泄露,技术人员常常用一种挥发性液体进行检查,该液体最有可能是( )
A.浓盐酸 B.石蕊试液 C.氯水 D.稀硫酸
8.氮及其化合物的转化具有重要应用。下列说法错误的是( )
A.自然固氮、人工固氮都是将转化为
B.侯氏制碱法以、、、为原料制备和
C.工业上通过催化氧化等反应过程生产
D.多种形态的氮及其化合物间的转化形成了自然界的“氮循环”
9.下列物质中,不能由单质直接化合生成的是( )
A.CuCl2 B.FeCl2 C.Na2O D.Al2O3
10.某实验小组探究SO2与AgNO3溶液的反应,实验记录如下:
序号 Ⅰ Ⅱ Ⅲ
实验 步骤
实验现象 得到无色溶液a和白色沉淀b 产生无色气体,遇空气变为红棕色 产生白色沉淀
下列说法正确的是( )
A.透过测Ⅰ中无色溶液a的pH可以判断SO2是否被氧化
B.实验Ⅱ说明白色沉淀b具有还原性
C.实验Ⅲ说明溶液a中一定有 生成
D.实验Ⅰ、Ⅱ、Ⅲ说明SO2与AgNO3溶液反应既有Ag2SO4生成,又有Ag2SO3生成
11.0.1 mol Cu与足量浓硫酸加热,充分反应后,被还原的H2SO4的物质的量为(mol)( )
A.<0.1 B.0.1 C.<0.2 D.0.2
12.下列制取、干燥、收集氨气,并用氨气进行喷泉实验的装置中,能够达到实验目的的是
A B C D
制取 干燥 收集 做喷泉实验
A.A B.B C.C D.D
13.FeSO4在工业上用途广泛,通过下列实验探究FeSO4溶液性质
实验l:向FeSO4溶液中滴入少许Na2CO3溶液,出现白色沉淀。
实验2:向FeSO4溶液中加入NaOH溶液,出现白色絮状沉淀,渐变成灰绿色,最后成红褐色沉淀。
实验3:向FeSO4溶液中滴入KSCN溶液,出现红色。
实验4:向FeSO4溶液中滴入酸性KMnO4溶液,KMnO4溶液褪色。
下列说法错误的是( )
A.实验1中发生的离子反应为:Fe2++CO=FeCO3↓
B.实验2现象说明Fe(OH)2具有还原性
C.实验3现象说明FeSO4氧化变质
D.实验4现象说明FeSO4具有漂白性
14.下列叙述错误的是( )
A.氨易液化,液氨常用作制冷剂
B.与金属反应时,稀硝酸可能被还原为更低价态,稀硝酸氧化性强于浓硝酸
C.铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉通风处
D.稀硝酸和活泼金属反应时得不到氢气
15.据文献报道,某反应的反应历程如图所示:
下列有关该历程的说法错误的是( )
A.总反应化学方程式为4NH3+3O2 2N2+6H2O
B. 是中间产物
C. 是催化剂
D. 属于分解反应
16.下列“类比”或“对比”不合理的是( )
A.Mg在中点燃反应生成MgO和C则Ca在中点燃反应生成CaO和C
B.NaClO溶液与反应生成和HClO,则溶液与少量反应生成CaCO3和HClO
C.与盐酸反应生成NaCl和,则与盐酸反应生成和
D.NaOH溶液与少量溶液反应生成和,则氨水与少量溶液反应最终生成和
二、综合题
17.非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
(1)若A常温下为淡黄色固体,B是无色有刺激性气味的气体,可作漂白剂,其漂白原理与氯水的漂白原理 (填“相同”或“不同”)。
(2)若A在常温下是气体,C是红棕色气体。
①A的化学式是 ;
②D的浓溶液在常温下可与铜反应并生成C气体,该反应的化学方程式为 ,若有3.2克铜完全参加反应,则被还原的D的物质的量为 。
③为避免尾气氮氧化物污染环境,可以在催化剂作用下使用将氮氧化物还原为。请以尾气中的处理为例,写出相关反应的化学方程式 。
18.和都是大气污染物,研究硫、氮及其化合物的性质,可以有效改善人类的生存环境。
(1)Ⅰ.以下是硫元素形成物质的价类二维图及含硫物质相互转化的部分信息。
C有毒,实验室可以用NaOH溶液吸收,反应的离子方程式是 。
(2)检验H中阴离子所用的试剂为 。
(3)燃料细菌脱硫法是用氧化亚铁硫杆菌(T.f)对硫铁矿进行催化脱硫,同时得到溶液。其过程如图所示:
已知总反应为:,则过程Ⅱ反应的离子方程式 。
(4)某小组同学设计实验实现几种价态硫元素的转化。
①欲制备,从氧化还原角度分析,合理的是 (填字母)。
A. B. C. D.
②转化Ⅲ可以通入氧气来实现,写出相应化学反应方程式 。
19.铁是人体内一种微量元素,以Fe2+的形式存在。回答下列问题:
(1)下列微粒中,只有还原性的是_________(填字母)。
A.Fe B.Fe2+ C.Fe3+
(2)维生素C可使食物中的Fe3+转化为Fe2+,在此过程中维生素C的作用是 。
(3)某种麦片中含有微量的细小铁粉,食用该麦片后,铁粉与胃酸(HCl)反应的离子方程式 。
20.工业上处理污水中NO常采用还原法。
(1)I.不同密度的HNO3与Fe反应(相同温度)时还原产物成分分布情况如图示。
硝酸的密度越大,高含量产物中N元素的化合价越 。
(2)已知:硝酸的密度小于1.1g·cm-3时,Fe元素转化生成Fe2+。写出硝酸密度小于1.1g·cm-3时发生的主要反应的离子方程式 。
(3)II.工业上利用铝粉(掺少量炭粉)处理酸性污水中的硝酸盐,脱硝率可达94%,其反应过程原理如图所示。
铝粉脱硝的过程可描述为 。
(4)酸性过强,不利于脱硝的原因是 。
三、推断题
21.A为两种金属组成的合金,发生如下图所示的变化:
试填写以下空白:
(1)合金A由 和 组成。
(2)写出下列变化的离子方程式。
C→E ;
D→F 。
22.已知、、、均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物略去)。请回答下列问题:
(1)若为常见的非金属单质,常温下为固体,、、均为气体。与的反应需要在高温下进行,则二者反应的化学方程式为 。
(2)若、、的溶液均显碱性,常用于培制糕点的发酵粉的主要成分之一,也可以作为抗酸药剂,则的俗名为 ,与反应生成的离子方程式为 。
(3)若为用量最大、用途最广泛的金属单质。它的一种氧化物为红棕色固体,可用作颜料。是一种黄绿色气体,则的化学式为 ,与Cu反应的离子方程式为 ,与反应生成B的化学反应方程式为 。
答案解析部分
1.C
【解答】A.CO2、NO与BaCl2溶液都不反应,所以两次都无沉淀,A不符合题意;
B.CO2、SO2与BaCl2溶液都不反应,所以两次都无沉淀,故B不符合题意;
C.向BaCl2溶液中先通入SO2,无沉淀生成,再通入NO2,NO2氧化溶解的SO2生成H2SO4,会有BaSO4沉淀生成,故C符合题意;
D.CO2、NO2与BaCl2溶液都不反应,所以两次都无沉淀,故D不符合题意;
故答案为C。
A.CO2、NO均不能与BaCl2溶液反应;
B.CO2、SO2均不能与BaCl2溶液反应;
D. NO2与BaCl2溶液中的水反应生成硝酸和NO气体,CO2与BaCl2溶液不反应。
2.D
【解答】A.“飞扬”火炬采用氢气作为燃料,可减少二氧化碳的排放,故A不选;
B.冬奥会所有场馆100%采用太阳能、风能供电,减少化石燃料的使用,可减少二氧化碳的排放,故B不选;
C.“冰丝带”制冰用二氧化碳代替传统的氟利昂作制冷剂,减少氟利昂对臭氧层空洞造成的影响,故C不选;
D.冬奥会使用以玉米、秸秆等为原料合成的可降解高分子材料制作餐具,减少塑料的使用,可防止白色污染,故D符合题意;
故答案为:D。
要先明确,所谓的白色污染指的是塑料垃圾,目前采用的可降解高分子材料作为餐具,可以有效减少塑料的使用。
3.A
【解答】A.二氧化碳无毒,不属于“城市空气质量日报”报道的物质,故A选;
B.二氧化硫为有害气体,属于“城市空气质量日报”报道的物质,故B不选;
C.氮氧化物为有害气体,属于“城市空气质量日报”报道的物质,故C不选;
D.可吸入颗粒物危害人体的呼吸道,属于有害物质,属于“城市空气质量日报”报道的物质,故D不选;
故答案为:A。
空气质量日报的主要内容包括“空气污染指数”“首要污染物”“空气质量级别”“空气质量状况”,根据目前计入空气污染指数的项目分析判断。
4.B
【解答】A.蓝矾是CuSO4·5H2O,Cu2+是重金属离子,能使蛋白质变性,因此蓝矾不能用于饮用水的杀菌消毒,故A不符合题意;
B.纯碱水溶液显碱性,能除去物品表面的油污,故B符合题意;
C.重金属离子能使蛋白质变性,旧电池中含有重金属离子,如果随处丢弃,能污染环境,因此回收处理废旧电池,防止污染环境,故C不符合题意;
D.燃煤中加入生石灰,可以减少SO2的排放,减少酸雨的形成,但不能减少温室气体的排放,故D不符合题意;
故答案为B。
A.蓝帆是CuSO4·5H2O,重金属离子有毒;
B.油污在碱性条件下发生水解;
C.旧电池中含有重金属离子,如果随处丢弃会污染环境;
D.燃煤中加入生石灰,可以减少SO2的排放。
5.A
【解答】检验溶液中是否含有SO42-,应先加入过量稀盐酸酸化,排除溶液中CO32-、SO32-和Ag+的干扰;再加入BaCl2溶液,若有白色沉淀产生,则说明溶液中含有SO42-,反之则不含有SO42-,A符合题意;
故答案为:A
此题是对SO42-检验的考查,结合SO42-的检验方法分析。
6.D
【解答】A.向H2S溶液中加入NaOH,生成硫化钠,溶液酸性减弱,pH上升,但c(S2-)升高,故A不符合题意;
B.CuSO4和H2S反应:CuSO4+H2S=CuS↓+ H2SO4,H2SO4是强电解质,H2S是弱电解质,所以氢离子浓度增大,溶液pH减小,故B不符合题意;
C.Cl2+H2S=S↓+2HCl,氯化氢是强电解质,H2S是弱电解质,所以氢离子浓度增大,溶液pH减小,故C不符合题意;
D.H2S溶液中通入SO2发生反应:SO2+2H2S=3S↓+2H2O,溶液酸性减弱,pH上升,c(S2-)降低,故D符合题意。
故答案为:D。
加入二氧化硫产生硫单质与水,符合题意。
7.A
【解答】A.浓盐酸具有挥发性,能和氨气之间反应产生白烟,可以检验NH3泄漏,A符合题意;
B.石蕊试液没有挥发性,不符合要求,B不符合题意;
C.氯水不稳定,难保存,C不符合题意;
D.稀硫酸没有挥发性,不符合要求,D不符合题意;
故答案为:A。
NH3可以使用挥发性酸检验。
8.A
【解答】A.自然固氮是将N2转化为含氮化合物,不一定是转化为NH3,比如大气固氮是将N2会转化为NO,A符合题意;
B.侯氏制碱法以H2O、NH3、CO2、NaCl为原料制备NaHCO3和NH4Cl,反应的化学方程式为H2O+NH3+CO2+NaCl=NaHCO3↓+NH4Cl,B不符合题意;
C.工业上通过NH3催化氧化等反应过程生产HNO3,相关的化学反应方程式为4NH3+5O24NO+6H2O、2NO+O2=2NO2、3NO2+H2O=2HNO3+NO、4NO2+O2+2H2O=4HNO3,C不符合题意;
D.氮元素在自然界中既有游离态又有化合态,多种形态的氮及其化合物间可相互转化,从而实现了自然界的“氮循环”,D不符合题意;
故答案为:A。
B.侯氏制碱法以H2O、NH3、CO2、NaCl为原料制备NaHCO3和NH4Cl;
C.氨气与氧气在催化条件下发生反应生成一氧化氮,一氧化氮可生成二氧化氮,二氧化氮和水、氧气反应生成硝酸;
D.氮元素在自然界中既有游离态又有化合态,多种形态的氮及其化合物间可相互转化。
9.B
【解答】A.Cu在Cl2中加热生成CuCl2,A不符合题意;
B.Fe在Cl2中加热生成FeCl3,两种单质直接化合得不到FeCl2,B符合题意;
C.Na与O2不加热能生成Na2O,C不符合题意;
D.Al与O2能生成Al2O3,D不符合题意;
故答案为:B。
A.铜在氯气中燃烧生成氯化铜;
B.铁在氯气中燃烧生成氯化铁;
C.钠与氧气常温下反应生成氧化钠;
D.铝与氧气反应生成氧化铝。
10.B
【解答】A.实验Ⅰ中,将SO2通入AgNO3溶液(pH=5)中得到无色溶液a,该溶液中可能含有亚硫酸,亚硫酸为中强酸,所以测定无色溶液a的pH无法判断二氧化硫是否被氧化,故A不符合题意;
B.实验Ⅱ中,取白色沉淀B,加入3mol/LHNO3,产生的无色气体遇空气变成红棕色,说明硝酸被还原为NO,证明该沉淀B中含有还原性的物质存在,故B符合题意;
C.实验Ⅲ中,检验硫酸根离子应先加入盐酸酸化,目的是排除Ag+等,以免干扰硫酸根的检验,直接向溶液a中加入BaCl2,产生的沉淀可能为氯化银,不一定是硫酸根离子,故C不符合题意;
D.由于实验Ⅰ、Ⅱ、Ⅲ不能证明产物中含有硫酸根,因此不能确定产物中含有Ag2SO4生成,故D不符合题意;
故答案为:B。
此题是对SO2性质的考查, 结合SO2的氧化性、还原性、酸性氧化物、漂白性等性质进行分析。
11.B
【解答】Cu与足量浓硫酸加热完全反应生成硫酸铜、二氧化硫和水,反应的化学方程式为Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,由方程式可知,硫酸起酸和氧化剂的作用,0.1 mol Cu完全反应生成0.1 mol SO2,则被还原的H2SO4的物质的量为0.1mol,
故答案为:B。
由铜与硫酸反应的化学方程式Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O可知,其中,1分子硫酸被还原为SO2显示其氧化性,1分子硫酸则显酸性。
12.D
【解答】A.NH4Cl加热分解生成氨气和氯化氢,氨气和氯化氢在试管上部又会重新化合为氯化铵,氨气不能逸出,不能用于制取氨气,故A不能达到实验目的;
B.氨气是碱性气体,浓硫酸能和氨气反应,不能用浓硫酸干燥氨气,故B不能达到实验目的;
C.氨气密度比空气小,应用向下排空气法收集氨气,故C不能达到实验目的;
D.氨气极易溶于水,可利用这点性质做喷泉实验,故D能达到实验目的;
故答案为:D。
A.加热氯化铵分解生成氨气和氯化氢,氨气和氯化氢在试管口遇冷又化合成氯化铵;
B.氨气为碱性气体,不能用浓硫酸干燥;
C.氨气的密度小于水。
13.D
【解答】A.实验1中二价铁和碳酸根离子生成沉淀,离子方程式为:Fe2++CO=FeCO3↓,A不符合题意;
B.白色沉淀是氢氧化亚铁,红褐色沉淀为氢氧化铁,该反应为氢氧化亚铁转化为氢氧化铁,铁的化合价升高,B不符合题意;
C.滴入KSCN溶液,出现红色,说明二价铁被氧化为三价铁,则说明FeSO4氧化变质,C不符合题意;
D.KMnO4溶液褪色,是溶液中的二价铁和高锰酸钾发生了氧化还原反应,体现了FeSO4具有还原性,D符合题意;
故答案为:D。
A.实验1中亚铁离子和碳酸根结合生成碳酸亚铁;
B. Fe(OH)2能被氧化成Fe(OH)3;
C.Fe3+与KSCN溶液反应生成红色络合物;
D.实验4体现FeSO4的还原性。
14.B
【解答】A.根据氨气的物理性质:NH3易液化,通常液氨常用作制冷剂,故不选A;
B.氧化性的强弱和得电子的能力有关,和得电子的多少无关,浓HNO3氧化性强于稀HNO3,故选B;
C.受热易分解的物质储存时,要密封保存,并放在阴凉通风处,故不选C;
D.硝酸具有强氧化性,金属和稀硝酸反应的还原产物一般是一氧化氮等低价态的含氮化合物,不会产生氢气,故不选D;
故答案为:B
易错选项BD,注意(1)氧化性的强弱和得电子的能力有关,和得电子的多少无关(2)硝酸为氧化性酸,与金属反应不可能生成H2。
15.A
【解答】A.读图可知,反应物有氨气、氧气和一氧化氮,生成物是氮气和水,符合题意
B. 读图可知 是中间产物,不符合题意
C. 在整个反应过程产假了反应,但质量和性质未变是催化剂
D. ,反应物只有一种,生成物多种是分解反应
故答案为:A
易错点:注意观察图一氧化氮也是生成物
16.D
【解答】A.由于还原性Ca>Mg,因此Mg能将CO2还原为C,则Ca也能将CO2还原为C,A不符合题意;
B.由于酸性H2CO3>HClO>HCO3-,因此NaClO溶液与CO2反应生成NaHCO3和HClO,但由于Ca(HCO3)2不稳定,在水溶液中浓度较大时能发生分解反应,生成CaCO3,因此Ca(ClO)2溶液与CO2反应只生成CaCO3和HClO,不生成Ca(HCO3)2,B不符合题意;
C.Na3N能与H2O反应生成NaOH和NH3,进一步与盐酸反应,生成NaCl和NH4Cl,Mg3N2与H2O反应生成Mg(OH)2和NH3,进一步与盐酸反应生成MgCl2和NH4Cl,C不符合题意;
D.NaOH溶液与少量AgNO3溶液反应生成AgOH沉淀,AgOH不稳定,分解成Ag2O。若氨水为少量AgNO3反应,由于氨水过量,反应生成的AgOH继续与氨水反应,形成[Ag(NH3)2]OH,不产生Ag2O,D符合题意;
故答案为:D
A、根据还原性Ca>Mg分析;
B、根据酸性H2CO3>HClO>HCO3-,但Ca(HCO3)2不稳定,在水溶液中也易分解;
C、金属氮化物能与H2O反应生成金属氢氧化物和NH3;
D、NaOH过量,与AgNO3溶液反应生成Ag(NH3)2+;
17.(1)不同
(2);;;
【解答】(1)若A常温下为淡黄色固体, B是能使品红溶液褪色的有刺激性气味的无色气体,则A是S单质,B是SO2,C是SO3,D是H2SO4;二氧化硫的漂白原理是SO2与有色物质结合生成不稳定的无色物质,漂白可逆;氯水的漂白原理是利用HClO的强氧化性,漂白不可逆;
答案为不同;
(2)若A在常温下是气体,C是红棕色气体,则C为NO2,B为NO,A为N2,D为HNO3;
①A的化学式是N2;
②D的浓溶液浓硝酸在常温下可与铜反应并生成C气体NO2,反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;反应中只有一半的HNO3作氧化剂被还原,若有3.2克铜(即0.05mol)完全参加反应,根据反应可知,被还原的D的物质的量为0.1;
③为避免尾气氮氧化物污染环境,可以在催化剂作用下使用将氮氧化物还原为。相关反应的化学方程式为。
(1)二氧化硫的漂白原理是SO2与有色物质结合生成不稳定的无色物质,漂白可逆;氯水的漂白原理是利用HClO的强氧化性,漂白不可逆;
(2)
①依据流程图,利用物质的性质判断;
②依据浓硝酸在常温下可与铜反应生成硝酸铜、水和NO2;
③根据反应物和产物的化学式,利用电子得失守恒、原子守恒书写。
18.(1)
(2)稀盐酸、溶液
(3)
(4)B;
【解答】
(1)根据分析C为SO2,与氢氧化钠溶液反应的离子方程式为:;
(2)H为硫酸盐,阴离子为硫酸根,检验硫酸根时先用稀盐酸酸化,无明显现象,再加氯化钡溶液,产生白色沉淀即可证明有硫酸根,
故答案为:用的试剂为:稀盐酸、溶液;
(3)由图可知过程II为铁离子和硫代硫酸根反应生成硫酸根、亚铁离子和氢离子,根据得失电子守恒和原子守恒,反应的离子离子方程式为:;
(4)①A.中硫元素的价态分别为-2和0价,不能生成+2价的Na2S2O3,A不正确;
B.中硫元素的价态分别为+4和0价,可能生成+2价的Na2S2O3,B正确;
C.中硫元素的价态分别为+4和+6价,不能生成+2价的Na2S2O3,C不正确;
D.中硫元素的价态分别为+4和+6价,不能生成+2价的Na2S2O3,D不正确;
故答案为:B。
②转化Ⅲ是亚硫酸钠溶液被氧气氧化成硫酸钠,化学反应方程式为:。
由图可知,A为H2S,B为S,C为SO2,D为SO3,E为H2SO4,F为H2SO3,亚硫酸被氧化可得到硫酸,H为硫酸盐,G为亚硫酸盐,亚硫酸盐被氧化可得到硫酸盐。
19.(1)A
(2)还原剂
(3)Fe+2H+=Fe2++H2↑
【解答】(1) 一种元素的化合价处于最低价态时则只具有还原性,所以铁元素的三种粒子A项的Fe原子则只具有还原性,故故答案为:A。(2) 食物中的Fe3+转化为Fe2+,化合价降低被还原,所以在此过程中维生素C的作用是还原剂。(3) 铁粉与胃酸(HCl)反应的化学方程式是Fe+2HCl=FeCl2+H2↑,故其离子方程式是Fe+2H+=Fe2++H2↑ 。
(1)化合价处于最低价态时只具有还原性;
(2)Fe3+得电子转化为Fe2+,发生还原反应,是氧化剂,维生素C是还原剂;
(3)根据Fe+2HCl=FeCl2+H2↑分析;
20.(1)高
(2)4Fe+10H++NO=4Fe2++NH+3H2O
(3)Al失去电子生成Al3+,NO在酸性条件下得到电子生成N2
(4)酸性过强,Al与H+反应生成H2
【解答】(1)根据图示,随硝酸密度增大,NO2的含量增大,硝酸的密度越大,高含量产物中N元素的化合价越高;
(2)硝酸的密度小于1.1g·cm-3时,Fe元素转化生成Fe2+,硝酸的还原产物主要是,硝酸密度小于1.1g·cm-3时发生的主要反应的离子方程式为4Fe+10H++NO=4Fe2++NH+3H2O;
(3)根据图示,Al失去电子生成Al3+,NO在酸性条件下得到电子生成N2;
(4)酸性过强,Al与H+反应生成H2,不利于脱硝。
(1)硝酸的密度越大,高含量产物中N元素的化合价越高;
(2)硝酸的密度小于1.1g·cm-3时,Fe生成Fe2+,硝酸的还原产物主要是;
(3)Al失去电子生成Al3+,NO在酸性条件下得到电子生成N2;
(4) 酸性过强 ,Al与H+反应生成H2。
21.(1)Al;Fe
(2)Al3++4OH-=AlO +2H2O;Fe(OH)3+3H+=Fe3++3H2O
【解答】A为两种金属组成的合金,A和盐酸反应生成浅绿色溶液B,B中含有亚铁离子,B中通入氯气得到棕黄色溶液C,向C中加入过量NaOH,生成红褐色沉淀D,D为Fe(OH)3,D和盐酸反应生成棕黄色溶液F,F中的溶质为FeCl3,无色滤液E中加入盐酸,得到白色沉淀G,因铝离子和过量氢氧化钠反应生成NaAlO2无色溶液,NaAlO2与适量盐酸反应可以生成Al(OH)3白色沉淀,所以E中含有偏铝酸根离子,G为Al(OH)3,根据原子守恒可知,A为Al、Fe两种金属组成的合金,B中溶质为FeCl2、AlCl3,C中溶质为AlCl3、FeCl3。(1). 由上述分析可知,合金A由Al、Fe两种金属组成,故答案为:Al;Fe;(2). C→E是氯化铝和过量氢氧化钠反应生成偏铝酸钠和水,离子方程式为Al3++4OH =AlO2 +2H2O,D→F是氢氧化铁和盐酸反应生成氯化铁和水,离子方程式为Fe(OH)3+3H+=Fe3++3H2O,故答案为:Al3++4OH =AlO2 +2H2O;Fe(OH)3+3H+=Fe3++3H2O。
特殊颜色的沉淀有:红褐色沉淀是氢氧化铁、蓝色沉淀为氢氧化铜。溶液中特殊颜色的离子:为蓝色、黄色、为浅绿色,为紫色。
22.(1)
(2)纯碱或苏打;
(3);;
【解答】(1)若为常见的非金属单质,常温下为固体,、、均为气体,与的反应需要在高温下进行,则A、B、C、D分别是C、CO、CO2、O2,则C、CO2反应的化学方程式为。
(2)若、、的溶液均显碱性,常用于培制糕点的发酵粉的主要成分之一,也可以作为抗酸药剂,C是碳酸氢钠,则A、B、D分别是NaOH、Na2CO3、CO2,的俗名为纯碱或苏打,NaOH与NaHCO3反应生成Na2CO3的离子方程式为;
(3)若为用量最大、用途最广泛的金属单质,它的一种氧化物为红棕色固体,可用作颜料,则D是Fe;是一种黄绿色气体,A是Cl2;铁和氯气反应生成氯化铁,的化学式为,和铁反应生成氯化亚铁,则C是;与Cu反应生成氯化亚铁和氯化铜,反应的离子方程式为,Cl2与反应生成的化学反应方程式为。
充分利用好题目中的关键信息以及转化关系进行解答;满足这样转化的有:C-CO-CO2;Na-Na2O-Na2O2;N-NO-NO2;Fe-Fe2+-Fe3+,结合先关信息进行解答即可
