专题1物质的分类及计量综合练习(含解析)2022-2023学年上学期高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 专题1物质的分类及计量综合练习(含解析)2022-2023学年上学期高一化学苏教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 416.7KB | ||
| 资源类型 | 教案 | ||
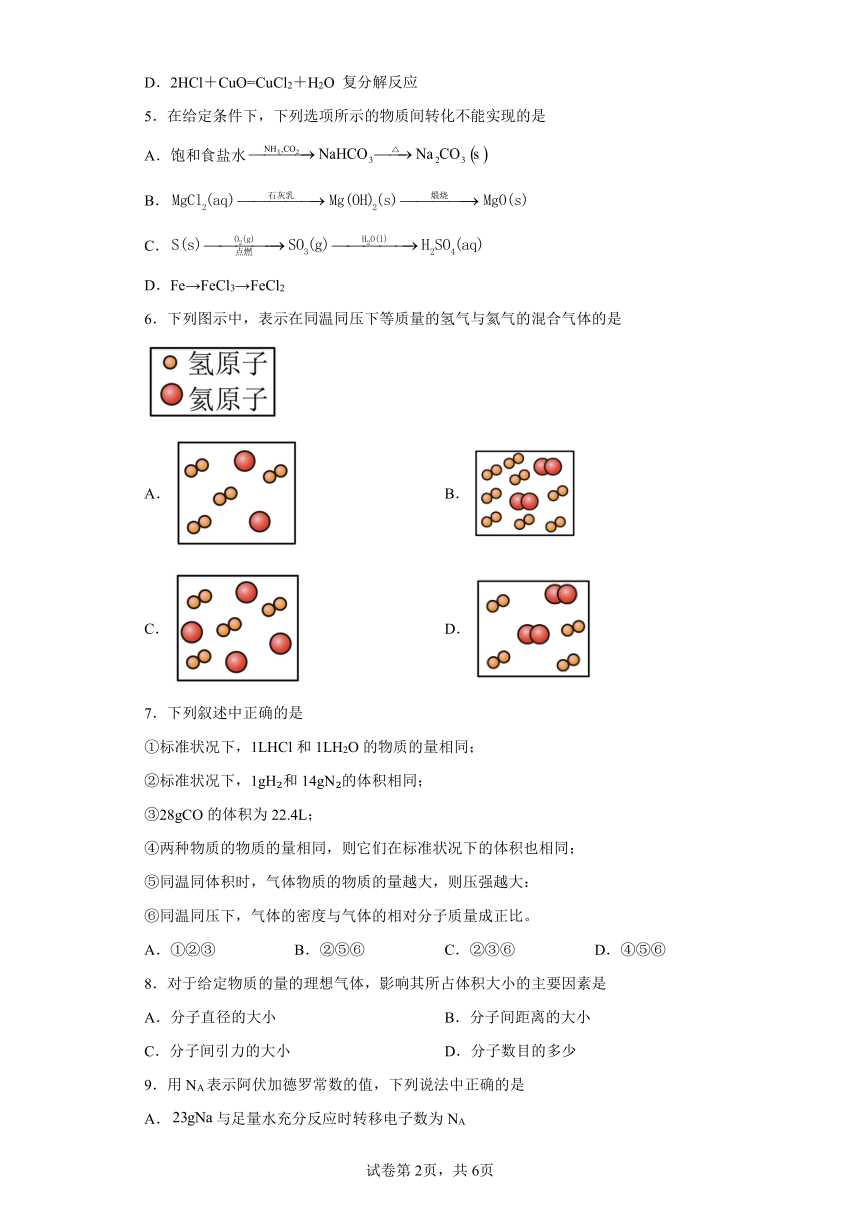
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-27 11:04:15 | ||
图片预览




文档简介
专题1物质的分类及计量综合练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列物质下列物质间的每一个转化都能通过一步反应实现的是
A.Fe2O3FeFeCl3 B.H2O2H2H2O
C.CaCl2溶液CaCO3CO2 D.CuSO4溶液CuCuO
2.含碳元素物质间发生转化:CCOCO2H2CO3K2CO3,其中碳元素化合价发生变化的是
A.①③ B.③④ C.①② D.②④
3.在一密闭容器中,a、b、c、d四种物质在一定条件下发生化学反应,反应前后各物质质量变化如图,下列说法错误的是
A.该反应是分解反应
B.b可能是催化剂
C.反应前后物质的总质量保持不变
D.反应生成的c和d质量相等
4.如图所示的微观变化与下列反应及反应类型对应正确的是
每个小球代表一个原子
A.2CO+O22CO2 化合反应
B.2HI+Cl2=2HCl+I2置换反应
C.2H2O2H2↑+O2↑ 分解反应
D.2HCl+CuO=CuCl2+H2O 复分解反应
5.在给定条件下,下列选项所示的物质间转化不能实现的是
A.饱和食盐水
B.
C.
D.Fe→FeCl3→FeCl2
6.下列图示中,表示在同温同压下等质量的氢气与氦气的混合气体的是
A. B.
C. D.
7.下列叙述中正确的是
①标准状况下,1LHCl和1LH2O的物质的量相同;
②标准状况下,1gH 和14gN 的体积相同;
③28gCO的体积为22.4L;
④两种物质的物质的量相同,则它们在标准状况下的体积也相同;
⑤同温同体积时,气体物质的物质的量越大,则压强越大:
⑥同温同压下,气体的密度与气体的相对分子质量成正比。
A.①②③ B.②⑤⑥ C.②③⑥ D.④⑤⑥
8.对于给定物质的量的理想气体,影响其所占体积大小的主要因素是
A.分子直径的大小 B.分子间距离的大小
C.分子间引力的大小 D.分子数目的多少
9.用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.与足量水充分反应时转移电子数为NA
B.25℃、时,中含有的原子数为NA
C.中含有的氢原子总数为3NA
D.溶液中离子总数为3NA
10.设表示阿伏加德罗常数的值。下列叙述正确的是
A.在常温常压下,含有的原子数为
B.标准状况下,含有的共价键数为
C.溶液中,的数目为
D.盐酸与足量共热,转移的电子数为
11.由多糖和多功能无机纳米颗粒组成的多糖基复合纳米材料(直径1-100 nm)在生物医学领域具有潜在的应用价值,具有协同性能和功能。多糖基复合纳米颗粒分散到水中,下列关于该分散系的说法错误的是
A.该分散系属于胶体
B.多糖基复合纳米颗粒直径较大,不能透过滤纸
C.利用丁达尔效应可以区分氯化钡溶液和该分散系
D.一束光通过该分散系,可观察到光亮的通路
12.下列关于胶体的说法中正确的是
A.胶体与溶液有明显不同的外观特征
B.胶体不稳定,静置后易产生沉淀
C.将Fe(OH)3胶体进行过滤,所得到的滤液与原来胶体的组成不同
D.豆浆是胶体,因为豆浆中的分散质粒子直径在1~100 nm之间
13.向烧杯中加入25mL蒸馏水,加热至沸腾,向沸水中逐滴加入6滴FeCl3饱和溶液。继续加热至液体呈红棕色,停止加热,就制得了Fe(OH)3胶体。下列有关胶体的叙述不正确的是
A.胶体是一种分散系,属于混合物
B.胶体的本质特征是能发生丁达尔效应
C.胶体分散质粒子直径介于10-9 -10-7m之间
D.利用丁达尔现象是区分胶体和溶液的一种常用方法
14.下列关于胶体的说法不正确的是
A.直径为的“钴钛菁”分子分散在水中能形成胶体,该分子直径比的直径大
B.丁达尔效应是区分溶液和胶体的一种常用物理方法
C.可以用滤纸分离除去胶体中的
D.胶体在一定条件下能稳定存在
15.朱自清先生在《荷塘月色》中写道。“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾所形成的种种美景的本质原因是
A.光是一种胶体
B.雾是一种胶体
C.薄雾中的小水滴颗粒大小约为10-9 m~10-7 m
D.发生丁达尔效应
二、填空题
16.回答下列问题:
(1)如图为五个椭圆交叉构成的图案,其中五个椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3、KOH五种物质,图中相连的物质均可归为一类,相交部分A、B、C、D为相应的分类标准代号:
①相连的两种物质都是电解质的是___(填分类标准代号,下同),都是氧化物的是___。
②图中相连的两种物质能够相互反应的是___,所属基本反应类型的是___反应。
③上述五种物质中的某一物质能与某种强酸反应生成上述中的另一种物质,则该反应的离子方程式为___。
④用洁净的烧杯取25mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热至液体呈红褐色,得到的分散系称为___,写出制备此分散系的化学反应方程式___。
(2)分类方法应用比较广泛,属于同一类的物质具有相似性,在生活和学习中使用分类的方法处理问题,可以做到举一反三,还可以做到由此及彼。如:
①CO2、SiO2、SO2、SO3都属于酸性氧化物,由CO2+Ca(OH)2=CaCO3↓+H2O,可完成SO3与NaOH反应的方程式为___。
②NaHCO3、NaHSO3、NaHS都属于弱酸形成的酸式盐,由NaHCO3+HCl=NaCl+H2O+CO2↑及NaHCO3+NaOH=Na2CO3+H2O,可完成NaHS分别与HCl、NaOH反应的方程式为___、___。
17.现有16.0 g CO和CO2的混合气体,在标准状况下其体积为8.96 L。请回答下列问题:
(1)该混合气体的平均摩尔质量为___________。
(2)混合气体中碳原子的个数为___________(用NA表示阿伏加德罗常数的值)。
(3)将混合气体依次通过如图所示装置,最后收集在气球中(体积在标准状况下测定)。
①气球中收集到的气体的摩尔质量为___________。
②气球中收集到的气体中,电子总数为___________(用NA表示阿伏加德罗常数的值,假设气体全部进入气球中)。
③气球的体积为___________L。
18.现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
甲同学:向1 mol·L-1的氯化铁溶液中加入少量3 mol·L-1的NaOH溶液。
乙同学:向25 mL沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至液体呈红褐色,停止加热。
丙同学:向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,待液体呈红褐色后继续煮沸10分钟。
试回答下列问题:
(1)其中操作正确的同学是___________,该反应原理的离子方程式为___________。
(2)证明有Fe(OH)3胶体生成的实验操作是___________,利用了胶体的___________性质。
(3)在胶体中加入电解质溶液或带有相反电荷的胶体微粒能使胶体微粒沉淀出来。丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现靠近阴极(和电源负极相连)区附近的颜色逐渐变深,这表明Fe(OH)3胶体粒子带___________(填“正”或“负”)电荷。
②现有橘红色的硫化锑(Sb2S3)胶体,装入U型管,插入石墨电极后通直流电,发现阳极附近橘红色加深,若把硫化锑(Sb2S3)胶体与Fe(OH)3胶体混合,看到的现象是___________。
三、计算题
19.(1)标准状况下,甲烷和一氧化碳的混合气体共8.96L,其质量为,则混合气体中甲烷的体积分数为______。
(2)某物质加热时按化学方程式分解,产物均为气体,测得由生成物组成的混合物气体对的相对密度为20,则反应物的摩尔质量为______。
(3) 密度为的溶液里含,从中取出一半的溶液,其中的物质的量浓度是______。
(4)溶液分别恰好使相同体积的硫酸铁、硫酸铜两种溶液中的完全转化成沉淀,则硫酸铁、硫酸铜两种溶液的物质的量浓度之比是______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.Fe和盐酸反应生成FeCl2和氢气,故不选A;
B.H2O2受热分解为水和氧气,故不选B;
C.CaCl2溶液和二氧化碳不反应,故不选C;
D.CuSO4溶液和铁反应生成硫酸亚铁和铜,铜和氧气反应生成CuO,故选D;
选D。
2.C
【详解】单质中元素的化合价为零、在化合物中正负化合价代数和为零。碳属于单质,碳元素的化合价为零。
一氧化碳中,氧元素显-2价,设碳元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x+(-2)=0,则x=+2价。
二氧化碳中,氧元素显-2价,设碳元素的化合价是y,根据在化合物中正负化合价代数和为零,可得:y+(-2)×2=0,则y=+4价。
碳酸中,氢元素显+1价,氧元素显-2价,设碳元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:(+1)×2+z+(-2)×3=0,则z=+4价。
碳酸钾中钾元素显+1价,氧元素显-2价,设碳元素的化合价是w,根据在化合物中正负化合价代数和为零,可得:(+1)×2+w+(-2)×3=0,则w=+4价。
故选:C。
3.D
【分析】图象显示,a是反应物,质量减少了10g,b的质量没有变化,可能是催化剂,c的质量增加了4g,d的质量增加了6g,该反应是a的分解反应。
【详解】A.根据分析,该反应是a的分解反应,A正确;
B.根据分析,b的质量没有变化,可能是催化剂,B正确;
C.根据质量守恒,反应前后物质的总质量保持不变,C正确;
D.根据分析,c的质量增加了4g,d的质量增加了6g,反应生成的c和d质量不相等,D错误;
故选D。
4.B
【分析】由题息,认真观察题目中的微观模拟图,前后认真对比,则可知此反应为:单质+化合物→单质+化合物,以此来解析;
【详解】A.2CO+O22CO2此反应不符合“单质+化合物→单质+化合物"的特点,A错误;
B.2HI+Cl2=2HCl+I2此反应符合“单质+化合物→单质+化合物”的置换反应特点,B正确;
C.2H2O2H2↑+O2↑此反应不符合符合“单质+化合物→单质+化合物”的特点,C错误;
D.2HCl+CuO=CuCl2+H2O此反应不符合“单质+化合物→单质+化合物”的特点,D错误;
故选B。
5.C
【详解】A.氯化钠水溶液电解生成氯气,但氯气与Fe发生反应生成FeCl3,故A不符合题意;
B.氯化镁溶液和石灰乳根据沉淀溶解平衡原理发生反应生成氢氧化镁,氢氧化镁高温煅烧后生成氧化镁,故B不符合题意;
C.硫在氧气中燃烧生成SO2,不能生成SO3,故C符合题意;
D.Fe与氯气反应生成FeCl3,FeCl3溶液中加入铁粉可以得到FeCl2,故D不符合题意;
故选C。
6.A
【分析】如图表示氢气与氦气分子的数量关系,分子数之比等于该物质的物质的量之比,根据n=判断等质量的氢气与氦气的物质的量之比,据此分析判断。
【详解】氦气的摩尔质量为4g/mol,氢气的摩尔质量为2g/mol,设质量为4g,则氦气的物质的量为=1mol,氢气的物质的量为=2mol,所以氢气分子与氦气分子的分子数之比为2mol∶1mol=2∶1,即分子个数之比为2∶1,根据图示,只有A符合,故选A。
7.B
【详解】①在标准状况下,HCl为气体,而H2O不是气体,因此等体积的HCl和H2O的物质的量不相同,①错误;
②标准状况下,1 g H2和14 g N2的物质的量都是0.5 mol,由于在此条件下气体摩尔体积相同,因此等物质的量的两种气体的体积也相同,②正确;
③28 g CO的物质的量是1 mol,由于 气体所处的外界条件,因此不能确定1 molCO的体积就是22.4 L,③错误;
④若两种物质在标准状况下的状态不都是气体,则两种物质尽管物质的量相同,但它们在标准状况下的体积也不相同,④错误;
⑤在同温同体积时,气体物质的物质的量越大,单位体积内气体分子数越多,则气体的压强就越大,⑤正确;
⑥根据气体的密度公式ρ=,在同温同压下,气体摩尔体积相同,所以气体的密度与气体的相对分子质量成正比,⑥正确;
综上所述可知:说法正确的是②⑤⑥;
故选B。
8.B
【详解】A.气体分子之间的直径远远小于分子间的距离,故分子直径不是主要的影响因素,选项 A 错误;
B.分子间距离的大小, 气体体积主要影响因素就是分子间距,例如加压可以减小分子间距,体积明显减少,选项 B 正确;
C.分子间引力的大小,不是影响体积的主要因素,选项 C 错误;
D.对于一定物质的量的理想气体,其分子数目一定,选项 D 错误;
答案选B。
9.A
【详解】A.23gNa的物质的量为1mol,与水反应时生成氢氧化钠,失去1mol电子,故转移电子数为NA,A正确;
B.25℃、101.3kPa不是标况,11.2LH2的物质的量不是0.5mol,氢原子数也不是NA,B错误;
C.54gH2O的物质的量为3mol,含有的氢原子总数为3NA,C错误;
D.2L1mol/LNaCl 溶液中氯化钠的物质的量为2mol,钠离子和氯离子总数为4NA,溶液中还有氢离子和氢氧根,D错误;
故选A。
10.A
【详解】A.由题意可知,1.7gNH3的分子数为,又由原子数为分子数的4倍,则原子数为,所以在常温常压下,1.7gNH3含有的原子数为,故A正确;
B.标准状况下, CCl4为液态,不能用气体摩尔体积计算,故B错误;
C.由于体积未知,所以无法计算,故C错误;
D.浓盐酸与MnO2共热时才能反应,稀盐酸与二氧化锰不反应,所以50mL12mol L-1盐酸与足量MnO2共热,盐酸不能被完全消耗,所以转移的电子数小于0.3NA,故D错误;
答案选A。
11.B
【详解】A.多糖基复合纳米材料(直径1-100 nm),将其分散到水中,形成的分散系属于胶体,A正确;
B.胶体粒子能透过滤纸,不能透过半透膜,B错误;
C.胶体能够使光线发生散射作用而沿直线传播,因而能够在胶体中看到有一条光亮的通路,即产生丁达尔效应,而BaCl2溶液分散质微粒直径小,不能使光线发生散射作用,因此不能产生丁达尔效应,故可以通过丁达尔效应区分氯化钡溶液和该分散系,C正确;
D.胶体能够使光线发生散射作用而沿直线传播,因而能够在胶体中看到有一条光亮的通路,即产生丁达尔效应,多糖基复合纳米材料由于其直径1-100 nm,将其分散到水中,形成的分散系属于胶体,因此一束光通过该分散系,可观察到光亮的通路,D正确;
答案选B。
12.D
【详解】A.胶体与溶液的主要特征都是均一、透明、稳定的,A选项错误;
B.胶体稳定,不易产生沉淀,B选项错误;
C.胶体的分散质粒子可以透过滤纸,所以将Fe(OH)3胶体进行过滤时,胶体的所有组成都会透过滤纸,滤液与胶体的组成一致,C选项错误;
D.胶体区别于其他分散系的本质在于其分散质粒子直径在1nm~100 nm之间,D选项正确;
答案选D。
13.B
【详解】A.分散系由分散质和分散剂组成,胶体是一种分散系,属于混合物,A正确;
B.胶体的本质特征是胶体粒子直径在1-100nm之间,B错误;
C.胶体分散质粒子直径介于1-100nm之间,即10-9 -10-7m之间,C正确;
D.胶体具有丁达尔现象,溶液不具有丁达尔现象,因此丁达尔现象是区分胶体和溶液的一种常用方法,D正确;
答案选B。
14.C
【详解】A.“钴酞菁”分子(直径为)的微粒直径属于胶体分散系范围内,属于胶体分散系,溶液中分散质直径小于1nm,所以“钴酞菁”分子的直径比Na+大,选项A正确;
B.丁达尔效应是胶体所特有的性质,所以丁达尔现象可以用来区别胶体和溶液,且为物理方法,选项B正确;
C.胶体、溶液中分散质粒子直径小于滤纸孔径,二者都能透过滤纸,达不到提纯的目的,选项C不正确;
D.胶体在一定条件下也能稳定存在,属介稳体系,选项D正确;
答案选C。
15.C
【详解】月光穿过薄雾所形成的种种美景的本质原因是薄雾中的小水滴颗粒大小约为10-9 m~10-7 m,具有胶体颗粒大小,从而产生了丁达尔效应,故合理选项是C。
16.(1) CD B D 复分解 Fe2O3+6H+=2Fe3++3H2O 胶体 FeCl3+3H2OFe(OH)3(胶体)+3HCl
(2) SO3+2NaOH=Na2SO4+H2O NaHS+HCl=NaCl+H2S↑ NaHS+NaOH=Na2S+H2O
【详解】(1)①C2H5OH是有机化合物,由分子构成,在水溶液中和熔融状态下不能因自身发生电离而导电,属于非电解质;CO2是非金属化合物,由分子构成,在水溶液中和熔融状态下不能因自身发生电离而导电,属于非电解质;Fe2O3是金属化合物,由离子构成,难溶于水,在熔融状态下能够发生电离而导电,属于电解质;FeCl3是盐,KOH是碱,二者都是离子化合物,在水溶液和熔融状态下都能够发生电离而导电,属于电解质,因此相连的两种物质都是电解质的是CD;都是氧化物的是B,故答案为:CD;B;
②在上述相连的物质中,FeCl3与KOH在溶液中会发生复分解反应,产生Fe(OH)3沉淀和KCl,反应方程式为FeCl3+3KOH=Fe(OH)3↓+3KCl,故答案为:D;复分解;
③上述五种物质中的某一物质能与某种强酸反应生成上述中的另一种物质,这种物质是Fe2O3,Fe2O3与HCl反应产生的另一种物质是FeCl3,该反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
④用洁净的烧杯取25 mL蒸馏水,加热至沸腾,然后向烧杯中逐滴加入几滴FeCl3饱和溶液,加热煮沸至液体呈红褐色,得到的分散系称为胶体;该化学方程式为:FeCl3+3H2OFe(OH)3(胶体)+3HCl,故答案为:胶体;FeCl3+3H2OFe(OH)3(胶体)+3HCl;
(2)①SO3是酸性氧化物,与NaOH反应产生Na2SO4和H2O,该反应的化学方程式为:SO3+2NaOH=Na2SO4+H2O,故答案为:SO3+2NaOH=Na2SO4+H2O;
②NaHS与HCl反应产生NaCl、H2S,反应方程式为:NaHS+HCl=NaCl+H2S↑;NaHS与NaOH反应产生Na2S、H2O,反应的化学方程式为:NaHS+NaOH=Na2S+H2O,故答案为:NaHS+HCl=NaCl+H2S↑;NaHS+NaOH=Na2S+H2O。
17.(1)40 g·mol-1
(2)0.4NA
(3) 28 g·mol-1 1.4NA 2.24
【分析】16.0 g CO和CO2的混合气体,在标准状况下其体积为8.96 L,则混合气体的总物质的量是; 设混合气体中CO和CO2的物质的量分别为xmol、ymol;,解得。
【详解】(1)该混合气体的平均摩尔质量为g·mol-1;
(2)CO和CO2分子中都只含1个碳原子,混合气体的总物质的量是0.4mol,所以混合气体中碳原子的个数为0.4 NA;
(3)①二氧化碳被氢氧化钠吸收,气球中收集到的气体是CO,CO的摩尔质量为28 g·mol-1;
②1个CO分子中有14个电子,气球中收集到的气体是0.1molCO,电子总数为1.4NA;
③气球中收集到的气体是0.1molCO,标准状况下,气球的体积为0.1mol×22.4L/mol=2.24L。
18.(1) 乙 Fe3+ + 3H2OFe (OH)3 (胶体) + 3H+
(2) 用一束光通过得到的液体,从侧面观察能看到一条光亮的“通路” 丁达尔效应
(3) 正 有沉淀生成
【解析】(1)氢氧化铁胶体制备的方法为:向25 mL沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至液体呈红褐色,停止加热,故乙同学的操作正确;该反应原理的离子方程式为Fe3+ + 3H2OFe (OH)3 (胶体) + 3H+;
(2)丁达尔效应是胶体独有的现象,证明有Fe(OH)3胶体生成的实验操作是用一束光通过得到的液体,从侧面观察能看到一条光亮的“通路”;利用了胶体的丁达尔效应;
(3)①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现靠近阴极(和电源负极相连)区附近的颜色逐渐变深,这表明Fe(OH)3胶体粒子带正电荷;②现有橘红色的硫化锑(Sb2S3)胶体,装入U型管,插入石墨电极后通直流电,发现阳极附近橘红色加深,说明硫化锑(Sb2S3)胶粒带负电, 硫化锑(Sb2S3)与Fe(OH)3胶体混合,看到的现象是有沉淀生成,异种电荷会发生聚沉。
19. 75%
【详解】(1)标准状况下,甲烷和一氧化碳的混合气体共,混合气体的物质的量为,设甲烷和一氧化碳的物质的量分别是、,则、,解得、,所以混合气体中甲烷的体积分数为,故答案为:75%;
(2)某物质加热时按化学方程式分解,产物均为气体,测得由生成物组成的混合物气体对的相对密度为20,则生成物的平均相对分子质量是。设反应物的摩尔质量为,参加反应的为,则根据质量守恒定律可知,解得,即的摩尔质量是,故答案为:;
(3)密度为的溶液里含,钙离子的物质的量为,根据化学式可知氯离子的物质的量为,溶液的体积为,则氯离子的浓度为。溶液是均一、稳定的,则从中再取出一半的溶液,其中的物质的量浓度仍是,故答案为:;
(4)等物质的量的恰好可使相同体积的两种溶液中的硫酸根离子完全转化为硫酸钡沉淀,根据可知,又因两种溶液体积相同,溶质的物质的量之比等于溶液的物质的量浓度之比,则硫酸铁、硫酸铜两种溶液的物质的量浓度之比为号,故答案为:1:3。
【点睛】本题主要考查物质的量以及物质的量浓度的有关计算,(4)是易错点,明确发生的化学反应及硫酸根离子守恒是解答本题的关键,注意答题时不需要利用钡离子的物质的量代入计算。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列物质下列物质间的每一个转化都能通过一步反应实现的是
A.Fe2O3FeFeCl3 B.H2O2H2H2O
C.CaCl2溶液CaCO3CO2 D.CuSO4溶液CuCuO
2.含碳元素物质间发生转化:CCOCO2H2CO3K2CO3,其中碳元素化合价发生变化的是
A.①③ B.③④ C.①② D.②④
3.在一密闭容器中,a、b、c、d四种物质在一定条件下发生化学反应,反应前后各物质质量变化如图,下列说法错误的是
A.该反应是分解反应
B.b可能是催化剂
C.反应前后物质的总质量保持不变
D.反应生成的c和d质量相等
4.如图所示的微观变化与下列反应及反应类型对应正确的是
每个小球代表一个原子
A.2CO+O22CO2 化合反应
B.2HI+Cl2=2HCl+I2置换反应
C.2H2O2H2↑+O2↑ 分解反应
D.2HCl+CuO=CuCl2+H2O 复分解反应
5.在给定条件下,下列选项所示的物质间转化不能实现的是
A.饱和食盐水
B.
C.
D.Fe→FeCl3→FeCl2
6.下列图示中,表示在同温同压下等质量的氢气与氦气的混合气体的是
A. B.
C. D.
7.下列叙述中正确的是
①标准状况下,1LHCl和1LH2O的物质的量相同;
②标准状况下,1gH 和14gN 的体积相同;
③28gCO的体积为22.4L;
④两种物质的物质的量相同,则它们在标准状况下的体积也相同;
⑤同温同体积时,气体物质的物质的量越大,则压强越大:
⑥同温同压下,气体的密度与气体的相对分子质量成正比。
A.①②③ B.②⑤⑥ C.②③⑥ D.④⑤⑥
8.对于给定物质的量的理想气体,影响其所占体积大小的主要因素是
A.分子直径的大小 B.分子间距离的大小
C.分子间引力的大小 D.分子数目的多少
9.用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.与足量水充分反应时转移电子数为NA
B.25℃、时,中含有的原子数为NA
C.中含有的氢原子总数为3NA
D.溶液中离子总数为3NA
10.设表示阿伏加德罗常数的值。下列叙述正确的是
A.在常温常压下,含有的原子数为
B.标准状况下,含有的共价键数为
C.溶液中,的数目为
D.盐酸与足量共热,转移的电子数为
11.由多糖和多功能无机纳米颗粒组成的多糖基复合纳米材料(直径1-100 nm)在生物医学领域具有潜在的应用价值,具有协同性能和功能。多糖基复合纳米颗粒分散到水中,下列关于该分散系的说法错误的是
A.该分散系属于胶体
B.多糖基复合纳米颗粒直径较大,不能透过滤纸
C.利用丁达尔效应可以区分氯化钡溶液和该分散系
D.一束光通过该分散系,可观察到光亮的通路
12.下列关于胶体的说法中正确的是
A.胶体与溶液有明显不同的外观特征
B.胶体不稳定,静置后易产生沉淀
C.将Fe(OH)3胶体进行过滤,所得到的滤液与原来胶体的组成不同
D.豆浆是胶体,因为豆浆中的分散质粒子直径在1~100 nm之间
13.向烧杯中加入25mL蒸馏水,加热至沸腾,向沸水中逐滴加入6滴FeCl3饱和溶液。继续加热至液体呈红棕色,停止加热,就制得了Fe(OH)3胶体。下列有关胶体的叙述不正确的是
A.胶体是一种分散系,属于混合物
B.胶体的本质特征是能发生丁达尔效应
C.胶体分散质粒子直径介于10-9 -10-7m之间
D.利用丁达尔现象是区分胶体和溶液的一种常用方法
14.下列关于胶体的说法不正确的是
A.直径为的“钴钛菁”分子分散在水中能形成胶体,该分子直径比的直径大
B.丁达尔效应是区分溶液和胶体的一种常用物理方法
C.可以用滤纸分离除去胶体中的
D.胶体在一定条件下能稳定存在
15.朱自清先生在《荷塘月色》中写道。“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾所形成的种种美景的本质原因是
A.光是一种胶体
B.雾是一种胶体
C.薄雾中的小水滴颗粒大小约为10-9 m~10-7 m
D.发生丁达尔效应
二、填空题
16.回答下列问题:
(1)如图为五个椭圆交叉构成的图案,其中五个椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3、KOH五种物质,图中相连的物质均可归为一类,相交部分A、B、C、D为相应的分类标准代号:
①相连的两种物质都是电解质的是___(填分类标准代号,下同),都是氧化物的是___。
②图中相连的两种物质能够相互反应的是___,所属基本反应类型的是___反应。
③上述五种物质中的某一物质能与某种强酸反应生成上述中的另一种物质,则该反应的离子方程式为___。
④用洁净的烧杯取25mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热至液体呈红褐色,得到的分散系称为___,写出制备此分散系的化学反应方程式___。
(2)分类方法应用比较广泛,属于同一类的物质具有相似性,在生活和学习中使用分类的方法处理问题,可以做到举一反三,还可以做到由此及彼。如:
①CO2、SiO2、SO2、SO3都属于酸性氧化物,由CO2+Ca(OH)2=CaCO3↓+H2O,可完成SO3与NaOH反应的方程式为___。
②NaHCO3、NaHSO3、NaHS都属于弱酸形成的酸式盐,由NaHCO3+HCl=NaCl+H2O+CO2↑及NaHCO3+NaOH=Na2CO3+H2O,可完成NaHS分别与HCl、NaOH反应的方程式为___、___。
17.现有16.0 g CO和CO2的混合气体,在标准状况下其体积为8.96 L。请回答下列问题:
(1)该混合气体的平均摩尔质量为___________。
(2)混合气体中碳原子的个数为___________(用NA表示阿伏加德罗常数的值)。
(3)将混合气体依次通过如图所示装置,最后收集在气球中(体积在标准状况下测定)。
①气球中收集到的气体的摩尔质量为___________。
②气球中收集到的气体中,电子总数为___________(用NA表示阿伏加德罗常数的值,假设气体全部进入气球中)。
③气球的体积为___________L。
18.现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
甲同学:向1 mol·L-1的氯化铁溶液中加入少量3 mol·L-1的NaOH溶液。
乙同学:向25 mL沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至液体呈红褐色,停止加热。
丙同学:向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,待液体呈红褐色后继续煮沸10分钟。
试回答下列问题:
(1)其中操作正确的同学是___________,该反应原理的离子方程式为___________。
(2)证明有Fe(OH)3胶体生成的实验操作是___________,利用了胶体的___________性质。
(3)在胶体中加入电解质溶液或带有相反电荷的胶体微粒能使胶体微粒沉淀出来。丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现靠近阴极(和电源负极相连)区附近的颜色逐渐变深,这表明Fe(OH)3胶体粒子带___________(填“正”或“负”)电荷。
②现有橘红色的硫化锑(Sb2S3)胶体,装入U型管,插入石墨电极后通直流电,发现阳极附近橘红色加深,若把硫化锑(Sb2S3)胶体与Fe(OH)3胶体混合,看到的现象是___________。
三、计算题
19.(1)标准状况下,甲烷和一氧化碳的混合气体共8.96L,其质量为,则混合气体中甲烷的体积分数为______。
(2)某物质加热时按化学方程式分解,产物均为气体,测得由生成物组成的混合物气体对的相对密度为20,则反应物的摩尔质量为______。
(3) 密度为的溶液里含,从中取出一半的溶液,其中的物质的量浓度是______。
(4)溶液分别恰好使相同体积的硫酸铁、硫酸铜两种溶液中的完全转化成沉淀,则硫酸铁、硫酸铜两种溶液的物质的量浓度之比是______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.Fe和盐酸反应生成FeCl2和氢气,故不选A;
B.H2O2受热分解为水和氧气,故不选B;
C.CaCl2溶液和二氧化碳不反应,故不选C;
D.CuSO4溶液和铁反应生成硫酸亚铁和铜,铜和氧气反应生成CuO,故选D;
选D。
2.C
【详解】单质中元素的化合价为零、在化合物中正负化合价代数和为零。碳属于单质,碳元素的化合价为零。
一氧化碳中,氧元素显-2价,设碳元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x+(-2)=0,则x=+2价。
二氧化碳中,氧元素显-2价,设碳元素的化合价是y,根据在化合物中正负化合价代数和为零,可得:y+(-2)×2=0,则y=+4价。
碳酸中,氢元素显+1价,氧元素显-2价,设碳元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:(+1)×2+z+(-2)×3=0,则z=+4价。
碳酸钾中钾元素显+1价,氧元素显-2价,设碳元素的化合价是w,根据在化合物中正负化合价代数和为零,可得:(+1)×2+w+(-2)×3=0,则w=+4价。
故选:C。
3.D
【分析】图象显示,a是反应物,质量减少了10g,b的质量没有变化,可能是催化剂,c的质量增加了4g,d的质量增加了6g,该反应是a的分解反应。
【详解】A.根据分析,该反应是a的分解反应,A正确;
B.根据分析,b的质量没有变化,可能是催化剂,B正确;
C.根据质量守恒,反应前后物质的总质量保持不变,C正确;
D.根据分析,c的质量增加了4g,d的质量增加了6g,反应生成的c和d质量不相等,D错误;
故选D。
4.B
【分析】由题息,认真观察题目中的微观模拟图,前后认真对比,则可知此反应为:单质+化合物→单质+化合物,以此来解析;
【详解】A.2CO+O22CO2此反应不符合“单质+化合物→单质+化合物"的特点,A错误;
B.2HI+Cl2=2HCl+I2此反应符合“单质+化合物→单质+化合物”的置换反应特点,B正确;
C.2H2O2H2↑+O2↑此反应不符合符合“单质+化合物→单质+化合物”的特点,C错误;
D.2HCl+CuO=CuCl2+H2O此反应不符合“单质+化合物→单质+化合物”的特点,D错误;
故选B。
5.C
【详解】A.氯化钠水溶液电解生成氯气,但氯气与Fe发生反应生成FeCl3,故A不符合题意;
B.氯化镁溶液和石灰乳根据沉淀溶解平衡原理发生反应生成氢氧化镁,氢氧化镁高温煅烧后生成氧化镁,故B不符合题意;
C.硫在氧气中燃烧生成SO2,不能生成SO3,故C符合题意;
D.Fe与氯气反应生成FeCl3,FeCl3溶液中加入铁粉可以得到FeCl2,故D不符合题意;
故选C。
6.A
【分析】如图表示氢气与氦气分子的数量关系,分子数之比等于该物质的物质的量之比,根据n=判断等质量的氢气与氦气的物质的量之比,据此分析判断。
【详解】氦气的摩尔质量为4g/mol,氢气的摩尔质量为2g/mol,设质量为4g,则氦气的物质的量为=1mol,氢气的物质的量为=2mol,所以氢气分子与氦气分子的分子数之比为2mol∶1mol=2∶1,即分子个数之比为2∶1,根据图示,只有A符合,故选A。
7.B
【详解】①在标准状况下,HCl为气体,而H2O不是气体,因此等体积的HCl和H2O的物质的量不相同,①错误;
②标准状况下,1 g H2和14 g N2的物质的量都是0.5 mol,由于在此条件下气体摩尔体积相同,因此等物质的量的两种气体的体积也相同,②正确;
③28 g CO的物质的量是1 mol,由于 气体所处的外界条件,因此不能确定1 molCO的体积就是22.4 L,③错误;
④若两种物质在标准状况下的状态不都是气体,则两种物质尽管物质的量相同,但它们在标准状况下的体积也不相同,④错误;
⑤在同温同体积时,气体物质的物质的量越大,单位体积内气体分子数越多,则气体的压强就越大,⑤正确;
⑥根据气体的密度公式ρ=,在同温同压下,气体摩尔体积相同,所以气体的密度与气体的相对分子质量成正比,⑥正确;
综上所述可知:说法正确的是②⑤⑥;
故选B。
8.B
【详解】A.气体分子之间的直径远远小于分子间的距离,故分子直径不是主要的影响因素,选项 A 错误;
B.分子间距离的大小, 气体体积主要影响因素就是分子间距,例如加压可以减小分子间距,体积明显减少,选项 B 正确;
C.分子间引力的大小,不是影响体积的主要因素,选项 C 错误;
D.对于一定物质的量的理想气体,其分子数目一定,选项 D 错误;
答案选B。
9.A
【详解】A.23gNa的物质的量为1mol,与水反应时生成氢氧化钠,失去1mol电子,故转移电子数为NA,A正确;
B.25℃、101.3kPa不是标况,11.2LH2的物质的量不是0.5mol,氢原子数也不是NA,B错误;
C.54gH2O的物质的量为3mol,含有的氢原子总数为3NA,C错误;
D.2L1mol/LNaCl 溶液中氯化钠的物质的量为2mol,钠离子和氯离子总数为4NA,溶液中还有氢离子和氢氧根,D错误;
故选A。
10.A
【详解】A.由题意可知,1.7gNH3的分子数为,又由原子数为分子数的4倍,则原子数为,所以在常温常压下,1.7gNH3含有的原子数为,故A正确;
B.标准状况下, CCl4为液态,不能用气体摩尔体积计算,故B错误;
C.由于体积未知,所以无法计算,故C错误;
D.浓盐酸与MnO2共热时才能反应,稀盐酸与二氧化锰不反应,所以50mL12mol L-1盐酸与足量MnO2共热,盐酸不能被完全消耗,所以转移的电子数小于0.3NA,故D错误;
答案选A。
11.B
【详解】A.多糖基复合纳米材料(直径1-100 nm),将其分散到水中,形成的分散系属于胶体,A正确;
B.胶体粒子能透过滤纸,不能透过半透膜,B错误;
C.胶体能够使光线发生散射作用而沿直线传播,因而能够在胶体中看到有一条光亮的通路,即产生丁达尔效应,而BaCl2溶液分散质微粒直径小,不能使光线发生散射作用,因此不能产生丁达尔效应,故可以通过丁达尔效应区分氯化钡溶液和该分散系,C正确;
D.胶体能够使光线发生散射作用而沿直线传播,因而能够在胶体中看到有一条光亮的通路,即产生丁达尔效应,多糖基复合纳米材料由于其直径1-100 nm,将其分散到水中,形成的分散系属于胶体,因此一束光通过该分散系,可观察到光亮的通路,D正确;
答案选B。
12.D
【详解】A.胶体与溶液的主要特征都是均一、透明、稳定的,A选项错误;
B.胶体稳定,不易产生沉淀,B选项错误;
C.胶体的分散质粒子可以透过滤纸,所以将Fe(OH)3胶体进行过滤时,胶体的所有组成都会透过滤纸,滤液与胶体的组成一致,C选项错误;
D.胶体区别于其他分散系的本质在于其分散质粒子直径在1nm~100 nm之间,D选项正确;
答案选D。
13.B
【详解】A.分散系由分散质和分散剂组成,胶体是一种分散系,属于混合物,A正确;
B.胶体的本质特征是胶体粒子直径在1-100nm之间,B错误;
C.胶体分散质粒子直径介于1-100nm之间,即10-9 -10-7m之间,C正确;
D.胶体具有丁达尔现象,溶液不具有丁达尔现象,因此丁达尔现象是区分胶体和溶液的一种常用方法,D正确;
答案选B。
14.C
【详解】A.“钴酞菁”分子(直径为)的微粒直径属于胶体分散系范围内,属于胶体分散系,溶液中分散质直径小于1nm,所以“钴酞菁”分子的直径比Na+大,选项A正确;
B.丁达尔效应是胶体所特有的性质,所以丁达尔现象可以用来区别胶体和溶液,且为物理方法,选项B正确;
C.胶体、溶液中分散质粒子直径小于滤纸孔径,二者都能透过滤纸,达不到提纯的目的,选项C不正确;
D.胶体在一定条件下也能稳定存在,属介稳体系,选项D正确;
答案选C。
15.C
【详解】月光穿过薄雾所形成的种种美景的本质原因是薄雾中的小水滴颗粒大小约为10-9 m~10-7 m,具有胶体颗粒大小,从而产生了丁达尔效应,故合理选项是C。
16.(1) CD B D 复分解 Fe2O3+6H+=2Fe3++3H2O 胶体 FeCl3+3H2OFe(OH)3(胶体)+3HCl
(2) SO3+2NaOH=Na2SO4+H2O NaHS+HCl=NaCl+H2S↑ NaHS+NaOH=Na2S+H2O
【详解】(1)①C2H5OH是有机化合物,由分子构成,在水溶液中和熔融状态下不能因自身发生电离而导电,属于非电解质;CO2是非金属化合物,由分子构成,在水溶液中和熔融状态下不能因自身发生电离而导电,属于非电解质;Fe2O3是金属化合物,由离子构成,难溶于水,在熔融状态下能够发生电离而导电,属于电解质;FeCl3是盐,KOH是碱,二者都是离子化合物,在水溶液和熔融状态下都能够发生电离而导电,属于电解质,因此相连的两种物质都是电解质的是CD;都是氧化物的是B,故答案为:CD;B;
②在上述相连的物质中,FeCl3与KOH在溶液中会发生复分解反应,产生Fe(OH)3沉淀和KCl,反应方程式为FeCl3+3KOH=Fe(OH)3↓+3KCl,故答案为:D;复分解;
③上述五种物质中的某一物质能与某种强酸反应生成上述中的另一种物质,这种物质是Fe2O3,Fe2O3与HCl反应产生的另一种物质是FeCl3,该反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
④用洁净的烧杯取25 mL蒸馏水,加热至沸腾,然后向烧杯中逐滴加入几滴FeCl3饱和溶液,加热煮沸至液体呈红褐色,得到的分散系称为胶体;该化学方程式为:FeCl3+3H2OFe(OH)3(胶体)+3HCl,故答案为:胶体;FeCl3+3H2OFe(OH)3(胶体)+3HCl;
(2)①SO3是酸性氧化物,与NaOH反应产生Na2SO4和H2O,该反应的化学方程式为:SO3+2NaOH=Na2SO4+H2O,故答案为:SO3+2NaOH=Na2SO4+H2O;
②NaHS与HCl反应产生NaCl、H2S,反应方程式为:NaHS+HCl=NaCl+H2S↑;NaHS与NaOH反应产生Na2S、H2O,反应的化学方程式为:NaHS+NaOH=Na2S+H2O,故答案为:NaHS+HCl=NaCl+H2S↑;NaHS+NaOH=Na2S+H2O。
17.(1)40 g·mol-1
(2)0.4NA
(3) 28 g·mol-1 1.4NA 2.24
【分析】16.0 g CO和CO2的混合气体,在标准状况下其体积为8.96 L,则混合气体的总物质的量是; 设混合气体中CO和CO2的物质的量分别为xmol、ymol;,解得。
【详解】(1)该混合气体的平均摩尔质量为g·mol-1;
(2)CO和CO2分子中都只含1个碳原子,混合气体的总物质的量是0.4mol,所以混合气体中碳原子的个数为0.4 NA;
(3)①二氧化碳被氢氧化钠吸收,气球中收集到的气体是CO,CO的摩尔质量为28 g·mol-1;
②1个CO分子中有14个电子,气球中收集到的气体是0.1molCO,电子总数为1.4NA;
③气球中收集到的气体是0.1molCO,标准状况下,气球的体积为0.1mol×22.4L/mol=2.24L。
18.(1) 乙 Fe3+ + 3H2OFe (OH)3 (胶体) + 3H+
(2) 用一束光通过得到的液体,从侧面观察能看到一条光亮的“通路” 丁达尔效应
(3) 正 有沉淀生成
【解析】(1)氢氧化铁胶体制备的方法为:向25 mL沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至液体呈红褐色,停止加热,故乙同学的操作正确;该反应原理的离子方程式为Fe3+ + 3H2OFe (OH)3 (胶体) + 3H+;
(2)丁达尔效应是胶体独有的现象,证明有Fe(OH)3胶体生成的实验操作是用一束光通过得到的液体,从侧面观察能看到一条光亮的“通路”;利用了胶体的丁达尔效应;
(3)①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现靠近阴极(和电源负极相连)区附近的颜色逐渐变深,这表明Fe(OH)3胶体粒子带正电荷;②现有橘红色的硫化锑(Sb2S3)胶体,装入U型管,插入石墨电极后通直流电,发现阳极附近橘红色加深,说明硫化锑(Sb2S3)胶粒带负电, 硫化锑(Sb2S3)与Fe(OH)3胶体混合,看到的现象是有沉淀生成,异种电荷会发生聚沉。
19. 75%
【详解】(1)标准状况下,甲烷和一氧化碳的混合气体共,混合气体的物质的量为,设甲烷和一氧化碳的物质的量分别是、,则、,解得、,所以混合气体中甲烷的体积分数为,故答案为:75%;
(2)某物质加热时按化学方程式分解,产物均为气体,测得由生成物组成的混合物气体对的相对密度为20,则生成物的平均相对分子质量是。设反应物的摩尔质量为,参加反应的为,则根据质量守恒定律可知,解得,即的摩尔质量是,故答案为:;
(3)密度为的溶液里含,钙离子的物质的量为,根据化学式可知氯离子的物质的量为,溶液的体积为,则氯离子的浓度为。溶液是均一、稳定的,则从中再取出一半的溶液,其中的物质的量浓度仍是,故答案为:;
(4)等物质的量的恰好可使相同体积的两种溶液中的硫酸根离子完全转化为硫酸钡沉淀,根据可知,又因两种溶液体积相同,溶质的物质的量之比等于溶液的物质的量浓度之比,则硫酸铁、硫酸铜两种溶液的物质的量浓度之比为号,故答案为:1:3。
【点睛】本题主要考查物质的量以及物质的量浓度的有关计算,(4)是易错点,明确发生的化学反应及硫酸根离子守恒是解答本题的关键,注意答题时不需要利用钡离子的物质的量代入计算。
答案第1页,共2页
答案第1页,共2页
