专题1第二单元物质的化学计量同步练习(含解析)2022-2023学年上学期高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 专题1第二单元物质的化学计量同步练习(含解析)2022-2023学年上学期高一化学苏教版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 168.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-27 11:06:09 | ||
图片预览




文档简介
专题1第二单元物质的化学计量同步练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.在0.5molNa2SO4中含有Na+的数目是
A.3.01×1023 B.6.02×1023 C.0.5 D.1
2.下列说法正确的是
A.同温同压下甲烷和氧气的密度之比为2∶1
B.1g甲烷和1g氧气的原子数之比为5∶1
C.等物质的量的甲烷和氧气的质量之比为2∶1
D.在标准状况下等质量的甲烷和氧气的体积之比为1∶2
3.现有34.5g由组成的混合物,将其完全溶解在的硫酸溶液中,收集到标准状况下3.36L气体。已知混合物中的质量分数分别为16.2%、46.4%、7.8%、29.6%,欲使溶液中的金属离子完全沉淀,应加入溶液的体积是
A.200 mL B.368 mL C.458 mL D.560 mL
4.已知Q与R的摩尔质量之比为9:22,在反应X+2Y=Q +R中,当1.6gX与一定量Y完全反应后,生成4.4gR,则参与反应的Y和生成物Q的质量之比为
A.46:9 B.32:9 C.23:9 D.16:9
5.屠呦呦因发现青蒿素治疗疟疾的新疗法而获得诺贝尔生理学或医学奖。青蒿素的分子式为C15H22O5,相对分子质量是282。下面关于青蒿素的说法正确的是(NA为阿伏加德罗常数的值)
A.C15H22O5的摩尔质量为282
B.1个C15H22O5分子的质量约为
C.1 mol C15H22O5完全燃烧生成22 mol H2O
D.含有NA个碳原子的C15H22O5的物质的量为1 mol
6.已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是
A.16g B.32g C.64g/mol D.32g/mol
7.3.75g胆矾晶体(CuSO4·5H2O)加热至100℃后,剩余粉末2.67g,该粉末的化学式是
A.CuSO4·3H2O B.CuSO4·H2O
C.CuSO4 D.CuO
8.下列说法中,不正确的是
A.“物质的量”表示含有一定数目粒子的集体,是七个基本物理量之一
B.“摩尔”是物质的量的单位
C.1 mol任何物质都约含6.02×1023个原子
D.一个水分子的质量约为g
9.在调节好平衡的托盘天平的两个托盘上,各放一个等质量的烧杯,再加入等质量、等质量分数的盐酸,然后二边各放a克锌和铝,反应结束后,烧杯中剩余的铝比剩余的锌多,则此时天平
A.仍平衡 B.放锌的一边重 C.放铝的一边重 D.无法判断
10.下列两种气体的分子数一定相等的是
A.质量相等、密度不等的N2和C2H4 B.等体积等密度的CO2和N2
C.等温度等体积的O2和N2 D.等压强等体积的N2和CO2
11.决定气体的体积的因素有
①气体分子数;②环境温度;③环境压强;④环境风力;⑤太阳光的照射。
A.①②③ B.②③④ C.③④⑤ D.①③⑤
12.从微观角度看,影响一定质量某气体体积大小的决定因素是
A.气体分子数 B.气体分子的体积
C.气体分子间的平均距离 D.气体分子的质量
13.下列叙述正确的是
A.同质量的H2和Cl2相比,H2的分子数多
B.Na2O2的摩尔质量为78g
C.0.1molH2SO4含有氢原子数的精确值为1.204×1023
D.1molKClO3含有阿伏加德罗常数个KClO3分子
14.下列有关气体所占体积的说法中正确的是
A.任何气体的体积都是
B.的质量是,它所占的体积是
C.在标准状况下,任何气体所占的体积都约为
D.在标准状况下,任何气体所占的体积都约为
15.用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.0.5mol/LMgCl2溶液中含有Cl-的数目为NA
C.标准状况下,2.24LCCl4中含有的原子数约为0.5×6.02×1023
D.常温常压下,14gN2含有的分子数为0.5NA
二、实验题
16.实验室需配制250 mL 0.1 mol·L-1的Na2CO3溶液,填空并回答下列问题:
(1)配制250 mL 0.1 mol·L-1的Na2CO3溶液。
实际应称Na2CO3质量/g 应选用容量瓶的规格/mL
______________ _________
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)________。
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.将准确称量的Na2CO3固体倒入烧杯中,再加适量水溶解
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1 cm~2 cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是________________,溶液注入容量瓶前需恢复到室温,这是因为__________________。
(4)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)
若容量瓶中有少量蒸馏水_____________________________;
若定容时俯视刻度线_______________________________。
(5)若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度________________________;
向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面____________________。
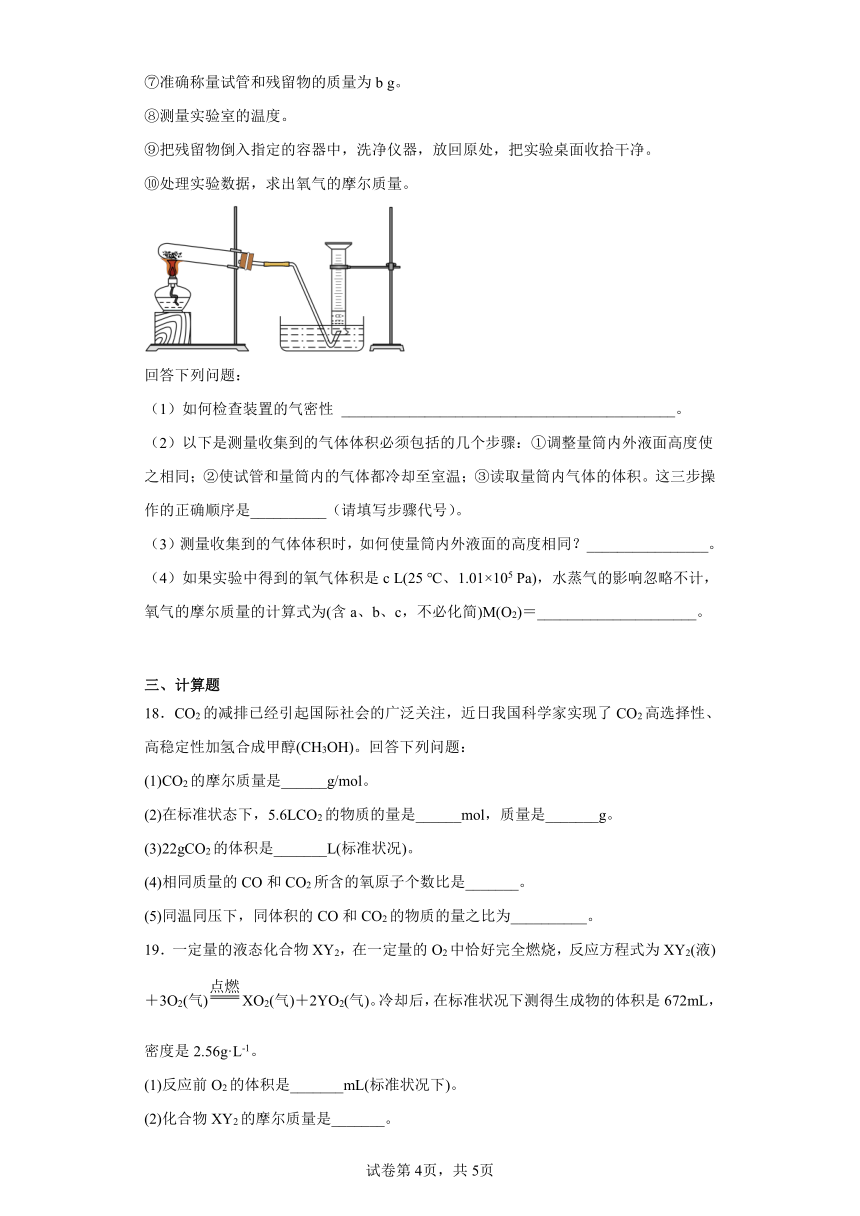
17.某同学利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量,实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为a g。
②装好实验装置。
③检查装置气密性。
④加热,开始反应,直到产生一定量的气体。
⑤停止加热(如图所示,导管出口高于液面)。
⑥测量收集到的气体的体积。
⑦准确称量试管和残留物的质量为b g。
⑧测量实验室的温度。
⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。
⑩处理实验数据,求出氧气的摩尔质量。
回答下列问题:
(1)如何检查装置的气密性 ____________________________________________。
(2)以下是测量收集到的气体体积必须包括的几个步骤:①调整量筒内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是__________(请填写步骤代号)。
(3)测量收集到的气体体积时,如何使量筒内外液面的高度相同?________________。
(4)如果实验中得到的氧气体积是c L(25 ℃、1.01×105 Pa),水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简)M(O2)=_____________________。
三、计算题
18.CO2的减排已经引起国际社会的广泛关注,近日我国科学家实现了CO2高选择性、高稳定性加氢合成甲醇(CH3OH)。回答下列问题:
(1)CO2的摩尔质量是______g/mol。
(2)在标准状态下,5.6LCO2的物质的量是______mol,质量是_______g。
(3)22gCO2的体积是_______L(标准状况)。
(4)相同质量的CO和CO2所含的氧原子个数比是_______。
(5)同温同压下,同体积的CO和CO2的物质的量之比为__________。
19.一定量的液态化合物XY2,在一定量的O2中恰好完全燃烧,反应方程式为XY2(液)+3O2(气)XO2(气)+2YO2(气)。冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g·L-1。
(1)反应前O2的体积是_______mL(标准状况下)。
(2)化合物XY2的摩尔质量是_______。
(3)若XY2分子中X、Y两元素质量比是3:16,则X、Y两元素分别为_______和_______(填元素符号)。
20.同温同压下,相同质量的一氧化碳和二氧化碳气体:
①它们的密度比是_______;②它们的体积比是_______;③它们所含氧元素的质量比是_______;④它们的原子个数比是_______。
若改为同温同压同体积下的一氧化碳和二氧化碳气体:
①它们的质量比是_______;②它们的密度比是_______;③它们的分子数比是_______;④它们的压强比是_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】0.5molNa2SO4中含有Na+的物质的量为1mol,则;
故答案为:B。
2.B
【详解】A.同温同压下,甲烷和氧气的密度之比等于二者的相对分子质量之比,则ρ(CH4):ρ(O2)=16:32=1:2,A错误;
B.1g的甲烷和氧气的物质的量的比为n(CH4):n(O2)=:=2:1。CH4中含有5个原子,O2中含有2个原子,则等质量的甲烷和氧气的原子数之比为:(2×5):(1×2)=5:1,B正确;
C.根据m=n·M可知:等物质的量的甲烷和氧气的质量之比等于二者的摩尔质量之比,则m(CH4):m(O2)=16:32=1:2,C错误;
D.根据V=n·Vm可知:同温同压下,等质量的甲烷和氧气的体积之比等于气体的物质的量的比,则n(CH4):n(O2)=:=2:1,故V(CH4):V(O2)=2:1,D错误;
故合理选项是B。
3.B
【详解】34.5g混合物完全溶解在溶液中生成硫酸盐,可能剩余,再向溶液中加入NaOH溶液,使溶液中的金属阳离子完全转化为氢氧化物沉淀并生成,由守恒可知溶液中存在关系:,即,则,即368mL,B正确。
故选:B。
4.C
【详解】假设Q和R的相对分子质量分别为9a、22a,设生成4.4gR时生成Q的质量是x,
根据=,解得:x=1.8g,由质量守恒可知参加反应的Y的质量为:4.4g+1.8g-1.6g=4.6g,所以参与反应的Y和生成物Q的质量之比为为4.6g∶1.8g=23∶9,
故选C。
5.B
【详解】A.C15H22O5的相对分子质量是282,则其摩尔质量为282 g/mol,A错误;
B.C15H22O5的摩尔质量为282 g/mol,1 mol C15H22O5中含有NA个分子,则1个C15H22O5分子的质量约为,B正确;
C.C15H22O5分子中含有22个H原子,则根据H元素守恒,可知1 mol C15H22O5完全燃烧生成11mol H2O,C错误;
D.1个C15H22O5分子中含有15个C原子,则含有NA个碳原子,含有C原子的物质的量是1 mol的C15H22O5的物质的量为mol,D错误;
故合理选项是B。
6.D
【详解】1.505×1023个X气体分子的物质的量为=0.25mol,由1.505×1023个X气体分子的质量为8g可知,X气体的摩尔质量为=32g/mol,故选D。
7.B
【详解】晶体中含水为3.75g×=1.35g,若完全失去结晶水,固体质量为3.75g-1.35g=2.4g,加热至100°C以上,剩下粉末为2.67g,失去水的质量为3.75g-2.67g=1.08g,所以晶体中还有水为1.35g-1.08g=0.27g,则n(CuSO4):n(H2O)=:=1:1,故失去结晶水后的粉末物质的化学式为CuSO4 H2O;
故选B。
8.C
【详解】A.在国际单位制中规定了七个基本物理量的单位,“物质的量”是七个基本物理量之一,它表示的意义是含有一定数目粒子的集体,A正确;
B.“物质的量”是一个基本物理量,“摩尔”是物质的量的单位,B正确;
C.物质构成的基本微粒有原子、分子、离子,物质的基本构成微粒若是原子,则1 mol任何物质都约含6.02×1023个原子,若原子不是构成物质的基本微粒,则1 mol该物质中含有的原子数目就不可能约是含6.02×1023个原子,C错误;
D.1 mol H2O中含有约6.02×1023个H2O分子,1 mol H2O的质量是18 g,则一个水分子的质量约为g,D正确;
故合理选项是C。
9.A
【详解】通过分析可知,等质量、等质量百分比浓度的盐酸中含有等质量的氢元素,反应结束后,烧杯中剩余的铝比剩余的锌多,说明金属有剩余,酸全部参加了反应,生成的氢气质量相等,所以天平仍然平衡,故选A。
10.A
【分析】气体分子数相等,即气体的物质的量相等。
【详解】A.氮气和C2H4的摩尔质量相同,当两者质量相同时,其物质的量相同,所以分子数相等,故A选;
B.体积和密度相等,即质量相等,而CO2和N2的摩尔质量不相等,所以两者的物质的量不相等,所以分子数不相等,故B不选;
C.等温度等体积,若压强也相等,则两者的分子数才相等,故C不选;
D.等压强等体积,若温度也相等,则两者的分子数才相等,故D不选;
故选A。
11.A
【详解】影响气体的体积的因素有:温度,压强,分子大小,数目以及分子之间的距离,同温同压下,气体的分子之间距离相等,分子大小与分子之间的距离相比较可忽略,决定气体体积的主要因素是气体的分子数,当温度压强改变,气体体积随之发生改变,其他条件不变时,升高温度,气体体积增大,其他条件不变时,增大压强,气体体积减小,所以①气体分子数、②环境温度、③环境压强是决定气体体积的因素,而④环境风力、⑤太阳光的照射不是决定气体体积的因素;
故选A。
12.C
【详解】气体粒子间距离较大,远大于粒子的直径,所以粒子大小可以忽略不计,决定气体体积的因素主要为构成物质的粒子数和粒子间的距离。一定质量的气体,气体的分子数目一定,故一定温度下,影响一定质量气体体积大小的决定因素是气体分子间的平均距离;
故选C。
13.A
【详解】A.依据n=可知,质量相同的氢气与氯气分子数与摩尔质量成反比,氢气摩尔质量小于氯气,所以H2的分子数多,故A正确;
B.Na2O2的摩尔质量为78g/mol,故B错误;
C.0.1molH2SO4含有0.2mol氢原子,阿伏加德罗常数约为6.02×1023,则氢原子数目的近似值为1.204×1023,故C错误;
D.KClO3为离子晶体,不含分子,故D错误;
故选:A。
14.D
【详解】A.没有指明标准状况,A项错误;
B.的质量是,标准状况下的体积是,B项错误;
C.标准状况下,任何气体所占的体积都约为,注意体积单位是“L”,而不是“”,C项错误,
D.根据C的分析可知,D项正确;
故选D。
15.D
【详解】A.含有个氦原子的氦气的物质的量是,在标准状况下的体积约为,A错误;
B.溶液的体积不确定,含有的数目不一定为,B错误;
C.CCl4标准状况下是液体,其物质的量不是,其中含有的原子数不是,C错误;
D.常温常压下,的物质的量是,含有的分子数为,D正确;
故答案选D。
16. 2.7 250 B、C、A、F、E、D 保证溶质全部转入容量瓶 容量瓶盛放热溶液时,体积不准 无影响 偏高 洗净容量瓶后重新配制 洗净容量瓶后重新配制
【详解】(1)称量Na2CO3的质量为250×10-3×0.1×106g=2.65g,因为托盘天平的读数精确到0.1g,因此需要称量的Na2CO3的质量为2.7g,实验室容量瓶的规格为100mL、250mL、500mL、1000mL,因此选用250mL容量瓶;
(2)配制一定物质的量浓度溶液的步骤是计算→称量→溶解→冷却→转移→洗涤→振荡→定容→摇匀,因此步骤是 B、C、A、F、E、D;
(3)洗涤液移入容量瓶中,保证溶质全部转入容量瓶中;溶液注入容量瓶前需要恢复到室温状态,因为热胀冷缩,溶液盛放热溶液时,体积不准;
(4)容量瓶中有少量的蒸馏水,对所配溶液浓度无影响;定容时俯视刻度线,容量瓶中溶液的体积减小,即所配溶液浓度偏高;
(5)加蒸馏水时不慎超过了刻度,需要洗净容量瓶重新配制;转移溶液时不慎有液滴掉在容量瓶的外面,需要重新配置溶液。
17. 将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气 ②①③ 慢慢将量筒下移
【分析】(1)检查气密性的方法:将导管的出口放入水中,用手紧握试管,观察水中的导管口是否有气泡冒出;
(2)要准确测量气体体积必须保持量筒内外气体的温度和压强相等,因此在读取量筒内气体的体积之前,应使试管和量筒内的气体都冷却至室温;再调节量筒内外液面高度使之相同;
(3)观察装置图可知,量筒内液面高于水槽液面,只要将量筒慢慢下移即可.从气体的热胀冷缩和读量筒中气体体积的方法两方面进行分析;
(4)利用恒压下的气体公式求得气体的物质的量和摩尔质量。
【详解】(1)检验装置的气密性时,将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气;
(2)因为排出的气体是需要用排出的水的体积衡量的,而反应前后的量筒温度是不同的,因此,反应终止应该先停止加热,待体系恢复到室温时,才取出导管,这一步操作跟通常的实验不同,所以停止加热时导管的出口要高于量筒内的液面,此时即使不取出导管而停止加热,也不会造成水的倒吸;停止加热、回到室温后,将量筒下移以调节量筒内的液面与水槽一致,此时量筒内气体压强也为大气压,读数才是正确的;所以正确的操作顺序为:②使气体都冷却至室温;①调整量筒内外液面高度使之相同;③读取量筒内气体的体积;即②①③;
(3)试管和量筒内的气体都冷却后,量筒内的液面一定高于量筒外的液面,慢慢将量筒下移,量筒上方气体体积减小,压强增大,当量筒内气体压强等于外界大气压时,量筒内液面和水槽内液面相平;
(4)由实验可知生成氧气的质量=ag-bg,25℃、1.01×l05 Pa时Vm=;n(O2)=;M(O2)==。
18. 44 0.25 11 11.2 11:14 1:1
【详解】(1)单位为g/mol时,摩尔质量的数值=相对分子质量,即CO2的摩尔质量是44g/mol,故答案为:44;
(2)在标准状态下,5.6LCO2的物质的量==0.25mol,质量=0.25mol×44g/mol=11g,故答案为:0.25;11;
(3)22gCO2的物质的量==0.5mol,在标准状况下的体积=0.5mol×22.4L/mol=11.2L,故答案为:11.2;
(4)相同质量的CO和CO2的物质的量之比==11:7,氧原子个数比=(11×1):(7×2)=11:14,故答案为:11:14;
(5)同温同压下,两种气体的体积比=物质的量之比,则同温同压下,同体积的CO和CO2的物质的量之比=1:1,故答案为:1:1。
19.(1)672
(2)76
(3) C S
【解析】(1)
由方程式可知,反应前后气体体积不变,则V(O2)=V(XO2)+V(YO2)=672mL;
(2)
依据质量守恒定律,有m(XY2)=0.672L2.56g·L-1-32g/mol≈0.76g,物质的量n(XY2)为n(O2)=0.01mol,所以M(XY2)==76g/mol;
(3)
由及可得,,,则X、Y两元素分别为C、S。
20. 7:11 11:7 11:14 22:21 7:11 7:11 1:1 1:1
【分析】相同质量的一氧化碳和二氧化碳气体,物质的量比为,根据阿伏伽德罗定律,同温同压同体积的一氧化碳和二氧化碳气体的物质的量相等。
【详解】同温同压下,相同质量的一氧化碳和二氧化碳气体,物质的量比为:
①同温同压下,气体密度比等于摩尔质量之比,它们的密度比是28:44=7:11;
②同温同压下,气体体积比等于物质的量比,所以它们的体积比是11:7;
③一氧化碳和二氧化碳气体的物质的量比为11:7,它们所含氧元素的质量比是11:14;
④一氧化碳和二氧化碳气体的物质的量比为11:7,它们的原子个数比是22:21;
同温同压同体积下的一氧化碳和二氧化碳气体物质的量相等:
①它们的物质的量相等,则质量比是28:44=7:11;
②同温同压下,气体密度比等于摩尔质量之比,它们的密度比是28:44=7:11;
③它们的物质的量相等,则它们的分子数比是1:1;
④同温同压,所以它们的压强比是1:1。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.在0.5molNa2SO4中含有Na+的数目是
A.3.01×1023 B.6.02×1023 C.0.5 D.1
2.下列说法正确的是
A.同温同压下甲烷和氧气的密度之比为2∶1
B.1g甲烷和1g氧气的原子数之比为5∶1
C.等物质的量的甲烷和氧气的质量之比为2∶1
D.在标准状况下等质量的甲烷和氧气的体积之比为1∶2
3.现有34.5g由组成的混合物,将其完全溶解在的硫酸溶液中,收集到标准状况下3.36L气体。已知混合物中的质量分数分别为16.2%、46.4%、7.8%、29.6%,欲使溶液中的金属离子完全沉淀,应加入溶液的体积是
A.200 mL B.368 mL C.458 mL D.560 mL
4.已知Q与R的摩尔质量之比为9:22,在反应X+2Y=Q +R中,当1.6gX与一定量Y完全反应后,生成4.4gR,则参与反应的Y和生成物Q的质量之比为
A.46:9 B.32:9 C.23:9 D.16:9
5.屠呦呦因发现青蒿素治疗疟疾的新疗法而获得诺贝尔生理学或医学奖。青蒿素的分子式为C15H22O5,相对分子质量是282。下面关于青蒿素的说法正确的是(NA为阿伏加德罗常数的值)
A.C15H22O5的摩尔质量为282
B.1个C15H22O5分子的质量约为
C.1 mol C15H22O5完全燃烧生成22 mol H2O
D.含有NA个碳原子的C15H22O5的物质的量为1 mol
6.已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是
A.16g B.32g C.64g/mol D.32g/mol
7.3.75g胆矾晶体(CuSO4·5H2O)加热至100℃后,剩余粉末2.67g,该粉末的化学式是
A.CuSO4·3H2O B.CuSO4·H2O
C.CuSO4 D.CuO
8.下列说法中,不正确的是
A.“物质的量”表示含有一定数目粒子的集体,是七个基本物理量之一
B.“摩尔”是物质的量的单位
C.1 mol任何物质都约含6.02×1023个原子
D.一个水分子的质量约为g
9.在调节好平衡的托盘天平的两个托盘上,各放一个等质量的烧杯,再加入等质量、等质量分数的盐酸,然后二边各放a克锌和铝,反应结束后,烧杯中剩余的铝比剩余的锌多,则此时天平
A.仍平衡 B.放锌的一边重 C.放铝的一边重 D.无法判断
10.下列两种气体的分子数一定相等的是
A.质量相等、密度不等的N2和C2H4 B.等体积等密度的CO2和N2
C.等温度等体积的O2和N2 D.等压强等体积的N2和CO2
11.决定气体的体积的因素有
①气体分子数;②环境温度;③环境压强;④环境风力;⑤太阳光的照射。
A.①②③ B.②③④ C.③④⑤ D.①③⑤
12.从微观角度看,影响一定质量某气体体积大小的决定因素是
A.气体分子数 B.气体分子的体积
C.气体分子间的平均距离 D.气体分子的质量
13.下列叙述正确的是
A.同质量的H2和Cl2相比,H2的分子数多
B.Na2O2的摩尔质量为78g
C.0.1molH2SO4含有氢原子数的精确值为1.204×1023
D.1molKClO3含有阿伏加德罗常数个KClO3分子
14.下列有关气体所占体积的说法中正确的是
A.任何气体的体积都是
B.的质量是,它所占的体积是
C.在标准状况下,任何气体所占的体积都约为
D.在标准状况下,任何气体所占的体积都约为
15.用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.0.5mol/LMgCl2溶液中含有Cl-的数目为NA
C.标准状况下,2.24LCCl4中含有的原子数约为0.5×6.02×1023
D.常温常压下,14gN2含有的分子数为0.5NA
二、实验题
16.实验室需配制250 mL 0.1 mol·L-1的Na2CO3溶液,填空并回答下列问题:
(1)配制250 mL 0.1 mol·L-1的Na2CO3溶液。
实际应称Na2CO3质量/g 应选用容量瓶的规格/mL
______________ _________
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)________。
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.将准确称量的Na2CO3固体倒入烧杯中,再加适量水溶解
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1 cm~2 cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是________________,溶液注入容量瓶前需恢复到室温,这是因为__________________。
(4)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)
若容量瓶中有少量蒸馏水_____________________________;
若定容时俯视刻度线_______________________________。
(5)若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度________________________;
向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面____________________。
17.某同学利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量,实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为a g。
②装好实验装置。
③检查装置气密性。
④加热,开始反应,直到产生一定量的气体。
⑤停止加热(如图所示,导管出口高于液面)。
⑥测量收集到的气体的体积。
⑦准确称量试管和残留物的质量为b g。
⑧测量实验室的温度。
⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。
⑩处理实验数据,求出氧气的摩尔质量。
回答下列问题:
(1)如何检查装置的气密性 ____________________________________________。
(2)以下是测量收集到的气体体积必须包括的几个步骤:①调整量筒内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是__________(请填写步骤代号)。
(3)测量收集到的气体体积时,如何使量筒内外液面的高度相同?________________。
(4)如果实验中得到的氧气体积是c L(25 ℃、1.01×105 Pa),水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简)M(O2)=_____________________。
三、计算题
18.CO2的减排已经引起国际社会的广泛关注,近日我国科学家实现了CO2高选择性、高稳定性加氢合成甲醇(CH3OH)。回答下列问题:
(1)CO2的摩尔质量是______g/mol。
(2)在标准状态下,5.6LCO2的物质的量是______mol,质量是_______g。
(3)22gCO2的体积是_______L(标准状况)。
(4)相同质量的CO和CO2所含的氧原子个数比是_______。
(5)同温同压下,同体积的CO和CO2的物质的量之比为__________。
19.一定量的液态化合物XY2,在一定量的O2中恰好完全燃烧,反应方程式为XY2(液)+3O2(气)XO2(气)+2YO2(气)。冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g·L-1。
(1)反应前O2的体积是_______mL(标准状况下)。
(2)化合物XY2的摩尔质量是_______。
(3)若XY2分子中X、Y两元素质量比是3:16,则X、Y两元素分别为_______和_______(填元素符号)。
20.同温同压下,相同质量的一氧化碳和二氧化碳气体:
①它们的密度比是_______;②它们的体积比是_______;③它们所含氧元素的质量比是_______;④它们的原子个数比是_______。
若改为同温同压同体积下的一氧化碳和二氧化碳气体:
①它们的质量比是_______;②它们的密度比是_______;③它们的分子数比是_______;④它们的压强比是_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】0.5molNa2SO4中含有Na+的物质的量为1mol,则;
故答案为:B。
2.B
【详解】A.同温同压下,甲烷和氧气的密度之比等于二者的相对分子质量之比,则ρ(CH4):ρ(O2)=16:32=1:2,A错误;
B.1g的甲烷和氧气的物质的量的比为n(CH4):n(O2)=:=2:1。CH4中含有5个原子,O2中含有2个原子,则等质量的甲烷和氧气的原子数之比为:(2×5):(1×2)=5:1,B正确;
C.根据m=n·M可知:等物质的量的甲烷和氧气的质量之比等于二者的摩尔质量之比,则m(CH4):m(O2)=16:32=1:2,C错误;
D.根据V=n·Vm可知:同温同压下,等质量的甲烷和氧气的体积之比等于气体的物质的量的比,则n(CH4):n(O2)=:=2:1,故V(CH4):V(O2)=2:1,D错误;
故合理选项是B。
3.B
【详解】34.5g混合物完全溶解在溶液中生成硫酸盐,可能剩余,再向溶液中加入NaOH溶液,使溶液中的金属阳离子完全转化为氢氧化物沉淀并生成,由守恒可知溶液中存在关系:,即,则,即368mL,B正确。
故选:B。
4.C
【详解】假设Q和R的相对分子质量分别为9a、22a,设生成4.4gR时生成Q的质量是x,
根据=,解得:x=1.8g,由质量守恒可知参加反应的Y的质量为:4.4g+1.8g-1.6g=4.6g,所以参与反应的Y和生成物Q的质量之比为为4.6g∶1.8g=23∶9,
故选C。
5.B
【详解】A.C15H22O5的相对分子质量是282,则其摩尔质量为282 g/mol,A错误;
B.C15H22O5的摩尔质量为282 g/mol,1 mol C15H22O5中含有NA个分子,则1个C15H22O5分子的质量约为,B正确;
C.C15H22O5分子中含有22个H原子,则根据H元素守恒,可知1 mol C15H22O5完全燃烧生成11mol H2O,C错误;
D.1个C15H22O5分子中含有15个C原子,则含有NA个碳原子,含有C原子的物质的量是1 mol的C15H22O5的物质的量为mol,D错误;
故合理选项是B。
6.D
【详解】1.505×1023个X气体分子的物质的量为=0.25mol,由1.505×1023个X气体分子的质量为8g可知,X气体的摩尔质量为=32g/mol,故选D。
7.B
【详解】晶体中含水为3.75g×=1.35g,若完全失去结晶水,固体质量为3.75g-1.35g=2.4g,加热至100°C以上,剩下粉末为2.67g,失去水的质量为3.75g-2.67g=1.08g,所以晶体中还有水为1.35g-1.08g=0.27g,则n(CuSO4):n(H2O)=:=1:1,故失去结晶水后的粉末物质的化学式为CuSO4 H2O;
故选B。
8.C
【详解】A.在国际单位制中规定了七个基本物理量的单位,“物质的量”是七个基本物理量之一,它表示的意义是含有一定数目粒子的集体,A正确;
B.“物质的量”是一个基本物理量,“摩尔”是物质的量的单位,B正确;
C.物质构成的基本微粒有原子、分子、离子,物质的基本构成微粒若是原子,则1 mol任何物质都约含6.02×1023个原子,若原子不是构成物质的基本微粒,则1 mol该物质中含有的原子数目就不可能约是含6.02×1023个原子,C错误;
D.1 mol H2O中含有约6.02×1023个H2O分子,1 mol H2O的质量是18 g,则一个水分子的质量约为g,D正确;
故合理选项是C。
9.A
【详解】通过分析可知,等质量、等质量百分比浓度的盐酸中含有等质量的氢元素,反应结束后,烧杯中剩余的铝比剩余的锌多,说明金属有剩余,酸全部参加了反应,生成的氢气质量相等,所以天平仍然平衡,故选A。
10.A
【分析】气体分子数相等,即气体的物质的量相等。
【详解】A.氮气和C2H4的摩尔质量相同,当两者质量相同时,其物质的量相同,所以分子数相等,故A选;
B.体积和密度相等,即质量相等,而CO2和N2的摩尔质量不相等,所以两者的物质的量不相等,所以分子数不相等,故B不选;
C.等温度等体积,若压强也相等,则两者的分子数才相等,故C不选;
D.等压强等体积,若温度也相等,则两者的分子数才相等,故D不选;
故选A。
11.A
【详解】影响气体的体积的因素有:温度,压强,分子大小,数目以及分子之间的距离,同温同压下,气体的分子之间距离相等,分子大小与分子之间的距离相比较可忽略,决定气体体积的主要因素是气体的分子数,当温度压强改变,气体体积随之发生改变,其他条件不变时,升高温度,气体体积增大,其他条件不变时,增大压强,气体体积减小,所以①气体分子数、②环境温度、③环境压强是决定气体体积的因素,而④环境风力、⑤太阳光的照射不是决定气体体积的因素;
故选A。
12.C
【详解】气体粒子间距离较大,远大于粒子的直径,所以粒子大小可以忽略不计,决定气体体积的因素主要为构成物质的粒子数和粒子间的距离。一定质量的气体,气体的分子数目一定,故一定温度下,影响一定质量气体体积大小的决定因素是气体分子间的平均距离;
故选C。
13.A
【详解】A.依据n=可知,质量相同的氢气与氯气分子数与摩尔质量成反比,氢气摩尔质量小于氯气,所以H2的分子数多,故A正确;
B.Na2O2的摩尔质量为78g/mol,故B错误;
C.0.1molH2SO4含有0.2mol氢原子,阿伏加德罗常数约为6.02×1023,则氢原子数目的近似值为1.204×1023,故C错误;
D.KClO3为离子晶体,不含分子,故D错误;
故选:A。
14.D
【详解】A.没有指明标准状况,A项错误;
B.的质量是,标准状况下的体积是,B项错误;
C.标准状况下,任何气体所占的体积都约为,注意体积单位是“L”,而不是“”,C项错误,
D.根据C的分析可知,D项正确;
故选D。
15.D
【详解】A.含有个氦原子的氦气的物质的量是,在标准状况下的体积约为,A错误;
B.溶液的体积不确定,含有的数目不一定为,B错误;
C.CCl4标准状况下是液体,其物质的量不是,其中含有的原子数不是,C错误;
D.常温常压下,的物质的量是,含有的分子数为,D正确;
故答案选D。
16. 2.7 250 B、C、A、F、E、D 保证溶质全部转入容量瓶 容量瓶盛放热溶液时,体积不准 无影响 偏高 洗净容量瓶后重新配制 洗净容量瓶后重新配制
【详解】(1)称量Na2CO3的质量为250×10-3×0.1×106g=2.65g,因为托盘天平的读数精确到0.1g,因此需要称量的Na2CO3的质量为2.7g,实验室容量瓶的规格为100mL、250mL、500mL、1000mL,因此选用250mL容量瓶;
(2)配制一定物质的量浓度溶液的步骤是计算→称量→溶解→冷却→转移→洗涤→振荡→定容→摇匀,因此步骤是 B、C、A、F、E、D;
(3)洗涤液移入容量瓶中,保证溶质全部转入容量瓶中;溶液注入容量瓶前需要恢复到室温状态,因为热胀冷缩,溶液盛放热溶液时,体积不准;
(4)容量瓶中有少量的蒸馏水,对所配溶液浓度无影响;定容时俯视刻度线,容量瓶中溶液的体积减小,即所配溶液浓度偏高;
(5)加蒸馏水时不慎超过了刻度,需要洗净容量瓶重新配制;转移溶液时不慎有液滴掉在容量瓶的外面,需要重新配置溶液。
17. 将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气 ②①③ 慢慢将量筒下移
【分析】(1)检查气密性的方法:将导管的出口放入水中,用手紧握试管,观察水中的导管口是否有气泡冒出;
(2)要准确测量气体体积必须保持量筒内外气体的温度和压强相等,因此在读取量筒内气体的体积之前,应使试管和量筒内的气体都冷却至室温;再调节量筒内外液面高度使之相同;
(3)观察装置图可知,量筒内液面高于水槽液面,只要将量筒慢慢下移即可.从气体的热胀冷缩和读量筒中气体体积的方法两方面进行分析;
(4)利用恒压下的气体公式求得气体的物质的量和摩尔质量。
【详解】(1)检验装置的气密性时,将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气;
(2)因为排出的气体是需要用排出的水的体积衡量的,而反应前后的量筒温度是不同的,因此,反应终止应该先停止加热,待体系恢复到室温时,才取出导管,这一步操作跟通常的实验不同,所以停止加热时导管的出口要高于量筒内的液面,此时即使不取出导管而停止加热,也不会造成水的倒吸;停止加热、回到室温后,将量筒下移以调节量筒内的液面与水槽一致,此时量筒内气体压强也为大气压,读数才是正确的;所以正确的操作顺序为:②使气体都冷却至室温;①调整量筒内外液面高度使之相同;③读取量筒内气体的体积;即②①③;
(3)试管和量筒内的气体都冷却后,量筒内的液面一定高于量筒外的液面,慢慢将量筒下移,量筒上方气体体积减小,压强增大,当量筒内气体压强等于外界大气压时,量筒内液面和水槽内液面相平;
(4)由实验可知生成氧气的质量=ag-bg,25℃、1.01×l05 Pa时Vm=;n(O2)=;M(O2)==。
18. 44 0.25 11 11.2 11:14 1:1
【详解】(1)单位为g/mol时,摩尔质量的数值=相对分子质量,即CO2的摩尔质量是44g/mol,故答案为:44;
(2)在标准状态下,5.6LCO2的物质的量==0.25mol,质量=0.25mol×44g/mol=11g,故答案为:0.25;11;
(3)22gCO2的物质的量==0.5mol,在标准状况下的体积=0.5mol×22.4L/mol=11.2L,故答案为:11.2;
(4)相同质量的CO和CO2的物质的量之比==11:7,氧原子个数比=(11×1):(7×2)=11:14,故答案为:11:14;
(5)同温同压下,两种气体的体积比=物质的量之比,则同温同压下,同体积的CO和CO2的物质的量之比=1:1,故答案为:1:1。
19.(1)672
(2)76
(3) C S
【解析】(1)
由方程式可知,反应前后气体体积不变,则V(O2)=V(XO2)+V(YO2)=672mL;
(2)
依据质量守恒定律,有m(XY2)=0.672L2.56g·L-1-32g/mol≈0.76g,物质的量n(XY2)为n(O2)=0.01mol,所以M(XY2)==76g/mol;
(3)
由及可得,,,则X、Y两元素分别为C、S。
20. 7:11 11:7 11:14 22:21 7:11 7:11 1:1 1:1
【分析】相同质量的一氧化碳和二氧化碳气体,物质的量比为,根据阿伏伽德罗定律,同温同压同体积的一氧化碳和二氧化碳气体的物质的量相等。
【详解】同温同压下,相同质量的一氧化碳和二氧化碳气体,物质的量比为:
①同温同压下,气体密度比等于摩尔质量之比,它们的密度比是28:44=7:11;
②同温同压下,气体体积比等于物质的量比,所以它们的体积比是11:7;
③一氧化碳和二氧化碳气体的物质的量比为11:7,它们所含氧元素的质量比是11:14;
④一氧化碳和二氧化碳气体的物质的量比为11:7,它们的原子个数比是22:21;
同温同压同体积下的一氧化碳和二氧化碳气体物质的量相等:
①它们的物质的量相等,则质量比是28:44=7:11;
②同温同压下,气体密度比等于摩尔质量之比,它们的密度比是28:44=7:11;
③它们的物质的量相等,则它们的分子数比是1:1;
④同温同压,所以它们的压强比是1:1。
答案第1页,共2页
答案第1页,共2页
