专题3从海水中获得的化学物质综合练习 (含解析)2022-2023学年上学期高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 专题3从海水中获得的化学物质综合练习 (含解析)2022-2023学年上学期高一化学苏教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 658.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-27 11:13:39 | ||
图片预览



文档简介
专题3从海水中获得的化学物质综合练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.化学与生产:生活及环境密切相关。下列说法正确的是
A.太阳能电池的主要材料是 B.新冠疫苗应冷藏存放,以避免活性降低
C.84消毒液可与洁厕灵(盐酸)混合使用 D.具有强氧化性,可用于漂白纸浆
2.氧化还原反应与四种基本反应类型的关系如下图所示,则下列化学反应属于阴影部分的是
A.
B.
C.
D.(提示:中氧元素的化合价为-1价)
3.已知、、和均有还原性,它们在酸性溶液中还原性的强弱顺序为。则下列反应不能发生的是
A.
B.
C.
D.
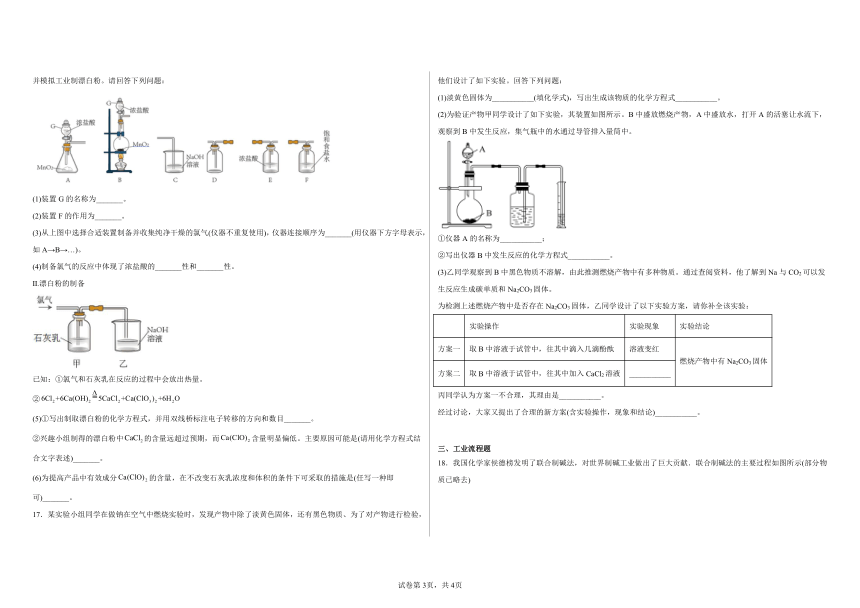
4.实验室用如图装置制取、提纯、收集Cl2、尾气处理,不能达到实验目的的是
A.用装置甲制取Cl2
B.用装置丙收集Cl2
C.用装置丁吸收尾气中的Cl2
D.用装置乙除去Cl2中的少量HCl
5.在新制氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一致且正确的是
A.新制氯水呈浅黄绿色,且有刺激性气味,说明溶液中有分子存在
B.用强光照射新制氯水一段时间后,溶液增大,说明溶液中有存在
C.将加入新制氯水中,有无色气泡产生,说明溶液中有存在
D.溶液中滴加新制氯水,溶液变成棕黄色,说明新制氯水中有存在
6.下列各组离子在给定条件下一定能大量共存的是
A.遇石蕊变蓝的溶液:、、、
B.常温下pH小于7的溶液:、、、
C.无色透明的溶液:、、、
D.含氯化铁的溶液:、、、
7.等质量的两块钠,第一块在足量氧气中加热,第二块在足量空气(常温)中充分反应,则 下列说法正确的是
A.第一块钠失去电子多 B.两块钠失去电子一样多
C.第二块钠的反应产物质量大 D.两块钠的反应产物质量一样大
8.金属钠在空气中燃烧时,产生的现象和生成物是
A.产生白烟,生成Na2O B.产生黄色火焰,生成Na2O
C.产生黄色火焰,生成Na2O2 D.产生白光,生成Na2O2
9.下列离子方程式书写正确的是
A.石灰乳与溶液混合:
B.将稀硝酸滴在大理石上:
C.与稀硫酸反应的离子方程式:
D.溶液与少量溶液反应:
10.有一包白色固体粉末,其中可能含有、、、中的一种或几种,现做以下实验(所加试剂均足量):
则下列说法正确的是
A.原粉末中一定有
B.是否存在无法确定,需进一步实验确定
C.白色沉淀乙可能是和的混合物
D.原粉末中一定没有,可能有
11.金属材料在日常生活以及生产中有着广泛的应用。下列关于金属的一些说法不正确的是
A.合金的性质与其组成金属的性质不完全相同
B.灼烧孔雀石[Cu2(OH)2CO3]和焦炭混合物制铜也属于还原法
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.工业上金属Mg、Cu都是用热还原法制得的
12.已知性质与卤素相似,下列关于的性质推测不合理的是
A.属于化合物 B.难溶于水
C.具有强还原性 D.
13.新型镁铝合金()有储氢性能,下列说法正确的是
A.1mol与足量盐酸完全反应放出的总物质的量为34mol
B.等质量的镁、铝和镁铝合金分别与足量的盐酸反应生成的体积(同温同压)由大到小的顺序为V(Al)>V(合金)>V(Mg)
C.该合金中存在
D.该合金应在氮气保护下,将一定比例的Mg、Al单质熔炼而成
14.下列关于卤素单质性质的说法错误的是
A.溴在常温下为液体,易挥发
B.碘在常温下为紫黑色固体,易挥发
C.溴可溶于水,更易溶于四氯化碳等有机溶剂中
D.碘蒸汽为紫色,碘水为棕黄色,碘的四氯化碳溶液呈紫红色
15.已知常温下,浓盐酸与高锰酸钾反应可以生成氯气。如图甲、乙、丙三处分别是沾有NaBr溶液的棉花、润湿的淀粉-KI试纸、润湿的品红试纸,下列说法正确的是
A.该实验通过现象可以证明氧化性:
B.沾有品红溶液的试纸会褪色,若再对丙微热则恢复红色
C.甲的现象也可以证明的还原性强于
D.与NaBr溶液反应的实质与与NaBr溶液反应类似
二、实验题
16.氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,某兴趣小组利用所给仪器在实验室制备纯净干燥的氯气,并模拟工业制漂白粉。请回答下列问题:
(1)装置G的名称为_______。
(2)装置F的作用为_______。
(3)从上图中选择合适装置制备并收集纯净干燥的氯气(仪器不重复使用),仪器连接顺序为_______(用仪器下方字母表示,如A→B→…)。
(4)制备氯气的反应中体现了浓盐酸的_______性和_______性。
Ⅱ.漂白粉的制备
已知:①氯气和石灰乳在反应的过程中会放出热量。
②
(5)①写出制取漂白粉的化学方程式,并用双线桥标注电子转移的方向和数目_______。
②兴趣小组制得的漂白粉中的含量远超过预期,而含量明显偏低。主要原因可能是(请用化学方程式结合文字表述)_______。
(6)为提高产品中有效成分的含量,在不改变石灰乳浓度和体积的条件下可采取的措施是(任写一种即可)_______。
17.某实验小组同学在做钠在空气中燃烧实验时,发现产物中除了淡黄色固体,还有黑色物质、为了对产物进行检验,他们设计了如下实验。回答下列问题:
(1)淡黄色固体为___________(填化学式),写出生成该物质的化学方程式___________。
(2)为验证产物甲同学设计了如下实验,其装置如图所示。B中盛放燃烧产物,A中盛放水,打开A的活塞让水流下,观察到B中发生反应,集气瓶中的水通过导管排入量筒中。
①仪器A的名称为___________;
②写出仪器B中发生反应的化学方程式___________。
(3)乙同学观察到B中黑色物质不溶解,由此推测燃烧产物中有多种物质。通过查阅资料,他了解到Na与CO2可以发生反应生成碳单质和Na2CO3固体。
为检测上述燃烧产物中是否存在Na2CO3固体,乙同学设计了以下实验方案,请你补全该实验:
实验操作 实验现象 实验结论
方案一 取B中溶液于试管中,往其中滴入几滴酚酞 溶液变红 燃烧产物中有Na2CO3固体
方案二 取B中溶液于试管中,往其中加入CaCl2溶液 ___________
丙同学认为方案一不合理,其理由是___________。
经过讨论,大家又提出了合理的新方案(含实验操作,现象和结论)___________。
三、工业流程题
18.我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献.联合制碱法的主要过程如图所示(部分物质已略去)
(1)①~③所涉及的操作方法中,包含过滤的是________(填序号)
(2)根据上图,写出①中发生反应的化学方程式:________
(3)煅烧固体的化学方程式是_____________
(4)下列说法中,正确的是________(填字母)
a.可循环使用
b.副产物可用作肥料
c.溶液B中一定含有、、
19.从海水中可提取多种化工原料,下图是工业上对海水资源进行综合利用的流程图。试回答下列问题:
(1)若粗盐中含有杂质离子Ca2+、Mg2+、SO42-,精制时所用试剂为A.盐酸、B.BaCl2溶液、C.NaOH溶液、D.Na2CO3溶液。则加入试剂的顺序是________(填序号)。
(2)写出用海滩上的贝壳制Ca(OH)2的化学方程式:________________。
(3)电解熔融MgCl2可制取镁和Cl2,其中Cl2和Ca(OH)2反应可制得漂白粉。制漂白粉的化学方程式为________________。
(4)从经济效益角度考虑,该化工厂厂址应选在________________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.太阳能电池的主要材料是,A错误;
B.新冠疫苗应冷藏存放,以避免活性降低,B正确;
C.84消毒液不可与洁厕灵(盐酸)混合使用,因为二者混合会生成有毒的Cl2,C错误;
D.具有漂白性性,可用于漂白纸浆,不是用到强氧化性,D错误。
因此,本题选B。
2.D
【分析】阴影部分的区域属于氧化还原反应,但不属于四大反应类型。
【详解】A.Cl2+2KBr=Br2+2KCl属于置换反应、氧化还原反应,故A不符合题意;
B.属于分解反应、非氧化还原反应,故B不符合题意;
C.属于化合反应、氧化还原反应,故C不符合题意;
D.属于氧化还原反应,但是不属于四大反应类型,属于阴影部分,故D符合题意;
故选D。
3.B
【详解】A.因该反应中S元素的化合价升高,Fe 元素的化合价降低,则SO2为还原剂,还原剂的还原性强于还原产物,SO2>Fe2+,与已知的还原性强弱一致,故A 不符合题意;
B.若该反应发生,S元素的化合价降低,O元素的化合价升高,则 H2O2为还原剂,还原性强弱为 H2O2>SO2,与已知的还原性强弱矛盾,不可能发生,故B符合题意;
C.因该反应中S元素的化合价升高,I元素的化合价降低,则SO2为还原剂,还原性强弱为SO2>I-,与已知的还原性强弱一致,能发生,故C不符合题意;
D.因该反应中 Fe元素的化合价降低,I元素的化合价升高,则I-为还原剂,还原性强弱为I->Fe2+,与已知的还原性强弱一致,能发生,故D不符合题意;
故答案为B。
4.A
【详解】A.二氧化锰氧化浓盐酸需要加热,装置甲不能制取Cl2,故A错误;
B.氯气密度大于空气,可以用向上排空气法收集,则可以用装置丙收集Cl2,故B正确;
C.氯气有毒,应该用氢氧化钠溶液吸收尾气,因此可用装置丁吸收尾气中的Cl2,故C正确;
D.氯化氢易溶于水,氯气在饱和食盐水中的溶解度很小,可用装置乙除去Cl2中的少量HCl,故D正确;
故答案选A。
5.C
【详解】A.新制氯水呈浅黄绿色,说明氯水中含Cl2,A错误;
B.光照时HClO转化为HCl和O2,溶液酸性增强,即pH减小,B错误;
C.发生的反应为,可说明溶液中有H+,C正确;
D.Cl2也可把Fe2+氧化为Fe3+,不能说明新制氯水中有HClO,D错误;
故选C。
6.A
【详解】A.遇石蕊变蓝的溶液呈碱性,、、、可大量共存,A正确;
B.和反应生成沉淀,H+和会反应生成气体,不能大量共存,B错误;
C.无色透明的溶液中不能存在紫红色的,C错误;
D.氯化铁中的Fe3+和反应生成沉淀,不能大量共存,D错误;
故答案选A。
7.B
【详解】设两块钠的质量都是23g,即钠的物质的量是1mol,钠在氧气中加热的反应方程式为:2Na+O2Na2O2,23g钠完全燃烧生成39g过氧化钠,转移电子是1mol;钠在氧气在常温下反应为:4Na+O2=2Na2O,23g钠与氧气发生反应,生成氧化钠的质量是31g,转移电子是1mol; 所以两块钠失去电子一样多,第一块钠的反应产物质量大,故选B。
8.C
【详解】钠在空气中燃烧,产生黄色火焰,生成淡黄色的固体Na2O2,故选C。
【点睛】钠在常温下和氧气反应生成白色固体Na2O,没有火焰,也不产生白光,能看到光亮的银白色表面很快变暗。
9.D
【详解】A.石灰乳的主要成分是,离子方程式中应写成化学式,石灰乳与溶液混合的离子方程式为:++2OH-,A错误;
B.碳酸不稳定,应写成二氧化碳和水,将稀硝酸滴在大理石上,反应的离子方程式为:,B错误;
C.铁与稀硫酸反应生成硫酸亚铁和氢气,反应的离子方程式为:,C错误;
D.溶液与少量溶液反应,氢氧化钠反应完全,反应的离子方程式为:,D正确;
答案选D。
10.A
【分析】固体粉末加水溶解后过滤,有完全溶于稀的滤渣,该滤渣可能是或,即原粉末中一定含;滤液加稀硫酸生成的白色沉淀甲为,即原粉末中一定含,则一定无;滤液中加生成的白色沉淀乙应为,即原粉末中含。
【详解】A.由分析可知,原粉末中一定有,A正确;
B.由分析可知,原粉末中一定有,B错误;
C.滤液中含,则肯定没有,即白色沉淀乙是,不可能含,C错误;
D.由分析可知,原粉末中一定没有,一定有,D错误;
答案选A。
11.D
【详解】A.合金的性质与其成分金属的性质不完全相同,如合金的硬度、强度更大、熔点更低等,A正确;
B.灼烧时孔雀石分解生成CuO,CuO被焦炭还原为单质Cu,属于还原法制取,B正确;
C.金属冶炼就是把金属阳离子还原为金属原子,越活泼的金属,其阳离子的氧化性越弱,越难被还原,C正确;
D.工业上利用电解熔融MgCl2的方法来制得金属镁,D错误;
故答案选D。
12.C
【详解】A.为由两种元素组成的化合物,A正确;
B.卤化银难溶于水,性质与卤素相似,难溶于水,B正确;
C.卤素单质具有氧化性,性质与卤素相似,具有氧化性,C错误;
D.卤素单质与水反应生成氢卤酸和次卤酸,性质与卤素相似,,D正确;
答案选C。
13.B
【详解】A.1molMg、Al分别与足量盐酸完全反应放出的物质的量分别为1mol、1.5mol。则1mol与足量盐酸完全反应放出的总物质的量为1×17+1.5×12=35mol,A错误;
B.设金属质量均为m,金属提供电子越多则生成氢气体积越大,铝提供电子的物质的量为,镁提供电子的物质的量为,合金提供电子的物质的量为,故等质量的镁、铝和镁铝合金分别与足量的盐酸反应生成的体积(同温同压)由大到小的顺序为V(Al)>V(合金)>V(Mg),B正确;
C.合金中的金属以单质形式存在,故C错误;
D.镁和氮气在一定温度下会发生反应,故不能用氮气做保护气,D错误。
故选B。
14.B
【详解】A.溴单质在常温下为液体,容易挥发,A说法正确;
B.碘单质在常温下为紫黑色固体,易升华,B说法错误;
C.溴可溶于水,在四氯化碳等有机溶剂中溶解度更大,更易溶,C说法正确;
D.碘蒸汽为紫色,碘水为棕黄色,碘的四氯化碳溶液呈紫红色,D说法正确;
答案选B。
15.C
【详解】A.该实验现象不能证明氧化性,因为过量的和KI反应也能置换出,选项A错误;
B.使润湿的品红试纸褪色主要是因为次氯酸的强氧化性漂白品红,生成稳定的无色物质,加热不会恢复原色,选项B错误;
C.甲中发生的反应是,利用还原剂的还原性强于还原产物,也可以证明的还原性强于,选项C正确;
D.通入NaBr溶液中,优先与水反应;通入溶液中,优先与NaBr反应,二者反应实质不同,选项D错误;
答案选C。
16. 分液漏斗 除去氯气中的HCl B→F→E→D→C 还原 酸 发生了副反应:6Cl2+6Ca(OH)25CaCl2+Ca(ClO3)2+6H2O,所以制得的漂白粉中n(CaCl2)远大于n[Ca(C1O)2] 用冰水或冷水冷却
【分析】由实验装置图可知,B中浓盐酸与二氧化锰加热制备氯气,然后连接F中饱和食盐水可除去HCl,再连接E干燥氯气,然后连接D收集氯气,最后连接C进行尾气处理,以此来解答。
【详解】Ⅰ.(1)装置G的名称为分液漏斗,故答案为:分液漏斗;
(2)装置F的作用为除去氯气中的HCl,故答案为:除去氯气中的HCl;
(3)从图中选择合适装置制备并收集纯净干的氯气仪器连接顺序为B→F→E→D→C(从左侧看导管长进短出),故答案为:B→F→E→D→C;
(4)制备氯气的反应为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,生成氯气体现还原性,生成氯化锰体现酸性,则体现了浓盐酸的还原性和酸性,故答案为:还原;酸;
Ⅱ.(5)①漂白粉的主要成分是次氯酸钙和氯化钙,将氯气通入石灰乳制取漂白粉,同时有水生成,反应的化学方程为2C12+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O,用双线桥标注电子转移的方向和数目, ,故答案为: ;
②氯气和碱反应会放出热量,导致温度升高,当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙和水;当温度高时,发生了副反应:6Cl2+6Ca(OH)25CaCl2+Ca(ClO3)2+6H2O,所以制得的漂白粉中n(CaCl2)远大于n[Ca(C1O)2], 故答案为:发生了副反应:6Cl2+6Ca(OH)25CaCl2+Ca(ClO3)2+6H2O,所以制得的漂白粉中n(CaCl2)远大于n[Ca(C1O)2];
③温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,用冰水或冷水冷却,或控制氯气产生速率,通过控制反应速率,避免反应放热瞬时升高,故答案为:用冰水或冷水冷却。
17.(1) Na2O2 2Na+O2Na2O2
(2) 分液漏斗 2Na2O2+2H2O=4NaOH+O2↑
(3) 产生白色沉淀 因B中溶液含有NaOH,它也能使酚酞变红 取B中溶液于试管中,往其中加入BaCl2溶液(或澄清石灰水),若有白色沉淀产生,则燃烧产物中有Na2CO3固体
【分析】(1)
据题干信息,钠在空气中燃烧的淡黄色产物为过氧化钠,化学式为Na2O2,生成过氧化钠的化学方程式为2Na+O2Na2O2。
(2)
仪器A为分液漏斗;将分液漏斗A中的水加入B中,有气体生成,可以得出其中反应为2Na2O2+2H2O=4NaOH+O2↑;
(3)
取B中溶液于试管中,往其中加入BaCl2溶液,得出实验结论燃烧产物中有Na2CO3固体,由此可以推出溶液中Na2CO3和BaCl2反应生成了CaCO3沉淀,由此得出实验现象是产生白色沉淀。丙同学认为方案不合理,原因是燃烧产物中含有Na2O2可和水反应生成NaOH,使得溶液呈碱性,可以使酚酞溶液变红色。检验Na2CO3可以用BaCl2溶液或澄清石灰水,若有白色沉淀产生,则燃烧产物中有Na2CO3固体。如果选择Ba(NO3)2或Ba(OH)2,足量盐酸等物质均可。
18. ① ③ a b c
【分析】根据图示过程分析可知,向饱和食盐水中先通入氨气,再通入CO2气体,发生反应:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,将NaHCO3过滤出来,加热发生分解反应,得到纯碱Na2CO3,滤液中加入NaCl固体,会析出NH4Cl晶体;
【详解】(1)根据上述分析可知,①~③所涉及的操作方法中,包含过滤的是①和③;
(2)过程①为向饱和食盐水中先通入氨气,再通入CO2气体,发生反应生成NaHCO3和NH4Cl,反应的化学方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
(3)NaHCO3受热分解产生Na2CO3、H2O和CO2,反应的化学方程式为;
(4)a.开始通入二氧化碳反应,最后碳酸氢钠受热分解生成的CO2可循环使用,a正确;
b.副产物NH4Cl是氮肥,可用作植物生长所需的肥料,b正确;
c.溶液B中主要是氯化钠、氯化铵饱和溶液,一定含有Na+、、Cl-,c正确;
故合理选项是abc。
19. (或、) 、 海边(或沿海陆地)
【分析】(1)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后;
(2)海滩贝壳的主要成分为CaCO3,CaCO3在高温煅烧下分解为氧化钙和二氧化碳,氧化钙与水反应可生成氢氧化钙;
(3)制漂白粉的方法是向石灰乳中通入氯气,反应生成次氯酸钙、氯化钙和水;
(4)从经济效益角度看,原料在海水和海滩上。
【详解】(1)用蒸发结晶的方法可以从海水中获得食盐,镁离子用氢氧根离子沉淀,加入过量的石灰乳可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以添加试剂的顺序为:或或,故答案为:(或、);
(2)海滩贝壳的主要成分为CaCO3,CaCO3在高温煅烧下分解为氧化钙和二氧化碳,氧化钙与水反应可生成氢氧化钙,反应方程式为:CaCO3CaO+CO2↑、CaO+H2O=Ca(OH)2,故答案为:CaCO3CaO+CO2↑、CaO+H2O=Ca(OH)2;
(3)制漂白粉的方法是向石灰乳中通入氯气,反应生成次氯酸钙、氯化钙和水,反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(4)从经济效益角度看,该化工厂厂址应选在沿海陆地,因为其原料在海水和海滩上,故答案为:海边(或沿海陆地)。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.化学与生产:生活及环境密切相关。下列说法正确的是
A.太阳能电池的主要材料是 B.新冠疫苗应冷藏存放,以避免活性降低
C.84消毒液可与洁厕灵(盐酸)混合使用 D.具有强氧化性,可用于漂白纸浆
2.氧化还原反应与四种基本反应类型的关系如下图所示,则下列化学反应属于阴影部分的是
A.
B.
C.
D.(提示:中氧元素的化合价为-1价)
3.已知、、和均有还原性,它们在酸性溶液中还原性的强弱顺序为。则下列反应不能发生的是
A.
B.
C.
D.
4.实验室用如图装置制取、提纯、收集Cl2、尾气处理,不能达到实验目的的是
A.用装置甲制取Cl2
B.用装置丙收集Cl2
C.用装置丁吸收尾气中的Cl2
D.用装置乙除去Cl2中的少量HCl
5.在新制氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一致且正确的是
A.新制氯水呈浅黄绿色,且有刺激性气味,说明溶液中有分子存在
B.用强光照射新制氯水一段时间后,溶液增大,说明溶液中有存在
C.将加入新制氯水中,有无色气泡产生,说明溶液中有存在
D.溶液中滴加新制氯水,溶液变成棕黄色,说明新制氯水中有存在
6.下列各组离子在给定条件下一定能大量共存的是
A.遇石蕊变蓝的溶液:、、、
B.常温下pH小于7的溶液:、、、
C.无色透明的溶液:、、、
D.含氯化铁的溶液:、、、
7.等质量的两块钠,第一块在足量氧气中加热,第二块在足量空气(常温)中充分反应,则 下列说法正确的是
A.第一块钠失去电子多 B.两块钠失去电子一样多
C.第二块钠的反应产物质量大 D.两块钠的反应产物质量一样大
8.金属钠在空气中燃烧时,产生的现象和生成物是
A.产生白烟,生成Na2O B.产生黄色火焰,生成Na2O
C.产生黄色火焰,生成Na2O2 D.产生白光,生成Na2O2
9.下列离子方程式书写正确的是
A.石灰乳与溶液混合:
B.将稀硝酸滴在大理石上:
C.与稀硫酸反应的离子方程式:
D.溶液与少量溶液反应:
10.有一包白色固体粉末,其中可能含有、、、中的一种或几种,现做以下实验(所加试剂均足量):
则下列说法正确的是
A.原粉末中一定有
B.是否存在无法确定,需进一步实验确定
C.白色沉淀乙可能是和的混合物
D.原粉末中一定没有,可能有
11.金属材料在日常生活以及生产中有着广泛的应用。下列关于金属的一些说法不正确的是
A.合金的性质与其组成金属的性质不完全相同
B.灼烧孔雀石[Cu2(OH)2CO3]和焦炭混合物制铜也属于还原法
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.工业上金属Mg、Cu都是用热还原法制得的
12.已知性质与卤素相似,下列关于的性质推测不合理的是
A.属于化合物 B.难溶于水
C.具有强还原性 D.
13.新型镁铝合金()有储氢性能,下列说法正确的是
A.1mol与足量盐酸完全反应放出的总物质的量为34mol
B.等质量的镁、铝和镁铝合金分别与足量的盐酸反应生成的体积(同温同压)由大到小的顺序为V(Al)>V(合金)>V(Mg)
C.该合金中存在
D.该合金应在氮气保护下,将一定比例的Mg、Al单质熔炼而成
14.下列关于卤素单质性质的说法错误的是
A.溴在常温下为液体,易挥发
B.碘在常温下为紫黑色固体,易挥发
C.溴可溶于水,更易溶于四氯化碳等有机溶剂中
D.碘蒸汽为紫色,碘水为棕黄色,碘的四氯化碳溶液呈紫红色
15.已知常温下,浓盐酸与高锰酸钾反应可以生成氯气。如图甲、乙、丙三处分别是沾有NaBr溶液的棉花、润湿的淀粉-KI试纸、润湿的品红试纸,下列说法正确的是
A.该实验通过现象可以证明氧化性:
B.沾有品红溶液的试纸会褪色,若再对丙微热则恢复红色
C.甲的现象也可以证明的还原性强于
D.与NaBr溶液反应的实质与与NaBr溶液反应类似
二、实验题
16.氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,某兴趣小组利用所给仪器在实验室制备纯净干燥的氯气,并模拟工业制漂白粉。请回答下列问题:
(1)装置G的名称为_______。
(2)装置F的作用为_______。
(3)从上图中选择合适装置制备并收集纯净干燥的氯气(仪器不重复使用),仪器连接顺序为_______(用仪器下方字母表示,如A→B→…)。
(4)制备氯气的反应中体现了浓盐酸的_______性和_______性。
Ⅱ.漂白粉的制备
已知:①氯气和石灰乳在反应的过程中会放出热量。
②
(5)①写出制取漂白粉的化学方程式,并用双线桥标注电子转移的方向和数目_______。
②兴趣小组制得的漂白粉中的含量远超过预期,而含量明显偏低。主要原因可能是(请用化学方程式结合文字表述)_______。
(6)为提高产品中有效成分的含量,在不改变石灰乳浓度和体积的条件下可采取的措施是(任写一种即可)_______。
17.某实验小组同学在做钠在空气中燃烧实验时,发现产物中除了淡黄色固体,还有黑色物质、为了对产物进行检验,他们设计了如下实验。回答下列问题:
(1)淡黄色固体为___________(填化学式),写出生成该物质的化学方程式___________。
(2)为验证产物甲同学设计了如下实验,其装置如图所示。B中盛放燃烧产物,A中盛放水,打开A的活塞让水流下,观察到B中发生反应,集气瓶中的水通过导管排入量筒中。
①仪器A的名称为___________;
②写出仪器B中发生反应的化学方程式___________。
(3)乙同学观察到B中黑色物质不溶解,由此推测燃烧产物中有多种物质。通过查阅资料,他了解到Na与CO2可以发生反应生成碳单质和Na2CO3固体。
为检测上述燃烧产物中是否存在Na2CO3固体,乙同学设计了以下实验方案,请你补全该实验:
实验操作 实验现象 实验结论
方案一 取B中溶液于试管中,往其中滴入几滴酚酞 溶液变红 燃烧产物中有Na2CO3固体
方案二 取B中溶液于试管中,往其中加入CaCl2溶液 ___________
丙同学认为方案一不合理,其理由是___________。
经过讨论,大家又提出了合理的新方案(含实验操作,现象和结论)___________。
三、工业流程题
18.我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献.联合制碱法的主要过程如图所示(部分物质已略去)
(1)①~③所涉及的操作方法中,包含过滤的是________(填序号)
(2)根据上图,写出①中发生反应的化学方程式:________
(3)煅烧固体的化学方程式是_____________
(4)下列说法中,正确的是________(填字母)
a.可循环使用
b.副产物可用作肥料
c.溶液B中一定含有、、
19.从海水中可提取多种化工原料,下图是工业上对海水资源进行综合利用的流程图。试回答下列问题:
(1)若粗盐中含有杂质离子Ca2+、Mg2+、SO42-,精制时所用试剂为A.盐酸、B.BaCl2溶液、C.NaOH溶液、D.Na2CO3溶液。则加入试剂的顺序是________(填序号)。
(2)写出用海滩上的贝壳制Ca(OH)2的化学方程式:________________。
(3)电解熔融MgCl2可制取镁和Cl2,其中Cl2和Ca(OH)2反应可制得漂白粉。制漂白粉的化学方程式为________________。
(4)从经济效益角度考虑,该化工厂厂址应选在________________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.太阳能电池的主要材料是,A错误;
B.新冠疫苗应冷藏存放,以避免活性降低,B正确;
C.84消毒液不可与洁厕灵(盐酸)混合使用,因为二者混合会生成有毒的Cl2,C错误;
D.具有漂白性性,可用于漂白纸浆,不是用到强氧化性,D错误。
因此,本题选B。
2.D
【分析】阴影部分的区域属于氧化还原反应,但不属于四大反应类型。
【详解】A.Cl2+2KBr=Br2+2KCl属于置换反应、氧化还原反应,故A不符合题意;
B.属于分解反应、非氧化还原反应,故B不符合题意;
C.属于化合反应、氧化还原反应,故C不符合题意;
D.属于氧化还原反应,但是不属于四大反应类型,属于阴影部分,故D符合题意;
故选D。
3.B
【详解】A.因该反应中S元素的化合价升高,Fe 元素的化合价降低,则SO2为还原剂,还原剂的还原性强于还原产物,SO2>Fe2+,与已知的还原性强弱一致,故A 不符合题意;
B.若该反应发生,S元素的化合价降低,O元素的化合价升高,则 H2O2为还原剂,还原性强弱为 H2O2>SO2,与已知的还原性强弱矛盾,不可能发生,故B符合题意;
C.因该反应中S元素的化合价升高,I元素的化合价降低,则SO2为还原剂,还原性强弱为SO2>I-,与已知的还原性强弱一致,能发生,故C不符合题意;
D.因该反应中 Fe元素的化合价降低,I元素的化合价升高,则I-为还原剂,还原性强弱为I->Fe2+,与已知的还原性强弱一致,能发生,故D不符合题意;
故答案为B。
4.A
【详解】A.二氧化锰氧化浓盐酸需要加热,装置甲不能制取Cl2,故A错误;
B.氯气密度大于空气,可以用向上排空气法收集,则可以用装置丙收集Cl2,故B正确;
C.氯气有毒,应该用氢氧化钠溶液吸收尾气,因此可用装置丁吸收尾气中的Cl2,故C正确;
D.氯化氢易溶于水,氯气在饱和食盐水中的溶解度很小,可用装置乙除去Cl2中的少量HCl,故D正确;
故答案选A。
5.C
【详解】A.新制氯水呈浅黄绿色,说明氯水中含Cl2,A错误;
B.光照时HClO转化为HCl和O2,溶液酸性增强,即pH减小,B错误;
C.发生的反应为,可说明溶液中有H+,C正确;
D.Cl2也可把Fe2+氧化为Fe3+,不能说明新制氯水中有HClO,D错误;
故选C。
6.A
【详解】A.遇石蕊变蓝的溶液呈碱性,、、、可大量共存,A正确;
B.和反应生成沉淀,H+和会反应生成气体,不能大量共存,B错误;
C.无色透明的溶液中不能存在紫红色的,C错误;
D.氯化铁中的Fe3+和反应生成沉淀,不能大量共存,D错误;
故答案选A。
7.B
【详解】设两块钠的质量都是23g,即钠的物质的量是1mol,钠在氧气中加热的反应方程式为:2Na+O2Na2O2,23g钠完全燃烧生成39g过氧化钠,转移电子是1mol;钠在氧气在常温下反应为:4Na+O2=2Na2O,23g钠与氧气发生反应,生成氧化钠的质量是31g,转移电子是1mol; 所以两块钠失去电子一样多,第一块钠的反应产物质量大,故选B。
8.C
【详解】钠在空气中燃烧,产生黄色火焰,生成淡黄色的固体Na2O2,故选C。
【点睛】钠在常温下和氧气反应生成白色固体Na2O,没有火焰,也不产生白光,能看到光亮的银白色表面很快变暗。
9.D
【详解】A.石灰乳的主要成分是,离子方程式中应写成化学式,石灰乳与溶液混合的离子方程式为:++2OH-,A错误;
B.碳酸不稳定,应写成二氧化碳和水,将稀硝酸滴在大理石上,反应的离子方程式为:,B错误;
C.铁与稀硫酸反应生成硫酸亚铁和氢气,反应的离子方程式为:,C错误;
D.溶液与少量溶液反应,氢氧化钠反应完全,反应的离子方程式为:,D正确;
答案选D。
10.A
【分析】固体粉末加水溶解后过滤,有完全溶于稀的滤渣,该滤渣可能是或,即原粉末中一定含;滤液加稀硫酸生成的白色沉淀甲为,即原粉末中一定含,则一定无;滤液中加生成的白色沉淀乙应为,即原粉末中含。
【详解】A.由分析可知,原粉末中一定有,A正确;
B.由分析可知,原粉末中一定有,B错误;
C.滤液中含,则肯定没有,即白色沉淀乙是,不可能含,C错误;
D.由分析可知,原粉末中一定没有,一定有,D错误;
答案选A。
11.D
【详解】A.合金的性质与其成分金属的性质不完全相同,如合金的硬度、强度更大、熔点更低等,A正确;
B.灼烧时孔雀石分解生成CuO,CuO被焦炭还原为单质Cu,属于还原法制取,B正确;
C.金属冶炼就是把金属阳离子还原为金属原子,越活泼的金属,其阳离子的氧化性越弱,越难被还原,C正确;
D.工业上利用电解熔融MgCl2的方法来制得金属镁,D错误;
故答案选D。
12.C
【详解】A.为由两种元素组成的化合物,A正确;
B.卤化银难溶于水,性质与卤素相似,难溶于水,B正确;
C.卤素单质具有氧化性,性质与卤素相似,具有氧化性,C错误;
D.卤素单质与水反应生成氢卤酸和次卤酸,性质与卤素相似,,D正确;
答案选C。
13.B
【详解】A.1molMg、Al分别与足量盐酸完全反应放出的物质的量分别为1mol、1.5mol。则1mol与足量盐酸完全反应放出的总物质的量为1×17+1.5×12=35mol,A错误;
B.设金属质量均为m,金属提供电子越多则生成氢气体积越大,铝提供电子的物质的量为,镁提供电子的物质的量为,合金提供电子的物质的量为,故等质量的镁、铝和镁铝合金分别与足量的盐酸反应生成的体积(同温同压)由大到小的顺序为V(Al)>V(合金)>V(Mg),B正确;
C.合金中的金属以单质形式存在,故C错误;
D.镁和氮气在一定温度下会发生反应,故不能用氮气做保护气,D错误。
故选B。
14.B
【详解】A.溴单质在常温下为液体,容易挥发,A说法正确;
B.碘单质在常温下为紫黑色固体,易升华,B说法错误;
C.溴可溶于水,在四氯化碳等有机溶剂中溶解度更大,更易溶,C说法正确;
D.碘蒸汽为紫色,碘水为棕黄色,碘的四氯化碳溶液呈紫红色,D说法正确;
答案选B。
15.C
【详解】A.该实验现象不能证明氧化性,因为过量的和KI反应也能置换出,选项A错误;
B.使润湿的品红试纸褪色主要是因为次氯酸的强氧化性漂白品红,生成稳定的无色物质,加热不会恢复原色,选项B错误;
C.甲中发生的反应是,利用还原剂的还原性强于还原产物,也可以证明的还原性强于,选项C正确;
D.通入NaBr溶液中,优先与水反应;通入溶液中,优先与NaBr反应,二者反应实质不同,选项D错误;
答案选C。
16. 分液漏斗 除去氯气中的HCl B→F→E→D→C 还原 酸 发生了副反应:6Cl2+6Ca(OH)25CaCl2+Ca(ClO3)2+6H2O,所以制得的漂白粉中n(CaCl2)远大于n[Ca(C1O)2] 用冰水或冷水冷却
【分析】由实验装置图可知,B中浓盐酸与二氧化锰加热制备氯气,然后连接F中饱和食盐水可除去HCl,再连接E干燥氯气,然后连接D收集氯气,最后连接C进行尾气处理,以此来解答。
【详解】Ⅰ.(1)装置G的名称为分液漏斗,故答案为:分液漏斗;
(2)装置F的作用为除去氯气中的HCl,故答案为:除去氯气中的HCl;
(3)从图中选择合适装置制备并收集纯净干的氯气仪器连接顺序为B→F→E→D→C(从左侧看导管长进短出),故答案为:B→F→E→D→C;
(4)制备氯气的反应为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,生成氯气体现还原性,生成氯化锰体现酸性,则体现了浓盐酸的还原性和酸性,故答案为:还原;酸;
Ⅱ.(5)①漂白粉的主要成分是次氯酸钙和氯化钙,将氯气通入石灰乳制取漂白粉,同时有水生成,反应的化学方程为2C12+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O,用双线桥标注电子转移的方向和数目, ,故答案为: ;
②氯气和碱反应会放出热量,导致温度升高,当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙和水;当温度高时,发生了副反应:6Cl2+6Ca(OH)25CaCl2+Ca(ClO3)2+6H2O,所以制得的漂白粉中n(CaCl2)远大于n[Ca(C1O)2], 故答案为:发生了副反应:6Cl2+6Ca(OH)25CaCl2+Ca(ClO3)2+6H2O,所以制得的漂白粉中n(CaCl2)远大于n[Ca(C1O)2];
③温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,用冰水或冷水冷却,或控制氯气产生速率,通过控制反应速率,避免反应放热瞬时升高,故答案为:用冰水或冷水冷却。
17.(1) Na2O2 2Na+O2Na2O2
(2) 分液漏斗 2Na2O2+2H2O=4NaOH+O2↑
(3) 产生白色沉淀 因B中溶液含有NaOH,它也能使酚酞变红 取B中溶液于试管中,往其中加入BaCl2溶液(或澄清石灰水),若有白色沉淀产生,则燃烧产物中有Na2CO3固体
【分析】(1)
据题干信息,钠在空气中燃烧的淡黄色产物为过氧化钠,化学式为Na2O2,生成过氧化钠的化学方程式为2Na+O2Na2O2。
(2)
仪器A为分液漏斗;将分液漏斗A中的水加入B中,有气体生成,可以得出其中反应为2Na2O2+2H2O=4NaOH+O2↑;
(3)
取B中溶液于试管中,往其中加入BaCl2溶液,得出实验结论燃烧产物中有Na2CO3固体,由此可以推出溶液中Na2CO3和BaCl2反应生成了CaCO3沉淀,由此得出实验现象是产生白色沉淀。丙同学认为方案不合理,原因是燃烧产物中含有Na2O2可和水反应生成NaOH,使得溶液呈碱性,可以使酚酞溶液变红色。检验Na2CO3可以用BaCl2溶液或澄清石灰水,若有白色沉淀产生,则燃烧产物中有Na2CO3固体。如果选择Ba(NO3)2或Ba(OH)2,足量盐酸等物质均可。
18. ① ③ a b c
【分析】根据图示过程分析可知,向饱和食盐水中先通入氨气,再通入CO2气体,发生反应:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,将NaHCO3过滤出来,加热发生分解反应,得到纯碱Na2CO3,滤液中加入NaCl固体,会析出NH4Cl晶体;
【详解】(1)根据上述分析可知,①~③所涉及的操作方法中,包含过滤的是①和③;
(2)过程①为向饱和食盐水中先通入氨气,再通入CO2气体,发生反应生成NaHCO3和NH4Cl,反应的化学方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
(3)NaHCO3受热分解产生Na2CO3、H2O和CO2,反应的化学方程式为;
(4)a.开始通入二氧化碳反应,最后碳酸氢钠受热分解生成的CO2可循环使用,a正确;
b.副产物NH4Cl是氮肥,可用作植物生长所需的肥料,b正确;
c.溶液B中主要是氯化钠、氯化铵饱和溶液,一定含有Na+、、Cl-,c正确;
故合理选项是abc。
19. (或、) 、 海边(或沿海陆地)
【分析】(1)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后;
(2)海滩贝壳的主要成分为CaCO3,CaCO3在高温煅烧下分解为氧化钙和二氧化碳,氧化钙与水反应可生成氢氧化钙;
(3)制漂白粉的方法是向石灰乳中通入氯气,反应生成次氯酸钙、氯化钙和水;
(4)从经济效益角度看,原料在海水和海滩上。
【详解】(1)用蒸发结晶的方法可以从海水中获得食盐,镁离子用氢氧根离子沉淀,加入过量的石灰乳可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以添加试剂的顺序为:或或,故答案为:(或、);
(2)海滩贝壳的主要成分为CaCO3,CaCO3在高温煅烧下分解为氧化钙和二氧化碳,氧化钙与水反应可生成氢氧化钙,反应方程式为:CaCO3CaO+CO2↑、CaO+H2O=Ca(OH)2,故答案为:CaCO3CaO+CO2↑、CaO+H2O=Ca(OH)2;
(3)制漂白粉的方法是向石灰乳中通入氯气,反应生成次氯酸钙、氯化钙和水,反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(4)从经济效益角度看,该化工厂厂址应选在沿海陆地,因为其原料在海水和海滩上,故答案为:海边(或沿海陆地)。
答案第1页,共2页
答案第1页,共2页
