原子结构 第3课时 课件(共20张PPT)2022-2023学年高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 原子结构 第3课时 课件(共20张PPT)2022-2023学年高二下学期化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 28.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-27 11:23:51 | ||
图片预览






文档简介
(共20张PPT)
第一章 原子结构与性质
第一节 原子结构
学习
目标
第3课时
电子云与原子轨道
PART
01
PART
02
知道电子的运动状态(空间分布及能量)可通过原子轨道和电子云模型来描述。
通过认识原子结构及核外电子排布,辨识微观粒子的运动状态不同于宏观物体的运动状态。
1913年
玻尔提出氢原子模型,电子在线性轨道上绕核运行。
1926年
玻尔建立的线性轨道模型被量子力学推翻。
量子力学指出,一定空间运动状态的电子并不在玻尔假定的线性轨道上运行,而在核外空间各处都可能出现,但出现的概率不同,可以算出它们的概率密度(ρ)分布——电子云
1911年,英国物理学家卢瑟福根据1910年进行的α粒子散射实验,提出了原子结构的行星模型。在这个模型里,电子像太阳系的行星围绕太阳转一样围绕着原子核旋转。
α粒子散射实验
思考:原子核外的电子运动状态是怎么样呢?
四、电子云与原子轨道
四、电子云与原子轨道
(1)概率密度:表示电子在某处出现的概率P与该处体积V的比值(即某处单位体积内电子出现的概率)
ρ=
P
V
思考1:如何形象的描述概率密度呢?
思考2:概率密度分布图中小点代表什么含义?
小点不是电子本身,小点是1s电子在原子核外出现的概率密度的形象描述。小点越密,表明概率密度越大(电子出现的几率越大)。
图1-7 氢原子1s电子在原子核外出现的概率密度分布图
1、概率密度(ρ)
—概率密度分布图
小黑点不表示电子,只表示电子在这里出现过一次。小黑点的疏密表示电子在核外空间内出现的机会的多少。
四、电子云与原子轨道
1、概率密度(ρ)
由于核外电子的概率密度分布看起来像一片云雾,因而被形象地称作电子云。
电子云是处于一定空间运动状态的电子在原子核外空间的概
率密度分布的形象化描述。不代表电子的运动轨迹。
四、电子云与原子轨道
2、电子云
(1)含义:
电子云图很形象直观,但是很难绘制,使用不便,我们常使用电子云轮廓图
电子云:只是形象地表示电子出现在各点的概率高低,而实际上并不存在。
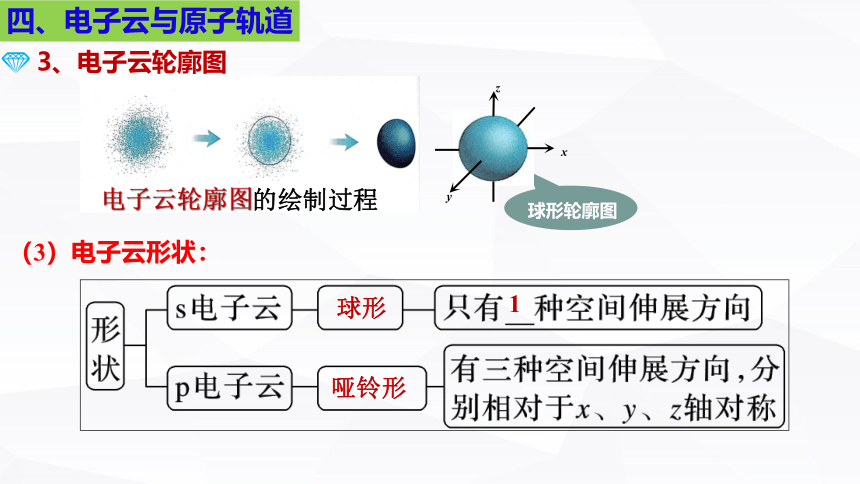
3、电子云轮廓图
(2)如何绘制电子云轮廓图:
(1)绘制目的:
表示电子云轮廓的形状,对核外电子的空间运动状态有一个形象化的简便描述。
把电子在原子核外空间出现概率P=90%的空间圈出来。
四、电子云与原子轨道
电子云轮廓图的绘制过程
球形轮廓图
x
y
z
(3)电子云形状:
球形
哑铃形
1
3、电子云轮廓图
四、电子云与原子轨道
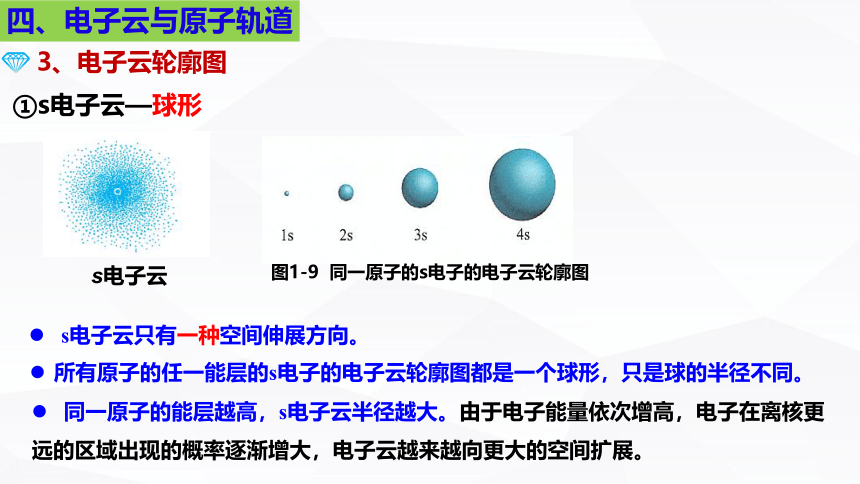
s电子云
3、电子云轮廓图
所有原子的任一能层的s电子的电子云轮廓图都是一个球形,只是球的半径不同。
同一原子的能层越高,s电子云半径越大。由于电子能量依次增高,电子在离核更
远的区域出现的概率逐渐增大,电子云越来越向更大的空间扩展。
s电子云只有一种空间伸展方向。
①s电子云—球形
图1-9 同一原子的s电子的电子云轮廓图
四、电子云与原子轨道
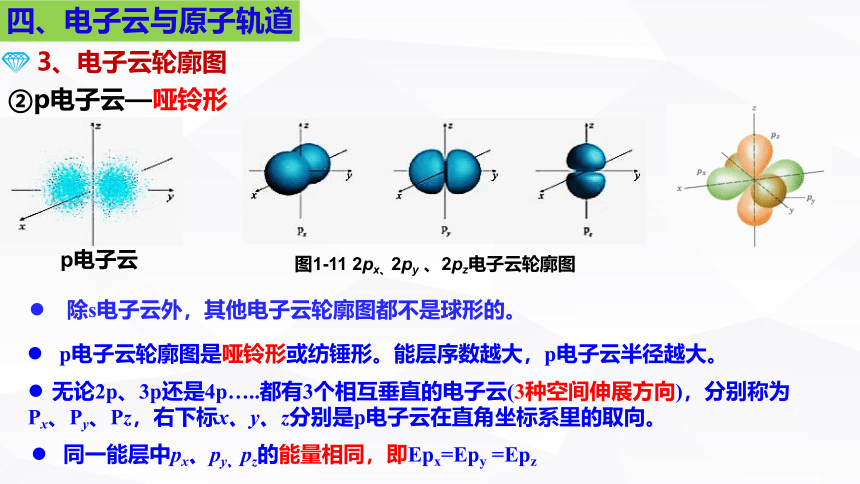
p电子云
3、电子云轮廓图
②p电子云—哑铃形
p电子云轮廓图是哑铃形或纺锤形。能层序数越大,p电子云半径越大。
无论2p、3p还是4p…..都有3个相互垂直的电子云(3种空间伸展方向),分别称为
Px、Py、Pz,右下标x、y、z分别是p电子云在直角坐标系里的取向。
同一能层中px、py、pz的能量相同,即Epx=Epy =Epz
除s电子云外,其他电子云轮廓图都不是球形的。
图1-11 2px、2py 、2pz电子云轮廓图
③d电子云——花瓣形或双哑铃形。
有5种空间伸展方向,
分别用dxy,dxz,dyz , dx2-y2,dz2表示。
④f 电子云轮廓图有7种空间伸展方向。
四、电子云与原子轨道
3、电子云轮廓图
量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。
四、电子云与原子轨道
4、原子轨道
常用电子云轮廓图的形状和取向来表示原子轨道的形状和取向。
各能级的一个伸展方向的电子云轮廓图即表示一个原子轨道。
(3)原子轨道的形状:
①s电子的原子轨道呈球形。只有一种空间伸展方向, 所以s能级只有1个原子轨道。
能层序数越大,原子轨道的半径越大。
②p电子的原子轨道呈哑铃形。有3种空间伸展方向, 所以p能级有3个原子轨道。
③d电子的原子轨道呈花瓣形或双哑铃形。有5种空间伸展方向,所以d能级有5个原子轨道。
④f 电子有7种空间伸展方向,所以f能级有7个原子轨道。
(1)定义:
(2)表示:
能层 能级 原子轨道数 原子轨道名称 原子轨道的形状和取向 K 1s 1 1s 球形 ——
L 2s 1 2s 球形 ——
2p 3 2px、2py、2pz 哑铃形 互相垂直
M 3s 1 3s 球形 ——
3p 3 3px、3py、3pz 哑铃形 互相垂直
3d 5 …… …… ……
N 4s 1 4s 球形 ——
4p 3 4px、4py、4pz 哑铃形 互相垂直
4d 5 …… …… …...
4f 7 …… …… ……
(4)不同能层的能级、原子轨道数、原子轨道名称以及形状和取向
原子轨道数与能层序数(n)的关系:原子轨道数目=n2。
四、电子云与原子轨道
小结:原子轨道与能层序数的关系
1.不同能层的同种能级的原子轨道形状 ,只是 不同。能层序数n越大,原子轨道的半径越 。
2.s能级只有 个原子轨道。p能级有 个原子轨道,它们互相垂直,分别以px、py、pz表示。在同一能层中px、py、pz的能量 。
3.原子轨道数与能层序数(n)的关系:原子轨道数=n2
相同
半径
大
1
3
相同
四、电子云与原子轨道
微观粒子可视化1: 1s~2p原子轨道
四、电子云与原子轨道
4、原子轨道
微观粒子可视化2: 1s~2p原子轨道的叠加
四、电子云与原子轨道
4、原子轨道
应用体验
1.正误判断
(1)电子的运动与行星相似,围绕原子核在固定轨道上高速旋转( )
(2)1s电子云示意图中一个小点表示一个自由运动的电子( )
(3)从空间角度看,2s轨道比1s轨道大,其空间包含了1s轨道( )
(4)2p、3p、4p能级的轨道数依次增多( )
(5)2px、2py、2pz轨道相互垂直,但能量相等( )
×
×
√
×
√
四、电子云与原子轨道
1.如图甲是氢原子的1s电子云图(即概率密度分布图),图乙、丙分别表示s、p能级的电子云轮廓图。下列有关说法正确的是( )
A.电子云图(即概率密度分布图)就是原子轨道图
B.3p2表示3p能级中有两个原子轨道
C.由图乙可知,s能级的电子云轮廓图呈圆形,有无数条对称轴
D.由图丙可知,p能级的原子轨道图呈哑铃形,且有3个伸展方向
【解析】选D。电子云轮廓图与电子云图不是同一个概念,而是我们常说的原子轨道图,A项错误;3p2表示3p能级中容纳了两个电子,B项错误;s能级的电子云轮廓图呈球形而不是圆形,C项错误;p能级的原子轨道图呈哑铃形,有px、py、pz三个伸展方向,并且互相垂直,D项正确。
四、电子云与原子轨道
2.下列说法中正确的是( )
A.1s电子云呈球形,表示电子绕原子核做圆周运动
B.电子云图中的小黑点密度大,说明该原子核外空间电子数目多
C.3d3表示3d能级有3个轨道
D.ns能级的原子轨道图可表示为
【解析】选D。电子云表示电子在核外空间某处出现的机会,不代表电子的运动轨迹,故A错误;小黑点的疏密表示电子出现机会的多少,密则机会大,疏则机会小,故B错误;3d3表示3d能级有3个电子,故C错误;ns能级的电子云呈球形,所以可以用该图表示该能级的原子轨道,故D正确。
四、电子云与原子轨道
3.下列有关说法正确的是( )
A.每个能层s能级的原子轨道的形状相同,能层序数越大,轨道半径越大,电子能量越高
B.原子核外电子云是核外电子运动后留下的痕迹
C.教材中说“核外电子的概率密度分布看起来像一片云雾,因而被形象地称作电子云”,这说明原子核外电子云是实际存在的
D.每个能层都有p能级,p能级都有3个原子轨道
【解析】选A。每个能层s能级的原子轨道的形状相同,能层序数越大,轨道半径越大,电子能量越高,故A正确;电子云表示的是电子在核外某处出现的概率,不是电子运动后留下的痕迹,故B错误;电子云是电子在核外运动的概率密度分布的形象化描述,实际不存在,故C错误;第一能层没有p能级,故D错误。
四、电子云与原子轨道
4.下列对核外电子运动状态的描述正确的是( )
A.电子的运动与行星的运动相似,围绕原子核在固定的轨道上高速旋转
B.能层数为3时,有3s、3p、3d、3f四个轨道
C.氢原子中只有一个电子,故氢原子只有一个轨道
D.在同一能级上运动的电子,其运动状态肯定不同
【解析】选D。电子运动不是围绕原子核在固定的轨道上高速旋转,只是在某个区域出现的概率大些,故A错误;能层数为3时,只有3s、3p、3d轨道,故B错误;氢原子有多个轨道,只有一个轨道上有电子,其他轨道为空轨道,故C错误;同一能级上的同一轨道上最多排两个电子,两个电子的自旋方向不同,则其运动状态肯定不同,所以在同一能级上运动的电子,其运动状态肯定不同,故D正确。
四、电子云与原子轨道
第一章 原子结构与性质
第一节 原子结构
学习
目标
第3课时
电子云与原子轨道
PART
01
PART
02
知道电子的运动状态(空间分布及能量)可通过原子轨道和电子云模型来描述。
通过认识原子结构及核外电子排布,辨识微观粒子的运动状态不同于宏观物体的运动状态。
1913年
玻尔提出氢原子模型,电子在线性轨道上绕核运行。
1926年
玻尔建立的线性轨道模型被量子力学推翻。
量子力学指出,一定空间运动状态的电子并不在玻尔假定的线性轨道上运行,而在核外空间各处都可能出现,但出现的概率不同,可以算出它们的概率密度(ρ)分布——电子云
1911年,英国物理学家卢瑟福根据1910年进行的α粒子散射实验,提出了原子结构的行星模型。在这个模型里,电子像太阳系的行星围绕太阳转一样围绕着原子核旋转。
α粒子散射实验
思考:原子核外的电子运动状态是怎么样呢?
四、电子云与原子轨道
四、电子云与原子轨道
(1)概率密度:表示电子在某处出现的概率P与该处体积V的比值(即某处单位体积内电子出现的概率)
ρ=
P
V
思考1:如何形象的描述概率密度呢?
思考2:概率密度分布图中小点代表什么含义?
小点不是电子本身,小点是1s电子在原子核外出现的概率密度的形象描述。小点越密,表明概率密度越大(电子出现的几率越大)。
图1-7 氢原子1s电子在原子核外出现的概率密度分布图
1、概率密度(ρ)
—概率密度分布图
小黑点不表示电子,只表示电子在这里出现过一次。小黑点的疏密表示电子在核外空间内出现的机会的多少。
四、电子云与原子轨道
1、概率密度(ρ)
由于核外电子的概率密度分布看起来像一片云雾,因而被形象地称作电子云。
电子云是处于一定空间运动状态的电子在原子核外空间的概
率密度分布的形象化描述。不代表电子的运动轨迹。
四、电子云与原子轨道
2、电子云
(1)含义:
电子云图很形象直观,但是很难绘制,使用不便,我们常使用电子云轮廓图
电子云:只是形象地表示电子出现在各点的概率高低,而实际上并不存在。
3、电子云轮廓图
(2)如何绘制电子云轮廓图:
(1)绘制目的:
表示电子云轮廓的形状,对核外电子的空间运动状态有一个形象化的简便描述。
把电子在原子核外空间出现概率P=90%的空间圈出来。
四、电子云与原子轨道
电子云轮廓图的绘制过程
球形轮廓图
x
y
z
(3)电子云形状:
球形
哑铃形
1
3、电子云轮廓图
四、电子云与原子轨道
s电子云
3、电子云轮廓图
所有原子的任一能层的s电子的电子云轮廓图都是一个球形,只是球的半径不同。
同一原子的能层越高,s电子云半径越大。由于电子能量依次增高,电子在离核更
远的区域出现的概率逐渐增大,电子云越来越向更大的空间扩展。
s电子云只有一种空间伸展方向。
①s电子云—球形
图1-9 同一原子的s电子的电子云轮廓图
四、电子云与原子轨道
p电子云
3、电子云轮廓图
②p电子云—哑铃形
p电子云轮廓图是哑铃形或纺锤形。能层序数越大,p电子云半径越大。
无论2p、3p还是4p…..都有3个相互垂直的电子云(3种空间伸展方向),分别称为
Px、Py、Pz,右下标x、y、z分别是p电子云在直角坐标系里的取向。
同一能层中px、py、pz的能量相同,即Epx=Epy =Epz
除s电子云外,其他电子云轮廓图都不是球形的。
图1-11 2px、2py 、2pz电子云轮廓图
③d电子云——花瓣形或双哑铃形。
有5种空间伸展方向,
分别用dxy,dxz,dyz , dx2-y2,dz2表示。
④f 电子云轮廓图有7种空间伸展方向。
四、电子云与原子轨道
3、电子云轮廓图
量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。
四、电子云与原子轨道
4、原子轨道
常用电子云轮廓图的形状和取向来表示原子轨道的形状和取向。
各能级的一个伸展方向的电子云轮廓图即表示一个原子轨道。
(3)原子轨道的形状:
①s电子的原子轨道呈球形。只有一种空间伸展方向, 所以s能级只有1个原子轨道。
能层序数越大,原子轨道的半径越大。
②p电子的原子轨道呈哑铃形。有3种空间伸展方向, 所以p能级有3个原子轨道。
③d电子的原子轨道呈花瓣形或双哑铃形。有5种空间伸展方向,所以d能级有5个原子轨道。
④f 电子有7种空间伸展方向,所以f能级有7个原子轨道。
(1)定义:
(2)表示:
能层 能级 原子轨道数 原子轨道名称 原子轨道的形状和取向 K 1s 1 1s 球形 ——
L 2s 1 2s 球形 ——
2p 3 2px、2py、2pz 哑铃形 互相垂直
M 3s 1 3s 球形 ——
3p 3 3px、3py、3pz 哑铃形 互相垂直
3d 5 …… …… ……
N 4s 1 4s 球形 ——
4p 3 4px、4py、4pz 哑铃形 互相垂直
4d 5 …… …… …...
4f 7 …… …… ……
(4)不同能层的能级、原子轨道数、原子轨道名称以及形状和取向
原子轨道数与能层序数(n)的关系:原子轨道数目=n2。
四、电子云与原子轨道
小结:原子轨道与能层序数的关系
1.不同能层的同种能级的原子轨道形状 ,只是 不同。能层序数n越大,原子轨道的半径越 。
2.s能级只有 个原子轨道。p能级有 个原子轨道,它们互相垂直,分别以px、py、pz表示。在同一能层中px、py、pz的能量 。
3.原子轨道数与能层序数(n)的关系:原子轨道数=n2
相同
半径
大
1
3
相同
四、电子云与原子轨道
微观粒子可视化1: 1s~2p原子轨道
四、电子云与原子轨道
4、原子轨道
微观粒子可视化2: 1s~2p原子轨道的叠加
四、电子云与原子轨道
4、原子轨道
应用体验
1.正误判断
(1)电子的运动与行星相似,围绕原子核在固定轨道上高速旋转( )
(2)1s电子云示意图中一个小点表示一个自由运动的电子( )
(3)从空间角度看,2s轨道比1s轨道大,其空间包含了1s轨道( )
(4)2p、3p、4p能级的轨道数依次增多( )
(5)2px、2py、2pz轨道相互垂直,但能量相等( )
×
×
√
×
√
四、电子云与原子轨道
1.如图甲是氢原子的1s电子云图(即概率密度分布图),图乙、丙分别表示s、p能级的电子云轮廓图。下列有关说法正确的是( )
A.电子云图(即概率密度分布图)就是原子轨道图
B.3p2表示3p能级中有两个原子轨道
C.由图乙可知,s能级的电子云轮廓图呈圆形,有无数条对称轴
D.由图丙可知,p能级的原子轨道图呈哑铃形,且有3个伸展方向
【解析】选D。电子云轮廓图与电子云图不是同一个概念,而是我们常说的原子轨道图,A项错误;3p2表示3p能级中容纳了两个电子,B项错误;s能级的电子云轮廓图呈球形而不是圆形,C项错误;p能级的原子轨道图呈哑铃形,有px、py、pz三个伸展方向,并且互相垂直,D项正确。
四、电子云与原子轨道
2.下列说法中正确的是( )
A.1s电子云呈球形,表示电子绕原子核做圆周运动
B.电子云图中的小黑点密度大,说明该原子核外空间电子数目多
C.3d3表示3d能级有3个轨道
D.ns能级的原子轨道图可表示为
【解析】选D。电子云表示电子在核外空间某处出现的机会,不代表电子的运动轨迹,故A错误;小黑点的疏密表示电子出现机会的多少,密则机会大,疏则机会小,故B错误;3d3表示3d能级有3个电子,故C错误;ns能级的电子云呈球形,所以可以用该图表示该能级的原子轨道,故D正确。
四、电子云与原子轨道
3.下列有关说法正确的是( )
A.每个能层s能级的原子轨道的形状相同,能层序数越大,轨道半径越大,电子能量越高
B.原子核外电子云是核外电子运动后留下的痕迹
C.教材中说“核外电子的概率密度分布看起来像一片云雾,因而被形象地称作电子云”,这说明原子核外电子云是实际存在的
D.每个能层都有p能级,p能级都有3个原子轨道
【解析】选A。每个能层s能级的原子轨道的形状相同,能层序数越大,轨道半径越大,电子能量越高,故A正确;电子云表示的是电子在核外某处出现的概率,不是电子运动后留下的痕迹,故B错误;电子云是电子在核外运动的概率密度分布的形象化描述,实际不存在,故C错误;第一能层没有p能级,故D错误。
四、电子云与原子轨道
4.下列对核外电子运动状态的描述正确的是( )
A.电子的运动与行星的运动相似,围绕原子核在固定的轨道上高速旋转
B.能层数为3时,有3s、3p、3d、3f四个轨道
C.氢原子中只有一个电子,故氢原子只有一个轨道
D.在同一能级上运动的电子,其运动状态肯定不同
【解析】选D。电子运动不是围绕原子核在固定的轨道上高速旋转,只是在某个区域出现的概率大些,故A错误;能层数为3时,只有3s、3p、3d轨道,故B错误;氢原子有多个轨道,只有一个轨道上有电子,其他轨道为空轨道,故C错误;同一能级上的同一轨道上最多排两个电子,两个电子的自旋方向不同,则其运动状态肯定不同,所以在同一能级上运动的电子,其运动状态肯定不同,故D正确。
四、电子云与原子轨道
