专题1 有机化学的发展及研究思路 单元测试(含解析) 2022-2023学年化学高二下学期苏教版(2019)选择性必修3
文档属性
| 名称 | 专题1 有机化学的发展及研究思路 单元测试(含解析) 2022-2023学年化学高二下学期苏教版(2019)选择性必修3 |  | |
| 格式 | docx | ||
| 文件大小 | 670.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-27 11:45:12 | ||
图片预览


文档简介
专题1《有机化学的发展及研究思路》单元测试卷
一、单选题
1.中国女药学家屠呦呦因发现青蒿素(分子式为C15H22O5)对疟疾的治疗作用而成为2015年诺贝尔生理学或医学奖获得者之一、下列说法不正确的是
A.利用青蒿研究青蒿素结构的基本步骤:元素分析确定结构式→测定相对分子质量确定分子式→波谱分析确定实验式
B.青蒿素属于有机物
C.人工合成青蒿素经过了长期的实验研究,实验是化学研究的重要手段
D.现代化学分析测试中,可用元素分析仪确定青蒿素中的C、H、O元素
2.随着科学技术的发展,人们可以利用很多先进的方法和手段来测定有机物的组成和结构。下列说法正确的是
A.李比希元素分析仪可以测定有机物的结构简式
B.质谱仪能根据最小的碎片离子确定有机物的相对分子质量
C.红外光谱分析能测出各种化学键和官能团
D.核磁共振氢谱只能推测出有机物分子中氢原子的种类
3.下列四种变化中,有一种变化与其他三种变化类型不同的是
A.CH4 + Cl2CH3Cl + HCl
B.CH3CH2OH + HBrCH3CH2Br + H2O
C.CH3CH2CH2Br + NaOHCH3CH=CH2↑+ NaBr + H2O
D.CH3COOCH2CH3+NaOHCH3COONa+C2H5OH
4.下列反应中,属于加成反应的是 ( )
A.CH3-CH3+Br2CH3-CH2Br+HBr
B.2CH3CHO+O22CH3COOH
C.CH3-CH=CH2+Br2→CH3-CHBr-CH2Br
D.+Br2+HBr
5.将某有机化合物M在足量氧气中完全燃烧,生成和。下列有关M的说法正确的是
A.属于烯烃 B.不含O元素
C.分子式可能为 D.相对分子质量一定为30
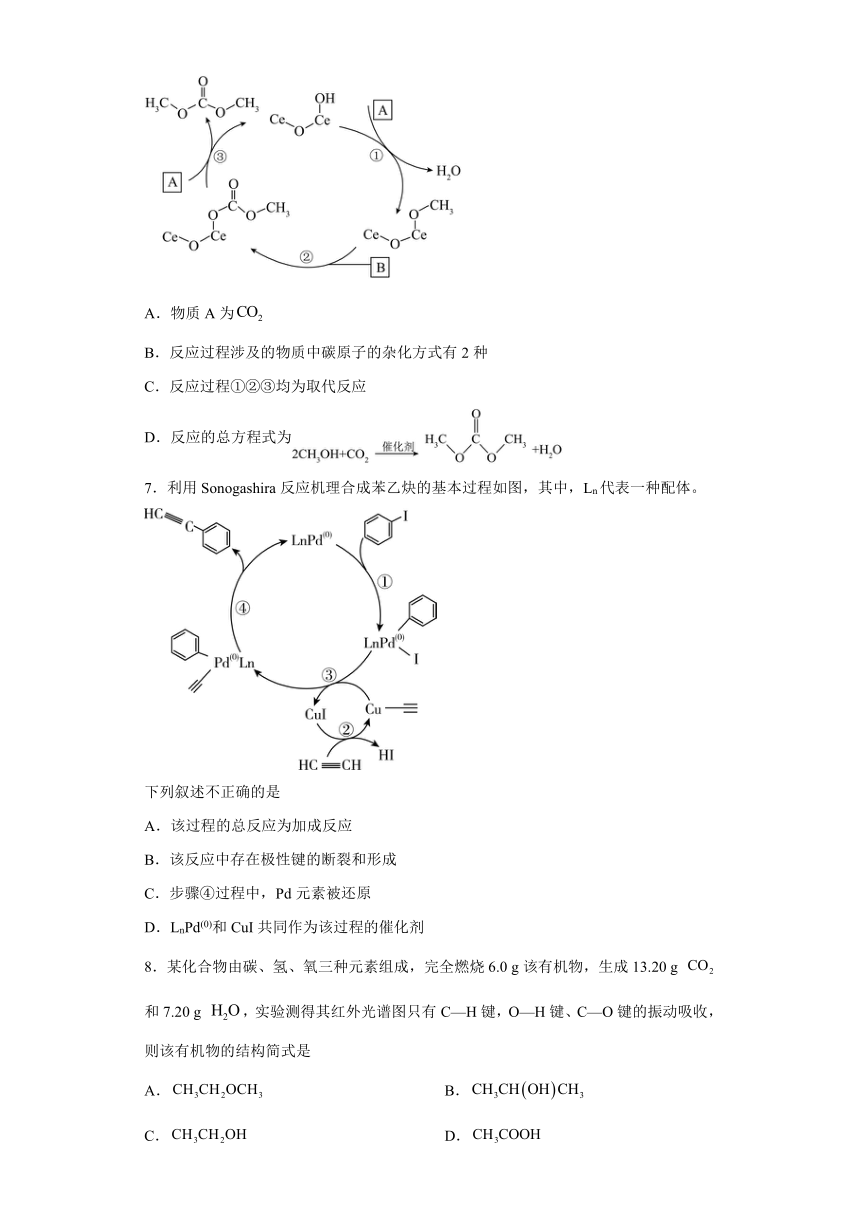
6.含铈(Ce)催化剂催化与甲醇反应的催化循环原理如图所示。下列说法正确的是
A.物质A为
B.反应过程涉及的物质中碳原子的杂化方式有2种
C.反应过程①②③均为取代反应
D.反应的总方程式为
7.利用Sonogashira反应机理合成苯乙炔的基本过程如图,其中,Ln代表一种配体。
下列叙述不正确的是
A.该过程的总反应为加成反应
B.该反应中存在极性键的断裂和形成
C.步骤④过程中,Pd元素被还原
D.LnPd(0)和CuI共同作为该过程的催化剂
8.某化合物由碳、氢、氧三种元素组成,完全燃烧6.0 g该有机物,生成13.20 g 和7.20 g ,实验测得其红外光谱图只有C—H键,O—H键、C—O键的振动吸收,则该有机物的结构简式是
A. B.
C. D.
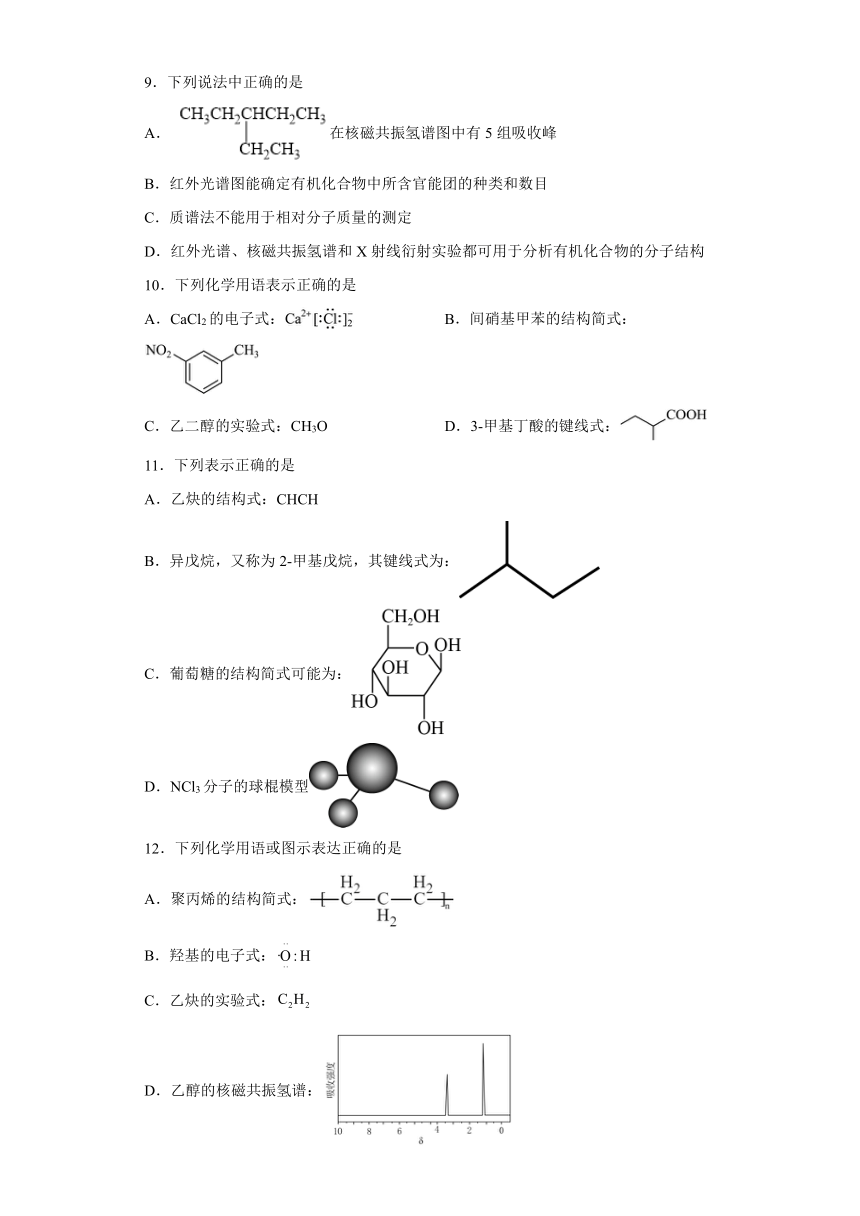
9.下列说法中正确的是
A. 在核磁共振氢谱图中有5组吸收峰
B.红外光谱图能确定有机化合物中所含官能团的种类和数目
C.质谱法不能用于相对分子质量的测定
D.红外光谱、核磁共振氢谱和X射线衍射实验都可用于分析有机化合物的分子结构
10.下列化学用语表示正确的是
A.CaCl2的电子式: B.间硝基甲苯的结构简式:
C.乙二醇的实验式:CH3O D.3-甲基丁酸的键线式:
11.下列表示正确的是
A.乙炔的结构式:CHCH
B.异戊烷,又称为2-甲基戊烷,其键线式为:
C.葡萄糖的结构简式可能为:
D.NCl3分子的球棍模型
12.下列化学用语或图示表达正确的是
A.聚丙烯的结构简式:
B.羟基的电子式:
C.乙炔的实验式:
D.乙醇的核磁共振氢谱:
13.分析下表中各项的排布规律,按此规律排布第26项应为
1 2 3 4 5 6 7 8 9 10 …
…
A. B.
C. D.
14.下列化学用语不正确的是 ( )
A.S2-的结构示意图: B.中子数为7的氮原子N
C.葡萄糖分子的实验式:CH2O D.乙炔的结构式:H-C≡C-H
15.按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物:
下列各步实验操作原理与方法错误的是
A B C D
步骤① 步骤② 步骤③ 步骤④
A.A B.B C.C D.D
二、填空题
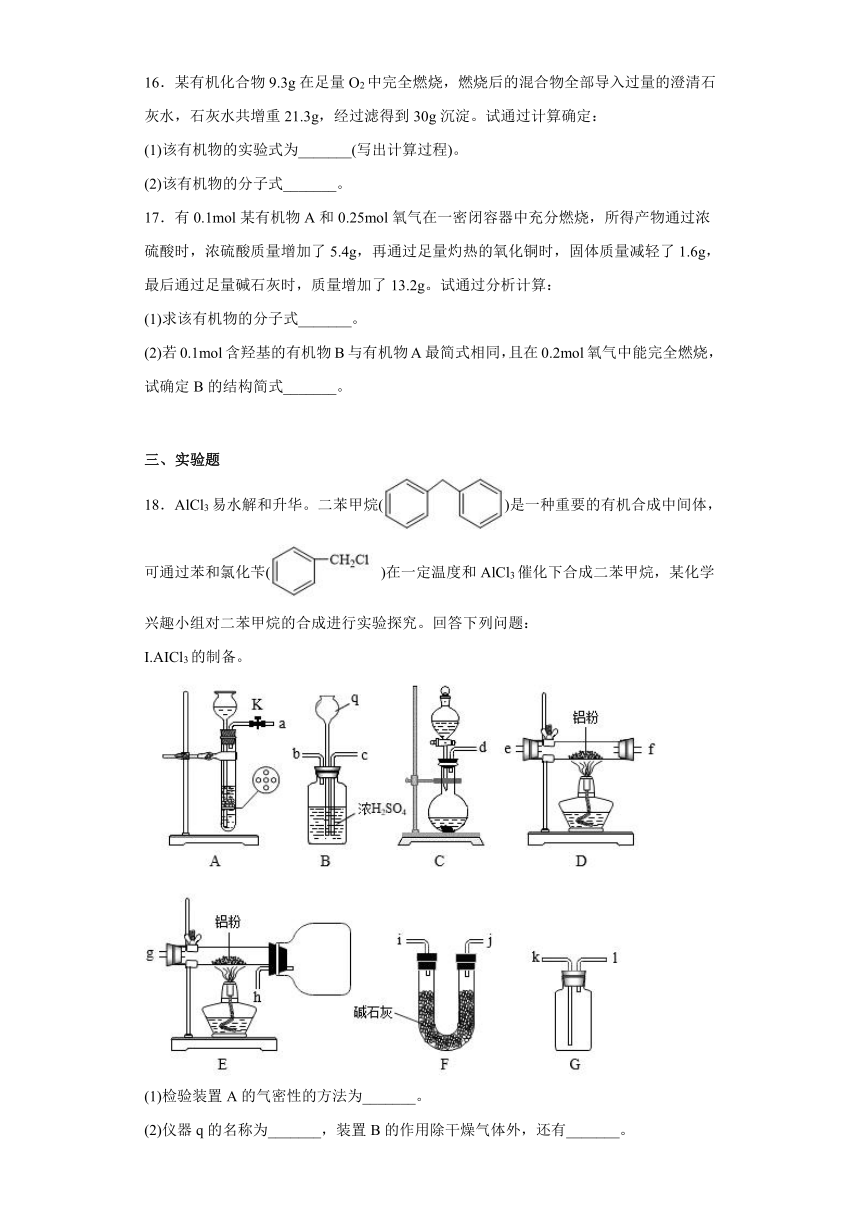
16.某有机化合物9.3g在足量O2中完全燃烧,燃烧后的混合物全部导入过量的澄清石灰水,石灰水共增重21.3g,经过滤得到30g沉淀。试通过计算确定:
(1)该有机物的实验式为_______(写出计算过程)。
(2)该有机物的分子式_______。
17.有0.1mol某有机物A和0.25mol氧气在一密闭容器中充分燃烧,所得产物通过浓硫酸时,浓硫酸质量增加了5.4g,再通过足量灼热的氧化铜时,固体质量减轻了1.6g,最后通过足量碱石灰时,质量增加了13.2g。试通过分析计算:
(1)求该有机物的分子式_______。
(2)若0.1mol含羟基的有机物B与有机物A最简式相同,且在0.2mol氧气中能完全燃烧,试确定B的结构简式_______。
三、实验题
18.AlCl3易水解和升华。二苯甲烷()是一种重要的有机合成中间体,可通过苯和氯化苄( )在一定温度和AlCl3催化下合成二苯甲烷,某化学兴趣小组对二苯甲烷的合成进行实验探究。回答下列问题:
Ⅰ.AICl3的制备。
(1)检验装置A的气密性的方法为_______。
(2)仪器q的名称为_______,装置B的作用除干燥气体外,还有_______。
(3)选择上图中合适的装置,按气流从左到右的方向,合理的连接顺序为_______(填仪器接口小写字母);其中制备氯气反应的化学方程式为_______。
Ⅱ.合成二苯甲烷。
(4)如图所示,向三颈烧瓶中加入25.0mL苯(p=0.87g·cm-3)、20.0mL氯化苄(p=1.10g·cm-3)和适量AlCl3,控制温度为80℃左右,回流2h;冷却后依次用水、稀碱液、水洗涤,最后一次水洗的目的为_______;再经干燥、_______(填操作名称)分离出二苯甲烷。
(5)若分离所得二苯甲烷的质量为25.2g,则其产率为_______(保留两位有效数字)。
(6)设计实验证明合成二苯甲烷的反应为取代反应:_______。
19.(一)某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。
步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收。2.12g有机物X的蒸气氧化产生7.04g二氧化碳和1.80g水;
步骤二:通过仪器分析得知X的相对分子质量为106;
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2:3(如图I)
步骤四:利用红外光谱仪测得X分子的红外光谱如图II,试回答:
(1)步骤二中的仪器分析方法称为_______。
(2)X的分子式为_______;X的结构简式为_______。
(二)溴乙烷性质的探究:
用如图实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:
I:在试管中加入10 mL 6mol/L NaOH溶液和2 mL 溴乙烷,振荡。
II:将试管如图固定后,水浴加热。
(3)观察到____现象时,表明溴乙烷与NaOH溶液已完全反应。
(4)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,将生成的气体通入如图装置。A试管中的水的作用是____,若无A试管,B试管中的试剂应为_____。
(三)某同学通过查阅资料后设计如图所示的装置制备粗溴苯。
(5)B中生成溴苯的化学方程式为_______。
(6)粗溴苯中含有FeBr3、Br2、苯、二溴苯等杂质,可经过几次洗涤后再用CaCl2处理,最后用蒸馏的方法就可得到ag精制溴苯。若实验中使用了20mL苯(密度为0.88g/mL),则苯的利用率为____(列出计算式即可)。
四、计算题
20.5.8g有机物在氧气中燃烧,只得到CO2和H2O(气),且二者体积比为1:1(同压同温),若把它们通过碱石灰,碱石灰增重18.6g。又知同量的有机物与0.1mol乙酸发生酯化反应,该有机物的蒸气对空气的相对密度为2。试通过计算写出:
(1)有机物的分子式_________________________________。
(2)该有机物的结构简式:__________________________。
21.0.2mol某有机物和0.4molO2在密闭容器中燃烧后,产物通过浓H2SO4后,浓H2SO4增重10.8g;通过灼热的CuO充分反应后,CuO失重3.2g;再将气体通入足量澄清石灰水,得到沉淀40g,无气体剩余。若已知等量该有机物与9.2gNa恰好完全反应,请回答:
(1)该有机物的结构简式是_______。
(2)写出该有机物的一种主要用途:_______。
试卷第2页,共8页
参考答案:
1.A
【详解】A.利用青蒿研究青蒿素结构的基本步骤为分离、提纯→元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式,A不正确;
B.青蒿素属于有机物,B正确;
C.实验是化学研究的重要手段之一,C正确;
D.现代化学分析测试中,可用元素分析仪确定青蒿素中的C、H、O元素,D正确;
故选答案A。
2.C
【详解】A.李比希的元素分析仪只能测定出元素种类,不能确定有机物的分子式,A错误;
B.质谱仪能根据最大的碎片离子确定有机物的相对分子质量,B错误;
C.不同的化学键或官能团吸收频率不同,在红外光谱图上将处于不同的位置,从而可以获得分子中含有任何化学键或官能团的信息,来确定有机物中的官能团或化学键,C正确;
D.核磁共振氢谱图中吸收峰的数目等于氢原子的种类数目,各峰的面积之比等于各类氢原子的数目之比,故核磁共振氢谱可以推测出有机物分子中氢原子的种类和各类氢原子的个数之比,D错误;
故答案为:C。
3.C
【详解】A.甲烷与氯气的反应为取代反应,与B、D反应类型相同,故A错误;
B.B为乙醇的卤代反应,卤代反应是取代反应的一种,与A、D反应类型相同,故B错误;
C.C为卤代烃的消去反应,与其他反应类型均不相同,故C正确;
D.D为酯的水解反应,水解反应属于取代反应,与A、B反应类型相同,故D错误。
答案选C。
4.C
【分析】
【详解】A.乙烷与溴在光照条件下的反应是取代反应,故A错误;
B.乙醛变乙酸是氧化反应,故B错误;
C.丙烯与溴的反应是加成反应,是烯烃的主要性质,故C正确;
D.苯和液溴在催化剂下的反应是取代反应,故D错误;
故选C。
5.C
【分析】3.0g某有机化合物M在足量氧气中完全燃烧,生成4.4gCO2和1.8gH2O,计算得n(CO2)= ,该物质中n(C)=0.1mol,m(C)=1.2g;n(H2O)= ,n(H)=0.2mol,m(H)=0.2g。M的质量为3.0g=m(H)+m(O)+m(C)则m(O)=1.6g,则n(O)=0.1mol。C、H、O物质的量之比为1:2:1,则M的最简式为CH2O。
【详解】A.该物质中含O,不属于烃类,A项错误;
B.由上述计算得,该物质中含有O,B项错误;
C.M的最简式为CH2O,其分子式可能为CH2O,C项正确;
D.M的最简式为CH2O,相对分子质量为30n(n≥1),D项错误;
故选C。
6.D
【分析】根据质量守恒,推出A为CH3OH,B为CO2,据此分析;
【详解】A.根据质量守恒,推出A为CH3OH,故A错误;
B.CO2中的C原子杂化类型为sp,甲基中的C原子杂化类型为sp3, 中的碳原子杂化类型为sp2,因此反应过程中涉及的物质中碳原子的杂化方式有3种,故B错误;
C.根据反应过程可知,反应①③为取代反应,反应②为加成反应,故C错误;
D.根据反应过程可知,CO2、CH3OH为反应物,碳酸二乙酯和水为生成物,因此总反应方程式为CO2+2CH3OH +H2O,故D正确;
故答案为D。
7.A
【详解】A.由图可知,反应为乙炔和生成苯乙炔和HI的反应,反应为取代反应,选项A错误;
B.该反应中存在碳氢键的断裂、氢碘键的形成,故存在极性键的断裂和形成,选项B正确;
C.步骤④过程中,Pd的化合价由+2变为0,化合价降低,元素被还原,选项C正确;
D.由图可知,LnPd(0)和CuI共同作为该过程的催化剂,选项D正确。
故选A。
8.B
【分析】根据碳原子守恒有,,根据质量守恒可知,该有机物中,,则该有机物中C、H、O原子数目比为3:8:1。
【详解】A. 的C、H、O原子数目比为3:8:1,分子中含有C—H键,C—O键,但不含O—H键,故A不符合题意;
B. 的C、H、O原子数目比为3:8:1,分子中含有C—H键,O—H键、C—O键,故B符合题意;
C. 的C、H、O原子数目比为2:6:1,故C不符合题意;
D. 的C、H、O原子数目比为1:2:1,故D不符合题意;
答案选B。
9.D
【详解】A.有3种等效氢,在核磁共振氢谱图中有3组吸收峰,故A错误;
B.红外光谱图只能确定有机物中所含官能团的种类,不能确定有机物的官能团的数目,故B错误;
C.质谱法用于相对分子质量的测定,故C错误;
D.红外光谱确定官能团种类、核磁共振氢谱用于确定分子中氢原子种类及相对个数,X射线衍射实验可确定分子的空间结构,所以都可用于分析有机化合物的分子结构,故D正确;
10.C
【详解】A.CaCl2是离子化合物,由钙离子和氯离子构成,其电子式为:,故A错误;
B.间硝基甲苯中,甲基和硝基位于苯环的间位,且硝基上的氮原子与苯环上的C原子相连,结构简式为:,故B错误;
C.乙二醇的结构简式为HOCH2CH2OH,分子式为C2H6O2,实验式为:CH3O,故C正确;
D.3-甲基丁酸中含有羧基的最长链为主链,主链上4个碳原子,从羧基上的碳开始编号,三号碳上含有一个甲基,则键线式为:,故D错误;
答案选C。
11.C
【详解】A.乙炔的结构式为H—C≡C—H,选项A错误;
B.异戊烷分子中最长碳链含有4个碳原子,侧链为甲基,又称为2—甲基丁烷,选项B错误;
C.葡萄糖的结构简式为HOCH2 (CHOH)4CHO,分子中的HOCH2—能与—CHO发生加成反应转化为,选项C正确;
D.Cl原子的半径大于N原子半径,NCl3分子的球棍模型是 ,选项D正确;
答案选C。
12.B
【详解】A.丙烯的结构简式为CH3-CH=CH2,发生加聚反应生成聚丙烯,则聚丙烯的结构简式为,A项错误;
B.羟基的结构式为-OH,O原子最外层电子数为6,则羟基的电子式为,B项正确;
C.乙炔的分子式为C2H2,则乙炔的实验式(最简式)为CH,C项错误;
D.乙醇的结构简式为,乙醇分子中的等效氢原子有3种,则核磁共振氢谱有三组吸收峰,且氢原子的比值为3:2:1,则核磁共振氢谱吸收峰的峰面积比值为3:2:1,D项错误;
答案选B。
13.C
【详解】表中物质的排布规律为4个一组,碳原子数不变,属于不同类别。第26种物质对应表中第2种物质类别且比第2种物质中碳原子数多6个,故该有机物为,故C正确。
故选C。
14.A
【详解】A.硫元素是16号元素,质子数为16,原子核内数据不对,应为+16,A项符合题意;
B.氮元素为7号元素,质子数为7,中子数为7,则质量数=质子数+中子数=7+7=14,B项不符合题意;
C.葡萄糖的分子式为C6H12O6,实验式即为最简式,化简后可得:CH2O,C项不符合题意;
D.乙炔的分子式为C2H2,有一个碳碳三键,所以结构式为:,D项不符合题意;
故正确选项为A
15.C
【分析】样品粉末用甲苯和甲醇溶解,并过滤得到滤液,滴加硝酸钠溶液分液得到水层溶液,蒸发结晶得到固体粗产品,有机层溶液蒸馏得到甲苯,据此判断。
【详解】A.步骤①为分离固体与液体混合物的操作,应使用过滤装置,故A正确;
B.步骤②是将互不相溶的有机层与水溶液层分离,应使用分液操作,故B正确;
C.步骤③是从水溶液中提取溶质,应使用蒸发操作,不能用坩埚,故C错误;
D.步骤④是从有机溶液中分离出溶剂,应使用蒸馏操作,故D正确;
故选C。
16.(1)CH3O
(2)C2H6O2
【解析】(1)
由碳原子守恒:;
根据质量守恒:,,根据质量守恒:;
所以该有机物的实验式:CH3O;
(2)
实验式为CH3O,分子式中C原子个数为1时,无满足条件的分子式;C原子个数为2时,分子式为C2H6O2;当C原子个数为3时,最多有8个氢原子,而按比例算出的氢原子个数为9,不符合,同理碳原子个数大于3时都不满足,故分子式:C2H6O2。
17.
【分析】根据浓硫酸能吸收水判断,浓硫酸增重的质量即是水的质量,通过足量灼热的氧化铜,固体质量减小,说明燃烧时产生了一氧化碳气体,最后通入足量碱石灰,质量增加说明含有二氧化碳气体。
【详解】(1)根据浓硫酸增重的质量5.4克计算:,根据通过足量灼热的氧化铜时,固体质量减轻了1.6g,计算: ,,再根据通过足量碱石灰时,质量增加了13.2g,进行计算:,故原0.1mol有机物燃烧中生成的二氧化碳的物质的量为:0.3-0.1=0.2mol。氧原子守恒得,该有机物含有的氧原子的物质的量为:0.3+0.1+0.2×2-0.25×2=0.3mol,故该有机物的碳与氢原子的物质的量之比为:(0.1+0.2):0.3×2:0.3=3:6:3;根据0.1mol该有机物燃烧,故该有机物的分子式为;
(2) 有机物B与有机物A最简式相同,故最简式为:CH2O,假设该有机物的化学式为
(CH2O)n,根据燃烧方程式:,n=2,故化学式为C2H4O2根据含有1个羟基进行判断结构简式为:。
【点睛】注意燃烧过程中,完全燃烧生产二氧化碳和水,充分燃烧是指反应物完全反应,但燃烧时由于未完全燃烧产生一氧化碳。
18. 关闭K,向长颈漏斗中加水至液面高出试管中液面,一段时间后,液面差不变,说明装置A气密性良好 长颈漏斗 平衡压强并检验后续装置是否发生堵塞 dcbghji(ij) 2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O 除去过量的碱液和生成的盐 过滤、蒸馏 86% 将合成二苯甲烷后的尾气通入AgNO3溶液中,若产生白色沉淀,则证明合成二苯甲烷的反应为取代反应
【分析】根据装置特点选择合适的方法检查气密性;根据装置构造分析装置用途;根据实验的流畅选择合适的安装顺序;根据反应方程式计算理论产量并计算产率;根据反应产物的性质,判断反应类型。
【详解】Ⅰ.(1)检验装置A的气密性的方法为关闭K,向长颈漏斗中加水至液面高出试管中液面,一段时间后,液面差不变,则装置气密性良好。
(2)由装置图知,仪器q的名称为长颈漏斗,装置B的作用除干燥气体外,还有平衡压强并检验后续装置是否发生堵塞。
(3)由实验目的和原理知,C可用于制备Cl2,B可用于干燥Cl2,E为Cl2与铝粉反应和收集AlCl3的装置,F用于尾气吸收和防止空气进入E导致AlCl3变质,故所选装置合理的连接顺序为 dcbghji(ij);由KMnO4与浓盐酸制备氯气反应的化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
Ⅱ.(4)由原理知,第一次水洗的目的是除去AlCl3和一定量HCl,稀碱液洗涤的目的是除去残留的HCl,最后一次水洗的目的是除去过量的碱液和生成的盐。粗品经干燥、(过滤、)蒸馏分离出二苯甲烷。
(5)苯的物质的量为 ,氯化苄的物质的量为 ,苯过量,则二苯甲烷的理论产量为29.2g,产率为 。
(6)合成二苯甲烷的反应若为取代反应,可通过检验产物中生成的HCl证明,方案为将合成二苯甲烷后的尾气通入AgNO3溶液中,若产生白色沉淀,则证明该反应为取代反应。
19. 质谱法 C8H10 液体不分层 吸收乙醇 溴水 +Br2+HBr
【详解】(1)步骤二通过仪器分析得知X的相对分子质量,该方法称为质谱法,故答案为:质谱法;
(2)烃X的物质的量为 = 0.02mol,生成二氧化碳为 = 0.16mol,生成水为= 0.1mol,则分子中N(C) == 8、N(H) ==10,故X的分子式为C8H10,X的红外光谱测定含有苯环,属于苯的同系物,而H核磁共振谱有2个峰,其面积之比为2:3,则X为;故答案为:C8H10;;
(3) 溴乙烷不溶于水,与氢氧化钠溶液混合后分层,溴乙烷在碱性条件下水解生成乙醇和溴化钠,二者都易溶于水,如果液体不分层,说明溴乙烷与NaOH溶液已完全反应,故答案为:液体不分层;
(4)乙醇具有还原性,能使高锰酸钾褪色,为防止乙醇对乙烯检验的干扰,应用A吸收乙醇,若高锰酸钾褪色,则证明乙烯的存在,说明证明溴乙烷在NaOH乙醇溶液中发生的是消去反应;乙醇与溴水不反应,乙烯与溴水发生加成反应使溴水褪色,若无A试管,B试管中的试剂应为溴水,如果溴水褪色,则证明乙烯的存在,说明证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,故答案为:吸收乙醇;溴水;
(5) 生成溴苯的化学方程式为: +Br2+HBr;故答案为:+Br2+HBr;
(6)苯的利用率= =,故答案为:;
20.(1)C3H6O
(2)CH2=CH-CH2OH
【分析】该有机物对空气的相对密度为2,则有机物相对分子质量=29×2=58,5.8g有机物的物质的量为0.1mol,燃烧生成CO2和H2O气且体积比为1:1,碱石灰在增加18.6g为CO2和H2O的质量,计算二者物质的量,根据原子守恒计算分子中C、H原子数目,再根据相对分子质量计算O原子数目,进而确定有机物分子式,同量的有机物与0.1mol乙酸完全发生酯化反应,则有机物分子含有1个-OH,结合有机物分子式确定其结构简式。
【详解】(1)该有机物对空气的相对密度为2,则有机物相对分子质量=29×2=58;5.8g有机物的物质的量为=0.1mol,燃烧生成CO2和H2O气且体积比为1:1,碱石灰在增加18.6g为CO2和H2O的质量,则n(CO2)=n(H2O)==0.3mol,则有机物分子中N(C)==3、N(H)= =6、N(O)==1,故有机物分子式为C3H6O;
故答案为:C3H6O;
(2)同量的有机物与0.1mol乙酸完全发生酯化反应,则有机物分子含有1个-OH,有机物分子式为C3H6O,含有1个碳碳双键,故其结构简式为CH2=CH-CH2OH;
故答案为:CH2=CH-CH2OH;
21.(1)CH2OHCH2OH
(2)汽车发动机的抗冻剂、生产聚酯纤维、合成涤纶等
【解析】(1)
浓H2SO4增重10.8g,说明反应产物中含水10.8g,水的物质的量为,通过灼热的CuO充分反应后,CuO失重3.2g,失去的重量为氧化铜中氧的质量,则氧化铜中氧的物质的量为,故CO的物质的量也为0.2mol,根据碳元素守恒可知CO与CuO反应生成的CO2的物质的量为0.2mol,将与氧化铜反应后的气体通入足量澄清石灰水,得到沉淀40g,沉淀的物质的量为,则有机物燃烧产生的CO2的物质的量为0.4mol-0.2mol=0.2mol,则有机物分子中,,,所以有机物的分子式为:C2H6O2,等量该有机物与9.2gNa恰好完全反应, 9.2gNa的物质的量为0.4mol,0.2mol该有机物与0.4mol钠恰好反应,说明有机物中含有2个羟基,该有机物的结构简式为CH2OHCH2OH;
(2)
根据(1)可知,该有机物为乙二醇,乙二醇的用途主要有:汽车发动机的抗冻剂、生产聚酯纤维、合成涤纶等
一、单选题
1.中国女药学家屠呦呦因发现青蒿素(分子式为C15H22O5)对疟疾的治疗作用而成为2015年诺贝尔生理学或医学奖获得者之一、下列说法不正确的是
A.利用青蒿研究青蒿素结构的基本步骤:元素分析确定结构式→测定相对分子质量确定分子式→波谱分析确定实验式
B.青蒿素属于有机物
C.人工合成青蒿素经过了长期的实验研究,实验是化学研究的重要手段
D.现代化学分析测试中,可用元素分析仪确定青蒿素中的C、H、O元素
2.随着科学技术的发展,人们可以利用很多先进的方法和手段来测定有机物的组成和结构。下列说法正确的是
A.李比希元素分析仪可以测定有机物的结构简式
B.质谱仪能根据最小的碎片离子确定有机物的相对分子质量
C.红外光谱分析能测出各种化学键和官能团
D.核磁共振氢谱只能推测出有机物分子中氢原子的种类
3.下列四种变化中,有一种变化与其他三种变化类型不同的是
A.CH4 + Cl2CH3Cl + HCl
B.CH3CH2OH + HBrCH3CH2Br + H2O
C.CH3CH2CH2Br + NaOHCH3CH=CH2↑+ NaBr + H2O
D.CH3COOCH2CH3+NaOHCH3COONa+C2H5OH
4.下列反应中,属于加成反应的是 ( )
A.CH3-CH3+Br2CH3-CH2Br+HBr
B.2CH3CHO+O22CH3COOH
C.CH3-CH=CH2+Br2→CH3-CHBr-CH2Br
D.+Br2+HBr
5.将某有机化合物M在足量氧气中完全燃烧,生成和。下列有关M的说法正确的是
A.属于烯烃 B.不含O元素
C.分子式可能为 D.相对分子质量一定为30
6.含铈(Ce)催化剂催化与甲醇反应的催化循环原理如图所示。下列说法正确的是
A.物质A为
B.反应过程涉及的物质中碳原子的杂化方式有2种
C.反应过程①②③均为取代反应
D.反应的总方程式为
7.利用Sonogashira反应机理合成苯乙炔的基本过程如图,其中,Ln代表一种配体。
下列叙述不正确的是
A.该过程的总反应为加成反应
B.该反应中存在极性键的断裂和形成
C.步骤④过程中,Pd元素被还原
D.LnPd(0)和CuI共同作为该过程的催化剂
8.某化合物由碳、氢、氧三种元素组成,完全燃烧6.0 g该有机物,生成13.20 g 和7.20 g ,实验测得其红外光谱图只有C—H键,O—H键、C—O键的振动吸收,则该有机物的结构简式是
A. B.
C. D.
9.下列说法中正确的是
A. 在核磁共振氢谱图中有5组吸收峰
B.红外光谱图能确定有机化合物中所含官能团的种类和数目
C.质谱法不能用于相对分子质量的测定
D.红外光谱、核磁共振氢谱和X射线衍射实验都可用于分析有机化合物的分子结构
10.下列化学用语表示正确的是
A.CaCl2的电子式: B.间硝基甲苯的结构简式:
C.乙二醇的实验式:CH3O D.3-甲基丁酸的键线式:
11.下列表示正确的是
A.乙炔的结构式:CHCH
B.异戊烷,又称为2-甲基戊烷,其键线式为:
C.葡萄糖的结构简式可能为:
D.NCl3分子的球棍模型
12.下列化学用语或图示表达正确的是
A.聚丙烯的结构简式:
B.羟基的电子式:
C.乙炔的实验式:
D.乙醇的核磁共振氢谱:
13.分析下表中各项的排布规律,按此规律排布第26项应为
1 2 3 4 5 6 7 8 9 10 …
…
A. B.
C. D.
14.下列化学用语不正确的是 ( )
A.S2-的结构示意图: B.中子数为7的氮原子N
C.葡萄糖分子的实验式:CH2O D.乙炔的结构式:H-C≡C-H
15.按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物:
下列各步实验操作原理与方法错误的是
A B C D
步骤① 步骤② 步骤③ 步骤④
A.A B.B C.C D.D
二、填空题
16.某有机化合物9.3g在足量O2中完全燃烧,燃烧后的混合物全部导入过量的澄清石灰水,石灰水共增重21.3g,经过滤得到30g沉淀。试通过计算确定:
(1)该有机物的实验式为_______(写出计算过程)。
(2)该有机物的分子式_______。
17.有0.1mol某有机物A和0.25mol氧气在一密闭容器中充分燃烧,所得产物通过浓硫酸时,浓硫酸质量增加了5.4g,再通过足量灼热的氧化铜时,固体质量减轻了1.6g,最后通过足量碱石灰时,质量增加了13.2g。试通过分析计算:
(1)求该有机物的分子式_______。
(2)若0.1mol含羟基的有机物B与有机物A最简式相同,且在0.2mol氧气中能完全燃烧,试确定B的结构简式_______。
三、实验题
18.AlCl3易水解和升华。二苯甲烷()是一种重要的有机合成中间体,可通过苯和氯化苄( )在一定温度和AlCl3催化下合成二苯甲烷,某化学兴趣小组对二苯甲烷的合成进行实验探究。回答下列问题:
Ⅰ.AICl3的制备。
(1)检验装置A的气密性的方法为_______。
(2)仪器q的名称为_______,装置B的作用除干燥气体外,还有_______。
(3)选择上图中合适的装置,按气流从左到右的方向,合理的连接顺序为_______(填仪器接口小写字母);其中制备氯气反应的化学方程式为_______。
Ⅱ.合成二苯甲烷。
(4)如图所示,向三颈烧瓶中加入25.0mL苯(p=0.87g·cm-3)、20.0mL氯化苄(p=1.10g·cm-3)和适量AlCl3,控制温度为80℃左右,回流2h;冷却后依次用水、稀碱液、水洗涤,最后一次水洗的目的为_______;再经干燥、_______(填操作名称)分离出二苯甲烷。
(5)若分离所得二苯甲烷的质量为25.2g,则其产率为_______(保留两位有效数字)。
(6)设计实验证明合成二苯甲烷的反应为取代反应:_______。
19.(一)某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。
步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收。2.12g有机物X的蒸气氧化产生7.04g二氧化碳和1.80g水;
步骤二:通过仪器分析得知X的相对分子质量为106;
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2:3(如图I)
步骤四:利用红外光谱仪测得X分子的红外光谱如图II,试回答:
(1)步骤二中的仪器分析方法称为_______。
(2)X的分子式为_______;X的结构简式为_______。
(二)溴乙烷性质的探究:
用如图实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:
I:在试管中加入10 mL 6mol/L NaOH溶液和2 mL 溴乙烷,振荡。
II:将试管如图固定后,水浴加热。
(3)观察到____现象时,表明溴乙烷与NaOH溶液已完全反应。
(4)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,将生成的气体通入如图装置。A试管中的水的作用是____,若无A试管,B试管中的试剂应为_____。
(三)某同学通过查阅资料后设计如图所示的装置制备粗溴苯。
(5)B中生成溴苯的化学方程式为_______。
(6)粗溴苯中含有FeBr3、Br2、苯、二溴苯等杂质,可经过几次洗涤后再用CaCl2处理,最后用蒸馏的方法就可得到ag精制溴苯。若实验中使用了20mL苯(密度为0.88g/mL),则苯的利用率为____(列出计算式即可)。
四、计算题
20.5.8g有机物在氧气中燃烧,只得到CO2和H2O(气),且二者体积比为1:1(同压同温),若把它们通过碱石灰,碱石灰增重18.6g。又知同量的有机物与0.1mol乙酸发生酯化反应,该有机物的蒸气对空气的相对密度为2。试通过计算写出:
(1)有机物的分子式_________________________________。
(2)该有机物的结构简式:__________________________。
21.0.2mol某有机物和0.4molO2在密闭容器中燃烧后,产物通过浓H2SO4后,浓H2SO4增重10.8g;通过灼热的CuO充分反应后,CuO失重3.2g;再将气体通入足量澄清石灰水,得到沉淀40g,无气体剩余。若已知等量该有机物与9.2gNa恰好完全反应,请回答:
(1)该有机物的结构简式是_______。
(2)写出该有机物的一种主要用途:_______。
试卷第2页,共8页
参考答案:
1.A
【详解】A.利用青蒿研究青蒿素结构的基本步骤为分离、提纯→元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式,A不正确;
B.青蒿素属于有机物,B正确;
C.实验是化学研究的重要手段之一,C正确;
D.现代化学分析测试中,可用元素分析仪确定青蒿素中的C、H、O元素,D正确;
故选答案A。
2.C
【详解】A.李比希的元素分析仪只能测定出元素种类,不能确定有机物的分子式,A错误;
B.质谱仪能根据最大的碎片离子确定有机物的相对分子质量,B错误;
C.不同的化学键或官能团吸收频率不同,在红外光谱图上将处于不同的位置,从而可以获得分子中含有任何化学键或官能团的信息,来确定有机物中的官能团或化学键,C正确;
D.核磁共振氢谱图中吸收峰的数目等于氢原子的种类数目,各峰的面积之比等于各类氢原子的数目之比,故核磁共振氢谱可以推测出有机物分子中氢原子的种类和各类氢原子的个数之比,D错误;
故答案为:C。
3.C
【详解】A.甲烷与氯气的反应为取代反应,与B、D反应类型相同,故A错误;
B.B为乙醇的卤代反应,卤代反应是取代反应的一种,与A、D反应类型相同,故B错误;
C.C为卤代烃的消去反应,与其他反应类型均不相同,故C正确;
D.D为酯的水解反应,水解反应属于取代反应,与A、B反应类型相同,故D错误。
答案选C。
4.C
【分析】
【详解】A.乙烷与溴在光照条件下的反应是取代反应,故A错误;
B.乙醛变乙酸是氧化反应,故B错误;
C.丙烯与溴的反应是加成反应,是烯烃的主要性质,故C正确;
D.苯和液溴在催化剂下的反应是取代反应,故D错误;
故选C。
5.C
【分析】3.0g某有机化合物M在足量氧气中完全燃烧,生成4.4gCO2和1.8gH2O,计算得n(CO2)= ,该物质中n(C)=0.1mol,m(C)=1.2g;n(H2O)= ,n(H)=0.2mol,m(H)=0.2g。M的质量为3.0g=m(H)+m(O)+m(C)则m(O)=1.6g,则n(O)=0.1mol。C、H、O物质的量之比为1:2:1,则M的最简式为CH2O。
【详解】A.该物质中含O,不属于烃类,A项错误;
B.由上述计算得,该物质中含有O,B项错误;
C.M的最简式为CH2O,其分子式可能为CH2O,C项正确;
D.M的最简式为CH2O,相对分子质量为30n(n≥1),D项错误;
故选C。
6.D
【分析】根据质量守恒,推出A为CH3OH,B为CO2,据此分析;
【详解】A.根据质量守恒,推出A为CH3OH,故A错误;
B.CO2中的C原子杂化类型为sp,甲基中的C原子杂化类型为sp3, 中的碳原子杂化类型为sp2,因此反应过程中涉及的物质中碳原子的杂化方式有3种,故B错误;
C.根据反应过程可知,反应①③为取代反应,反应②为加成反应,故C错误;
D.根据反应过程可知,CO2、CH3OH为反应物,碳酸二乙酯和水为生成物,因此总反应方程式为CO2+2CH3OH +H2O,故D正确;
故答案为D。
7.A
【详解】A.由图可知,反应为乙炔和生成苯乙炔和HI的反应,反应为取代反应,选项A错误;
B.该反应中存在碳氢键的断裂、氢碘键的形成,故存在极性键的断裂和形成,选项B正确;
C.步骤④过程中,Pd的化合价由+2变为0,化合价降低,元素被还原,选项C正确;
D.由图可知,LnPd(0)和CuI共同作为该过程的催化剂,选项D正确。
故选A。
8.B
【分析】根据碳原子守恒有,,根据质量守恒可知,该有机物中,,则该有机物中C、H、O原子数目比为3:8:1。
【详解】A. 的C、H、O原子数目比为3:8:1,分子中含有C—H键,C—O键,但不含O—H键,故A不符合题意;
B. 的C、H、O原子数目比为3:8:1,分子中含有C—H键,O—H键、C—O键,故B符合题意;
C. 的C、H、O原子数目比为2:6:1,故C不符合题意;
D. 的C、H、O原子数目比为1:2:1,故D不符合题意;
答案选B。
9.D
【详解】A.有3种等效氢,在核磁共振氢谱图中有3组吸收峰,故A错误;
B.红外光谱图只能确定有机物中所含官能团的种类,不能确定有机物的官能团的数目,故B错误;
C.质谱法用于相对分子质量的测定,故C错误;
D.红外光谱确定官能团种类、核磁共振氢谱用于确定分子中氢原子种类及相对个数,X射线衍射实验可确定分子的空间结构,所以都可用于分析有机化合物的分子结构,故D正确;
10.C
【详解】A.CaCl2是离子化合物,由钙离子和氯离子构成,其电子式为:,故A错误;
B.间硝基甲苯中,甲基和硝基位于苯环的间位,且硝基上的氮原子与苯环上的C原子相连,结构简式为:,故B错误;
C.乙二醇的结构简式为HOCH2CH2OH,分子式为C2H6O2,实验式为:CH3O,故C正确;
D.3-甲基丁酸中含有羧基的最长链为主链,主链上4个碳原子,从羧基上的碳开始编号,三号碳上含有一个甲基,则键线式为:,故D错误;
答案选C。
11.C
【详解】A.乙炔的结构式为H—C≡C—H,选项A错误;
B.异戊烷分子中最长碳链含有4个碳原子,侧链为甲基,又称为2—甲基丁烷,选项B错误;
C.葡萄糖的结构简式为HOCH2 (CHOH)4CHO,分子中的HOCH2—能与—CHO发生加成反应转化为,选项C正确;
D.Cl原子的半径大于N原子半径,NCl3分子的球棍模型是 ,选项D正确;
答案选C。
12.B
【详解】A.丙烯的结构简式为CH3-CH=CH2,发生加聚反应生成聚丙烯,则聚丙烯的结构简式为,A项错误;
B.羟基的结构式为-OH,O原子最外层电子数为6,则羟基的电子式为,B项正确;
C.乙炔的分子式为C2H2,则乙炔的实验式(最简式)为CH,C项错误;
D.乙醇的结构简式为,乙醇分子中的等效氢原子有3种,则核磁共振氢谱有三组吸收峰,且氢原子的比值为3:2:1,则核磁共振氢谱吸收峰的峰面积比值为3:2:1,D项错误;
答案选B。
13.C
【详解】表中物质的排布规律为4个一组,碳原子数不变,属于不同类别。第26种物质对应表中第2种物质类别且比第2种物质中碳原子数多6个,故该有机物为,故C正确。
故选C。
14.A
【详解】A.硫元素是16号元素,质子数为16,原子核内数据不对,应为+16,A项符合题意;
B.氮元素为7号元素,质子数为7,中子数为7,则质量数=质子数+中子数=7+7=14,B项不符合题意;
C.葡萄糖的分子式为C6H12O6,实验式即为最简式,化简后可得:CH2O,C项不符合题意;
D.乙炔的分子式为C2H2,有一个碳碳三键,所以结构式为:,D项不符合题意;
故正确选项为A
15.C
【分析】样品粉末用甲苯和甲醇溶解,并过滤得到滤液,滴加硝酸钠溶液分液得到水层溶液,蒸发结晶得到固体粗产品,有机层溶液蒸馏得到甲苯,据此判断。
【详解】A.步骤①为分离固体与液体混合物的操作,应使用过滤装置,故A正确;
B.步骤②是将互不相溶的有机层与水溶液层分离,应使用分液操作,故B正确;
C.步骤③是从水溶液中提取溶质,应使用蒸发操作,不能用坩埚,故C错误;
D.步骤④是从有机溶液中分离出溶剂,应使用蒸馏操作,故D正确;
故选C。
16.(1)CH3O
(2)C2H6O2
【解析】(1)
由碳原子守恒:;
根据质量守恒:,,根据质量守恒:;
所以该有机物的实验式:CH3O;
(2)
实验式为CH3O,分子式中C原子个数为1时,无满足条件的分子式;C原子个数为2时,分子式为C2H6O2;当C原子个数为3时,最多有8个氢原子,而按比例算出的氢原子个数为9,不符合,同理碳原子个数大于3时都不满足,故分子式:C2H6O2。
17.
【分析】根据浓硫酸能吸收水判断,浓硫酸增重的质量即是水的质量,通过足量灼热的氧化铜,固体质量减小,说明燃烧时产生了一氧化碳气体,最后通入足量碱石灰,质量增加说明含有二氧化碳气体。
【详解】(1)根据浓硫酸增重的质量5.4克计算:,根据通过足量灼热的氧化铜时,固体质量减轻了1.6g,计算: ,,再根据通过足量碱石灰时,质量增加了13.2g,进行计算:,故原0.1mol有机物燃烧中生成的二氧化碳的物质的量为:0.3-0.1=0.2mol。氧原子守恒得,该有机物含有的氧原子的物质的量为:0.3+0.1+0.2×2-0.25×2=0.3mol,故该有机物的碳与氢原子的物质的量之比为:(0.1+0.2):0.3×2:0.3=3:6:3;根据0.1mol该有机物燃烧,故该有机物的分子式为;
(2) 有机物B与有机物A最简式相同,故最简式为:CH2O,假设该有机物的化学式为
(CH2O)n,根据燃烧方程式:,n=2,故化学式为C2H4O2根据含有1个羟基进行判断结构简式为:。
【点睛】注意燃烧过程中,完全燃烧生产二氧化碳和水,充分燃烧是指反应物完全反应,但燃烧时由于未完全燃烧产生一氧化碳。
18. 关闭K,向长颈漏斗中加水至液面高出试管中液面,一段时间后,液面差不变,说明装置A气密性良好 长颈漏斗 平衡压强并检验后续装置是否发生堵塞 dcbghji(ij) 2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O 除去过量的碱液和生成的盐 过滤、蒸馏 86% 将合成二苯甲烷后的尾气通入AgNO3溶液中,若产生白色沉淀,则证明合成二苯甲烷的反应为取代反应
【分析】根据装置特点选择合适的方法检查气密性;根据装置构造分析装置用途;根据实验的流畅选择合适的安装顺序;根据反应方程式计算理论产量并计算产率;根据反应产物的性质,判断反应类型。
【详解】Ⅰ.(1)检验装置A的气密性的方法为关闭K,向长颈漏斗中加水至液面高出试管中液面,一段时间后,液面差不变,则装置气密性良好。
(2)由装置图知,仪器q的名称为长颈漏斗,装置B的作用除干燥气体外,还有平衡压强并检验后续装置是否发生堵塞。
(3)由实验目的和原理知,C可用于制备Cl2,B可用于干燥Cl2,E为Cl2与铝粉反应和收集AlCl3的装置,F用于尾气吸收和防止空气进入E导致AlCl3变质,故所选装置合理的连接顺序为 dcbghji(ij);由KMnO4与浓盐酸制备氯气反应的化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
Ⅱ.(4)由原理知,第一次水洗的目的是除去AlCl3和一定量HCl,稀碱液洗涤的目的是除去残留的HCl,最后一次水洗的目的是除去过量的碱液和生成的盐。粗品经干燥、(过滤、)蒸馏分离出二苯甲烷。
(5)苯的物质的量为 ,氯化苄的物质的量为 ,苯过量,则二苯甲烷的理论产量为29.2g,产率为 。
(6)合成二苯甲烷的反应若为取代反应,可通过检验产物中生成的HCl证明,方案为将合成二苯甲烷后的尾气通入AgNO3溶液中,若产生白色沉淀,则证明该反应为取代反应。
19. 质谱法 C8H10 液体不分层 吸收乙醇 溴水 +Br2+HBr
【详解】(1)步骤二通过仪器分析得知X的相对分子质量,该方法称为质谱法,故答案为:质谱法;
(2)烃X的物质的量为 = 0.02mol,生成二氧化碳为 = 0.16mol,生成水为= 0.1mol,则分子中N(C) == 8、N(H) ==10,故X的分子式为C8H10,X的红外光谱测定含有苯环,属于苯的同系物,而H核磁共振谱有2个峰,其面积之比为2:3,则X为;故答案为:C8H10;;
(3) 溴乙烷不溶于水,与氢氧化钠溶液混合后分层,溴乙烷在碱性条件下水解生成乙醇和溴化钠,二者都易溶于水,如果液体不分层,说明溴乙烷与NaOH溶液已完全反应,故答案为:液体不分层;
(4)乙醇具有还原性,能使高锰酸钾褪色,为防止乙醇对乙烯检验的干扰,应用A吸收乙醇,若高锰酸钾褪色,则证明乙烯的存在,说明证明溴乙烷在NaOH乙醇溶液中发生的是消去反应;乙醇与溴水不反应,乙烯与溴水发生加成反应使溴水褪色,若无A试管,B试管中的试剂应为溴水,如果溴水褪色,则证明乙烯的存在,说明证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,故答案为:吸收乙醇;溴水;
(5) 生成溴苯的化学方程式为: +Br2+HBr;故答案为:+Br2+HBr;
(6)苯的利用率= =,故答案为:;
20.(1)C3H6O
(2)CH2=CH-CH2OH
【分析】该有机物对空气的相对密度为2,则有机物相对分子质量=29×2=58,5.8g有机物的物质的量为0.1mol,燃烧生成CO2和H2O气且体积比为1:1,碱石灰在增加18.6g为CO2和H2O的质量,计算二者物质的量,根据原子守恒计算分子中C、H原子数目,再根据相对分子质量计算O原子数目,进而确定有机物分子式,同量的有机物与0.1mol乙酸完全发生酯化反应,则有机物分子含有1个-OH,结合有机物分子式确定其结构简式。
【详解】(1)该有机物对空气的相对密度为2,则有机物相对分子质量=29×2=58;5.8g有机物的物质的量为=0.1mol,燃烧生成CO2和H2O气且体积比为1:1,碱石灰在增加18.6g为CO2和H2O的质量,则n(CO2)=n(H2O)==0.3mol,则有机物分子中N(C)==3、N(H)= =6、N(O)==1,故有机物分子式为C3H6O;
故答案为:C3H6O;
(2)同量的有机物与0.1mol乙酸完全发生酯化反应,则有机物分子含有1个-OH,有机物分子式为C3H6O,含有1个碳碳双键,故其结构简式为CH2=CH-CH2OH;
故答案为:CH2=CH-CH2OH;
21.(1)CH2OHCH2OH
(2)汽车发动机的抗冻剂、生产聚酯纤维、合成涤纶等
【解析】(1)
浓H2SO4增重10.8g,说明反应产物中含水10.8g,水的物质的量为,通过灼热的CuO充分反应后,CuO失重3.2g,失去的重量为氧化铜中氧的质量,则氧化铜中氧的物质的量为,故CO的物质的量也为0.2mol,根据碳元素守恒可知CO与CuO反应生成的CO2的物质的量为0.2mol,将与氧化铜反应后的气体通入足量澄清石灰水,得到沉淀40g,沉淀的物质的量为,则有机物燃烧产生的CO2的物质的量为0.4mol-0.2mol=0.2mol,则有机物分子中,,,所以有机物的分子式为:C2H6O2,等量该有机物与9.2gNa恰好完全反应, 9.2gNa的物质的量为0.4mol,0.2mol该有机物与0.4mol钠恰好反应,说明有机物中含有2个羟基,该有机物的结构简式为CH2OHCH2OH;
(2)
根据(1)可知,该有机物为乙二醇,乙二醇的用途主要有:汽车发动机的抗冻剂、生产聚酯纤维、合成涤纶等
