2.1共价键第2课时课件(共31张PPT)2022-2023学年高二下学期人教版+(2019)化学选择性必修2
文档属性
| 名称 | 2.1共价键第2课时课件(共31张PPT)2022-2023学年高二下学期人教版+(2019)化学选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-27 11:27:19 | ||
图片预览









文档简介
(共31张PPT)
第二章 分子结构与性质
第一节 共价键
学习
目标
第2课时
共价键的键参数
PART
01
PART
02
PART
03
通过认识共价键的键能、键长和键角,从微观角度模型化解释分子的空间结构。
结合共价键的键长、键能和键角等数据,理解分子的性质与键参数的关系,培养证据推理与模型认知的核心素养。
掌握用共价键的强弱解释物质稳定性的方法。
共价键的强弱用什么来衡量?我们如何用化学语言来描述不同分子的空间结构和稳定性?
CH4
CH3CH2OH
CH3COOH
C6H6
【思考交流】
共价键的三个键参数——键能、键长与键角
气态分子中1mol化学键解离成气态原子所吸收的能量,kJ mol-1
1.键能
二、键参数
(1)概念:
共价键的强弱可用键能来衡量。键能是指气态分子中1mol化学键解离成气态原子所吸收的能量;键能通常是298.15 K 101 kPa条件下的标准值。
键能可通过实验测定,更多的却是推算获得的。
例如,断开CH4中的4个C一H所需能量并不相等,因此,CH4中的C一H键能只是平均值,而表2-1中的C-H键能是更多分子中的C-H键能的平均值。
例如:断开1molN≡N键吸收的最低能量为946 kJ,形成lmolN≡N键释放的最低能量为946kJ,这些能量就是相应化学键的键能,通常取正值。
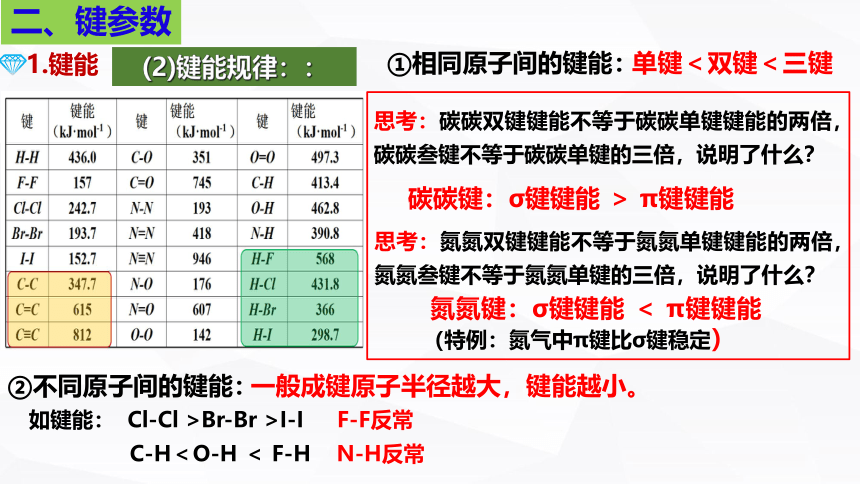
(2)键能规律::
1.键能
二、键参数
①相同原子间的键能:
碳碳键:σ键键能 > π键键能
氮氮键:σ键键能 < π键键能(特例:氮气中π键比σ键稳定)
C-H<O-H < F-H N-H反常
如键能: Cl-Cl >Br-Br >I-I F-F反常
②不同原子间的键能:
一般成键原子半径越大,键能越小。
单键<双键<三键
思考:碳碳双键键能不等于碳碳单键键能的两倍,碳碳叁键不等于碳碳单键的三倍,说明了什么?
思考:氮氮双键键能不等于氮氮单键键能的两倍,氮氮叁键不等于氮氮单键的三倍,说明了什么?
1.键能
二、键参数
(3)应用:
①判断共价键的稳定性(键能越大,共价键越稳定)
从键能的定义可知,破坏1mol化学键所需能量越多,即共价键的键能越大,则共价键越稳定。
②判断分子的稳定性(结构相似的分子中,键能越大,分子越稳定)
【例1】 键能:H-F H-Cl H-Br H-I
稳定性:HF HCl HBr HI
>
>
>
>
>
>
③估算化学反应的反应热
ΔH=反应物的总键能﹣生成物的总键能 / ΔH =(断-成)
同一化学键解离成气态原子所吸收的能量与气态原子结合形成化学键所释放的
能量在数值上是相等的,故根据化学键的键能数据可计算化学反应的反应热 。
如:已知N-N、N=N和N≡N的键能之比为1.00∶2.17∶4.90,而C-C、C=C、C≡C的键能之比为1.00∶1.77∶2.34。如何用这些数据理解氮分子不容易发生加成反应而乙烯和乙炔容易发生加成反应?
二、键参数
1.键能
提示: 键能数据表明,N≡N的键能大于N-N键能的三倍,N=N的键能大于N-N键能的两倍;而C≡C的键能却小于C-C键能的三倍,C=C的键能小于C-C的键能的两倍,说明乙烯和乙炔中的π键不牢固,易发生加成反应,而N2分子中N≡N非常牢固,所以氮分子不易发生加成反应。
④通过键能判断物质的反应活性。
键长是构成化学键的两个原子的核间距。
不过,分子中的原子始终处于不断振动之中,键长只是振动着的原子处于平衡位置时的核间距。
键长是衡量共价键稳定性的另一个参数.
Cl2中Cl-Cl键长
二、键参数
2.键长
(1)概念:
(3)键长大小:
皮米pm(1pm=10-12m=10-10cm)
(2)单位:
原子半径决定化学键的键长,一般原子半径越小,共价键的键长越短,键能越大,共价键越稳定
②成键原子相同时:
键长:单键键长>双键键长>三键键长
键能:单键键能<双键键能<三键键能
①同种类型的共价键:
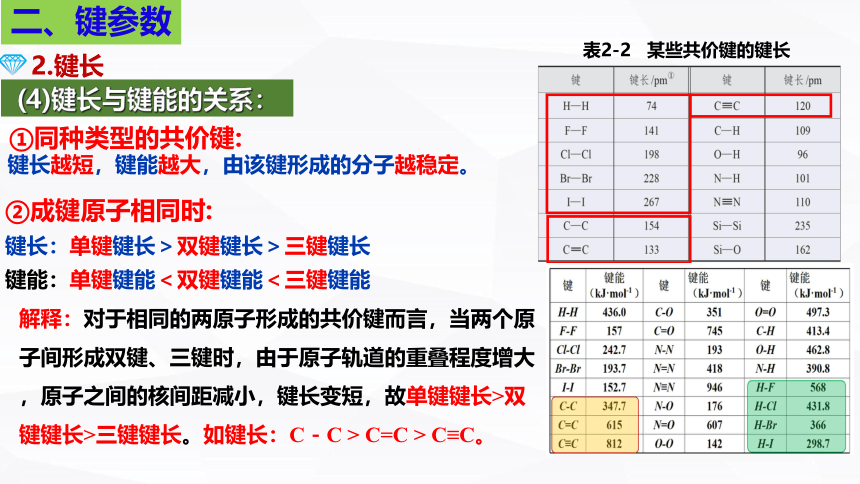
表2-2 某些共价键的键长
二、键参数
2.键长
(4)键长与键能的关系:
解释:对于相同的两原子形成的共价键而言,当两个原子间形成双键、三键时,由于原子轨道的重叠程度增大,原子之间的核间距减小,键长变短,故单键键长>双键键长>三键键长。如键长:C-C > C=C > C≡C。
键长越短,键能越大,由该键形成的分子越稳定。
某些共价键的键能和键长
键 键能(kJ·mol-1) 键长pm 键 键能(kJ·mol-1) 键长pm
F-F 157 141 H-F 568 92
Cl-Cl 242.7 198 H-Cl 431.8 127
Br-Br 193.7 228 H-Br 366 142
I-I 152.7 267 H-I 298.7 161
C-C 347.7 154 C≡C 812 120
C=C 615 133
F-F不符合“键长越短,键能越大”的规律,为什么?
【思考与讨论】
二、键参数
2.键长
原因:由于F原子半径太小,因此F-F的键长太短,而由于键长太短,两个F原子形成共价键时,原子核之间的距离太小,排斥力大,因此键能比Cl-Cl键小。(物极必反)
思考:为什么F-F的键长比Cl-Cl的键长短,但键能却比Cl-Cl的键能小?
键长特例:如F-F键(比Cl-Cl键小)(反常)
①判断共价键的稳定性
键长越短,键能越大,共价键越稳定。
②影响分子的空间结构
如CH4分子的空间结构为正四面体形,而CH3Cl分子的空间结构是四面体形而不是正四面体形,原因是C-H和C-Cl 的键长不相等。
(5)键长的应用
二、键参数
2.键长
思考与讨论P38
由计算结果可知:生成2 mol HCl比生成2 mol HBr释放的能量多。生成的HBr分子中H-Br的键能比HCl分子中H-Cl的键能小,说明H-Br比H-Cl容易断裂,所以HBr分子更容易发生热分解生成相应的单质。
二、键参数
(1)试利用表2-1数据进行计算,1molH2分别跟1molCl2、1molBr2(蒸气)反应,分别生成2molHCl和2molHBr分子,哪个反应放出的能量更多?如何用计算结果说明氯化氢和溴化氢哪个更容易发生热分解生成相应的单质?
思考与讨论
化学键 N≡N O=O F-F
键 能
946kJ/mol
497.3kJ/mol
157kJ/mol
化学键 N-H O-H F-H
键 能
390.8kJ/mol
462.8kJ/mol
568kJ/mol
(2)N2、O2、F2与H2的反应能力依次增强,从键能的角度如何理解这一化学事实。(利用课本P37表2-1的相应数据分析)
二、键参数
提示:从表2-1的数据可知,N-H、O-H与H-F的键能依次增大,意味着形成这些键时放出的能量依次增大,化学键越来越稳定。所以N2、O2、F2与H2的反应能力依次增强。
(3)通过上述例子,你认为键长、键能对分子的化学性质有什么影响?
思考与讨论
二、键参数
1.键能
键长越短、键能越大,则化学键越稳定,分子的化学性质越不活泼。
反之键长越长、键能越小,则化学键越不稳定,分子的化学性质越活泼。
【思考与讨论】
2、再结合课本P37表2-1的数据,F-F键、Cl-Cl键的键能大小,讨论键能与键长的关系。
3、已知CH4是正四面体结构,CH3Cl是不是也是四面体结构?为什么?
1、查看课本P38表2-2的数据,C-C、C=C、C≡C的键长是否相同?有什么规律?
4、C和Ge是同族元素,为什么C原子间可形成双键、三键,但Ge原子间难形成双键或三键 。
二、键参数
2.键长
【思考与讨论】
2、再结合课本P37表2-1的数据,F-F键、Cl-Cl键的键能大小,讨论键能与键长的关系.
3、已知CH4是正四面体结构,CH3Cl是不是也是四面体结构?为什么?
1、查看课本P38表2-2的数据,C-C、C=C、C≡C的键长是否相同?有什么规律?
4、C和Ge是同族元素,为什么C原子间可形成双键、三键,但Ge原子间难形成双键或三键 .
不同
就相同原子形成的共价键:单键键长>双键键长>三键键长
一般而言,共价键键长越短,键能越大,共价键越稳定
CH3Cl分子不是正四面体形,C-H 、C-Cl键的键长不相等
Ge原子半径大,原子间形成的σ键键长较长,p轨道“肩并肩”重叠程
度很小或几乎不能重叠,难以形成π键.
二、键参数
2.键长
观察上述分子构型并思考:为什么CO2的空间结构是直线形,而H2O的空间结构是V形(角形)?
CO2
H2O
直线形
V形(角形)
二、键参数
3.键角
在多原子分子中,两个相邻化学键之间的夹角。
二、键参数
3.键角
(1)概念:
键长和键角的数值可通过晶体的X射线衍射实验获得。
多原子分子的键角一定,表明共价键具有方向性。键角是描述分子结构的重要参数,分子的许多性质都与键角有关 。
(2)意义:
— 键角决定分子的空间构型
键长和键角决定分子的空间结构。
常见分子中的键角与分子空间结构。
化学式 结构式 键角 空间结构
CO2 180° 直线型
H2O 105° V型
NH3 107° 三角锥形
BF3 120° 平面三角形
CH4 109°28′ 正四面体型
(3)键角的应用:
二、键参数
3.键角
思考与讨论
如图白磷和甲烷均为正四面体结构,它们的键角是否相同,为什么?
不同,白磷分子的键角是指P—P之间的夹角,为60°;而甲烷分子的键角是指C—H的夹角,为109°28′。
二、键参数
3.键角
归纳总结
返回
共价键稳定性强弱的判断方法
(1)根据原子半径和共用电子对数目判断:
成键原子的原子半径越小,共用电子对数越多,共价键越牢固,含有该共价键的分子越稳定。
(2)根据键能判断:
共价键的键能越大,共价键越牢固,破坏共价键消耗的能量越多。
(3)根据键长判断:
共价键的键长越短,共价键越牢固,破坏共价键所消耗的能量越多。
二、键参数
键能
键长
共价键的稳定性
一般地,形成的共价键的键能越大,键长越短,共价键越稳定,含有该键的分子越稳定,化学性质越稳定。
键角
分子的空间结构
决定分子的性质
键参数
决定
决定
二、键参数
小结
从表中可以看出,CO分子与N2分子在许多性质上十分相似。
这些相似性,可以归结为它们具有相等的价电子总数,导致它们具有相似的性质。
CO和N2的某些性质
分子
熔点/℃
水中溶解度
(室温)
分子解离能
(kJ/mol)
分子的价电子总数
CO
-205.05
2.3 mL
10
N2
沸点/℃
-210.00
-190.49
-195.81
1.6 mL
1075
946
10
三、等电子体
思考:为何CO和N2的各性质如此相似?
等电子体具有相似的化学键特征,它们的结构相近,物理性质相似。
原子总数相同、价电子总数相同的分子(或离子)互为等电子体。
①预测分子或离子的立体构型(如已知SO2的空间构型是V形,则可以判断NO2-、O3也是V形)
②利用等电子体在性质上的相似性制造新材料;
③利用等电子原理针对某物质找等电子体。
(3)应用::
如N2与CO、O3与SO2、N2O与CO2、CH4与NH4+等。
1.等电子体
三、等电子体
(1)概念:
(2)等电子体特征:
(4)等电子体的推断确定方法:
根据等电子原理的定义和条件判断——二同(等)
借助周期表知识进行等电子体的判定
①同主族变换,如CO2与CS2、CF4与CCl4的等电子体。
②左右移位补偿,如N2与CO,CO32-、NO3-与SO3是等电子体。
如果是阴离子,判断价电子总数时应用各原子价电子数之和加上阴离子所带的电荷数;(例: CO32-价电子总数为24)
如果是阳离子,判断价电子总数时应用各原子价电子数之和减去阳离子所带的电荷数。(例:NH4+价电子总数为8)
1.等电子体
三、等电子体
(5)一些常见的等电子体:
1.等电子体
三、等电子体
等电子体类型 实例 空间构型
2原子10e-的等电子体 N2、CO、CN-、C22-、NO+ 直线形
3原子16e-的等电子体 CO2、CS2、N2O、CNO-、N3-、NO2+、SCN-、BeCI2 直线形
3原子18e-的等电子体 NO2-、O3、SO2 V形
4原子24e-的等电子体 NO3-、CO32-、BF3、SO3(g)、BO33-、CS32- 平面三角形
5原子8e-的等电子体 CH4、NH4+、SiH4 正四面体形
5原子32e-的等电子体 SiF4、CCI4、SO42-、PO43- 正四面体形
练习
1.可以反映共价键强弱的物理量是( )
A.键能 B.键能、键长
C.键能、键长、键角 D.键长、键角
2.从键长的角度判断,下列共价键中最稳定的是( )
A.H—F B.N—H C.C—H D.S—H
B
A
二、键参数
练习
3.二氯化二硫(S2Cl2),非平面结构,常温下是一种黄红色液体,有刺激性恶臭,熔点:-80 ℃,沸点:137.1 ℃。下列对于二氯化二硫叙述正确的是( )
A.二氯化二硫的电子式为
B.分子中既有极性键又有非极性键
C.分子中S—Cl的键长大于S—S的键长
D.分子中S—Cl的键能小于S—S的键能
B
二、键参数
练习
4.关于键长、键能和键角,下列说法不正确的是( )
A.键角是描述分子空间结构的重要参数
B.键长的大小与成键原子的半径和成键数目有关
C.键能越大,键长越大,共价化合物越稳定
D.键角的大小与键长、键能的大小无关
C
二、键参数
练习
5.用“>”或“<”填空。
(1)比较键能大小:
①C—H____N—H____H—O;②H—F____H—Cl。
(2)比较键长大小:
①C—H____N—H____H—O;②H—F____H—Cl。
(3)比较键角大小:
①CO2____NH3;②H2O____NH3。
<
<
>
>
>
<
<
>
二、键参数
练习
6.有关碳和硅的共价键键能如下表所示:
简要分析和解释下列有关事实。
(1)比较通常条件下,CH4和SiH4的稳定性强弱: 。
(2)SiH4的稳定性小于CH4,硅更易生成氧化物,原因是:
共价键 C—C C—H C—O Si—Si Si—H Si—O
348 413 351 226 318 452
CH4比SiH4稳定
C—H键的键能大于C—O键,C—H键比C—O键稳定,而Si—H的键能却远小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键。
二、键参数
第二章 分子结构与性质
第一节 共价键
学习
目标
第2课时
共价键的键参数
PART
01
PART
02
PART
03
通过认识共价键的键能、键长和键角,从微观角度模型化解释分子的空间结构。
结合共价键的键长、键能和键角等数据,理解分子的性质与键参数的关系,培养证据推理与模型认知的核心素养。
掌握用共价键的强弱解释物质稳定性的方法。
共价键的强弱用什么来衡量?我们如何用化学语言来描述不同分子的空间结构和稳定性?
CH4
CH3CH2OH
CH3COOH
C6H6
【思考交流】
共价键的三个键参数——键能、键长与键角
气态分子中1mol化学键解离成气态原子所吸收的能量,kJ mol-1
1.键能
二、键参数
(1)概念:
共价键的强弱可用键能来衡量。键能是指气态分子中1mol化学键解离成气态原子所吸收的能量;键能通常是298.15 K 101 kPa条件下的标准值。
键能可通过实验测定,更多的却是推算获得的。
例如,断开CH4中的4个C一H所需能量并不相等,因此,CH4中的C一H键能只是平均值,而表2-1中的C-H键能是更多分子中的C-H键能的平均值。
例如:断开1molN≡N键吸收的最低能量为946 kJ,形成lmolN≡N键释放的最低能量为946kJ,这些能量就是相应化学键的键能,通常取正值。
(2)键能规律::
1.键能
二、键参数
①相同原子间的键能:
碳碳键:σ键键能 > π键键能
氮氮键:σ键键能 < π键键能(特例:氮气中π键比σ键稳定)
C-H<O-H < F-H N-H反常
如键能: Cl-Cl >Br-Br >I-I F-F反常
②不同原子间的键能:
一般成键原子半径越大,键能越小。
单键<双键<三键
思考:碳碳双键键能不等于碳碳单键键能的两倍,碳碳叁键不等于碳碳单键的三倍,说明了什么?
思考:氮氮双键键能不等于氮氮单键键能的两倍,氮氮叁键不等于氮氮单键的三倍,说明了什么?
1.键能
二、键参数
(3)应用:
①判断共价键的稳定性(键能越大,共价键越稳定)
从键能的定义可知,破坏1mol化学键所需能量越多,即共价键的键能越大,则共价键越稳定。
②判断分子的稳定性(结构相似的分子中,键能越大,分子越稳定)
【例1】 键能:H-F H-Cl H-Br H-I
稳定性:HF HCl HBr HI
>
>
>
>
>
>
③估算化学反应的反应热
ΔH=反应物的总键能﹣生成物的总键能 / ΔH =(断-成)
同一化学键解离成气态原子所吸收的能量与气态原子结合形成化学键所释放的
能量在数值上是相等的,故根据化学键的键能数据可计算化学反应的反应热 。
如:已知N-N、N=N和N≡N的键能之比为1.00∶2.17∶4.90,而C-C、C=C、C≡C的键能之比为1.00∶1.77∶2.34。如何用这些数据理解氮分子不容易发生加成反应而乙烯和乙炔容易发生加成反应?
二、键参数
1.键能
提示: 键能数据表明,N≡N的键能大于N-N键能的三倍,N=N的键能大于N-N键能的两倍;而C≡C的键能却小于C-C键能的三倍,C=C的键能小于C-C的键能的两倍,说明乙烯和乙炔中的π键不牢固,易发生加成反应,而N2分子中N≡N非常牢固,所以氮分子不易发生加成反应。
④通过键能判断物质的反应活性。
键长是构成化学键的两个原子的核间距。
不过,分子中的原子始终处于不断振动之中,键长只是振动着的原子处于平衡位置时的核间距。
键长是衡量共价键稳定性的另一个参数.
Cl2中Cl-Cl键长
二、键参数
2.键长
(1)概念:
(3)键长大小:
皮米pm(1pm=10-12m=10-10cm)
(2)单位:
原子半径决定化学键的键长,一般原子半径越小,共价键的键长越短,键能越大,共价键越稳定
②成键原子相同时:
键长:单键键长>双键键长>三键键长
键能:单键键能<双键键能<三键键能
①同种类型的共价键:
表2-2 某些共价键的键长
二、键参数
2.键长
(4)键长与键能的关系:
解释:对于相同的两原子形成的共价键而言,当两个原子间形成双键、三键时,由于原子轨道的重叠程度增大,原子之间的核间距减小,键长变短,故单键键长>双键键长>三键键长。如键长:C-C > C=C > C≡C。
键长越短,键能越大,由该键形成的分子越稳定。
某些共价键的键能和键长
键 键能(kJ·mol-1) 键长pm 键 键能(kJ·mol-1) 键长pm
F-F 157 141 H-F 568 92
Cl-Cl 242.7 198 H-Cl 431.8 127
Br-Br 193.7 228 H-Br 366 142
I-I 152.7 267 H-I 298.7 161
C-C 347.7 154 C≡C 812 120
C=C 615 133
F-F不符合“键长越短,键能越大”的规律,为什么?
【思考与讨论】
二、键参数
2.键长
原因:由于F原子半径太小,因此F-F的键长太短,而由于键长太短,两个F原子形成共价键时,原子核之间的距离太小,排斥力大,因此键能比Cl-Cl键小。(物极必反)
思考:为什么F-F的键长比Cl-Cl的键长短,但键能却比Cl-Cl的键能小?
键长特例:如F-F键(比Cl-Cl键小)(反常)
①判断共价键的稳定性
键长越短,键能越大,共价键越稳定。
②影响分子的空间结构
如CH4分子的空间结构为正四面体形,而CH3Cl分子的空间结构是四面体形而不是正四面体形,原因是C-H和C-Cl 的键长不相等。
(5)键长的应用
二、键参数
2.键长
思考与讨论P38
由计算结果可知:生成2 mol HCl比生成2 mol HBr释放的能量多。生成的HBr分子中H-Br的键能比HCl分子中H-Cl的键能小,说明H-Br比H-Cl容易断裂,所以HBr分子更容易发生热分解生成相应的单质。
二、键参数
(1)试利用表2-1数据进行计算,1molH2分别跟1molCl2、1molBr2(蒸气)反应,分别生成2molHCl和2molHBr分子,哪个反应放出的能量更多?如何用计算结果说明氯化氢和溴化氢哪个更容易发生热分解生成相应的单质?
思考与讨论
化学键 N≡N O=O F-F
键 能
946kJ/mol
497.3kJ/mol
157kJ/mol
化学键 N-H O-H F-H
键 能
390.8kJ/mol
462.8kJ/mol
568kJ/mol
(2)N2、O2、F2与H2的反应能力依次增强,从键能的角度如何理解这一化学事实。(利用课本P37表2-1的相应数据分析)
二、键参数
提示:从表2-1的数据可知,N-H、O-H与H-F的键能依次增大,意味着形成这些键时放出的能量依次增大,化学键越来越稳定。所以N2、O2、F2与H2的反应能力依次增强。
(3)通过上述例子,你认为键长、键能对分子的化学性质有什么影响?
思考与讨论
二、键参数
1.键能
键长越短、键能越大,则化学键越稳定,分子的化学性质越不活泼。
反之键长越长、键能越小,则化学键越不稳定,分子的化学性质越活泼。
【思考与讨论】
2、再结合课本P37表2-1的数据,F-F键、Cl-Cl键的键能大小,讨论键能与键长的关系。
3、已知CH4是正四面体结构,CH3Cl是不是也是四面体结构?为什么?
1、查看课本P38表2-2的数据,C-C、C=C、C≡C的键长是否相同?有什么规律?
4、C和Ge是同族元素,为什么C原子间可形成双键、三键,但Ge原子间难形成双键或三键 。
二、键参数
2.键长
【思考与讨论】
2、再结合课本P37表2-1的数据,F-F键、Cl-Cl键的键能大小,讨论键能与键长的关系.
3、已知CH4是正四面体结构,CH3Cl是不是也是四面体结构?为什么?
1、查看课本P38表2-2的数据,C-C、C=C、C≡C的键长是否相同?有什么规律?
4、C和Ge是同族元素,为什么C原子间可形成双键、三键,但Ge原子间难形成双键或三键 .
不同
就相同原子形成的共价键:单键键长>双键键长>三键键长
一般而言,共价键键长越短,键能越大,共价键越稳定
CH3Cl分子不是正四面体形,C-H 、C-Cl键的键长不相等
Ge原子半径大,原子间形成的σ键键长较长,p轨道“肩并肩”重叠程
度很小或几乎不能重叠,难以形成π键.
二、键参数
2.键长
观察上述分子构型并思考:为什么CO2的空间结构是直线形,而H2O的空间结构是V形(角形)?
CO2
H2O
直线形
V形(角形)
二、键参数
3.键角
在多原子分子中,两个相邻化学键之间的夹角。
二、键参数
3.键角
(1)概念:
键长和键角的数值可通过晶体的X射线衍射实验获得。
多原子分子的键角一定,表明共价键具有方向性。键角是描述分子结构的重要参数,分子的许多性质都与键角有关 。
(2)意义:
— 键角决定分子的空间构型
键长和键角决定分子的空间结构。
常见分子中的键角与分子空间结构。
化学式 结构式 键角 空间结构
CO2 180° 直线型
H2O 105° V型
NH3 107° 三角锥形
BF3 120° 平面三角形
CH4 109°28′ 正四面体型
(3)键角的应用:
二、键参数
3.键角
思考与讨论
如图白磷和甲烷均为正四面体结构,它们的键角是否相同,为什么?
不同,白磷分子的键角是指P—P之间的夹角,为60°;而甲烷分子的键角是指C—H的夹角,为109°28′。
二、键参数
3.键角
归纳总结
返回
共价键稳定性强弱的判断方法
(1)根据原子半径和共用电子对数目判断:
成键原子的原子半径越小,共用电子对数越多,共价键越牢固,含有该共价键的分子越稳定。
(2)根据键能判断:
共价键的键能越大,共价键越牢固,破坏共价键消耗的能量越多。
(3)根据键长判断:
共价键的键长越短,共价键越牢固,破坏共价键所消耗的能量越多。
二、键参数
键能
键长
共价键的稳定性
一般地,形成的共价键的键能越大,键长越短,共价键越稳定,含有该键的分子越稳定,化学性质越稳定。
键角
分子的空间结构
决定分子的性质
键参数
决定
决定
二、键参数
小结
从表中可以看出,CO分子与N2分子在许多性质上十分相似。
这些相似性,可以归结为它们具有相等的价电子总数,导致它们具有相似的性质。
CO和N2的某些性质
分子
熔点/℃
水中溶解度
(室温)
分子解离能
(kJ/mol)
分子的价电子总数
CO
-205.05
2.3 mL
10
N2
沸点/℃
-210.00
-190.49
-195.81
1.6 mL
1075
946
10
三、等电子体
思考:为何CO和N2的各性质如此相似?
等电子体具有相似的化学键特征,它们的结构相近,物理性质相似。
原子总数相同、价电子总数相同的分子(或离子)互为等电子体。
①预测分子或离子的立体构型(如已知SO2的空间构型是V形,则可以判断NO2-、O3也是V形)
②利用等电子体在性质上的相似性制造新材料;
③利用等电子原理针对某物质找等电子体。
(3)应用::
如N2与CO、O3与SO2、N2O与CO2、CH4与NH4+等。
1.等电子体
三、等电子体
(1)概念:
(2)等电子体特征:
(4)等电子体的推断确定方法:
根据等电子原理的定义和条件判断——二同(等)
借助周期表知识进行等电子体的判定
①同主族变换,如CO2与CS2、CF4与CCl4的等电子体。
②左右移位补偿,如N2与CO,CO32-、NO3-与SO3是等电子体。
如果是阴离子,判断价电子总数时应用各原子价电子数之和加上阴离子所带的电荷数;(例: CO32-价电子总数为24)
如果是阳离子,判断价电子总数时应用各原子价电子数之和减去阳离子所带的电荷数。(例:NH4+价电子总数为8)
1.等电子体
三、等电子体
(5)一些常见的等电子体:
1.等电子体
三、等电子体
等电子体类型 实例 空间构型
2原子10e-的等电子体 N2、CO、CN-、C22-、NO+ 直线形
3原子16e-的等电子体 CO2、CS2、N2O、CNO-、N3-、NO2+、SCN-、BeCI2 直线形
3原子18e-的等电子体 NO2-、O3、SO2 V形
4原子24e-的等电子体 NO3-、CO32-、BF3、SO3(g)、BO33-、CS32- 平面三角形
5原子8e-的等电子体 CH4、NH4+、SiH4 正四面体形
5原子32e-的等电子体 SiF4、CCI4、SO42-、PO43- 正四面体形
练习
1.可以反映共价键强弱的物理量是( )
A.键能 B.键能、键长
C.键能、键长、键角 D.键长、键角
2.从键长的角度判断,下列共价键中最稳定的是( )
A.H—F B.N—H C.C—H D.S—H
B
A
二、键参数
练习
3.二氯化二硫(S2Cl2),非平面结构,常温下是一种黄红色液体,有刺激性恶臭,熔点:-80 ℃,沸点:137.1 ℃。下列对于二氯化二硫叙述正确的是( )
A.二氯化二硫的电子式为
B.分子中既有极性键又有非极性键
C.分子中S—Cl的键长大于S—S的键长
D.分子中S—Cl的键能小于S—S的键能
B
二、键参数
练习
4.关于键长、键能和键角,下列说法不正确的是( )
A.键角是描述分子空间结构的重要参数
B.键长的大小与成键原子的半径和成键数目有关
C.键能越大,键长越大,共价化合物越稳定
D.键角的大小与键长、键能的大小无关
C
二、键参数
练习
5.用“>”或“<”填空。
(1)比较键能大小:
①C—H____N—H____H—O;②H—F____H—Cl。
(2)比较键长大小:
①C—H____N—H____H—O;②H—F____H—Cl。
(3)比较键角大小:
①CO2____NH3;②H2O____NH3。
<
<
>
>
>
<
<
>
二、键参数
练习
6.有关碳和硅的共价键键能如下表所示:
简要分析和解释下列有关事实。
(1)比较通常条件下,CH4和SiH4的稳定性强弱: 。
(2)SiH4的稳定性小于CH4,硅更易生成氧化物,原因是:
共价键 C—C C—H C—O Si—Si Si—H Si—O
348 413 351 226 318 452
CH4比SiH4稳定
C—H键的键能大于C—O键,C—H键比C—O键稳定,而Si—H的键能却远小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键。
二、键参数
