2.3分子结构与物质的性质 第2课时 课件(共59张PPT)2022-2023学年高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.3分子结构与物质的性质 第2课时 课件(共59张PPT)2022-2023学年高二下学期化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 84.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-27 11:48:26 | ||
图片预览









文档简介
(共59张PPT)
第二章 分子结构与性质
第三节 分子结构与物质性质
学习
目标
第2课时
分子间作用力
1.认识分子间存在相互作用,知道范德华力是常见的分子间作用力;能说明范德华力对物质熔点、沸点等性质的影响,形成“结构决定性质”的基本观念。
2.知道氢键是常见的分子间作用力;能说明氢键对物质熔点、沸点等性质的影响,能举例说明氢键对于生命的重大意义。
3.知道物质的溶解性与分子结构的关系,了解“相似相溶”规律。
为什么下雪不冷,化雪冷呢?
雪融化现象是物理变化还是化学变化?
雪过程中有没有破坏其中的化学键?
冰雪
水
水蒸气
(固)
(液)
(气)
分子间距离增大
思考:
→雪融化成水,需要吸收热量;把水变成水蒸气仍然需要吸收热量。
吸收的热量用于破坏某种分子间作用力,这说明水分子之间存在着相互作用力。
思考:吸收的热量去哪里了呢?
100℃:水会剧腾沸腾
3000℃: 水分解产生氧气和氢气
化学变化
分子内化学键破坏
水分子之间存在着相互作用力
物理变化
两个变化
有何异同
1.范德华力及其对物质性质的影响
二、分子间的作用力
(1)定义:
把分子聚集在一起的作用力称为分子间作用力,又叫范德华力。(普遍存在于固体、液体和气体分子间的作用力)
(2)存在:
非金属单质(除C、Si)分子。稀有气体分子,共价化合物(SiO2、SiC)
分子之间,石墨片层之间。
1.范德华力及其对物质性质的影响
二、分子间的作用力
(3)特点:(与共价键的区别)
①范德华力很弱,约比化学键键能小1-2个数量级。
②广泛存在于分子之间。只要分子充分接近就有范德华力。
③范德华力没有方向性和饱和性:只要分子周围空间允许,分子总是尽可能多地吸引其他分子。
微粒间 作用力 能量
kJ·mol -1
化学键 100 - 600
范德华力 2 - 20
(4)影响因素
分子 Ar CO HI HBr HCl
相对分子质量 40 28 129 81 36.5
范德华力 (kJ/mol) 8.50 8.75 26.00 23.11 21.14
②对于组成和结构相似的分子,相对分子质量越大,范德华力越大。
①分子极性越大,范德华力越大。
1.范德华力及其对物质性质的影响
二、分子间的作用力
[思考]为什么范德华力:CO>Ar
[思考]为什么:HI>HBr>HCl>CO
表2-7 某些分子间的作用力
③对于相对分子质量、极性相似的分子,分子的对称性越强,范德华力越弱,如正丁烷>异丁烷,邻二甲苯>间二甲苯>对二甲苯。
范德华力主要影响物质的物理性质。如熔、沸点。
规律1:结构相似的分子,相对分子质量越大,范德华力越大,熔、沸点越高。
(5)范德华力对物质性质的影响:
1.范德华力及其对物质性质的影响
二、分子间的作用力
规律2:相对分子质量相同或相近时,分子的极性越大,范德华力越大,熔、沸点越高。
规律3:在同分异构体中,一般来说,支链越多(越分散),熔、沸点就越低。
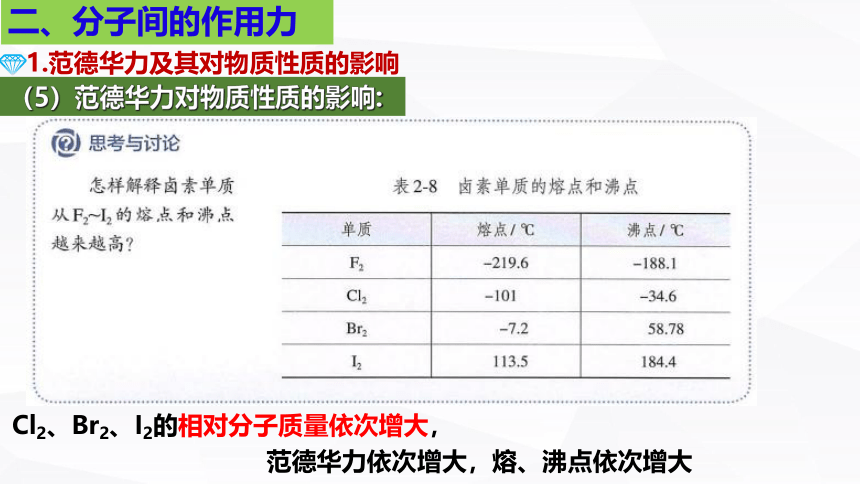
如:熔沸点: I2>Br2>Cl2>F2
如:熔沸点: CO>N2
如:熔沸点: 正戊烷>异戊烷>新戊烷
Cl2、Br2、I2的相对分子质量依次增大,
范德华力依次增大,熔、沸点依次增大
(5)范德华力对物质性质的影响:
1.范德华力及其对物质性质的影响
二、分子间的作用力
夏天经常见到许多壁虎在墙壁或天花板上爬却掉不下来,为什么?
近年来,有人用计算机模拟,证明壁虎的足与墙体之间的作用力在本质上是它的细毛与墙体之间的范德华力。
科学 技术 社会
1.范德华力及其对物质性质的影响
二、分子间的作用力
壁虎与范德华力
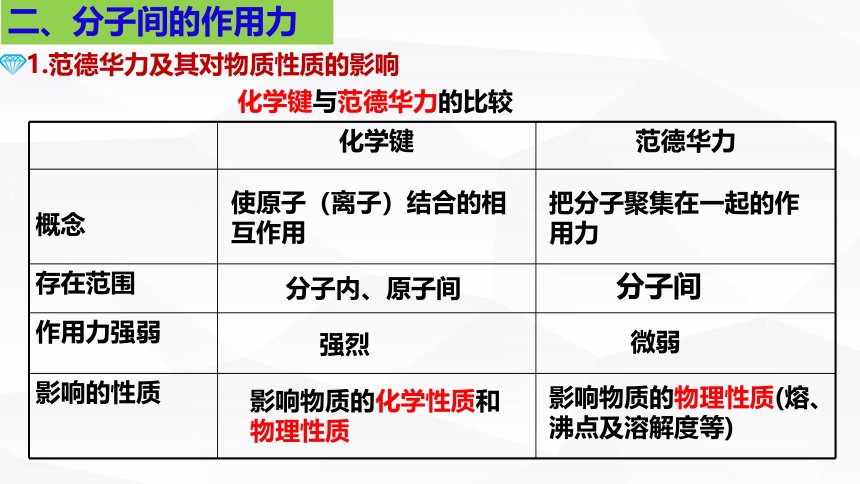
化学键 范德华力
概念
存在范围
作用力强弱
影响的性质
使原子(离子)结合的相互作用
把分子聚集在一起的作用力
分子内、原子间
分子间
强烈
微弱
影响物质的化学性质和物理性质
影响物质的物理性质(熔、沸点及溶解度等)
化学键与范德华力的比较
1.范德华力及其对物质性质的影响
二、分子间的作用力
1)将干冰气化,破坏了CO2分子的—————
2)将CO2气体溶于水,破坏了CO2分子的————
范德华力
共价键
3)解释CCl4(液体),CH4及CF4是气体,CI4是固体的原因。
它们空间构型均是正四面体,结构相似,相对分子质量越大,范德华力越大,聚集程度越大。范德华力比较小时呈气态,随范德华力增大时变为液体,大到一定程度时变为固体
【练习】
1.范德华力及其对物质性质的影响
二、分子间的作用力
4)人们熟悉的影片《蜘蛛侠》为我们塑造了一个能飞檐走壁、过高楼如履平地的蜘蛛侠,现实中的蜘蛛能在天花板等比较滑的板面上爬行,蜘蛛之所以不能从天花板上掉下的主要原因是( )
A.蜘蛛脚的尖端锋利,能抓住天花板
B.蜘蛛的脚上有“胶水”,从而能使蜘蛛粘在天花板上
C.蜘蛛脚上的大量细毛与天花板之间的范德华力这一“黏力”使蜘蛛不致坠落
D.蜘蛛有特异功能,能抓住任何物体
C
1.范德华力及其对物质性质的影响
二、分子间的作用力
【练习】
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
×
×
×
×
CH4
SiH4
GeH4
SnH4
NH3
PH3
AsH3
SbH3
HF
HCl
HBr
HI
H2O
H2S
H2Se
H2Te
沸
点
/℃
周期
【情景引入】一些氢化物的沸点:
→对于同一主族非金属元素氢化物而言,从上到下,相对分子质量逐渐增大,范德华力逐渐增大,熔沸点逐渐升高.而HF、H2O、NH3却出现反常,为什么?
→说明在HF、H2O、NH3分子间还存在除范德华力之外的其他作用.
这种作用力就是氢键.
二、分子间的作用力
- - - - - - - - - -
在水分子的O-H中,共用电子对强烈的偏向O,使得H几乎成为“裸露”的质子,其显正电性,它能与另一个水分子中相对显负电性的O的孤电子对产生静电作用,这种静电作用就是氢键。
2.氢键及其对物质性质的影响
二、分子间的作用力
由已经与电负性很大的原子(如N、O、F)形成共价键的氢原子与
另一分子中电负性很大的原子(如N、O、F)之间的作用力叫氢键。
如:
H
F
H
F
H
F
H
F
2.氢键及其对物质性质的影响
二、分子间的作用力
(1)定义:
(2)表示方法:
注:氢键是除范德华力之外的另一种分子间作用力,它不是化学键。
① X、Y为N、O、F。
②X、Y可以相同,也可以不同。
③“—”表示共价键,“···”表示氢键
用X—H···Y — 表示
①氢键不属于化学键:化学键>氢键>范德华力。
②分子有氢键就一定有范德华力,有范德华力不一定有氢键。
③与氢原子形成氢键时,电负性越大,氢键越强。
④氢键会使物质熔、沸点大大增加。
⑤氢键具有一定的方向性和饱和性。
饱和性:每一个X—H只能与一个Y原子形成氢键,原因是H原子半径很小,再有一个原子接近时,会受到X、Y原子电子云的排斥。
方向性:X—H···Y—三个原子一般在同一方向上。原因是在这样的方向上成键两原子电子云之间的排斥力最小,形成的氢键最强,体系最稳定。
H
F
H
F
H
F
H
F
2.氢键及其对物质性质的影响
二、分子间的作用力
(3)氢 键 特 征:
(4)分类:
邻羟基苯甲醛
(熔点-7℃ 沸点196.5℃)
对羟基苯甲醛
(熔点115℃ 沸点246.6℃)
2.氢键及其对物质性质的影响
二、分子间的作用力
分子内氢键和分子间氢键
① 分子间氢键:(属于分子间作用力)
如:H2O、NH3、HF、C2H5OH、
CH3COOH相互之间。
② 分子内氢键(不属于分子间作用力)
沸点:分子间氢键>分子内氢键
如:当苯酚在邻位上有—CHO、—COOH、
—NO2和 —OH时,可形成分子内的氢键。
注:分子内氢键可以使分子更稳定。且分子内氢键会削弱分子间氢键形成,故一般熔沸点较低。
分子间氢键
分子内氢键
邻羟基苯甲醛在分子内形成氢键,在分子间就不存在氢键了,只存在范德华力。
对羟基苯甲醛不存在分子内氢键,只能在分子间形成氢键。
(5)氢键对物质物理性质的影响
①分子间氢键使物质熔、沸点升高。
③对物质溶解度的影响
2.氢键及其对物质性质的影响
二、分子间的作用力
→分子间存在氢键时,物质在熔化或汽化时,除需破坏范德华力外,还需破坏分子间氢键,消耗更多的能量,所以存在分子间氢键的物质一般具有较高的熔、沸点。
如ⅤA~ⅦA族元素的氢化物中,NH3、H2O和HF的熔、沸点比同主族相邻元素氢化物的熔、沸点高,这种反常现象是由于它们各自的分子间形成了氢键。
②分子内氢键使物质熔、沸点降低.
→如熔、沸点:邻羟基苯甲酸( )<对羟基苯甲酸( )
→溶剂和溶质之间形成氢键使溶质的溶解度增大,如氨、甲醇、甲醛、甲酸等易溶于水。
(5)氢键对物质物理性质的影响
2.氢键及其对物质性质的影响
二、分子间的作用力
④氢键对水分子的影响
b.水结冰时,体积膨胀,密度降低。
a.氢键使水分子沸点反常的高
c.接近水的沸点的水蒸气的相对分子质量的测定值比按化学式H2O计算出来的相对分子质量大。
在水蒸气中:水以单个的H2O分子形式存在;无氢键。
液态水中:除了含有简单H2O外,还含有通过氢键联结在一起的缔合分子(H2O)2、(H2O)3……(H2O)n等。
在固态水(冰)中:水分子大范围地以氢键互相联结成为晶体,因此在冰的结构中形成许多空隙,体积膨胀,密度减小。
—接近水的沸点的水蒸气中存在相当量的水分子因氢键而相互缔合,形成所谓的缔合分子(H2O)n。
定义
范德华力
氢键
共价键
作用微粒
把分子聚集在一起的相互作用力
氢原子与电负性大的原子X以共价键结合时,H原子还能够跟另外一个电负性大的原子Y之间产生静电作用
相邻原子之间通过共用电子对形成的化学键
相邻原子之间
分子间或分子内
分子之间
强弱
弱
较强
很强
对物质性质的影响
影响物质的物理性质(熔、沸点及溶解度)
影响某些物质(如水、氨气)的物理性质(熔、沸点及溶解度)
影响物质的化学性质(主)和物理性质
【课堂小结】
二、分子间的作用力
练习:下列有关水的叙述中,不能用氢键的知识来解释的是( )
A、 0℃时,水的密度比冰大 B、水的熔沸点比硫化氢的高
C、测得H2O的相对分子质量大于18 D、水比硫化氢气体稳定
D
共价化合物:
键能大小影响分子的热稳定性,
分子间作用力的大小影响物质的熔、沸点。
(5)氢键对物质物理性质的影响
2.氢键及其对物质性质的影响
二、分子间的作用力
练习:回答下列问题:
(1)已知A、B的结构如下:
A的熔、沸点高于B的原因为_________________。
A分子间存在氢键
(2)邻羟基苯胺的沸点______对羟基苯胺的沸点(填“低于” “高于”或“不确定”);其原因是:
__________________________________________________________________________________________________________________________________________________。
低于
邻羟基苯胺容易形成分子内氢键,沸点降低,对羟基苯胺容易形成分子间氢键,沸点升高,因此邻羟基苯胺的沸点低于对羟基苯胺的沸点。
(5)氢键对物质物理性质的影响
2.氢键及其对物质性质的影响
二、分子间的作用力
DNA分子有两条链,链内原子之间以很强的共价键结合,链之间则是两条链上的碱基以氢键配对,许许多多的氢键将两条链连成独特的双螺旋结构,这是遗传基因复制机理的化学基础。
生物大分子中的氢键
科学 技术 社会
2.氢键及其对物质性质的影响
二、分子间的作用力
①昆虫为什么能在“水上漂”?
水中的氢键很脆弱,破坏快,形成也快,导致水分子总是以不稳定的氢键连成一片。水的这一特性使水有了较强的内聚力和表面能力。由于具有较高的表面能力,所以昆虫能在水面上行走。当然也和昆虫本身所具有的结构有关系.
【视野拓展】
2.氢键及其对物质性质的影响
二、分子间的作用力
羊毛纤维是蛋白质构成的,蛋白质上的氨基和羰基可能会形成氢键。羊毛在浸水和干燥的过程中,会在这些氢键处纳入水和去除水,原先的氢键部位可能发生移动,而且这变化往往是不可逆的,从而改变了原先蛋白质的构造,由此引起羊毛织品变形。
②羊毛织品水洗后为什么会变形
2.氢键及其对物质性质的影响
二、分子间的作用力
【视野拓展】
《肘后备急方》:“青蒿一握,以水二升渍,绞取汁,尽服之”
屠呦呦团队先后经历了用水、乙醇、乙醚提取青蒿素的过程,最终用乙醚在低温下成功提取了青蒿素,治疗疟疾,挽救了无数人的生命。
思考:为什么需要用乙醚来提取青蒿素,用水不可以呢?
青蒿素
萃取——青蒿素的提取
3.溶解性
二、分子间的作用力
萃取——青蒿素的提取
3.溶解性
二、分子间的作用力
2)分子结构相似
溶质和溶剂的分子结构相似程度越大,其溶解性越大。
非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
1)分子极性相似
若溶剂和溶质之间有氢键,则氢键作用力越大,溶解性越好。
若溶剂和溶质之间无氢键,则溶质在水中的溶解度比较小。
3.溶解性
二、分子间的作用力
①相似相溶
(1) 影响物质溶解性的因素
如果溶质与水发生化学反应,则可增大其溶解度。
③发生化学反应:
②氢键
例如:CCl4是非极性分子,是非极性溶剂;而H2O是极性分子,是极性溶剂。
a. 萘、Br2、I2等都是非极性分子,所以易溶于CCl4、苯,而难溶于水。
b. 蔗糖、氨、HCl、H2SO4是极性分子,易溶于水而难溶于CCl4。
注:
常见的极性溶剂:水、乙醇、甘油(甘油是丙三醇)等
常见的非极性溶剂:CCl4、苯、环己烷等
这是一条经验规律,有不符合规律的情况:如CO、NO等极性分子均难溶于水;不少盐类(如AgCl、PbSO4、BaCO3等)也难溶于水;H2、N2难溶于水也难溶于苯等。
3.溶解性
二、分子间的作用力
1)分子极性相似相溶
(1) 影响物质溶解性的因素
乙醇CH3CH2OH分子中的—OH与水分子的—OH相近,因而乙醇与水能互溶;而戊醇CH3CH2CH2CH2CH2OH中的烃基较大,其中的-OH跟水分子的-OH相似因素小得多了,因而它在水中的溶解度明显减小。
2)分子结构相似相溶
思考:乙醇、戊醇都是极性分子,为什么乙醇可以与水任意比例互溶,而戊醇的溶解度小?
规律:随分子中的碳原子数增加,饱和一元醇在水中的溶解度逐渐减小。
例如:低级醇、低级醛、低级酸均易溶于水(当然也有氢键的因素),
高级醇、高级醛、高级酸含疏水基团(烃基)越大,溶解性越差。
3.溶解性
二、分子间的作用力
某些物质在293 K 100 g 水中的溶解度
名称 甲醇 乙醇 1-丙醇 1-丁醇 1-戊醇
溶解度/g ∞ ∞ ∞ 0.11 0.030
(1) 影响物质溶解性的因素
因为NH3与水分子形成了氢键,且NH3是极性分子,水也是极性分子。
思考:为什么NH3在水中的溶解度最大呢
某些气体的溶解度如下表(压强为1.01×105 Pa,温度为293 K)
气体 溶解度/g 气体 溶解度/g 气体 溶解度/g 气体 溶解度/g
甲烷 0.0023 乙烷 0.0062 乙烯 0.0149 乙炔 0.117
氢气 0.00016 氮气 0.0019 氧气 0.0043 氯气 0.729
一氧化碳 0.0028 二氧化碳 0.169 二氧化硫 11.28 氨气 52.9
3.溶解性
二、分子间的作用力
(1) 影响物质溶解性的因素
若溶剂和溶质之间有氢键,则氢键作用力越大,溶解性越好。
②氢键:
如果溶质与水发生化学反应,则可增大其溶解度。
③发生化学反应:
思考:为什么Cl2、CO2是非极性分子, 在水中的溶解度却比H2大
某些气体的溶解度如下表(压强为1.01×105 Pa,温度为293 K)
气体 溶解度/g 气体 溶解度/g 气体 溶解度/g 气体 溶解度/g
甲烷 0.0023 乙烷 0.0062 乙烯 0.0149 乙炔 0.117
氢气 0.00016 氮气 0.0019 氧气 0.0043 氯气 0.729
一氧化碳 0.0028 二氧化碳 0.169 二氧化硫 11.28 氨气 52.9
3.溶解性
二、分子间的作用力
(1) 影响物质溶解性的因素
因为Cl2、CO2能与水反应,可增大其溶解度。
【思考与讨论】
1、比较NH3和CH4在水中的溶解度。怎样用“相似相溶”规律理解它们的溶解度不同?
NH3分子在水中的溶解:
相似相溶:NH3分子和H2O分子都是极性分子。
氢 键:NH3分子与H2O分子之间形成氢键,促进了NH3的溶解。
反 应:部分NH3分子与H2O分子反应生成NH3·H2O,促进了NH3的溶解。
CH4分子在水中的溶解:
相似相溶:CH4是非极性分子,难溶于极性溶剂水中。
3.溶解性
二、分子间的作用力
2、为什么在日常生活中用有机溶剂(如乙酸乙酯)溶解油漆而不用水?
油漆的主要成分
乙酸乙酯、苯、甲苯等有机溶剂
非极性或极性很小分子
【思考与讨论】
3.溶解性
二、分子间的作用力
因为油漆的主要成分是非极性或极性很小的有机分子,故易溶于非极性或极性很小的有机溶剂中,如苯、甲苯、乙酸乙酯等,而不溶于水。
(3)在一个小试管里放入一小粒碘晶体,加入约5 mL蒸馏水,观察碘在水中的溶解性(若有不溶的碘,可将碘水溶液倾倒在另一个试管里继续下面的实验)。在碘水溶液中加入约1 ml CCl4,振荡试管,观察碘被CCl4萃取,形成紫红色的碘的CCl4溶液。再向试管里加入1 ml 浓碘化钾(KI)水溶液,振荡试管,溶液紫色变浅,这是由于在水溶液里可发生如下反应:I2+I- I3-。实验表明碘在纯水还是在CCl4中溶解性较好 为什么?
→I2是非极性分子,所以在极性溶剂水中的溶解度很小,而易溶于非极性溶剂CCl4 。
→碘水中加人浓的KI溶液后,由于发生反应:I2+I- I3-,
碘生成了无色的I3-,并溶解到水中,碘的浓度降低,所以溶液紫色变浅。
3.溶解性
二、分子间的作用力
【思考与讨论】
为什么需要用乙醚来提取青蒿素,用水不可以呢?
CH3CH2—O—CH2CH3
乙醚
3.溶解性
二、分子间的作用力
青蒿素
分子极性角度:
青蒿素和乙醚的极性小,所以青蒿素在水中的溶解度小,在乙醚中的溶解度大。
分子结构角度:
青蒿素中含有醚键,乙醚中也有醚键。 相似相溶!
例2、下列关于氢键的说法中正确的是( )
A. 每个水分子内含有两个氢键
B. 在所有的水蒸气、水、冰中都含有氢键
C. 分子间能形成氢键,使物质的熔沸点升高
D. HF稳定性很强,是因为其分子间能形成氢键
C
例1、根据“相似相溶”规律和实际经验,下列叙述不正确的是( )
A、卤化氢易溶于水,也易溶于CCl4
B、白磷(P4)易溶于CS2,但难溶于水
C、碘易溶于苯,微溶于水
D、NaCl易溶于水,难溶于CCl4
A
3.溶解性
二、分子间的作用力
例3、下列现象与氢键有关的是( )
①HF的熔、沸点比ⅦA族其他元素氢化物的高
②乙醇可以和水以任意比互溶
③冰的密度比液态水的密度小
④水分子高温下也很稳定
⑤ 邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
A.②③④⑤ B.①②③⑤ C.①②③④ D.①②③④⑤
B
3.溶解性
二、分子间的作用力
溶解性
相似相溶
氢 键
发生反应
分子极性相似
分子结构相似
课堂小结:
二、分子间的作用力
第二章 分子结构与性质
第三节 分子结构与物质性质
学习
目标
第3课时
分子的手性
1.结合实例初步认识分子的手性对其性质的影响。
2.能从微观角度理解分子的手性,形成判断手性分子的思维模型。
观察一下两组图片,有何特征?
左右手互为镜像
左手和右手不能重叠
三、分子的手性
人的左、右手互为实物 和 镜像,但彼此不能重合。
具有完全相同的组成和原子排列的一对分子,犹如实物和镜像,但彼此不能重合,互称手性异构体(或对映异构体)。
有手性异构体的分子叫做手性分子。
物质的这种特征叫手性
三、分子的手性
1.概念:
(1) 手性异构体:
(2) 手性分子:
如 CHFClBr的空间结构
绕轴旋转
不能叠合
三、分子的手性
例如:
手性碳原子
三、分子的手性
2.手性分子的判断方法:
①当碳原子连接4 个不同的原子或基团时,该碳原子称为手性碳原子,标记为﹡。
②手性碳原子一定是饱和碳原子。
①当碳原子连接4 个不同的原子或基团时,该碳原子称为手性碳原子,标记为*.
②手性碳原子一定是饱和碳原子。
﹡
﹡
﹡
例1:标出下列物质的手性碳原子:
﹡
﹡
﹡
﹡
﹡
﹡
﹡
三、分子的手性
2.手性分子的判断方法:
例2、当一个碳原子连接四个不同的原子或基团时,该碳原子叫“手性碳原子”。下列化合物中含有2个手性碳原子的是( )
A
B
C
D
C
三、分子的手性
2.手性分子的判断方法:
2001年,诺贝尔化学奖授予三位用手性催化剂生产手性药物的化学家。用他们的合成方法,可以只得到一种或者主要只得到一种手性分子,不得到或者基本上不得到它的手性异构分子,这种独特的合成方法称为手性合成。手性合成的药物生产造福人类并带来巨大的经济效益。
三、分子的手性
3.手性分子的应用:
①合成手性药物
②合成手性催化剂
手性合成、手性催化方面做出贡献的科学家
阅读课本P60—61,了解手性分子的发展和应用
三、分子的手性
3.手性分子的应用:
分子的手性
手性异构体
手 性 分 子
手性碳原子
手性分子的应用
三、分子的手性
课堂小结:
1、已知O3的空间结构为V形,分子中正电中心和负电中心不重合,则下列关于O3和O2在水中的溶解度的叙述正确的是( )
A、O3在水中的溶解度和O2的一样
B、O3在水中的溶解度比O2的小
C、O3在水中的溶解度比O2的大
D、无法比较
C
课后练习:
三、分子的手性
2、下列说法不正确的是( )
A、互为手性异构体的分子互为镜像
B、利用手性催化剂可主要得到一种手性分子
C、手性异构体分子组成相同
D、手性异构体性质相同
D
3、手性分子往往具有一定光学活性。乳酸分子是手性分子,如图 。乳酸中的手性碳原子是( )
A、① B、② C、③ D、②③
B
课后练习:
三、分子的手性
4、下列分子中,不含手性碳原子的是( )
A、 B、
C、 D、CH3CHClCH2CHO
B
课后练习:
三、分子的手性
5、下列说法不正确的是( )
A、 HClO、H2CO3、HNO3、HClO4的酸性依次增强
B、苹果酸 含有1个手性碳原子
C、HCl、NH3、C2H5OH均易溶于水的原因之一是与H2O分子均形成氢键
D、以极性键结合的分子不一定是极性分子
C
课后练习:
三、分子的手性
6、下列对分子的性质的解释,错误的是( )
A、HF易溶于水,是因为HF与水分子间形成氢键
B、 分子中只含有2个手性碳原子
C、次磷酸(H3PO2)与足量的NaOH溶液反应生成NaH2PO2,可知H3PO2是一元酸
D、H2O2分子的结构为 ,可知H2O2为极性分子
B
课后练习:
三、分子的手性
第二章 分子结构与性质
第三节 分子结构与物质性质
学习
目标
第2课时
分子间作用力
1.认识分子间存在相互作用,知道范德华力是常见的分子间作用力;能说明范德华力对物质熔点、沸点等性质的影响,形成“结构决定性质”的基本观念。
2.知道氢键是常见的分子间作用力;能说明氢键对物质熔点、沸点等性质的影响,能举例说明氢键对于生命的重大意义。
3.知道物质的溶解性与分子结构的关系,了解“相似相溶”规律。
为什么下雪不冷,化雪冷呢?
雪融化现象是物理变化还是化学变化?
雪过程中有没有破坏其中的化学键?
冰雪
水
水蒸气
(固)
(液)
(气)
分子间距离增大
思考:
→雪融化成水,需要吸收热量;把水变成水蒸气仍然需要吸收热量。
吸收的热量用于破坏某种分子间作用力,这说明水分子之间存在着相互作用力。
思考:吸收的热量去哪里了呢?
100℃:水会剧腾沸腾
3000℃: 水分解产生氧气和氢气
化学变化
分子内化学键破坏
水分子之间存在着相互作用力
物理变化
两个变化
有何异同
1.范德华力及其对物质性质的影响
二、分子间的作用力
(1)定义:
把分子聚集在一起的作用力称为分子间作用力,又叫范德华力。(普遍存在于固体、液体和气体分子间的作用力)
(2)存在:
非金属单质(除C、Si)分子。稀有气体分子,共价化合物(SiO2、SiC)
分子之间,石墨片层之间。
1.范德华力及其对物质性质的影响
二、分子间的作用力
(3)特点:(与共价键的区别)
①范德华力很弱,约比化学键键能小1-2个数量级。
②广泛存在于分子之间。只要分子充分接近就有范德华力。
③范德华力没有方向性和饱和性:只要分子周围空间允许,分子总是尽可能多地吸引其他分子。
微粒间 作用力 能量
kJ·mol -1
化学键 100 - 600
范德华力 2 - 20
(4)影响因素
分子 Ar CO HI HBr HCl
相对分子质量 40 28 129 81 36.5
范德华力 (kJ/mol) 8.50 8.75 26.00 23.11 21.14
②对于组成和结构相似的分子,相对分子质量越大,范德华力越大。
①分子极性越大,范德华力越大。
1.范德华力及其对物质性质的影响
二、分子间的作用力
[思考]为什么范德华力:CO>Ar
[思考]为什么:HI>HBr>HCl>CO
表2-7 某些分子间的作用力
③对于相对分子质量、极性相似的分子,分子的对称性越强,范德华力越弱,如正丁烷>异丁烷,邻二甲苯>间二甲苯>对二甲苯。
范德华力主要影响物质的物理性质。如熔、沸点。
规律1:结构相似的分子,相对分子质量越大,范德华力越大,熔、沸点越高。
(5)范德华力对物质性质的影响:
1.范德华力及其对物质性质的影响
二、分子间的作用力
规律2:相对分子质量相同或相近时,分子的极性越大,范德华力越大,熔、沸点越高。
规律3:在同分异构体中,一般来说,支链越多(越分散),熔、沸点就越低。
如:熔沸点: I2>Br2>Cl2>F2
如:熔沸点: CO>N2
如:熔沸点: 正戊烷>异戊烷>新戊烷
Cl2、Br2、I2的相对分子质量依次增大,
范德华力依次增大,熔、沸点依次增大
(5)范德华力对物质性质的影响:
1.范德华力及其对物质性质的影响
二、分子间的作用力
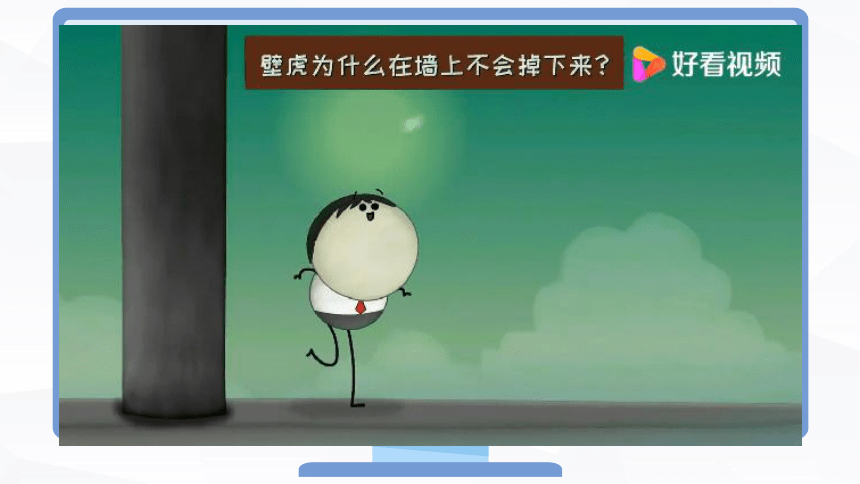
夏天经常见到许多壁虎在墙壁或天花板上爬却掉不下来,为什么?
近年来,有人用计算机模拟,证明壁虎的足与墙体之间的作用力在本质上是它的细毛与墙体之间的范德华力。
科学 技术 社会
1.范德华力及其对物质性质的影响
二、分子间的作用力
壁虎与范德华力
化学键 范德华力
概念
存在范围
作用力强弱
影响的性质
使原子(离子)结合的相互作用
把分子聚集在一起的作用力
分子内、原子间
分子间
强烈
微弱
影响物质的化学性质和物理性质
影响物质的物理性质(熔、沸点及溶解度等)
化学键与范德华力的比较
1.范德华力及其对物质性质的影响
二、分子间的作用力
1)将干冰气化,破坏了CO2分子的—————
2)将CO2气体溶于水,破坏了CO2分子的————
范德华力
共价键
3)解释CCl4(液体),CH4及CF4是气体,CI4是固体的原因。
它们空间构型均是正四面体,结构相似,相对分子质量越大,范德华力越大,聚集程度越大。范德华力比较小时呈气态,随范德华力增大时变为液体,大到一定程度时变为固体
【练习】
1.范德华力及其对物质性质的影响
二、分子间的作用力
4)人们熟悉的影片《蜘蛛侠》为我们塑造了一个能飞檐走壁、过高楼如履平地的蜘蛛侠,现实中的蜘蛛能在天花板等比较滑的板面上爬行,蜘蛛之所以不能从天花板上掉下的主要原因是( )
A.蜘蛛脚的尖端锋利,能抓住天花板
B.蜘蛛的脚上有“胶水”,从而能使蜘蛛粘在天花板上
C.蜘蛛脚上的大量细毛与天花板之间的范德华力这一“黏力”使蜘蛛不致坠落
D.蜘蛛有特异功能,能抓住任何物体
C
1.范德华力及其对物质性质的影响
二、分子间的作用力
【练习】
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
×
×
×
×
CH4
SiH4
GeH4
SnH4
NH3
PH3
AsH3
SbH3
HF
HCl
HBr
HI
H2O
H2S
H2Se
H2Te
沸
点
/℃
周期
【情景引入】一些氢化物的沸点:
→对于同一主族非金属元素氢化物而言,从上到下,相对分子质量逐渐增大,范德华力逐渐增大,熔沸点逐渐升高.而HF、H2O、NH3却出现反常,为什么?
→说明在HF、H2O、NH3分子间还存在除范德华力之外的其他作用.
这种作用力就是氢键.
二、分子间的作用力
- - - - - - - - - -
在水分子的O-H中,共用电子对强烈的偏向O,使得H几乎成为“裸露”的质子,其显正电性,它能与另一个水分子中相对显负电性的O的孤电子对产生静电作用,这种静电作用就是氢键。
2.氢键及其对物质性质的影响
二、分子间的作用力
由已经与电负性很大的原子(如N、O、F)形成共价键的氢原子与
另一分子中电负性很大的原子(如N、O、F)之间的作用力叫氢键。
如:
H
F
H
F
H
F
H
F
2.氢键及其对物质性质的影响
二、分子间的作用力
(1)定义:
(2)表示方法:
注:氢键是除范德华力之外的另一种分子间作用力,它不是化学键。
① X、Y为N、O、F。
②X、Y可以相同,也可以不同。
③“—”表示共价键,“···”表示氢键
用X—H···Y — 表示
①氢键不属于化学键:化学键>氢键>范德华力。
②分子有氢键就一定有范德华力,有范德华力不一定有氢键。
③与氢原子形成氢键时,电负性越大,氢键越强。
④氢键会使物质熔、沸点大大增加。
⑤氢键具有一定的方向性和饱和性。
饱和性:每一个X—H只能与一个Y原子形成氢键,原因是H原子半径很小,再有一个原子接近时,会受到X、Y原子电子云的排斥。
方向性:X—H···Y—三个原子一般在同一方向上。原因是在这样的方向上成键两原子电子云之间的排斥力最小,形成的氢键最强,体系最稳定。
H
F
H
F
H
F
H
F
2.氢键及其对物质性质的影响
二、分子间的作用力
(3)氢 键 特 征:
(4)分类:
邻羟基苯甲醛
(熔点-7℃ 沸点196.5℃)
对羟基苯甲醛
(熔点115℃ 沸点246.6℃)
2.氢键及其对物质性质的影响
二、分子间的作用力
分子内氢键和分子间氢键
① 分子间氢键:(属于分子间作用力)
如:H2O、NH3、HF、C2H5OH、
CH3COOH相互之间。
② 分子内氢键(不属于分子间作用力)
沸点:分子间氢键>分子内氢键
如:当苯酚在邻位上有—CHO、—COOH、
—NO2和 —OH时,可形成分子内的氢键。
注:分子内氢键可以使分子更稳定。且分子内氢键会削弱分子间氢键形成,故一般熔沸点较低。
分子间氢键
分子内氢键
邻羟基苯甲醛在分子内形成氢键,在分子间就不存在氢键了,只存在范德华力。
对羟基苯甲醛不存在分子内氢键,只能在分子间形成氢键。
(5)氢键对物质物理性质的影响
①分子间氢键使物质熔、沸点升高。
③对物质溶解度的影响
2.氢键及其对物质性质的影响
二、分子间的作用力
→分子间存在氢键时,物质在熔化或汽化时,除需破坏范德华力外,还需破坏分子间氢键,消耗更多的能量,所以存在分子间氢键的物质一般具有较高的熔、沸点。
如ⅤA~ⅦA族元素的氢化物中,NH3、H2O和HF的熔、沸点比同主族相邻元素氢化物的熔、沸点高,这种反常现象是由于它们各自的分子间形成了氢键。
②分子内氢键使物质熔、沸点降低.
→如熔、沸点:邻羟基苯甲酸( )<对羟基苯甲酸( )
→溶剂和溶质之间形成氢键使溶质的溶解度增大,如氨、甲醇、甲醛、甲酸等易溶于水。
(5)氢键对物质物理性质的影响
2.氢键及其对物质性质的影响
二、分子间的作用力
④氢键对水分子的影响
b.水结冰时,体积膨胀,密度降低。
a.氢键使水分子沸点反常的高
c.接近水的沸点的水蒸气的相对分子质量的测定值比按化学式H2O计算出来的相对分子质量大。
在水蒸气中:水以单个的H2O分子形式存在;无氢键。
液态水中:除了含有简单H2O外,还含有通过氢键联结在一起的缔合分子(H2O)2、(H2O)3……(H2O)n等。
在固态水(冰)中:水分子大范围地以氢键互相联结成为晶体,因此在冰的结构中形成许多空隙,体积膨胀,密度减小。
—接近水的沸点的水蒸气中存在相当量的水分子因氢键而相互缔合,形成所谓的缔合分子(H2O)n。
定义
范德华力
氢键
共价键
作用微粒
把分子聚集在一起的相互作用力
氢原子与电负性大的原子X以共价键结合时,H原子还能够跟另外一个电负性大的原子Y之间产生静电作用
相邻原子之间通过共用电子对形成的化学键
相邻原子之间
分子间或分子内
分子之间
强弱
弱
较强
很强
对物质性质的影响
影响物质的物理性质(熔、沸点及溶解度)
影响某些物质(如水、氨气)的物理性质(熔、沸点及溶解度)
影响物质的化学性质(主)和物理性质
【课堂小结】
二、分子间的作用力
练习:下列有关水的叙述中,不能用氢键的知识来解释的是( )
A、 0℃时,水的密度比冰大 B、水的熔沸点比硫化氢的高
C、测得H2O的相对分子质量大于18 D、水比硫化氢气体稳定
D
共价化合物:
键能大小影响分子的热稳定性,
分子间作用力的大小影响物质的熔、沸点。
(5)氢键对物质物理性质的影响
2.氢键及其对物质性质的影响
二、分子间的作用力
练习:回答下列问题:
(1)已知A、B的结构如下:
A的熔、沸点高于B的原因为_________________。
A分子间存在氢键
(2)邻羟基苯胺的沸点______对羟基苯胺的沸点(填“低于” “高于”或“不确定”);其原因是:
__________________________________________________________________________________________________________________________________________________。
低于
邻羟基苯胺容易形成分子内氢键,沸点降低,对羟基苯胺容易形成分子间氢键,沸点升高,因此邻羟基苯胺的沸点低于对羟基苯胺的沸点。
(5)氢键对物质物理性质的影响
2.氢键及其对物质性质的影响
二、分子间的作用力
DNA分子有两条链,链内原子之间以很强的共价键结合,链之间则是两条链上的碱基以氢键配对,许许多多的氢键将两条链连成独特的双螺旋结构,这是遗传基因复制机理的化学基础。
生物大分子中的氢键
科学 技术 社会
2.氢键及其对物质性质的影响
二、分子间的作用力
①昆虫为什么能在“水上漂”?
水中的氢键很脆弱,破坏快,形成也快,导致水分子总是以不稳定的氢键连成一片。水的这一特性使水有了较强的内聚力和表面能力。由于具有较高的表面能力,所以昆虫能在水面上行走。当然也和昆虫本身所具有的结构有关系.
【视野拓展】
2.氢键及其对物质性质的影响
二、分子间的作用力
羊毛纤维是蛋白质构成的,蛋白质上的氨基和羰基可能会形成氢键。羊毛在浸水和干燥的过程中,会在这些氢键处纳入水和去除水,原先的氢键部位可能发生移动,而且这变化往往是不可逆的,从而改变了原先蛋白质的构造,由此引起羊毛织品变形。
②羊毛织品水洗后为什么会变形
2.氢键及其对物质性质的影响
二、分子间的作用力
【视野拓展】
《肘后备急方》:“青蒿一握,以水二升渍,绞取汁,尽服之”
屠呦呦团队先后经历了用水、乙醇、乙醚提取青蒿素的过程,最终用乙醚在低温下成功提取了青蒿素,治疗疟疾,挽救了无数人的生命。
思考:为什么需要用乙醚来提取青蒿素,用水不可以呢?
青蒿素
萃取——青蒿素的提取
3.溶解性
二、分子间的作用力
萃取——青蒿素的提取
3.溶解性
二、分子间的作用力
2)分子结构相似
溶质和溶剂的分子结构相似程度越大,其溶解性越大。
非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
1)分子极性相似
若溶剂和溶质之间有氢键,则氢键作用力越大,溶解性越好。
若溶剂和溶质之间无氢键,则溶质在水中的溶解度比较小。
3.溶解性
二、分子间的作用力
①相似相溶
(1) 影响物质溶解性的因素
如果溶质与水发生化学反应,则可增大其溶解度。
③发生化学反应:
②氢键
例如:CCl4是非极性分子,是非极性溶剂;而H2O是极性分子,是极性溶剂。
a. 萘、Br2、I2等都是非极性分子,所以易溶于CCl4、苯,而难溶于水。
b. 蔗糖、氨、HCl、H2SO4是极性分子,易溶于水而难溶于CCl4。
注:
常见的极性溶剂:水、乙醇、甘油(甘油是丙三醇)等
常见的非极性溶剂:CCl4、苯、环己烷等
这是一条经验规律,有不符合规律的情况:如CO、NO等极性分子均难溶于水;不少盐类(如AgCl、PbSO4、BaCO3等)也难溶于水;H2、N2难溶于水也难溶于苯等。
3.溶解性
二、分子间的作用力
1)分子极性相似相溶
(1) 影响物质溶解性的因素
乙醇CH3CH2OH分子中的—OH与水分子的—OH相近,因而乙醇与水能互溶;而戊醇CH3CH2CH2CH2CH2OH中的烃基较大,其中的-OH跟水分子的-OH相似因素小得多了,因而它在水中的溶解度明显减小。
2)分子结构相似相溶
思考:乙醇、戊醇都是极性分子,为什么乙醇可以与水任意比例互溶,而戊醇的溶解度小?
规律:随分子中的碳原子数增加,饱和一元醇在水中的溶解度逐渐减小。
例如:低级醇、低级醛、低级酸均易溶于水(当然也有氢键的因素),
高级醇、高级醛、高级酸含疏水基团(烃基)越大,溶解性越差。
3.溶解性
二、分子间的作用力
某些物质在293 K 100 g 水中的溶解度
名称 甲醇 乙醇 1-丙醇 1-丁醇 1-戊醇
溶解度/g ∞ ∞ ∞ 0.11 0.030
(1) 影响物质溶解性的因素
因为NH3与水分子形成了氢键,且NH3是极性分子,水也是极性分子。
思考:为什么NH3在水中的溶解度最大呢
某些气体的溶解度如下表(压强为1.01×105 Pa,温度为293 K)
气体 溶解度/g 气体 溶解度/g 气体 溶解度/g 气体 溶解度/g
甲烷 0.0023 乙烷 0.0062 乙烯 0.0149 乙炔 0.117
氢气 0.00016 氮气 0.0019 氧气 0.0043 氯气 0.729
一氧化碳 0.0028 二氧化碳 0.169 二氧化硫 11.28 氨气 52.9
3.溶解性
二、分子间的作用力
(1) 影响物质溶解性的因素
若溶剂和溶质之间有氢键,则氢键作用力越大,溶解性越好。
②氢键:
如果溶质与水发生化学反应,则可增大其溶解度。
③发生化学反应:
思考:为什么Cl2、CO2是非极性分子, 在水中的溶解度却比H2大
某些气体的溶解度如下表(压强为1.01×105 Pa,温度为293 K)
气体 溶解度/g 气体 溶解度/g 气体 溶解度/g 气体 溶解度/g
甲烷 0.0023 乙烷 0.0062 乙烯 0.0149 乙炔 0.117
氢气 0.00016 氮气 0.0019 氧气 0.0043 氯气 0.729
一氧化碳 0.0028 二氧化碳 0.169 二氧化硫 11.28 氨气 52.9
3.溶解性
二、分子间的作用力
(1) 影响物质溶解性的因素
因为Cl2、CO2能与水反应,可增大其溶解度。
【思考与讨论】
1、比较NH3和CH4在水中的溶解度。怎样用“相似相溶”规律理解它们的溶解度不同?
NH3分子在水中的溶解:
相似相溶:NH3分子和H2O分子都是极性分子。
氢 键:NH3分子与H2O分子之间形成氢键,促进了NH3的溶解。
反 应:部分NH3分子与H2O分子反应生成NH3·H2O,促进了NH3的溶解。
CH4分子在水中的溶解:
相似相溶:CH4是非极性分子,难溶于极性溶剂水中。
3.溶解性
二、分子间的作用力
2、为什么在日常生活中用有机溶剂(如乙酸乙酯)溶解油漆而不用水?
油漆的主要成分
乙酸乙酯、苯、甲苯等有机溶剂
非极性或极性很小分子
【思考与讨论】
3.溶解性
二、分子间的作用力
因为油漆的主要成分是非极性或极性很小的有机分子,故易溶于非极性或极性很小的有机溶剂中,如苯、甲苯、乙酸乙酯等,而不溶于水。
(3)在一个小试管里放入一小粒碘晶体,加入约5 mL蒸馏水,观察碘在水中的溶解性(若有不溶的碘,可将碘水溶液倾倒在另一个试管里继续下面的实验)。在碘水溶液中加入约1 ml CCl4,振荡试管,观察碘被CCl4萃取,形成紫红色的碘的CCl4溶液。再向试管里加入1 ml 浓碘化钾(KI)水溶液,振荡试管,溶液紫色变浅,这是由于在水溶液里可发生如下反应:I2+I- I3-。实验表明碘在纯水还是在CCl4中溶解性较好 为什么?
→I2是非极性分子,所以在极性溶剂水中的溶解度很小,而易溶于非极性溶剂CCl4 。
→碘水中加人浓的KI溶液后,由于发生反应:I2+I- I3-,
碘生成了无色的I3-,并溶解到水中,碘的浓度降低,所以溶液紫色变浅。
3.溶解性
二、分子间的作用力
【思考与讨论】
为什么需要用乙醚来提取青蒿素,用水不可以呢?
CH3CH2—O—CH2CH3
乙醚
3.溶解性
二、分子间的作用力
青蒿素
分子极性角度:
青蒿素和乙醚的极性小,所以青蒿素在水中的溶解度小,在乙醚中的溶解度大。
分子结构角度:
青蒿素中含有醚键,乙醚中也有醚键。 相似相溶!
例2、下列关于氢键的说法中正确的是( )
A. 每个水分子内含有两个氢键
B. 在所有的水蒸气、水、冰中都含有氢键
C. 分子间能形成氢键,使物质的熔沸点升高
D. HF稳定性很强,是因为其分子间能形成氢键
C
例1、根据“相似相溶”规律和实际经验,下列叙述不正确的是( )
A、卤化氢易溶于水,也易溶于CCl4
B、白磷(P4)易溶于CS2,但难溶于水
C、碘易溶于苯,微溶于水
D、NaCl易溶于水,难溶于CCl4
A
3.溶解性
二、分子间的作用力
例3、下列现象与氢键有关的是( )
①HF的熔、沸点比ⅦA族其他元素氢化物的高
②乙醇可以和水以任意比互溶
③冰的密度比液态水的密度小
④水分子高温下也很稳定
⑤ 邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
A.②③④⑤ B.①②③⑤ C.①②③④ D.①②③④⑤
B
3.溶解性
二、分子间的作用力
溶解性
相似相溶
氢 键
发生反应
分子极性相似
分子结构相似
课堂小结:
二、分子间的作用力
第二章 分子结构与性质
第三节 分子结构与物质性质
学习
目标
第3课时
分子的手性
1.结合实例初步认识分子的手性对其性质的影响。
2.能从微观角度理解分子的手性,形成判断手性分子的思维模型。
观察一下两组图片,有何特征?
左右手互为镜像
左手和右手不能重叠
三、分子的手性
人的左、右手互为实物 和 镜像,但彼此不能重合。
具有完全相同的组成和原子排列的一对分子,犹如实物和镜像,但彼此不能重合,互称手性异构体(或对映异构体)。
有手性异构体的分子叫做手性分子。
物质的这种特征叫手性
三、分子的手性
1.概念:
(1) 手性异构体:
(2) 手性分子:
如 CHFClBr的空间结构
绕轴旋转
不能叠合
三、分子的手性
例如:
手性碳原子
三、分子的手性
2.手性分子的判断方法:
①当碳原子连接4 个不同的原子或基团时,该碳原子称为手性碳原子,标记为﹡。
②手性碳原子一定是饱和碳原子。
①当碳原子连接4 个不同的原子或基团时,该碳原子称为手性碳原子,标记为*.
②手性碳原子一定是饱和碳原子。
﹡
﹡
﹡
例1:标出下列物质的手性碳原子:
﹡
﹡
﹡
﹡
﹡
﹡
﹡
三、分子的手性
2.手性分子的判断方法:
例2、当一个碳原子连接四个不同的原子或基团时,该碳原子叫“手性碳原子”。下列化合物中含有2个手性碳原子的是( )
A
B
C
D
C
三、分子的手性
2.手性分子的判断方法:
2001年,诺贝尔化学奖授予三位用手性催化剂生产手性药物的化学家。用他们的合成方法,可以只得到一种或者主要只得到一种手性分子,不得到或者基本上不得到它的手性异构分子,这种独特的合成方法称为手性合成。手性合成的药物生产造福人类并带来巨大的经济效益。
三、分子的手性
3.手性分子的应用:
①合成手性药物
②合成手性催化剂
手性合成、手性催化方面做出贡献的科学家
阅读课本P60—61,了解手性分子的发展和应用
三、分子的手性
3.手性分子的应用:
分子的手性
手性异构体
手 性 分 子
手性碳原子
手性分子的应用
三、分子的手性
课堂小结:
1、已知O3的空间结构为V形,分子中正电中心和负电中心不重合,则下列关于O3和O2在水中的溶解度的叙述正确的是( )
A、O3在水中的溶解度和O2的一样
B、O3在水中的溶解度比O2的小
C、O3在水中的溶解度比O2的大
D、无法比较
C
课后练习:
三、分子的手性
2、下列说法不正确的是( )
A、互为手性异构体的分子互为镜像
B、利用手性催化剂可主要得到一种手性分子
C、手性异构体分子组成相同
D、手性异构体性质相同
D
3、手性分子往往具有一定光学活性。乳酸分子是手性分子,如图 。乳酸中的手性碳原子是( )
A、① B、② C、③ D、②③
B
课后练习:
三、分子的手性
4、下列分子中,不含手性碳原子的是( )
A、 B、
C、 D、CH3CHClCH2CHO
B
课后练习:
三、分子的手性
5、下列说法不正确的是( )
A、 HClO、H2CO3、HNO3、HClO4的酸性依次增强
B、苹果酸 含有1个手性碳原子
C、HCl、NH3、C2H5OH均易溶于水的原因之一是与H2O分子均形成氢键
D、以极性键结合的分子不一定是极性分子
C
课后练习:
三、分子的手性
6、下列对分子的性质的解释,错误的是( )
A、HF易溶于水,是因为HF与水分子间形成氢键
B、 分子中只含有2个手性碳原子
C、次磷酸(H3PO2)与足量的NaOH溶液反应生成NaH2PO2,可知H3PO2是一元酸
D、H2O2分子的结构为 ,可知H2O2为极性分子
B
课后练习:
三、分子的手性
