第一章《有机化合物的结构特点与研究方法》测试卷(含解析)2022-2023学年下学期高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 第一章《有机化合物的结构特点与研究方法》测试卷(含解析)2022-2023学年下学期高二化学人教版(2019)选择性必修3 |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-27 11:58:11 | ||
图片预览


文档简介
第一章《有机化合物的结构特点与研究方法》测试卷
一、单选题
1.我国女药学家屠呦呦因四十多年前发现了青蒿素,有效降低疟疾患者的死亡率,从而获得2015年诺贝尔生理学或医学奖。青蒿素的分子结构如图所示,下列有关青蒿素的说法正确的是
注:手性碳指的是连接4个不同原子或原子团的碳原子
A.青蒿素的分子式是C15H22O5
B.青蒿素具有5个手性碳原子
C.分子中含氧官能团只有酯基
D.分子中所有碳原子可能处于同一平面上
2.下列化学用语错误的是
A.的结构示意图: B.乙烯的分子比例模型:
C.的电子式: D.乙醇的实验式
3.按照有机物的分类,甲醛属于醛,乙酸乙酯属于酯。下列各项对有机物的分类方法与此方法相同的是
①属于环状化合物
②属于卤代烃
③属于链状化合物
④属于羧酸
A.①② B.②③ C.②④ D.①④
4.下列关于同分异构体的说法正确的是
A.甲苯苯环上的一硝基代物有邻硝基甲苯和对硝基甲苯2种
B.苊烯()的一氯代物有5种
C.乙烷的四氯代物有2种
D.萘()的二氯代物共有15种
5.下列化合物的分子中,所有原子可能共平面的是
A.一氯乙烷 B.2-丁烯 C.乙炔 D.甲烷
6.下列叙述正确的是
A.CH4 与 C4H10 互为同系物
B.C3H8 有 2 种同分异构体
C.所有烷烃的分子组成上都满足 CnH2n(n≥1)
D.烷烃分子中,相邻的三个碳原子可能在同一条直线上
7.下列表示正确的是
A.乙炔的结构式:CHCH
B.异戊烷,又称为2-甲基戊烷,其键线式为:
C.葡萄糖的结构简式可能为:
D.NCl3分子的球棍模型
8.双香豆素是一种重要的抗凝血药物,可用于防治血栓形成,其结构如图所示。下列说法正确的是
A.双香豆素中有3种杂化类型的碳原子
B.双香豆素有4种一氯代物
C.双香豆素可以形成分子内氢键
D.用香豆素( )和HCHO合成双香豆素反应的原子利用率为100%
9.下列说法正确的是
A.分馏石油可以得到植物油、柴油、润滑油
B.萘()属于芳香烃,其一氯代物有两种
C.在FeBr3催化下苯和液溴发生自由基型链反应
D.过度使用尿素[CO(NH2)2]会使土壤碱化,可用石灰加以改良
10.分子式为的有机物共有
A.7种 B.8种 C.9种 D.10种
二、填空题
11.氨在化肥生产、贮氢及燃煤烟气脱硫脱硝等领域用途非常广泛。
(1)尿素[CO(NH2)2]与氰酸铵(NH4CNO)互为____;(选填:“同一物质”或“同系物”或“同分异构体”),氰酸铵属于____化合物(选填:“离子”或“共价”)。
(2)液氨是一种贮氢材料,已知:断开1mol共价键吸收的能量数据如表:
共价键 H-H N-H N≡N
kJ·mol-1 436 390.8 946
则合成氨反应:N2(g)+3H2(g)2NH3(g),生成2mol氨气放出____kJ热量,若1molN2与3molH2在一定条件下反应,达到平衡时放出36.32kJ热量,则此时NH3所占的体积分数为____。
(3)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)5N2(g)+6H2O(g)。能说明该反应已达到平衡状态的标志是____(不定项选择)。
a.反应速率4v(NH3)=5v(N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
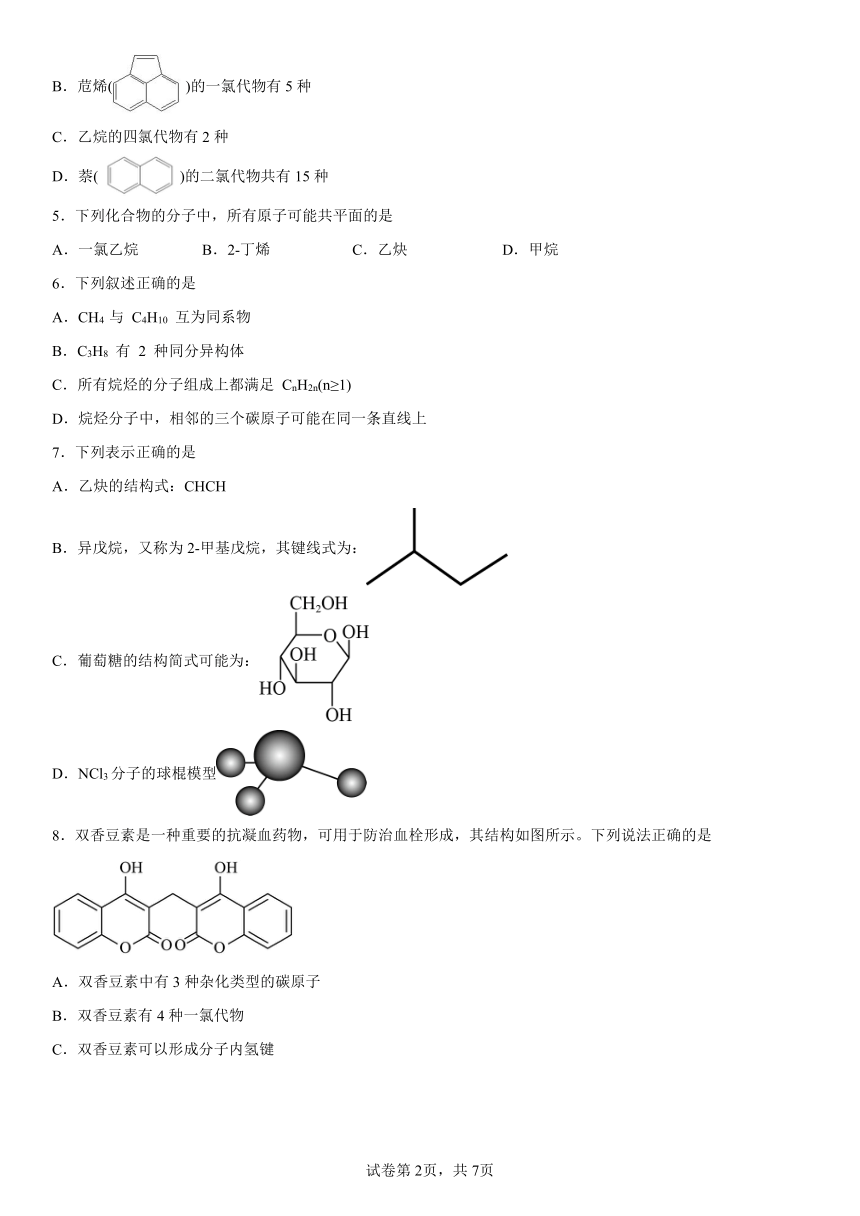
12.化合物G是一种药物合成中间体,其合成路线如下:
写出具有六元环结构、并能发生银镜反应的B的同分异构体的结构简式___________。
13.C( )的同分异构体有多种,其中苯环上有一个甲基的酯类化合物有_______种。
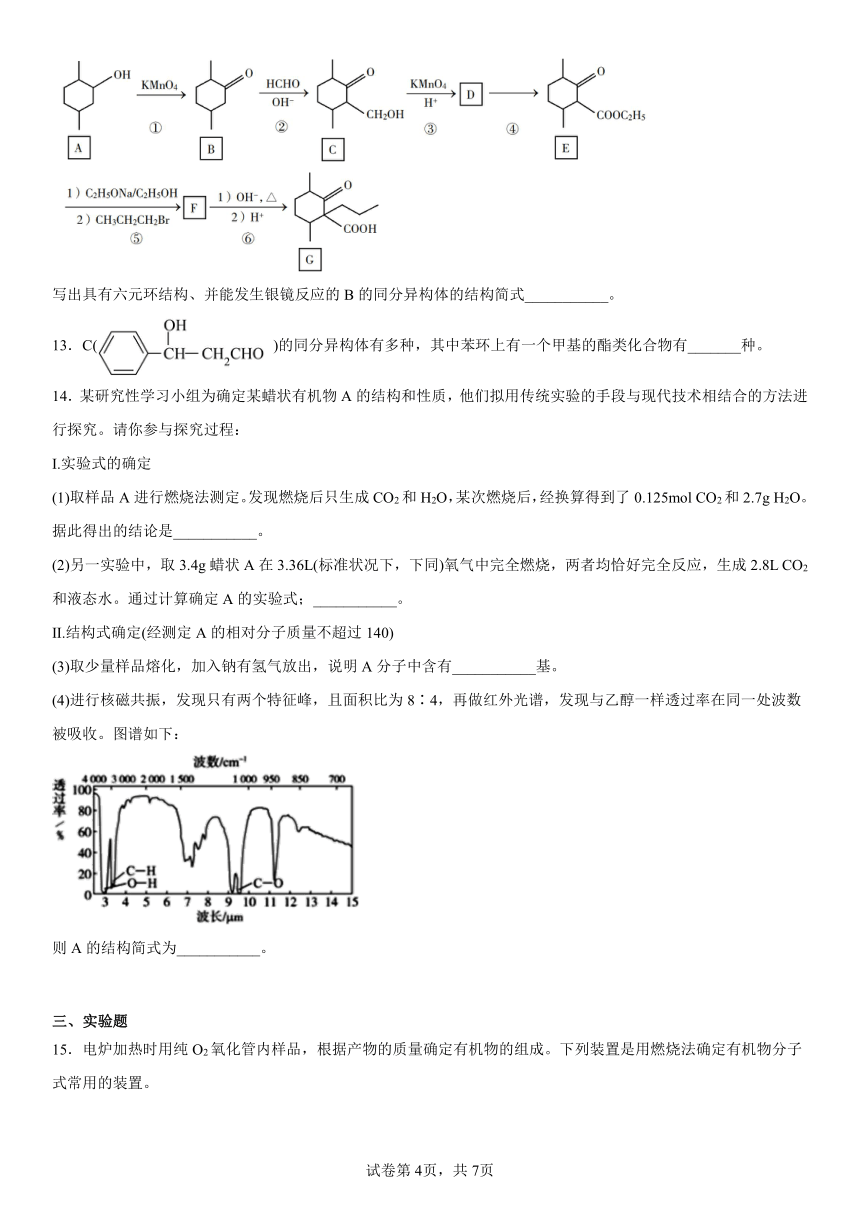
14.某研究性学习小组为确定某蜡状有机物A的结构和性质,他们拟用传统实验的手段与现代技术相结合的方法进行探究。请你参与探究过程:
Ⅰ.实验式的确定
(1)取样品A进行燃烧法测定。发现燃烧后只生成CO2和H2O,某次燃烧后,经换算得到了0.125mol CO2和2.7g H2O。据此得出的结论是___________。
(2)另一实验中,取3.4g蜡状A在3.36L(标准状况下,下同)氧气中完全燃烧,两者均恰好完全反应,生成2.8L CO2和液态水。通过计算确定A的实验式;___________。
Ⅱ.结构式确定(经测定A的相对分子质量不超过140)
(3)取少量样品熔化,加入钠有氢气放出,说明A分子中含有___________基。
(4)进行核磁共振,发现只有两个特征峰,且面积比为8∶4,再做红外光谱,发现与乙醇一样透过率在同一处波数被吸收。图谱如下:
则A的结构简式为___________。
三、实验题
15.电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成。下列装置是用燃烧法确定有机物分子式常用的装置。
(1)按气体从左到右的流向,所选装置各接口的正确连接顺序是___。
(2)C装置中浓硫酸的作用是___。
(3)D装置中MnO2的作用是___。
(4)燃烧管中CuO的作用是___。
(5)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92g样品,经充分反应后,A管质量增加1.76g,B管质量增加1.08g,则该样品的实验式为___。
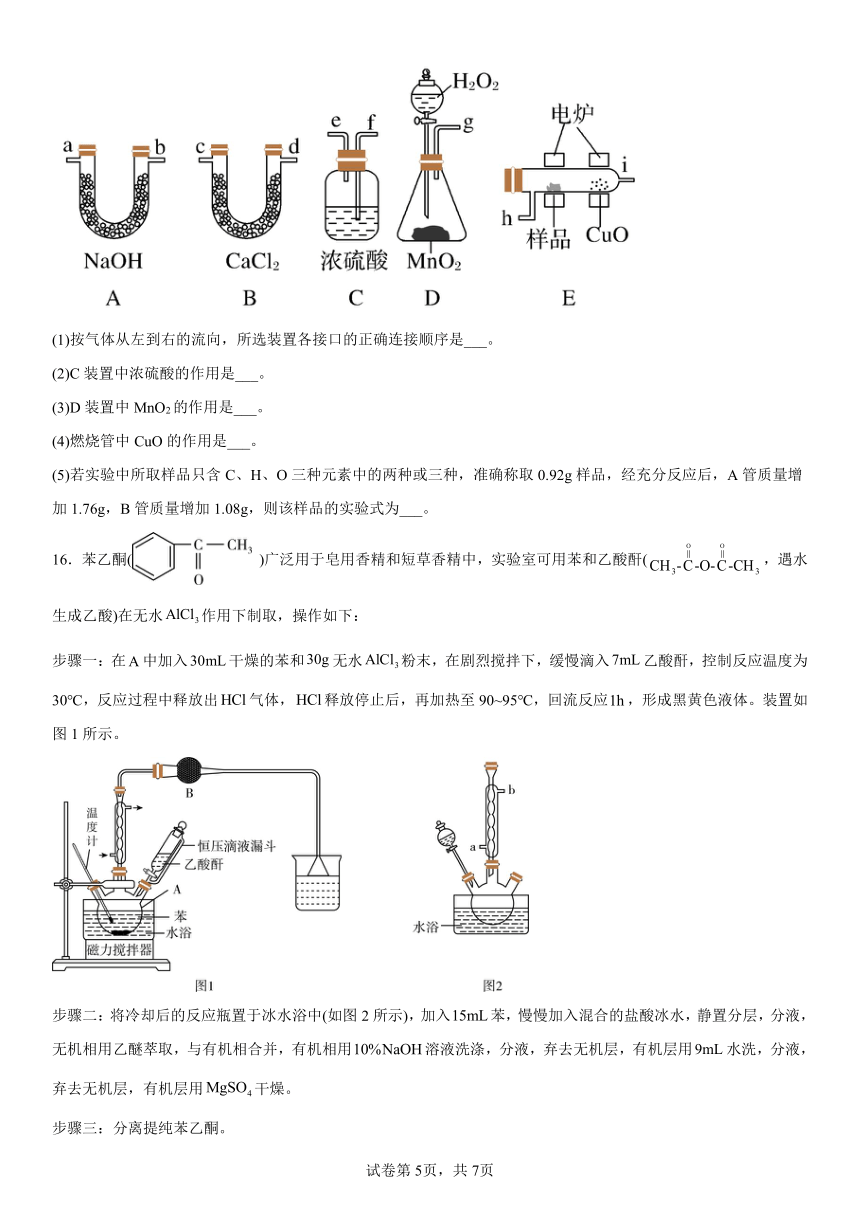
16.苯乙酮( )广泛用于皂用香精和短草香精中,实验室可用苯和乙酸酐(,遇水生成乙酸)在无水作用下制取,操作如下:
步骤一:在中加入干燥的苯和无水粉末,在剧烈搅拌下,缓慢滴入乙酸酐,控制反应温度为30℃,反应过程中释放出气体,释放停止后,再加热至90~95℃,回流反应,形成黑黄色液体。装置如图1所示。
步骤二:将冷却后的反应瓶置于冰水浴中(如图2所示),加入苯,慢慢加入混合的盐酸冰水,静置分层,分液,无机相用乙醚萃取,与有机相合并,有机相用溶液洗涤,分液,弃去无机层,有机层用水洗,分液,弃去无机层,有机层用干燥。
步骤三:分离提纯苯乙酮。
回答下列问题:
(1)仪器的名称是________。写出苯与乙酸酐生成苯乙酮的化学方程式:________。
(2)仪器中盛装无水,其作用是________。
(3)步骤二中多次使用到的操作是________。
(4)已知常压下:
熔点/℃ 沸点/℃
苯 5.5 80.1
乙醚 34.6
苯乙酮 19.6 202
则步骤三分离提纯苯乙酮使用的操作是________;为了收集纯净的苯乙酮馏分,分离苯乙酮应使用下面的图________装置。
四、计算题
17.1828年,德国化学家维勒用氰酸铵(NH4CNO)合成了尿素(),打破了有机物与无机物的界限。
(1)氰酸铵晶体熔化时克服的作用力为_______,氰酸铵晶体比干冰的熔点_______(填“低”“高”或“相等”)。
(2)尿素中氮原子的杂化方式为_______,CH3CONH2中官能团的名称是_______。
(3)0.1mol有机物和0.2molO2在密闭容器中燃烧后的产物为CO2、CO和H2O(g),产物经过浓硫酸后,浓硫酸的质量增加5.4g;再通过灼热CuO充分反应后,固体质量减轻1.6g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加8.8g。
①该有机物的分子式为:_______。
②若0.2mol该有机物恰好与9.2g金属钠完全反应,请写出该反应的化学方程式:_______。
(4)某苯的同系物分子式为C8H10,若苯环上的氢原子被卤原子取代,生成的一卤代物有一种同分异构体,则该苯的同系物的结构简式为_______。
五、有机推断题
18.现有A、B,C、D四种常见烃,A、B、C在常温常压下是无色气体且都是链烃,D为无色液体。①A完全燃烧后的气态产物(CO2和H2O)的体积比为2:1, ②标准状况下lOOmLB恰好能使含1.43g Br2的溴水褪色,生成物经测定每个碳原子都结合有溴原子;③C不能使酸性高锰酸钾溶液褪色,但在光照最多能和6倍体积的氯气发生反应;④D不能使溴水褪色但能使酸性高锰酸钾溶液褪色;在140℃和1.01×105Pa压强下,250mL D蒸气的质量为O.782g,在铁为催化剂时D和溴发生反应生成的一溴代物只有一种,试确定A __________、B__________、C__________、D__________各是什么物质。
19.现有以下十种有机物:① ② ③④CH3CH2CH2CH3⑤CH3CH2CH2COOH ⑥C2H4⑦ ⑧CH3COOCH2CH3⑨⑩CH3CH2CH2OH
请从上述有机物中选择适当物质按要求回答下列问题:
(1)①的名称是_______。
(2)与②互为同系物的是_______(填序号),互为同分异构体的是_______(填序号)。
(3)③的一氯代物有_______种。
(4)在120℃,1.01×105Pa条件下,某种气态烃与足量的O2完全反应后,测得反应前后气体的体积没有发生改变,则该烃是_______(填序号)。
(5)⑦中核磁共振氢谱有_______组峰。
(6)合成有机高分子的单体是_______(填序号)。
(7)若准确称取4.4g样品X(只含C、H、O三种元素),经充分燃烧后产物依次通过浓硫酸和碱石灰,二者质量分别增加3.6g和8.8g。又知有机物X的质谱图和红外光谱分别如图所示,则该有机物的分子式为_______,结构简式可能为_______(从上面提供的物质选择,填序号)。
(8)写出⑨⑩在一定条件下反应的化学方程式_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.由青蒿素的结构简式可知其分子式为:C15H22O5,故A正确;
B.青蒿素具有7个手性碳原子,故B错误;
C.分子中含氧官能团有酯基、醚键还有过氧键结构,故C错误;
D.分子中存在多个饱和碳原子,且有与三个碳原子相连的饱和碳原子,因此所有碳原子不可能共平面,故D错误;
故选:A。
2.C
【详解】A.核内有17个质子,核外有18个电子,则其电子式为 ,故A正确;
B.乙烯中的两个C原子分别与2个H原子形成共价键,碳原子之间也形成碳碳双键,则其比例模型为,故B正确;
C.硫化氢是共价化合物,原子间通过共用电子对形成化合物,所以的电子式:,故C错误;
D.乙醇的分子式、实验式或最简式均为,故D正确;
答案选C。
3.C
【详解】甲醛属于醛,乙酸乙酯属于酯,均是按照有机物中所含官能团进行分类
①是根据碳骨架进行的分类,分成链状化合物和环状化合物,①不符合题意;
②因为含有-Br,因此此有机物属于卤代烃,②符合题意;
③根据碳骨架进行分类,③不符合题意;
④含有羧基,属于羧酸,按照官能团进行分类,④符合题意;
综上,②④符合题意,答案选C。
4.C
【详解】A.甲苯苯环上有3种H原子,甲苯苯环上的一硝基代物有邻硝基甲苯、间硝基甲苯和对硝基甲苯3种,故A错误;
B.苊烯()结构对称,其一氯代物有4种,故B错误;
C.乙烷的二氯代物与四氯代物的同分异构体数目相同,乙烷的二氯代物有2种异构体,则其四氯代物的异构体数目也为2种,故C正确;
D.为对称结构,有2种H原子,其一氯代物2种,则其二氯代物是10种(、),故D错误;
故选C。
5.C
【详解】A.一氯乙烷分子中含有饱和C原子,具有甲烷的四面体结构,因此所有原子不可能共平面,A不符合题意;
B.2-丁烯含有饱和C原子,具有甲烷的四面体结构,因此所有原子不可能共平面,B不符合题意;
C.乙炔分子中四个原子在同一条直线上,因此分子中所有原子共平面,C符合题意;
D.甲烷分子中C原子与4个H原子形成正四面体结构,键角是109°28′,因此分子中所有原子不可能共平面,D不符合题意;
故合理选项是C。
6.A
【详解】A.与均是烷烃,结构相似,二者相差3个原子团,二者互为同系物,A正确;
B.是丙烷,无同分异构体,B错误;
C.烷烃中所含碳原子是饱和的,链状烷烃分子组成上都满足,但环烷烃符合,其通式为,C错误;
D.烷烃分子中的碳原子呈锯齿形,分子中相邻的三个碳原子不可能在同一条直线上,D错误;
故选A。
7.C
【详解】A.乙炔的结构式为H—C≡C—H,选项A错误;
B.异戊烷分子中最长碳链含有4个碳原子,侧链为甲基,又称为2—甲基丁烷,选项B错误;
C.葡萄糖的结构简式为HOCH2 (CHOH)4CHO,分子中的HOCH2—能与—CHO发生加成反应转化为,选项C正确;
D.Cl原子的半径大于N原子半径,NCl3分子的球棍模型是 ,选项D正确;
答案选C。
8.C
【详解】A.苯环和碳碳双键上的C原子采用sp2杂化,亚甲基上的中心C原子采用sp3杂化,共2种杂化方式,A错误;
B.根据等效氢思想可知,双香豆素有5种一氯代物,如图: ,B错误;
C.根据分子结构可知,双香豆素分子内的羟基之间可形成分子内氢键,C正确;
D.2mol香豆素分子( )和1molHCHO在一定条件下可合成1mol双香豆素和 1molH2O,所以反应的原子利用率未达到100%,D错误;
故选C。
9.B
【详解】A.分馏石油可以得到汽油、柴油、润滑油等烷烃,植物油属于酯类,不能通过石油分馏得到,A错误;
B.萘()属于芳香烃,其一氯代物有两种(),B正确;
C.在FeBr3催化下苯和液溴发生取代反应,C错误;
D.过度使用尿素[CO(NH2)2]会使土壤碱化,而石灰与水反应生成的是碱性物质,故不能用其加以改良,D错误;
答案选B。
10.B
【分析】分子式为的有机物,可看作Br原子取代戊烷的H原子,戊烷有3种结构,结合等效氢原子的方法分析判断。
【详解】分子式为的有机物,可看作Br原子取代戊烷的H原子,戊烷有正戊烷、异戊烷、新戊烷3种结构,其中正戊烷有3种H,异戊烷有4种H,新戊烷有1种H,因此共8种同分异构体,故选B。
11.(1) 同分异构体 离子
(2) 90.8 25%
(3)bc
【详解】(1)尿素[CO(NH2)2]与氰酸铵(NH4CNO)的分子式相同,但结构不同,所以互为同分异构体;氰酸铵属于盐,是离子化合物,故答案为:同分异构体;离子;
(2)反应:N2(g)+3H2(g)2NH3(g),的反应热 H=反应物总键能-生成物总键能=(946+4363-390.86)=-90.8 kJ·mol-1,则生成2mol氨气放出90.8kJ热量;若1molN2与3molH2在一定条件下反应,达到平衡时放出36.32kJ热量,则生成氨气2mol=0.8mol,根据反应方程式,平衡时N2为1mol-0.4mol=0.6mol,H2为3mol-1.2mol=1.8mol,则此时NH3所占的体积分数==100%=25%,故答案为:90.8;25%;
(3)a.该反应达到平衡状态时,5v(NH3)正=4v(N2)逆,该选项没有标明正逆反应且比例错误,故a错误;
b.该反应是反应前后气体体积增大的可逆反应,当反应达到平衡状态时,容器内压强不再随时间而发生变化,所以能判断反应达到平衡状态,故b正确;
c.容器内N2的物质的量分数不再随时间而发生变化说明浓度不再改变,故c正确;
d.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6,不能说明正逆反应速率相等或者浓度不变,故d错误;
故答案为:bc。
12.、、、、
【详解】具有六元环结构、并能发生银镜反应的B的同分异构体的结构简式中含有醛基,则可能的结构为、、、、。
13.9
【详解】C的同分异构体有多种,其中若苯环上有一个甲基,而且是酯类化合物,则另一个取代基酯基的结构可能是HCOOCH2-、CH3COO-、CH3OOC-三种,它们与甲基在苯环上的位置分别处于邻位、间位、对位三种不同的位置,因此形成的物质是3×3=9种。故答案为:9。
14. C5H12Oz(z=0,1,2,…) C5H12O4 羟基 C(CH2OH)4
【分析】燃烧产物只有CO2和H2O,则样品中一定有C、H元素,可能有O元素。据样品、CO2和H2O的质量,可计算确定有无氧元素、求得实验式。再由实验式、相对分子质量求出有机物的分子式。
【详解】(1)燃烧产物只有CO2和H2O,则样品中一定有C、H元素,可能有O元素。n(C)=n(CO2)=0.125mol,n(H)=n(H2O)×2=(2.7g/18g·mol 1)×2=0.3mol,则N(C)∶N(H)=n(CO2)∶n(H)=0.125mol∶0.3mol=
5∶12,A实验式为C5H12Oz(z=0,1,2,…),故答案为:C5H12Oz(z=0,1,2,…);
(2)n(CO2)=2.8L/22.4L·mol 1=0.125mol,与(1)中CO2等量,则n(H2O)=2.7g/18g·mol 1=0.15mol,n(O)=,N(C)∶N(H)∶N(O)=0.125 mol∶0.15mol×2∶0.1mol=5∶12∶4,则A的实验式C5H12O4;故答案为:C5H12O4;
(3)设A分子式(C5H12O4)n,则Mr=136n<140,仅n=1合理,即A分子式为C5H12O4.A与钠反应放出氢气,说明A分子中含有羟基(A分子中氢原子数已饱和,不可能有羧基);故答案为:羟基;
(4)A核磁共振只有两个吸收峰、且面积比为8∶4,即A分子中有两种氢原子且数目之比为8∶4;红外光谱图说明A分子中有C-H、O-H、C-O键,故A结构简式为C(CH2OH)4,故答案为:C(CH2OH)4;
15. g→f→e→h→i→c(或d)→d(或c)→a(或b)→b(或a) 干燥O2 做催化剂,加快O2的生成 使有机物充分氧化生成CO2和H2O C2H6O
【分析】根据实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式。因此生成O2后必须除杂(主要是除H2O)明确各装置的作用是解题的前提,A用来吸收二氧化碳、B用来吸收水、C用于干燥通入E中的氧气、D用来制取反应所需的氧气、E是在电炉加热时用纯氧气氧化管内样品;根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2,据此分析解答。
【详解】(1) D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,在E中电炉加热时用纯氧氧化管内样品,生成二氧化碳和水,如有一氧化碳生成,则E中CuO可与CO进一步反应生成二氧化碳,然后分别通入B(吸收水)、A(吸收二氧化碳)中,所选择装置连接顺序是DCEBA,故答案为:g→f→e→h→i→c(或d)→d(或c)→a(或b)→b(或a);
(2) 根据上述分析,C装置中浓硫酸的作用是干燥O2,故答案为:干燥O2;
(3) D装置为制备氧气的装置,MnO2的作用是催化剂,故答案为做催化剂,加快O2的生成;
(4) 根据上述分析,燃烧管中CuO的作用是使有机物充分氧化生成CO2和H2O,故答案为:使有机物充分氧化生成CO2和H2O;
(5) A管增加的质量1.76 g为CO2的质量,n(CO2)==0.04 mol,B管增加的质量1.08 g为H2O的质量,则n(H2O)==0.06 mol,n(H)=0.12 mol,根据质量守恒可知,样品中含n(O)==0.02 mol,则样品中n(C)∶n(H)∶n(O)=0.04 mol∶0.12 mol∶0.02 mol=2∶6∶1,则该样品的实验式为C2H6O,故答案为:C2H6O。
16. 三颈烧瓶 +(CH3CO)2O+CH3COOH 防止水蒸气进入反应器中 萃取分液 蒸馏 4
【分析】(1)根据仪器的构造判断;苯与乙酸酐在AlCl3做催化剂作用下生成苯乙酮和乙酸;
(2)由于乙酸酐遇水生成乙酸,影响苯乙酮的制备,据此分析;
(3)根据步骤二中的描述,用有机溶剂从无机相中进行萃取并且溶液分层,据此分析;
(4)根据表格中熔沸点的数据可知,苯乙酮的熔沸点与乙醚和苯的差距较大,可采取蒸馏的方法分离;苯乙酮的沸点为202℃,水浴加热的温度不足以使苯乙酮变为蒸汽,据此分析解答。
【详解】(1)根据仪器的构造可知,仪器的名称是三颈烧瓶;苯与乙酸酐在AlCl3做催化剂作用下生成苯乙酮和乙酸,化学反应方程式为:+(CH3CO)2O+CH3COOH;
(2)由于乙酸酐遇水生成乙酸,影响苯乙酮的制备,则仪器中盛装无水,其作用是防止水蒸气进入反应器中;
(3)根据步骤二中的描述,用有机溶剂从无机相中进行萃取并且溶液分层,多次使用到的操作是萃取分液;
(4)根据表格中熔沸点的数据可知,苯乙酮的熔沸点与乙醚和苯的差距较大,可采取蒸馏的方法分离,则步骤三分离提纯苯乙酮使用的操作是蒸馏;苯乙酮的沸点为202℃,为了收集纯净的苯乙酮馏分,需要加热较高的温度,水浴加热的温度不足以使苯乙酮变为蒸汽,则分离苯乙酮应使用下面的图4装置。
17. 离子键 高 sp3 酰胺基 C2H6O2
【分析】浓硫酸具有吸水性,浓硫酸的质量增加5.4g,说明反应产物中含水5.4g,通过灼热氧化铜,由于发生反应CuO+COCu+CO2使固体的质量减轻,结合方程式利用差量法可计算CO的物质的量;通过碱石灰时,碱石灰的质量增加了8.8g可计算总CO2的物质的量,减去CO与CuO反应生成的CO2的质量为有机物燃烧生成CO2的质量,根据元素守恒计算有机物中含有C、H、O的物质的量,进而求得化学式;结合分子式、与钠反应生成氢气的体积,判断分子中官能团。
【详解】(1)氰酸铵是离子化合物,氰酸铵晶体熔化时克服的作用力为离子键;干冰是分子晶体,由于离子键的强度远大于分子间作用力,故氰酸铵晶体比干冰的熔点高。故答案为:离子键;高;
(2)尿素中氮原子的价层电子对=3+ =4,杂化方式为sp3,CH3CONH2中官能团-CONH2的名称是酰胺基。故答案为:sp3;酰胺基;
(3)①有机物燃烧生成水5.4g,物质的量为 =0.3mol,令有机物燃烧生成的CO的质量为x,则: ,所以x=2.8g,CO的物质的量为 =0.1mol,根据碳元素守恒可知CO与CuO反应生成的CO2的物质的量为0.1mol,质量为0.1mol×44g/mol=4.4g,有机物燃烧生成的CO2的质量为8.8g-4.4g=4.4g,物质的量为=0.1mol,根据原子守恒可知,有机物分子中N(C)= =2,N(H)= =6,N(O)= =2,该有机物的分子式为:C2H6O2。故答案为:C2H6O2;
②9.2g金属钠的物质的量为=0.4mol,与0.2mol该有机物恰好完全反应,故该有机物分子中含有2个羟基,该有机物的结构简式为HO-CH2-CH2-OH,该反应的化学方程式:。故答案为: ;
(4)某苯的同系物分子式为C8H10,不饱和度为4,若苯环上的氢原子被卤原子取代,生成的一卤代物有一种同分异构体,结构对称,为对二甲苯,则该苯的同系物的结构简式为。故答案为:。
18. C2H2 CH2=CH-CH=CH2 C2H6
【详解】A完全燃烧后的气态产物(CO2和H2O)的体积比为2:1,说明A分子中C、H原子个数比为1:1,则A为乙炔;标况下100mLB的物质的量为:0.1L÷22.4L/mol=mol,1.43gBr2的物质的量为:1.43g÷160g/mol=mol,n(B):n(Br)=mol:mol=1:2,则B分子中含有两个双键或一个碳碳叁键,因B与溴加成反应后的生成物每个碳原子都结合有溴原子,则B分子中含有两个双键,结构简式为:CH2=CH-CH=CH2;C不能使酸性高锰酸钾溶液褪色,说明C为饱和烃;在光照最多能和6倍体积的氯气发生反应,说明分子中含有6个氢原子,故C为乙烷;由理想气体的状态方程可得D的相对分子质量M===106,D不能使溴水褪色但能使酸性高锰酸钾溶液褪色,说有D为苯的同系物,在铁为催化剂时D和溴发生反应生成的一溴代物只有一种,说明D中两个甲基位于苯环的对位,结构简式为:;故答案为A:C2H2 乙炔; B:CH2=CH-CH=CH2 1,3丁二烯;C:C2H6 乙烷 D: 1,4-二甲基苯。
19.(1)反-2-丁烯
(2) ④ ⑦
(3)4
(4)⑥
(5)2
(6)①⑥
(7) C4H8O2 ⑧
(8)+CH3CH2CH2OH+H2O
【解析】(1)
①为 ,属于单烯烃,反式结构,名称是反-2-丁烯。答案为:反-2-丁烯;
(2)
②为,属于烷烃,与烷烃互为同系物,故选④;与⑦分子式均为C6H14,结构不相同,互为同分异构体,故选⑦;答案为:④;⑦;
(3)
③为 ,一氯代物有苯环上邻、间、对位的氯代及甲基上的氯代共4种。答案为:4;
(4)
设烃的分子式为CxHy,燃烧方程式为CxHy+(x+)O2xCO2+H2O,在120℃,1.01×105Pa条件下,反应前后气体的体积没有发生改变,则1+ x+= x+,从而得出y=4,所以该烃是⑥。答案为:⑥;
(5)
⑦为 ,分子中只有2种氢原子,所以核磁共振氢谱有2组峰。答案为:2;
(6)
采用弯箭头法,可确定有机高分子的单体是和CH2=CH2,故选①⑥。答案为:①⑥;
(7)
m(H2O)=3.6g,m(CO2)=8.8g,则n(H2O)==0.2mol,n(CO2)=0.2mol,有机物分子中含氧的物质的量n(O)==0.1mol,从而得出有机物分子中n(C): n(H): n(O)=2:4:1,最简式为C2H4O。从质谱中可以看出,该有机物的相对分子质量为88,设分子式为(C2H4O)n,44n=88,n=2,所以分子式为C4H8O2。红外光谱图中信息显示,该有机物分子中含有不对称的-CH3、C=O、C-O-C,则该有机物的结构简式可能为CH3COOCH2CH3,故选⑧。答案为:C4H8O2;⑧;
(8)
⑨⑩在一定条件下发生酯化反应生成和水,反应的化学方程式为+CH3CH2CH2OH+H2O。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.我国女药学家屠呦呦因四十多年前发现了青蒿素,有效降低疟疾患者的死亡率,从而获得2015年诺贝尔生理学或医学奖。青蒿素的分子结构如图所示,下列有关青蒿素的说法正确的是
注:手性碳指的是连接4个不同原子或原子团的碳原子
A.青蒿素的分子式是C15H22O5
B.青蒿素具有5个手性碳原子
C.分子中含氧官能团只有酯基
D.分子中所有碳原子可能处于同一平面上
2.下列化学用语错误的是
A.的结构示意图: B.乙烯的分子比例模型:
C.的电子式: D.乙醇的实验式
3.按照有机物的分类,甲醛属于醛,乙酸乙酯属于酯。下列各项对有机物的分类方法与此方法相同的是
①属于环状化合物
②属于卤代烃
③属于链状化合物
④属于羧酸
A.①② B.②③ C.②④ D.①④
4.下列关于同分异构体的说法正确的是
A.甲苯苯环上的一硝基代物有邻硝基甲苯和对硝基甲苯2种
B.苊烯()的一氯代物有5种
C.乙烷的四氯代物有2种
D.萘()的二氯代物共有15种
5.下列化合物的分子中,所有原子可能共平面的是
A.一氯乙烷 B.2-丁烯 C.乙炔 D.甲烷
6.下列叙述正确的是
A.CH4 与 C4H10 互为同系物
B.C3H8 有 2 种同分异构体
C.所有烷烃的分子组成上都满足 CnH2n(n≥1)
D.烷烃分子中,相邻的三个碳原子可能在同一条直线上
7.下列表示正确的是
A.乙炔的结构式:CHCH
B.异戊烷,又称为2-甲基戊烷,其键线式为:
C.葡萄糖的结构简式可能为:
D.NCl3分子的球棍模型
8.双香豆素是一种重要的抗凝血药物,可用于防治血栓形成,其结构如图所示。下列说法正确的是
A.双香豆素中有3种杂化类型的碳原子
B.双香豆素有4种一氯代物
C.双香豆素可以形成分子内氢键
D.用香豆素( )和HCHO合成双香豆素反应的原子利用率为100%
9.下列说法正确的是
A.分馏石油可以得到植物油、柴油、润滑油
B.萘()属于芳香烃,其一氯代物有两种
C.在FeBr3催化下苯和液溴发生自由基型链反应
D.过度使用尿素[CO(NH2)2]会使土壤碱化,可用石灰加以改良
10.分子式为的有机物共有
A.7种 B.8种 C.9种 D.10种
二、填空题
11.氨在化肥生产、贮氢及燃煤烟气脱硫脱硝等领域用途非常广泛。
(1)尿素[CO(NH2)2]与氰酸铵(NH4CNO)互为____;(选填:“同一物质”或“同系物”或“同分异构体”),氰酸铵属于____化合物(选填:“离子”或“共价”)。
(2)液氨是一种贮氢材料,已知:断开1mol共价键吸收的能量数据如表:
共价键 H-H N-H N≡N
kJ·mol-1 436 390.8 946
则合成氨反应:N2(g)+3H2(g)2NH3(g),生成2mol氨气放出____kJ热量,若1molN2与3molH2在一定条件下反应,达到平衡时放出36.32kJ热量,则此时NH3所占的体积分数为____。
(3)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)5N2(g)+6H2O(g)。能说明该反应已达到平衡状态的标志是____(不定项选择)。
a.反应速率4v(NH3)=5v(N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
12.化合物G是一种药物合成中间体,其合成路线如下:
写出具有六元环结构、并能发生银镜反应的B的同分异构体的结构简式___________。
13.C( )的同分异构体有多种,其中苯环上有一个甲基的酯类化合物有_______种。
14.某研究性学习小组为确定某蜡状有机物A的结构和性质,他们拟用传统实验的手段与现代技术相结合的方法进行探究。请你参与探究过程:
Ⅰ.实验式的确定
(1)取样品A进行燃烧法测定。发现燃烧后只生成CO2和H2O,某次燃烧后,经换算得到了0.125mol CO2和2.7g H2O。据此得出的结论是___________。
(2)另一实验中,取3.4g蜡状A在3.36L(标准状况下,下同)氧气中完全燃烧,两者均恰好完全反应,生成2.8L CO2和液态水。通过计算确定A的实验式;___________。
Ⅱ.结构式确定(经测定A的相对分子质量不超过140)
(3)取少量样品熔化,加入钠有氢气放出,说明A分子中含有___________基。
(4)进行核磁共振,发现只有两个特征峰,且面积比为8∶4,再做红外光谱,发现与乙醇一样透过率在同一处波数被吸收。图谱如下:
则A的结构简式为___________。
三、实验题
15.电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成。下列装置是用燃烧法确定有机物分子式常用的装置。
(1)按气体从左到右的流向,所选装置各接口的正确连接顺序是___。
(2)C装置中浓硫酸的作用是___。
(3)D装置中MnO2的作用是___。
(4)燃烧管中CuO的作用是___。
(5)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92g样品,经充分反应后,A管质量增加1.76g,B管质量增加1.08g,则该样品的实验式为___。
16.苯乙酮( )广泛用于皂用香精和短草香精中,实验室可用苯和乙酸酐(,遇水生成乙酸)在无水作用下制取,操作如下:
步骤一:在中加入干燥的苯和无水粉末,在剧烈搅拌下,缓慢滴入乙酸酐,控制反应温度为30℃,反应过程中释放出气体,释放停止后,再加热至90~95℃,回流反应,形成黑黄色液体。装置如图1所示。
步骤二:将冷却后的反应瓶置于冰水浴中(如图2所示),加入苯,慢慢加入混合的盐酸冰水,静置分层,分液,无机相用乙醚萃取,与有机相合并,有机相用溶液洗涤,分液,弃去无机层,有机层用水洗,分液,弃去无机层,有机层用干燥。
步骤三:分离提纯苯乙酮。
回答下列问题:
(1)仪器的名称是________。写出苯与乙酸酐生成苯乙酮的化学方程式:________。
(2)仪器中盛装无水,其作用是________。
(3)步骤二中多次使用到的操作是________。
(4)已知常压下:
熔点/℃ 沸点/℃
苯 5.5 80.1
乙醚 34.6
苯乙酮 19.6 202
则步骤三分离提纯苯乙酮使用的操作是________;为了收集纯净的苯乙酮馏分,分离苯乙酮应使用下面的图________装置。
四、计算题
17.1828年,德国化学家维勒用氰酸铵(NH4CNO)合成了尿素(),打破了有机物与无机物的界限。
(1)氰酸铵晶体熔化时克服的作用力为_______,氰酸铵晶体比干冰的熔点_______(填“低”“高”或“相等”)。
(2)尿素中氮原子的杂化方式为_______,CH3CONH2中官能团的名称是_______。
(3)0.1mol有机物和0.2molO2在密闭容器中燃烧后的产物为CO2、CO和H2O(g),产物经过浓硫酸后,浓硫酸的质量增加5.4g;再通过灼热CuO充分反应后,固体质量减轻1.6g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加8.8g。
①该有机物的分子式为:_______。
②若0.2mol该有机物恰好与9.2g金属钠完全反应,请写出该反应的化学方程式:_______。
(4)某苯的同系物分子式为C8H10,若苯环上的氢原子被卤原子取代,生成的一卤代物有一种同分异构体,则该苯的同系物的结构简式为_______。
五、有机推断题
18.现有A、B,C、D四种常见烃,A、B、C在常温常压下是无色气体且都是链烃,D为无色液体。①A完全燃烧后的气态产物(CO2和H2O)的体积比为2:1, ②标准状况下lOOmLB恰好能使含1.43g Br2的溴水褪色,生成物经测定每个碳原子都结合有溴原子;③C不能使酸性高锰酸钾溶液褪色,但在光照最多能和6倍体积的氯气发生反应;④D不能使溴水褪色但能使酸性高锰酸钾溶液褪色;在140℃和1.01×105Pa压强下,250mL D蒸气的质量为O.782g,在铁为催化剂时D和溴发生反应生成的一溴代物只有一种,试确定A __________、B__________、C__________、D__________各是什么物质。
19.现有以下十种有机物:① ② ③④CH3CH2CH2CH3⑤CH3CH2CH2COOH ⑥C2H4⑦ ⑧CH3COOCH2CH3⑨⑩CH3CH2CH2OH
请从上述有机物中选择适当物质按要求回答下列问题:
(1)①的名称是_______。
(2)与②互为同系物的是_______(填序号),互为同分异构体的是_______(填序号)。
(3)③的一氯代物有_______种。
(4)在120℃,1.01×105Pa条件下,某种气态烃与足量的O2完全反应后,测得反应前后气体的体积没有发生改变,则该烃是_______(填序号)。
(5)⑦中核磁共振氢谱有_______组峰。
(6)合成有机高分子的单体是_______(填序号)。
(7)若准确称取4.4g样品X(只含C、H、O三种元素),经充分燃烧后产物依次通过浓硫酸和碱石灰,二者质量分别增加3.6g和8.8g。又知有机物X的质谱图和红外光谱分别如图所示,则该有机物的分子式为_______,结构简式可能为_______(从上面提供的物质选择,填序号)。
(8)写出⑨⑩在一定条件下反应的化学方程式_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.由青蒿素的结构简式可知其分子式为:C15H22O5,故A正确;
B.青蒿素具有7个手性碳原子,故B错误;
C.分子中含氧官能团有酯基、醚键还有过氧键结构,故C错误;
D.分子中存在多个饱和碳原子,且有与三个碳原子相连的饱和碳原子,因此所有碳原子不可能共平面,故D错误;
故选:A。
2.C
【详解】A.核内有17个质子,核外有18个电子,则其电子式为 ,故A正确;
B.乙烯中的两个C原子分别与2个H原子形成共价键,碳原子之间也形成碳碳双键,则其比例模型为,故B正确;
C.硫化氢是共价化合物,原子间通过共用电子对形成化合物,所以的电子式:,故C错误;
D.乙醇的分子式、实验式或最简式均为,故D正确;
答案选C。
3.C
【详解】甲醛属于醛,乙酸乙酯属于酯,均是按照有机物中所含官能团进行分类
①是根据碳骨架进行的分类,分成链状化合物和环状化合物,①不符合题意;
②因为含有-Br,因此此有机物属于卤代烃,②符合题意;
③根据碳骨架进行分类,③不符合题意;
④含有羧基,属于羧酸,按照官能团进行分类,④符合题意;
综上,②④符合题意,答案选C。
4.C
【详解】A.甲苯苯环上有3种H原子,甲苯苯环上的一硝基代物有邻硝基甲苯、间硝基甲苯和对硝基甲苯3种,故A错误;
B.苊烯()结构对称,其一氯代物有4种,故B错误;
C.乙烷的二氯代物与四氯代物的同分异构体数目相同,乙烷的二氯代物有2种异构体,则其四氯代物的异构体数目也为2种,故C正确;
D.为对称结构,有2种H原子,其一氯代物2种,则其二氯代物是10种(、),故D错误;
故选C。
5.C
【详解】A.一氯乙烷分子中含有饱和C原子,具有甲烷的四面体结构,因此所有原子不可能共平面,A不符合题意;
B.2-丁烯含有饱和C原子,具有甲烷的四面体结构,因此所有原子不可能共平面,B不符合题意;
C.乙炔分子中四个原子在同一条直线上,因此分子中所有原子共平面,C符合题意;
D.甲烷分子中C原子与4个H原子形成正四面体结构,键角是109°28′,因此分子中所有原子不可能共平面,D不符合题意;
故合理选项是C。
6.A
【详解】A.与均是烷烃,结构相似,二者相差3个原子团,二者互为同系物,A正确;
B.是丙烷,无同分异构体,B错误;
C.烷烃中所含碳原子是饱和的,链状烷烃分子组成上都满足,但环烷烃符合,其通式为,C错误;
D.烷烃分子中的碳原子呈锯齿形,分子中相邻的三个碳原子不可能在同一条直线上,D错误;
故选A。
7.C
【详解】A.乙炔的结构式为H—C≡C—H,选项A错误;
B.异戊烷分子中最长碳链含有4个碳原子,侧链为甲基,又称为2—甲基丁烷,选项B错误;
C.葡萄糖的结构简式为HOCH2 (CHOH)4CHO,分子中的HOCH2—能与—CHO发生加成反应转化为,选项C正确;
D.Cl原子的半径大于N原子半径,NCl3分子的球棍模型是 ,选项D正确;
答案选C。
8.C
【详解】A.苯环和碳碳双键上的C原子采用sp2杂化,亚甲基上的中心C原子采用sp3杂化,共2种杂化方式,A错误;
B.根据等效氢思想可知,双香豆素有5种一氯代物,如图: ,B错误;
C.根据分子结构可知,双香豆素分子内的羟基之间可形成分子内氢键,C正确;
D.2mol香豆素分子( )和1molHCHO在一定条件下可合成1mol双香豆素和 1molH2O,所以反应的原子利用率未达到100%,D错误;
故选C。
9.B
【详解】A.分馏石油可以得到汽油、柴油、润滑油等烷烃,植物油属于酯类,不能通过石油分馏得到,A错误;
B.萘()属于芳香烃,其一氯代物有两种(),B正确;
C.在FeBr3催化下苯和液溴发生取代反应,C错误;
D.过度使用尿素[CO(NH2)2]会使土壤碱化,而石灰与水反应生成的是碱性物质,故不能用其加以改良,D错误;
答案选B。
10.B
【分析】分子式为的有机物,可看作Br原子取代戊烷的H原子,戊烷有3种结构,结合等效氢原子的方法分析判断。
【详解】分子式为的有机物,可看作Br原子取代戊烷的H原子,戊烷有正戊烷、异戊烷、新戊烷3种结构,其中正戊烷有3种H,异戊烷有4种H,新戊烷有1种H,因此共8种同分异构体,故选B。
11.(1) 同分异构体 离子
(2) 90.8 25%
(3)bc
【详解】(1)尿素[CO(NH2)2]与氰酸铵(NH4CNO)的分子式相同,但结构不同,所以互为同分异构体;氰酸铵属于盐,是离子化合物,故答案为:同分异构体;离子;
(2)反应:N2(g)+3H2(g)2NH3(g),的反应热 H=反应物总键能-生成物总键能=(946+4363-390.86)=-90.8 kJ·mol-1,则生成2mol氨气放出90.8kJ热量;若1molN2与3molH2在一定条件下反应,达到平衡时放出36.32kJ热量,则生成氨气2mol=0.8mol,根据反应方程式,平衡时N2为1mol-0.4mol=0.6mol,H2为3mol-1.2mol=1.8mol,则此时NH3所占的体积分数==100%=25%,故答案为:90.8;25%;
(3)a.该反应达到平衡状态时,5v(NH3)正=4v(N2)逆,该选项没有标明正逆反应且比例错误,故a错误;
b.该反应是反应前后气体体积增大的可逆反应,当反应达到平衡状态时,容器内压强不再随时间而发生变化,所以能判断反应达到平衡状态,故b正确;
c.容器内N2的物质的量分数不再随时间而发生变化说明浓度不再改变,故c正确;
d.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6,不能说明正逆反应速率相等或者浓度不变,故d错误;
故答案为:bc。
12.、、、、
【详解】具有六元环结构、并能发生银镜反应的B的同分异构体的结构简式中含有醛基,则可能的结构为、、、、。
13.9
【详解】C的同分异构体有多种,其中若苯环上有一个甲基,而且是酯类化合物,则另一个取代基酯基的结构可能是HCOOCH2-、CH3COO-、CH3OOC-三种,它们与甲基在苯环上的位置分别处于邻位、间位、对位三种不同的位置,因此形成的物质是3×3=9种。故答案为:9。
14. C5H12Oz(z=0,1,2,…) C5H12O4 羟基 C(CH2OH)4
【分析】燃烧产物只有CO2和H2O,则样品中一定有C、H元素,可能有O元素。据样品、CO2和H2O的质量,可计算确定有无氧元素、求得实验式。再由实验式、相对分子质量求出有机物的分子式。
【详解】(1)燃烧产物只有CO2和H2O,则样品中一定有C、H元素,可能有O元素。n(C)=n(CO2)=0.125mol,n(H)=n(H2O)×2=(2.7g/18g·mol 1)×2=0.3mol,则N(C)∶N(H)=n(CO2)∶n(H)=0.125mol∶0.3mol=
5∶12,A实验式为C5H12Oz(z=0,1,2,…),故答案为:C5H12Oz(z=0,1,2,…);
(2)n(CO2)=2.8L/22.4L·mol 1=0.125mol,与(1)中CO2等量,则n(H2O)=2.7g/18g·mol 1=0.15mol,n(O)=,N(C)∶N(H)∶N(O)=0.125 mol∶0.15mol×2∶0.1mol=5∶12∶4,则A的实验式C5H12O4;故答案为:C5H12O4;
(3)设A分子式(C5H12O4)n,则Mr=136n<140,仅n=1合理,即A分子式为C5H12O4.A与钠反应放出氢气,说明A分子中含有羟基(A分子中氢原子数已饱和,不可能有羧基);故答案为:羟基;
(4)A核磁共振只有两个吸收峰、且面积比为8∶4,即A分子中有两种氢原子且数目之比为8∶4;红外光谱图说明A分子中有C-H、O-H、C-O键,故A结构简式为C(CH2OH)4,故答案为:C(CH2OH)4;
15. g→f→e→h→i→c(或d)→d(或c)→a(或b)→b(或a) 干燥O2 做催化剂,加快O2的生成 使有机物充分氧化生成CO2和H2O C2H6O
【分析】根据实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式。因此生成O2后必须除杂(主要是除H2O)明确各装置的作用是解题的前提,A用来吸收二氧化碳、B用来吸收水、C用于干燥通入E中的氧气、D用来制取反应所需的氧气、E是在电炉加热时用纯氧气氧化管内样品;根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2,据此分析解答。
【详解】(1) D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,在E中电炉加热时用纯氧氧化管内样品,生成二氧化碳和水,如有一氧化碳生成,则E中CuO可与CO进一步反应生成二氧化碳,然后分别通入B(吸收水)、A(吸收二氧化碳)中,所选择装置连接顺序是DCEBA,故答案为:g→f→e→h→i→c(或d)→d(或c)→a(或b)→b(或a);
(2) 根据上述分析,C装置中浓硫酸的作用是干燥O2,故答案为:干燥O2;
(3) D装置为制备氧气的装置,MnO2的作用是催化剂,故答案为做催化剂,加快O2的生成;
(4) 根据上述分析,燃烧管中CuO的作用是使有机物充分氧化生成CO2和H2O,故答案为:使有机物充分氧化生成CO2和H2O;
(5) A管增加的质量1.76 g为CO2的质量,n(CO2)==0.04 mol,B管增加的质量1.08 g为H2O的质量,则n(H2O)==0.06 mol,n(H)=0.12 mol,根据质量守恒可知,样品中含n(O)==0.02 mol,则样品中n(C)∶n(H)∶n(O)=0.04 mol∶0.12 mol∶0.02 mol=2∶6∶1,则该样品的实验式为C2H6O,故答案为:C2H6O。
16. 三颈烧瓶 +(CH3CO)2O+CH3COOH 防止水蒸气进入反应器中 萃取分液 蒸馏 4
【分析】(1)根据仪器的构造判断;苯与乙酸酐在AlCl3做催化剂作用下生成苯乙酮和乙酸;
(2)由于乙酸酐遇水生成乙酸,影响苯乙酮的制备,据此分析;
(3)根据步骤二中的描述,用有机溶剂从无机相中进行萃取并且溶液分层,据此分析;
(4)根据表格中熔沸点的数据可知,苯乙酮的熔沸点与乙醚和苯的差距较大,可采取蒸馏的方法分离;苯乙酮的沸点为202℃,水浴加热的温度不足以使苯乙酮变为蒸汽,据此分析解答。
【详解】(1)根据仪器的构造可知,仪器的名称是三颈烧瓶;苯与乙酸酐在AlCl3做催化剂作用下生成苯乙酮和乙酸,化学反应方程式为:+(CH3CO)2O+CH3COOH;
(2)由于乙酸酐遇水生成乙酸,影响苯乙酮的制备,则仪器中盛装无水,其作用是防止水蒸气进入反应器中;
(3)根据步骤二中的描述,用有机溶剂从无机相中进行萃取并且溶液分层,多次使用到的操作是萃取分液;
(4)根据表格中熔沸点的数据可知,苯乙酮的熔沸点与乙醚和苯的差距较大,可采取蒸馏的方法分离,则步骤三分离提纯苯乙酮使用的操作是蒸馏;苯乙酮的沸点为202℃,为了收集纯净的苯乙酮馏分,需要加热较高的温度,水浴加热的温度不足以使苯乙酮变为蒸汽,则分离苯乙酮应使用下面的图4装置。
17. 离子键 高 sp3 酰胺基 C2H6O2
【分析】浓硫酸具有吸水性,浓硫酸的质量增加5.4g,说明反应产物中含水5.4g,通过灼热氧化铜,由于发生反应CuO+COCu+CO2使固体的质量减轻,结合方程式利用差量法可计算CO的物质的量;通过碱石灰时,碱石灰的质量增加了8.8g可计算总CO2的物质的量,减去CO与CuO反应生成的CO2的质量为有机物燃烧生成CO2的质量,根据元素守恒计算有机物中含有C、H、O的物质的量,进而求得化学式;结合分子式、与钠反应生成氢气的体积,判断分子中官能团。
【详解】(1)氰酸铵是离子化合物,氰酸铵晶体熔化时克服的作用力为离子键;干冰是分子晶体,由于离子键的强度远大于分子间作用力,故氰酸铵晶体比干冰的熔点高。故答案为:离子键;高;
(2)尿素中氮原子的价层电子对=3+ =4,杂化方式为sp3,CH3CONH2中官能团-CONH2的名称是酰胺基。故答案为:sp3;酰胺基;
(3)①有机物燃烧生成水5.4g,物质的量为 =0.3mol,令有机物燃烧生成的CO的质量为x,则: ,所以x=2.8g,CO的物质的量为 =0.1mol,根据碳元素守恒可知CO与CuO反应生成的CO2的物质的量为0.1mol,质量为0.1mol×44g/mol=4.4g,有机物燃烧生成的CO2的质量为8.8g-4.4g=4.4g,物质的量为=0.1mol,根据原子守恒可知,有机物分子中N(C)= =2,N(H)= =6,N(O)= =2,该有机物的分子式为:C2H6O2。故答案为:C2H6O2;
②9.2g金属钠的物质的量为=0.4mol,与0.2mol该有机物恰好完全反应,故该有机物分子中含有2个羟基,该有机物的结构简式为HO-CH2-CH2-OH,该反应的化学方程式:。故答案为: ;
(4)某苯的同系物分子式为C8H10,不饱和度为4,若苯环上的氢原子被卤原子取代,生成的一卤代物有一种同分异构体,结构对称,为对二甲苯,则该苯的同系物的结构简式为。故答案为:。
18. C2H2 CH2=CH-CH=CH2 C2H6
【详解】A完全燃烧后的气态产物(CO2和H2O)的体积比为2:1,说明A分子中C、H原子个数比为1:1,则A为乙炔;标况下100mLB的物质的量为:0.1L÷22.4L/mol=mol,1.43gBr2的物质的量为:1.43g÷160g/mol=mol,n(B):n(Br)=mol:mol=1:2,则B分子中含有两个双键或一个碳碳叁键,因B与溴加成反应后的生成物每个碳原子都结合有溴原子,则B分子中含有两个双键,结构简式为:CH2=CH-CH=CH2;C不能使酸性高锰酸钾溶液褪色,说明C为饱和烃;在光照最多能和6倍体积的氯气发生反应,说明分子中含有6个氢原子,故C为乙烷;由理想气体的状态方程可得D的相对分子质量M===106,D不能使溴水褪色但能使酸性高锰酸钾溶液褪色,说有D为苯的同系物,在铁为催化剂时D和溴发生反应生成的一溴代物只有一种,说明D中两个甲基位于苯环的对位,结构简式为:;故答案为A:C2H2 乙炔; B:CH2=CH-CH=CH2 1,3丁二烯;C:C2H6 乙烷 D: 1,4-二甲基苯。
19.(1)反-2-丁烯
(2) ④ ⑦
(3)4
(4)⑥
(5)2
(6)①⑥
(7) C4H8O2 ⑧
(8)+CH3CH2CH2OH+H2O
【解析】(1)
①为 ,属于单烯烃,反式结构,名称是反-2-丁烯。答案为:反-2-丁烯;
(2)
②为,属于烷烃,与烷烃互为同系物,故选④;与⑦分子式均为C6H14,结构不相同,互为同分异构体,故选⑦;答案为:④;⑦;
(3)
③为 ,一氯代物有苯环上邻、间、对位的氯代及甲基上的氯代共4种。答案为:4;
(4)
设烃的分子式为CxHy,燃烧方程式为CxHy+(x+)O2xCO2+H2O,在120℃,1.01×105Pa条件下,反应前后气体的体积没有发生改变,则1+ x+= x+,从而得出y=4,所以该烃是⑥。答案为:⑥;
(5)
⑦为 ,分子中只有2种氢原子,所以核磁共振氢谱有2组峰。答案为:2;
(6)
采用弯箭头法,可确定有机高分子的单体是和CH2=CH2,故选①⑥。答案为:①⑥;
(7)
m(H2O)=3.6g,m(CO2)=8.8g,则n(H2O)==0.2mol,n(CO2)=0.2mol,有机物分子中含氧的物质的量n(O)==0.1mol,从而得出有机物分子中n(C): n(H): n(O)=2:4:1,最简式为C2H4O。从质谱中可以看出,该有机物的相对分子质量为88,设分子式为(C2H4O)n,44n=88,n=2,所以分子式为C4H8O2。红外光谱图中信息显示,该有机物分子中含有不对称的-CH3、C=O、C-O-C,则该有机物的结构简式可能为CH3COOCH2CH3,故选⑧。答案为:C4H8O2;⑧;
(8)
⑨⑩在一定条件下发生酯化反应生成和水,反应的化学方程式为+CH3CH2CH2OH+H2O。
答案第1页,共2页
答案第1页,共2页
