专题1第二单元化学能与电能的转化同步练习(含解析)2022-2023学年上学期高二化学苏教版(2019)选择性必修1
文档属性
| 名称 | 专题1第二单元化学能与电能的转化同步练习(含解析)2022-2023学年上学期高二化学苏教版(2019)选择性必修1 |  | |
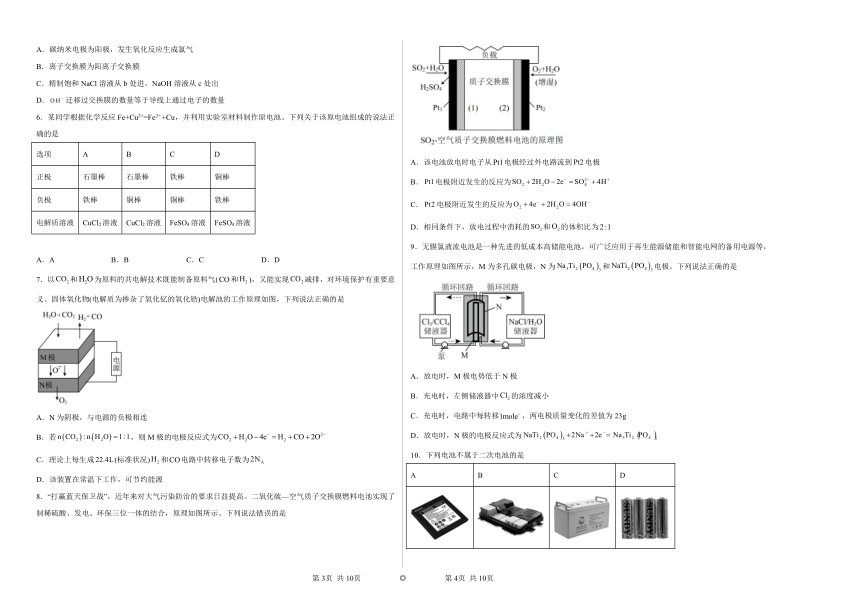
| 格式 | docx | ||
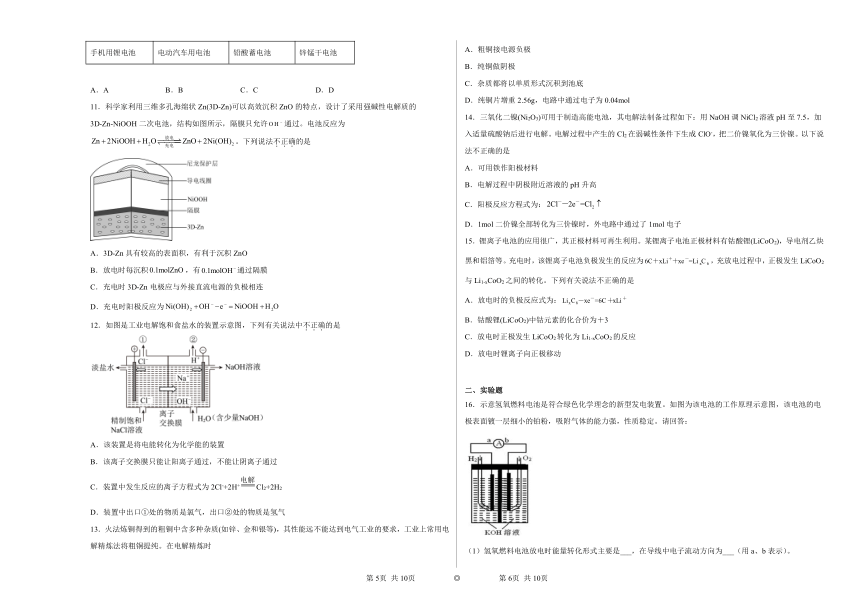
| 文件大小 | 1.1MB | ||
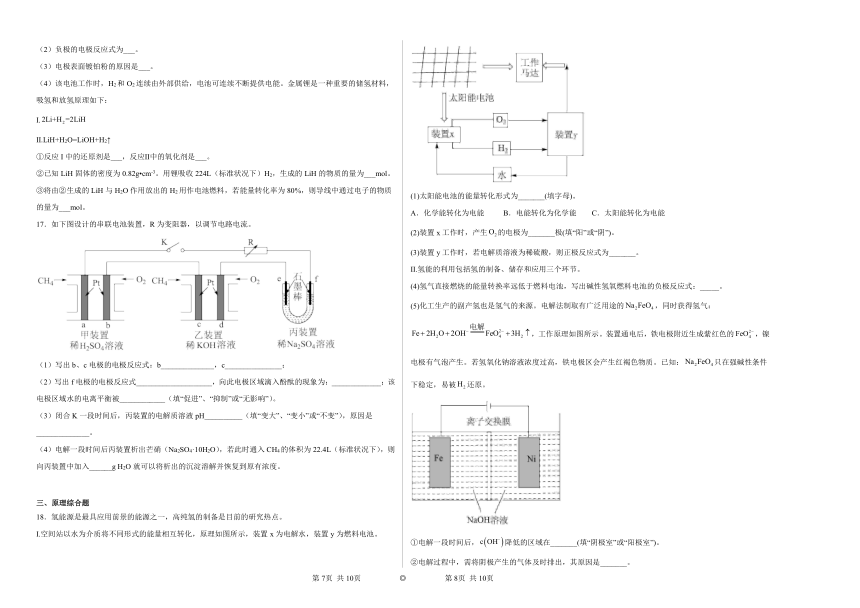
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-28 08:09:04 | ||
图片预览

文档简介
专题1第二单元化学能与电能的转化同步练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下图是一个用石墨作电极,电解稀Na2SO4溶液的装置,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液。下列有关叙述正确的是
A.A极生成的气体无色无味,B极生成的气体有刺激性气味
B.收集B极产生的气体,该气体能使带火星的木条复燃
C.A极附近呈红色,B极附近呈蓝色
D.电解一段时间后,将全部电解液转移到同一烧杯中,充分搅拌后溶解呈碱性
2.钴()的合金材料广泛应用于航空航天、机械制造等领域。如图为水溶液中电解制备金属钴的装置示意图。下列说法正确的是
A.工作时,I室和II室溶液的均增大
B.电解总反应:
C.移除两交换膜后,电极和石墨电极发生的反应均发生变化
D.生成,I室溶液质量理论上减少
3.我国科学家以铝和石墨烯载钯作电极,氯铝酸型离子液体作电解质,构建了如图所示的Al-N2电池体系(阳离子略),总反应为2Al+N22AlN。下列说法正确的是
A.电池充电时AlCl向Al电极移动
B.石墨烯载钯电极的电势比Al电极低
C.电池放电时,每转移3mole-消耗11.2LN2
D.电池放电时,正极的电极反应式是8Al2Cl+N2+6e-=2AlN+14AlCl
4.某科研团队提出了一种碱—酸Zn-—混合充放电电池,其放电时的工作原理如图所示,下列说法正确的是
A.放电时,M极为正极
B.放电时,从中间室移向左极室
C.充电时,N极发生的电极反应式为
D.充电时,M极质量每增加32.5g,外电路中通过2mol电子
5.在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下。下列说法错误的是
A.碳纳米电极为阳极,发生氧化反应生成氯气
B.离子交换膜为阳离子交换膜
C.精制饱和NaCl溶液从b处进,NaOH溶液从c处出
D.迁移过交换膜的数量等于导线上通过电子的数量
6.某同学根据化学反应Fe+Cu2+=Fe2+ +Cu,并利用实验室材料制作原电池。下列关于该原电池组成的说法正确的是
选项 A B C D
正极 石墨棒 石墨棒 铁棒 铜棒
负极 铁棒 铜棒 铜棒 铁棒
电解质溶液 CuCl2溶液 CuCl2溶液 FeSO4溶液 FeSO4溶液
A.A B.B C.C D.D
7.以和为原料的共电解技术既能制备原料气(和),又能实现减排,对环境保护有重要意义。固体氧化物(电解质为掺杂了氧化钇的氧化锆)电解池的工作原理如图,下列说法正确的是
A.N为阴极,与电源的负极相连
B.若,则M极的电极反应式为
C.理论上每生成(标准状况)和电路中转移电子数为
D.该装置在常温下工作,可节约能源
8.“打赢蓝天保卫战”,近年来对大气污染防治的要求日益提高。二氧化硫—空气质子交换膜燃料电池实现了制稀硫酸、发电、环保三位一体的结合,原理如图所示。下列说法错误的是
A.该电池放电时电子从电极经过外电路流到电极
B.电极附近发生的反应为
C.电极附近发生的反应为
D.相同条件下,放电过程中消耗的和的体积比为
9.无膜氯液流电池是一种先进的低成本高储能电池,可广泛应用于再生能源储能和智能电网的备用电源等,工作原理如图所示,M为多孔碳电极,N为和电极。下列说法正确的是
A.放电时,M极电势低于N极
B.充电时,左侧储液器中的浓度减小
C.充电时,电路中每转移,两电极质量变化的差值为23g
D.放电时,N极的电极反应式为
10.下列电池不属于二次电池的是
A B C D
手机用锂电池 电动汽车用电池 铅酸蓄电池 锌锰干电池
A.A B.B C.C D.D
11.科学家利用三维多孔海绵状Zn(3D-Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D-Zn-NiOOH二次电池,结构如图所示,隔膜只允许通过。电池反应为。下列说法不正确的是
A.3D-Zn具有较高的表面积,有利于沉积ZnO
B.放电时每沉积,有通过隔膜
C.充电时3D-Zn电极应与外接直流电源的负极相连
D.充电时阳极反应为
12.如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是
A.该装置是将电能转化为化学能的装置
B.该离子交换膜只能让阳离子通过,不能让阴离子通过
C.装置中发生反应的离子方程式为2Cl-+2H+Cl2+2H2
D.装置中出口①处的物质是氯气,出口②处的物质是氢气
13.火法炼铜得到的粗铜中含多种杂质(如锌、金和银等),其性能远不能达到电气工业的要求,工业上常用电解精炼法将粗铜提纯。在电解精炼时
A.粗铜接电源负极
B.纯铜做阴极
C.杂质都将以单质形式沉积到池底
D.纯铜片增重2.56g,电路中通过电子为0.04mol
14.三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法不正确的是
A.可用铁作阳极材料
B.电解过程中阴极附近溶液的pH升高
C.阳极反应方程式为:
D.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子
15.锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2),导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为,充放电过程中,正极发生LiCoO2与Li1-xCoO2之间的转化。下列有关说法不正确的是
A.放电时的负极反应式为:
B.钴酸锂(LiCoO2)中钴元素的化合价为+3
C.放电时正极发生LiCoO2转化为Li1-xCoO2的反应
D.放电时锂离子向正极移动
二、实验题
16.示意氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为该电池的工作原理示意图,该电池的电极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定。请回答:
(1)氢氧燃料电池放电时能量转化形式主要是___,在导线中电子流动方向为___(用a、b表示)。
(2)负极的电极反应式为___。
(3)电极表面镀铂粉的原因是___。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
I.
Ⅱ.LiH+H2O=LiOH+H2↑
①反应I中的还原剂是___,反应Ⅱ中的氧化剂是___。
②已知LiH固体的密度为0.82g cm-3。用锂吸收224L(标准状况下)H2,生成的LiH的物质的量为___mol。
③将由②生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为___mol。
17.如下图设计的串联电池装置,R为变阻器,以调节电路电流。
(1)写出b、c电极的电极反应式:b______________,c_______________;
(2)写出f电极的电极反应式____________________,向此电极区域滴入酚酞的现象为:_____________;该电极区域水的电离平衡被____________(填“促进”、“抑制”或“无影响”)。
(3)闭合K一段时间后,丙装置的电解质溶液pH__________(填“变大”、“变小”或“不变”),原因是______________。
(4)电解一段时间后丙装置析出芒硝(Na2SO4·10H2O),若此时通入CH4的体积为22.4L(标准状况下),则向丙装置中加入______g H2O就可以将析出的沉淀溶解并恢复到原有浓度。
三、原理综合题
18.氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
I.空间站以水为介质将不同形式的能量相互转化,原理如图所示,装置x为电解水,装置y为燃料电池。
(1)太阳能电池的能量转化形式为_______(填字母)。
A.化学能转化为电能 B.电能转化为化学能 C.太阳能转化为电能
(2)装置x工作时,产生的电极为_______极(填“阳”或“阴”)。
(3)装置y工作时,若电解质溶液为稀硫酸,则正极反应式为_______。
II.氢能的利用包括氢的制备、储存和应用三个环节。
(4)氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:_____。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的,同时获得氢气:,工作原理如图所示。装置通电后,铁电极附近生成紫红色的,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:只在强碱性条件下稳定,易被还原。
①电解一段时间后,降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,需将阴极产生的气体及时排出,其原因是_______。
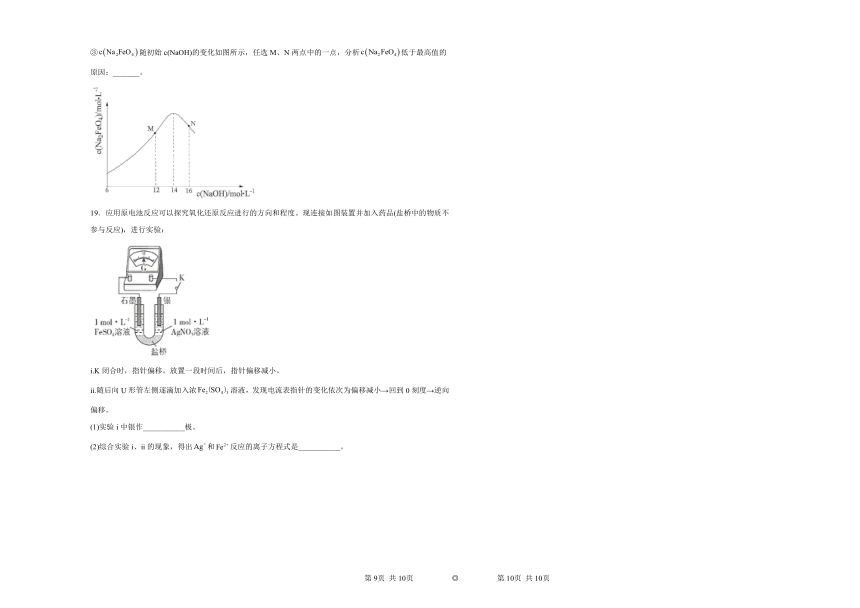
③随初始c(NaOH)的变化如图所示,任选M、N两点中的一点,分析低于最高值的原因:_______。
19.应用原电池反应可以探究氧化还原反应进行的方向和程度。现连接如图装置并加入药品(盐桥中的物质不参与反应),进行实验:
i.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
ii.随后向U形管左侧逐滴加入浓溶液,发现电流表指针的变化依次为偏移减小→回到0刻度→逆向偏移。
(1)实验i中银作___________极。
(2)综合实验i、ii的现象,得出和反应的离子方程式是___________。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【分析】该装置为电解池,与电源正极相连的B极作阳极,电极反应式为;与电源负极相连的A极作阴极,电极反应式为;据此分析解答。
【详解】A.A、B电极反应式分别为、, A电极生成的H2与B电极生成的O2都是无色,无味的,A错误;
B.根据分析,B极作阳极,电极反应式为,阳极上生成O2,O2能使带火星的木条复燃,B正确;
C.由电极反应式知,A电极附近溶液呈碱性,B电极附近溶液呈酸性,则A电极溶液呈蓝色,B电极溶液呈红色,C错误;
D.惰性电极电解稀Na2SO4溶液,实际是电解水,将全部电解液转移到同一烧杯中,充分搅拌后溶解呈中性。
故选B。
2.B
【分析】由图可知,该装置为电解池,石墨电极为阳极,水在阳极失去电子发生氧化反应生成氧气和氢离子,电极反应式为,I室中阳离子电荷数大于阴离子电荷数,放电生成的氢离子通过阳离子交换膜由I室向II室移动,钴电极为阴极,钴离子在阴极得到电子发生还原反应生成钴,电极反应式为,III室中阴离子电荷数大于阳离子电荷数,氯离子通过阴离子交换膜由III室向II室移动,电解的总反应的离子方程式为。
【详解】A.由分析可知,放电生成的氢离子通过阳离子交换膜由I室向II室移动,使II室中氢离子浓度增大,溶液减小,A错误;
B.由分析可知,电解总反应为,B正确;
C.若移除离子交换膜,氯离子的放电能力强于水,氯离子会在阳极失去电子发生氧化反应生成氯气,则移除离子交换膜,石墨电极的电极反应会发生变化,电极发生的反应不变,C错误;
D.由分析可知,阴极生成钴,阳极有水放电生成,且氢离子通过阳离子交换膜由I室移向II室,则I室溶液质量减少,D错误;
故选:B。
3.D
【分析】由电池总反应,可知放电时铝电极为负极,负极反应式为,其逆过程就是充电时的阴极反应;正极为石墨烯载钯电极,其电极反应式为,其逆过程就是充电时的阳极反应。
【详解】A.电池充电时向阳极石墨烯载钯电极移动,A项错误;
B.放电时铝电极为负极,石墨烯载钯电极为正极,正极电势高于负极,因此石墨烯载钯电极的电势比铝电极高,B项错误;
C.未指明所处的状态是否为标准状况,无法计算的体积,C项错误;
D.根据上述分析可知,电池放电时,正极的电极反应式是8Al2Cl+N2+6e-=2AlN+14AlCl,D项正确;
答案选D。
4.C
【分析】由图可知,放电时,M极为原电池的负极,碱性条件下锌失去电子发生氧化反应生成四羟基合锌离子,电极反应式为Zn—2e—+4OH—=Zn(OH),N电极为正极,酸性条件下二氧化铅在正极得到电子发生还原反应生成硫酸铅和水PbO2+2e—+SO+4H+=PbSO4+2H2O,充电时,与直流电源负极相连的M极为阴极,N电极为阳极。
【详解】A.由分析可知,放电时,M极为原电池的负极,故A错误;
B.由分析可知,放电时,M极为原电池的负极,N电极为正极,则阳离子钾离子从中间室移向右极室,故B错误;
C.由分析可知,充电时,N极为阳极,水分子作用下硫酸铅在阳极失去电子发生氧化反应生成二氧化铅、硫酸根离子和氢离子,电极反应式为,故C正确;
D.由分析可知,充电时,与直流电源负极相连的M极为阴极,N电极为阳极,当M极质量每增加32.5g,外电路中通过电子的物质的量为×2=1mol,故D错误;
故选C。
5.D
【详解】A.电解饱和食盐时氯离子在阳极放电生成氯气,所以碳纳米电极为阳极,发生氧化反应生成氯气,故A正确;
B.为防止阳极生成的氯气与阴极生成的H2、NaOH发生反应,所以离子交换膜为阳离子交换膜,故B正确;
C.Cl2在阳极,依据装置图分析可知精制饱和食盐水从阳极进入,即b处进,NaOH在阴极生成,NaOH溶液的从c处出,故C正确;
D.由B可知,离子交换膜为阳离子交换膜,不迁移,钠离子迁移,故D错误;
故选:D。
6.A
【分析】根据反应Fe+Cu2+=Fe2+ +Cu,可知该原电池中Fe为负极,正极选用比铁不活泼的金属或碳棒,电解液为含Cu2+的溶液。
【详解】A.由分析可知Fe为负极,碳棒为正极,Cu2+的溶液为电解液,A正确;
B.Fe为负极,不能为铜棒,B错误;
C.铁和铜作原电池电极,铁更活泼应为负极,C错误;
D.由分析可知电解液为含Cu2+的溶液,D错误;
故选A。
7.C
【分析】该电解池中,O2-离子移向N极、失去电子发生氧化反应生成O2,则N极为阳极,N极与电源正极相连,M极是阴极、与电源负极相连,M极上发生还原反应;
【详解】A. 据分析,M为阴极,与电源的负极相连,A错误;
B. 据分析:M极上发生还原反应,若,则M极的电极反应式为,B错误;
C.存在关系式:,每生成(标准状况) 电路中转移电子数为,,每生成(标准状况)电路中转移电子数为,则理论上每生成(标准状况)和电路中转移电子数为,C正确;
D.常温下固体氧化物(电解质为掺杂了氧化钇的氧化锆)中离子不能自由移动,高温下熔融离子可自由移动,则该装置在不能在常温下工作, D错误;
答案选C。
8.C
【分析】根据图示,电极通入SO2失电子生成,则电极为负极,电极反应为,电极为正极,酸性条件下,通入的氧气得电子生成水,发生的反应为,据此分析解答。
【详解】A.放电时,电子从负极流向正极,电极为负极,电极为正极,则该电池放电时电子从电极经过外电路流到电极,故A正确;
B.电极通入SO2,SO2在负极失电子生成,则电极反应为,故B正确;
C.酸性条件下,氧气得电子生成水,则电极附近发生的反应为,故C错误;
D.该电池的原理为二氧化硫与氧气的反应,即2SO2+O2+2H2O=2H2SO4,所以放电过程中消耗的和的体积比为,故D正确;
答案选C。
9.C
【分析】该装置为二次电池,由信息可知放电时M极氯气得电子,发生还原反应,M为正极,N为负极,充电时M为阳极,N为阴极。
【详解】A.放电时,M极为正极,N极为负极,M极电势高于N极,A错误;
B.充电时,充电时, M为阳极,电极反应2Cl—-2e-=Cl2↑,左侧储液器中的浓度增大,B错误;
C.充电时, M为阳极,电极反应2Cl—-2e-=Cl2↑,N为阴极,电极反应,电路中每转移时,M电极质量不变,N电极质量增加23g,两电极质量变化的差值为23g,C正确;
D.放电时,N极为负极,发生失电子的氧化反应,电极反应式为,D错误;
故答案选C。
10.D
【详解】A.手机用锂电池,可充电,属于二次电池,故A不选;
B.电动汽车用电池,可充电,属于二次电池,故B不选;
C.铅酸蓄电池,可充电,属于二次电池,故C不选;
D.锌锰干电池不可充电,属于一次电池,故D选;
故选D。
11.B
【分析】根据电池中元素化合价变化可知,放电时Zn为负极,NiOOH为正极,电解质溶液呈碱性,负极反应为,正极反应为,充电时阳极反应为,阴极反应为,据此回答。
【详解】A.三维多孔海绵状Zn(3D-Zn)为多孔结构,具有较高的表面积,有利于沉积ZnO,故A正确;
B.放电时由负极反应,可知每沉积,有通过隔膜,故B不正确;
C.充电时3D-Zn电极做阴极,应与外接直流电源的负极相连,故C正确;
D.由分析知 充电时阳极反应为,故D正确;
故答案为:B。
12.C
【分析】装置是电解饱和食盐水,将电能转化为化学能;电解过程是氯化钠和水反应生成氢氧化钠和氢气、氯气;出口①是电解池的阳极,出口②是电解池的阴极;依据装置图可知,阳离子向电解池的阴极移动,故离子交换膜是阳离子交换膜。
【详解】A.装置是电解池,是将电能转化为化学能的装置,选项A正确;
B.依据装置图可知,离子交换膜是阳离子交换膜,只允许阳离子通过,不能让阴离子通过,选项B正确;
C.装置是电解饱和食盐水,电解过程是氯化钠和水反应生成氢氧化钠和氢气、氯气,反应的离子方程式为:2Cl-+2H2OCl2↑+2H2↑+2OH-,选项C不正确;
D.根据钠离子移向阴极确定②是阴极,出口①是电解池的阳极,溶液中的氯离子在阳极失电子生成氯气,出口②是电解池的阴极,溶液中的氢离子得到电子发生还原反应生成氢气,选项D正确;
答案选C。
13.B
【详解】A.电解精炼时,粗铜做阳极接电源正极,故A错误;
B.电解精炼时,纯铜做阴极,故B正确;
C.活动性Zn>Cu>Ag>Au,所以Zn-2e-=Zn2+,不活泼金和银以单质的形式沉积在阳极附近形成阳极泥,故C错误;
D.纯铜片增重2.56 g,即0.04mol,由Cu2++2e-=Cu知,电路中通过的电子应为0.08mol,故D错误;
故答案为:B。
14.A
【详解】A.由题意知电解过程中氯离子失电子生成氯气,该反应应在阳极发生,阳极:2Cl--2e-=Cl2↑,则阳极应为惰性电极,因此不能是铁,故A错误,
B.阴极:2H++2e-=H2↑,阴极溶液呈碱性,pH升高,故B正确;
C.由以上分析可知阳极反应为:,故C正确;
D.由Ni2+→Ni3+,失去1 mol e-,外电路中转移1 mol e-,即Cl-失去1 mol e-,H+得到1 mol e-,故D正确;
故选:A。
15.C
【详解】A.放电时为原电池,负极失电子发生氧化反应,则负极反应式为:,故A正确;
B.钴酸锂(LiCoO2)中Li为+1价,O为-2价,则钴元素的化合价为+3,故B正确;
C.放电时正极得电子发生氧化反应, Li1-xCoO2+xe-+xLi+=LiCoO2,即发生Li1-xCoO2转化为LiCoO2的反应,故C错误;
D.放电时,阳离子向正极移动,则锂离子向正极移动,故D正确;
故答案为C。
16. 化学能转化为电能 由a到b 增大电极单位面积吸附H2、O2的分子数,加快电极反应速率 Li H2O 20 32
【分析】氢氧燃料电池总反应为,氢气所在电极为负极,氢元素化合价升高,失去电子,发生氧化反应,电子在导线中从a流向b,依此解答。
【详解】(1)原电池是把化学能转化成电能的装置,电池总反应为,其中H元素从0价升至+1价,失去电子,即电子在导线中从a流向b;
(2)负极为失去电子的一极, 失电子生成,由于溶液呈碱性,故负极的电极反应式为;
(3)电极表面镀铂粉可增大电极单位面积吸附、的分子数,可以加快反应速率;
(4)①反应I中元素从0价升至+1价,故作还原剂;反应Ⅱ中中的H元素从+1价降至中的0价,故作氧化剂;
②由反应I可知,当锂吸收标准状况下时,生成;
③可生成,则实际参加反应的为,
因1mol转化成1mol的过程中转移2mol电子,所以16mol在反应中转移32mol电子。
17. O2+4H++4e-=2H2O CH4+10OH--8e-=+7H2O 2H++2e-=H2↑ 溶液变红 促进 不变 硫酸钠为强酸强碱盐,用惰性电极电解,实质是电解水,所以pH不变 72
【分析】根据图示可知:甲、乙装置为两个燃料电池串联,丙为电解硫酸钠的装置。甲、乙装置中通入甲烷的a、c电极为负极,通入氧气的b、d为正极,则与正极连接的e为阳极,与负极连接的f电极为阴极。
【详解】(1)根据上述分析,b电极通入O2为正极,得到电子发生还原反应,由于电解质为H2SO4,所以b电极反应式为:O2+4H++4e-=2H2O,c电极通入CH4为负极,失去电子发生氧化反应,电解质为KOH,CH4失去电子变为,同时产生H2O,则c电极反应式为:CH4+10OH--8e-=+7H2O;
(2)f电极连接电源的负极作阴极,得到电子发生还原反应,由于得到电子能力:H+>Na+,故f电极反应式为:2H++2e-=H2↑。H+放电,使附近水的电离平衡正向移动,因而水电离受到促进作用,最终达到平衡后溶液中c(OH-)>c(H+),电极附近溶液显碱性,向此电极区域滴入酚酞,溶液变红色;
(3)丙装置为电解Na2SO4溶液,该物质是强酸强碱盐,不水解,溶液显中性,用惰性电极电解Na2SO4溶液相当于电解水,电解后电解质溶液pH不变;
(4) 标准状况下22.4 L CH4的物质的量为1 mol,根据CH4+10OH--8e-=+7H2O可知,反应过程转移的电子为8 mol,则丙装置中电解的水物质的量为4 mol,其质量m(H2O)=4 mol×18 g/mol=72 g,因此需要加入72 g水,可以将析出的沉淀溶解并恢复到原有浓度。
18.(1)C
(2)阳
(3)
(4)
(5) 阳极室 防止被还原,使产率降低 M点:小,稳定性差,且反应慢[或N点:过大,铁电极区有氢氧化铁生成,使产率降低
【分析】太阳能电池将太阳能转化为电能,装置x为电解池,电解水生成氢气和氧气;氢气和氧气通入原电池装置y中发生反应生成水。
(1)
太阳能电池的能量转化形式为光能转化为电能,C正确,故选C;
(2)
x为电解池,氧元素发生氧化反应生成氧气,产生O2的电极为阳极;
(3)
装置y为燃料电池,是原电池,若电解质溶液为硫酸,则正极为氧气发生还原反应,反应式为;
(4)
碱性氢氧燃料电池的负极为氢气发生氧化反应,反应式为;
(5)
①根据题意,镍电极有气泡产生是氢离子放电发生还原反应生成氢气,为阴极室;在铁电极发生反应为氧化反应,溶液中的氢氧根离子减少,为阳极室;因此电解—段时间后,降低的区域在阳极室;
②氢气具有还原性,根据题意只在强碱性条件下稳定,易被H2还原。电解过程中,须将阴极产生的气体及时排出,防止与H2反应使产率降低;
③根据题意只在强碱性条件下稳定,若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质;在M点,低,稳定性差,且反应慢,在N点:过高,铁电极上有氢氧化铁生成,使产率降低,故答案为:M点:低,稳定性差,且反应慢(或N点:过高,铁电极上有氢氧化铁生成,使产率降低)。
19.(1)正
(2)
【分析】实验i,K闭合时,指针偏移,说明形成了原电池,放置一段时间后,指针偏移减小;实验ii,向U形管左侧逐滴加入浓Fe2(SO4)3溶液,电流表指针的变化依次为偏移减小→回到0刻度→逆向偏移,实验ii左侧的电极反应为Fe3++e-=Fe2+;则实验i左侧的电极反应为Fe2+-e-=Fe3+。
(1)
根据分析,实验i左侧Fe2+失电子被氧化成Fe3+,则石墨电极为负极,银作正极;答案为:正。
(2)
实验i中,石墨电极电极反应为Fe2+-e-=Fe3+,银为正极,电极反应为Ag++e-=Ag;而实验ii向U形管左侧加入浓硫酸铁溶液,指针先回到0刻度,最终指针的偏移方向与实验i相反,可知发生的反应为可逆反应,反应的离子方程式为Fe2++Ag+Fe3++Ag;答案为:Fe2++Ag+Fe3++Ag。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下图是一个用石墨作电极,电解稀Na2SO4溶液的装置,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液。下列有关叙述正确的是
A.A极生成的气体无色无味,B极生成的气体有刺激性气味
B.收集B极产生的气体,该气体能使带火星的木条复燃
C.A极附近呈红色,B极附近呈蓝色
D.电解一段时间后,将全部电解液转移到同一烧杯中,充分搅拌后溶解呈碱性
2.钴()的合金材料广泛应用于航空航天、机械制造等领域。如图为水溶液中电解制备金属钴的装置示意图。下列说法正确的是
A.工作时,I室和II室溶液的均增大
B.电解总反应:
C.移除两交换膜后,电极和石墨电极发生的反应均发生变化
D.生成,I室溶液质量理论上减少
3.我国科学家以铝和石墨烯载钯作电极,氯铝酸型离子液体作电解质,构建了如图所示的Al-N2电池体系(阳离子略),总反应为2Al+N22AlN。下列说法正确的是
A.电池充电时AlCl向Al电极移动
B.石墨烯载钯电极的电势比Al电极低
C.电池放电时,每转移3mole-消耗11.2LN2
D.电池放电时,正极的电极反应式是8Al2Cl+N2+6e-=2AlN+14AlCl
4.某科研团队提出了一种碱—酸Zn-—混合充放电电池,其放电时的工作原理如图所示,下列说法正确的是
A.放电时,M极为正极
B.放电时,从中间室移向左极室
C.充电时,N极发生的电极反应式为
D.充电时,M极质量每增加32.5g,外电路中通过2mol电子
5.在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下。下列说法错误的是
A.碳纳米电极为阳极,发生氧化反应生成氯气
B.离子交换膜为阳离子交换膜
C.精制饱和NaCl溶液从b处进,NaOH溶液从c处出
D.迁移过交换膜的数量等于导线上通过电子的数量
6.某同学根据化学反应Fe+Cu2+=Fe2+ +Cu,并利用实验室材料制作原电池。下列关于该原电池组成的说法正确的是
选项 A B C D
正极 石墨棒 石墨棒 铁棒 铜棒
负极 铁棒 铜棒 铜棒 铁棒
电解质溶液 CuCl2溶液 CuCl2溶液 FeSO4溶液 FeSO4溶液
A.A B.B C.C D.D
7.以和为原料的共电解技术既能制备原料气(和),又能实现减排,对环境保护有重要意义。固体氧化物(电解质为掺杂了氧化钇的氧化锆)电解池的工作原理如图,下列说法正确的是
A.N为阴极,与电源的负极相连
B.若,则M极的电极反应式为
C.理论上每生成(标准状况)和电路中转移电子数为
D.该装置在常温下工作,可节约能源
8.“打赢蓝天保卫战”,近年来对大气污染防治的要求日益提高。二氧化硫—空气质子交换膜燃料电池实现了制稀硫酸、发电、环保三位一体的结合,原理如图所示。下列说法错误的是
A.该电池放电时电子从电极经过外电路流到电极
B.电极附近发生的反应为
C.电极附近发生的反应为
D.相同条件下,放电过程中消耗的和的体积比为
9.无膜氯液流电池是一种先进的低成本高储能电池,可广泛应用于再生能源储能和智能电网的备用电源等,工作原理如图所示,M为多孔碳电极,N为和电极。下列说法正确的是
A.放电时,M极电势低于N极
B.充电时,左侧储液器中的浓度减小
C.充电时,电路中每转移,两电极质量变化的差值为23g
D.放电时,N极的电极反应式为
10.下列电池不属于二次电池的是
A B C D
手机用锂电池 电动汽车用电池 铅酸蓄电池 锌锰干电池
A.A B.B C.C D.D
11.科学家利用三维多孔海绵状Zn(3D-Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D-Zn-NiOOH二次电池,结构如图所示,隔膜只允许通过。电池反应为。下列说法不正确的是
A.3D-Zn具有较高的表面积,有利于沉积ZnO
B.放电时每沉积,有通过隔膜
C.充电时3D-Zn电极应与外接直流电源的负极相连
D.充电时阳极反应为
12.如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是
A.该装置是将电能转化为化学能的装置
B.该离子交换膜只能让阳离子通过,不能让阴离子通过
C.装置中发生反应的离子方程式为2Cl-+2H+Cl2+2H2
D.装置中出口①处的物质是氯气,出口②处的物质是氢气
13.火法炼铜得到的粗铜中含多种杂质(如锌、金和银等),其性能远不能达到电气工业的要求,工业上常用电解精炼法将粗铜提纯。在电解精炼时
A.粗铜接电源负极
B.纯铜做阴极
C.杂质都将以单质形式沉积到池底
D.纯铜片增重2.56g,电路中通过电子为0.04mol
14.三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法不正确的是
A.可用铁作阳极材料
B.电解过程中阴极附近溶液的pH升高
C.阳极反应方程式为:
D.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子
15.锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2),导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为,充放电过程中,正极发生LiCoO2与Li1-xCoO2之间的转化。下列有关说法不正确的是
A.放电时的负极反应式为:
B.钴酸锂(LiCoO2)中钴元素的化合价为+3
C.放电时正极发生LiCoO2转化为Li1-xCoO2的反应
D.放电时锂离子向正极移动
二、实验题
16.示意氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为该电池的工作原理示意图,该电池的电极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定。请回答:
(1)氢氧燃料电池放电时能量转化形式主要是___,在导线中电子流动方向为___(用a、b表示)。
(2)负极的电极反应式为___。
(3)电极表面镀铂粉的原因是___。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
I.
Ⅱ.LiH+H2O=LiOH+H2↑
①反应I中的还原剂是___,反应Ⅱ中的氧化剂是___。
②已知LiH固体的密度为0.82g cm-3。用锂吸收224L(标准状况下)H2,生成的LiH的物质的量为___mol。
③将由②生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为___mol。
17.如下图设计的串联电池装置,R为变阻器,以调节电路电流。
(1)写出b、c电极的电极反应式:b______________,c_______________;
(2)写出f电极的电极反应式____________________,向此电极区域滴入酚酞的现象为:_____________;该电极区域水的电离平衡被____________(填“促进”、“抑制”或“无影响”)。
(3)闭合K一段时间后,丙装置的电解质溶液pH__________(填“变大”、“变小”或“不变”),原因是______________。
(4)电解一段时间后丙装置析出芒硝(Na2SO4·10H2O),若此时通入CH4的体积为22.4L(标准状况下),则向丙装置中加入______g H2O就可以将析出的沉淀溶解并恢复到原有浓度。
三、原理综合题
18.氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
I.空间站以水为介质将不同形式的能量相互转化,原理如图所示,装置x为电解水,装置y为燃料电池。
(1)太阳能电池的能量转化形式为_______(填字母)。
A.化学能转化为电能 B.电能转化为化学能 C.太阳能转化为电能
(2)装置x工作时,产生的电极为_______极(填“阳”或“阴”)。
(3)装置y工作时,若电解质溶液为稀硫酸,则正极反应式为_______。
II.氢能的利用包括氢的制备、储存和应用三个环节。
(4)氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:_____。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的,同时获得氢气:,工作原理如图所示。装置通电后,铁电极附近生成紫红色的,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:只在强碱性条件下稳定,易被还原。
①电解一段时间后,降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,需将阴极产生的气体及时排出,其原因是_______。
③随初始c(NaOH)的变化如图所示,任选M、N两点中的一点,分析低于最高值的原因:_______。
19.应用原电池反应可以探究氧化还原反应进行的方向和程度。现连接如图装置并加入药品(盐桥中的物质不参与反应),进行实验:
i.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
ii.随后向U形管左侧逐滴加入浓溶液,发现电流表指针的变化依次为偏移减小→回到0刻度→逆向偏移。
(1)实验i中银作___________极。
(2)综合实验i、ii的现象,得出和反应的离子方程式是___________。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【分析】该装置为电解池,与电源正极相连的B极作阳极,电极反应式为;与电源负极相连的A极作阴极,电极反应式为;据此分析解答。
【详解】A.A、B电极反应式分别为、, A电极生成的H2与B电极生成的O2都是无色,无味的,A错误;
B.根据分析,B极作阳极,电极反应式为,阳极上生成O2,O2能使带火星的木条复燃,B正确;
C.由电极反应式知,A电极附近溶液呈碱性,B电极附近溶液呈酸性,则A电极溶液呈蓝色,B电极溶液呈红色,C错误;
D.惰性电极电解稀Na2SO4溶液,实际是电解水,将全部电解液转移到同一烧杯中,充分搅拌后溶解呈中性。
故选B。
2.B
【分析】由图可知,该装置为电解池,石墨电极为阳极,水在阳极失去电子发生氧化反应生成氧气和氢离子,电极反应式为,I室中阳离子电荷数大于阴离子电荷数,放电生成的氢离子通过阳离子交换膜由I室向II室移动,钴电极为阴极,钴离子在阴极得到电子发生还原反应生成钴,电极反应式为,III室中阴离子电荷数大于阳离子电荷数,氯离子通过阴离子交换膜由III室向II室移动,电解的总反应的离子方程式为。
【详解】A.由分析可知,放电生成的氢离子通过阳离子交换膜由I室向II室移动,使II室中氢离子浓度增大,溶液减小,A错误;
B.由分析可知,电解总反应为,B正确;
C.若移除离子交换膜,氯离子的放电能力强于水,氯离子会在阳极失去电子发生氧化反应生成氯气,则移除离子交换膜,石墨电极的电极反应会发生变化,电极发生的反应不变,C错误;
D.由分析可知,阴极生成钴,阳极有水放电生成,且氢离子通过阳离子交换膜由I室移向II室,则I室溶液质量减少,D错误;
故选:B。
3.D
【分析】由电池总反应,可知放电时铝电极为负极,负极反应式为,其逆过程就是充电时的阴极反应;正极为石墨烯载钯电极,其电极反应式为,其逆过程就是充电时的阳极反应。
【详解】A.电池充电时向阳极石墨烯载钯电极移动,A项错误;
B.放电时铝电极为负极,石墨烯载钯电极为正极,正极电势高于负极,因此石墨烯载钯电极的电势比铝电极高,B项错误;
C.未指明所处的状态是否为标准状况,无法计算的体积,C项错误;
D.根据上述分析可知,电池放电时,正极的电极反应式是8Al2Cl+N2+6e-=2AlN+14AlCl,D项正确;
答案选D。
4.C
【分析】由图可知,放电时,M极为原电池的负极,碱性条件下锌失去电子发生氧化反应生成四羟基合锌离子,电极反应式为Zn—2e—+4OH—=Zn(OH),N电极为正极,酸性条件下二氧化铅在正极得到电子发生还原反应生成硫酸铅和水PbO2+2e—+SO+4H+=PbSO4+2H2O,充电时,与直流电源负极相连的M极为阴极,N电极为阳极。
【详解】A.由分析可知,放电时,M极为原电池的负极,故A错误;
B.由分析可知,放电时,M极为原电池的负极,N电极为正极,则阳离子钾离子从中间室移向右极室,故B错误;
C.由分析可知,充电时,N极为阳极,水分子作用下硫酸铅在阳极失去电子发生氧化反应生成二氧化铅、硫酸根离子和氢离子,电极反应式为,故C正确;
D.由分析可知,充电时,与直流电源负极相连的M极为阴极,N电极为阳极,当M极质量每增加32.5g,外电路中通过电子的物质的量为×2=1mol,故D错误;
故选C。
5.D
【详解】A.电解饱和食盐时氯离子在阳极放电生成氯气,所以碳纳米电极为阳极,发生氧化反应生成氯气,故A正确;
B.为防止阳极生成的氯气与阴极生成的H2、NaOH发生反应,所以离子交换膜为阳离子交换膜,故B正确;
C.Cl2在阳极,依据装置图分析可知精制饱和食盐水从阳极进入,即b处进,NaOH在阴极生成,NaOH溶液的从c处出,故C正确;
D.由B可知,离子交换膜为阳离子交换膜,不迁移,钠离子迁移,故D错误;
故选:D。
6.A
【分析】根据反应Fe+Cu2+=Fe2+ +Cu,可知该原电池中Fe为负极,正极选用比铁不活泼的金属或碳棒,电解液为含Cu2+的溶液。
【详解】A.由分析可知Fe为负极,碳棒为正极,Cu2+的溶液为电解液,A正确;
B.Fe为负极,不能为铜棒,B错误;
C.铁和铜作原电池电极,铁更活泼应为负极,C错误;
D.由分析可知电解液为含Cu2+的溶液,D错误;
故选A。
7.C
【分析】该电解池中,O2-离子移向N极、失去电子发生氧化反应生成O2,则N极为阳极,N极与电源正极相连,M极是阴极、与电源负极相连,M极上发生还原反应;
【详解】A. 据分析,M为阴极,与电源的负极相连,A错误;
B. 据分析:M极上发生还原反应,若,则M极的电极反应式为,B错误;
C.存在关系式:,每生成(标准状况) 电路中转移电子数为,,每生成(标准状况)电路中转移电子数为,则理论上每生成(标准状况)和电路中转移电子数为,C正确;
D.常温下固体氧化物(电解质为掺杂了氧化钇的氧化锆)中离子不能自由移动,高温下熔融离子可自由移动,则该装置在不能在常温下工作, D错误;
答案选C。
8.C
【分析】根据图示,电极通入SO2失电子生成,则电极为负极,电极反应为,电极为正极,酸性条件下,通入的氧气得电子生成水,发生的反应为,据此分析解答。
【详解】A.放电时,电子从负极流向正极,电极为负极,电极为正极,则该电池放电时电子从电极经过外电路流到电极,故A正确;
B.电极通入SO2,SO2在负极失电子生成,则电极反应为,故B正确;
C.酸性条件下,氧气得电子生成水,则电极附近发生的反应为,故C错误;
D.该电池的原理为二氧化硫与氧气的反应,即2SO2+O2+2H2O=2H2SO4,所以放电过程中消耗的和的体积比为,故D正确;
答案选C。
9.C
【分析】该装置为二次电池,由信息可知放电时M极氯气得电子,发生还原反应,M为正极,N为负极,充电时M为阳极,N为阴极。
【详解】A.放电时,M极为正极,N极为负极,M极电势高于N极,A错误;
B.充电时,充电时, M为阳极,电极反应2Cl—-2e-=Cl2↑,左侧储液器中的浓度增大,B错误;
C.充电时, M为阳极,电极反应2Cl—-2e-=Cl2↑,N为阴极,电极反应,电路中每转移时,M电极质量不变,N电极质量增加23g,两电极质量变化的差值为23g,C正确;
D.放电时,N极为负极,发生失电子的氧化反应,电极反应式为,D错误;
故答案选C。
10.D
【详解】A.手机用锂电池,可充电,属于二次电池,故A不选;
B.电动汽车用电池,可充电,属于二次电池,故B不选;
C.铅酸蓄电池,可充电,属于二次电池,故C不选;
D.锌锰干电池不可充电,属于一次电池,故D选;
故选D。
11.B
【分析】根据电池中元素化合价变化可知,放电时Zn为负极,NiOOH为正极,电解质溶液呈碱性,负极反应为,正极反应为,充电时阳极反应为,阴极反应为,据此回答。
【详解】A.三维多孔海绵状Zn(3D-Zn)为多孔结构,具有较高的表面积,有利于沉积ZnO,故A正确;
B.放电时由负极反应,可知每沉积,有通过隔膜,故B不正确;
C.充电时3D-Zn电极做阴极,应与外接直流电源的负极相连,故C正确;
D.由分析知 充电时阳极反应为,故D正确;
故答案为:B。
12.C
【分析】装置是电解饱和食盐水,将电能转化为化学能;电解过程是氯化钠和水反应生成氢氧化钠和氢气、氯气;出口①是电解池的阳极,出口②是电解池的阴极;依据装置图可知,阳离子向电解池的阴极移动,故离子交换膜是阳离子交换膜。
【详解】A.装置是电解池,是将电能转化为化学能的装置,选项A正确;
B.依据装置图可知,离子交换膜是阳离子交换膜,只允许阳离子通过,不能让阴离子通过,选项B正确;
C.装置是电解饱和食盐水,电解过程是氯化钠和水反应生成氢氧化钠和氢气、氯气,反应的离子方程式为:2Cl-+2H2OCl2↑+2H2↑+2OH-,选项C不正确;
D.根据钠离子移向阴极确定②是阴极,出口①是电解池的阳极,溶液中的氯离子在阳极失电子生成氯气,出口②是电解池的阴极,溶液中的氢离子得到电子发生还原反应生成氢气,选项D正确;
答案选C。
13.B
【详解】A.电解精炼时,粗铜做阳极接电源正极,故A错误;
B.电解精炼时,纯铜做阴极,故B正确;
C.活动性Zn>Cu>Ag>Au,所以Zn-2e-=Zn2+,不活泼金和银以单质的形式沉积在阳极附近形成阳极泥,故C错误;
D.纯铜片增重2.56 g,即0.04mol,由Cu2++2e-=Cu知,电路中通过的电子应为0.08mol,故D错误;
故答案为:B。
14.A
【详解】A.由题意知电解过程中氯离子失电子生成氯气,该反应应在阳极发生,阳极:2Cl--2e-=Cl2↑,则阳极应为惰性电极,因此不能是铁,故A错误,
B.阴极:2H++2e-=H2↑,阴极溶液呈碱性,pH升高,故B正确;
C.由以上分析可知阳极反应为:,故C正确;
D.由Ni2+→Ni3+,失去1 mol e-,外电路中转移1 mol e-,即Cl-失去1 mol e-,H+得到1 mol e-,故D正确;
故选:A。
15.C
【详解】A.放电时为原电池,负极失电子发生氧化反应,则负极反应式为:,故A正确;
B.钴酸锂(LiCoO2)中Li为+1价,O为-2价,则钴元素的化合价为+3,故B正确;
C.放电时正极得电子发生氧化反应, Li1-xCoO2+xe-+xLi+=LiCoO2,即发生Li1-xCoO2转化为LiCoO2的反应,故C错误;
D.放电时,阳离子向正极移动,则锂离子向正极移动,故D正确;
故答案为C。
16. 化学能转化为电能 由a到b 增大电极单位面积吸附H2、O2的分子数,加快电极反应速率 Li H2O 20 32
【分析】氢氧燃料电池总反应为,氢气所在电极为负极,氢元素化合价升高,失去电子,发生氧化反应,电子在导线中从a流向b,依此解答。
【详解】(1)原电池是把化学能转化成电能的装置,电池总反应为,其中H元素从0价升至+1价,失去电子,即电子在导线中从a流向b;
(2)负极为失去电子的一极, 失电子生成,由于溶液呈碱性,故负极的电极反应式为;
(3)电极表面镀铂粉可增大电极单位面积吸附、的分子数,可以加快反应速率;
(4)①反应I中元素从0价升至+1价,故作还原剂;反应Ⅱ中中的H元素从+1价降至中的0价,故作氧化剂;
②由反应I可知,当锂吸收标准状况下时,生成;
③可生成,则实际参加反应的为,
因1mol转化成1mol的过程中转移2mol电子,所以16mol在反应中转移32mol电子。
17. O2+4H++4e-=2H2O CH4+10OH--8e-=+7H2O 2H++2e-=H2↑ 溶液变红 促进 不变 硫酸钠为强酸强碱盐,用惰性电极电解,实质是电解水,所以pH不变 72
【分析】根据图示可知:甲、乙装置为两个燃料电池串联,丙为电解硫酸钠的装置。甲、乙装置中通入甲烷的a、c电极为负极,通入氧气的b、d为正极,则与正极连接的e为阳极,与负极连接的f电极为阴极。
【详解】(1)根据上述分析,b电极通入O2为正极,得到电子发生还原反应,由于电解质为H2SO4,所以b电极反应式为:O2+4H++4e-=2H2O,c电极通入CH4为负极,失去电子发生氧化反应,电解质为KOH,CH4失去电子变为,同时产生H2O,则c电极反应式为:CH4+10OH--8e-=+7H2O;
(2)f电极连接电源的负极作阴极,得到电子发生还原反应,由于得到电子能力:H+>Na+,故f电极反应式为:2H++2e-=H2↑。H+放电,使附近水的电离平衡正向移动,因而水电离受到促进作用,最终达到平衡后溶液中c(OH-)>c(H+),电极附近溶液显碱性,向此电极区域滴入酚酞,溶液变红色;
(3)丙装置为电解Na2SO4溶液,该物质是强酸强碱盐,不水解,溶液显中性,用惰性电极电解Na2SO4溶液相当于电解水,电解后电解质溶液pH不变;
(4) 标准状况下22.4 L CH4的物质的量为1 mol,根据CH4+10OH--8e-=+7H2O可知,反应过程转移的电子为8 mol,则丙装置中电解的水物质的量为4 mol,其质量m(H2O)=4 mol×18 g/mol=72 g,因此需要加入72 g水,可以将析出的沉淀溶解并恢复到原有浓度。
18.(1)C
(2)阳
(3)
(4)
(5) 阳极室 防止被还原,使产率降低 M点:小,稳定性差,且反应慢[或N点:过大,铁电极区有氢氧化铁生成,使产率降低
【分析】太阳能电池将太阳能转化为电能,装置x为电解池,电解水生成氢气和氧气;氢气和氧气通入原电池装置y中发生反应生成水。
(1)
太阳能电池的能量转化形式为光能转化为电能,C正确,故选C;
(2)
x为电解池,氧元素发生氧化反应生成氧气,产生O2的电极为阳极;
(3)
装置y为燃料电池,是原电池,若电解质溶液为硫酸,则正极为氧气发生还原反应,反应式为;
(4)
碱性氢氧燃料电池的负极为氢气发生氧化反应,反应式为;
(5)
①根据题意,镍电极有气泡产生是氢离子放电发生还原反应生成氢气,为阴极室;在铁电极发生反应为氧化反应,溶液中的氢氧根离子减少,为阳极室;因此电解—段时间后,降低的区域在阳极室;
②氢气具有还原性,根据题意只在强碱性条件下稳定,易被H2还原。电解过程中,须将阴极产生的气体及时排出,防止与H2反应使产率降低;
③根据题意只在强碱性条件下稳定,若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质;在M点,低,稳定性差,且反应慢,在N点:过高,铁电极上有氢氧化铁生成,使产率降低,故答案为:M点:低,稳定性差,且反应慢(或N点:过高,铁电极上有氢氧化铁生成,使产率降低)。
19.(1)正
(2)
【分析】实验i,K闭合时,指针偏移,说明形成了原电池,放置一段时间后,指针偏移减小;实验ii,向U形管左侧逐滴加入浓Fe2(SO4)3溶液,电流表指针的变化依次为偏移减小→回到0刻度→逆向偏移,实验ii左侧的电极反应为Fe3++e-=Fe2+;则实验i左侧的电极反应为Fe2+-e-=Fe3+。
(1)
根据分析,实验i左侧Fe2+失电子被氧化成Fe3+,则石墨电极为负极,银作正极;答案为:正。
(2)
实验i中,石墨电极电极反应为Fe2+-e-=Fe3+,银为正极,电极反应为Ag++e-=Ag;而实验ii向U形管左侧加入浓硫酸铁溶液,指针先回到0刻度,最终指针的偏移方向与实验i相反,可知发生的反应为可逆反应,反应的离子方程式为Fe2++Ag+Fe3++Ag;答案为:Fe2++Ag+Fe3++Ag。
答案第1页,共2页
答案第1页,共2页
