专题1第三单元金属的腐蚀与防护同步练习(含解析)2022-2023学年上学期高二化学苏教版(2019)选择性必修1
文档属性
| 名称 | 专题1第三单元金属的腐蚀与防护同步练习(含解析)2022-2023学年上学期高二化学苏教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 981.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-28 08:14:35 | ||
图片预览




文档简介
专题1第三单元金属的腐蚀与防护同步练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
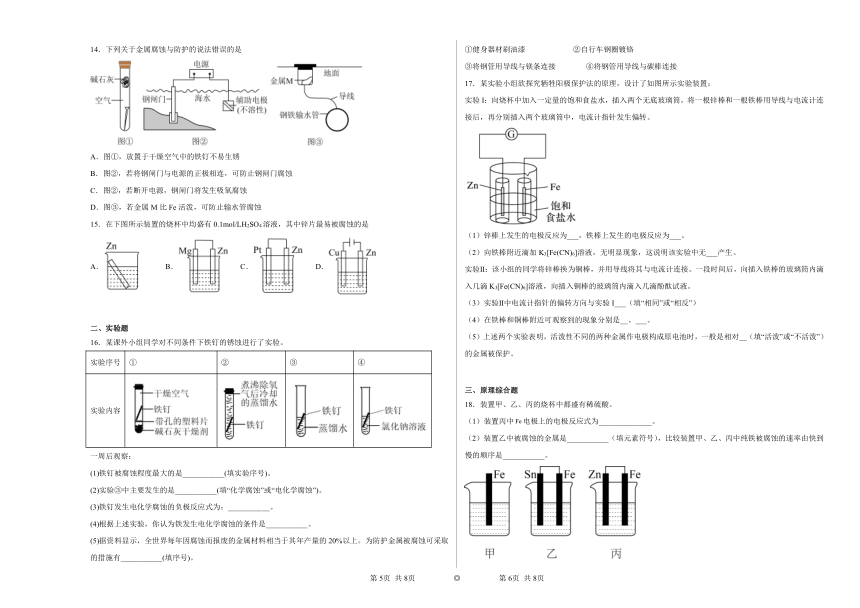
1.下列说法正确的是
A.金属腐蚀的本质就是金属原子失去电子被还原的过程
B.镀层破损后,白铁皮(镀锌铁)比马口铁(镀锡铁)更易腐蚀
C.钢铁水闸可用牺牲阳极法或外加电流法等方法防止其腐蚀
D.钢铁在发生析氢腐蚀和吸氧腐蚀时,负极发生的反应不相同
2.下列说法错误的是
A.在钢铁设备上安装若干镁合金块或锌块,可保护设备不被腐蚀
B.将钢闸门通过导线与直流电源的正极相连,保护闸门不被腐蚀
C.厨房中炒完菜的铁锅应及时清洗并擦干,防止发生电化学腐蚀
D.镀锌铁表面的镀层如发生破损,被腐蚀的仍然是镀层
3.港珠澳大桥设计寿命为120年,桥体钢构件防腐是使用过程中面临的重要问题,下列说法错误的是
A.海水的pH一般在8.0~8.5,则钢构件的腐蚀主要是析氢腐蚀
B.钢构件可采用不锈钢材料以减缓腐蚀
C.钢构件表面喷涂环氧树脂涂层,是为了隔绝空气、水等
D.后期采用牺牲阳极的阴极保护法时,可使用铝作为负极
4.文物的腐蚀是指出土前由于自然的侵蚀、损坏而破坏文物的原貌,电化学腐蚀也是重要因素之一。三星堆是中华文明的重要组成部分,下列出土文物可能涉及电化学腐蚀的是
A B C D
青铜神树 玉璋 陶瓷马头 黄金面罩
A.A B.B C.C D.D
5.利用如图装置可以模拟铁的电化学防护。下列说法不正确的是
A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀速率
B.若X为锌棒,开关K置于M处,铁的保护属于牺牲阳极的阴极保护法
C.若X为碳棒,开关K置于N处,铁的保护属于外接电流的阴极保护法
D.若X为碳棒,开关K置于N处,X极发生还原反应
6.铆有铁钉的铜板暴露在潮湿的空气中,一段时间后铁钉上有铁锈出现,其原理如图所示。下列说法错误的是
A.铁发生氧化反应
B.腐蚀过程中铜板上发生的反应为
C.铁锈的主要成分是
D.在铆有铁钉的铜板上刷一层油漆,可减缓腐蚀
7.“孔蚀”是一种集中于金属表面极小范围并能深入到金属内部的电化学腐蚀。某铁合金表面钝化膜破损后,发生“孔蚀”的电化学腐蚀过程如题图所示。下列有关说法正确的是
A.负极反应:Fe-3e-=Fe3+
B.氧化0.2 mol Fe,需消耗3.36 LO2
C.铁合金腐蚀的最终产物为Fe(OH)3
D.为防止孔蚀发生可以将外接电源负极与金属相连
8.常用电化学方法对支撑海港码头基础的钢管桩进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述错误的是
A.采用的电化学方法是外加电流的阴极保护法
B.通电后外电路电子被强制从负极流向钢管桩
C.高硅铸铁的作用是作为辅助阳极材料被损耗
D.通电后阳极上发生氧化反应,电子流向正极
9.下列试管所盛的溶液中的铁腐蚀速度说法正确的是
A.①比②慢 B.③比④快 C.⑤比⑥快 D.①比③慢
10.下列四个装置中都用到了金属铜,下列有关说法正确的是
A.用图甲装置可在铁件上镀铜
B.用图乙装置可证明活泼性:
C.用图丙装置可实现牺牲Cu电极保护钢铁设施
D.用图丁装置可实现化学能向电能的转化,且C极的电极反应式是
11.用如图所示装置及试剂进行铁的电化学腐蚀实验探究,测定具支锥形瓶中压强随时间变化关系以及溶解氧随时间变化关系的曲线如下。下列说法不正确的是
A.pH=2.0时,体系为强酸性,正极只发生析氢腐蚀,电极方程式为:2H++2e-=H2↑
B.压强增大主要是因为产生了H2
C.整个过程中,负极电极反应式均为:Fe–2e-=Fe2+
D.pH=4.0时,体系为弱酸性,同时发生析氢腐蚀和吸氧腐蚀
12.利用如图装置模拟铁的电化学防护。下列说法正确的是
A.若X为碳棒,为减缓铁的腐蚀,开关K应置于M处
B.若X为碳棒,为减缓铁的腐蚀,开关K置于N处,对铁不能起到防护作用
C.若X为锌,开关K置于M处,该电化学防护法称为牺牲阳极的阴极保护法
D.若X为锌,开关K置于N处,对铁不能起到防护作用
13.下列电化学装置完全正确的是
A.图甲粗铜精炼 B.图乙铜锌原电池
C.图丙防止铁被腐蚀 D.图丁铁件镀银
14.下列关于金属腐蚀与防护的说法错误的是
A.图①,放置于干燥空气中的铁钉不易生锈
B.图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀
C.图②,若断开电源,钢闸门将发生吸氧腐蚀
D.图③,若金属M比Fe活泼,可防止输水管腐蚀
15.在下图所示装置的烧杯中均盛有0.1mol/LH2SO4溶液,其中锌片最易被腐蚀的是
A. B. C. D.
二、实验题
16.某课外小组同学对不同条件下铁钉的锈蚀进行了实验。
实验序号 ① ② ③ ④
实验内容
一周后观察:
(1)铁钉被腐蚀程度最大的是___________(填实验序号)。
(2)实验③中主要发生的是___________(填“化学腐蚀”或“电化学腐蚀”)。
(3)铁钉发生电化学腐蚀的负极反应式为:___________。
(4)根据上述实验,你认为铁发生电化学腐蚀的条件是___________。
(5)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上。为防护金属被腐蚀可采取的措施有___________(填序号)。
①健身器材刷油漆 ②自行车钢圈镀铬
③将钢管用导线与镁条连接 ④将钢管用导线与碳棒连接
17.某实验小组欲探究牺牲阳极保护法的原理,设计了如图所示实验装置:
实验I:向烧杯中加入一定量的饱和食盐水,插入两个无底玻璃筒。将一根锌棒和一根铁棒用导线与电流计连接后,再分别插入两个玻璃筒中,电流计指针发生偏转。
(1)锌棒上发生的电极反应为___,铁棒上发生的电极反应为___。
(2)向铁棒附近滴加K3[Fe(CN)6]溶液,无明显现象,这说明该实验中无___产生。
实验Ⅱ:该小组的同学将锌棒换为铜棒,并用导线将其与电流计连接。一段时间后,向插入铁棒的玻璃筒内滴入几滴K3[Fe(CN)6]溶液,向插入铜棒的玻璃筒内滴入几滴酚酞试液。
(3)实验Ⅱ中电流计指针的偏转方向与实验I___(填“相同”或“相反”)
(4)在铁棒和铜棒附近可观察到的现象分别是__、___。
(5)上述两个实验表明,活泼性不同的两种金属作电极构成原电池时,一般是相对__(填“活泼”或“不活泼”)的金属被保护。
三、原理综合题
18.装置甲、乙、丙的烧杯中都盛有稀硫酸。
(1)装置丙中电极上的电极反应式为______________。
(2)装置乙中被腐蚀的金属是___________(填元素符号),比较装置甲、乙、丙中纯铁被腐蚀的速率由快到慢的顺序是___________。
(3)图丁是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化学腐蚀的类型为__________腐蚀。
②图中A、B、C三处附近的区域内,腐蚀最严重的是__________(填序号)。
19.垃圾是放错了位置的资源。郑州市从2019年12月1日起开始实施垃圾分类。垃圾主要分为可回收垃圾、有害垃圾、厨余垃圾和其他垃圾四类。
A B C D
(1)小明在整理房间时,清理出如下物品:废作业本、镍镉电池、汽水易拉罐、生锈铁钉、矿泉水瓶、烂苹果、涂改液瓶、过期药片。其中镍镉电池和汽水易拉罐分别投入___和___垃圾桶中(填“A”、“B”、“C”、“D”)。
(2)生锈铁钉属于可回收垃圾。铁生锈的实质是铁失去电子被氧化。为探究金属的腐蚀条件,小明同学做了以下五个对照实验。
实验1 实验2 实验3 实验4 实验5
8小时未观察到明显锈蚀 8小时未观察到明显锈蚀 8小时未观察到明显锈蚀 8小时未观察到明显锈蚀 1小时观察到明显锈蚀
由以上实验可知,金属腐蚀的条件是___。请用电极反应式表示实验5得电子的反应过程___。
(3)防止金属腐蚀的方法有电化学防护、添加保护层等多种方法。如图装置,可以模拟铁的电化学防护。
若模拟外加电流的阴极保护法,电极材料X可为碳棒,并将开关K置于N处;若模拟牺牲阳极的阴极保护法,电极材料X及相关操作为___。
(4)镀铜可防止铁制品腐蚀,请在下方方框内画出在铁制品上镀铜的实验装置示意图___。
(5)金属阳极钝化是一种电化学防腐方法。将Fe作阳极置于一定浓度的H2SO4溶液中,一定条件下Fe钝化形成致密的Fe3O4氧化膜,请写出该阳极的电极反应式___。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【详解】A.金属腐蚀的本质就是金属原子失去电子被氧化的过程,A错误;
B.铁制品的镀层破损后,在潮湿环境中可发生原电池反应,白铁皮(镀锌铁)中锌比铁活泼,反应时锌作负极,被氧化而腐蚀,铁作正极,被保护;马口铁(镀锡铁)中铁比锡活泼,铁作负极,被氧化而腐蚀,B错误;
C.金属的电化学防护方法通常有牺牲阳极法或外加电流法,钢铁水闸可用此等方法防止其腐蚀,C正确;
D.钢铁在发生析氢腐蚀和吸气腐蚀时,负极均是铁失去电子生成亚铁离子,D错误;
故选C。
2.B
【详解】A.在钢铁设备上安装若干镁合金或锌块,镁合金或锌块作原电池负极的金属加速被腐蚀,钢铁设备作正极的金属被保护,故A正确;
B.将钢闸门通过导线与直流电源的正极相连,钢闸门作阳极,加速了腐蚀,故B错误;
C.钢铁在有电解质溶液的环境中易发生电化学腐蚀,炒过菜的铁锅含有电解质溶液,不及时清洗会发生电化学腐蚀,故C正确;
D.Fe与Zn形成原电池时Fe作正极被保护,所以镀锌铁的镀层破损后,镀层仍然对铁起保护作用,故D正确;
故选B。
3.A
【详解】A.海水的pH一般在8.0~8.5,碱性条件下钢构件的腐蚀主要是吸氧腐蚀,A项错误;
B.通过改变钢构件材料的组成,可以减缓腐蚀速率,B项正确;
C.在钢构件表面喷涂环氧树脂涂层,可以防止钢构件与空气、水接触,C项正确;
D.铝与钢铁连接时,铝作原电池的负极,更容易被氧化,对桥体钢构件起到保护作用,D项正确;
故选A。
4.A
【分析】电化学腐蚀就是金属和电解质组成两个电极,所以需含有两种金属,据此分析解题。
【详解】A.青铜神树中含有Sn和Cu,可能涉及电化学腐蚀,故A符合题意;
B.玉璋属于玉器,主要成分为无机物,不涉及电化学腐蚀,故B不符合题意;
C.陶瓷马头以粘土为主要原料制成,不涉及电化学腐蚀,故C不符合题意;
D.黄金面罩由黄金制成,只含有金,不涉及电化学腐蚀,故D不符合题意;
故答案选A。
5.D
【详解】A.开关K置于M处,形成铁锌原电池,X为锌棒,为负极,铁为正极,可减缓铁的腐蚀速率,A正确;
B.开关K置于M处,形成铁锌原电池,X为锌棒,较活泼,为负极,铁为正极,利用牺牲阳极的阴极保护法保护铁,B正确;
C.开关K置于N处,形成电解池,铁接电源的负极形成电解池的阴极被保护,属于外接电流的阴极保护法,C正确;
D.开关K置于N处,X极接电源的正极,形成电解池的阳极,发生氧化反应,D错误;
故选D。
6.C
【分析】铆有铁钉的铜板暴露在潮湿的空气中,形成原电池,铁为负极,失电子被氧化。
【详解】A.由图可知,Fe失电子,化合价升高,被氧化,选项A正确;
B.腐蚀过程中,铁钉作负极,铜板作正极,正极上发生还原反应,电极反应式为,选项B正确;
C.铁锈的主要成分是,选项C错误;
D.在铆有铁钉的铜板上刷一层油漆,可隔绝空气和水,减缓腐蚀,选项D正确;
答案选C。
7.D
【分析】在Fe原电池反应引起的腐蚀中,Fe为负极,失去电子发生氧化反应产生Fe2+,电极反应式为Fe-2e-=Fe2+;在合金中另外一种金属上溶解的O2得到电子发生还原反应产生OH-,Fe2+与OH-结合生成Fe(OH)2,Fe(OH)2再被氧化产生Fe(OH)3,Fe(OH)3部分失去水分变为铁锈Fe2O3 xH2O。
【详解】A.Fe易失电子作负极,另外的金属电极为正极,负极上Fe失电子生成Fe2+,则电极反应式为Fe-2e-=Fe2+,A错误;
B.温度和压强未知,气体摩尔体积无法确定,所以无法计算氧气的物质的量,B错误;
C.铁合金腐蚀时先生成Fe2+,Fe2+和OH-反应生成Fe(OH)2,Fe(OH)2再被氧化生成Fe(OH)3,Fe(OH)3脱去一部分水生成Fe2O3 xH2O,所以最终产物为Fe2O3 xH2O,C错误;
D.为防止孔蚀发生,可以将被保护的金属作电解池阴极,所以应该将金属连接原电池的负极,D正确;
故合理选项是D。
8.C
【详解】A.此防护为外加电流的防护,将被保护金属与电源的负极相连,作电解池的阴极,所以该电化学方法是外加电流的阴极保护法,A正确;
B.通电后,外电路电子被强制从负极流向钢管桩、从阳极材料流向电源正极,B正确;
C.高硅铸铁为惰性辅助阳极,所以其作用是提供海水中的阴离子在其表面失电子的场所,本身不失电子,不被损耗,C错误;
D.通电后,在阳极上阴离子失电子,发生氧化反应,电子由阳极材料流向电源正极,D正确;
故选C。
9.C
【详解】A.②中是干燥、相对无氧环境,故不容易发生腐蚀,则①比②快,A错误;
B.③中是无氧环境,故不容易发生腐蚀,则③比④慢,B错误;
C.⑤中铁与铜丝构成原电池、铁为负极被氧化而腐蚀,⑥中铁与锌构成原电池、锌为负极被氧化而腐蚀、铁为正极被保护,则⑤比⑥快,C正确;
D.③中是无氧环境,故不容易发生腐蚀,则①比③快,D错误;
答案选C。
10.D
【详解】A.在铁件上镀铜,铁件作阴极、铜棒作阳极,故A错误;
B.铝在浓硝酸中钝化,图乙装置,Cu是负极、Al是正极,不能证明活泼性:,故B错误;
C.铁的活泼型大于铜,铜、铁构成原电池,铁为负极,图丙装置不能牺牲Cu电极保护钢铁,故C错误;
D.铜和Fe3+反应生成Cu2+、Fe2+,图丁装置构成原电池,可实现化学能向电能的转化, Cu是负极、C极是正极,正极的电极反应式是,故D正确;
选D。
11.A
【分析】Fe在酸性环境下会发生析氢腐蚀,产生氢气,会导致锥形瓶内压强增大;若介质的酸性很弱或呈中性,并且有氧气参与,此时Fe就会发生吸氧腐蚀,吸收氧气,会导致锥形瓶内压强减小,据此分析解答。
【详解】A.由图可知,pH=2.0时,锥形瓶内的溶解氧减少,说明有消耗氧气的吸氧腐蚀发生,同时锥形瓶内的气压增大,说明有产生氢气的析氢腐蚀发生;因此既发生析氢腐蚀,又发生吸氧腐蚀,正极电极反应式为:2H++2e-=H2↑和O2+4H++4e-=2H2O,A错误;
B.pH=2.0的溶液,酸性较强,因此锥形瓶中的Fe粉能发生析氢腐蚀,析氢腐蚀产生氢气,因此会导致锥形瓶内压强增大,B正确;
C.整个过程中,锥形瓶中的Fe粉和C粉构成了原电池,Fe粉作为原电池的负极,发生的电极反应式为:Fe-2e-=Fe2+,C正确;
D.若pH=4.0时只发生吸氧腐蚀,那么锥形瓶内的气体压强会有下降,而图中pH=4.0时,锥形瓶内的压强几乎不变,说明图中反应除了吸氧腐蚀,Fe粉还发生了析氢腐蚀,消耗氧气的同时也产生了氢气,因此锥形瓶内压强几乎不变,D正确;
故合理选项是A。
12.C
【详解】A.若X为碳棒,开关K置于M处,构成原电池,铁作负极,加快了铁的腐蚀,A项错误;
B.若X为碳棒,开关K置于N处,形成电解池,此时金属铁为阴极,铁被保护,为外加电源的阴极保护法,可减缓铁的腐蚀,B项错误;
C.若X为锌,开关K置于M处,构成原电池,锌作负极,铁作正极,该电化学防护法称为牺牲阳极的阴极保护法,C项正确;
D.若X为锌,开关K置于N处,构成电解池,锌作阳极,铁作阴极,可以减缓铁的腐蚀,D项错误;
故选C。
13.C
【详解】A.图甲粗铜精炼,粗铜应该作阳极,纯铜作阴极,故A错误;
B.图乙铜锌原电池,锌电极下面应该是硫酸锌溶液,铜电极下面应该是硫酸铜溶液,故B错误;
C.图丙防止铁被腐蚀,该方法是外加电流的阴极保护法,要保护的金属作电解池的阴极,故C正确;
D.图丁铁件镀银,镀件(Fe)作阴极,镀层金属(Ag)做阳极,故D错误。
综上所述,答案为C。
14.B
【详解】A.潮湿空气中铁钉能发生吸氧腐蚀;干燥空气中无水,不能发生吸氧腐蚀,铁钉不易生锈,A错误;
B.将钢铁闸门与电源的负极相连,可防止钢闸门腐蚀,防腐蚀原理为外加电源的阴极保护法,B正确;
C.断开电源后,该装置为原电池装置,铁钉作负极,失电子被氧化,在海水中发生吸氧腐蚀,C错误;
D.若金属M比铁活泼,将M与铁相连,为牺牲阳极的阴极保护法,可保护铁,D错误;
故选B。
15.C
【详解】金属腐蚀快慢顺序为电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阴极,A中锌发生化学腐蚀,B中锌作正极被镁保护,C中锌作负极加速被腐蚀,D中锌作阴极被保护,所以锌片最易被腐蚀的是C;答案为C。
16.(1)④
(2)电化学腐蚀
(3)Fe-2e-=Fe2+
(4)铁接触空气和电解质溶液(铁与潮湿空气接触)
(5)①②③
【详解】(1)①在干燥空气中难以腐蚀,②隔绝空气也难以腐蚀,③④发生电化学腐蚀,但④中电解质溶液离子浓度大,导电性强,电化学腐蚀速率快,故答案为:④;
(2)③中蒸馏水溶解氧气,能发生电化学腐蚀,故答案为:电化学腐蚀;
(3)反应中铁是负极,发生氧化反应,生成Fe2+,故答案为:Fe-2e-=Fe2+;
(4)电化学腐蚀发生了原电池反应,从原电池的形成条件来判断:有两个活泼性不同的电极、电解质溶液、闭合回路,金属腐蚀时还要有空气,故答案为:铁接触空气和电解质溶液(铁与潮湿空气接触);
(5)本题中①②为外加防护膜的保护法,可以隔绝空气,③中金属镁比铁活泼,属于牺牲阳极的阴极保护法(可理解为牺牲负极的正极保护法),④中加快了金属的腐蚀,故答案为:①②③。
17. Zn-2e-=Zn2+ 2H2O+O2+4e-=4OH- Fe2+ 相反 产生蓝色沉淀 溶液变红色 不活泼
【分析】实验I:锌、铁、氯化钠溶液构成原电池时,发生的是吸氧腐蚀,锌作负极被腐蚀,铁作正极被保护;
实验Ⅱ:铜、铁、氯化钠溶液构成原电池时,发生的也是吸氧腐蚀,铜作正极被保护,铁作负极被腐蚀;
由于两次实验中原电池的电子流向相反,所以电流计指针的偏转方向也相反,依此解答。
【详解】(1)实验I锌作负极被腐蚀,负极的电极反应式为:Zn-2e-=Zn2+;铁作正极被保护,氧气在正极参与反应,电极反应式为:2H2O+O2+4e-=4OH-;
(2)Fe失去电子生成,可与反应生成蓝色沉淀,该实验中无明显现象,则说明溶液中无生成;
(3)由于两次实验中原电池的电子流向相反,所以电流计指针的偏转方向也相反;
(4)铁作负极,Fe失去电子生成,可与反应生成蓝色沉淀;铜作正极,电极反应式为,故滴有几滴酚酞试液的铜棒附近溶液变红色;
(5)对比两个实验可知,一般情况下,活泼性不同的两种金属作电极构成原电池时,活泼金属被腐蚀,不活泼金属被保护。
18. 乙>甲>丙 吸氧 B
【详解】(1)装置丙构成了原电池,由于金属活动性:,所以为正极,在正极上得电子生成,电极反应式为。
(2)装置乙构成了原电池,由于金属活动性:,所以装置乙中被腐蚀的金属是金属活动性较强的;装置甲中与稀硫酸直接发生反应,装置乙构成原电池,被腐蚀的是,腐蚀速率比甲快;装置丙构成原电池,被腐蚀的是得到了保护,所以装置甲、乙、丙中纯铁被腐蚀的速率由快到慢的顺序是乙>甲>丙。
(3)①钢铁在海水中发生的是吸氧腐蚀;②A处不与海水接触,在海水中B处的氧气浓度比C处大,发生的吸氧腐蚀速率最快,腐蚀最严重。
【点睛】金属腐蚀类试题最常见的错误原因是弄不清腐蚀原理,一是分析不清楚金属腐蚀是属于化学腐蚀还是电化学腐蚀;二是判断不出该腐蚀是属于析氢腐蚀还是吸氧腐蚀。金属腐蚀的原理是金属单质失电子被氧化的过程,其中化学腐蚀是指金属和直接接触的物质发生化学反应而引起的腐蚀,其腐蚀过程中没有电流产生;电化学腐蚀指不纯金属或合金在电解质溶液中发生原电池反应,电化学腐蚀过程中有电流产生,电化学腐蚀比化学腐蚀更为普遍。不纯金属在强酸性介质中通常发生析氢腐蚀,在中性、弱酸性和碱性介质中均发生吸氧腐蚀。
19. B A 有氧气和电解质溶液 O2+2H2O+4e-=4OH- 电极材料X可为锌棒,并将开关K置于M处 3Fe-8e-+4H2O=Fe3O4+8H+
【详解】(1)其中镍镉电池和汽水易拉罐分别属于有害垃圾和可回收垃圾,分别投入B和A垃圾桶中。
(2)从图中对比可知金属腐蚀的条件是有氧气和电解质溶液,5得电子的反应过程O2+2H2O+4e-=4OH-。
(3)若模拟外加电流的阴极保护法,电极材料X可为碳棒,并将开关K置于N处;若模拟牺牲阳极的阴极保护法,电极材料X可为锌棒,并将开关K置于M处 。
(4)在铁制品上镀铜时铁制品作阴极,铜作阳极,硫酸铜作电解质,则实验装置示意图为。
(5)将Fe作阳极置于一定浓度的H2SO4溶液中,一定条件下Fe钝化形成致密的Fe3O4氧化膜,阳极的电极反应式3Fe-8e-+4H2O=Fe3O4+8H+。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列说法正确的是
A.金属腐蚀的本质就是金属原子失去电子被还原的过程
B.镀层破损后,白铁皮(镀锌铁)比马口铁(镀锡铁)更易腐蚀
C.钢铁水闸可用牺牲阳极法或外加电流法等方法防止其腐蚀
D.钢铁在发生析氢腐蚀和吸氧腐蚀时,负极发生的反应不相同
2.下列说法错误的是
A.在钢铁设备上安装若干镁合金块或锌块,可保护设备不被腐蚀
B.将钢闸门通过导线与直流电源的正极相连,保护闸门不被腐蚀
C.厨房中炒完菜的铁锅应及时清洗并擦干,防止发生电化学腐蚀
D.镀锌铁表面的镀层如发生破损,被腐蚀的仍然是镀层
3.港珠澳大桥设计寿命为120年,桥体钢构件防腐是使用过程中面临的重要问题,下列说法错误的是
A.海水的pH一般在8.0~8.5,则钢构件的腐蚀主要是析氢腐蚀
B.钢构件可采用不锈钢材料以减缓腐蚀
C.钢构件表面喷涂环氧树脂涂层,是为了隔绝空气、水等
D.后期采用牺牲阳极的阴极保护法时,可使用铝作为负极
4.文物的腐蚀是指出土前由于自然的侵蚀、损坏而破坏文物的原貌,电化学腐蚀也是重要因素之一。三星堆是中华文明的重要组成部分,下列出土文物可能涉及电化学腐蚀的是
A B C D
青铜神树 玉璋 陶瓷马头 黄金面罩
A.A B.B C.C D.D
5.利用如图装置可以模拟铁的电化学防护。下列说法不正确的是
A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀速率
B.若X为锌棒,开关K置于M处,铁的保护属于牺牲阳极的阴极保护法
C.若X为碳棒,开关K置于N处,铁的保护属于外接电流的阴极保护法
D.若X为碳棒,开关K置于N处,X极发生还原反应
6.铆有铁钉的铜板暴露在潮湿的空气中,一段时间后铁钉上有铁锈出现,其原理如图所示。下列说法错误的是
A.铁发生氧化反应
B.腐蚀过程中铜板上发生的反应为
C.铁锈的主要成分是
D.在铆有铁钉的铜板上刷一层油漆,可减缓腐蚀
7.“孔蚀”是一种集中于金属表面极小范围并能深入到金属内部的电化学腐蚀。某铁合金表面钝化膜破损后,发生“孔蚀”的电化学腐蚀过程如题图所示。下列有关说法正确的是
A.负极反应:Fe-3e-=Fe3+
B.氧化0.2 mol Fe,需消耗3.36 LO2
C.铁合金腐蚀的最终产物为Fe(OH)3
D.为防止孔蚀发生可以将外接电源负极与金属相连
8.常用电化学方法对支撑海港码头基础的钢管桩进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述错误的是
A.采用的电化学方法是外加电流的阴极保护法
B.通电后外电路电子被强制从负极流向钢管桩
C.高硅铸铁的作用是作为辅助阳极材料被损耗
D.通电后阳极上发生氧化反应,电子流向正极
9.下列试管所盛的溶液中的铁腐蚀速度说法正确的是
A.①比②慢 B.③比④快 C.⑤比⑥快 D.①比③慢
10.下列四个装置中都用到了金属铜,下列有关说法正确的是
A.用图甲装置可在铁件上镀铜
B.用图乙装置可证明活泼性:
C.用图丙装置可实现牺牲Cu电极保护钢铁设施
D.用图丁装置可实现化学能向电能的转化,且C极的电极反应式是
11.用如图所示装置及试剂进行铁的电化学腐蚀实验探究,测定具支锥形瓶中压强随时间变化关系以及溶解氧随时间变化关系的曲线如下。下列说法不正确的是
A.pH=2.0时,体系为强酸性,正极只发生析氢腐蚀,电极方程式为:2H++2e-=H2↑
B.压强增大主要是因为产生了H2
C.整个过程中,负极电极反应式均为:Fe–2e-=Fe2+
D.pH=4.0时,体系为弱酸性,同时发生析氢腐蚀和吸氧腐蚀
12.利用如图装置模拟铁的电化学防护。下列说法正确的是
A.若X为碳棒,为减缓铁的腐蚀,开关K应置于M处
B.若X为碳棒,为减缓铁的腐蚀,开关K置于N处,对铁不能起到防护作用
C.若X为锌,开关K置于M处,该电化学防护法称为牺牲阳极的阴极保护法
D.若X为锌,开关K置于N处,对铁不能起到防护作用
13.下列电化学装置完全正确的是
A.图甲粗铜精炼 B.图乙铜锌原电池
C.图丙防止铁被腐蚀 D.图丁铁件镀银
14.下列关于金属腐蚀与防护的说法错误的是
A.图①,放置于干燥空气中的铁钉不易生锈
B.图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀
C.图②,若断开电源,钢闸门将发生吸氧腐蚀
D.图③,若金属M比Fe活泼,可防止输水管腐蚀
15.在下图所示装置的烧杯中均盛有0.1mol/LH2SO4溶液,其中锌片最易被腐蚀的是
A. B. C. D.
二、实验题
16.某课外小组同学对不同条件下铁钉的锈蚀进行了实验。
实验序号 ① ② ③ ④
实验内容
一周后观察:
(1)铁钉被腐蚀程度最大的是___________(填实验序号)。
(2)实验③中主要发生的是___________(填“化学腐蚀”或“电化学腐蚀”)。
(3)铁钉发生电化学腐蚀的负极反应式为:___________。
(4)根据上述实验,你认为铁发生电化学腐蚀的条件是___________。
(5)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上。为防护金属被腐蚀可采取的措施有___________(填序号)。
①健身器材刷油漆 ②自行车钢圈镀铬
③将钢管用导线与镁条连接 ④将钢管用导线与碳棒连接
17.某实验小组欲探究牺牲阳极保护法的原理,设计了如图所示实验装置:
实验I:向烧杯中加入一定量的饱和食盐水,插入两个无底玻璃筒。将一根锌棒和一根铁棒用导线与电流计连接后,再分别插入两个玻璃筒中,电流计指针发生偏转。
(1)锌棒上发生的电极反应为___,铁棒上发生的电极反应为___。
(2)向铁棒附近滴加K3[Fe(CN)6]溶液,无明显现象,这说明该实验中无___产生。
实验Ⅱ:该小组的同学将锌棒换为铜棒,并用导线将其与电流计连接。一段时间后,向插入铁棒的玻璃筒内滴入几滴K3[Fe(CN)6]溶液,向插入铜棒的玻璃筒内滴入几滴酚酞试液。
(3)实验Ⅱ中电流计指针的偏转方向与实验I___(填“相同”或“相反”)
(4)在铁棒和铜棒附近可观察到的现象分别是__、___。
(5)上述两个实验表明,活泼性不同的两种金属作电极构成原电池时,一般是相对__(填“活泼”或“不活泼”)的金属被保护。
三、原理综合题
18.装置甲、乙、丙的烧杯中都盛有稀硫酸。
(1)装置丙中电极上的电极反应式为______________。
(2)装置乙中被腐蚀的金属是___________(填元素符号),比较装置甲、乙、丙中纯铁被腐蚀的速率由快到慢的顺序是___________。
(3)图丁是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化学腐蚀的类型为__________腐蚀。
②图中A、B、C三处附近的区域内,腐蚀最严重的是__________(填序号)。
19.垃圾是放错了位置的资源。郑州市从2019年12月1日起开始实施垃圾分类。垃圾主要分为可回收垃圾、有害垃圾、厨余垃圾和其他垃圾四类。
A B C D
(1)小明在整理房间时,清理出如下物品:废作业本、镍镉电池、汽水易拉罐、生锈铁钉、矿泉水瓶、烂苹果、涂改液瓶、过期药片。其中镍镉电池和汽水易拉罐分别投入___和___垃圾桶中(填“A”、“B”、“C”、“D”)。
(2)生锈铁钉属于可回收垃圾。铁生锈的实质是铁失去电子被氧化。为探究金属的腐蚀条件,小明同学做了以下五个对照实验。
实验1 实验2 实验3 实验4 实验5
8小时未观察到明显锈蚀 8小时未观察到明显锈蚀 8小时未观察到明显锈蚀 8小时未观察到明显锈蚀 1小时观察到明显锈蚀
由以上实验可知,金属腐蚀的条件是___。请用电极反应式表示实验5得电子的反应过程___。
(3)防止金属腐蚀的方法有电化学防护、添加保护层等多种方法。如图装置,可以模拟铁的电化学防护。
若模拟外加电流的阴极保护法,电极材料X可为碳棒,并将开关K置于N处;若模拟牺牲阳极的阴极保护法,电极材料X及相关操作为___。
(4)镀铜可防止铁制品腐蚀,请在下方方框内画出在铁制品上镀铜的实验装置示意图___。
(5)金属阳极钝化是一种电化学防腐方法。将Fe作阳极置于一定浓度的H2SO4溶液中,一定条件下Fe钝化形成致密的Fe3O4氧化膜,请写出该阳极的电极反应式___。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【详解】A.金属腐蚀的本质就是金属原子失去电子被氧化的过程,A错误;
B.铁制品的镀层破损后,在潮湿环境中可发生原电池反应,白铁皮(镀锌铁)中锌比铁活泼,反应时锌作负极,被氧化而腐蚀,铁作正极,被保护;马口铁(镀锡铁)中铁比锡活泼,铁作负极,被氧化而腐蚀,B错误;
C.金属的电化学防护方法通常有牺牲阳极法或外加电流法,钢铁水闸可用此等方法防止其腐蚀,C正确;
D.钢铁在发生析氢腐蚀和吸气腐蚀时,负极均是铁失去电子生成亚铁离子,D错误;
故选C。
2.B
【详解】A.在钢铁设备上安装若干镁合金或锌块,镁合金或锌块作原电池负极的金属加速被腐蚀,钢铁设备作正极的金属被保护,故A正确;
B.将钢闸门通过导线与直流电源的正极相连,钢闸门作阳极,加速了腐蚀,故B错误;
C.钢铁在有电解质溶液的环境中易发生电化学腐蚀,炒过菜的铁锅含有电解质溶液,不及时清洗会发生电化学腐蚀,故C正确;
D.Fe与Zn形成原电池时Fe作正极被保护,所以镀锌铁的镀层破损后,镀层仍然对铁起保护作用,故D正确;
故选B。
3.A
【详解】A.海水的pH一般在8.0~8.5,碱性条件下钢构件的腐蚀主要是吸氧腐蚀,A项错误;
B.通过改变钢构件材料的组成,可以减缓腐蚀速率,B项正确;
C.在钢构件表面喷涂环氧树脂涂层,可以防止钢构件与空气、水接触,C项正确;
D.铝与钢铁连接时,铝作原电池的负极,更容易被氧化,对桥体钢构件起到保护作用,D项正确;
故选A。
4.A
【分析】电化学腐蚀就是金属和电解质组成两个电极,所以需含有两种金属,据此分析解题。
【详解】A.青铜神树中含有Sn和Cu,可能涉及电化学腐蚀,故A符合题意;
B.玉璋属于玉器,主要成分为无机物,不涉及电化学腐蚀,故B不符合题意;
C.陶瓷马头以粘土为主要原料制成,不涉及电化学腐蚀,故C不符合题意;
D.黄金面罩由黄金制成,只含有金,不涉及电化学腐蚀,故D不符合题意;
故答案选A。
5.D
【详解】A.开关K置于M处,形成铁锌原电池,X为锌棒,为负极,铁为正极,可减缓铁的腐蚀速率,A正确;
B.开关K置于M处,形成铁锌原电池,X为锌棒,较活泼,为负极,铁为正极,利用牺牲阳极的阴极保护法保护铁,B正确;
C.开关K置于N处,形成电解池,铁接电源的负极形成电解池的阴极被保护,属于外接电流的阴极保护法,C正确;
D.开关K置于N处,X极接电源的正极,形成电解池的阳极,发生氧化反应,D错误;
故选D。
6.C
【分析】铆有铁钉的铜板暴露在潮湿的空气中,形成原电池,铁为负极,失电子被氧化。
【详解】A.由图可知,Fe失电子,化合价升高,被氧化,选项A正确;
B.腐蚀过程中,铁钉作负极,铜板作正极,正极上发生还原反应,电极反应式为,选项B正确;
C.铁锈的主要成分是,选项C错误;
D.在铆有铁钉的铜板上刷一层油漆,可隔绝空气和水,减缓腐蚀,选项D正确;
答案选C。
7.D
【分析】在Fe原电池反应引起的腐蚀中,Fe为负极,失去电子发生氧化反应产生Fe2+,电极反应式为Fe-2e-=Fe2+;在合金中另外一种金属上溶解的O2得到电子发生还原反应产生OH-,Fe2+与OH-结合生成Fe(OH)2,Fe(OH)2再被氧化产生Fe(OH)3,Fe(OH)3部分失去水分变为铁锈Fe2O3 xH2O。
【详解】A.Fe易失电子作负极,另外的金属电极为正极,负极上Fe失电子生成Fe2+,则电极反应式为Fe-2e-=Fe2+,A错误;
B.温度和压强未知,气体摩尔体积无法确定,所以无法计算氧气的物质的量,B错误;
C.铁合金腐蚀时先生成Fe2+,Fe2+和OH-反应生成Fe(OH)2,Fe(OH)2再被氧化生成Fe(OH)3,Fe(OH)3脱去一部分水生成Fe2O3 xH2O,所以最终产物为Fe2O3 xH2O,C错误;
D.为防止孔蚀发生,可以将被保护的金属作电解池阴极,所以应该将金属连接原电池的负极,D正确;
故合理选项是D。
8.C
【详解】A.此防护为外加电流的防护,将被保护金属与电源的负极相连,作电解池的阴极,所以该电化学方法是外加电流的阴极保护法,A正确;
B.通电后,外电路电子被强制从负极流向钢管桩、从阳极材料流向电源正极,B正确;
C.高硅铸铁为惰性辅助阳极,所以其作用是提供海水中的阴离子在其表面失电子的场所,本身不失电子,不被损耗,C错误;
D.通电后,在阳极上阴离子失电子,发生氧化反应,电子由阳极材料流向电源正极,D正确;
故选C。
9.C
【详解】A.②中是干燥、相对无氧环境,故不容易发生腐蚀,则①比②快,A错误;
B.③中是无氧环境,故不容易发生腐蚀,则③比④慢,B错误;
C.⑤中铁与铜丝构成原电池、铁为负极被氧化而腐蚀,⑥中铁与锌构成原电池、锌为负极被氧化而腐蚀、铁为正极被保护,则⑤比⑥快,C正确;
D.③中是无氧环境,故不容易发生腐蚀,则①比③快,D错误;
答案选C。
10.D
【详解】A.在铁件上镀铜,铁件作阴极、铜棒作阳极,故A错误;
B.铝在浓硝酸中钝化,图乙装置,Cu是负极、Al是正极,不能证明活泼性:,故B错误;
C.铁的活泼型大于铜,铜、铁构成原电池,铁为负极,图丙装置不能牺牲Cu电极保护钢铁,故C错误;
D.铜和Fe3+反应生成Cu2+、Fe2+,图丁装置构成原电池,可实现化学能向电能的转化, Cu是负极、C极是正极,正极的电极反应式是,故D正确;
选D。
11.A
【分析】Fe在酸性环境下会发生析氢腐蚀,产生氢气,会导致锥形瓶内压强增大;若介质的酸性很弱或呈中性,并且有氧气参与,此时Fe就会发生吸氧腐蚀,吸收氧气,会导致锥形瓶内压强减小,据此分析解答。
【详解】A.由图可知,pH=2.0时,锥形瓶内的溶解氧减少,说明有消耗氧气的吸氧腐蚀发生,同时锥形瓶内的气压增大,说明有产生氢气的析氢腐蚀发生;因此既发生析氢腐蚀,又发生吸氧腐蚀,正极电极反应式为:2H++2e-=H2↑和O2+4H++4e-=2H2O,A错误;
B.pH=2.0的溶液,酸性较强,因此锥形瓶中的Fe粉能发生析氢腐蚀,析氢腐蚀产生氢气,因此会导致锥形瓶内压强增大,B正确;
C.整个过程中,锥形瓶中的Fe粉和C粉构成了原电池,Fe粉作为原电池的负极,发生的电极反应式为:Fe-2e-=Fe2+,C正确;
D.若pH=4.0时只发生吸氧腐蚀,那么锥形瓶内的气体压强会有下降,而图中pH=4.0时,锥形瓶内的压强几乎不变,说明图中反应除了吸氧腐蚀,Fe粉还发生了析氢腐蚀,消耗氧气的同时也产生了氢气,因此锥形瓶内压强几乎不变,D正确;
故合理选项是A。
12.C
【详解】A.若X为碳棒,开关K置于M处,构成原电池,铁作负极,加快了铁的腐蚀,A项错误;
B.若X为碳棒,开关K置于N处,形成电解池,此时金属铁为阴极,铁被保护,为外加电源的阴极保护法,可减缓铁的腐蚀,B项错误;
C.若X为锌,开关K置于M处,构成原电池,锌作负极,铁作正极,该电化学防护法称为牺牲阳极的阴极保护法,C项正确;
D.若X为锌,开关K置于N处,构成电解池,锌作阳极,铁作阴极,可以减缓铁的腐蚀,D项错误;
故选C。
13.C
【详解】A.图甲粗铜精炼,粗铜应该作阳极,纯铜作阴极,故A错误;
B.图乙铜锌原电池,锌电极下面应该是硫酸锌溶液,铜电极下面应该是硫酸铜溶液,故B错误;
C.图丙防止铁被腐蚀,该方法是外加电流的阴极保护法,要保护的金属作电解池的阴极,故C正确;
D.图丁铁件镀银,镀件(Fe)作阴极,镀层金属(Ag)做阳极,故D错误。
综上所述,答案为C。
14.B
【详解】A.潮湿空气中铁钉能发生吸氧腐蚀;干燥空气中无水,不能发生吸氧腐蚀,铁钉不易生锈,A错误;
B.将钢铁闸门与电源的负极相连,可防止钢闸门腐蚀,防腐蚀原理为外加电源的阴极保护法,B正确;
C.断开电源后,该装置为原电池装置,铁钉作负极,失电子被氧化,在海水中发生吸氧腐蚀,C错误;
D.若金属M比铁活泼,将M与铁相连,为牺牲阳极的阴极保护法,可保护铁,D错误;
故选B。
15.C
【详解】金属腐蚀快慢顺序为电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阴极,A中锌发生化学腐蚀,B中锌作正极被镁保护,C中锌作负极加速被腐蚀,D中锌作阴极被保护,所以锌片最易被腐蚀的是C;答案为C。
16.(1)④
(2)电化学腐蚀
(3)Fe-2e-=Fe2+
(4)铁接触空气和电解质溶液(铁与潮湿空气接触)
(5)①②③
【详解】(1)①在干燥空气中难以腐蚀,②隔绝空气也难以腐蚀,③④发生电化学腐蚀,但④中电解质溶液离子浓度大,导电性强,电化学腐蚀速率快,故答案为:④;
(2)③中蒸馏水溶解氧气,能发生电化学腐蚀,故答案为:电化学腐蚀;
(3)反应中铁是负极,发生氧化反应,生成Fe2+,故答案为:Fe-2e-=Fe2+;
(4)电化学腐蚀发生了原电池反应,从原电池的形成条件来判断:有两个活泼性不同的电极、电解质溶液、闭合回路,金属腐蚀时还要有空气,故答案为:铁接触空气和电解质溶液(铁与潮湿空气接触);
(5)本题中①②为外加防护膜的保护法,可以隔绝空气,③中金属镁比铁活泼,属于牺牲阳极的阴极保护法(可理解为牺牲负极的正极保护法),④中加快了金属的腐蚀,故答案为:①②③。
17. Zn-2e-=Zn2+ 2H2O+O2+4e-=4OH- Fe2+ 相反 产生蓝色沉淀 溶液变红色 不活泼
【分析】实验I:锌、铁、氯化钠溶液构成原电池时,发生的是吸氧腐蚀,锌作负极被腐蚀,铁作正极被保护;
实验Ⅱ:铜、铁、氯化钠溶液构成原电池时,发生的也是吸氧腐蚀,铜作正极被保护,铁作负极被腐蚀;
由于两次实验中原电池的电子流向相反,所以电流计指针的偏转方向也相反,依此解答。
【详解】(1)实验I锌作负极被腐蚀,负极的电极反应式为:Zn-2e-=Zn2+;铁作正极被保护,氧气在正极参与反应,电极反应式为:2H2O+O2+4e-=4OH-;
(2)Fe失去电子生成,可与反应生成蓝色沉淀,该实验中无明显现象,则说明溶液中无生成;
(3)由于两次实验中原电池的电子流向相反,所以电流计指针的偏转方向也相反;
(4)铁作负极,Fe失去电子生成,可与反应生成蓝色沉淀;铜作正极,电极反应式为,故滴有几滴酚酞试液的铜棒附近溶液变红色;
(5)对比两个实验可知,一般情况下,活泼性不同的两种金属作电极构成原电池时,活泼金属被腐蚀,不活泼金属被保护。
18. 乙>甲>丙 吸氧 B
【详解】(1)装置丙构成了原电池,由于金属活动性:,所以为正极,在正极上得电子生成,电极反应式为。
(2)装置乙构成了原电池,由于金属活动性:,所以装置乙中被腐蚀的金属是金属活动性较强的;装置甲中与稀硫酸直接发生反应,装置乙构成原电池,被腐蚀的是,腐蚀速率比甲快;装置丙构成原电池,被腐蚀的是得到了保护,所以装置甲、乙、丙中纯铁被腐蚀的速率由快到慢的顺序是乙>甲>丙。
(3)①钢铁在海水中发生的是吸氧腐蚀;②A处不与海水接触,在海水中B处的氧气浓度比C处大,发生的吸氧腐蚀速率最快,腐蚀最严重。
【点睛】金属腐蚀类试题最常见的错误原因是弄不清腐蚀原理,一是分析不清楚金属腐蚀是属于化学腐蚀还是电化学腐蚀;二是判断不出该腐蚀是属于析氢腐蚀还是吸氧腐蚀。金属腐蚀的原理是金属单质失电子被氧化的过程,其中化学腐蚀是指金属和直接接触的物质发生化学反应而引起的腐蚀,其腐蚀过程中没有电流产生;电化学腐蚀指不纯金属或合金在电解质溶液中发生原电池反应,电化学腐蚀过程中有电流产生,电化学腐蚀比化学腐蚀更为普遍。不纯金属在强酸性介质中通常发生析氢腐蚀,在中性、弱酸性和碱性介质中均发生吸氧腐蚀。
19. B A 有氧气和电解质溶液 O2+2H2O+4e-=4OH- 电极材料X可为锌棒,并将开关K置于M处 3Fe-8e-+4H2O=Fe3O4+8H+
【详解】(1)其中镍镉电池和汽水易拉罐分别属于有害垃圾和可回收垃圾,分别投入B和A垃圾桶中。
(2)从图中对比可知金属腐蚀的条件是有氧气和电解质溶液,5得电子的反应过程O2+2H2O+4e-=4OH-。
(3)若模拟外加电流的阴极保护法,电极材料X可为碳棒,并将开关K置于N处;若模拟牺牲阳极的阴极保护法,电极材料X可为锌棒,并将开关K置于M处 。
(4)在铁制品上镀铜时铁制品作阴极,铜作阳极,硫酸铜作电解质,则实验装置示意图为。
(5)将Fe作阳极置于一定浓度的H2SO4溶液中,一定条件下Fe钝化形成致密的Fe3O4氧化膜,阳极的电极反应式3Fe-8e-+4H2O=Fe3O4+8H+。
答案第1页,共2页
答案第1页,共2页
