专题3第一单元弱电解质的电离平衡同步练习(含解析)2022-2023学年上学期高一化学苏教版(2019)选择性必修1
文档属性
| 名称 | 专题3第一单元弱电解质的电离平衡同步练习(含解析)2022-2023学年上学期高一化学苏教版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 447.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-28 08:32:35 | ||
图片预览




文档简介
专题3第一单元弱电解质的电离平衡同步练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.在0.1 mol·L-1的HCN溶液中存在如下电离平衡: HCN H++CN-。下列叙述正确的是
A.加入少量NaOH固体,平衡正向移动
B.加入少量NaCN固体,平衡正向移动
C.加水,平衡逆向移动
D.滴加少量0.1 mol·L-1HCl溶液, 溶液中c(H+)减小
2.向蒸馏水中滴入少量盐酸后,下列说法中错误的是
A.c(H+)·c(OH-)不变 B.pH增大了
C.c(OH-)降低了 D.水电离出的c(H+)减小了
3.有关电离平衡的理解不正确的是
A.电解质在溶液中达到电离平衡时,分子浓度和离子的浓度相等
B.电离平衡状态下溶液中各微粒的物质的量浓度和质量分数均保持不变
C.电离平衡是动态平衡,弱电解质分子电离成离子和其离子结合成分子的过程均在进行
D.改变条件时,电离平衡会发生移动,在新的条件下建立新的平衡
4.下列电离方程式书写正确的是
A.
B.
C.
D.
5.水的电离过程为。在25℃、35℃时水的离子积常数分别为、。下列叙述中正确的是
A.纯水中随着温度的升高而增大
B.在35℃时,纯水中
C.水的电离度
D.水的电离过程是放热过程
6.下列关于醋酸性质的描述,不能证明它是弱电解质的是
A.0.1mol·L-1的醋酸溶液中H+浓度约为10-3mol·L-1
B.醋酸溶液中存在CH3COOH分子
C.CH3COONa溶液pH大于7
D.5mL0.1mol·L-1的醋酸溶液与5mL0.1mol·L-1的KOH溶液恰好完全中和
7.下列实验事实不能证明醋酸是弱电解质的是
A.相同pH的醋酸溶液和盐酸分别与同样颗粒大小的锌反应时,产生H2的起始速率相等
B.常温下,测得0.1 mol·L-1醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4
D.相同浓度的盐酸和醋酸,醋酸溶液的导电性比盐酸的弱
8.时,若溶液中由水电离产生的,则下列说法正确的是
A.该溶液中水的电离被促进
B.该溶液的一定为12
C.该溶液一定是溶液
D.该溶液中、、、可以大量共存
9.表中数据是几种弱酸常温下的电离平衡常数:
下列说法中不正确的是
A.碳酸的酸性强于氢硫酸
B.多元弱酸的酸性主要由第一步电离决定
C.常温下,加水稀释溶液,减小
D.向弱酸溶液中加少量溶液,恢复到常温,该弱酸的电离平衡常数不变
10.下列说法错误的是
A.常温下,纯水中的c(H+)=c(OH-)=1×10-7mol·L-1
B.向水中加入NaCl,H+与Cl-结合生成HCl,使水的电离平衡向正反应方向移动
C.向水中加入HCl或者NaOH,水的电离平衡都向逆反应方向移动
D.改变温度,Kw也会发生改变
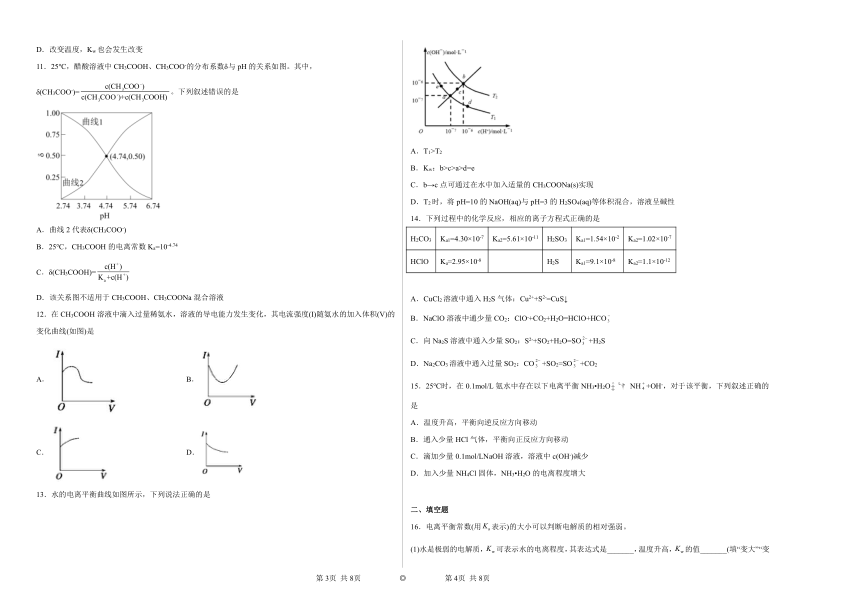
11.25℃,醋酸溶液中CH3COOH、CH3COO-的分布系数δ与pH的关系如图。其中,δ(CH3COO-)=。下列叙述错误的是
A.曲线2代表δ(CH3COO-)
B.25℃,CH3COOH的电离常数Ka=10-4.74
C.δ(CH3COOH)=
D.该关系图不适用于CH3COOH、CH3COONa混合溶液
12.在CH3COOH溶液中滴入过量稀氨水,溶液的导电能力发生变化,其电流强度(I)随氨水的加入体积(V)的变化曲线(如图)是
A. B.
C. D.
13.水的电离平衡曲线如图所示,下列说法正确的是
A.T1>T2
B.Kw:b>c>a>d=e
C.b→c点可通过在水中加入适量的CH3COONa(s)实现
D.T2时,将pH=10的NaOH(aq)与pH=3的H2SO4(aq)等体积混合,溶液呈碱性
14.下列过程中的化学反应,相应的离子方程式正确的是
H2CO3 Ka1=4.30×10-7 Ka2=5.61×10-11 H2SO3 Ka1=1.54×10-2 Ka2=1.02×10-7
HClO Ka=2.95×10-8 H2S Ka1=9.1×10-8 Ka2=1.1×10-12
A.CuCl2溶液中通入H2S气体:Cu2++S2-=CuS↓
B.NaClO溶液中通少量CO2:ClO-+CO2+H2O=HClO+HCO
C.向Na2S溶液中通入少量SO2:S2-+SO2+H2O=SO+H2S
D.Na2CO3溶液中通入过量SO2:CO+SO2=SO+CO2
15.25℃时,在0.1mol/L氨水中存在以下电离平衡NH3 H2ONH+OH-,对于该平衡,下列叙述正确的是
A.温度升高,平衡向逆反应方向移动
B.通入少量HCl气体,平衡向正反应方向移动
C.滴加少量0.1mol/LNaOH溶液,溶液中c(OH-)减少
D.加入少量NH4Cl固体,NH3 H2O的电离程度增大
二、填空题
16.电离平衡常数(用表示)的大小可以判断电解质的相对强弱。
(1)水是极弱的电解质,可表示水的电离程度,其表达式是_______,温度升高,的值_______(填“变大”“变小”或“不变”)。
(2)通常表示弱酸的电离平衡常数,值越大表示该弱酸的酸性_______,当用蒸馏水稀释醋酸时,醋酸的_______(填“变大”“变小”或“不变”)。
(3)常温下,的盐酸中由水电离出的浓度为_______,的NaOH溶液中由水电离出的浓度为_______。
(4)常温下,4种酸的电离平衡常数如下:
化学式 HF HClO
电离平衡常数
①物质的量浓度相同的HF、、、HClO中,由大到小的顺序是_______。
②、、、、结合的能力由大到小的顺序是_______。
17.按要求填空。
(1)现有以下物质:①NaCl晶体;②SO2;③液态醋酸;④铜;⑤固体BaSO4;⑥纯蔗糖(C12H22O11);⑦酒精(C2H5OH);⑧熔化的KHSO4;⑨氨水;⑩液氮。请回答下列问题。(填相应序号)
①以上物质能导电的是____。
②以上物质属于非电解质的是____。
③以上物质属于强电解质的是____。
④写出⑧的电离方程式:____。
(2)25℃时H2S的Ka1=1.0×10-7,此温度下0.1mol·L-1H2S溶液的c(H+)为____mol·L-1。
(3)25℃时,amol·L-1CH3COOH溶液的pH=b,用含a和b的代数式表示CH3COOH的电离平衡常数Ka=____。
(4)已知25℃时,几种弱酸的电离平衡常数如下:HCOOH:Ka=1.77×10-4,HCN:Ka=4.9×10-10,H2CO3:Ka1=4.30×10-7,Ka2=5.61×10-11,则以下反应不能自发进行的是____(填字母)。
a.HCOOH+NaCN=HCOONa+HCN
b.NaHCO3+NaCN=Na2CO3+HCN
c.NaCN+H2O+CO2=HCN+NaHCO3
d.2HCOOH+CO=2HCOO-+H2O+CO2↑
e.H2O+CO2+2CN-=2HCN+CO
三、原理综合题
18.回答下列问题
(1)时,水的,则该温度___________(填“>”“<”或“=”)25℃,其理由是___________。
(2)在(1)中所述温度下,的溶液呈___________(填“酸性”“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由水电离出的___________。
(3)实验室用Zn和稀硫酸制取,反应时溶液中水的电离平衡___________(填“向左”“向右”或“不”,下同)移动。在新制氯水中加入少量NaCl固体,水的电离平衡___________移动。
(4)25℃时,pH=4的盐酸中水的电离程度___________(填“大于”“小于”或“等于”)pH=10的溶液中水的电离程度。
(5)乙酸(甲,)和氯乙酸(乙,)的水溶液,下列可以表示两溶液中由水电离出的与加入水的体积之间关系的是___________(填字母)。
a. b. c. d.
19.结合下表回答下列问题(均为常温下的数据):请回答下列问题:
酸 电离常数(Ka)
HClO
(1)同浓度的、中结合的能力最强的___________。
(2)常温下0.1mol/L的溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填字母)。
A. B.
C. D.
(3)取等体积物质的量浓度相等的、HClO两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:___________(填“>”、“<”或“=”)
(4)在新制氯水中加入少量的NaCl固体,水的电离平衡___________移动(填“向右”、“向左”、或“不”)。
(5)某温度下,纯水中的。若温度不变,滴入稀硫酸使,则由水电离出的为___________ mol/L。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.A
【详解】A.加入NaOH固体,OH-与H+结合,促进平衡正向进行,A正确;
B.加入NaCN固体,溶液中CN-的浓度增大,促进平衡逆向进行,B错误;
C.加水,促进电离,平衡正向进行,C错误;
D.加入HCl,溶液中H+浓度增大,平衡逆向进行,CN-浓度减小,D错误;
故答案为:A。
2.B
【详解】c(H+)·c(OH-)=KW,KW只与温度有关,与溶液的酸碱性无关,A正确;滴入少量盐酸后,c(H+)增大,pH减小,B错误;因c(H+)·c(OH-)=KW,c(H+)增大,则c(OH-)减小,C正确;滴入盐酸,会抑制水的电离,水电离出的c(H+)减小,D正确
3.A
【详解】A. 电解质在溶液中达到电离平衡后,各种分子和离子的浓度不再发生变化,但不一定相等,故A错误;
B. 电离平衡状态下溶液中各微粒的物质的量浓度和质量分数均保持不变,是动态平衡,故B正确;
C. 电离平衡是动态平衡,弱电解质分子电离成离子和其离子结合成分子的过程均在进行,速率不等于0,故C正确;
D. 电离平衡的建立是有条件的,改变条件时,电离平衡会发生移动,在新的条件下建立新的平衡,故D正确;
故选A。
4.B
【详解】A.碳酸是弱酸,碳酸氢根离子不拆,NaHCO3在水中全部电离,电离方程式为:NaHCO3=Na++,故A错误;
B.氢氟酸是弱酸,在水中部分电离,,故B正确;
C.硫酸是强酸,在水中全部电离,H2SO4=2H++SO,故C错误;
D.CH3COONH4是强电解质,在水中全部电离,应为:CH3COONH4=CH3COO-+NH,故D错误;
故选B。
5.A
【详解】A.纯水中,在25℃、35℃时水的离子积常数分别为、,因此纯水中随着温度的升高而增大,故A项正确;
B.由水的电离方程式可知,纯水中,故B项错误;
C.化学反应平衡常数越大,说明反应进行程度越大,根据水的离子积常数可知,升高温度有利于水的电离,因此水的电离度,故C项错误;
D.升高温度促进水的电离,而升高温度平衡将向吸热反应方向移动,因此水的电离为吸热过程,故D项错误;
综上所述,正确的是A项。
6.D
【详解】A.0.1 mol·L-1的醋酸溶液中H+浓度约为10-3 mol·L-1,说明不完全电离,说明其为弱电解质 ,A不符合题意;
B.醋酸溶液中存在CH3COOH分子,说明没有完全电离,说明是弱电解质,B不符合题意;
C.室温时,CH3COONa溶液的pH大于7说明该物质为强碱弱酸盐,醋酸是弱电解质,C不符合题意;
D.5mL 0.1 mol·L-1的醋酸溶液与5mL 0.1mol·L-1的KOH溶液恰好完全中和说明其为一元酸,不能说明其为弱电解质,D符合题意;
故选D。
7.A
【详解】A.醋酸溶液和盐酸pH相同,则溶液中c(H+)相同,因此分别与同样颗粒大小的锌反应时,产生H2的起始速率相等,这不能证明醋酸是弱电解质,A符合题意;
B.常温下,测得0.1 mol/L醋酸溶液的pH=4,c(H+)=10-4 mol/L<0.1 mol/L,因此可证明醋酸是弱酸,存在电离平衡,B不符合题意;
C.常温下,将pH=1的醋酸溶液稀释1000倍,若醋酸是强酸,则稀释后c(H+)=10-4 mol/L,pH=4,现在测得pH<4,c(H+)>10-4 mol/L,说明又有一部分醋酸分子发生电离产生H+,使溶液中c(H+)增大,故可以证明醋酸是弱酸,C不符合题意;
D.在相同条件下,相同浓度醋酸溶液的导电性比盐酸的弱,说明醋酸溶液中电离产生的自由移动的离子浓度比HCl小,因此可以说明醋酸是弱酸,D不符合题意;
故合理选项是A。
8.D
【分析】时,纯水中由水电离产生的。
【详解】A.时,水电离产生的的溶液中水的电离受到抑制,故A错误;
B.酸、碱都抑制水电离,所以该溶液可能是酸溶液也可能是碱溶液,为12或2,故B错误;
C.酸、碱都抑制水电离,所以该溶液可能是酸溶液也可能是碱溶液,故C错误;
D.在酸性或碱性条件下,、、、都能大量共存,故D正确;
选D。
9.C
【详解】A.由表格数据可知,相同温度下碳酸的氢硫酸的,则碳酸的酸性强于氢硫酸,A正确;
B.多元弱酸以第一步电离为主,则多元弱酸的酸性主要由第一步电离决定,B正确;C.,常温下,加水稀释溶液,不变,减小,则增大,C错误;D.弱酸的电离平衡常数与温度有关,与浓度无关,则向弱酸溶液中加少量溶液,恢复到常温,该弱酸的电离平衡常数不变,D正确;
故答案选:C。
10.B
【详解】A.常温下,Kw= c(H+)×c(OH-)=1×10-14,所以纯水中的c(H+)=c(OH-)=1×10-7mol·L-1,A项正确;
B.向水中加入NaCl,由于Na+与水电离出的OH-或Cl-与水电离出的H+均不形成弱电解质,则不会破坏水的电离平衡,B项错误;
C.向水中加入HCl或者NaOH,增大了H+或OH-的浓度,即增大了生成物浓度,平衡逆向移动,C项正确;
D.水的电离为吸热反应,升高温度,平衡正向移动,Kw增大,反之,Kw减小,D项正确;
答案选B。
11.D
【详解】A.已知δ(CH3COO-)=,等式上下同除c(CH3COO-)可得δ(CH3COO-)==,随着pH增大,氢离子浓度减小,增大,即随着pH增大,δ(CH3COO-)增大,则曲线2代表δ(CH3COO-),A正确;
B.δ(CH3COO-)=,c(CH3COO-)=c(CH3COOH),Ka==c(H+),已知pH=4.74,故Ka=10-4.74,B正确;
C.,故C正确;
D.根据选项A中推导可知,δ(CH3COO-)与pH正相关,此关系图同样适用于醋酸和醋酸钠的混合溶液,D错误;
故答案选D。
12.A
【详解】醋酸是一元弱酸,在溶液中部分电离,溶液中离子浓度小,导电性弱,向溶液中加入稀氨水时,醋酸溶液与氨水反应生成醋酸铵,溶液中离子浓度增大,导电能力增强,当醋酸溶液恰好完全反应时,溶液中离子浓度最大,导电性最大,若继续滴入氨水,溶液体积增大,一水合氨在溶液中部分电离,溶液的离子浓度减小,导电能力减弱,则图A的曲线符合醋酸溶液中滴入过量稀氨水时,电流强度随氨水的加入体积的变化,故选A。
13.D
【详解】A.水的电离是吸热反应,温度升高电离平衡正向移动,c(H+)和c(OH-)都增大,由图可知,T2>T1,A错误;
B.Kw只受温度影响,温度不变,Kw不变,ade点都处于同一温度下,则三点的Kw相等,b点c(H+)和c(OH-)都大于a点的,由Kw=c(H+) c(OH-)可知,b点Kw大于c点大于a点,则Kw:b>c>a=d=e,B错误;
C.b→c点Kw变小,是降温导致的,在水中加入适量的CH3COONa(s)但温度不变,不能改变Kw,C错误;
D.T2时,Kw=c(H+) c(OH-)=10-6×10-6=10-12,pH=10的NaOH(aq)其c(OH-)=,pH=3的H2SO4(aq)其c(H+)=10-3mol/L,两者等体积混合,n(OH-)过量,则溶液呈碱性,D正确;
故选:D。
14.B
【详解】A.CuCl2溶液中通入H2S气体的离子方程式为Cu2++H2S=CuS↓+2H+,故A错误;
B.NaClO溶液中通少量CO2生成次氯酸钠和碳酸氢钠,故离子方程式为ClO-+CO2+H2O=HClO+HCO,故B正确;
C.向Na2S溶液中通入少量SO2,发生反应的离子方程式为2H2O+2S2-+SO2=4OH-+3S↓,故C错误;
D.Na2CO3溶液中通入过量SO2生成NaHSO3和CO2,故离子方程式为CO+2SO2+H2O=2HSO+CO2,故D错误;
故选B。
15.B
【详解】A.电离吸热,温度升高,平衡向正反应方向移动,故A错误;
B.通入少量HCl气体,氢氧根离子浓度减小,平衡向正反应方向移动,故B正确;
C.氨水是弱碱,在0.1mol/L氨水中氢氧根离子的浓度小于0.1mol/L,滴加少量0.1mol/LNaOH溶液,氢氧根离子的浓度增大,故C错误;
D.加入少量NH4Cl固体,铵根离子浓度增大,电离平衡NH3 H2ONH+OH-逆向移动,NH3 H2O的电离程度减小,故D错误;
选B。
16.(1) 变大
(2) 越强 不变
(3)
(4) HF>>>HClO >>>>
【详解】(1)水的离子积常数;由于水的电离是吸热过程,升高温度将促进水的电离,因此将变大。
(2)通常表示弱酸的电离平衡常数,值越大说明酸的电离程度越大,弱酸的酸性越强;电离平衡常数只受温度影响,因此加水稀释不会影响电离平衡常数。
(3)盐酸溶液中水的电离受到抑制,因此盐酸溶液中OH-几乎来自于水的电离,常温下,的盐酸中,溶液中水电离的;NaOH溶液中水的电离受到抑制,因此NaOH溶液中H+几乎来自于水的电离,的NaOH溶液中,溶液中水电离的。
(4)①相同条件下,酸的电离平衡常数越大,酸的电离程度越大,溶液中越大,根据电离平衡常数可知物质的量浓度相同的HF、、、HClO中,由大到小的顺序是HF>>>HClO。
②相同条件下,酸的酸性越弱,酸根离子结合氢离子的能力越强,因此、、、、结合的能力由大到小的顺序是>>>>。
17.(1) ④⑧⑨ ②⑥⑦ ①⑤⑧ KHSO4=K++HSO
(2)1.0×10-4
(3)
(4)be
【分析】①NaCl晶体,在熔融状态和水溶液中能完全电离生成钠离子和氯离子,属于强电解质,但氯化钠晶体不含自由移动的离子,不导电;
②SO2,在熔融状态和水溶液中都不能导电,属于非电解质,不导电;
③液态醋酸,溶于水时能部分电离生成醋酸根离子和氢离子,属于弱电解质,但液态醋酸不含自由移动的离子,不导电;
④铜为单质,既不是电解质也不是非电解质,但铜含自由移动的电子,能导电;
⑤固体BaSO4,在熔融状态和水溶液中能完全电离生成钡离子和硫酸根离子,属于强电解质,但固体BaSO4不含自由移动的离子,不导电;
⑥纯蔗糖(C12H22O11),在熔融状态和水溶液中都不能导电,属于非电解质,不导电;
⑦酒精(C2H5OH),在熔融状态和水溶液中都不能导电,属于非电解质,不导电;
⑧熔化的KHSO4,能完全电离生成钾离子和硫酸氢根离子,属于强电解质,含自由移动的离子,能导电;
⑨氨水为混合物,既不是电解质也不是非电解质,但溶液中含自由移动的离子,能导电;
⑩液氮为单质,既不是电解质也不是非电解质,不含自由移动的电子或离子,不导电;
(1)
①由分析可知,以上物质能导电的是:④⑧⑨;
②由分析可知,以上物质属于非电解质的是:②⑥⑦;
③由分析可知,以上物质属于强电解质的是:①⑤⑧;
④熔化的KHSO4,完全电离生成钾离子和硫酸氢根离子,其电离方程式为:KHSO4=K++HSO;
(2)
设H2S第一步电离出的氢离子浓度为x,列三段式:
Ka1==≈=1.0×10-7,解得x=1.0×10-4,相对于第一步电离,第二步电离和水电离生成的氢离子可以忽略不记,则此温度下0.1mol·L-1H2S溶液的c(H+)为1.0×10-4mol/L;
(3)
amol/LCH3COOH溶液的pH=b,c(H+)=10-bmol/L,由CH3COOH CH3COO-+H+可知,Ka===;
(4)
酸的电离平衡常数越大,酸的酸性越强,强酸能和弱酸盐反应生成弱酸,根据电离平衡常数知,酸性:HCOOH>H2CO3>HCN>HCO,
a.酸性:HCOOH>HCN,反应HCOOH+NaCN=HCOONa+HCN能发生,a不符合题意;
b.酸性:HCN>HCO,反应NaHCO3+NaCN=Na2CO3+HCN不能发生,b符合题意;
c.酸性:H2CO3>HCN ,反应NaCN+H2O+CO2=HCN+NaHCO3能发生,c不符合题意;
d.酸性:HCOOH>H2CO3,反应2HCOOH+CO=2HCOO-+H2O+CO2↑能发生,d不符合题意;
e.酸性:H2CO3>HCN>HCO,反应H2O+CO2+2CN-=2HCN+CO不能发生,e符合题意;
答案选be。
18.(1) > 升温促进水的电离,KW增大
(2) 碱性
(3) 向右 向右
(4)等于
(5)c
【详解】(1)升高温度,促进水的电离,增大,由于,因此该温度大于25℃,故答案为:>;升温促进水的电离,KW增大;
(2)该温度下,溶液中,因为,所以溶液呈碱性;NaOH溶液中由水电离出的等于溶液中的,即为;故答案为:碱性;;
(3)Zn与稀硫酸反应过程中,溶液中减小,水的电离平衡向右移动。新制氯水中加入少量NaCl固体,反应的平衡向左移动,溶液中减小,水的电离平衡向右移动;故答案为:向右;向右;
(4)pH=4的盐酸中,由水电离出的,pH=10的溶液中,由水电离出的,故两种溶液中水的电离程度相同;故答案为:等于;
(5)乙酸的小于氯乙酸的,所以乙酸溶液中的小于氯乙酸溶液中的,故水的电离程度:的乙酸溶液(甲)大于的氯乙酸溶液(乙),加水稀释,两溶液中的均减小,水的电离程度均增大,故选c;故答案为:c。
19.(1)
(2)AC
(3)=
(4)向右
(5)
【详解】(1)电离平衡常数越小、电离出氢离子能力越小、酸越弱、则其阴离子结合质子能力越强。由表知:HS-电离能力最差、则同浓度的、中结合的能力最强的是;
(2)A.稀释促进电离, n(H+)有所增大,而体积增加得更快、变小,A符合;
B.稀释促进电离, n(H+)有所增大,变小,则增大,B不符合;
C.稀释变小,常温下Kw不变,则变小,C符合;
D.稀释变小,常温下Kw不变,则增大,D不符合;
故答案选AC;
(3)、HClO溶液体积相等、物质的量浓度相等、即物质的量相等,分别用NaOH稀溶液中和可得到对应的钠盐溶液,则它们消耗的的NaOH物质的量相等、则消耗的等浓度NaOH溶液的体积大小关系为:=;
(4)在新制氯水中加入少量的NaCl固体,增大了氯离子浓度,使左移,变小,促进水电离,则水的电离平衡向右移动;
(5)某温度下,纯水中的,则该温度下,若温度不变,滴入稀硫酸使,则由水电离出的。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.在0.1 mol·L-1的HCN溶液中存在如下电离平衡: HCN H++CN-。下列叙述正确的是
A.加入少量NaOH固体,平衡正向移动
B.加入少量NaCN固体,平衡正向移动
C.加水,平衡逆向移动
D.滴加少量0.1 mol·L-1HCl溶液, 溶液中c(H+)减小
2.向蒸馏水中滴入少量盐酸后,下列说法中错误的是
A.c(H+)·c(OH-)不变 B.pH增大了
C.c(OH-)降低了 D.水电离出的c(H+)减小了
3.有关电离平衡的理解不正确的是
A.电解质在溶液中达到电离平衡时,分子浓度和离子的浓度相等
B.电离平衡状态下溶液中各微粒的物质的量浓度和质量分数均保持不变
C.电离平衡是动态平衡,弱电解质分子电离成离子和其离子结合成分子的过程均在进行
D.改变条件时,电离平衡会发生移动,在新的条件下建立新的平衡
4.下列电离方程式书写正确的是
A.
B.
C.
D.
5.水的电离过程为。在25℃、35℃时水的离子积常数分别为、。下列叙述中正确的是
A.纯水中随着温度的升高而增大
B.在35℃时,纯水中
C.水的电离度
D.水的电离过程是放热过程
6.下列关于醋酸性质的描述,不能证明它是弱电解质的是
A.0.1mol·L-1的醋酸溶液中H+浓度约为10-3mol·L-1
B.醋酸溶液中存在CH3COOH分子
C.CH3COONa溶液pH大于7
D.5mL0.1mol·L-1的醋酸溶液与5mL0.1mol·L-1的KOH溶液恰好完全中和
7.下列实验事实不能证明醋酸是弱电解质的是
A.相同pH的醋酸溶液和盐酸分别与同样颗粒大小的锌反应时,产生H2的起始速率相等
B.常温下,测得0.1 mol·L-1醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4
D.相同浓度的盐酸和醋酸,醋酸溶液的导电性比盐酸的弱
8.时,若溶液中由水电离产生的,则下列说法正确的是
A.该溶液中水的电离被促进
B.该溶液的一定为12
C.该溶液一定是溶液
D.该溶液中、、、可以大量共存
9.表中数据是几种弱酸常温下的电离平衡常数:
下列说法中不正确的是
A.碳酸的酸性强于氢硫酸
B.多元弱酸的酸性主要由第一步电离决定
C.常温下,加水稀释溶液,减小
D.向弱酸溶液中加少量溶液,恢复到常温,该弱酸的电离平衡常数不变
10.下列说法错误的是
A.常温下,纯水中的c(H+)=c(OH-)=1×10-7mol·L-1
B.向水中加入NaCl,H+与Cl-结合生成HCl,使水的电离平衡向正反应方向移动
C.向水中加入HCl或者NaOH,水的电离平衡都向逆反应方向移动
D.改变温度,Kw也会发生改变
11.25℃,醋酸溶液中CH3COOH、CH3COO-的分布系数δ与pH的关系如图。其中,δ(CH3COO-)=。下列叙述错误的是
A.曲线2代表δ(CH3COO-)
B.25℃,CH3COOH的电离常数Ka=10-4.74
C.δ(CH3COOH)=
D.该关系图不适用于CH3COOH、CH3COONa混合溶液
12.在CH3COOH溶液中滴入过量稀氨水,溶液的导电能力发生变化,其电流强度(I)随氨水的加入体积(V)的变化曲线(如图)是
A. B.
C. D.
13.水的电离平衡曲线如图所示,下列说法正确的是
A.T1>T2
B.Kw:b>c>a>d=e
C.b→c点可通过在水中加入适量的CH3COONa(s)实现
D.T2时,将pH=10的NaOH(aq)与pH=3的H2SO4(aq)等体积混合,溶液呈碱性
14.下列过程中的化学反应,相应的离子方程式正确的是
H2CO3 Ka1=4.30×10-7 Ka2=5.61×10-11 H2SO3 Ka1=1.54×10-2 Ka2=1.02×10-7
HClO Ka=2.95×10-8 H2S Ka1=9.1×10-8 Ka2=1.1×10-12
A.CuCl2溶液中通入H2S气体:Cu2++S2-=CuS↓
B.NaClO溶液中通少量CO2:ClO-+CO2+H2O=HClO+HCO
C.向Na2S溶液中通入少量SO2:S2-+SO2+H2O=SO+H2S
D.Na2CO3溶液中通入过量SO2:CO+SO2=SO+CO2
15.25℃时,在0.1mol/L氨水中存在以下电离平衡NH3 H2ONH+OH-,对于该平衡,下列叙述正确的是
A.温度升高,平衡向逆反应方向移动
B.通入少量HCl气体,平衡向正反应方向移动
C.滴加少量0.1mol/LNaOH溶液,溶液中c(OH-)减少
D.加入少量NH4Cl固体,NH3 H2O的电离程度增大
二、填空题
16.电离平衡常数(用表示)的大小可以判断电解质的相对强弱。
(1)水是极弱的电解质,可表示水的电离程度,其表达式是_______,温度升高,的值_______(填“变大”“变小”或“不变”)。
(2)通常表示弱酸的电离平衡常数,值越大表示该弱酸的酸性_______,当用蒸馏水稀释醋酸时,醋酸的_______(填“变大”“变小”或“不变”)。
(3)常温下,的盐酸中由水电离出的浓度为_______,的NaOH溶液中由水电离出的浓度为_______。
(4)常温下,4种酸的电离平衡常数如下:
化学式 HF HClO
电离平衡常数
①物质的量浓度相同的HF、、、HClO中,由大到小的顺序是_______。
②、、、、结合的能力由大到小的顺序是_______。
17.按要求填空。
(1)现有以下物质:①NaCl晶体;②SO2;③液态醋酸;④铜;⑤固体BaSO4;⑥纯蔗糖(C12H22O11);⑦酒精(C2H5OH);⑧熔化的KHSO4;⑨氨水;⑩液氮。请回答下列问题。(填相应序号)
①以上物质能导电的是____。
②以上物质属于非电解质的是____。
③以上物质属于强电解质的是____。
④写出⑧的电离方程式:____。
(2)25℃时H2S的Ka1=1.0×10-7,此温度下0.1mol·L-1H2S溶液的c(H+)为____mol·L-1。
(3)25℃时,amol·L-1CH3COOH溶液的pH=b,用含a和b的代数式表示CH3COOH的电离平衡常数Ka=____。
(4)已知25℃时,几种弱酸的电离平衡常数如下:HCOOH:Ka=1.77×10-4,HCN:Ka=4.9×10-10,H2CO3:Ka1=4.30×10-7,Ka2=5.61×10-11,则以下反应不能自发进行的是____(填字母)。
a.HCOOH+NaCN=HCOONa+HCN
b.NaHCO3+NaCN=Na2CO3+HCN
c.NaCN+H2O+CO2=HCN+NaHCO3
d.2HCOOH+CO=2HCOO-+H2O+CO2↑
e.H2O+CO2+2CN-=2HCN+CO
三、原理综合题
18.回答下列问题
(1)时,水的,则该温度___________(填“>”“<”或“=”)25℃,其理由是___________。
(2)在(1)中所述温度下,的溶液呈___________(填“酸性”“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由水电离出的___________。
(3)实验室用Zn和稀硫酸制取,反应时溶液中水的电离平衡___________(填“向左”“向右”或“不”,下同)移动。在新制氯水中加入少量NaCl固体,水的电离平衡___________移动。
(4)25℃时,pH=4的盐酸中水的电离程度___________(填“大于”“小于”或“等于”)pH=10的溶液中水的电离程度。
(5)乙酸(甲,)和氯乙酸(乙,)的水溶液,下列可以表示两溶液中由水电离出的与加入水的体积之间关系的是___________(填字母)。
a. b. c. d.
19.结合下表回答下列问题(均为常温下的数据):请回答下列问题:
酸 电离常数(Ka)
HClO
(1)同浓度的、中结合的能力最强的___________。
(2)常温下0.1mol/L的溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填字母)。
A. B.
C. D.
(3)取等体积物质的量浓度相等的、HClO两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:___________(填“>”、“<”或“=”)
(4)在新制氯水中加入少量的NaCl固体,水的电离平衡___________移动(填“向右”、“向左”、或“不”)。
(5)某温度下,纯水中的。若温度不变,滴入稀硫酸使,则由水电离出的为___________ mol/L。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.A
【详解】A.加入NaOH固体,OH-与H+结合,促进平衡正向进行,A正确;
B.加入NaCN固体,溶液中CN-的浓度增大,促进平衡逆向进行,B错误;
C.加水,促进电离,平衡正向进行,C错误;
D.加入HCl,溶液中H+浓度增大,平衡逆向进行,CN-浓度减小,D错误;
故答案为:A。
2.B
【详解】c(H+)·c(OH-)=KW,KW只与温度有关,与溶液的酸碱性无关,A正确;滴入少量盐酸后,c(H+)增大,pH减小,B错误;因c(H+)·c(OH-)=KW,c(H+)增大,则c(OH-)减小,C正确;滴入盐酸,会抑制水的电离,水电离出的c(H+)减小,D正确
3.A
【详解】A. 电解质在溶液中达到电离平衡后,各种分子和离子的浓度不再发生变化,但不一定相等,故A错误;
B. 电离平衡状态下溶液中各微粒的物质的量浓度和质量分数均保持不变,是动态平衡,故B正确;
C. 电离平衡是动态平衡,弱电解质分子电离成离子和其离子结合成分子的过程均在进行,速率不等于0,故C正确;
D. 电离平衡的建立是有条件的,改变条件时,电离平衡会发生移动,在新的条件下建立新的平衡,故D正确;
故选A。
4.B
【详解】A.碳酸是弱酸,碳酸氢根离子不拆,NaHCO3在水中全部电离,电离方程式为:NaHCO3=Na++,故A错误;
B.氢氟酸是弱酸,在水中部分电离,,故B正确;
C.硫酸是强酸,在水中全部电离,H2SO4=2H++SO,故C错误;
D.CH3COONH4是强电解质,在水中全部电离,应为:CH3COONH4=CH3COO-+NH,故D错误;
故选B。
5.A
【详解】A.纯水中,在25℃、35℃时水的离子积常数分别为、,因此纯水中随着温度的升高而增大,故A项正确;
B.由水的电离方程式可知,纯水中,故B项错误;
C.化学反应平衡常数越大,说明反应进行程度越大,根据水的离子积常数可知,升高温度有利于水的电离,因此水的电离度,故C项错误;
D.升高温度促进水的电离,而升高温度平衡将向吸热反应方向移动,因此水的电离为吸热过程,故D项错误;
综上所述,正确的是A项。
6.D
【详解】A.0.1 mol·L-1的醋酸溶液中H+浓度约为10-3 mol·L-1,说明不完全电离,说明其为弱电解质 ,A不符合题意;
B.醋酸溶液中存在CH3COOH分子,说明没有完全电离,说明是弱电解质,B不符合题意;
C.室温时,CH3COONa溶液的pH大于7说明该物质为强碱弱酸盐,醋酸是弱电解质,C不符合题意;
D.5mL 0.1 mol·L-1的醋酸溶液与5mL 0.1mol·L-1的KOH溶液恰好完全中和说明其为一元酸,不能说明其为弱电解质,D符合题意;
故选D。
7.A
【详解】A.醋酸溶液和盐酸pH相同,则溶液中c(H+)相同,因此分别与同样颗粒大小的锌反应时,产生H2的起始速率相等,这不能证明醋酸是弱电解质,A符合题意;
B.常温下,测得0.1 mol/L醋酸溶液的pH=4,c(H+)=10-4 mol/L<0.1 mol/L,因此可证明醋酸是弱酸,存在电离平衡,B不符合题意;
C.常温下,将pH=1的醋酸溶液稀释1000倍,若醋酸是强酸,则稀释后c(H+)=10-4 mol/L,pH=4,现在测得pH<4,c(H+)>10-4 mol/L,说明又有一部分醋酸分子发生电离产生H+,使溶液中c(H+)增大,故可以证明醋酸是弱酸,C不符合题意;
D.在相同条件下,相同浓度醋酸溶液的导电性比盐酸的弱,说明醋酸溶液中电离产生的自由移动的离子浓度比HCl小,因此可以说明醋酸是弱酸,D不符合题意;
故合理选项是A。
8.D
【分析】时,纯水中由水电离产生的。
【详解】A.时,水电离产生的的溶液中水的电离受到抑制,故A错误;
B.酸、碱都抑制水电离,所以该溶液可能是酸溶液也可能是碱溶液,为12或2,故B错误;
C.酸、碱都抑制水电离,所以该溶液可能是酸溶液也可能是碱溶液,故C错误;
D.在酸性或碱性条件下,、、、都能大量共存,故D正确;
选D。
9.C
【详解】A.由表格数据可知,相同温度下碳酸的氢硫酸的,则碳酸的酸性强于氢硫酸,A正确;
B.多元弱酸以第一步电离为主,则多元弱酸的酸性主要由第一步电离决定,B正确;C.,常温下,加水稀释溶液,不变,减小,则增大,C错误;D.弱酸的电离平衡常数与温度有关,与浓度无关,则向弱酸溶液中加少量溶液,恢复到常温,该弱酸的电离平衡常数不变,D正确;
故答案选:C。
10.B
【详解】A.常温下,Kw= c(H+)×c(OH-)=1×10-14,所以纯水中的c(H+)=c(OH-)=1×10-7mol·L-1,A项正确;
B.向水中加入NaCl,由于Na+与水电离出的OH-或Cl-与水电离出的H+均不形成弱电解质,则不会破坏水的电离平衡,B项错误;
C.向水中加入HCl或者NaOH,增大了H+或OH-的浓度,即增大了生成物浓度,平衡逆向移动,C项正确;
D.水的电离为吸热反应,升高温度,平衡正向移动,Kw增大,反之,Kw减小,D项正确;
答案选B。
11.D
【详解】A.已知δ(CH3COO-)=,等式上下同除c(CH3COO-)可得δ(CH3COO-)==,随着pH增大,氢离子浓度减小,增大,即随着pH增大,δ(CH3COO-)增大,则曲线2代表δ(CH3COO-),A正确;
B.δ(CH3COO-)=,c(CH3COO-)=c(CH3COOH),Ka==c(H+),已知pH=4.74,故Ka=10-4.74,B正确;
C.,故C正确;
D.根据选项A中推导可知,δ(CH3COO-)与pH正相关,此关系图同样适用于醋酸和醋酸钠的混合溶液,D错误;
故答案选D。
12.A
【详解】醋酸是一元弱酸,在溶液中部分电离,溶液中离子浓度小,导电性弱,向溶液中加入稀氨水时,醋酸溶液与氨水反应生成醋酸铵,溶液中离子浓度增大,导电能力增强,当醋酸溶液恰好完全反应时,溶液中离子浓度最大,导电性最大,若继续滴入氨水,溶液体积增大,一水合氨在溶液中部分电离,溶液的离子浓度减小,导电能力减弱,则图A的曲线符合醋酸溶液中滴入过量稀氨水时,电流强度随氨水的加入体积的变化,故选A。
13.D
【详解】A.水的电离是吸热反应,温度升高电离平衡正向移动,c(H+)和c(OH-)都增大,由图可知,T2>T1,A错误;
B.Kw只受温度影响,温度不变,Kw不变,ade点都处于同一温度下,则三点的Kw相等,b点c(H+)和c(OH-)都大于a点的,由Kw=c(H+) c(OH-)可知,b点Kw大于c点大于a点,则Kw:b>c>a=d=e,B错误;
C.b→c点Kw变小,是降温导致的,在水中加入适量的CH3COONa(s)但温度不变,不能改变Kw,C错误;
D.T2时,Kw=c(H+) c(OH-)=10-6×10-6=10-12,pH=10的NaOH(aq)其c(OH-)=,pH=3的H2SO4(aq)其c(H+)=10-3mol/L,两者等体积混合,n(OH-)过量,则溶液呈碱性,D正确;
故选:D。
14.B
【详解】A.CuCl2溶液中通入H2S气体的离子方程式为Cu2++H2S=CuS↓+2H+,故A错误;
B.NaClO溶液中通少量CO2生成次氯酸钠和碳酸氢钠,故离子方程式为ClO-+CO2+H2O=HClO+HCO,故B正确;
C.向Na2S溶液中通入少量SO2,发生反应的离子方程式为2H2O+2S2-+SO2=4OH-+3S↓,故C错误;
D.Na2CO3溶液中通入过量SO2生成NaHSO3和CO2,故离子方程式为CO+2SO2+H2O=2HSO+CO2,故D错误;
故选B。
15.B
【详解】A.电离吸热,温度升高,平衡向正反应方向移动,故A错误;
B.通入少量HCl气体,氢氧根离子浓度减小,平衡向正反应方向移动,故B正确;
C.氨水是弱碱,在0.1mol/L氨水中氢氧根离子的浓度小于0.1mol/L,滴加少量0.1mol/LNaOH溶液,氢氧根离子的浓度增大,故C错误;
D.加入少量NH4Cl固体,铵根离子浓度增大,电离平衡NH3 H2ONH+OH-逆向移动,NH3 H2O的电离程度减小,故D错误;
选B。
16.(1) 变大
(2) 越强 不变
(3)
(4) HF>>>HClO >>>>
【详解】(1)水的离子积常数;由于水的电离是吸热过程,升高温度将促进水的电离,因此将变大。
(2)通常表示弱酸的电离平衡常数,值越大说明酸的电离程度越大,弱酸的酸性越强;电离平衡常数只受温度影响,因此加水稀释不会影响电离平衡常数。
(3)盐酸溶液中水的电离受到抑制,因此盐酸溶液中OH-几乎来自于水的电离,常温下,的盐酸中,溶液中水电离的;NaOH溶液中水的电离受到抑制,因此NaOH溶液中H+几乎来自于水的电离,的NaOH溶液中,溶液中水电离的。
(4)①相同条件下,酸的电离平衡常数越大,酸的电离程度越大,溶液中越大,根据电离平衡常数可知物质的量浓度相同的HF、、、HClO中,由大到小的顺序是HF>>>HClO。
②相同条件下,酸的酸性越弱,酸根离子结合氢离子的能力越强,因此、、、、结合的能力由大到小的顺序是>>>>。
17.(1) ④⑧⑨ ②⑥⑦ ①⑤⑧ KHSO4=K++HSO
(2)1.0×10-4
(3)
(4)be
【分析】①NaCl晶体,在熔融状态和水溶液中能完全电离生成钠离子和氯离子,属于强电解质,但氯化钠晶体不含自由移动的离子,不导电;
②SO2,在熔融状态和水溶液中都不能导电,属于非电解质,不导电;
③液态醋酸,溶于水时能部分电离生成醋酸根离子和氢离子,属于弱电解质,但液态醋酸不含自由移动的离子,不导电;
④铜为单质,既不是电解质也不是非电解质,但铜含自由移动的电子,能导电;
⑤固体BaSO4,在熔融状态和水溶液中能完全电离生成钡离子和硫酸根离子,属于强电解质,但固体BaSO4不含自由移动的离子,不导电;
⑥纯蔗糖(C12H22O11),在熔融状态和水溶液中都不能导电,属于非电解质,不导电;
⑦酒精(C2H5OH),在熔融状态和水溶液中都不能导电,属于非电解质,不导电;
⑧熔化的KHSO4,能完全电离生成钾离子和硫酸氢根离子,属于强电解质,含自由移动的离子,能导电;
⑨氨水为混合物,既不是电解质也不是非电解质,但溶液中含自由移动的离子,能导电;
⑩液氮为单质,既不是电解质也不是非电解质,不含自由移动的电子或离子,不导电;
(1)
①由分析可知,以上物质能导电的是:④⑧⑨;
②由分析可知,以上物质属于非电解质的是:②⑥⑦;
③由分析可知,以上物质属于强电解质的是:①⑤⑧;
④熔化的KHSO4,完全电离生成钾离子和硫酸氢根离子,其电离方程式为:KHSO4=K++HSO;
(2)
设H2S第一步电离出的氢离子浓度为x,列三段式:
Ka1==≈=1.0×10-7,解得x=1.0×10-4,相对于第一步电离,第二步电离和水电离生成的氢离子可以忽略不记,则此温度下0.1mol·L-1H2S溶液的c(H+)为1.0×10-4mol/L;
(3)
amol/LCH3COOH溶液的pH=b,c(H+)=10-bmol/L,由CH3COOH CH3COO-+H+可知,Ka===;
(4)
酸的电离平衡常数越大,酸的酸性越强,强酸能和弱酸盐反应生成弱酸,根据电离平衡常数知,酸性:HCOOH>H2CO3>HCN>HCO,
a.酸性:HCOOH>HCN,反应HCOOH+NaCN=HCOONa+HCN能发生,a不符合题意;
b.酸性:HCN>HCO,反应NaHCO3+NaCN=Na2CO3+HCN不能发生,b符合题意;
c.酸性:H2CO3>HCN ,反应NaCN+H2O+CO2=HCN+NaHCO3能发生,c不符合题意;
d.酸性:HCOOH>H2CO3,反应2HCOOH+CO=2HCOO-+H2O+CO2↑能发生,d不符合题意;
e.酸性:H2CO3>HCN>HCO,反应H2O+CO2+2CN-=2HCN+CO不能发生,e符合题意;
答案选be。
18.(1) > 升温促进水的电离,KW增大
(2) 碱性
(3) 向右 向右
(4)等于
(5)c
【详解】(1)升高温度,促进水的电离,增大,由于,因此该温度大于25℃,故答案为:>;升温促进水的电离,KW增大;
(2)该温度下,溶液中,因为,所以溶液呈碱性;NaOH溶液中由水电离出的等于溶液中的,即为;故答案为:碱性;;
(3)Zn与稀硫酸反应过程中,溶液中减小,水的电离平衡向右移动。新制氯水中加入少量NaCl固体,反应的平衡向左移动,溶液中减小,水的电离平衡向右移动;故答案为:向右;向右;
(4)pH=4的盐酸中,由水电离出的,pH=10的溶液中,由水电离出的,故两种溶液中水的电离程度相同;故答案为:等于;
(5)乙酸的小于氯乙酸的,所以乙酸溶液中的小于氯乙酸溶液中的,故水的电离程度:的乙酸溶液(甲)大于的氯乙酸溶液(乙),加水稀释,两溶液中的均减小,水的电离程度均增大,故选c;故答案为:c。
19.(1)
(2)AC
(3)=
(4)向右
(5)
【详解】(1)电离平衡常数越小、电离出氢离子能力越小、酸越弱、则其阴离子结合质子能力越强。由表知:HS-电离能力最差、则同浓度的、中结合的能力最强的是;
(2)A.稀释促进电离, n(H+)有所增大,而体积增加得更快、变小,A符合;
B.稀释促进电离, n(H+)有所增大,变小,则增大,B不符合;
C.稀释变小,常温下Kw不变,则变小,C符合;
D.稀释变小,常温下Kw不变,则增大,D不符合;
故答案选AC;
(3)、HClO溶液体积相等、物质的量浓度相等、即物质的量相等,分别用NaOH稀溶液中和可得到对应的钠盐溶液,则它们消耗的的NaOH物质的量相等、则消耗的等浓度NaOH溶液的体积大小关系为:=;
(4)在新制氯水中加入少量的NaCl固体,增大了氯离子浓度,使左移,变小,促进水电离,则水的电离平衡向右移动;
(5)某温度下,纯水中的,则该温度下,若温度不变,滴入稀硫酸使,则由水电离出的。
答案第1页,共2页
答案第1页,共2页
