必修第一册 第二章 海水中的重要元素——钠和氯 章末单元同步练习题(含解析)
文档属性
| 名称 | 必修第一册 第二章 海水中的重要元素——钠和氯 章末单元同步练习题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-27 10:34:31 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
第二章 海水中的重要元素——钠和氯 章末单元 同步练习题
一、选择题(每小题只有一个正确选项,每小题3分,共45分)
1.“神舟”号载人航天器中,宇航员所在的返回舱都是密封的,宇航员吸入氧气,呼出二氧化碳,如果二氧化碳浓度过大,会使宇航员困乏,呼吸频率加快,严重的会窒息。为使二氧化碳浓度降低而保持舱内氧气的适当比例,可以在返回舱内放入 ( )
A.过氧化钠 B.碳酸钠
C.氢氧化钠 D.氧气瓶
2. 钠及其化合物与人们的生活密切相关,某同学对其认识不正确的是( )
A.碳酸氢钠常用于治疗胃酸过多症
B.Na2O2用作呼吸面具的供氧剂
C.发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
D.金属钠着火时,使用泡沫灭火器来灭火
3. 节日里燃放的五彩缤纷的烟花与高中化学中“焰色试验”知识相关。下列说法中正确的是( )
A.焰色试验是化学变化
B.用稀盐酸清洗做焰色试验的铂丝(镍丝或铁丝)
C.焰色试验均应透过蓝色钴玻璃观察
D.利用焰色试验可区分NaCl与Na2CO3固体
4. 某化学教师为“氯气与金属钠反应”设计了如图装置与操作以替代相关的课本实验。玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,待钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是( )
A.反应生成的大量白烟是氯化钠晶体
B.浸有NaOH溶液的棉花球用于吸收过量的氯气,以免其污染空气
C.钠着火燃烧产生苍白色火焰
D.在棉花球外沿滴一滴石蕊溶液,判断氯气是否被碱液完全吸收
5. 设NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.2.4 g金属镁变成镁离子时失去的电子数目为0.1NA
B.2 g氢气所含原子数目为NA
C.在25 ℃,压强为1.01×105 Pa时,11.2 L氮气所含的原子数目为NA
D.17 g氨气所含电子数目为10 NA
6. 利用太阳能分解水制氢,若分解0.02 mol水,下列说法正确的是( )
A.可生成H2的质量为0.02 g
B.可生成氢的原子数为2.408×1023个
C.可生成H2的体积为0.224 L(标准状况)
D.生成H2的量理论上等于0.04 mol Na与水反应产生H2的量
7. 在臭氧发生装置中装入氧气100 mL,经反应:3O22O3,最后气体体积变为95 mL(体积均在标准状况下测定),则混合气体的密度是( )
A.1.3 g·L-1 B.1.5 g·L-1
C.1.7 g·L-1 D.2.0 g·L-1
8. 下列有关离子方程式书写不正确的是( )
A.NaOH溶液吸收Cl2:Cl2+2OH-===ClO-+Cl-+H2O
B.过氧化钠和水反应:2Na2O2+2H2O===4Na++4OH-+O2↑
C.“84”消毒液与洁厕灵(主要成分为HCl)混用,产生有毒Cl2:2H++Cl-+ClO-===Cl2↑+H2O
D.“84”消毒液中加白醋生成HClO:H++ClO-===HClO
9. 在制备和收集Cl2的实验过程中,下列装置正确的是( )
10. 某硫原子的质量是a g,12C原子的质量是b g,若NA只表示阿伏加德罗常数的数值,则下列说法中正确的是( )
①该硫原子的相对原子质量为
②m g该硫原子的物质的量为 mol
③该硫原子的摩尔质量是aNA g
④a g该硫原子所含的电子数为16NA
A.①③ B.②④
C.①② D.②③
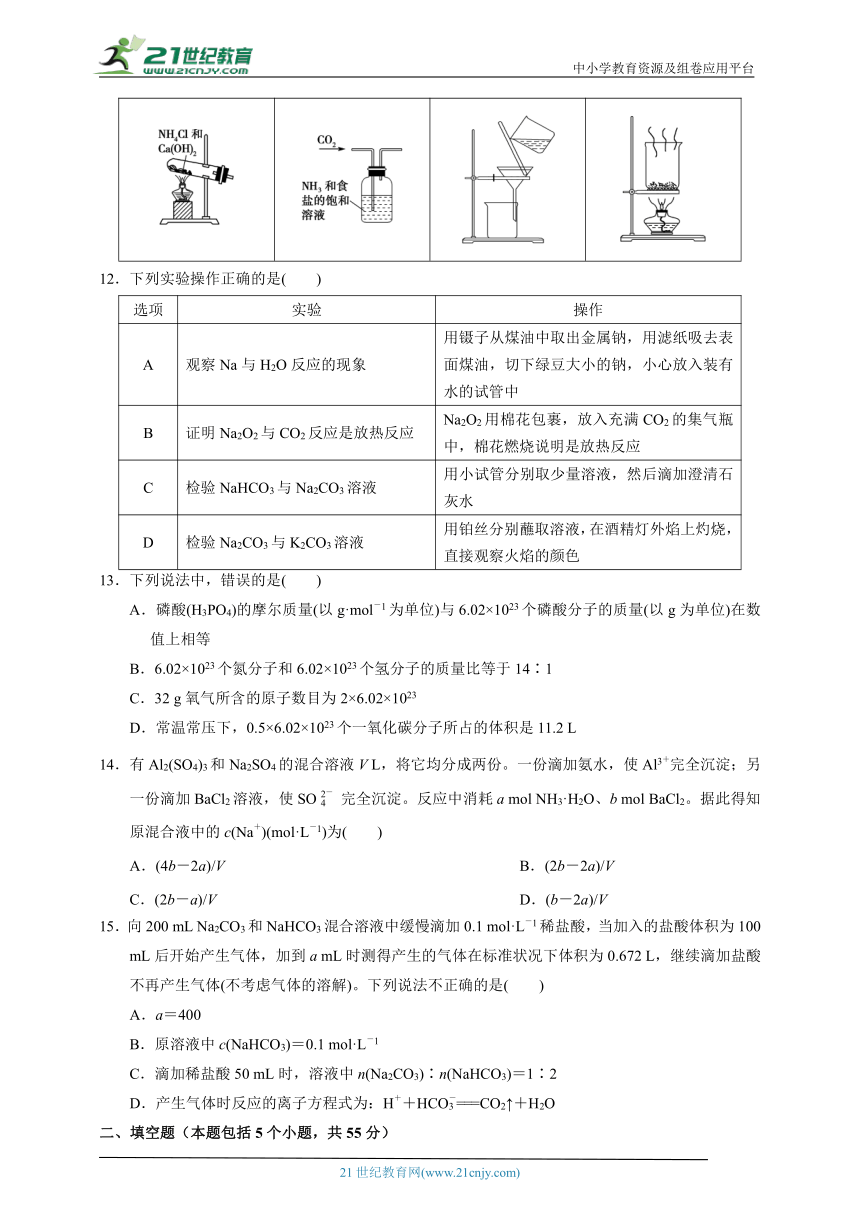
11.下列依据侯氏制碱原理制备少量NaHCO3的实验操作中不能达到实验目的的是( )
A.制取氨气 B.制取NaHCO3 C.分离NaHCO3 D.干燥NaHCO3
12.下列实验操作正确的是( )
选项 实验 操作
A 观察Na与H2O反应的现象 用镊子从煤油中取出金属钠,用滤纸吸去表面煤油,切下绿豆大小的钠,小心放入装有水的试管中
B 证明Na2O2与CO2反应是放热反应 Na2O2用棉花包裹,放入充满CO2的集气瓶中,棉花燃烧说明是放热反应
C 检验NaHCO3与Na2CO3溶液 用小试管分别取少量溶液,然后滴加澄清石灰水
D 检验Na2CO3与K2CO3溶液 用铂丝分别蘸取溶液,在酒精灯外焰上灼烧,直接观察火焰的颜色
13.下列说法中,错误的是( )
A.磷酸(H3PO4)的摩尔质量(以g·mol-1为单位)与6.02×1023个磷酸分子的质量(以g为单位)在数值上相等
B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14∶1
C.32 g氧气所含的原子数目为2×6.02×1023
D.常温常压下,0.5×6.02×1023个一氧化碳分子所占的体积是11.2 L
14.有Al2(SO4)3和Na2SO4的混合溶液V L,将它均分成两份。一份滴加氨水,使Al3+完全沉淀;另一份滴加BaCl2溶液,使SO完全沉淀。反应中消耗a mol NH3·H2O、b mol BaCl2。据此得知原混合液中的c(Na+)(mol·L-1)为( )
A.(4b-2a)/V B.(2b-2a)/V
C.(2b-a)/V D.(b-2a)/V
15.向200 mL Na2CO3和NaHCO3混合溶液中缓慢滴加0.1 mol·L-1稀盐酸,当加入的盐酸体积为100 mL后开始产生气体,加到a mL时测得产生的气体在标准状况下体积为0.672 L,继续滴加盐酸不再产生气体(不考虑气体的溶解)。下列说法不正确的是( )
A.a=400
B.原溶液中c(NaHCO3)=0.1 mol·L-1
C.滴加稀盐酸50 mL时,溶液中n(Na2CO3)∶n(NaHCO3)=1∶2
D.产生气体时反应的离子方程式为:H++HCO===CO2↑+H2O
二、填空题(本题包括5个小题,共55分)
16.(6分) (1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为________。
(2)在25 ℃、101 kPa的条件下,相同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A 气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为 ________。
17.(12分)标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是________。 (2)混合气体的平均摩尔质量是________。
(3)CO2和CO的体积之比是________。 (4)CO的体积分数是________。
(5)CO2和CO的质量之比是________。 (6)CO的质量分数是________。
(7)混合气体中所含氧原子的物质的量是______________。
(8)混合气体中所含碳原子的物质的量是______________。
18.(11分)298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。
(1)制备20.0 mL 0.10 mol·L-1的氨水,需向水中通入NH3的体积为________L(标准状况)。
(2)假设0.10 mol·L-1氨水的密度为0.95 g·cm-3,则该氨水的溶质质量分数约为________。
(3)使氨水恰好完全反应需盐酸的体积为_____________________mL。
(4)配制250 mL 0.10 mol·L-1的氨水,需5.0 mol·L-1的氨水________mL,配制时需要的仪器有______________________,配制过程中俯视刻度线定容,所配溶液浓度________(填“偏大”“偏小”或“不变”)。
19.(14分)如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉)。请回答下列问题:
(1)仪器A的名称是____________,烧瓶中反应的化学方程式是__________________。
(2)装置B中盛放的液体是__________,气体通过装置B的目的是__________________________。装置C中盛放的液体是____________,气体通过装置C的目的是____________________。
(3)D中反应的化学方程式是________________________________________________。
(4)烧杯E中盛放的液体是________,反应的离子方程式是_________________________。
(5)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应。为收集D中产物,在D与E之间,除增加收集装置外,还需要增加________装置。
20.(12分)人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如图实验步骤测定血液样品中Ca2+的浓度。
【配制KMnO4标准溶液】
如图所示是配制50 mL KMnO4标准溶液的过程示意图。
(1)请你观察图示判断,其中不正确的操作有________(填序号)。
(2)其中确定50 mL溶液体积的容器是__________(填名称)。
(3)如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
【测定血液样品中Ca2+的浓度】
抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)已知草酸跟KMnO4反应的离子方程式为2MnO+5H2C2O4+6H+===2Mnx++10CO2↑+8H2O,则方程式中的x=________。
(5)经过计算,血液样品中Ca2+的浓度为________mg/cm3。
1.答案:A
解析:过氧化钠能与二氧化碳反应,生成碳酸钠和氧气,使航天器返回舱中的二氧化碳浓度降低,保持舱内氧气具有适当的比例。
2.答案:D
解析:,Na燃烧生成的Na2O2能与CO2反应生成O2,因此金属钠着火时不能用泡沫灭火器灭火,应用沙土掩埋法灭火。
3.答案:B
解析:焰色试验是物理变化,A项错误;盐酸可以溶解氧化物等杂质,且易挥发,不会有残留,B项正确;K的焰色试验应透过蓝色钴玻璃观察,避免钠的焰色对钾的焰色产生干扰,其他元素不需要透过蓝色钴玻璃观察,C项错误;焰色试验是金属元素的性质,NaCl与Na2CO3固体的焰色试验都为黄色,无法利用焰色试验区分,D项错误。
4.答案:C
解析:钠燃烧时火焰呈黄色;Na与Cl2反应生成NaCl固体小颗粒出现白烟;NaOH溶液可与Cl2反应,常用于尾气吸收;Cl2可使石蕊溶液先变红后褪色。
5.答案:D
解析:2.4 g金属镁的物质的量为=0.1 mol,则0.1 mol Mg变成Mg2+失去0.2 mol电子,失去的电子数目为0.2NA,故A项错误;2 g氢气的物质的量为=1 mol,1个氢分子由2个氢原子构成,则所含原子数目为2NA,故B项错误;不是标准状况,无法计算11.2 L氮气的物质的量,故C项错误;17 g氨气的物质的量为=1 mol,1个氨气分子中含有10个电子,则1 mol NH3中所含电子数目为10NA,故D项正确。
6.答案:D
解析:根据方程式2H2O2H2↑+O2↑,分解0.02 mol水,可产生0.02 mol H2和0.01 mol O2,结合n===解答该题。
7.答案:B
解析:ρ(O2)=32 g·mol-1÷22.4 L·mol-1≈1.429 g·L-1,根据同温同压下同质量气体的密度之比等于体积的反比,可得ρ(混)≈1.5 g·L-1。
8.答案:D
解析:CH3COOH是弱酸,不能写成H+。
9.答案:D
解析:实验室用MnO2与浓盐酸共热反应制备Cl2,缺少酒精灯,故A错误;应通过饱和食盐水除去氯化氢,HCl与饱和碳酸氢钠溶液反应会生成CO2杂质,达不到除杂目的,故B错误;Cl2密度比空气大,用向上排空气法收集Cl2,应从长管通入气体,故C错误;Cl2有毒,需要用氢氧化钠溶液吸收,倒置的漏斗能够防止倒吸,故D正确。
10.答案:C
解析:该硫原子的相对原子质量Mr(S)==,①对;该硫原子的摩尔质量M(S)=a g×NA mol-1=aNA g·mol-1,③错;m g该硫原子的物质的量n(S)== mol,②对;a g硫原子即1个硫原子,其中所含电子数为16个,④错。
11.答案:D
解析:碳酸氢钠不稳定,不能直接加热干燥,可低温烘干。
12.答案:B
解析:钠与水的反应剧烈,试管管口太小,产生的氢气不能及时排出,有可能引起爆炸,反应不能在试管中进行,故A错误;可燃物燃烧的条件之一是温度达到着火点,Na2O2用棉花包裹,放入充满CO2的集气瓶中,棉花燃烧,说明过氧化钠和二氧化碳反应放出热量,导致棉花的温度达到着火点,故B正确;碳酸氢钠和碳酸钠都能与氢氧化钙反应生成碳酸钙沉淀,现象相同,所以不能用澄清石灰水鉴别碳酸氢钠和碳酸钠,故C错误;观察钾元素的焰色反应要透过蓝色钴玻璃,故D错误。
13.答案:D
解析:H3PO4的摩尔质量是98 g·mol-1,6.02×1023个H3PO4分子的质量是98 g,A正确;6.02×1023个分子是1 mol,故其质量之比是28∶2=14∶1,B正确;32 g氧气是1 mol,所含的原子数目为2×6.02×1023,C正确;0.5 mol气体在标准状况下的体积是11.2 L,而题目条件是“常温常压”,D错误。
14.答案:A
解析:根据题意Al3+的物质的量为a/3 mol,SO的物质的量为b mol,因Na2SO4和Al2(SO4)3的混合液不显电性,设每份混合溶液中Na+的物质的量为x mol,则根据电荷守恒可知,×3+x×1=b×2,x=2b-a,原混合溶液中的c(Na+)=(4b-2a)/V mol·L-1。
15.答案:C
解析:根据题意,向200 mL Na2CO3和NaHCO3混合溶液中缓慢滴加0.1 mol·L-1稀盐酸,从开始到加入的盐酸体积为100 mL时发生的反应为HCl+Na2CO3===NaHCO3+NaCl,此时消耗盐酸的物质的量为0.1 L×0.1 mol·L-1=0.01 mol,根据反应方程式可知,溶液中碳酸钠的物质的量为0.01 mol;则溶液中的碳酸钠全部转化为碳酸氢钠,再继续滴加盐酸时发生的反应为NaHCO3+HCl===NaCl+H2O+CO2↑,加到a mL时测得产生的气体在标准状况下体积为0.672 L,继续滴加盐酸不再产生气体时反应完全,产生的气体为二氧化碳,其物质的量为=0.03 mol,根据碳原子守恒,0.01 mol碳酸钠与盐酸完全反应生成二氧化碳的物质的量为0.01 mol,则原混合溶液中碳酸氢钠与盐酸完全反应生成的二氧化碳的物质的量为0.03 mol-0.01 mol=0.02 mol,则原混合溶液中碳酸氢钠的物质的量为0.02 mol,在原混合溶液中c(NaHCO3)==0.1 mol/L。根据分析,反应中产生的气体为二氧化碳,其物质的量为0.03 mol,根据反应NaHCO3+HCl===NaCl+H2O+CO2↑可知,消耗盐酸的物质的量为0.03 mol,则发生该反应消耗盐酸的体积为=0.3 L=300 mL,发生该反应前已经消耗100 mL盐酸,则a=300+100=400,故A正确;根据分析计算可知,原溶液中c(NaHCO3)=0.1 mol·L-1,故B正确;根据分析,原混合溶液中碳酸钠的物质的量为0.01mol,碳酸氢钠的物质的量为0.02mol,此时溶液中n(Na2CO3)∶n(NaHCO3)=1∶2,滴加稀盐酸50 mL 时,碳酸钠转化为碳酸氢钠,发生的反应为HCl+Na2CO3===NaHCO3+NaCl,消耗盐酸的物质的量为0.05 L×0.1 mol·L-1=0.005 mol,则溶液中生成0.005mol碳酸氢钠,消耗0.005mol碳酸钠,溶液中n(Na2CO3)∶n(NaHCO3)=(0.01-0.005) mol∶(0.02+0.005) mol=1∶5,故C错误;根据分析,产生气体时发生的化学反应为NaHCO3+HCl===NaCl+H2O+CO2↑,则反应的离子方程式为H++ HCO===CO2↑+H2O,故D正确。
16.答案: (1)64 (2)30 g·mol-1 (3)44 g·mol-1
解析:(1)n==0.03 mol,M==64 g·mol-1。(2)温度、压强相同时,气体体积之比等于其物质的量之比,15∶8=∶,M(A)=30 g·mol-1。(3)温度、体积相同时,气体压强之比等于其物质的量之比,4∶11=∶,M(A)=44 g·mol-1。
17.答案: (1)1.339 g·L-1 (2)30 g·mol-1 (3)1∶7 (4)87.5% (5)11∶49
(6)81.7% (7)0.562 5 mol (8)0.5 mol
解析:(1)ρ==≈1.339 g·L-1。(2)解法一:n==0.5 mol,M===30 g·mol-1。
解法二:M=ρ·Vm=1.339 g·L-1×22.4 L·mol-1≈30 g·mol-1。
(3)同温同压下,两种气体体积之比等于其物质的量之比,最简单的方法是用十字交叉法计算:
则=。(4)CO的体积分数=×100%=87.5%。(5)==。(6)CO的质量分数=×100%≈81.7%。 (7)n(O)=2n(CO2)+n(CO)=2×0.5 mol×+0.5 mol×=0.562 5 mol。(8)n(C)=n(CO2)+n(CO)=0.5 mol。
18.答案:(1)0.044 8 (2)0.18% (3)20.0
(4)5.0 量筒、烧杯、玻璃棒、250 mL容量瓶、胶头滴管 偏大
解析:(1)溶液中n(NH3)=0.10 mol·L-1×0.020 0 L=0.002 0 mol,V(NH3)=0.002 0 mol×22.4 L·mol-1=0.044 8 L。(2)根据公式c=,则w===0.18%。(3)使氨水完全反应,n(HCl)=n(NH3),则盐酸体积为20.0 mL。(4)根据稀释过程溶质的物质的量不变,则0.10 mol·L-1×0.25 L=5.0 mol·L-1×V,V=0.005 0 L=5.0 mL。定容时俯视刻度线,会使溶液的体积偏小,浓度偏大。
19.答案:(1)分液漏斗 4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O
(2)饱和NaCl溶液 吸收氯气中混有的杂质HCl 浓硫酸 吸收水蒸气,干燥氯气
(3)2Fe+3Cl2===2FeCl3
(4)NaOH溶液 2OH-+Cl2===Cl-+ClO-+H2O
(5)干燥
解析:(1)由题图可知,仪器A的名称为分液漏斗;烧瓶中发生反应的化学方程式为4HCl(浓)+MnO2+Cl2↑+2H2O+MnCl2(2)装置B中的试剂是饱和食盐水,作用是吸收氯气中混有的杂质HCl;装置C中盛放的液体是浓硫酸,作用是吸收水蒸气,干燥氯气。(3)D中反应的化学方程式是2Fe+3Cl2===2FeCl3。(4)烧杯E中盛放的液体是NaOH溶液;氯气与NaOH溶液反应的离子方程式是2OH-+Cl2===Cl-+ClO-+H2O。(5)由题给资料,为收集D中产物,在D与E之间,除增加收集装置外,还需要增加一个干燥装置。
20.答案: (1)②⑤ (2)50 mL容量瓶 (3)偏小 (4)2 (5)1.2
解析:(1)由图示可知②⑤操作不正确,②不能在量筒中溶解固体,⑤定容时应平视刻度线,至液体凹液面与刻度线相切。(2)应该用容量瓶准确确定50 mL溶液的体积。(3)如果用图示的操作配制溶液,由于定容时仰视刻度线,会使溶液体积偏大,所配制的溶液浓度将偏小。(4)根据电荷守恒,(-1)×2+(+1)×6=(+x)×2,解得x=2,草酸跟KMnO4反应的离子方程式为2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O。(5)血样20.00 mL经过上述处理后得到草酸,草酸消耗的高锰酸钾的物质的量为0.020 mol/L×0.012 L=2.4×10-4 mol,根据反应方程式2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O及草酸钙的化学式CaC2O4,可知:n(Ca2+)=n(H2C2O4)=n(MnO)=2.5×2.4×10-4 mol=6×10-4 mol,Ca2+的质量为40 g/mol×6×10-4 mol=0.024 g,钙离子的浓度为==1.2 mg/cm3。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
第二章 海水中的重要元素——钠和氯 章末单元 同步练习题
一、选择题(每小题只有一个正确选项,每小题3分,共45分)
1.“神舟”号载人航天器中,宇航员所在的返回舱都是密封的,宇航员吸入氧气,呼出二氧化碳,如果二氧化碳浓度过大,会使宇航员困乏,呼吸频率加快,严重的会窒息。为使二氧化碳浓度降低而保持舱内氧气的适当比例,可以在返回舱内放入 ( )
A.过氧化钠 B.碳酸钠
C.氢氧化钠 D.氧气瓶
2. 钠及其化合物与人们的生活密切相关,某同学对其认识不正确的是( )
A.碳酸氢钠常用于治疗胃酸过多症
B.Na2O2用作呼吸面具的供氧剂
C.发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
D.金属钠着火时,使用泡沫灭火器来灭火
3. 节日里燃放的五彩缤纷的烟花与高中化学中“焰色试验”知识相关。下列说法中正确的是( )
A.焰色试验是化学变化
B.用稀盐酸清洗做焰色试验的铂丝(镍丝或铁丝)
C.焰色试验均应透过蓝色钴玻璃观察
D.利用焰色试验可区分NaCl与Na2CO3固体
4. 某化学教师为“氯气与金属钠反应”设计了如图装置与操作以替代相关的课本实验。玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,待钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是( )
A.反应生成的大量白烟是氯化钠晶体
B.浸有NaOH溶液的棉花球用于吸收过量的氯气,以免其污染空气
C.钠着火燃烧产生苍白色火焰
D.在棉花球外沿滴一滴石蕊溶液,判断氯气是否被碱液完全吸收
5. 设NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.2.4 g金属镁变成镁离子时失去的电子数目为0.1NA
B.2 g氢气所含原子数目为NA
C.在25 ℃,压强为1.01×105 Pa时,11.2 L氮气所含的原子数目为NA
D.17 g氨气所含电子数目为10 NA
6. 利用太阳能分解水制氢,若分解0.02 mol水,下列说法正确的是( )
A.可生成H2的质量为0.02 g
B.可生成氢的原子数为2.408×1023个
C.可生成H2的体积为0.224 L(标准状况)
D.生成H2的量理论上等于0.04 mol Na与水反应产生H2的量
7. 在臭氧发生装置中装入氧气100 mL,经反应:3O22O3,最后气体体积变为95 mL(体积均在标准状况下测定),则混合气体的密度是( )
A.1.3 g·L-1 B.1.5 g·L-1
C.1.7 g·L-1 D.2.0 g·L-1
8. 下列有关离子方程式书写不正确的是( )
A.NaOH溶液吸收Cl2:Cl2+2OH-===ClO-+Cl-+H2O
B.过氧化钠和水反应:2Na2O2+2H2O===4Na++4OH-+O2↑
C.“84”消毒液与洁厕灵(主要成分为HCl)混用,产生有毒Cl2:2H++Cl-+ClO-===Cl2↑+H2O
D.“84”消毒液中加白醋生成HClO:H++ClO-===HClO
9. 在制备和收集Cl2的实验过程中,下列装置正确的是( )
10. 某硫原子的质量是a g,12C原子的质量是b g,若NA只表示阿伏加德罗常数的数值,则下列说法中正确的是( )
①该硫原子的相对原子质量为
②m g该硫原子的物质的量为 mol
③该硫原子的摩尔质量是aNA g
④a g该硫原子所含的电子数为16NA
A.①③ B.②④
C.①② D.②③
11.下列依据侯氏制碱原理制备少量NaHCO3的实验操作中不能达到实验目的的是( )
A.制取氨气 B.制取NaHCO3 C.分离NaHCO3 D.干燥NaHCO3
12.下列实验操作正确的是( )
选项 实验 操作
A 观察Na与H2O反应的现象 用镊子从煤油中取出金属钠,用滤纸吸去表面煤油,切下绿豆大小的钠,小心放入装有水的试管中
B 证明Na2O2与CO2反应是放热反应 Na2O2用棉花包裹,放入充满CO2的集气瓶中,棉花燃烧说明是放热反应
C 检验NaHCO3与Na2CO3溶液 用小试管分别取少量溶液,然后滴加澄清石灰水
D 检验Na2CO3与K2CO3溶液 用铂丝分别蘸取溶液,在酒精灯外焰上灼烧,直接观察火焰的颜色
13.下列说法中,错误的是( )
A.磷酸(H3PO4)的摩尔质量(以g·mol-1为单位)与6.02×1023个磷酸分子的质量(以g为单位)在数值上相等
B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14∶1
C.32 g氧气所含的原子数目为2×6.02×1023
D.常温常压下,0.5×6.02×1023个一氧化碳分子所占的体积是11.2 L
14.有Al2(SO4)3和Na2SO4的混合溶液V L,将它均分成两份。一份滴加氨水,使Al3+完全沉淀;另一份滴加BaCl2溶液,使SO完全沉淀。反应中消耗a mol NH3·H2O、b mol BaCl2。据此得知原混合液中的c(Na+)(mol·L-1)为( )
A.(4b-2a)/V B.(2b-2a)/V
C.(2b-a)/V D.(b-2a)/V
15.向200 mL Na2CO3和NaHCO3混合溶液中缓慢滴加0.1 mol·L-1稀盐酸,当加入的盐酸体积为100 mL后开始产生气体,加到a mL时测得产生的气体在标准状况下体积为0.672 L,继续滴加盐酸不再产生气体(不考虑气体的溶解)。下列说法不正确的是( )
A.a=400
B.原溶液中c(NaHCO3)=0.1 mol·L-1
C.滴加稀盐酸50 mL时,溶液中n(Na2CO3)∶n(NaHCO3)=1∶2
D.产生气体时反应的离子方程式为:H++HCO===CO2↑+H2O
二、填空题(本题包括5个小题,共55分)
16.(6分) (1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为________。
(2)在25 ℃、101 kPa的条件下,相同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A 气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为 ________。
17.(12分)标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是________。 (2)混合气体的平均摩尔质量是________。
(3)CO2和CO的体积之比是________。 (4)CO的体积分数是________。
(5)CO2和CO的质量之比是________。 (6)CO的质量分数是________。
(7)混合气体中所含氧原子的物质的量是______________。
(8)混合气体中所含碳原子的物质的量是______________。
18.(11分)298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。
(1)制备20.0 mL 0.10 mol·L-1的氨水,需向水中通入NH3的体积为________L(标准状况)。
(2)假设0.10 mol·L-1氨水的密度为0.95 g·cm-3,则该氨水的溶质质量分数约为________。
(3)使氨水恰好完全反应需盐酸的体积为_____________________mL。
(4)配制250 mL 0.10 mol·L-1的氨水,需5.0 mol·L-1的氨水________mL,配制时需要的仪器有______________________,配制过程中俯视刻度线定容,所配溶液浓度________(填“偏大”“偏小”或“不变”)。
19.(14分)如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉)。请回答下列问题:
(1)仪器A的名称是____________,烧瓶中反应的化学方程式是__________________。
(2)装置B中盛放的液体是__________,气体通过装置B的目的是__________________________。装置C中盛放的液体是____________,气体通过装置C的目的是____________________。
(3)D中反应的化学方程式是________________________________________________。
(4)烧杯E中盛放的液体是________,反应的离子方程式是_________________________。
(5)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应。为收集D中产物,在D与E之间,除增加收集装置外,还需要增加________装置。
20.(12分)人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如图实验步骤测定血液样品中Ca2+的浓度。
【配制KMnO4标准溶液】
如图所示是配制50 mL KMnO4标准溶液的过程示意图。
(1)请你观察图示判断,其中不正确的操作有________(填序号)。
(2)其中确定50 mL溶液体积的容器是__________(填名称)。
(3)如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
【测定血液样品中Ca2+的浓度】
抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)已知草酸跟KMnO4反应的离子方程式为2MnO+5H2C2O4+6H+===2Mnx++10CO2↑+8H2O,则方程式中的x=________。
(5)经过计算,血液样品中Ca2+的浓度为________mg/cm3。
1.答案:A
解析:过氧化钠能与二氧化碳反应,生成碳酸钠和氧气,使航天器返回舱中的二氧化碳浓度降低,保持舱内氧气具有适当的比例。
2.答案:D
解析:,Na燃烧生成的Na2O2能与CO2反应生成O2,因此金属钠着火时不能用泡沫灭火器灭火,应用沙土掩埋法灭火。
3.答案:B
解析:焰色试验是物理变化,A项错误;盐酸可以溶解氧化物等杂质,且易挥发,不会有残留,B项正确;K的焰色试验应透过蓝色钴玻璃观察,避免钠的焰色对钾的焰色产生干扰,其他元素不需要透过蓝色钴玻璃观察,C项错误;焰色试验是金属元素的性质,NaCl与Na2CO3固体的焰色试验都为黄色,无法利用焰色试验区分,D项错误。
4.答案:C
解析:钠燃烧时火焰呈黄色;Na与Cl2反应生成NaCl固体小颗粒出现白烟;NaOH溶液可与Cl2反应,常用于尾气吸收;Cl2可使石蕊溶液先变红后褪色。
5.答案:D
解析:2.4 g金属镁的物质的量为=0.1 mol,则0.1 mol Mg变成Mg2+失去0.2 mol电子,失去的电子数目为0.2NA,故A项错误;2 g氢气的物质的量为=1 mol,1个氢分子由2个氢原子构成,则所含原子数目为2NA,故B项错误;不是标准状况,无法计算11.2 L氮气的物质的量,故C项错误;17 g氨气的物质的量为=1 mol,1个氨气分子中含有10个电子,则1 mol NH3中所含电子数目为10NA,故D项正确。
6.答案:D
解析:根据方程式2H2O2H2↑+O2↑,分解0.02 mol水,可产生0.02 mol H2和0.01 mol O2,结合n===解答该题。
7.答案:B
解析:ρ(O2)=32 g·mol-1÷22.4 L·mol-1≈1.429 g·L-1,根据同温同压下同质量气体的密度之比等于体积的反比,可得ρ(混)≈1.5 g·L-1。
8.答案:D
解析:CH3COOH是弱酸,不能写成H+。
9.答案:D
解析:实验室用MnO2与浓盐酸共热反应制备Cl2,缺少酒精灯,故A错误;应通过饱和食盐水除去氯化氢,HCl与饱和碳酸氢钠溶液反应会生成CO2杂质,达不到除杂目的,故B错误;Cl2密度比空气大,用向上排空气法收集Cl2,应从长管通入气体,故C错误;Cl2有毒,需要用氢氧化钠溶液吸收,倒置的漏斗能够防止倒吸,故D正确。
10.答案:C
解析:该硫原子的相对原子质量Mr(S)==,①对;该硫原子的摩尔质量M(S)=a g×NA mol-1=aNA g·mol-1,③错;m g该硫原子的物质的量n(S)== mol,②对;a g硫原子即1个硫原子,其中所含电子数为16个,④错。
11.答案:D
解析:碳酸氢钠不稳定,不能直接加热干燥,可低温烘干。
12.答案:B
解析:钠与水的反应剧烈,试管管口太小,产生的氢气不能及时排出,有可能引起爆炸,反应不能在试管中进行,故A错误;可燃物燃烧的条件之一是温度达到着火点,Na2O2用棉花包裹,放入充满CO2的集气瓶中,棉花燃烧,说明过氧化钠和二氧化碳反应放出热量,导致棉花的温度达到着火点,故B正确;碳酸氢钠和碳酸钠都能与氢氧化钙反应生成碳酸钙沉淀,现象相同,所以不能用澄清石灰水鉴别碳酸氢钠和碳酸钠,故C错误;观察钾元素的焰色反应要透过蓝色钴玻璃,故D错误。
13.答案:D
解析:H3PO4的摩尔质量是98 g·mol-1,6.02×1023个H3PO4分子的质量是98 g,A正确;6.02×1023个分子是1 mol,故其质量之比是28∶2=14∶1,B正确;32 g氧气是1 mol,所含的原子数目为2×6.02×1023,C正确;0.5 mol气体在标准状况下的体积是11.2 L,而题目条件是“常温常压”,D错误。
14.答案:A
解析:根据题意Al3+的物质的量为a/3 mol,SO的物质的量为b mol,因Na2SO4和Al2(SO4)3的混合液不显电性,设每份混合溶液中Na+的物质的量为x mol,则根据电荷守恒可知,×3+x×1=b×2,x=2b-a,原混合溶液中的c(Na+)=(4b-2a)/V mol·L-1。
15.答案:C
解析:根据题意,向200 mL Na2CO3和NaHCO3混合溶液中缓慢滴加0.1 mol·L-1稀盐酸,从开始到加入的盐酸体积为100 mL时发生的反应为HCl+Na2CO3===NaHCO3+NaCl,此时消耗盐酸的物质的量为0.1 L×0.1 mol·L-1=0.01 mol,根据反应方程式可知,溶液中碳酸钠的物质的量为0.01 mol;则溶液中的碳酸钠全部转化为碳酸氢钠,再继续滴加盐酸时发生的反应为NaHCO3+HCl===NaCl+H2O+CO2↑,加到a mL时测得产生的气体在标准状况下体积为0.672 L,继续滴加盐酸不再产生气体时反应完全,产生的气体为二氧化碳,其物质的量为=0.03 mol,根据碳原子守恒,0.01 mol碳酸钠与盐酸完全反应生成二氧化碳的物质的量为0.01 mol,则原混合溶液中碳酸氢钠与盐酸完全反应生成的二氧化碳的物质的量为0.03 mol-0.01 mol=0.02 mol,则原混合溶液中碳酸氢钠的物质的量为0.02 mol,在原混合溶液中c(NaHCO3)==0.1 mol/L。根据分析,反应中产生的气体为二氧化碳,其物质的量为0.03 mol,根据反应NaHCO3+HCl===NaCl+H2O+CO2↑可知,消耗盐酸的物质的量为0.03 mol,则发生该反应消耗盐酸的体积为=0.3 L=300 mL,发生该反应前已经消耗100 mL盐酸,则a=300+100=400,故A正确;根据分析计算可知,原溶液中c(NaHCO3)=0.1 mol·L-1,故B正确;根据分析,原混合溶液中碳酸钠的物质的量为0.01mol,碳酸氢钠的物质的量为0.02mol,此时溶液中n(Na2CO3)∶n(NaHCO3)=1∶2,滴加稀盐酸50 mL 时,碳酸钠转化为碳酸氢钠,发生的反应为HCl+Na2CO3===NaHCO3+NaCl,消耗盐酸的物质的量为0.05 L×0.1 mol·L-1=0.005 mol,则溶液中生成0.005mol碳酸氢钠,消耗0.005mol碳酸钠,溶液中n(Na2CO3)∶n(NaHCO3)=(0.01-0.005) mol∶(0.02+0.005) mol=1∶5,故C错误;根据分析,产生气体时发生的化学反应为NaHCO3+HCl===NaCl+H2O+CO2↑,则反应的离子方程式为H++ HCO===CO2↑+H2O,故D正确。
16.答案: (1)64 (2)30 g·mol-1 (3)44 g·mol-1
解析:(1)n==0.03 mol,M==64 g·mol-1。(2)温度、压强相同时,气体体积之比等于其物质的量之比,15∶8=∶,M(A)=30 g·mol-1。(3)温度、体积相同时,气体压强之比等于其物质的量之比,4∶11=∶,M(A)=44 g·mol-1。
17.答案: (1)1.339 g·L-1 (2)30 g·mol-1 (3)1∶7 (4)87.5% (5)11∶49
(6)81.7% (7)0.562 5 mol (8)0.5 mol
解析:(1)ρ==≈1.339 g·L-1。(2)解法一:n==0.5 mol,M===30 g·mol-1。
解法二:M=ρ·Vm=1.339 g·L-1×22.4 L·mol-1≈30 g·mol-1。
(3)同温同压下,两种气体体积之比等于其物质的量之比,最简单的方法是用十字交叉法计算:
则=。(4)CO的体积分数=×100%=87.5%。(5)==。(6)CO的质量分数=×100%≈81.7%。 (7)n(O)=2n(CO2)+n(CO)=2×0.5 mol×+0.5 mol×=0.562 5 mol。(8)n(C)=n(CO2)+n(CO)=0.5 mol。
18.答案:(1)0.044 8 (2)0.18% (3)20.0
(4)5.0 量筒、烧杯、玻璃棒、250 mL容量瓶、胶头滴管 偏大
解析:(1)溶液中n(NH3)=0.10 mol·L-1×0.020 0 L=0.002 0 mol,V(NH3)=0.002 0 mol×22.4 L·mol-1=0.044 8 L。(2)根据公式c=,则w===0.18%。(3)使氨水完全反应,n(HCl)=n(NH3),则盐酸体积为20.0 mL。(4)根据稀释过程溶质的物质的量不变,则0.10 mol·L-1×0.25 L=5.0 mol·L-1×V,V=0.005 0 L=5.0 mL。定容时俯视刻度线,会使溶液的体积偏小,浓度偏大。
19.答案:(1)分液漏斗 4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O
(2)饱和NaCl溶液 吸收氯气中混有的杂质HCl 浓硫酸 吸收水蒸气,干燥氯气
(3)2Fe+3Cl2===2FeCl3
(4)NaOH溶液 2OH-+Cl2===Cl-+ClO-+H2O
(5)干燥
解析:(1)由题图可知,仪器A的名称为分液漏斗;烧瓶中发生反应的化学方程式为4HCl(浓)+MnO2+Cl2↑+2H2O+MnCl2(2)装置B中的试剂是饱和食盐水,作用是吸收氯气中混有的杂质HCl;装置C中盛放的液体是浓硫酸,作用是吸收水蒸气,干燥氯气。(3)D中反应的化学方程式是2Fe+3Cl2===2FeCl3。(4)烧杯E中盛放的液体是NaOH溶液;氯气与NaOH溶液反应的离子方程式是2OH-+Cl2===Cl-+ClO-+H2O。(5)由题给资料,为收集D中产物,在D与E之间,除增加收集装置外,还需要增加一个干燥装置。
20.答案: (1)②⑤ (2)50 mL容量瓶 (3)偏小 (4)2 (5)1.2
解析:(1)由图示可知②⑤操作不正确,②不能在量筒中溶解固体,⑤定容时应平视刻度线,至液体凹液面与刻度线相切。(2)应该用容量瓶准确确定50 mL溶液的体积。(3)如果用图示的操作配制溶液,由于定容时仰视刻度线,会使溶液体积偏大,所配制的溶液浓度将偏小。(4)根据电荷守恒,(-1)×2+(+1)×6=(+x)×2,解得x=2,草酸跟KMnO4反应的离子方程式为2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O。(5)血样20.00 mL经过上述处理后得到草酸,草酸消耗的高锰酸钾的物质的量为0.020 mol/L×0.012 L=2.4×10-4 mol,根据反应方程式2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O及草酸钙的化学式CaC2O4,可知:n(Ca2+)=n(H2C2O4)=n(MnO)=2.5×2.4×10-4 mol=6×10-4 mol,Ca2+的质量为40 g/mol×6×10-4 mol=0.024 g,钙离子的浓度为==1.2 mg/cm3。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
