必修第一册 4.2 第1课时 元素性质的周期性变化规律 同步练习题(含解析)
文档属性
| 名称 | 必修第一册 4.2 第1课时 元素性质的周期性变化规律 同步练习题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 916.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-27 10:34:31 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
4.2 第1课时 元素性质的周期性变化规律 同步练习题
一、选择题(每小题只有一个正确选项,每小题4分,共60分)
1. 下列说法正确的是( )
A.在元素周期表中金属与非金属分界线左边的元素均为金属元素
B.Na、Mg、Al的还原性依次减弱
C.F、Cl、Br的非金属性依次增强
D.NaOH、KOH、Mg(OH)2的碱性依次减弱
2. 下列事实不能作为实验判断依据的是( )
A.钠和镁分别与冷水反应,判断钠和镁的金属活动性强弱
B.在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属活动性强弱
C.硫酸和硅酸钠溶液反应出现白色沉淀,判断硫与硅的非金属活动性强弱
D.Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱
3. 根据元素周期律,由下列事实进行推测,其中推测不合理的是( )
选项 事实 推测
A Mg与冷水反应缓慢,Ca与冷水反应较快 Ba(该元素位于第六周期第ⅡA族)与冷水反应会更快
B Si是半导体材料,同族的Ge也是半导体材料 第ⅣA族的元素都是半导体材料
C HCl在1 500 ℃时分解,HI在230 ℃时分解 HBr的分解温度介于二者之间
D Si与H2高温时反应,S与H2加热能反应 P与H2在高温时能反应
4. 居室装修用的石材放射性的监测常用Ra作为标准,居里夫人因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是( )
A.一个Ra原子中含有138个中子
B.Ra元素位于元素周期表中第六周期第ⅡA族
C.RaCO3不能与盐酸反应
D.Ra(OH)2是一种两性氢氧化物
5. 如图是元素周期表的一部分,下列说法中正确的是( )
A.元素①位于第二周期ⅣA族
B.气态氢化物的稳定性:④>②
C.最高价氧化物对应水化物的酸性:⑤>④
D.元素的最高正化合价:③=⑤
6. 第ⅡA族元素从第二周期到第六周期的元素分别是Be(铍)、Mg(镁)、Ca(钙)、Sr(锶)、Ba(钡)。下列关于第ⅡA族元素预言可能正确的是( )
①常温下,单质铍能与水剧烈反应放出H2 ②常温下,单质钡能与水剧烈反应放出H2 ③Be(OH)2易溶于水 ④Ba(OH)2易溶于水 ⑤SrCO3易溶于水
A.①②③ B.③⑤
C.②④ D.①②③④⑤
7. 下列叙述中正确的是( )
A.进行H2O和H2S的热分解实验,可确定S、O两种元素的非金属性强弱
B.根据非金属性:F>Cl,可以推测沸点:HF>HCl
C.已知H2CO3的酸性比HClO的酸性强,说明C的非金属性比Cl强
D.若已知H2SO3的酸性比H2CO3的酸性强, 则说明S的非金属性比C强
8. 根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D.Cl与Cl得电子能力相同
9. 下列关于Na、Mg、Cl、Br元素及其化合物的说法正确的是( )
A.NaOH的碱性比Mg(OH)2的强
B.Cl2得到电子的能力比Br2的弱
C.原子半径r: r(Br)>r(Cl)>r(Mg)>r(Na)
D.原子的最外层电子数n: n(Na)<n(Mg)<n(Cl)<n(Br)
10.下列关于元素周期表和元素性质的叙述正确的是( )
A.质子数相同的微粒之间一定互称同位素
B.ⅠA族与ⅦA族元素间形成的化合物一定是离子化合物
C.同主族元素的简单阴离子半径越大,其单质氧化性越弱
D.同周期金属元素的化合价越高,其氢氧化物的碱性越强
11.A、B、C均为短周期元素,A、B同周期,其原子核外有三个电子层,A、C的最低价阴离子分别为A2 和C ,B2+和C 具有相同的电子层结构,下列说法中正确的是( )
A.A元素的最高正价不可能是+6价
B.原子半径:B>A>C
C.离子半径:B2+>C >A2
D.氧化性:C<A
12.下列叙述中,金属a 的活泼性肯定比金属b 的活泼性强的是( )
A.a原子的最外层电子数比B原子的最外层电子数少
B.常温时,a能从水中置换出氢,而b不能
C.1 mol a从酸中置换H+生成的H2比l mol b从酸中置换H+生成的H2多
D.a原子电子层数比b原子的电子层数多
13.科学家根据元素周期律和原子结构理论预测,原子序数为114的元素位于第七周期第ⅣA族,称为类铅元素。下面关于它的原子结构和性质的预测正确的是( )
A.类铅元素原子的最外层电子数为6
B.其常见价态为+2、+3、+4
C.它的金属性比铅强
D.它的原子半径比铅小
14.运用元素周期律分析下面的判断,其中错误的是( )
A.铍(Be)的氧化物的水化物可能具有两性
B.砹(At)为白色固体,HAt不稳定,AgAt感光性很强
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.硒化氢(H2Se)无色、有毒,比H2S更不稳定
15.下列结论错误的是( )
①微粒半径:K+>Al3+>S2->Cl- ②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO4 ⑥非金属性:O>N>P>Si
⑦金属性:BeA.只有① B.①③⑤ C.②④⑤⑥⑦ D.②④⑥
二、填空题(本题包括3个小题,共40分)
16.(12分)现有部分元素的性质与原子(或分子)结构如下表:
元素编号 元素性质与原子(或分子)结构
T 最外层电子数是次外层电子数的3倍
X 常温下单质为双原子分子,分子中含有3对共用电子对
Y M层比K层少1个电子
Z 第三周期元素的简单离子中半径最小
(1)写出元素T的原子结构示意图: _______________。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示)。下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物对应的水化物的碱性比Z强
(3)写出T与Y形成的化合物的化学式______________________。
(4)元素T和氢元素以原子个数比1∶1化合形成化合物Q,元素X与氢元素以原子个数比1∶2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:____________________________。
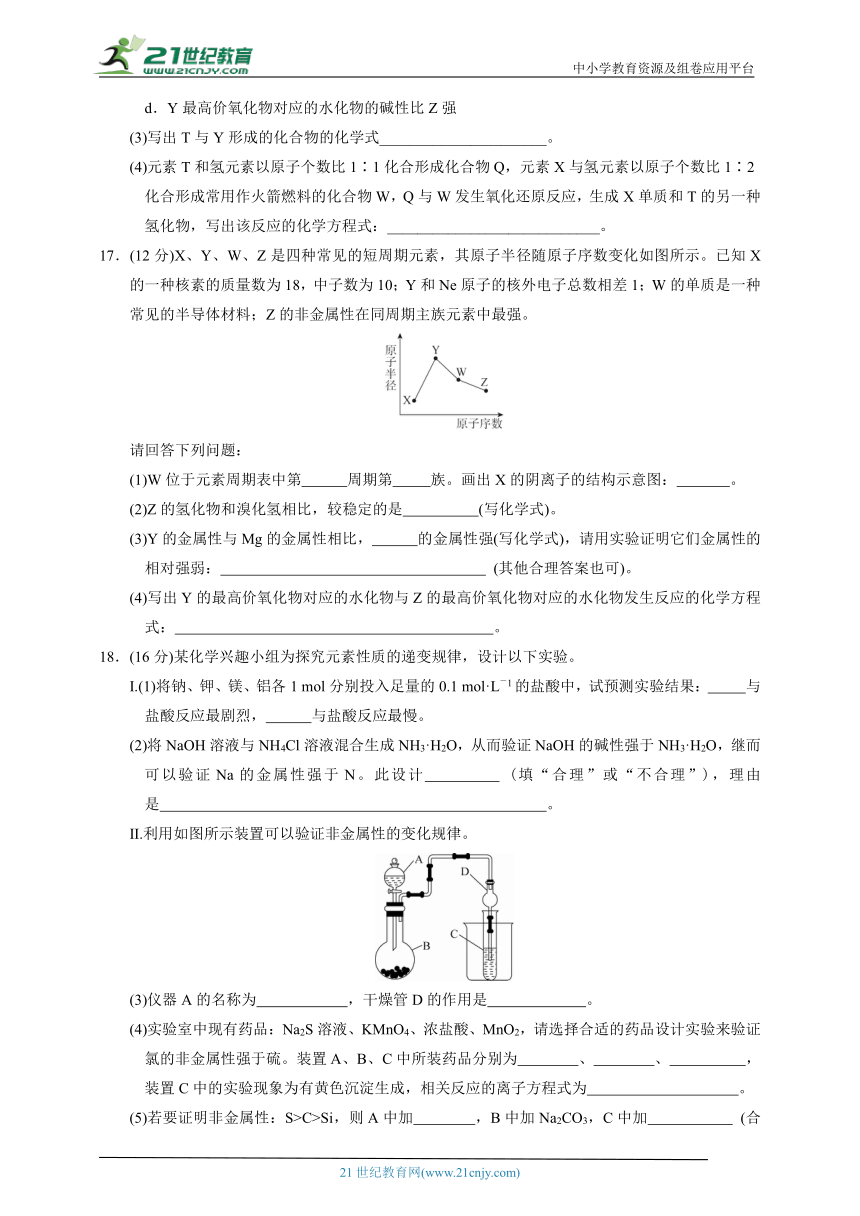
17.(12分)X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知X的一种核素的质量数为18,中子数为10;Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强。
请回答下列问题:
(1)W位于元素周期表中第 周期第 族。画出X的阴离子的结构示意图: 。
(2)Z的氢化物和溴化氢相比,较稳定的是 (写化学式)。
(3)Y的金属性与Mg的金属性相比, 的金属性强(写化学式),请用实验证明它们金属性的相对强弱: (其他合理答案也可)。
(4)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物发生反应的化学方程式: 。
18.(16分)某化学兴趣小组为探究元素性质的递变规律,设计以下实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入足量的0.1 mol·L-1的盐酸中,试预测实验结果: 与盐酸反应最剧烈, 与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性强于NH3·H2O,继而可以验证Na的金属性强于N。此设计 (填“合理”或“不合理”),理由是 。
Ⅱ.利用如图所示装置可以验证非金属性的变化规律。
(3)仪器A的名称为 ,干燥管D的作用是 。
(4)实验室中现有药品:Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置A、B、C中所装药品分别为 、 、 ,装置C中的实验现象为有黄色沉淀生成,相关反应的离子方程式为 。
(5)若要证明非金属性:S>C>Si,则A中加 ,B中加Na2CO3,C中加 (合理即可),观察到C中的现象为 。
1.答案:B
解析:在元素周期表中金属在分界线左边,但分界线左边的并不都是金属元素,如氢元素,A错;Na、Mg、Al位于同一周期,根据元素周期律,其还原性依次减弱,B正确;F、Cl、Br位于同一主族,根据元素周期律,其非金属性依次减弱,C错;K的金属性强于Na,KOH碱性强于NaOH,D错。
2.答案:B
解析:A、钠与冷水比镁与冷水反应剧烈,因此钠的金属性强于镁,A正确;B、在MgCl2与AlCl3溶液中分别加入过量的氨水,均生成白色沉淀,现象相同,不能判断镁与铝的金属活动性强弱,B错误;C、硫酸和硅酸钠溶液反应出现白色沉淀,证明硫酸的酸性比硅酸强,所以能判断硫与硅的非金属活动性强弱,C正确;D、卤素单质与氢气化合越容易,非金属性越强,因此可以利用Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱,D正确;答案选B。
3.答案:B
解析:镁、钙和钡同主族,根据同主族元素从上到下金属性逐渐增强,则钡与冷水反应会更快,A选项正确;硅和锗都是常用的半导体材料,但同主族的碳和铅不具备此特点,B选项错误;氯、溴和碘同主族,根据同主族元素从上到下非金属氢化物稳定性逐渐减弱可知,C选项正确;硅、磷和硫同周期,根据同周期元素从左到右非金属单质与氢气反应的条件要求逐渐降低可知,D选项正确。
4.答案:B
解析:A对,由质量数等于质子数与中子数之和可知1个该原子中含有的中子数是226-88=138。B错,由第六周期的0族元素氡的原子序数为86可知,该元素位于第七周期第ⅡA族。C错,Ra在Ba的下面,其碳酸盐应与CaCO3、BaCO3性质相似,能与盐酸反应。D错,主族元素从上到下金属性依次增强,故Ra元素金属性较强,其最高价氧化物对应的水化物碱性也较强,不会具有两性。
5.答案:B
解析:对照元素周期表可确定①、②、③、④、⑤分别是N、O、F、S、Cl。元素①是N,位于第二周期第ⅤA族,A项错误;S的非金属性比O弱,因此H2S的热稳定性比H2O弱,B项错误;Cl的非金属性比S强,HClO4的酸性大于H2SO4,C项正确;Cl的最高正化合价为+7价,F没有正化合价,D项错误。
6.答案:C
解析:同主族从上到下,金属性逐渐增强,与水反应越来越剧烈,即常温下,单质钡能与水剧烈反应放出H2,①错误,②正确;Mg(OH)2难溶于水,Ca(OH)2微溶于水,推出Be(OH)2 难溶于水,③错误;Ba(OH)2是易溶于水的强碱,④正确;根据MgCO3、CaCO3、BaCO3难溶于水,因此SrCO3难溶于水,⑤错误。
7.答案:A
解析:A项,非金属性越强,简单氢化物的稳定性越强,进行H2O和H2S的热分解实验可确定S、O两种元素的非金属性强弱,正确;B项,非金属性强弱与氢化物的沸点没有关系,错误;C项,非金属性越强,最高价氧化物对应水化物酸性越强,HClO不是最高价含氧酸,不能直接比较,错误;D项,尽管H2SO3的酸性比H2CO3的酸性强,但H2SO3不是最高价含氧酸,不能说明S的非金属性比C强,错误。
8.答案:D
解析:同主族元素最高价含氧酸的酸性随核电荷数的增加而减弱,A项错误;核外电子排布相同的微粒化学性质不一定相同,如S2-、Ar、K+,B项错误;半径大小S2->Cl->K+>Ca2+,C项错误;Cl与Cl互为同位素,化学性质相同,D项正确。
9.答案:A
解析: A.同周期自左至右金属性减弱,所以金属性Na>Mg,则碱性NaOH>Mg(OH)2,故A正确;B.同主族元素自上而下非金属性减弱,所以非金属性Cl>Br,所以Cl2得电子的能力比Br2强,故B错误;C.电子层数越多原子半径越大,电子层数相同,核电荷数越小原子半径越大,所以原子半径:r(Br)>r(Na)>r(Mg)>r(Cl),故C错误;D.Cl和Br为同主族元素,最外层电子数相等,故D错误。
10.答案:C
解析:A、微粒包括分子、原子、离子等,如H2O、NH3分子质子数相同,但不是同位素,错误;B、ⅠA族与ⅦA族元素间形成的化合物也有可能为共价化合物,如HF、HCl、HBr等,错误;C、同主族元素的简单阴离子半径越大,说明元素的原子序数越大,其单质氧化性越弱,正确;D、同周期金属元素的化合价越高,其氢氧化物的碱性越弱,错误。
11.答案:B
解析:由A、C的最低价离子分别为A2 和C ,则A为ⅥA族元素,C为ⅦA族元素,B2+和C 具有相同的电子层结构,则B在C的下一周期,则B为Mg元素,C为F元素,A、B同周期,则A为S元素。据此解答。A.A为S元素,S元素的最高正化合价为+6,故A错误;B.A为S元素,B为Mg元素,C为F元素,同周期原子半径从左到右逐渐减小,电子层数越多,半径越大,则原子半径为B>A>C,故B正确;C.离子的电子层数越多,半径越大,具有相同核外电子结构的离子,核电荷数越大,半径越小,所以离子半径为A2 >C >B2+,故C错误;D.元素的非金属性越强,单质的氧化性越强,氧化性为C>A,故D错误;故选B。
12.答案:B
解析:A、最外层电子数少的金属金属性不一定比最外层电子数多的金属性强,如锂比钙弱,选项A错误;B、金属的活泼性越强,越易与水反应,常温时,a能从水中置换出氢,而b不能,说明金属的活泼性a比b活泼,选项B正确;C、产生氢气的多少取决于金属失去电子数的多少,金属的活泼性与得失电子难易有关,与得失电子数目多少无关,选项C错误;D、如金属不位于同一主族,则不能根据电子层数的多少来判断金属的活泼性强弱,选项D错误。答案选B。
13.答案:C
解析:114号元素位于第ⅣA族,最外层电子数应该是4个,A项错;C、Si、Pb的常见正价有+2、+4价,没有+3价,B项错;同主族元素的金属性由上至下逐渐增强,C项正确;该元素的电子层数比Pb多,原子半径比Pb大,D项错。
14.答案:B
解析:对角线处的元素具有相似的性质,Al(OH)3是两性氢氧化物,所以Be(OH)2有可能是两性氢氧化物,A项正确;卤素单质的颜色由上至下逐渐加深,因而At单质的颜色不能是白色固体,B项错;Sr与Ba、Ca同主族,对应的硫酸盐应具有相似的溶解性,C项正确;Se与S位于ⅥA族,非金属性比S弱,因此H2Se比H2S更不稳定,D项正确。
15.答案:B
解析:①中微粒半径应为S2->Cl->K+>Al3+;③中离子还原性应为S2->I->Br->Cl-;⑤中非金属性Cl>S>P>C,故其最高价氧化物对应水化物的酸性应为:HClO4>H2SO4>H3PO4>H2CO3;①③⑤错,故选B。
16.答案:15.(1) (2)Na cd (3)Na2O、Na2O2 (4)N2H4+2H2O2===N2+4H2O
解析:T元素最外层电子数是次外层电子数的3倍,故T元素为氧;元素X常温下单质为双原子分子,分子中含有3对共用电子对,应为N2,故X元素为氮;Y元素M层比K层少1个电子,应为钠;Z元素第三周期元素的简单离子中半径最小的为三价铝离子,故Z元素为铝。
17.答案:(1) 三 ⅣA (2) HCl
(3) Na Na与冷水剧烈反应,而Mg与冷水反应较慢
(4) NaOH+HClO4===NaClO4+H2O
解析:X、Y、W、Z是四种常见的短周期元素,已知X的一种核素的质量数为18,中子数为10,则X元素原子的质子数为18-10=8,故X为O元素;Y和Ne原子的核外电子数相差1,Y为Na或F元素,由题图可知,Y原子半径大于氧原子,故Y为Na元素;W的单质是一种常见的半导体材料,原子序数大于Na元素,故W为Si元素;Z的非金属性在同周期主族元素中最强,故Z为Cl元素。(1)W为Si元素,原子核外电子数为14,有3个电子层,最外层电子数为4,处于周期表中第三周期第ⅣA族。(2)Z为Cl元素,由于元素的非金属性:Cl>Br,故氢化物稳定性:HCl>HBr,即较稳定的是HCl。(3)同周期元素随原子序数增大原子半径减小,原子失去电子的能力逐渐减弱,元素的金属性逐渐减弱,所以金属性:Na>Mg;元素的金属性越强,其单质与水或酸反应置换出氢气就越容易,所以可以通过Na与冷水剧烈反应,而Mg与冷水反应较慢证明元素的金属性强弱。(4)Y的最高价氧化物对应的水化物NaOH是强碱,Z的最高价氧化物对应的水化物HClO4是一元强酸,二者发生酸碱中和反应,生成NaClO4和H2O,发生反应的化学方程式是NaOH+HClO4===NaClO4+H2O。
18.答案:Ⅰ.(1) 钾 铝 (2)不合理 N为活泼非金属元素,不表现金属性
(3)防止倒吸
(4)实浓盐酸、KMnO4、Na2S溶液 S2-+Cl2===S↓+2Cl-
(5)稀硫酸 Na2SiO3溶液有白色沉淀产生
解析:(1)金属活动性顺序是钾>钠>镁>铝,因此与盐酸反应,钾最剧烈,铝相对最缓慢。(3)进行气体性质实验时需要注意防止倒吸。(4)由题中所给药品可知,可用Na2S与氯气发生置换反应来判断Cl与S非金属性的强弱,因为无加热装置,所以只能选择KMnO4与浓盐酸反应制取氯气。(5)由B中药品为Na2CO3可知,用最高价氧化物对应水化物的酸性强弱判断对应元素的非金属性强弱,所以A中加入稀硫酸,C中可加入Na2SiO3溶液。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
4.2 第1课时 元素性质的周期性变化规律 同步练习题
一、选择题(每小题只有一个正确选项,每小题4分,共60分)
1. 下列说法正确的是( )
A.在元素周期表中金属与非金属分界线左边的元素均为金属元素
B.Na、Mg、Al的还原性依次减弱
C.F、Cl、Br的非金属性依次增强
D.NaOH、KOH、Mg(OH)2的碱性依次减弱
2. 下列事实不能作为实验判断依据的是( )
A.钠和镁分别与冷水反应,判断钠和镁的金属活动性强弱
B.在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属活动性强弱
C.硫酸和硅酸钠溶液反应出现白色沉淀,判断硫与硅的非金属活动性强弱
D.Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱
3. 根据元素周期律,由下列事实进行推测,其中推测不合理的是( )
选项 事实 推测
A Mg与冷水反应缓慢,Ca与冷水反应较快 Ba(该元素位于第六周期第ⅡA族)与冷水反应会更快
B Si是半导体材料,同族的Ge也是半导体材料 第ⅣA族的元素都是半导体材料
C HCl在1 500 ℃时分解,HI在230 ℃时分解 HBr的分解温度介于二者之间
D Si与H2高温时反应,S与H2加热能反应 P与H2在高温时能反应
4. 居室装修用的石材放射性的监测常用Ra作为标准,居里夫人因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是( )
A.一个Ra原子中含有138个中子
B.Ra元素位于元素周期表中第六周期第ⅡA族
C.RaCO3不能与盐酸反应
D.Ra(OH)2是一种两性氢氧化物
5. 如图是元素周期表的一部分,下列说法中正确的是( )
A.元素①位于第二周期ⅣA族
B.气态氢化物的稳定性:④>②
C.最高价氧化物对应水化物的酸性:⑤>④
D.元素的最高正化合价:③=⑤
6. 第ⅡA族元素从第二周期到第六周期的元素分别是Be(铍)、Mg(镁)、Ca(钙)、Sr(锶)、Ba(钡)。下列关于第ⅡA族元素预言可能正确的是( )
①常温下,单质铍能与水剧烈反应放出H2 ②常温下,单质钡能与水剧烈反应放出H2 ③Be(OH)2易溶于水 ④Ba(OH)2易溶于水 ⑤SrCO3易溶于水
A.①②③ B.③⑤
C.②④ D.①②③④⑤
7. 下列叙述中正确的是( )
A.进行H2O和H2S的热分解实验,可确定S、O两种元素的非金属性强弱
B.根据非金属性:F>Cl,可以推测沸点:HF>HCl
C.已知H2CO3的酸性比HClO的酸性强,说明C的非金属性比Cl强
D.若已知H2SO3的酸性比H2CO3的酸性强, 则说明S的非金属性比C强
8. 根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D.Cl与Cl得电子能力相同
9. 下列关于Na、Mg、Cl、Br元素及其化合物的说法正确的是( )
A.NaOH的碱性比Mg(OH)2的强
B.Cl2得到电子的能力比Br2的弱
C.原子半径r: r(Br)>r(Cl)>r(Mg)>r(Na)
D.原子的最外层电子数n: n(Na)<n(Mg)<n(Cl)<n(Br)
10.下列关于元素周期表和元素性质的叙述正确的是( )
A.质子数相同的微粒之间一定互称同位素
B.ⅠA族与ⅦA族元素间形成的化合物一定是离子化合物
C.同主族元素的简单阴离子半径越大,其单质氧化性越弱
D.同周期金属元素的化合价越高,其氢氧化物的碱性越强
11.A、B、C均为短周期元素,A、B同周期,其原子核外有三个电子层,A、C的最低价阴离子分别为A2 和C ,B2+和C 具有相同的电子层结构,下列说法中正确的是( )
A.A元素的最高正价不可能是+6价
B.原子半径:B>A>C
C.离子半径:B2+>C >A2
D.氧化性:C<A
12.下列叙述中,金属a 的活泼性肯定比金属b 的活泼性强的是( )
A.a原子的最外层电子数比B原子的最外层电子数少
B.常温时,a能从水中置换出氢,而b不能
C.1 mol a从酸中置换H+生成的H2比l mol b从酸中置换H+生成的H2多
D.a原子电子层数比b原子的电子层数多
13.科学家根据元素周期律和原子结构理论预测,原子序数为114的元素位于第七周期第ⅣA族,称为类铅元素。下面关于它的原子结构和性质的预测正确的是( )
A.类铅元素原子的最外层电子数为6
B.其常见价态为+2、+3、+4
C.它的金属性比铅强
D.它的原子半径比铅小
14.运用元素周期律分析下面的判断,其中错误的是( )
A.铍(Be)的氧化物的水化物可能具有两性
B.砹(At)为白色固体,HAt不稳定,AgAt感光性很强
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.硒化氢(H2Se)无色、有毒,比H2S更不稳定
15.下列结论错误的是( )
①微粒半径:K+>Al3+>S2->Cl- ②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO4 ⑥非金属性:O>N>P>Si
⑦金属性:Be
二、填空题(本题包括3个小题,共40分)
16.(12分)现有部分元素的性质与原子(或分子)结构如下表:
元素编号 元素性质与原子(或分子)结构
T 最外层电子数是次外层电子数的3倍
X 常温下单质为双原子分子,分子中含有3对共用电子对
Y M层比K层少1个电子
Z 第三周期元素的简单离子中半径最小
(1)写出元素T的原子结构示意图: _______________。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示)。下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物对应的水化物的碱性比Z强
(3)写出T与Y形成的化合物的化学式______________________。
(4)元素T和氢元素以原子个数比1∶1化合形成化合物Q,元素X与氢元素以原子个数比1∶2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:____________________________。
17.(12分)X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知X的一种核素的质量数为18,中子数为10;Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强。
请回答下列问题:
(1)W位于元素周期表中第 周期第 族。画出X的阴离子的结构示意图: 。
(2)Z的氢化物和溴化氢相比,较稳定的是 (写化学式)。
(3)Y的金属性与Mg的金属性相比, 的金属性强(写化学式),请用实验证明它们金属性的相对强弱: (其他合理答案也可)。
(4)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物发生反应的化学方程式: 。
18.(16分)某化学兴趣小组为探究元素性质的递变规律,设计以下实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入足量的0.1 mol·L-1的盐酸中,试预测实验结果: 与盐酸反应最剧烈, 与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性强于NH3·H2O,继而可以验证Na的金属性强于N。此设计 (填“合理”或“不合理”),理由是 。
Ⅱ.利用如图所示装置可以验证非金属性的变化规律。
(3)仪器A的名称为 ,干燥管D的作用是 。
(4)实验室中现有药品:Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置A、B、C中所装药品分别为 、 、 ,装置C中的实验现象为有黄色沉淀生成,相关反应的离子方程式为 。
(5)若要证明非金属性:S>C>Si,则A中加 ,B中加Na2CO3,C中加 (合理即可),观察到C中的现象为 。
1.答案:B
解析:在元素周期表中金属在分界线左边,但分界线左边的并不都是金属元素,如氢元素,A错;Na、Mg、Al位于同一周期,根据元素周期律,其还原性依次减弱,B正确;F、Cl、Br位于同一主族,根据元素周期律,其非金属性依次减弱,C错;K的金属性强于Na,KOH碱性强于NaOH,D错。
2.答案:B
解析:A、钠与冷水比镁与冷水反应剧烈,因此钠的金属性强于镁,A正确;B、在MgCl2与AlCl3溶液中分别加入过量的氨水,均生成白色沉淀,现象相同,不能判断镁与铝的金属活动性强弱,B错误;C、硫酸和硅酸钠溶液反应出现白色沉淀,证明硫酸的酸性比硅酸强,所以能判断硫与硅的非金属活动性强弱,C正确;D、卤素单质与氢气化合越容易,非金属性越强,因此可以利用Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱,D正确;答案选B。
3.答案:B
解析:镁、钙和钡同主族,根据同主族元素从上到下金属性逐渐增强,则钡与冷水反应会更快,A选项正确;硅和锗都是常用的半导体材料,但同主族的碳和铅不具备此特点,B选项错误;氯、溴和碘同主族,根据同主族元素从上到下非金属氢化物稳定性逐渐减弱可知,C选项正确;硅、磷和硫同周期,根据同周期元素从左到右非金属单质与氢气反应的条件要求逐渐降低可知,D选项正确。
4.答案:B
解析:A对,由质量数等于质子数与中子数之和可知1个该原子中含有的中子数是226-88=138。B错,由第六周期的0族元素氡的原子序数为86可知,该元素位于第七周期第ⅡA族。C错,Ra在Ba的下面,其碳酸盐应与CaCO3、BaCO3性质相似,能与盐酸反应。D错,主族元素从上到下金属性依次增强,故Ra元素金属性较强,其最高价氧化物对应的水化物碱性也较强,不会具有两性。
5.答案:B
解析:对照元素周期表可确定①、②、③、④、⑤分别是N、O、F、S、Cl。元素①是N,位于第二周期第ⅤA族,A项错误;S的非金属性比O弱,因此H2S的热稳定性比H2O弱,B项错误;Cl的非金属性比S强,HClO4的酸性大于H2SO4,C项正确;Cl的最高正化合价为+7价,F没有正化合价,D项错误。
6.答案:C
解析:同主族从上到下,金属性逐渐增强,与水反应越来越剧烈,即常温下,单质钡能与水剧烈反应放出H2,①错误,②正确;Mg(OH)2难溶于水,Ca(OH)2微溶于水,推出Be(OH)2 难溶于水,③错误;Ba(OH)2是易溶于水的强碱,④正确;根据MgCO3、CaCO3、BaCO3难溶于水,因此SrCO3难溶于水,⑤错误。
7.答案:A
解析:A项,非金属性越强,简单氢化物的稳定性越强,进行H2O和H2S的热分解实验可确定S、O两种元素的非金属性强弱,正确;B项,非金属性强弱与氢化物的沸点没有关系,错误;C项,非金属性越强,最高价氧化物对应水化物酸性越强,HClO不是最高价含氧酸,不能直接比较,错误;D项,尽管H2SO3的酸性比H2CO3的酸性强,但H2SO3不是最高价含氧酸,不能说明S的非金属性比C强,错误。
8.答案:D
解析:同主族元素最高价含氧酸的酸性随核电荷数的增加而减弱,A项错误;核外电子排布相同的微粒化学性质不一定相同,如S2-、Ar、K+,B项错误;半径大小S2->Cl->K+>Ca2+,C项错误;Cl与Cl互为同位素,化学性质相同,D项正确。
9.答案:A
解析: A.同周期自左至右金属性减弱,所以金属性Na>Mg,则碱性NaOH>Mg(OH)2,故A正确;B.同主族元素自上而下非金属性减弱,所以非金属性Cl>Br,所以Cl2得电子的能力比Br2强,故B错误;C.电子层数越多原子半径越大,电子层数相同,核电荷数越小原子半径越大,所以原子半径:r(Br)>r(Na)>r(Mg)>r(Cl),故C错误;D.Cl和Br为同主族元素,最外层电子数相等,故D错误。
10.答案:C
解析:A、微粒包括分子、原子、离子等,如H2O、NH3分子质子数相同,但不是同位素,错误;B、ⅠA族与ⅦA族元素间形成的化合物也有可能为共价化合物,如HF、HCl、HBr等,错误;C、同主族元素的简单阴离子半径越大,说明元素的原子序数越大,其单质氧化性越弱,正确;D、同周期金属元素的化合价越高,其氢氧化物的碱性越弱,错误。
11.答案:B
解析:由A、C的最低价离子分别为A2 和C ,则A为ⅥA族元素,C为ⅦA族元素,B2+和C 具有相同的电子层结构,则B在C的下一周期,则B为Mg元素,C为F元素,A、B同周期,则A为S元素。据此解答。A.A为S元素,S元素的最高正化合价为+6,故A错误;B.A为S元素,B为Mg元素,C为F元素,同周期原子半径从左到右逐渐减小,电子层数越多,半径越大,则原子半径为B>A>C,故B正确;C.离子的电子层数越多,半径越大,具有相同核外电子结构的离子,核电荷数越大,半径越小,所以离子半径为A2 >C >B2+,故C错误;D.元素的非金属性越强,单质的氧化性越强,氧化性为C>A,故D错误;故选B。
12.答案:B
解析:A、最外层电子数少的金属金属性不一定比最外层电子数多的金属性强,如锂比钙弱,选项A错误;B、金属的活泼性越强,越易与水反应,常温时,a能从水中置换出氢,而b不能,说明金属的活泼性a比b活泼,选项B正确;C、产生氢气的多少取决于金属失去电子数的多少,金属的活泼性与得失电子难易有关,与得失电子数目多少无关,选项C错误;D、如金属不位于同一主族,则不能根据电子层数的多少来判断金属的活泼性强弱,选项D错误。答案选B。
13.答案:C
解析:114号元素位于第ⅣA族,最外层电子数应该是4个,A项错;C、Si、Pb的常见正价有+2、+4价,没有+3价,B项错;同主族元素的金属性由上至下逐渐增强,C项正确;该元素的电子层数比Pb多,原子半径比Pb大,D项错。
14.答案:B
解析:对角线处的元素具有相似的性质,Al(OH)3是两性氢氧化物,所以Be(OH)2有可能是两性氢氧化物,A项正确;卤素单质的颜色由上至下逐渐加深,因而At单质的颜色不能是白色固体,B项错;Sr与Ba、Ca同主族,对应的硫酸盐应具有相似的溶解性,C项正确;Se与S位于ⅥA族,非金属性比S弱,因此H2Se比H2S更不稳定,D项正确。
15.答案:B
解析:①中微粒半径应为S2->Cl->K+>Al3+;③中离子还原性应为S2->I->Br->Cl-;⑤中非金属性Cl>S>P>C,故其最高价氧化物对应水化物的酸性应为:HClO4>H2SO4>H3PO4>H2CO3;①③⑤错,故选B。
16.答案:15.(1) (2)Na cd (3)Na2O、Na2O2 (4)N2H4+2H2O2===N2+4H2O
解析:T元素最外层电子数是次外层电子数的3倍,故T元素为氧;元素X常温下单质为双原子分子,分子中含有3对共用电子对,应为N2,故X元素为氮;Y元素M层比K层少1个电子,应为钠;Z元素第三周期元素的简单离子中半径最小的为三价铝离子,故Z元素为铝。
17.答案:(1) 三 ⅣA (2) HCl
(3) Na Na与冷水剧烈反应,而Mg与冷水反应较慢
(4) NaOH+HClO4===NaClO4+H2O
解析:X、Y、W、Z是四种常见的短周期元素,已知X的一种核素的质量数为18,中子数为10,则X元素原子的质子数为18-10=8,故X为O元素;Y和Ne原子的核外电子数相差1,Y为Na或F元素,由题图可知,Y原子半径大于氧原子,故Y为Na元素;W的单质是一种常见的半导体材料,原子序数大于Na元素,故W为Si元素;Z的非金属性在同周期主族元素中最强,故Z为Cl元素。(1)W为Si元素,原子核外电子数为14,有3个电子层,最外层电子数为4,处于周期表中第三周期第ⅣA族。(2)Z为Cl元素,由于元素的非金属性:Cl>Br,故氢化物稳定性:HCl>HBr,即较稳定的是HCl。(3)同周期元素随原子序数增大原子半径减小,原子失去电子的能力逐渐减弱,元素的金属性逐渐减弱,所以金属性:Na>Mg;元素的金属性越强,其单质与水或酸反应置换出氢气就越容易,所以可以通过Na与冷水剧烈反应,而Mg与冷水反应较慢证明元素的金属性强弱。(4)Y的最高价氧化物对应的水化物NaOH是强碱,Z的最高价氧化物对应的水化物HClO4是一元强酸,二者发生酸碱中和反应,生成NaClO4和H2O,发生反应的化学方程式是NaOH+HClO4===NaClO4+H2O。
18.答案:Ⅰ.(1) 钾 铝 (2)不合理 N为活泼非金属元素,不表现金属性
(3)防止倒吸
(4)实浓盐酸、KMnO4、Na2S溶液 S2-+Cl2===S↓+2Cl-
(5)稀硫酸 Na2SiO3溶液有白色沉淀产生
解析:(1)金属活动性顺序是钾>钠>镁>铝,因此与盐酸反应,钾最剧烈,铝相对最缓慢。(3)进行气体性质实验时需要注意防止倒吸。(4)由题中所给药品可知,可用Na2S与氯气发生置换反应来判断Cl与S非金属性的强弱,因为无加热装置,所以只能选择KMnO4与浓盐酸反应制取氯气。(5)由B中药品为Na2CO3可知,用最高价氧化物对应水化物的酸性强弱判断对应元素的非金属性强弱,所以A中加入稀硫酸,C中可加入Na2SiO3溶液。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
