1.1 第3课时 反应焓变的计算 课件(共23张PPT)-高中化学鲁科版选择性必修第一册
文档属性
| 名称 | 1.1 第3课时 反应焓变的计算 课件(共23张PPT)-高中化学鲁科版选择性必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-28 11:39:39 | ||
图片预览







文档简介
(共23张PPT)
第3课时 反应焓变的计算
第1章 第1节
1.了解盖斯定律的概念和意义。
2.理解盖斯定律的本质,并能运用盖斯定律计算反应热(重、难点)。
3.了解摩尔燃烧焓的概念及燃料的合理利用。
学习目标
盖斯定律的内容与理解
一
H2(g) + O2(g) ===H2O(l) H1= 285.8 kJ·mol -1
H2O(g) ===H2O(l) H2= 44 kJ·mol -1
已知实验测得1 mol H2(g)和0.5 mol O2(g)反应生成1 mol H2O(l)的反应热为285.8 kJ·mol-1,请试通过计算是否可以得出H2(g) + O2(g) === H2O(g)的反应热 H ?
(查阅资料 H2O(g) ===H2O(l) H= 44 kJ·mol -1)
①
②
① ②
H2(g) + O2(g) H2O(g) ===H2O(l) H2O(l)
H2(g) + O2(g) ===H2O(g) H= 241.8 kJ·mol -1
H2O(g)
H
H2(g)+O2(g)
H2O(l)
H1
H2
H1 = H + H2
问题探究
2. 特点
遵循能量守恒定律,在一定条件下,化学反应的反应热只与反应体系的始态和终态有关,与反应途径无关。
内容:
一个化学反应,不管是一步完成的还是分几步完
成的,其反应热是相同的。
则:ΔH=ΔH1+ΔH2+ΔH3
思考交流
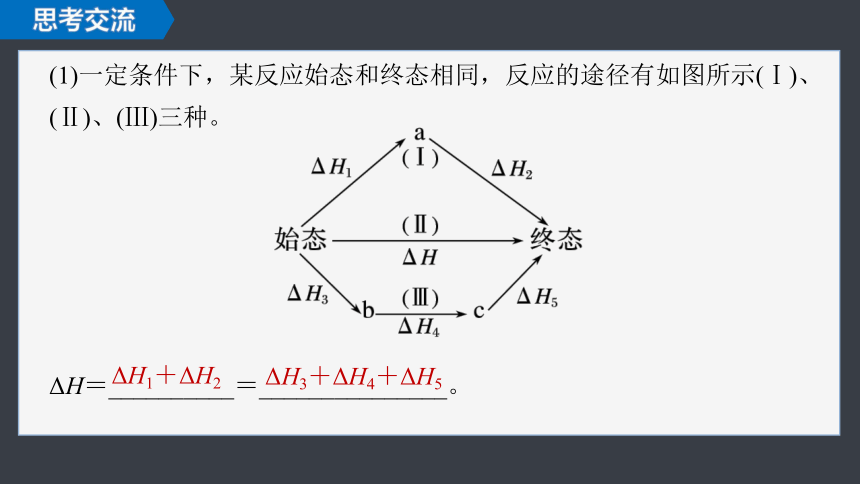
(1)一定条件下,某反应始态和终态相同,反应的途径有如图所示(Ⅰ)、(Ⅱ)、(Ⅲ)三种。
ΔH=__________=_______________。
ΔH1+ΔH2
ΔH3+ΔH4+ΔH5
思考交流
(2)C不完全燃烧反应C(s)+ O2(g)===CO(g)的ΔH无法直接测得,可利
用1 mol C(s)和1 mol CO(g)完全燃烧的焓变分别为393.5 kJ·mol-1、283.0 kJ·mol-1计算,写出分析过程。
第一步:分别写出二者完全燃烧的热化学方程式:
__________________________________________,
____________________________________________。
C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
思考交流
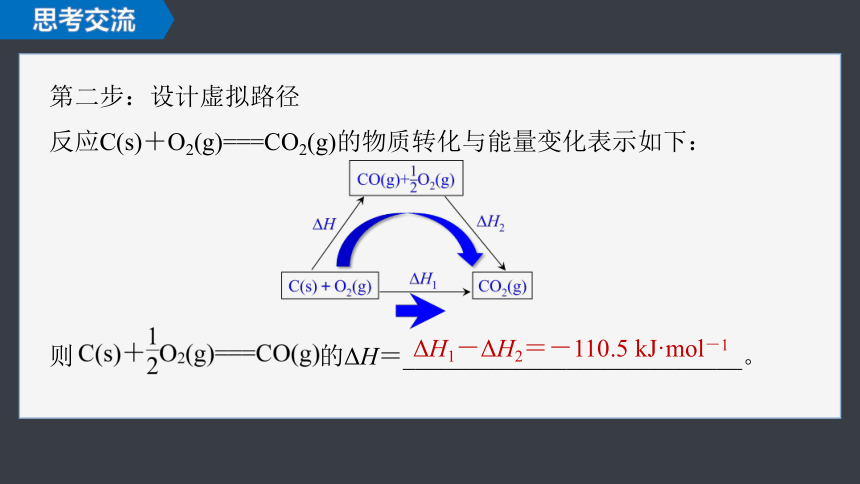
第二步:设计虚拟路径
反应C(s)+O2(g)===CO2(g)的物质转化与能量变化表示如下:
则 的ΔH=___________________________。
ΔH1-ΔH2=-110.5 kJ·mol-1
思考交流
(3)镁和氯气反应生成氯化镁的能量关系如图所示。
则ΔH6=__________________________(用ΔH1~ΔH5表示)。
ΔH1+ΔH2+ΔH3+ΔH4-ΔH5
3. 意义
可间接计算以下情况的反应热:
(1)有些反应进行得很慢;
(2)有些反应不容易直接发生;
(3)有些反应往往伴有副反应发生。
H = H1+ H2
= H3+ H4+ H5
H2 = H H1
?
盖斯定律解题的常用方法
二
C(s)+O2(g)==CO2(g) ΔH1=-393.5 kJ·mol-1
CO(g)+O2(g)==CO2(g) ΔH2=-283.0 kJ·mol-1
2H2(g)+O2(g)==2H2O(g) ΔH3=-483.6 kJ·mol-1
求该反应 C(s)+H2O (g)==CO(g)+H2(g) ΔH= ?
选目标一侧参照;
若已知与目标异侧,
则倒转,改变ΔH符号。
调方向
2H2O(g) == 2H2(g)+O2(g)
ΔH5=+483.6 kJ·mol-1
CO2(g) == CO(g)+O2(g)
ΔH4=+283.0 kJ·mol-1
已知方程式乘某数,
系数与目标一致,
ΔH也同乘。
调系数
调整好相加,
ΔH也相加。
加
H2O(g) == H2(g)+O2(g)
ΔH6=+241.8 kJ·mol-1
ΔH = +131.3 kJ·mol-1
问题探究
应用体验
1. 已知:
① Al2O3(s)+3C(s)===2Al(s)+3CO(g) ΔH1=+1 344.1 kJ·mol-1
② 2AlCl3(g)===2Al(s)+3Cl2(g) ΔH2=+1 169.2 kJ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为
____________________________________________________________。
根据盖斯定律 ①+③
需颠倒过来
得 ③ 2Al(s)+3Cl2(g)===2AlCl3(g) ΔH3=-ΔH2=-1 169.2 kJ·mol-1
Al2O3(s)+3C(s)+3Cl2(g)===2AlCl3(g)+3CO(g) ΔH=+174.9 kJ·mol-1
应用体验
2. 用水吸收 NOx 的相关热化学方程式如下:
2NO2(g)+H2O(l)===HNO3(aq)+HNO2(aq) ΔH=-116.1 kJ·mol-1
3HNO2(aq)===HNO3(aq)+2NO(g)+H2O(l) ΔH=+75.9 kJ·mol-1
反应3NO2(g)+H2O(l)===2HNO3(aq)+NO(g)的ΔH=________kJ·mol-1。
反应物
产物
需消去
①
②
则ΔH=(①×3+②)
=×(-116.1 kJ·mol-1×3+75.9 kJ·mol-1)
=-136.2 kJ·mol-1
-136.2
利用盖斯定律书写热化学方程式的关键
结合已知热化学方程式消去“中间产物”,得到目标热化学方程式,
采用“目标加合法”可快速消去“中间产物”,反应热也随之相加减。
练后反思
能源 摩尔燃烧焓
三
柴草
煤
液化石油气
天然气
家用燃料的变迁
根据什么标准来选择燃料
问题探究
物质的燃烧热
燃料的储量
燃料的开采、运输
燃料储存的条件、价格
燃料对生态环境的影响
… …
1.能源
(2)种类:包括太阳能、风能、水能、生物质能、地热能、海洋能、核能、化石燃料等。
(1)概念:能为人类提供能量的物质或物质运动。
(3)能源危机解决的办法 :
开发新能源
节约现有能源,提高能源的利用率
开源节流
2.摩尔燃烧焓
在一定反应温度和压强条件下,1 mol纯物质完全氧化为同温下的指定产物时的焓变。
C→CO2(g) H→H2O(l) S→SO2(g) N→N2(g)
思考交流
1.25 ℃、101 kPa时甲烷的摩尔燃烧焓为-890.3 kJ·mol-1,解释其表示的意义。
__________________________________________________________________________________。
2.在25 ℃、101 kPa下,汽油的成分之一——辛烷(C8H18)燃烧的热化学方程式为2C8H18(l)+25O2(g)===16CO2(g)+18H2O(l) ΔH=-11 036 kJ·mol-1。
则表示辛烷摩尔燃烧焓的热化学方程式为___________________________
______________________________。
表示25 ℃、101 kPa时, 1 mol CH4完全燃烧生成CO2气体和液态H2O时放出890.3 kJ的热量
+9H2O(l) ΔH=-5 518 kJ·mol-1
C8H18(l)+ O2(g)=== 8CO2(g)
9
思考交流
3.目前煤在我国依然是第一能源,煤的气化可以实现煤的综合利用,提高煤的利用价值。下表列举了几种常见物质的摩尔燃烧焓(298 K,101 kPa),且298 K,101 kPa时,1 mol H2O(l)变为H2O(g)需要吸收44.0 kJ的热量(注意:煤的摩尔燃烧焓可用石墨的摩尔燃烧焓计算)。
物质 化学式 ΔH/(kJ·mol-1)
石墨 C(s) -393.5
氢气 H2(g) -285.8
一氧化碳 CO(g) -283.0
思考交流
(1)计算煤气化反应C(s)+H2O(g)===CO(g)+H2(g)的焓变,写出计算过程。
答案 根据摩尔燃烧焓的含义,可得热化学方程式:
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1;
②CO(g)+ O2(g)===CO2(g) ΔH2=-283.0 kJ·mol-1;
③H2(g)+ O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1;
④H2O(l)===H2O(g) ΔH4=+44.0 kJ·mol-1。所以根据盖斯定律,将①-②-③-④,整理可得:C(s)+H2O(g)===CO(g)+H2(g),则ΔH=ΔH1-ΔH2-ΔH3-ΔH4=+131.3 kJ·mol-1
思考交流
(2)从物质和能量的角度说明将煤炭转化为水煤气的价值:
__________________________________________________________________________________________________________________。
可以增大可燃物与氧气的接触面积提高燃烧效率;可以减少二氧化硫和一氧化碳等污染气体的排放;气化后的燃料便于运输
第3课时 反应焓变的计算
第1章 第1节
1.了解盖斯定律的概念和意义。
2.理解盖斯定律的本质,并能运用盖斯定律计算反应热(重、难点)。
3.了解摩尔燃烧焓的概念及燃料的合理利用。
学习目标
盖斯定律的内容与理解
一
H2(g) + O2(g) ===H2O(l) H1= 285.8 kJ·mol -1
H2O(g) ===H2O(l) H2= 44 kJ·mol -1
已知实验测得1 mol H2(g)和0.5 mol O2(g)反应生成1 mol H2O(l)的反应热为285.8 kJ·mol-1,请试通过计算是否可以得出H2(g) + O2(g) === H2O(g)的反应热 H ?
(查阅资料 H2O(g) ===H2O(l) H= 44 kJ·mol -1)
①
②
① ②
H2(g) + O2(g) H2O(g) ===H2O(l) H2O(l)
H2(g) + O2(g) ===H2O(g) H= 241.8 kJ·mol -1
H2O(g)
H
H2(g)+O2(g)
H2O(l)
H1
H2
H1 = H + H2
问题探究
2. 特点
遵循能量守恒定律,在一定条件下,化学反应的反应热只与反应体系的始态和终态有关,与反应途径无关。
内容:
一个化学反应,不管是一步完成的还是分几步完
成的,其反应热是相同的。
则:ΔH=ΔH1+ΔH2+ΔH3
思考交流
(1)一定条件下,某反应始态和终态相同,反应的途径有如图所示(Ⅰ)、(Ⅱ)、(Ⅲ)三种。
ΔH=__________=_______________。
ΔH1+ΔH2
ΔH3+ΔH4+ΔH5
思考交流
(2)C不完全燃烧反应C(s)+ O2(g)===CO(g)的ΔH无法直接测得,可利
用1 mol C(s)和1 mol CO(g)完全燃烧的焓变分别为393.5 kJ·mol-1、283.0 kJ·mol-1计算,写出分析过程。
第一步:分别写出二者完全燃烧的热化学方程式:
__________________________________________,
____________________________________________。
C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
思考交流
第二步:设计虚拟路径
反应C(s)+O2(g)===CO2(g)的物质转化与能量变化表示如下:
则 的ΔH=___________________________。
ΔH1-ΔH2=-110.5 kJ·mol-1
思考交流
(3)镁和氯气反应生成氯化镁的能量关系如图所示。
则ΔH6=__________________________(用ΔH1~ΔH5表示)。
ΔH1+ΔH2+ΔH3+ΔH4-ΔH5
3. 意义
可间接计算以下情况的反应热:
(1)有些反应进行得很慢;
(2)有些反应不容易直接发生;
(3)有些反应往往伴有副反应发生。
H = H1+ H2
= H3+ H4+ H5
H2 = H H1
?
盖斯定律解题的常用方法
二
C(s)+O2(g)==CO2(g) ΔH1=-393.5 kJ·mol-1
CO(g)+O2(g)==CO2(g) ΔH2=-283.0 kJ·mol-1
2H2(g)+O2(g)==2H2O(g) ΔH3=-483.6 kJ·mol-1
求该反应 C(s)+H2O (g)==CO(g)+H2(g) ΔH= ?
选目标一侧参照;
若已知与目标异侧,
则倒转,改变ΔH符号。
调方向
2H2O(g) == 2H2(g)+O2(g)
ΔH5=+483.6 kJ·mol-1
CO2(g) == CO(g)+O2(g)
ΔH4=+283.0 kJ·mol-1
已知方程式乘某数,
系数与目标一致,
ΔH也同乘。
调系数
调整好相加,
ΔH也相加。
加
H2O(g) == H2(g)+O2(g)
ΔH6=+241.8 kJ·mol-1
ΔH = +131.3 kJ·mol-1
问题探究
应用体验
1. 已知:
① Al2O3(s)+3C(s)===2Al(s)+3CO(g) ΔH1=+1 344.1 kJ·mol-1
② 2AlCl3(g)===2Al(s)+3Cl2(g) ΔH2=+1 169.2 kJ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为
____________________________________________________________。
根据盖斯定律 ①+③
需颠倒过来
得 ③ 2Al(s)+3Cl2(g)===2AlCl3(g) ΔH3=-ΔH2=-1 169.2 kJ·mol-1
Al2O3(s)+3C(s)+3Cl2(g)===2AlCl3(g)+3CO(g) ΔH=+174.9 kJ·mol-1
应用体验
2. 用水吸收 NOx 的相关热化学方程式如下:
2NO2(g)+H2O(l)===HNO3(aq)+HNO2(aq) ΔH=-116.1 kJ·mol-1
3HNO2(aq)===HNO3(aq)+2NO(g)+H2O(l) ΔH=+75.9 kJ·mol-1
反应3NO2(g)+H2O(l)===2HNO3(aq)+NO(g)的ΔH=________kJ·mol-1。
反应物
产物
需消去
①
②
则ΔH=(①×3+②)
=×(-116.1 kJ·mol-1×3+75.9 kJ·mol-1)
=-136.2 kJ·mol-1
-136.2
利用盖斯定律书写热化学方程式的关键
结合已知热化学方程式消去“中间产物”,得到目标热化学方程式,
采用“目标加合法”可快速消去“中间产物”,反应热也随之相加减。
练后反思
能源 摩尔燃烧焓
三
柴草
煤
液化石油气
天然气
家用燃料的变迁
根据什么标准来选择燃料
问题探究
物质的燃烧热
燃料的储量
燃料的开采、运输
燃料储存的条件、价格
燃料对生态环境的影响
… …
1.能源
(2)种类:包括太阳能、风能、水能、生物质能、地热能、海洋能、核能、化石燃料等。
(1)概念:能为人类提供能量的物质或物质运动。
(3)能源危机解决的办法 :
开发新能源
节约现有能源,提高能源的利用率
开源节流
2.摩尔燃烧焓
在一定反应温度和压强条件下,1 mol纯物质完全氧化为同温下的指定产物时的焓变。
C→CO2(g) H→H2O(l) S→SO2(g) N→N2(g)
思考交流
1.25 ℃、101 kPa时甲烷的摩尔燃烧焓为-890.3 kJ·mol-1,解释其表示的意义。
__________________________________________________________________________________。
2.在25 ℃、101 kPa下,汽油的成分之一——辛烷(C8H18)燃烧的热化学方程式为2C8H18(l)+25O2(g)===16CO2(g)+18H2O(l) ΔH=-11 036 kJ·mol-1。
则表示辛烷摩尔燃烧焓的热化学方程式为___________________________
______________________________。
表示25 ℃、101 kPa时, 1 mol CH4完全燃烧生成CO2气体和液态H2O时放出890.3 kJ的热量
+9H2O(l) ΔH=-5 518 kJ·mol-1
C8H18(l)+ O2(g)=== 8CO2(g)
9
思考交流
3.目前煤在我国依然是第一能源,煤的气化可以实现煤的综合利用,提高煤的利用价值。下表列举了几种常见物质的摩尔燃烧焓(298 K,101 kPa),且298 K,101 kPa时,1 mol H2O(l)变为H2O(g)需要吸收44.0 kJ的热量(注意:煤的摩尔燃烧焓可用石墨的摩尔燃烧焓计算)。
物质 化学式 ΔH/(kJ·mol-1)
石墨 C(s) -393.5
氢气 H2(g) -285.8
一氧化碳 CO(g) -283.0
思考交流
(1)计算煤气化反应C(s)+H2O(g)===CO(g)+H2(g)的焓变,写出计算过程。
答案 根据摩尔燃烧焓的含义,可得热化学方程式:
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1;
②CO(g)+ O2(g)===CO2(g) ΔH2=-283.0 kJ·mol-1;
③H2(g)+ O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1;
④H2O(l)===H2O(g) ΔH4=+44.0 kJ·mol-1。所以根据盖斯定律,将①-②-③-④,整理可得:C(s)+H2O(g)===CO(g)+H2(g),则ΔH=ΔH1-ΔH2-ΔH3-ΔH4=+131.3 kJ·mol-1
思考交流
(2)从物质和能量的角度说明将煤炭转化为水煤气的价值:
__________________________________________________________________________________________________________________。
可以增大可燃物与氧气的接触面积提高燃烧效率;可以减少二氧化硫和一氧化碳等污染气体的排放;气化后的燃料便于运输
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
