1.1 第4课时 化学反应的热效应重点题型突破 课件(共22张PPT)-高中化学鲁科版选择性必修第一册
文档属性
| 名称 | 1.1 第4课时 化学反应的热效应重点题型突破 课件(共22张PPT)-高中化学鲁科版选择性必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 601.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-28 11:40:46 | ||
图片预览








文档简介
(共22张PPT)
第4课时 化学反应的热效应
重点题型突破
第1章 第1节
1.掌握ΔH的大小比较方法。
2.掌握综合利用热化学方程式、盖斯定律等进行有关反应热的相关计算方法(重、
难点)。
学习目标
ΔH的大小比较
一
ΔH大小比较的原则
(1)吸热反应的ΔH(ΔH>0)大于放热反应的ΔH(ΔH<0)。
(2)ΔH的大小比较要带正负号。放热反应中放出的热量越多,ΔH越小,吸热反应中,吸收热量越多,ΔH越大。
(3)等量可燃物完全燃烧的ΔH小于不完全燃烧的ΔH。
(4)等物质的量的物质,能量大小与其状态有关,气态>液态>固态。
思考交流
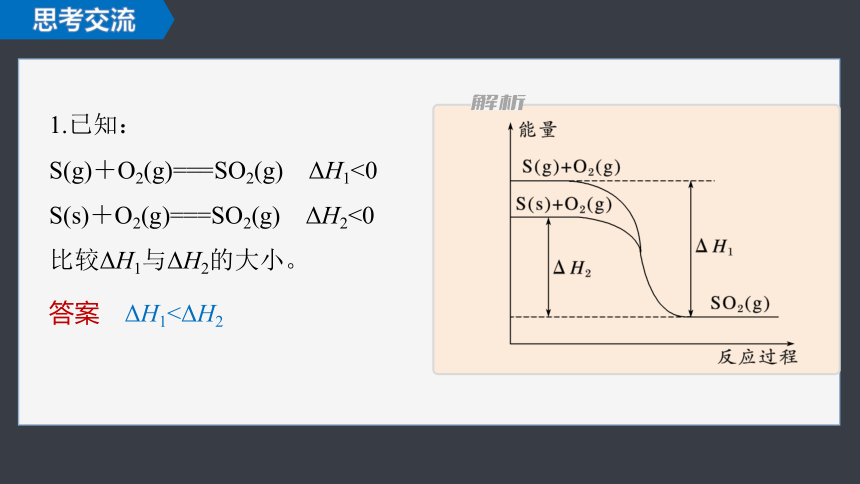
1.已知:
S(g)+O2(g)===SO2(g) ΔH1<0
S(s)+O2(g)===SO2(g) ΔH2<0
比较ΔH1与ΔH2的大小。
答案 ΔH1<ΔH2
思考交流
2.已知石墨比金刚石稳定,C(s,石墨)+O2(g)=== CO2(g) ΔH1=
-a kJ·mol-1;C(s,金刚石)+O2(g)===CO2(g) ΔH2=-b kJ·mol-1。比较ΔH1与ΔH2的大小。
答案 ΔH2<ΔH1
能量越低物质越稳定,则燃烧过程中能量变化如图,
由图示可知:b>a,则 ΔH2<ΔH1。
思考交流
3.已知:①2Al(s)+ O2(g)===Al2O3(s) ΔH1
②2Fe(s)+ O2(g)===Fe2O3(s) ΔH2
比较ΔH1与ΔH2的大小,写出分析过程。
答案 由反应①-反应②可得2Al(s)+Fe2O3(s)===2Fe(s)+Al2O3(s) ΔH=ΔH1-ΔH2,已知铝热反应为放热反应,故ΔH<0,则ΔH1<ΔH2。
利用盖斯定律计算多步反应的焓变
二
1.让生态环境更秀美、人民生活更幸福!为此,冬季取暖许多家庭用上了清洁能源天然气,实际生产中天然气需要脱硫,在1 200 ℃时,工艺中会发生下列反应:
则ΔH4的正确表达式为__________________________。
将2×②+2×①-6×③得到6S(g)===3S2(g)的焓变3ΔH4=2ΔH1+2ΔH2
-6ΔH3;所以2S(g)===S2(g)的焓变ΔH4= (ΔH1+ΔH2-3ΔH3)。
2.直接将CO2转化为有机物并非植物的“专利”,科学家通过多种途径实现了CO2合成甲醛,总反应为CO2(g)+2H2(g) HCHO(g)+H2O(g) ΔH,转化步骤如图所示:
已知2H2(g)+O2(g)=== 2H2O(g) ΔH4,则总反应的ΔH=____________(用图中焓变以及ΔH4表示)。
根据题图及盖斯定律,总反应CO2(g)+2H2(g) HCHO(g)+H2O(g)是
①+②+ ×③- ×④得到的,则反应热ΔH=ΔH1+ΔH2+ 。
(1)不能基于目标热化学方程式确定中间产物。
(2)没调整好系数,不能完全消去中间产物。
(3)在方程式调整系数时,焓变没随之调整。
1
2
3
自我测试
4
1.下列选项中ΔH2>ΔH1的是
A.H2(g)+Cl2(g)===2HCl(g) ΔH1,H2(g)+Cl2(g)===2HCl(l) ΔH2
B.H2O(l)===H2(g)+ O2(g) ΔH1,2H2(g)+O2(g)===2H2O(l) ΔH2
C.2C(s)+O2(g)===2CO(g) ΔH1,2C(s)+2O2(g)===2CO2(g) ΔH2
D.已知:弱酸电离时吸热
HCl(aq)+NaOH(aq)===NaCl(aq)+H2O(l) ΔH1,
CH3COOH(aq)+NaOH(aq)===CH3COONa(aq)+H2O(l) ΔH2
√
1
2
3
自我测试
4
气态HCl的能量高于液态HCl,所以生成HCl气体时放出的热量少,又因为这两个反应的反应热均为负值,故ΔH1>ΔH2,A项不符合题意;
水分解反应的反应热为正值,燃烧反应的反应热为负值,即ΔH1>ΔH2,B项不符合题意;
后者为完全燃烧,放出的热量较多,因而ΔH1>ΔH2,C项不符合题意;
醋酸是弱酸,电离时吸热,则醋酸与氢氧化钠溶液反应比盐酸与氢氧化钠溶液反应放出的热量少,又因为这两个反应的反应热均为负值,则ΔH2>ΔH1,D项符合题意。
2.已知热化学方程式:
①C2H2(g)+ O2(g)===2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+ O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1
则反应④2C(s)+H2(g)===C2H2(g)的ΔH4为
A.+228.2 kJ·mol-1
B.-228.2 kJ·mol-1
C.+1 301.0 kJ·mol-1
D.+621.7 kJ·mol-1
1
2
3
自我测试
4
√
1
2
3
自我测试
热化学方程式①②③和④之间存在如下关系:2×②+③-①=④。所以根据盖斯定律,得ΔH4=2ΔH2+ΔH3-ΔH1=2×(-393.5 kJ·mol-1)-285.8 kJ·mol-1+1 301.0 kJ·mol-1=+228.2 kJ·mol-1。
4
3.MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
已知:离子电荷相同时,半径越小,离子键越强。下列说法不正确的是
A.ΔH1(MgCO3)>ΔH1(CaCO3)>0
B.ΔH2(MgCO3)=ΔH2(CaCO3)>0
C.ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO)
D.对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3
1
2
3
自我测试
4
√
1
2
3
自我测试
4
根据盖斯定律,得ΔH=ΔH1+ΔH2+ΔH3,又已知Ca2+半径大于Mg2+半径,所以CaCO3的离子键强度弱于MgCO3,CaO的离子键强度弱于MgO。
A项,ΔH1表示断裂MCO3中的离子键形成M2+和 所吸收的能量,离子键强度越大,吸收的能量越大,因而ΔH1(MgCO3)>ΔH1(CaCO3)>0,正确;
B项,ΔH2表示断裂 中共价键形成O2-和CO2吸收的能量,与M2+无关,因而ΔH2(MgCO3)=ΔH2(CaCO3)>0,正确;
1
2
3
自我测试
C项,由上述分析可知ΔH1(CaCO3)-ΔH1(MgCO3)<0,而ΔH3表示形成MO离子键所放出的能量,ΔH3为负值,CaO的离子键强度弱于MgO,因而ΔH3(CaO)>ΔH3(MgO),ΔH3(CaO)-ΔH3(MgO)>0,错误;
D项,由以上分析可知ΔH1+ΔH2>0,ΔH3<0,故ΔH1+ΔH2>ΔH3,正确。
4
1
2
3
自我测试
4.甲醇水蒸气催化重整是当前制取清洁能源氢气的主要方法,其反应机理如下:
反应:CH3OH(g)+H2O(g) CO2(g)+3H2(g) ΔH=________________。
4
返回
(a-b+c)kJ·mol-1
本课结束
第4课时 化学反应的热效应
重点题型突破
第1章 第1节
1.掌握ΔH的大小比较方法。
2.掌握综合利用热化学方程式、盖斯定律等进行有关反应热的相关计算方法(重、
难点)。
学习目标
ΔH的大小比较
一
ΔH大小比较的原则
(1)吸热反应的ΔH(ΔH>0)大于放热反应的ΔH(ΔH<0)。
(2)ΔH的大小比较要带正负号。放热反应中放出的热量越多,ΔH越小,吸热反应中,吸收热量越多,ΔH越大。
(3)等量可燃物完全燃烧的ΔH小于不完全燃烧的ΔH。
(4)等物质的量的物质,能量大小与其状态有关,气态>液态>固态。
思考交流
1.已知:
S(g)+O2(g)===SO2(g) ΔH1<0
S(s)+O2(g)===SO2(g) ΔH2<0
比较ΔH1与ΔH2的大小。
答案 ΔH1<ΔH2
思考交流
2.已知石墨比金刚石稳定,C(s,石墨)+O2(g)=== CO2(g) ΔH1=
-a kJ·mol-1;C(s,金刚石)+O2(g)===CO2(g) ΔH2=-b kJ·mol-1。比较ΔH1与ΔH2的大小。
答案 ΔH2<ΔH1
能量越低物质越稳定,则燃烧过程中能量变化如图,
由图示可知:b>a,则 ΔH2<ΔH1。
思考交流
3.已知:①2Al(s)+ O2(g)===Al2O3(s) ΔH1
②2Fe(s)+ O2(g)===Fe2O3(s) ΔH2
比较ΔH1与ΔH2的大小,写出分析过程。
答案 由反应①-反应②可得2Al(s)+Fe2O3(s)===2Fe(s)+Al2O3(s) ΔH=ΔH1-ΔH2,已知铝热反应为放热反应,故ΔH<0,则ΔH1<ΔH2。
利用盖斯定律计算多步反应的焓变
二
1.让生态环境更秀美、人民生活更幸福!为此,冬季取暖许多家庭用上了清洁能源天然气,实际生产中天然气需要脱硫,在1 200 ℃时,工艺中会发生下列反应:
则ΔH4的正确表达式为__________________________。
将2×②+2×①-6×③得到6S(g)===3S2(g)的焓变3ΔH4=2ΔH1+2ΔH2
-6ΔH3;所以2S(g)===S2(g)的焓变ΔH4= (ΔH1+ΔH2-3ΔH3)。
2.直接将CO2转化为有机物并非植物的“专利”,科学家通过多种途径实现了CO2合成甲醛,总反应为CO2(g)+2H2(g) HCHO(g)+H2O(g) ΔH,转化步骤如图所示:
已知2H2(g)+O2(g)=== 2H2O(g) ΔH4,则总反应的ΔH=____________(用图中焓变以及ΔH4表示)。
根据题图及盖斯定律,总反应CO2(g)+2H2(g) HCHO(g)+H2O(g)是
①+②+ ×③- ×④得到的,则反应热ΔH=ΔH1+ΔH2+ 。
(1)不能基于目标热化学方程式确定中间产物。
(2)没调整好系数,不能完全消去中间产物。
(3)在方程式调整系数时,焓变没随之调整。
1
2
3
自我测试
4
1.下列选项中ΔH2>ΔH1的是
A.H2(g)+Cl2(g)===2HCl(g) ΔH1,H2(g)+Cl2(g)===2HCl(l) ΔH2
B.H2O(l)===H2(g)+ O2(g) ΔH1,2H2(g)+O2(g)===2H2O(l) ΔH2
C.2C(s)+O2(g)===2CO(g) ΔH1,2C(s)+2O2(g)===2CO2(g) ΔH2
D.已知:弱酸电离时吸热
HCl(aq)+NaOH(aq)===NaCl(aq)+H2O(l) ΔH1,
CH3COOH(aq)+NaOH(aq)===CH3COONa(aq)+H2O(l) ΔH2
√
1
2
3
自我测试
4
气态HCl的能量高于液态HCl,所以生成HCl气体时放出的热量少,又因为这两个反应的反应热均为负值,故ΔH1>ΔH2,A项不符合题意;
水分解反应的反应热为正值,燃烧反应的反应热为负值,即ΔH1>ΔH2,B项不符合题意;
后者为完全燃烧,放出的热量较多,因而ΔH1>ΔH2,C项不符合题意;
醋酸是弱酸,电离时吸热,则醋酸与氢氧化钠溶液反应比盐酸与氢氧化钠溶液反应放出的热量少,又因为这两个反应的反应热均为负值,则ΔH2>ΔH1,D项符合题意。
2.已知热化学方程式:
①C2H2(g)+ O2(g)===2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+ O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1
则反应④2C(s)+H2(g)===C2H2(g)的ΔH4为
A.+228.2 kJ·mol-1
B.-228.2 kJ·mol-1
C.+1 301.0 kJ·mol-1
D.+621.7 kJ·mol-1
1
2
3
自我测试
4
√
1
2
3
自我测试
热化学方程式①②③和④之间存在如下关系:2×②+③-①=④。所以根据盖斯定律,得ΔH4=2ΔH2+ΔH3-ΔH1=2×(-393.5 kJ·mol-1)-285.8 kJ·mol-1+1 301.0 kJ·mol-1=+228.2 kJ·mol-1。
4
3.MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
已知:离子电荷相同时,半径越小,离子键越强。下列说法不正确的是
A.ΔH1(MgCO3)>ΔH1(CaCO3)>0
B.ΔH2(MgCO3)=ΔH2(CaCO3)>0
C.ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO)
D.对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3
1
2
3
自我测试
4
√
1
2
3
自我测试
4
根据盖斯定律,得ΔH=ΔH1+ΔH2+ΔH3,又已知Ca2+半径大于Mg2+半径,所以CaCO3的离子键强度弱于MgCO3,CaO的离子键强度弱于MgO。
A项,ΔH1表示断裂MCO3中的离子键形成M2+和 所吸收的能量,离子键强度越大,吸收的能量越大,因而ΔH1(MgCO3)>ΔH1(CaCO3)>0,正确;
B项,ΔH2表示断裂 中共价键形成O2-和CO2吸收的能量,与M2+无关,因而ΔH2(MgCO3)=ΔH2(CaCO3)>0,正确;
1
2
3
自我测试
C项,由上述分析可知ΔH1(CaCO3)-ΔH1(MgCO3)<0,而ΔH3表示形成MO离子键所放出的能量,ΔH3为负值,CaO的离子键强度弱于MgO,因而ΔH3(CaO)>ΔH3(MgO),ΔH3(CaO)-ΔH3(MgO)>0,错误;
D项,由以上分析可知ΔH1+ΔH2>0,ΔH3<0,故ΔH1+ΔH2>ΔH3,正确。
4
1
2
3
自我测试
4.甲醇水蒸气催化重整是当前制取清洁能源氢气的主要方法,其反应机理如下:
反应:CH3OH(g)+H2O(g) CO2(g)+3H2(g) ΔH=________________。
4
返回
(a-b+c)kJ·mol-1
本课结束
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
