1.2 第3课时 常见化学电源(二)——形形色色的燃料电池 课件(共21张PPT)-高中化学鲁科版选择性必修第一册
文档属性
| 名称 | 1.2 第3课时 常见化学电源(二)——形形色色的燃料电池 课件(共21张PPT)-高中化学鲁科版选择性必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-28 14:58:32 | ||
图片预览






文档简介
(共21张PPT)
第3课时 常见化学电源(二)——
形形色色的燃料电池
第1章 第2节
1.理解常见的氢氧燃料电池的工作原理,并能设计简易氢氧燃料电池(重点)。
2.会书写不同介质条件下,其他燃料电池的电极反应(重、难点)。
学习目标
情境导入
燃料电池城市客车
燃料电池和“超级电容”混合动力客车
燃料电池的供电量易于调节,能适应电器负载的变化,而且不需要很长的充电时间,在航天、军事和交通等领域有广阔的应用前景。
制作简易氢氧燃料电
池,并分析其工作原理
一
1.燃料电池的概念
一种连续地将燃料和氧化剂的化学能直接转化
为电能的化学电源。
2.燃料电池的特点
燃料和氧化剂连续地由外部供给并在电极
上进行反应,生成物不断地被排出。
(2) 能量转换率高(>80%),排放的废弃物少。
可共选择的燃料很多,如氢气、烃类、肼、甲醇、氨、煤气等液态或气态燃料。
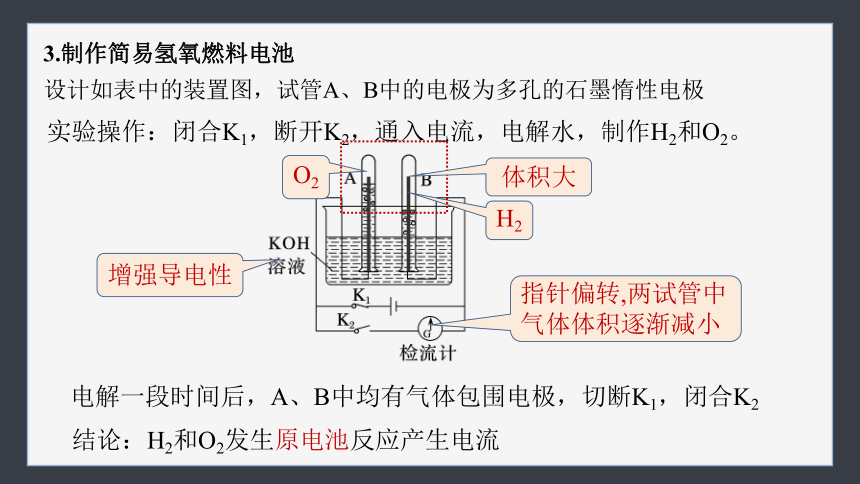
3.制作简易氢氧燃料电池
设计如表中的装置图,试管A、B中的电极为多孔的石墨惰性电极
实验操作:闭合K1,断开K2,通入电流,电解水,制作H2和O2。
电解一段时间后,A、B中均有气体包围电极,切断K1,闭合K2
结论:H2和O2发生原电池反应产生电流
增强导电性
O2
H2
体积大
指针偏转,两试管中气体体积逐渐减小
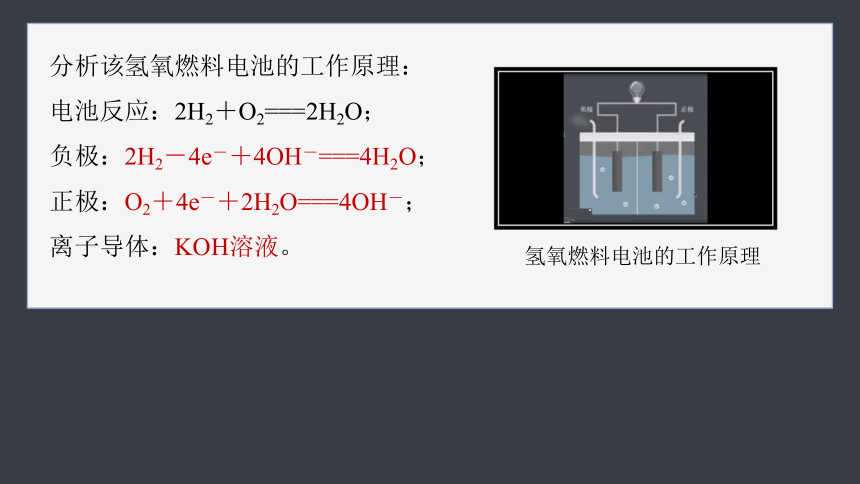
分析该氢氧燃料电池的工作原理:
电池反应:2H2+O2===2H2O;
负极:2H2-4e-+4OH-===4H2O;
正极:O2+4e-+2H2O===4OH-;
离子导体:KOH溶液。
氢氧燃料电池的工作原理
思考交流
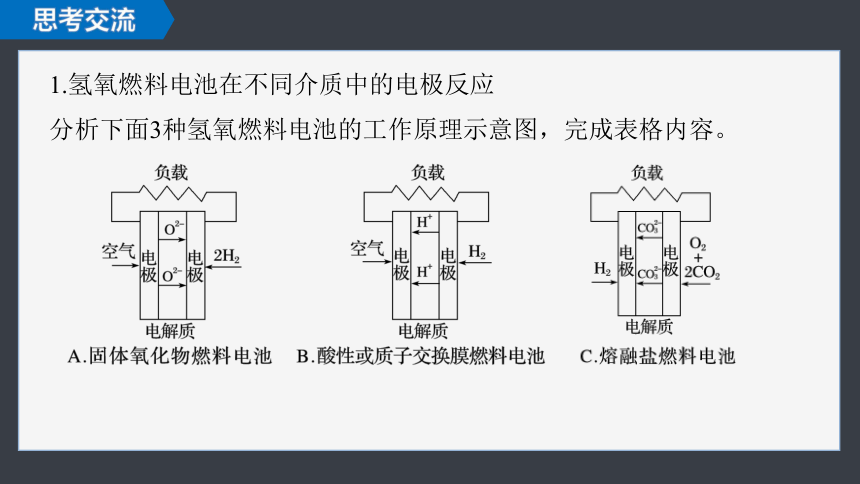
1.氢氧燃料电池在不同介质中的电极反应
分析下面3种氢氧燃料电池的工作原理示意图,完成表格内容。
思考交流
装置 电池反应:2H2+O2===2H2O 传导离子
A 负极 _________________________ ____
正极 _________________ B 负极 __________________ ____
正极 ________________________ C 负极 ______________________________ _____
正极 ________________________ 2H2-4e-+2O2-===2H2O
O2+4e-===2O2-
2H2-4e-===4H+
O2+4H++4e-===2H2O
H+
O2-
思考交流
2.燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极。
(1)负极是____(填“a”或“b”)。
a
(2)b极的电极反应式是________________________。
O2+2H2O+4e-===4OH-
O2得电子结合水生成氢氧根离子
(3)标准状况下,消耗11.2 L H2时,转移的电子数为________________。
6.02×1023(或NA)
常见有机物燃料电池、熔融氧化物
(盐)燃料电池的种类及工作原理
二
1.甲烷燃料电池成本远低于以氢气为燃料的传统燃料电池。
(1)在酸性介质中
负极反应式:______________________;
正极反应式:______________________;
总反应式:________________________。
答案 CH4+2H2O-8e-===CO2+8H+
2O2+8H++8e-===4H2O
CH4+2O2===CO2+2H2O
(2)在碱性(KOH溶液)介质中
负极反应式: ;
正极反应式: ;
总反应式: 。
归纳总结
在酸性介质和碱性介质中甲烷燃料电池的总反应不同
酸性条件下,+4价碳元素全部转化为CO2;
碱性条件下,+4价碳元素全部转化为 。
2.一种固体电解质燃料电池的构造示意图如图所示。该电池以稀土金属材料作电极,两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-。
负极反应式:__________________;
正极反应式:__________________;
总反应式:____________________。
答案 CH4+4O2--8e-===CO2+2H2O
2O2+8e-===4O2-
CH4+2O2===CO2+2H2O
3.一种熔融碳酸盐燃料电池工作原理如图所示。
(1)电池工作时,外电路上电流的方向应从电极____(填“A”或“B”,下同)流向用电器。
(3)电极A上CO参与的电极反应为_______________________。
答案 A
答案 B
(2) 向电极____移动。
答案 CO-2e-+ ===2CO2
归纳总结
燃料电池电极反应式书写的方法
第一步:写出燃料电池的总反应式
燃料电池的总反应与燃料的燃烧反应一致,若产物能和电解质反应,则总反应为加和后的反应。
第二步:写出电池的正极反应式
正极反应物一般为氧气得电子,介质不同时其电极反应式有所不同,如:
酸性电解质溶液:O2+4H++4e-===2H2O;
归纳总结
碱性电解质溶液:O2+2H2O+4e-===4OH-;
固体电解质(高温下能传导O2-):O2+4e-===2O2-;
熔融碳酸盐(如熔融K2CO3):O2+2CO2+4e-=== 。
第三步:根据电池总反应式和正极反应式,写出负极反应式。电池反应的总反应式-电池正极反应式=电池负极反应式。因为O2不是负极反应物,因此两个反应式相减时要彻底消除O2。
1
2
3
自我测试
1.氢氧燃料电池具有绿色环保和高效等特点,某种氢氧燃料电池的结构示意图如图,该电池工作时
A.a处通入O2
B.甲电极为负极
C.将电能转化为化学能
D.正极反应式为H2-2e-===2H+
√
H2
O2
失电子,发生氧化反应
负极
得电子,发生还原反应
正极
化学能转化为电能
O2+4e-+4H+===2H2O
1
2
3
自我测试
2.某学习小组以肼(N2H4)为原料设计了一种燃料电池,构造如图所示:
其中两个电极均为铂电极,电池的总反应方程式为N2H4+O2===N2+2H2O。下列说法错误的是
A.通入N2H4的一极是电池的负极
B.通入O2的电极反应式为O2+2H2O+4e-===4OH-
C.电池工作一段时间后电解质溶液的pH将变大
D.若消耗16 g N2H4,则理论上转移2 mol电子
√
得电子
正极
n(OH-)不变,但水的质量增加,则c(OH-)减小,pH将变小
N2H4 ~ 4e-
0.5 mol
0.5 mol 2 mol
3.如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测,下列说法不正确的是
A.电流由O2所在的铂电极经外电路流向另一电极
B.O2所在的铂电极处发生还原反应
C.该电池的负极反应为CH3CH2OH+3H2O-12e-===2CO2+12H+
D.微处理器通过检测电流大小而计算出被测气体中酒精的含量
1
2
3
自我测试
√
乙醇失电子氧化反应
氧气得电子
还原反应
CH3CH2OH-4e-+H2O===4H++CH3COOH
第3课时 常见化学电源(二)——
形形色色的燃料电池
第1章 第2节
1.理解常见的氢氧燃料电池的工作原理,并能设计简易氢氧燃料电池(重点)。
2.会书写不同介质条件下,其他燃料电池的电极反应(重、难点)。
学习目标
情境导入
燃料电池城市客车
燃料电池和“超级电容”混合动力客车
燃料电池的供电量易于调节,能适应电器负载的变化,而且不需要很长的充电时间,在航天、军事和交通等领域有广阔的应用前景。
制作简易氢氧燃料电
池,并分析其工作原理
一
1.燃料电池的概念
一种连续地将燃料和氧化剂的化学能直接转化
为电能的化学电源。
2.燃料电池的特点
燃料和氧化剂连续地由外部供给并在电极
上进行反应,生成物不断地被排出。
(2) 能量转换率高(>80%),排放的废弃物少。
可共选择的燃料很多,如氢气、烃类、肼、甲醇、氨、煤气等液态或气态燃料。
3.制作简易氢氧燃料电池
设计如表中的装置图,试管A、B中的电极为多孔的石墨惰性电极
实验操作:闭合K1,断开K2,通入电流,电解水,制作H2和O2。
电解一段时间后,A、B中均有气体包围电极,切断K1,闭合K2
结论:H2和O2发生原电池反应产生电流
增强导电性
O2
H2
体积大
指针偏转,两试管中气体体积逐渐减小
分析该氢氧燃料电池的工作原理:
电池反应:2H2+O2===2H2O;
负极:2H2-4e-+4OH-===4H2O;
正极:O2+4e-+2H2O===4OH-;
离子导体:KOH溶液。
氢氧燃料电池的工作原理
思考交流
1.氢氧燃料电池在不同介质中的电极反应
分析下面3种氢氧燃料电池的工作原理示意图,完成表格内容。
思考交流
装置 电池反应:2H2+O2===2H2O 传导离子
A 负极 _________________________ ____
正极 _________________ B 负极 __________________ ____
正极 ________________________ C 负极 ______________________________ _____
正极 ________________________ 2H2-4e-+2O2-===2H2O
O2+4e-===2O2-
2H2-4e-===4H+
O2+4H++4e-===2H2O
H+
O2-
思考交流
2.燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极。
(1)负极是____(填“a”或“b”)。
a
(2)b极的电极反应式是________________________。
O2+2H2O+4e-===4OH-
O2得电子结合水生成氢氧根离子
(3)标准状况下,消耗11.2 L H2时,转移的电子数为________________。
6.02×1023(或NA)
常见有机物燃料电池、熔融氧化物
(盐)燃料电池的种类及工作原理
二
1.甲烷燃料电池成本远低于以氢气为燃料的传统燃料电池。
(1)在酸性介质中
负极反应式:______________________;
正极反应式:______________________;
总反应式:________________________。
答案 CH4+2H2O-8e-===CO2+8H+
2O2+8H++8e-===4H2O
CH4+2O2===CO2+2H2O
(2)在碱性(KOH溶液)介质中
负极反应式: ;
正极反应式: ;
总反应式: 。
归纳总结
在酸性介质和碱性介质中甲烷燃料电池的总反应不同
酸性条件下,+4价碳元素全部转化为CO2;
碱性条件下,+4价碳元素全部转化为 。
2.一种固体电解质燃料电池的构造示意图如图所示。该电池以稀土金属材料作电极,两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-。
负极反应式:__________________;
正极反应式:__________________;
总反应式:____________________。
答案 CH4+4O2--8e-===CO2+2H2O
2O2+8e-===4O2-
CH4+2O2===CO2+2H2O
3.一种熔融碳酸盐燃料电池工作原理如图所示。
(1)电池工作时,外电路上电流的方向应从电极____(填“A”或“B”,下同)流向用电器。
(3)电极A上CO参与的电极反应为_______________________。
答案 A
答案 B
(2) 向电极____移动。
答案 CO-2e-+ ===2CO2
归纳总结
燃料电池电极反应式书写的方法
第一步:写出燃料电池的总反应式
燃料电池的总反应与燃料的燃烧反应一致,若产物能和电解质反应,则总反应为加和后的反应。
第二步:写出电池的正极反应式
正极反应物一般为氧气得电子,介质不同时其电极反应式有所不同,如:
酸性电解质溶液:O2+4H++4e-===2H2O;
归纳总结
碱性电解质溶液:O2+2H2O+4e-===4OH-;
固体电解质(高温下能传导O2-):O2+4e-===2O2-;
熔融碳酸盐(如熔融K2CO3):O2+2CO2+4e-=== 。
第三步:根据电池总反应式和正极反应式,写出负极反应式。电池反应的总反应式-电池正极反应式=电池负极反应式。因为O2不是负极反应物,因此两个反应式相减时要彻底消除O2。
1
2
3
自我测试
1.氢氧燃料电池具有绿色环保和高效等特点,某种氢氧燃料电池的结构示意图如图,该电池工作时
A.a处通入O2
B.甲电极为负极
C.将电能转化为化学能
D.正极反应式为H2-2e-===2H+
√
H2
O2
失电子,发生氧化反应
负极
得电子,发生还原反应
正极
化学能转化为电能
O2+4e-+4H+===2H2O
1
2
3
自我测试
2.某学习小组以肼(N2H4)为原料设计了一种燃料电池,构造如图所示:
其中两个电极均为铂电极,电池的总反应方程式为N2H4+O2===N2+2H2O。下列说法错误的是
A.通入N2H4的一极是电池的负极
B.通入O2的电极反应式为O2+2H2O+4e-===4OH-
C.电池工作一段时间后电解质溶液的pH将变大
D.若消耗16 g N2H4,则理论上转移2 mol电子
√
得电子
正极
n(OH-)不变,但水的质量增加,则c(OH-)减小,pH将变小
N2H4 ~ 4e-
0.5 mol
0.5 mol 2 mol
3.如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测,下列说法不正确的是
A.电流由O2所在的铂电极经外电路流向另一电极
B.O2所在的铂电极处发生还原反应
C.该电池的负极反应为CH3CH2OH+3H2O-12e-===2CO2+12H+
D.微处理器通过检测电流大小而计算出被测气体中酒精的含量
1
2
3
自我测试
√
乙醇失电子氧化反应
氧气得电子
还原反应
CH3CH2OH-4e-+H2O===4H++CH3COOH
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
