1.3 第3课时 电解原理的创新应用 课件(共22张PPT)-高中化学鲁科版选择性必修第一册
文档属性
| 名称 | 1.3 第3课时 电解原理的创新应用 课件(共22张PPT)-高中化学鲁科版选择性必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 763.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-28 15:05:12 | ||
图片预览






文档简介
(共22张PPT)
第3课时 电解原理的创新应用
第1章 第3节
1.了解电解原理在工农业生产中的广泛应用。
2.进一步掌握电解问题分析的一般方法,巩固陌生电解装置中电极反应式的书
写方法(重、难点)。
学习目标
电解在物质的转化与制备方面的应用
一
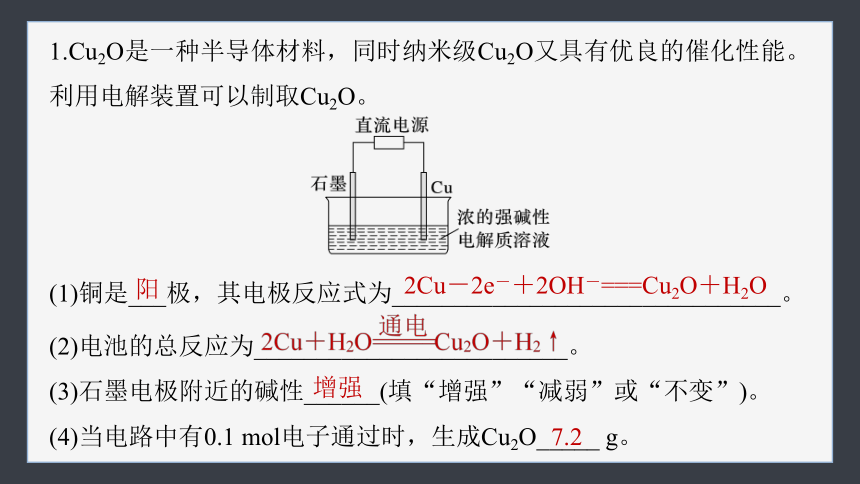
1.Cu2O是一种半导体材料,同时纳米级Cu2O又具有优良的催化性能。利用电解装置可以制取Cu2O。
(1)铜是___极,其电极反应式为_______________________________。
(2)电池的总反应为_________________________。
(3)石墨电极附近的碱性______(填“增强”“减弱”或“不变”)。
(4)当电路中有0.1 mol电子通过时,生成Cu2O_____ g。
阳
2Cu-2e-+2OH-===Cu2O+H2O
增强
7.2
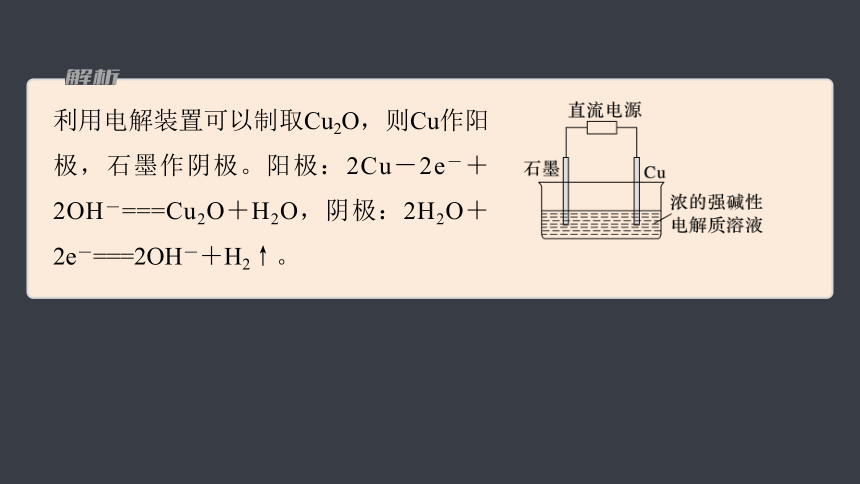
利用电解装置可以制取Cu2O,则Cu作阳极,石墨作阴极。阳极:2Cu-2e-+2OH-===Cu2O+H2O,阴极:2H2O+2e-===2OH-+H2↑。
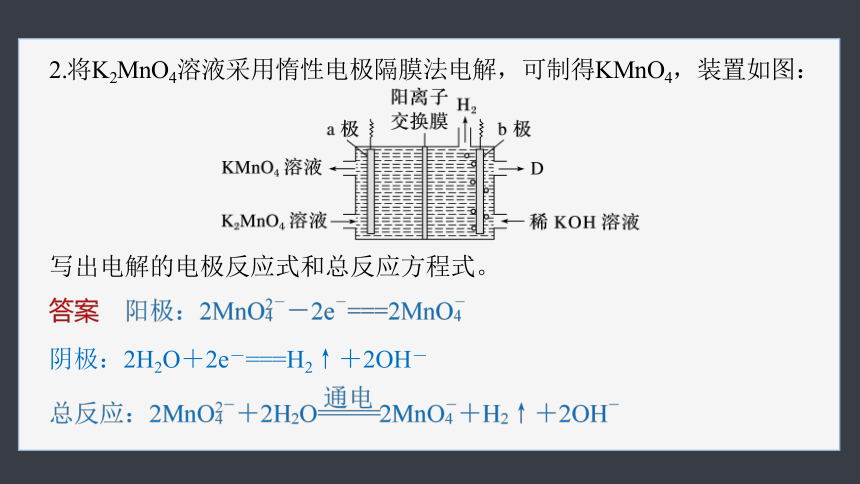
2.将K2MnO4溶液采用惰性电极隔膜法电解,可制得KMnO4,装置如图:
写出电解的电极反应式和总反应方程式。
阴极:2H2O+2e-===H2↑+2OH-
3.许多有机化学反应包含电子的转移,使这些反应在电解池中进行时称为电有机合成。一种由丙烯腈电有机合成己二腈的反应为4CH2===
CHCN+2H2O 2NC(CH2)4CN+O2↑,写出电解时的电极反应式。
答案 阳极:2H2O-4e-===O2↑+4H+
阴极:4CH2===CHCN+4H++4e-===2NC(CH2)4CN
4.以铝材为阳极,电解H2SO4溶液,铝材表面形成氧化膜:
阳极反应式:_____________________________;
阴极反应式:___________________;
总反应式: ___________________________。
2Al-6e-+3H2O===Al2O3+6H+
6H++6e-===3H2↑
配平电极反应式的思路方法
步骤1:运用得失电子守恒,配平变价物质的计量数和得失电子数。
步骤2:运用电荷守恒,配平H+或OH—等离子的计量数。
一般,强酸性环境用H+调电荷;强碱性环境用OH-调电荷。其他情况:生成物中加H+或OH-。
步骤3:运用质量守恒配平其他物质的计量数,如H2O等。
归纳总结
电解原理在水处理方面的应用
二
5.电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示,电极为惰性电极。已知海水中含Na+、Cl-、Ca2+、Mg2+、
等离子。下列叙述正确的是
A.A膜是阳离子交换膜
B.通电后,海水中阴离子向b电极处移动
C.通电后,b电极上产生无色气体,溶液中出现白色沉淀
D.通电后,a电极的电极反应式为2H2O-4e-===O2↑+4H+
√
A错,a电极为电解池的阳极,且在电解池中阴离子向阳极移动,所以A膜是阴离子交换膜;
B错,通电后,海水中阴离子向阳极(a电极)处移动;
C对,阳离子放电能力:H+>Mg2+>Na+>Ca2+,所以通电后,H+在阴极(b电极)上放电:2H++2e-===H2↑,产生无色气体,由于破坏了附近水的电离平衡,在该区域c(OH-)增大,会发生反应:Mg2++2OH-===Mg(OH)2↓,所以溶液中会出现白色沉淀;
D错,阴离子放电能力:Cl->OH-,所以通电后,在阳极发生反应:2Cl--2e-===Cl2↑。
6.用铁和石墨作电极电解酸性废水,可将废水中的 以FePO4(不溶于水)的形式除去,其装置如图所示。下列说法正确的是
A.若X、Y电极材料连接反了,仍可将废水中的 除去
B.X极为石墨,该电极上发生氧化反应
C.电解过程中Y极周围溶液的pH减小
D.电解时废水中会发生反应:4Fe2++O2
+4H++ ===4FePO4↓+2H2O
√
根据题意分析可知,X电极材料为铁,Y电极材料为石墨。若X、Y电极材料连接反了,铁就不能失电子变为离子,也就不能生成FePO4,A错误;
Y极为石墨,该电极上发生还原反应,B错误;
电解过程中Y极发生反应:2H++2e-===H2↑,氢离子浓度减小,溶液的pH增大,C错误;
铁在阳极失电子变为Fe2+,通入的氧气把Fe2+氧化为Fe3+,Fe3+与
反应生成FePO4,D正确。
返回
电解原理在废物回收利用方面的应用
三
7.利用电解技术,以氯化氢为原料回收氯气的过程如图所示,下列说法不正确的是
A.H+由阳极区向阴极区迁移
B.阳极反应式:2HCl+2e-===Cl2+2H+
C.阴极反应式:Fe3++e-===Fe2+
D.阴极区发生的反应:4Fe2++O2+4H+===4Fe3++2H2O
√
B项,阳极失电子发生氧化反应,电极反应式:2HCl-2e-===2H++Cl2,错误;
C项,阴极发生还原反应,电极反应式:Fe3++e-===Fe2+,正确;
D项,根据图中的循环,可以推出阴极区会发生反应:4Fe2++O2+4H+===4Fe3++2H2O,正确。
8.我国科研团队开发了一种新型铠甲催化剂Ni/Co@石墨烯,可以高效去除合成气中的H2S杂质并耦合产氢,其工作原理如图所示。下列说法错误的是
A.M电极为阴极
B.电极上生成H2和Sx的物质的量之比为1∶x
C.阳极的电极反应式为xH2S-2xe-===Sx+2xH+
D.铠甲催化剂表面的石墨烯可以保护内部金属免受环境的影响
√
由题图可知,铠甲催化剂电极上H2S转化为Sx,S元素化合价升高,发生氧化反应,则铠甲催化剂电极为阳极,电极反应式为xH2S-2xe-===Sx+2xH+,M电极为阴极,电极反应式为2H++2e-===H2↑,A、C项正确;
根据得失电子守恒可得关系式:xH2~Sx~2xe-,则生成H2和Sx的物质的量之比为x∶1,B项错误;
由于铠甲催化剂电极为阳极,若没有表面的石墨烯,内部金属容易放电,故铠甲催化剂表面的石墨烯可以保护内部金属免受环境的影响,D正确。
9.电解法转化CO2可实现CO2的资源化利用,电解CO2制甲酸盐的装置如图所示。下列说法正确的是
A.b是电源正极
B.K+由乙池向甲池迁移
C.甲池中KHCO3溶液浓度增大,乙池中KHCO3溶液浓度降低
D.乙池电极反应式为
√
通入CO2的乙池电极为阴极,所以b是电源负极,A错误;
电解池中,阳离子向阴极(乙池)移动,B错误;
甲池Pt电极作阳极,OH-失电子生成O2,促进水的电离,电极附近H+浓度增大, 浓度减小,乙池Sn电极为阴极,发生的电极反应为 , 浓度减小,C错误、D正确。
归纳总结
第3课时 电解原理的创新应用
第1章 第3节
1.了解电解原理在工农业生产中的广泛应用。
2.进一步掌握电解问题分析的一般方法,巩固陌生电解装置中电极反应式的书
写方法(重、难点)。
学习目标
电解在物质的转化与制备方面的应用
一
1.Cu2O是一种半导体材料,同时纳米级Cu2O又具有优良的催化性能。利用电解装置可以制取Cu2O。
(1)铜是___极,其电极反应式为_______________________________。
(2)电池的总反应为_________________________。
(3)石墨电极附近的碱性______(填“增强”“减弱”或“不变”)。
(4)当电路中有0.1 mol电子通过时,生成Cu2O_____ g。
阳
2Cu-2e-+2OH-===Cu2O+H2O
增强
7.2
利用电解装置可以制取Cu2O,则Cu作阳极,石墨作阴极。阳极:2Cu-2e-+2OH-===Cu2O+H2O,阴极:2H2O+2e-===2OH-+H2↑。
2.将K2MnO4溶液采用惰性电极隔膜法电解,可制得KMnO4,装置如图:
写出电解的电极反应式和总反应方程式。
阴极:2H2O+2e-===H2↑+2OH-
3.许多有机化学反应包含电子的转移,使这些反应在电解池中进行时称为电有机合成。一种由丙烯腈电有机合成己二腈的反应为4CH2===
CHCN+2H2O 2NC(CH2)4CN+O2↑,写出电解时的电极反应式。
答案 阳极:2H2O-4e-===O2↑+4H+
阴极:4CH2===CHCN+4H++4e-===2NC(CH2)4CN
4.以铝材为阳极,电解H2SO4溶液,铝材表面形成氧化膜:
阳极反应式:_____________________________;
阴极反应式:___________________;
总反应式: ___________________________。
2Al-6e-+3H2O===Al2O3+6H+
6H++6e-===3H2↑
配平电极反应式的思路方法
步骤1:运用得失电子守恒,配平变价物质的计量数和得失电子数。
步骤2:运用电荷守恒,配平H+或OH—等离子的计量数。
一般,强酸性环境用H+调电荷;强碱性环境用OH-调电荷。其他情况:生成物中加H+或OH-。
步骤3:运用质量守恒配平其他物质的计量数,如H2O等。
归纳总结
电解原理在水处理方面的应用
二
5.电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示,电极为惰性电极。已知海水中含Na+、Cl-、Ca2+、Mg2+、
等离子。下列叙述正确的是
A.A膜是阳离子交换膜
B.通电后,海水中阴离子向b电极处移动
C.通电后,b电极上产生无色气体,溶液中出现白色沉淀
D.通电后,a电极的电极反应式为2H2O-4e-===O2↑+4H+
√
A错,a电极为电解池的阳极,且在电解池中阴离子向阳极移动,所以A膜是阴离子交换膜;
B错,通电后,海水中阴离子向阳极(a电极)处移动;
C对,阳离子放电能力:H+>Mg2+>Na+>Ca2+,所以通电后,H+在阴极(b电极)上放电:2H++2e-===H2↑,产生无色气体,由于破坏了附近水的电离平衡,在该区域c(OH-)增大,会发生反应:Mg2++2OH-===Mg(OH)2↓,所以溶液中会出现白色沉淀;
D错,阴离子放电能力:Cl->OH-,所以通电后,在阳极发生反应:2Cl--2e-===Cl2↑。
6.用铁和石墨作电极电解酸性废水,可将废水中的 以FePO4(不溶于水)的形式除去,其装置如图所示。下列说法正确的是
A.若X、Y电极材料连接反了,仍可将废水中的 除去
B.X极为石墨,该电极上发生氧化反应
C.电解过程中Y极周围溶液的pH减小
D.电解时废水中会发生反应:4Fe2++O2
+4H++ ===4FePO4↓+2H2O
√
根据题意分析可知,X电极材料为铁,Y电极材料为石墨。若X、Y电极材料连接反了,铁就不能失电子变为离子,也就不能生成FePO4,A错误;
Y极为石墨,该电极上发生还原反应,B错误;
电解过程中Y极发生反应:2H++2e-===H2↑,氢离子浓度减小,溶液的pH增大,C错误;
铁在阳极失电子变为Fe2+,通入的氧气把Fe2+氧化为Fe3+,Fe3+与
反应生成FePO4,D正确。
返回
电解原理在废物回收利用方面的应用
三
7.利用电解技术,以氯化氢为原料回收氯气的过程如图所示,下列说法不正确的是
A.H+由阳极区向阴极区迁移
B.阳极反应式:2HCl+2e-===Cl2+2H+
C.阴极反应式:Fe3++e-===Fe2+
D.阴极区发生的反应:4Fe2++O2+4H+===4Fe3++2H2O
√
B项,阳极失电子发生氧化反应,电极反应式:2HCl-2e-===2H++Cl2,错误;
C项,阴极发生还原反应,电极反应式:Fe3++e-===Fe2+,正确;
D项,根据图中的循环,可以推出阴极区会发生反应:4Fe2++O2+4H+===4Fe3++2H2O,正确。
8.我国科研团队开发了一种新型铠甲催化剂Ni/Co@石墨烯,可以高效去除合成气中的H2S杂质并耦合产氢,其工作原理如图所示。下列说法错误的是
A.M电极为阴极
B.电极上生成H2和Sx的物质的量之比为1∶x
C.阳极的电极反应式为xH2S-2xe-===Sx+2xH+
D.铠甲催化剂表面的石墨烯可以保护内部金属免受环境的影响
√
由题图可知,铠甲催化剂电极上H2S转化为Sx,S元素化合价升高,发生氧化反应,则铠甲催化剂电极为阳极,电极反应式为xH2S-2xe-===Sx+2xH+,M电极为阴极,电极反应式为2H++2e-===H2↑,A、C项正确;
根据得失电子守恒可得关系式:xH2~Sx~2xe-,则生成H2和Sx的物质的量之比为x∶1,B项错误;
由于铠甲催化剂电极为阳极,若没有表面的石墨烯,内部金属容易放电,故铠甲催化剂表面的石墨烯可以保护内部金属免受环境的影响,D正确。
9.电解法转化CO2可实现CO2的资源化利用,电解CO2制甲酸盐的装置如图所示。下列说法正确的是
A.b是电源正极
B.K+由乙池向甲池迁移
C.甲池中KHCO3溶液浓度增大,乙池中KHCO3溶液浓度降低
D.乙池电极反应式为
√
通入CO2的乙池电极为阴极,所以b是电源负极,A错误;
电解池中,阳离子向阴极(乙池)移动,B错误;
甲池Pt电极作阳极,OH-失电子生成O2,促进水的电离,电极附近H+浓度增大, 浓度减小,乙池Sn电极为阴极,发生的电极反应为 , 浓度减小,C错误、D正确。
归纳总结
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
