第1章 第2、3节复习课 第1课时 新型化学电源工作原理的分析 课件(共27张PPT)-高中化学鲁科版选择性必修第一册
文档属性
| 名称 | 第1章 第2、3节复习课 第1课时 新型化学电源工作原理的分析 课件(共27张PPT)-高中化学鲁科版选择性必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 988.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-28 15:45:25 | ||
图片预览






文档简介
(共27张PPT)
第1课时 新型化学电源工作
原理的分析
第1章 第2、3节复习课
1.掌握二次电池充放电过程的分析思路(重、难点)。
2.了解常见新型化学电源的种类。
学习目标
二次电池的充放电原理
一
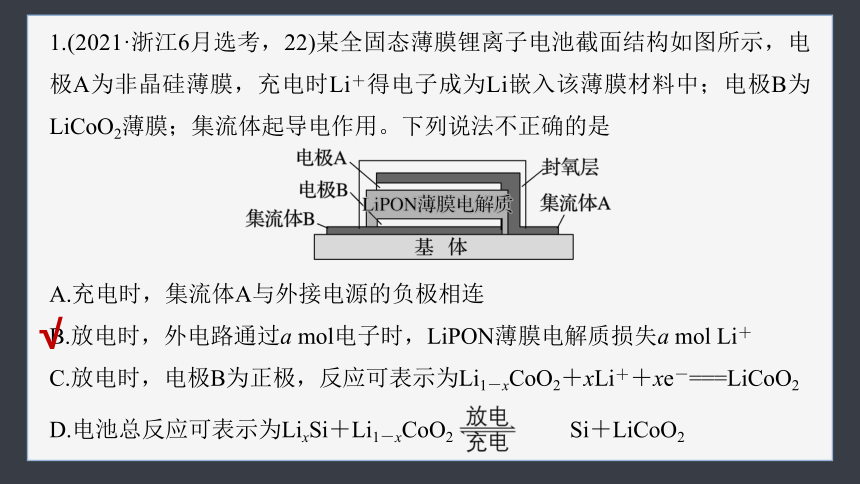
1.(2021·浙江6月选考,22)某全固态薄膜锂离子电池截面结构如图所示,电极A为非晶硅薄膜,充电时Li+得电子成为Li嵌入该薄膜材料中;电极B为LiCoO2薄膜;集流体起导电作用。下列说法不正确的是
A.充电时,集流体A与外接电源的负极相连
B.放电时,外电路通过a mol电子时,LiPON薄膜电解质损失a mol Li+
C.放电时,电极B为正极,反应可表示为Li1-xCoO2+xLi++xe-===LiCoO2
D.电池总反应可表示为LixSi+Li1-xCoO2 Si+LiCoO2
√
由图可知,集流体A与电极A相连,充电时电极A作阴极,故充电时集流体A与外接电源的负极相连,A说法正确;
放电时,外电路通过a mol电子时,内电路中有a mol Li+通过LiPON薄膜电解质从负极迁移到正极,但是LiPON薄膜电解质没有损失Li+,B说法不正确;
放电时,电极B为正极,发生还原反应,反应式为Li1-xCoO2+xLi++xe-===LiCoO2,C说法正确;
电池放电时,嵌入在非晶硅薄膜中的锂失去电子转化为Li+,正极上Li1-xCoO2得到电子和Li+转化为LiCoO2,故电池总反应可表示为LixSi+
Li1-xCoO2 Si+LiCoO2,D说法正确。
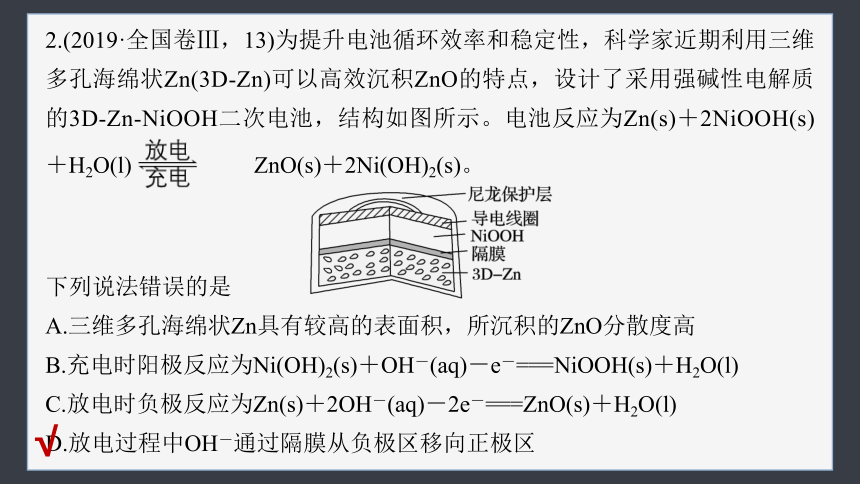
2.(2019·全国卷Ⅲ,13)为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D-Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D-Zn-NiOOH二次电池,结构如图所示。电池反应为Zn(s)+2NiOOH(s)
+H2O(l) ZnO(s)+2Ni(OH)2(s)。
下列说法错误的是
A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B.充电时阳极反应为Ni(OH)2(s)+OH-(aq)-e-===NiOOH(s)+H2O(l)
C.放电时负极反应为Zn(s)+2OH-(aq)-2e-===ZnO(s)+H2O(l)
D.放电过程中OH-通过隔膜从负极区移向正极区
√
该电池采用的三维多孔海绵状Zn具有较高的表面积,可以高效沉积ZnO,且所沉积的ZnO分散度高,A正确;
根据题干中总反应可知,该电池充电时,Ni(OH)2在阳极发生氧化反应生成NiOOH,其电极反应式为Ni(OH)2(s)+OH-(aq)-e-===NiOOH(s)
+H2O(l),B正确;
放电时Zn在负极发生氧化反应生成ZnO,电极反应式为Zn(s)+2OH-(aq)-2e-===ZnO(s)+H2O(l),C正确;
电池放电过程中,OH-等阴离子通过隔膜从正极区移向负极区,D错误。
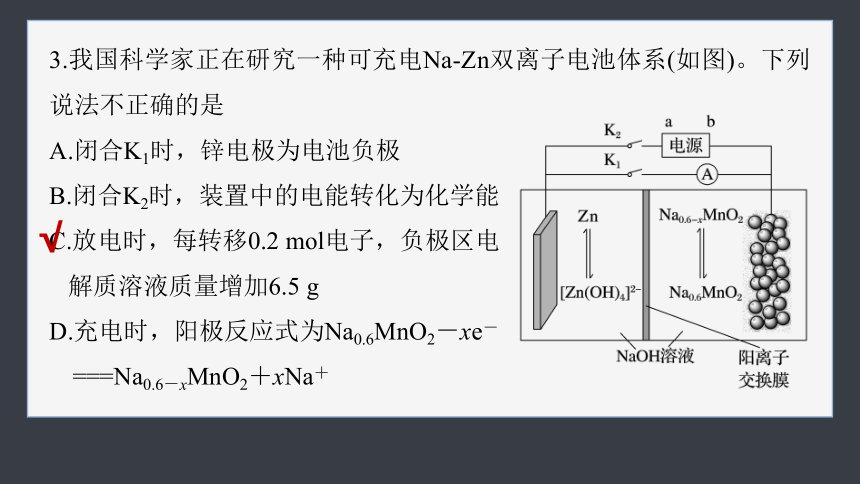
3.我国科学家正在研究一种可充电Na-Zn双离子电池体系(如图)。下列说法不正确的是
A.闭合K1时,锌电极为电池负极
B.闭合K2时,装置中的电能转化为化学能
C.放电时,每转移0.2 mol电子,负极区电
解质溶液质量增加6.5 g
D.充电时,阳极反应式为Na0.6MnO2-xe-
===Na0.6-xMnO2+xNa+
√
闭合K1时,该装置为原电池,锌电极为负极,A正确;
闭合K2时,该装置为电解池,电解池是将电能转化为化学能,B正确;
放电时,装置为原电池,负极发生反应:Zn-2e-+4OH-===[Zn(OH)4]2-,每
转移0.2 mol电子,负极区由Zn失去电子生成0.1 mol [Zn(OH)4]2-,有0.2 molNa+通过阳离子交换膜到正极,故负极区电解质溶液质量增重0.1 mol×65 g·mol-1-0.2 mol×23 g·mol-1=1.9 g,C错误;
充电时,阳极失电子,Mn元素的化合价升高,电极反应式为Na0.6MnO2-xe-===Na0.6-xMnO2+xNa+,D正确。
二次电池题目的解答思路
归纳总结
常考新型化学电源
二
类型一 浓差电池
1.某化学兴趣小组将两个完全相同的铜片分别放入体积相同、浓度不同的CuSO4溶液中形成浓差电池(如图所示),当两极附近电解质溶液浓度相等时停止放电。下列说法正确的是
A.Cu(2)极发生还原反应
B.Cu(1)极附近Cu2+通过膜1向右迁移
C.放电过程中,两膜之间的c(CuSO4)
理论上保持不变
D.当Cu(2)极附近c(CuSO4)变为1 mol·L-1
时,该电池停止放电
√
Cu(1)极附近硫酸铜溶液浓度大于Cu(2)极,故Cu(1)极的电解质溶液浓度降低,即Cu(1)极为正极,Cu(2)极为负极,发生氧化反应,电极反应为Cu-2e-===Cu2+,A项错误;
Cu(1)极的电极反应式为Cu2++2e-===Cu,为了维持电荷平衡, 通过膜1向右迁移,B项错误;
理论上两膜之间的硫酸铜溶液浓度保持不变,C项正确;
理论上正、负两极硫酸铜溶液浓度均为0.55 mol·L-1时,该电池停止放电,D项错误。
类型二 电催化剂(电子传递体)电池
2.(2019·全国卷Ⅰ,12)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如图所示。下列说法错误的是
A.相比现有工业合成氨,该方法条件温和,同时还可提供电能
B.阴极区,在氢化酶作用下发生反应H2+2MV2+===2H++2MV+
C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D.电池工作时质子通过交换膜由负极区向正极区移动
√
由题图和题意知,电池总反应是3H2+N2===2NH3。该合成氨反应在常温下进行,并形成原电池产生电能,反应不需要高温、高压和催化剂,A项正确;
观察题图知,左边电极发生氧化反应MV+-e-===MV2+,为负极,不是阴极,B项错误;
正极区N2在固氮酶作用下发生还原反应生成NH3,C项正确;
电池工作时,H+通过交换膜,由左侧(负极区)向右侧(正极区)迁移,D项正确。
3.近年来AIST报告正在研制一种“高容量、低成本”锂-铜空气燃料电池,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-,如图所示。下列说法不正确的是
A.放电时,Li+透过固体电解质向Cu极移动
B.放电时,负极的电极反应式为Cu2O+H2O
+2e-===2Cu+2OH-
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,铜相当于催化剂
√
由题中装置图和放电时总反应可知,放电时Li为负极,Cu为正极,阳离子向正极移动,A项正确;
放电时,负极Li失电子转化成Li+,B项错误;
结合题中装置图可知,通入空气时,铜被腐蚀,生成Cu2O,C项正确;
铜被腐蚀生成Cu2O,放电时Cu2O又被还原成Cu,所以整个反应过程中Cu相当于催化剂,D项正确。
类型三 太阳能转化电池
4.(2022·全国乙卷,12)Li-O2电池比能量高,在汽车、航天等领域具有良好的应用前景。近年来,科学家研究了一种光照充电Li-O2电池(如图所示)。光照时,光催化电极产生电子(e-)和空穴(h+),驱动阴极反应(Li++e-===Li)和阳极反应(Li2O2+2h+===2Li++O2)对电池进行充电。下列叙述错误的是
A.充电时,电池的总反应为Li2O2===2Li+O2
B.充电效率与光照产生的电子和空穴量有关
C.放电时,Li+从正极穿过离子交换膜向负
极迁移
D.放电时,正极发生反应:O2+2Li++2e-
===Li2O2
√
充电时为电解池,由题目信息知,光照时,光催化电极产生电子和空穴,驱动阴极反应(Li++e-===Li)和阳极反应(Li2O2+2h+===
2Li++O2),则充电时,电池的总反应为Li2O2===2Li+O2,因此,充电效率与光照产生的电子和空穴量有关,A、B正确;
放电时,金属Li电极为负极,光催化电极为正极,Li+从负极穿过离子交换膜向正极迁移,C错误;
放电时,电池总反应为2Li+O2===Li2O2,则正极反应为O2+2Li++2e-===Li2O2,D正确。
5.我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如下所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为
①EDTA-Fe2+-e-===EDTA-Fe3+
②2EDTA-Fe3++H2S===2H++S+2EDTA-Fe2+
该装置工作时,下列叙述错误的是
A.阴极的电极反应:CO2+2H++2e-===CO+H2O
B.协同转化总反应:CO2+H2S===CO+H2O+S
C.石墨烯上的电势比ZnO@石墨烯上的低
D.若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需为酸性
√
由题中信息可知,石墨烯电极发生氧化反应,为电解池的阳极,则ZnO@石墨烯电极为阴极。阳极接电源正极,电势高,阴极接电源负极,电势低,故石墨烯上的电势比ZnO@石墨烯上的高,C项错误;
由题图可知,电解时阴极反应式为CO2+2H++2e-===CO+H2O,A项正确;
将阴、阳两极反应式合并可得总反应式为CO2+H2S===CO+H2O+S,B项正确;
Fe3+、Fe2+只能存在于酸性溶液中,D项正确。
类型四 液流储能电池
6.(2022·辽宁,14)某储能电池原理如图。下列说法正确的是
A.放电时负极反应:Na3Ti2(PO4)3-2e-===NaTi2(PO4)3+2Na+
B.放电时Cl-透过多孔活性炭电极向CCl4中迁移
C.放电时每转移1 mol电子,理论上CCl4吸收0.5 mol Cl2
D.充电过程中,NaCl溶液浓度增大
√
放电时负极失电子,发生氧化反应,电极反应:Na3Ti2(PO4)3-2e-===NaTi2(PO4)3+2Na+,故A正确;
放电时,阴离子移向负极,则放电时Cl-透过多孔活性炭电极向NaCl中迁移,故B错误;
正极电极反应:Cl2+2e-===2Cl-,放电时每转移1 mol电子,理论上CCl4释放0.5 mol Cl2,故C错误;
充电过程中,阳极电极反应:2Cl--2e-===Cl2 ,消耗氯离子,NaCl溶液浓度减小,故D错误。
类型五 金属二次电池
7.(2022·贵州遵义高二质检)镍镉电池是一种新型的封闭式体积小的可充电电池。其工作原理如图所示,下列说法错误的是
A.放电时b极为正极
B.放电时a极的反应:Cd+2e-+2OH-===Cd(OH)2
C.充电时电流的方向:外电源正极→b极→电解质溶液→a极
D.用该电池提供的电能电解饱和食盐水,当电路中通过0.2 mol e-,
阴极生成0.2 g H2
√
根据图中信息及电子从a极转移到b极,因此放电时a极为负极,b极为正极,故A正确;
根据图示信息,放电时a极的反应:Cd-2e-+2OH-===Cd(OH)2,故B错误;
充电时电流的方向:外电源正极→阳极(b极)→电解质溶液→阴极(a极)→外电源负极,故C正确;
用该电池提供的电能电解饱和食盐水,阴极反应为2H++2e-===H2↑,电路中通过0.2 mol e-,则阴极生成氢气物质的量为0.1 mol,质量为0.2 g,故D正确。
原电池工作原理的新认识
(1)相同的金属插入相同的电解质溶液中,由于电解质浓度不同,导致两极上氧化反应或还原反应的程度不同,可形成原电池,如浓差电池。
(2)惰性电极材料也可能是原电池的正、负极,只要在电极表面能发生电子的交换就能构成原电池,能向外输出电子的电极为负极,能从电极上获取电子的为正极反应物,该电极为正极。
归纳总结
(3)能源物质(燃料)不一定将电子直接传给负极,可能与电催化剂(电子传递体)进行电子交换,因而要特别关注催化循环中物质的变化、电子的转移方向及反应类型。
(4)储能(充电)过程,不一定是电能转化为化学能,也可能是光能直接转化为化学能。
归纳总结
第1课时 新型化学电源工作
原理的分析
第1章 第2、3节复习课
1.掌握二次电池充放电过程的分析思路(重、难点)。
2.了解常见新型化学电源的种类。
学习目标
二次电池的充放电原理
一
1.(2021·浙江6月选考,22)某全固态薄膜锂离子电池截面结构如图所示,电极A为非晶硅薄膜,充电时Li+得电子成为Li嵌入该薄膜材料中;电极B为LiCoO2薄膜;集流体起导电作用。下列说法不正确的是
A.充电时,集流体A与外接电源的负极相连
B.放电时,外电路通过a mol电子时,LiPON薄膜电解质损失a mol Li+
C.放电时,电极B为正极,反应可表示为Li1-xCoO2+xLi++xe-===LiCoO2
D.电池总反应可表示为LixSi+Li1-xCoO2 Si+LiCoO2
√
由图可知,集流体A与电极A相连,充电时电极A作阴极,故充电时集流体A与外接电源的负极相连,A说法正确;
放电时,外电路通过a mol电子时,内电路中有a mol Li+通过LiPON薄膜电解质从负极迁移到正极,但是LiPON薄膜电解质没有损失Li+,B说法不正确;
放电时,电极B为正极,发生还原反应,反应式为Li1-xCoO2+xLi++xe-===LiCoO2,C说法正确;
电池放电时,嵌入在非晶硅薄膜中的锂失去电子转化为Li+,正极上Li1-xCoO2得到电子和Li+转化为LiCoO2,故电池总反应可表示为LixSi+
Li1-xCoO2 Si+LiCoO2,D说法正确。
2.(2019·全国卷Ⅲ,13)为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D-Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D-Zn-NiOOH二次电池,结构如图所示。电池反应为Zn(s)+2NiOOH(s)
+H2O(l) ZnO(s)+2Ni(OH)2(s)。
下列说法错误的是
A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B.充电时阳极反应为Ni(OH)2(s)+OH-(aq)-e-===NiOOH(s)+H2O(l)
C.放电时负极反应为Zn(s)+2OH-(aq)-2e-===ZnO(s)+H2O(l)
D.放电过程中OH-通过隔膜从负极区移向正极区
√
该电池采用的三维多孔海绵状Zn具有较高的表面积,可以高效沉积ZnO,且所沉积的ZnO分散度高,A正确;
根据题干中总反应可知,该电池充电时,Ni(OH)2在阳极发生氧化反应生成NiOOH,其电极反应式为Ni(OH)2(s)+OH-(aq)-e-===NiOOH(s)
+H2O(l),B正确;
放电时Zn在负极发生氧化反应生成ZnO,电极反应式为Zn(s)+2OH-(aq)-2e-===ZnO(s)+H2O(l),C正确;
电池放电过程中,OH-等阴离子通过隔膜从正极区移向负极区,D错误。
3.我国科学家正在研究一种可充电Na-Zn双离子电池体系(如图)。下列说法不正确的是
A.闭合K1时,锌电极为电池负极
B.闭合K2时,装置中的电能转化为化学能
C.放电时,每转移0.2 mol电子,负极区电
解质溶液质量增加6.5 g
D.充电时,阳极反应式为Na0.6MnO2-xe-
===Na0.6-xMnO2+xNa+
√
闭合K1时,该装置为原电池,锌电极为负极,A正确;
闭合K2时,该装置为电解池,电解池是将电能转化为化学能,B正确;
放电时,装置为原电池,负极发生反应:Zn-2e-+4OH-===[Zn(OH)4]2-,每
转移0.2 mol电子,负极区由Zn失去电子生成0.1 mol [Zn(OH)4]2-,有0.2 molNa+通过阳离子交换膜到正极,故负极区电解质溶液质量增重0.1 mol×65 g·mol-1-0.2 mol×23 g·mol-1=1.9 g,C错误;
充电时,阳极失电子,Mn元素的化合价升高,电极反应式为Na0.6MnO2-xe-===Na0.6-xMnO2+xNa+,D正确。
二次电池题目的解答思路
归纳总结
常考新型化学电源
二
类型一 浓差电池
1.某化学兴趣小组将两个完全相同的铜片分别放入体积相同、浓度不同的CuSO4溶液中形成浓差电池(如图所示),当两极附近电解质溶液浓度相等时停止放电。下列说法正确的是
A.Cu(2)极发生还原反应
B.Cu(1)极附近Cu2+通过膜1向右迁移
C.放电过程中,两膜之间的c(CuSO4)
理论上保持不变
D.当Cu(2)极附近c(CuSO4)变为1 mol·L-1
时,该电池停止放电
√
Cu(1)极附近硫酸铜溶液浓度大于Cu(2)极,故Cu(1)极的电解质溶液浓度降低,即Cu(1)极为正极,Cu(2)极为负极,发生氧化反应,电极反应为Cu-2e-===Cu2+,A项错误;
Cu(1)极的电极反应式为Cu2++2e-===Cu,为了维持电荷平衡, 通过膜1向右迁移,B项错误;
理论上两膜之间的硫酸铜溶液浓度保持不变,C项正确;
理论上正、负两极硫酸铜溶液浓度均为0.55 mol·L-1时,该电池停止放电,D项错误。
类型二 电催化剂(电子传递体)电池
2.(2019·全国卷Ⅰ,12)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如图所示。下列说法错误的是
A.相比现有工业合成氨,该方法条件温和,同时还可提供电能
B.阴极区,在氢化酶作用下发生反应H2+2MV2+===2H++2MV+
C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D.电池工作时质子通过交换膜由负极区向正极区移动
√
由题图和题意知,电池总反应是3H2+N2===2NH3。该合成氨反应在常温下进行,并形成原电池产生电能,反应不需要高温、高压和催化剂,A项正确;
观察题图知,左边电极发生氧化反应MV+-e-===MV2+,为负极,不是阴极,B项错误;
正极区N2在固氮酶作用下发生还原反应生成NH3,C项正确;
电池工作时,H+通过交换膜,由左侧(负极区)向右侧(正极区)迁移,D项正确。
3.近年来AIST报告正在研制一种“高容量、低成本”锂-铜空气燃料电池,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-,如图所示。下列说法不正确的是
A.放电时,Li+透过固体电解质向Cu极移动
B.放电时,负极的电极反应式为Cu2O+H2O
+2e-===2Cu+2OH-
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,铜相当于催化剂
√
由题中装置图和放电时总反应可知,放电时Li为负极,Cu为正极,阳离子向正极移动,A项正确;
放电时,负极Li失电子转化成Li+,B项错误;
结合题中装置图可知,通入空气时,铜被腐蚀,生成Cu2O,C项正确;
铜被腐蚀生成Cu2O,放电时Cu2O又被还原成Cu,所以整个反应过程中Cu相当于催化剂,D项正确。
类型三 太阳能转化电池
4.(2022·全国乙卷,12)Li-O2电池比能量高,在汽车、航天等领域具有良好的应用前景。近年来,科学家研究了一种光照充电Li-O2电池(如图所示)。光照时,光催化电极产生电子(e-)和空穴(h+),驱动阴极反应(Li++e-===Li)和阳极反应(Li2O2+2h+===2Li++O2)对电池进行充电。下列叙述错误的是
A.充电时,电池的总反应为Li2O2===2Li+O2
B.充电效率与光照产生的电子和空穴量有关
C.放电时,Li+从正极穿过离子交换膜向负
极迁移
D.放电时,正极发生反应:O2+2Li++2e-
===Li2O2
√
充电时为电解池,由题目信息知,光照时,光催化电极产生电子和空穴,驱动阴极反应(Li++e-===Li)和阳极反应(Li2O2+2h+===
2Li++O2),则充电时,电池的总反应为Li2O2===2Li+O2,因此,充电效率与光照产生的电子和空穴量有关,A、B正确;
放电时,金属Li电极为负极,光催化电极为正极,Li+从负极穿过离子交换膜向正极迁移,C错误;
放电时,电池总反应为2Li+O2===Li2O2,则正极反应为O2+2Li++2e-===Li2O2,D正确。
5.我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如下所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为
①EDTA-Fe2+-e-===EDTA-Fe3+
②2EDTA-Fe3++H2S===2H++S+2EDTA-Fe2+
该装置工作时,下列叙述错误的是
A.阴极的电极反应:CO2+2H++2e-===CO+H2O
B.协同转化总反应:CO2+H2S===CO+H2O+S
C.石墨烯上的电势比ZnO@石墨烯上的低
D.若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需为酸性
√
由题中信息可知,石墨烯电极发生氧化反应,为电解池的阳极,则ZnO@石墨烯电极为阴极。阳极接电源正极,电势高,阴极接电源负极,电势低,故石墨烯上的电势比ZnO@石墨烯上的高,C项错误;
由题图可知,电解时阴极反应式为CO2+2H++2e-===CO+H2O,A项正确;
将阴、阳两极反应式合并可得总反应式为CO2+H2S===CO+H2O+S,B项正确;
Fe3+、Fe2+只能存在于酸性溶液中,D项正确。
类型四 液流储能电池
6.(2022·辽宁,14)某储能电池原理如图。下列说法正确的是
A.放电时负极反应:Na3Ti2(PO4)3-2e-===NaTi2(PO4)3+2Na+
B.放电时Cl-透过多孔活性炭电极向CCl4中迁移
C.放电时每转移1 mol电子,理论上CCl4吸收0.5 mol Cl2
D.充电过程中,NaCl溶液浓度增大
√
放电时负极失电子,发生氧化反应,电极反应:Na3Ti2(PO4)3-2e-===NaTi2(PO4)3+2Na+,故A正确;
放电时,阴离子移向负极,则放电时Cl-透过多孔活性炭电极向NaCl中迁移,故B错误;
正极电极反应:Cl2+2e-===2Cl-,放电时每转移1 mol电子,理论上CCl4释放0.5 mol Cl2,故C错误;
充电过程中,阳极电极反应:2Cl--2e-===Cl2 ,消耗氯离子,NaCl溶液浓度减小,故D错误。
类型五 金属二次电池
7.(2022·贵州遵义高二质检)镍镉电池是一种新型的封闭式体积小的可充电电池。其工作原理如图所示,下列说法错误的是
A.放电时b极为正极
B.放电时a极的反应:Cd+2e-+2OH-===Cd(OH)2
C.充电时电流的方向:外电源正极→b极→电解质溶液→a极
D.用该电池提供的电能电解饱和食盐水,当电路中通过0.2 mol e-,
阴极生成0.2 g H2
√
根据图中信息及电子从a极转移到b极,因此放电时a极为负极,b极为正极,故A正确;
根据图示信息,放电时a极的反应:Cd-2e-+2OH-===Cd(OH)2,故B错误;
充电时电流的方向:外电源正极→阳极(b极)→电解质溶液→阴极(a极)→外电源负极,故C正确;
用该电池提供的电能电解饱和食盐水,阴极反应为2H++2e-===H2↑,电路中通过0.2 mol e-,则阴极生成氢气物质的量为0.1 mol,质量为0.2 g,故D正确。
原电池工作原理的新认识
(1)相同的金属插入相同的电解质溶液中,由于电解质浓度不同,导致两极上氧化反应或还原反应的程度不同,可形成原电池,如浓差电池。
(2)惰性电极材料也可能是原电池的正、负极,只要在电极表面能发生电子的交换就能构成原电池,能向外输出电子的电极为负极,能从电极上获取电子的为正极反应物,该电极为正极。
归纳总结
(3)能源物质(燃料)不一定将电子直接传给负极,可能与电催化剂(电子传递体)进行电子交换,因而要特别关注催化循环中物质的变化、电子的转移方向及反应类型。
(4)储能(充电)过程,不一定是电能转化为化学能,也可能是光能直接转化为化学能。
归纳总结
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
