第1章 章末复习-高中化学鲁科版选择性必修第一册(31张)
文档属性
| 名称 | 第1章 章末复习-高中化学鲁科版选择性必修第一册(31张) |  | |
| 格式 | pptx | ||
| 文件大小 | 961.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-28 22:07:40 | ||
图片预览









文档简介
(共31张PPT)
章末复习
第1章
体系构建 理清脉络
一
(一)化学能与热能的转化
化学反应的热效应
表示方法
热化学方程式
意义:表明物质的变化和焓变
书写:方法及注意事项
描述
反应热:Q
焓变:ΔH
计算
依据
ΔH=H(反应产物)-H(反应物)
盖斯定律
分类
放热反应:ΔH<0
吸热反应:ΔH>0
测量
原理:Q=-C(T2-T1)
装置:量热计
键能
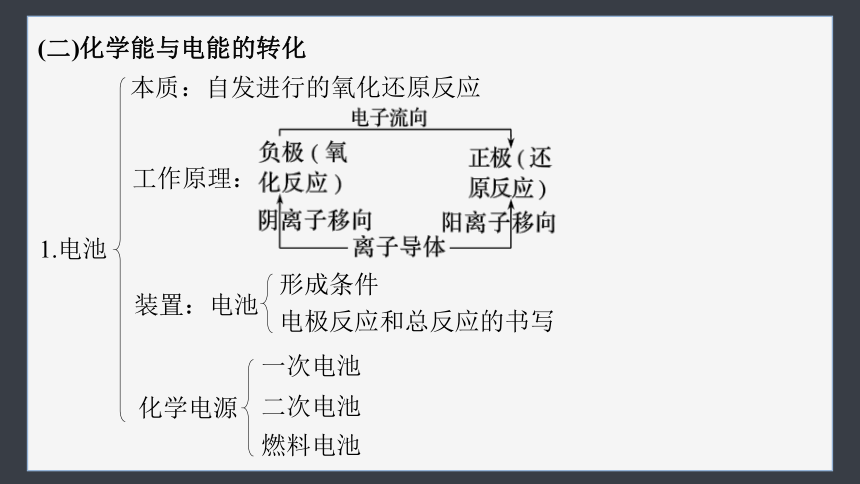
(二)化学能与电能的转化
1.电池
本质:自发进行的氧化还原反应
工作原理:
装置:电池
形成条件
电极反应和总反应的书写
化学电源
一次电池
二次电池
燃料电池
2.电解
概念:将直流电通过熔融电解质或电解质溶液,在两个电极上分别发
生氧化反应及还原反应的过程
电解池
能量变化:电能转化为化学能
装置构成:直流电源、固体电极材料以及电解质溶液或熔融
电解质
反应原理:
应用
氯碱工业:2NaCl+2H2O 2NaOH+H2↑+Cl2↑
电镀:①镀件作阴极;②镀层金属作阳极; ③电镀液中含有
镀层金属离子
电解精炼铜:①纯铜作阴极;②粗铜作阳极;③电解液中含
有Cu2+
3.金属的腐蚀与防护
金属腐蚀
化学腐蚀
电化学腐蚀
析氢腐蚀
吸氧腐蚀
金属防护
电化学防护
牺牲阳极保护法
外加电流阴极保护法
改变金属的内部结构或覆盖保护层等
真题导向
二
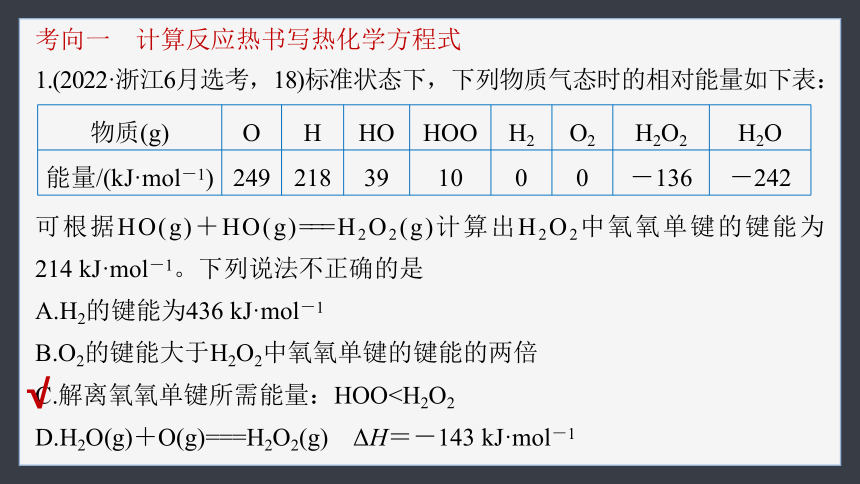
考向一 计算反应热书写热化学方程式
1.(2022·浙江6月选考,18)标准状态下,下列物质气态时的相对能量如下表:
物质(g) O H HO HOO H2 O2 H2O2 H2O
能量/(kJ·mol-1) 249 218 39 10 0 0 -136 -242
可根据HO(g)+HO(g)===H2O2(g)计算出H2O2中氧氧单键的键能为
214 kJ·mol-1。下列说法不正确的是
A.H2的键能为436 kJ·mol-1
B.O2的键能大于H2O2中氧氧单键的键能的两倍
C.解离氧氧单键所需能量:HOOD.H2O(g)+O(g)===H2O2(g) ΔH=-143 kJ·mol-1
√
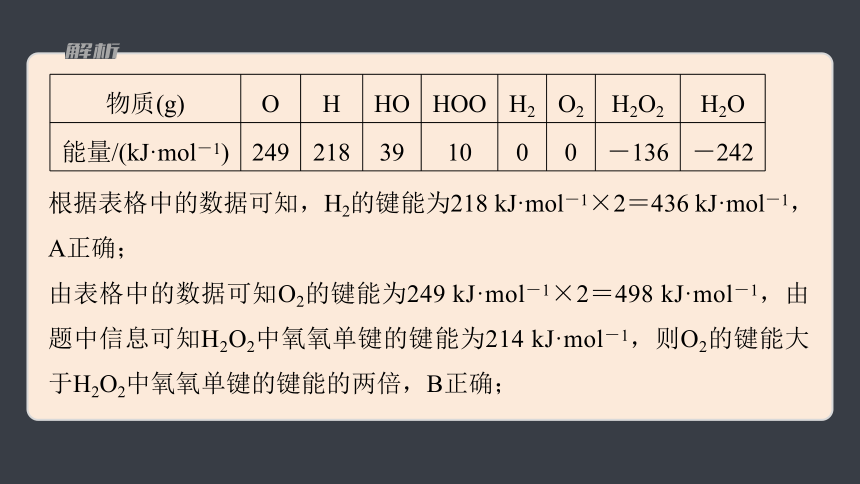
根据表格中的数据可知,H2的键能为218 kJ·mol-1×2=436 kJ·mol-1,A正确;
由表格中的数据可知O2的键能为249 kJ·mol-1×2=498 kJ·mol-1,由题中信息可知H2O2中氧氧单键的键能为214 kJ·mol-1,则O2的键能大于H2O2中氧氧单键的键能的两倍,B正确;
物质(g) O H HO HOO H2 O2 H2O2 H2O
能量/(kJ·mol-1) 249 218 39 10 0 0 -136 -242
由表格中的数据可知HOO===HO+O,解离其中氧氧单键需要的能量为249 kJ·mol-1+39 kJ·mol-1-10 kJ·mol-1=278 kJ·mol-1,H2O2中氧氧单键的键能为214 kJ·mol-1,C错误;
由表中的数据可知H2O(g)+O(g)===H2O2(g)的ΔH=-136 kJ·mol-1-(-242 kJ·mol-1)-249 kJ·mol-1=-143 kJ·mol-1,D正确。
物质(g) O H HO HOO H2 O2 H2O2 H2O
能量/(kJ·mol-1) 249 218 39 10 0 0 -136 -242
2.[2022·河北,16(1)]氢能是极具发展潜力的清洁能源,以氢燃料为代表的燃料电池有良好的应用前景。298 K时,1 g H2燃烧生成H2O(g)放热121 kJ,1 mol H2O(l)蒸发吸热44 kJ,表示H2燃烧热的热化学方程式为
_________________________________________。
298 K时,1 g H2燃烧生成H2O(g)放热121 kJ,1 mol H2O(l)蒸发吸热44 kJ,则1 mol H2完全燃烧生成1 mol H2O(l)放热286 kJ,表示H2燃烧热的热化
学方程式为H2(g)+ O2(g)===H2O(l) ΔH=-286 kJ·mol-1。
考向二 应用盖斯定律计算多步反应的反应热
3.[2022·湖北,19(1)]自发热材料在生活中的应用日益广泛。已知:
①CaO(s)+H2O(l) Ca(OH)2(s) ΔH1=-65.17 kJ·mol-1
②Ca(OH)2(s) Ca2+(aq)+2OH-(aq) ΔH2=-16.73 kJ·mol-1
③Al(s)+OH-(aq)+3H2O(l) [Al(OH)4]-(aq)+ H2(g)
ΔH3=-415.0 kJ·mol-1
则CaO(s)+2Al(s)+7H2O(l)===Ca2+(aq)+2[Al(OH)4]-(aq)+3H2(g)的ΔH4=_______kJ·mol-1。
-911.9
根据盖斯定律,①+②+2×③可得反应CaO(s)+2Al(s)+7H2O(l)===
Ca2+(aq)+2[Al(OH)4]-(aq)+3H2(g),则ΔH4=ΔH1+ΔH2+2ΔH3=(-65.17 kJ·mol-1)+(-16.73 kJ·mol-1)+2×(-415.0 kJ·mol-1)=-911.9 kJ·mol-1。
4.[2022·全国乙卷,28(1)(2)]油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:
(1)已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)===2SO2(g)+2H2O(g) ΔH1=-1 036 kJ·mol-1
②4H2S(g)+2SO2(g)===3S2(g)+4H2O(g) ΔH2=+94 kJ·mol-1
③2H2(g)+O2(g)===2H2O(g) ΔH3=-484 kJ·mol-1
计算H2S热分解反应④2H2S(g)===S2(g)+2H2(g)的ΔH4=______kJ·mol-1。
+170
(2)较普遍采用的H2S处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④高温热分解H2S。相比克劳斯工艺,高温热分解方法的优点是____________________,缺点是________。
副产物氢气可作燃料
耗能高
根据盖斯定律(①+②)× 可得2H2S(g)+O2(g)===S2(g)+2H2O(g) ΔH=
(-1 036+94) kJ·mol-1× =-314 kJ·mol-1,因此,克劳斯工艺的总反
应是放热反应;根据硫化氢分解的化学方程式可知,高温热分解方法在生成单质硫的同时还有氢气生成。因此,高温热分解方法的优点是:可以获得氢气作燃料;但由于高温分解H2S会消耗大量能量,所以其缺点是耗能高。
考向三 新型化学电源
5.(2022·湖南,8)海水电池在海洋能源领域备受关注,一种锂-海水电池构造如图所示。下列说法错误的是
A.海水起电解质溶液作用
B.N极仅发生的电极反应:2H2O+2e-===2OH-+H2↑
C.玻璃陶瓷具有传导离子和防水的功能
D.该锂-海水电池属于一次电池
√
海水中含有丰富的电解质,如氯化钠、氯化镁等,可作为电解质溶液,故A正确;
N为正极,电极反应主要为O2+2H2O+4e-===4OH-,故B错误;
Li为活泼金属,易与水反应,玻璃陶瓷的作用是防止水和Li反应,并能传导离子,故C正确;
该电池不可充电,属于一次电池,故D正确。
6.(2022·全国甲卷,10)一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示[KOH溶液中,Zn2+以 存在]。电池放电时,下列叙述错误的是
A.Ⅱ区的K+通过隔膜向Ⅲ区迁移
B.Ⅰ区的 通过隔膜向Ⅱ区迁移
C.MnO2电极反应:MnO2+2e-+4H+===Mn2++2H2O
D.电池总反应:Zn+4OH-+MnO2+4H+=== +Mn2++2H2O
√
根据图示的电池结构和题目所给信息可知,Ⅲ区Zn为电池的负极,电极反应为Zn-2e-+4OH-=== ,Ⅰ区MnO2为电池的正极,电极反应为MnO2+2e-+4H+===Mn2++2H2O,K+从Ⅲ区通过隔膜向Ⅱ区迁移,A错误、C正确;
Ⅰ区的 通过隔膜向Ⅱ区移动,B正确;
电池的总反应为Zn+4OH-+MnO2+4H+=== +Mn2++2H2O,D正确。
考向四 电解原理的应用
7.(2022·广东,10)以熔融盐为电解液,以含Cu、Mg和Si等的铝合金废料为阳极进行电解,实现Al的再生。该过程中
A.阴极发生的反应为Mg-2e-===Mg2+
B.阴极上Al被氧化
C.在电解槽底部产生含Cu的阳极泥
D.阳极和阴极的质量变化相等
√
该题中以熔融盐为电解液,以含Cu、Mg和Si等的铝合金废料为阳极进行电解,通过控制一定的条件,可使阳极区Mg和Al发生失电子的氧化反应,分别生成Mg2+和Al3+,Cu和Si不参与反应,阴极区Al3+得电子生成Al单质,从而实现Al的再生,A、B错误;
阳极材料中Cu和Si不参与氧化反应,在电解槽底部可形成阳极泥,C正确;
因为阳极除了铝参与电子转移,镁也参与了电子转移,且还会形成阳极泥,而阴极只有铝离子得电子生成铝单质,根据得失电子守恒及元素守恒可知,阳极与阴极的质量变化不相等,D错误。
8.(2022·海南,9)一种采用H2O(g)和N2(g)为原料制备NH3(g)的装置示意图如下。
下列有关说法正确的是
A.在b电极上,N2被还原
B.金属Ag可作为a电极的材料
C.改变工作电源电压,反应速率不变
D.电解过程中,固体氧化物电解质中O2-不断减少
√
由装置示意图可知,b电极上N2转化为NH3,N元素的化合价降低,得到电子发生还原反应,因此b为阴极,电极反应式为N2+3H2O+6e-===2NH3+3O2-,a为阳极,电极反应式为2O2--4e-===O2,据此分析解答。由分析可得,在b电极上,N2被还原,A正确;
a为阳极,若金属Ag作a电极的材料,则金属Ag优先失去电子,B错误;
改变工作电源的电压,导致电流大小改变,反应速率也会改变,C错误;
电解过程中,阴极电极反应式为2N2+6H2O+12e-===4NH3+6O2-,阳极电极反应式为6O2--12e-===3O2,因此固体氧化物电解质中O2-不会减少,D错误。
9.[2019·北京,27(2)]可利用太阳能光伏电池电解水制高纯氢,工作示意图如图。通过控制开关连接K1或K2,可交替得到H2和O2。
①制H2时,连接____。产生H2的电极反应式是__________________________。
②改变开关连接方式,可得O2。
K1
2H2O+2e-===H2↑+2OH-
电解碱性电解液时,H2O电离出的H+在阴极得到电子产生H2,根据题图可知电极1与电池负极连接,为阴极,所以制H2时,连接K1,产生H2的电极反应式为2H2O+2e-===H2↑+2OH-。
③结合①和②中电极3的电极反应,说明电极3的作用:______________________________
______________________________________________________________________________。
制H2时,电极3发生反应:Ni(OH)2
+OH--e-===NiO(OH)+H2O。制O2时,上述电极反应逆向进行,使电极3得以循环使用
制备O2时碱性电解液中的OH-失去电子生成O2,连接K2,O2在电极2上产生。连接K1时,电极3为电解池的阳极,Ni(OH)2失去电子生成NiO(OH),电极反应式为Ni(OH)2-e-+OH-===NiO(OH)+H2O,连接K2时,电极3为电解池的阴极,电极反应式为NiO(OH)+e-+H2O===Ni(OH)2+OH-,使电极3得以循环使用。
10.(2022·山东,13改编)设计如图装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成CO2,将废旧锂离子电池的正极材料LiCoO2(s)转化为Co2+,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是
A.装置工作时,甲室溶液pH逐渐增大
B.装置工作一段时间后,乙室应补充水
C.乙室电极反应式为LiCoO2+2H2O+e-
===Li++Co2++4OH-
D.若甲室Co2+减少200 mg,乙室Co2+增
加300 mg,则此时已进行过溶液转移
√
由于右侧装置为原电池,所以乙室是原电池,甲室是电解池。电池工作时,甲室中细菌上乙酸盐的阴离子失去电子被氧化为CO2气体,Co2+在另一个电极上得到电子,被还原为Co单质,甲室总反应为CH3COO-+4Co2++
2H2O 2CO2↑+4Co+7H+,溶液pH减小,A错误;
乙室电解质溶液为酸性,不可能大量存在OH-,乙室电极反应式为LiCoO2+e-+4H+===Li++Co2++2H2O,且消耗H+,因此电池工作一段时间后应该补充盐酸,B、C错误;
若甲室Co2+减少200 mg,转移电子的物质的量为n(e-)= ×2
≈0.006 8 mol,乙室Co2+增加300 mg,转移电子的物质的量为n(e-)=
×1≈0.005 1 mol,说明此时已进行过溶液转移,D正确。
章末复习
第1章
体系构建 理清脉络
一
(一)化学能与热能的转化
化学反应的热效应
表示方法
热化学方程式
意义:表明物质的变化和焓变
书写:方法及注意事项
描述
反应热:Q
焓变:ΔH
计算
依据
ΔH=H(反应产物)-H(反应物)
盖斯定律
分类
放热反应:ΔH<0
吸热反应:ΔH>0
测量
原理:Q=-C(T2-T1)
装置:量热计
键能
(二)化学能与电能的转化
1.电池
本质:自发进行的氧化还原反应
工作原理:
装置:电池
形成条件
电极反应和总反应的书写
化学电源
一次电池
二次电池
燃料电池
2.电解
概念:将直流电通过熔融电解质或电解质溶液,在两个电极上分别发
生氧化反应及还原反应的过程
电解池
能量变化:电能转化为化学能
装置构成:直流电源、固体电极材料以及电解质溶液或熔融
电解质
反应原理:
应用
氯碱工业:2NaCl+2H2O 2NaOH+H2↑+Cl2↑
电镀:①镀件作阴极;②镀层金属作阳极; ③电镀液中含有
镀层金属离子
电解精炼铜:①纯铜作阴极;②粗铜作阳极;③电解液中含
有Cu2+
3.金属的腐蚀与防护
金属腐蚀
化学腐蚀
电化学腐蚀
析氢腐蚀
吸氧腐蚀
金属防护
电化学防护
牺牲阳极保护法
外加电流阴极保护法
改变金属的内部结构或覆盖保护层等
真题导向
二
考向一 计算反应热书写热化学方程式
1.(2022·浙江6月选考,18)标准状态下,下列物质气态时的相对能量如下表:
物质(g) O H HO HOO H2 O2 H2O2 H2O
能量/(kJ·mol-1) 249 218 39 10 0 0 -136 -242
可根据HO(g)+HO(g)===H2O2(g)计算出H2O2中氧氧单键的键能为
214 kJ·mol-1。下列说法不正确的是
A.H2的键能为436 kJ·mol-1
B.O2的键能大于H2O2中氧氧单键的键能的两倍
C.解离氧氧单键所需能量:HOO
√
根据表格中的数据可知,H2的键能为218 kJ·mol-1×2=436 kJ·mol-1,A正确;
由表格中的数据可知O2的键能为249 kJ·mol-1×2=498 kJ·mol-1,由题中信息可知H2O2中氧氧单键的键能为214 kJ·mol-1,则O2的键能大于H2O2中氧氧单键的键能的两倍,B正确;
物质(g) O H HO HOO H2 O2 H2O2 H2O
能量/(kJ·mol-1) 249 218 39 10 0 0 -136 -242
由表格中的数据可知HOO===HO+O,解离其中氧氧单键需要的能量为249 kJ·mol-1+39 kJ·mol-1-10 kJ·mol-1=278 kJ·mol-1,H2O2中氧氧单键的键能为214 kJ·mol-1,C错误;
由表中的数据可知H2O(g)+O(g)===H2O2(g)的ΔH=-136 kJ·mol-1-(-242 kJ·mol-1)-249 kJ·mol-1=-143 kJ·mol-1,D正确。
物质(g) O H HO HOO H2 O2 H2O2 H2O
能量/(kJ·mol-1) 249 218 39 10 0 0 -136 -242
2.[2022·河北,16(1)]氢能是极具发展潜力的清洁能源,以氢燃料为代表的燃料电池有良好的应用前景。298 K时,1 g H2燃烧生成H2O(g)放热121 kJ,1 mol H2O(l)蒸发吸热44 kJ,表示H2燃烧热的热化学方程式为
_________________________________________。
298 K时,1 g H2燃烧生成H2O(g)放热121 kJ,1 mol H2O(l)蒸发吸热44 kJ,则1 mol H2完全燃烧生成1 mol H2O(l)放热286 kJ,表示H2燃烧热的热化
学方程式为H2(g)+ O2(g)===H2O(l) ΔH=-286 kJ·mol-1。
考向二 应用盖斯定律计算多步反应的反应热
3.[2022·湖北,19(1)]自发热材料在生活中的应用日益广泛。已知:
①CaO(s)+H2O(l) Ca(OH)2(s) ΔH1=-65.17 kJ·mol-1
②Ca(OH)2(s) Ca2+(aq)+2OH-(aq) ΔH2=-16.73 kJ·mol-1
③Al(s)+OH-(aq)+3H2O(l) [Al(OH)4]-(aq)+ H2(g)
ΔH3=-415.0 kJ·mol-1
则CaO(s)+2Al(s)+7H2O(l)===Ca2+(aq)+2[Al(OH)4]-(aq)+3H2(g)的ΔH4=_______kJ·mol-1。
-911.9
根据盖斯定律,①+②+2×③可得反应CaO(s)+2Al(s)+7H2O(l)===
Ca2+(aq)+2[Al(OH)4]-(aq)+3H2(g),则ΔH4=ΔH1+ΔH2+2ΔH3=(-65.17 kJ·mol-1)+(-16.73 kJ·mol-1)+2×(-415.0 kJ·mol-1)=-911.9 kJ·mol-1。
4.[2022·全国乙卷,28(1)(2)]油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:
(1)已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)===2SO2(g)+2H2O(g) ΔH1=-1 036 kJ·mol-1
②4H2S(g)+2SO2(g)===3S2(g)+4H2O(g) ΔH2=+94 kJ·mol-1
③2H2(g)+O2(g)===2H2O(g) ΔH3=-484 kJ·mol-1
计算H2S热分解反应④2H2S(g)===S2(g)+2H2(g)的ΔH4=______kJ·mol-1。
+170
(2)较普遍采用的H2S处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④高温热分解H2S。相比克劳斯工艺,高温热分解方法的优点是____________________,缺点是________。
副产物氢气可作燃料
耗能高
根据盖斯定律(①+②)× 可得2H2S(g)+O2(g)===S2(g)+2H2O(g) ΔH=
(-1 036+94) kJ·mol-1× =-314 kJ·mol-1,因此,克劳斯工艺的总反
应是放热反应;根据硫化氢分解的化学方程式可知,高温热分解方法在生成单质硫的同时还有氢气生成。因此,高温热分解方法的优点是:可以获得氢气作燃料;但由于高温分解H2S会消耗大量能量,所以其缺点是耗能高。
考向三 新型化学电源
5.(2022·湖南,8)海水电池在海洋能源领域备受关注,一种锂-海水电池构造如图所示。下列说法错误的是
A.海水起电解质溶液作用
B.N极仅发生的电极反应:2H2O+2e-===2OH-+H2↑
C.玻璃陶瓷具有传导离子和防水的功能
D.该锂-海水电池属于一次电池
√
海水中含有丰富的电解质,如氯化钠、氯化镁等,可作为电解质溶液,故A正确;
N为正极,电极反应主要为O2+2H2O+4e-===4OH-,故B错误;
Li为活泼金属,易与水反应,玻璃陶瓷的作用是防止水和Li反应,并能传导离子,故C正确;
该电池不可充电,属于一次电池,故D正确。
6.(2022·全国甲卷,10)一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示[KOH溶液中,Zn2+以 存在]。电池放电时,下列叙述错误的是
A.Ⅱ区的K+通过隔膜向Ⅲ区迁移
B.Ⅰ区的 通过隔膜向Ⅱ区迁移
C.MnO2电极反应:MnO2+2e-+4H+===Mn2++2H2O
D.电池总反应:Zn+4OH-+MnO2+4H+=== +Mn2++2H2O
√
根据图示的电池结构和题目所给信息可知,Ⅲ区Zn为电池的负极,电极反应为Zn-2e-+4OH-=== ,Ⅰ区MnO2为电池的正极,电极反应为MnO2+2e-+4H+===Mn2++2H2O,K+从Ⅲ区通过隔膜向Ⅱ区迁移,A错误、C正确;
Ⅰ区的 通过隔膜向Ⅱ区移动,B正确;
电池的总反应为Zn+4OH-+MnO2+4H+=== +Mn2++2H2O,D正确。
考向四 电解原理的应用
7.(2022·广东,10)以熔融盐为电解液,以含Cu、Mg和Si等的铝合金废料为阳极进行电解,实现Al的再生。该过程中
A.阴极发生的反应为Mg-2e-===Mg2+
B.阴极上Al被氧化
C.在电解槽底部产生含Cu的阳极泥
D.阳极和阴极的质量变化相等
√
该题中以熔融盐为电解液,以含Cu、Mg和Si等的铝合金废料为阳极进行电解,通过控制一定的条件,可使阳极区Mg和Al发生失电子的氧化反应,分别生成Mg2+和Al3+,Cu和Si不参与反应,阴极区Al3+得电子生成Al单质,从而实现Al的再生,A、B错误;
阳极材料中Cu和Si不参与氧化反应,在电解槽底部可形成阳极泥,C正确;
因为阳极除了铝参与电子转移,镁也参与了电子转移,且还会形成阳极泥,而阴极只有铝离子得电子生成铝单质,根据得失电子守恒及元素守恒可知,阳极与阴极的质量变化不相等,D错误。
8.(2022·海南,9)一种采用H2O(g)和N2(g)为原料制备NH3(g)的装置示意图如下。
下列有关说法正确的是
A.在b电极上,N2被还原
B.金属Ag可作为a电极的材料
C.改变工作电源电压,反应速率不变
D.电解过程中,固体氧化物电解质中O2-不断减少
√
由装置示意图可知,b电极上N2转化为NH3,N元素的化合价降低,得到电子发生还原反应,因此b为阴极,电极反应式为N2+3H2O+6e-===2NH3+3O2-,a为阳极,电极反应式为2O2--4e-===O2,据此分析解答。由分析可得,在b电极上,N2被还原,A正确;
a为阳极,若金属Ag作a电极的材料,则金属Ag优先失去电子,B错误;
改变工作电源的电压,导致电流大小改变,反应速率也会改变,C错误;
电解过程中,阴极电极反应式为2N2+6H2O+12e-===4NH3+6O2-,阳极电极反应式为6O2--12e-===3O2,因此固体氧化物电解质中O2-不会减少,D错误。
9.[2019·北京,27(2)]可利用太阳能光伏电池电解水制高纯氢,工作示意图如图。通过控制开关连接K1或K2,可交替得到H2和O2。
①制H2时,连接____。产生H2的电极反应式是__________________________。
②改变开关连接方式,可得O2。
K1
2H2O+2e-===H2↑+2OH-
电解碱性电解液时,H2O电离出的H+在阴极得到电子产生H2,根据题图可知电极1与电池负极连接,为阴极,所以制H2时,连接K1,产生H2的电极反应式为2H2O+2e-===H2↑+2OH-。
③结合①和②中电极3的电极反应,说明电极3的作用:______________________________
______________________________________________________________________________。
制H2时,电极3发生反应:Ni(OH)2
+OH--e-===NiO(OH)+H2O。制O2时,上述电极反应逆向进行,使电极3得以循环使用
制备O2时碱性电解液中的OH-失去电子生成O2,连接K2,O2在电极2上产生。连接K1时,电极3为电解池的阳极,Ni(OH)2失去电子生成NiO(OH),电极反应式为Ni(OH)2-e-+OH-===NiO(OH)+H2O,连接K2时,电极3为电解池的阴极,电极反应式为NiO(OH)+e-+H2O===Ni(OH)2+OH-,使电极3得以循环使用。
10.(2022·山东,13改编)设计如图装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成CO2,将废旧锂离子电池的正极材料LiCoO2(s)转化为Co2+,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是
A.装置工作时,甲室溶液pH逐渐增大
B.装置工作一段时间后,乙室应补充水
C.乙室电极反应式为LiCoO2+2H2O+e-
===Li++Co2++4OH-
D.若甲室Co2+减少200 mg,乙室Co2+增
加300 mg,则此时已进行过溶液转移
√
由于右侧装置为原电池,所以乙室是原电池,甲室是电解池。电池工作时,甲室中细菌上乙酸盐的阴离子失去电子被氧化为CO2气体,Co2+在另一个电极上得到电子,被还原为Co单质,甲室总反应为CH3COO-+4Co2++
2H2O 2CO2↑+4Co+7H+,溶液pH减小,A错误;
乙室电解质溶液为酸性,不可能大量存在OH-,乙室电极反应式为LiCoO2+e-+4H+===Li++Co2++2H2O,且消耗H+,因此电池工作一段时间后应该补充盐酸,B、C错误;
若甲室Co2+减少200 mg,转移电子的物质的量为n(e-)= ×2
≈0.006 8 mol,乙室Co2+增加300 mg,转移电子的物质的量为n(e-)=
×1≈0.005 1 mol,说明此时已进行过溶液转移,D正确。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
