1.3 第2课时 电解原理的应用-高中化学鲁科版选择性必修第一册(34张)
文档属性
| 名称 | 1.3 第2课时 电解原理的应用-高中化学鲁科版选择性必修第一册(34张) |

|
|
| 格式 | pptx | ||
| 文件大小 | 30.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-28 22:19:25 | ||
图片预览







文档简介
(共34张PPT)
第2课时 电解原理的应用
第1章 第3节
1.认识电解原理在氯碱工业、电镀及电冶金等工业生产中的实际应用(重点)。
2.深化对电解原理的理解(重、难点)。
学习目标
电解食盐水制备烧碱、氢气和氯气
一
温故知新
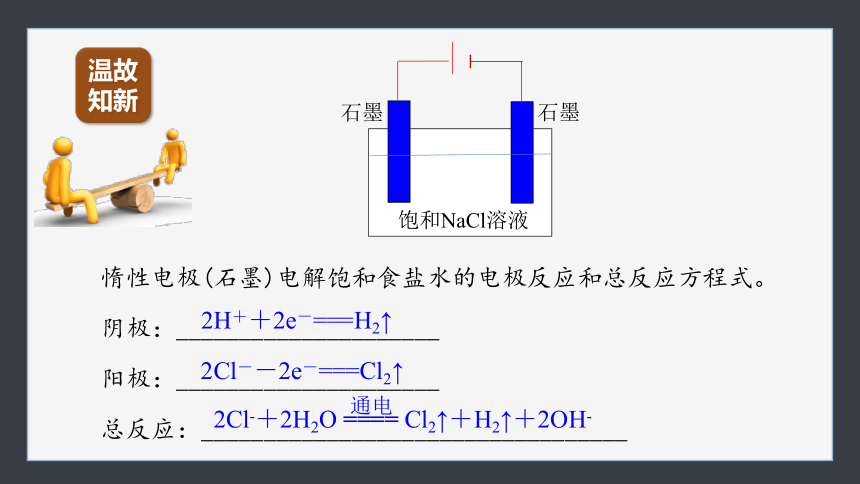
惰性电极(石墨)电解饱和食盐水的电极反应和总反应方程式。
阴极:_____________________
阳极:_____________________
总反应:__________________________________
2Cl-+2H2O ==== Cl2↑+H2↑+2OH-
通电
2H++2e-===H2↑
2Cl--2e-===Cl2↑
石墨
石墨
饱和NaCl溶液
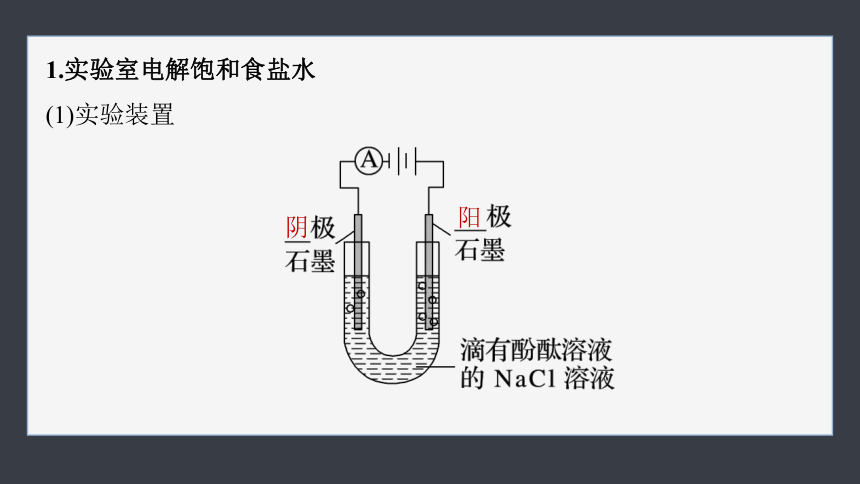
1.实验室电解饱和食盐水
1.实验室电解饱和食盐水
(1)实验装置
阴
阳
(2)实验现象
阴极:有无色气体产生,阴极附
近溶液变红色。
阳极:有刺激性气味的黄绿色气
体产生,湿润的淀粉碘化钾试纸变蓝色。
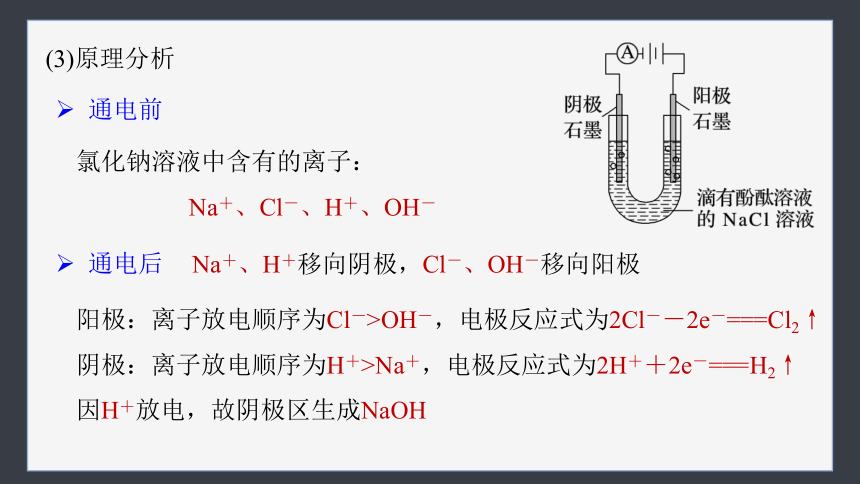
(3)原理分析
阳极:离子放电顺序为Cl->OH-,电极反应式为2Cl--2e-===Cl2↑
阴极:离子放电顺序为H+>Na+,电极反应式为2H++2e-===H2↑
因H+放电,故阴极区生成NaOH
通电前
氯化钠溶液中含有的离子:
Na+、Cl-、H+、OH-
通电后
Na+、H+移向阴极,Cl-、OH-移向阳极
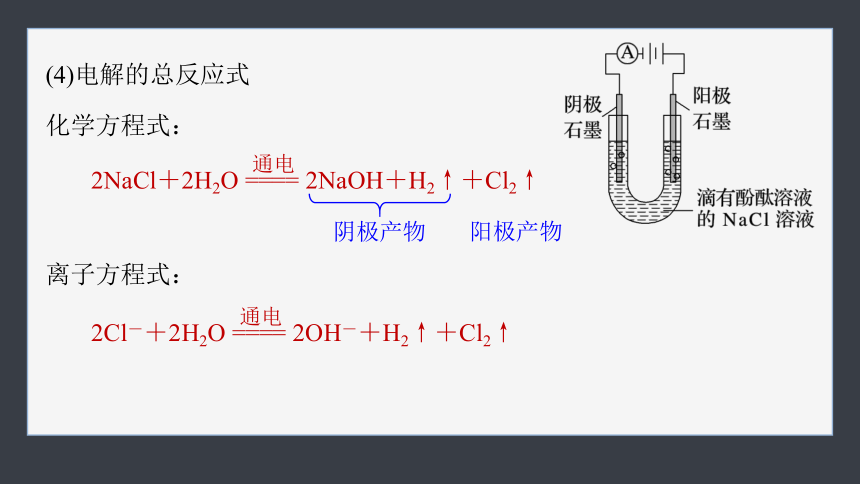
(4)电解的总反应式
化学方程式:
离子方程式:
2NaCl+2H2O ==== 2NaOH+H2↑+Cl2↑
通电
2Cl-+2H2O ==== 2OH-+H2↑+Cl2↑
通电
阴极产物
阳极产物
2.氯碱工业
工业上,用隔膜阻止OH-移向阳极,则Na+和OH-可以在阴极附近的溶液中富集,这样就可以从阴极溶液中得到NaOH。这就是电解食盐水制备烧碱的原理,也称作氯碱工业。
思考交流
1.正误判断
(1)电解饱和食盐水时,阴极发生氧化反应:2Cl--2e-===Cl2↑
(2)氯碱工业电解槽中滴入酚酞溶液,变红色的区域为阳极区
(3)电解饱和食盐水时,阳极和阴极都可以选择金属材料(如铁)
(4)电解饱和NaCl溶液可以制取金属钠
×
×
×
×
思考交流
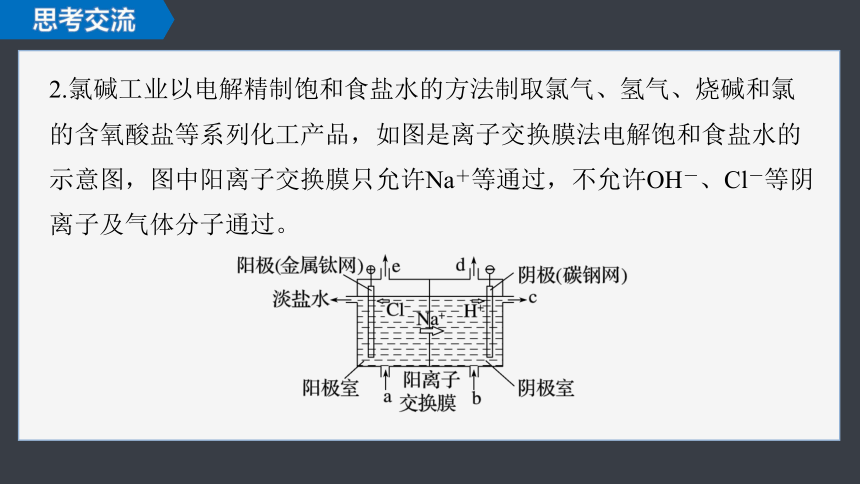
2.氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品,如图是离子交换膜法电解饱和食盐水的示意图,图中阳离子交换膜只允许Na+等通过,不允许OH-、Cl-等阴离子及气体分子通过。
思考交流
试完成下列问题:
(1)阳极(金属钛网)电极反应式:___________________;
阴极(碳钢网)电极反应式:___________________;
电解饱和食盐水总离子方程式:_________________________________。
2Cl--2e-===Cl2↑
2H++2e-===H2↑
思考交流
(2)阳离子交换膜的作用为______________________________________
____________________________________________________________
______________________。
从图中b位置补充的为含有少量NaOH的水,NaOH的作用为_________
_________________。
将电解槽隔成阳极室和阴极室,允许阳离子
Na+通过,阻止阴离子OH-和气体通过,使生成的NaOH更纯,并防
止H2、Cl2混合发生爆炸
增强导电
性,提高电解效率
思考交流
(3)精制饱和食盐水从图中___(填“a”“b”“c”或“d”,下同)位置补充,NaOH溶液从图中___位置流出。图中e位置排出的气体为______。
a
c
氯气
思考交流
3.84消毒液是常用的环境消毒液之一。某课外小组制作一种家用环保型消毒液发生器,用石墨做电极电解饱和氯化钠溶液,通电时,可以使Cl2被完全吸收制得有较强杀菌能力的消毒液,装置如图所示。c、d都为碳电极。
完成下列填空:
(1)a为电源的___极,c为电解池的___极(填“正”“负”
或“阴”“阳”)。
(2)d电极上发生的电极反应式:_________________,
负
阳
2H++2e-===H2↑
电解产生消毒液的总化学方程式为___________________________。
要让Cl2与NaOH充分混合反应,应在下端产生Cl2
﹣ ﹢
工业电解饱和食盐水制取烧碱
在氯碱工业中,采用了阳离子交换膜,阳离子交换膜将电解槽隔成阴极室和阳极室,它只允许阳离子(Na+、H+)通过,而阻止阴离子(Cl-、OH-)和气体通过。这样既能防止阴极产生的H2和阳极产生的Cl2混合而引起爆炸,又能避免Cl2和NaOH作用生成NaClO而影响烧碱的质量。
归纳总结
铜的电解精炼、电镀
二
粗铜中含锌、银、金等杂质,结合电解原理如何设计电解池进行粗铜的精炼
阴极
阳极
粗铜
纯铜
粗铜:Cu-2e-===Cu2+ 纯铜:Cu2++2e-===Cu
CuSO4溶液
阳极粗铜中金属锌失电子吗?
1.铜的电解精炼
粗铜
精铜
黄铜矿
1.铜的电解精炼
(1)粗铜成分
主要成分:Cu
杂质金属:Zn、Fe、Ni、Ag、Pt、Au等。
(2)装置
比铜活泼
不如铜活泼
(3)电解精炼的电极反应
Cu(粗铜) -2e-===Cu2+
Cu2+ +2e-=== Cu(精铜)
Ag、Pt 、Au等金属沉积在池底形成阳极泥
阴极:
阳极:
Zn-2e-===Zn2+
Fe-2e-===Fe2+
Ni-2e-===Ni2+
(主要反应)
(4)电解精炼的结果
粗铜中比铜活泼的金属Zn、Fe、Ni等失去电子形成的阳离子进入溶液;不如铜活泼的金属Ag、Au、Pt等以金属单质的形式沉积在电解池的底部,与其他不溶性杂质混在一起形成阳极泥;阴极上得到精铜。
2.电镀
(1)定义:应用电解原理,在金属表面镀上一薄层金属或合金的方法。
(2)目的:提高金属的抗腐蚀能力、耐磨性能或改善金属制品的外观。
(3)电镀池的设计
直流电源
﹢
﹣
阳极
阴极
镀层金属
镀件
电镀液:
含有镀层金属离子的盐溶液
阳 极:
镀层金属
(与直流电源正极相连)
阴 极:
镀件
(与直流电源负极相连)
(4)案例(铁钉镀铜实验)
阴极
阳极
离子导体
装置图与 实验现象
铁钉(镀件)
电极反应:Cu2++2e-===Cu
电极反应:Cu-2e-===Cu2+
铜片(镀层金属)
硫酸铜溶液
铜片:逐渐溶解
铁钉:表面覆盖一层红色物质
3.电解法用于冶炼较活泼的金属
电解熔融的氯化钠制取金属钠
电解工业上常利用电解法冶炼较活泼的金属(如钠、钙、镁、铝等),但不能电解其盐溶液,应电解其熔融态。
阳极:2Cl--2e-===Cl2↑
阴极:2Na++2e-===2Na
总反应:
电解熔融的氧化铝制取金属铝
阳极:6O2--12e-===3O2↑
阴极:4Al3++12e-===4Al
电解熔融的氯化镁制取金属镁
总反应:
2Al2O3(熔融) 4Al+3O2↑
阳极:2Cl--2e-===Cl2↑
阴极:Mg2++2e-===Mg
总反应:
MgCl2(熔融) Mg+Cl2↑
思考交流
1.正误判断
(1)在Fe上镀Ag,应用Fe作阳极,Ag作阴极,用AgNO3溶液作电镀液
(2)电解精炼铜和电镀铜,电解质溶液中的c(Cu2+)均保持不变
(3)电解冶炼镁、铝通常电解MgCl2和Al2O3,也可以电解MgO和AlCl3
(4)电解精炼时,阳极泥可以作为提炼贵重金属的原料
(5)电解精炼铜和电镀铜过程中,阳极质量的减少与阴极质量的增加都相等
×
×
√
×
×
思考交流
2.电镀和电解精炼时,电解液的浓度分别有何变化?
提示 电镀池中,电解液的浓度不变;电解精炼池中,电解液的浓度减小。
思考交流
3.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,思考回答下列问题:
(1)阳极发生_____反应,其电极反应式:________________________
__________________________。
氧化
Ni-2e-===Ni2+,Fe-2e-
===Fe2+,Zn-2e-===Zn2+
(2)电解过程中,阳极质量的减少与阴极质量的增加________(填“相等”或“不相等”)。
电解过程中阳极失电子的有Fe、Zn、Ni,阴极析出的是镍,依据得失电子守恒,阳极质量的减少与阴极质量的增加不相等。
不相等
思考交流
3.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,思考回答下列问题:
(3)电解后,溶液中存在的金属阳离子有_____、______、Ni2+等。
(4)电解后,电解池底部含有_______等金属。
Fe2+
Zn2+
Cu、Pt
粗镍作阳极,Fe、Zn在电极上失去电子形成阳离子进入溶液中,Cu和Pt沉降到电解池底部。
思考交流
4.如图为电解熔融的氧化铝冶炼铝的示意图。
(1)资料表明Al2O3的熔点2 054 ℃,冰晶石(Na3AlF6)的熔点1 000 ℃,用电解Al2O3制取金属铝时会加入冰晶石,其作用是__________________。
(2)该电解装置中的离子导体是__________________________。
降低氧化铝的熔点
熔融状态的冰晶石和Al2O3
思考交流
(3)该电解过程要在1 000 ℃以上进行,工业上冶炼铝过程中会发生阳
极损耗,可能发生的反应有___________________________________
__________________。
第2课时 电解原理的应用
第1章 第3节
1.认识电解原理在氯碱工业、电镀及电冶金等工业生产中的实际应用(重点)。
2.深化对电解原理的理解(重、难点)。
学习目标
电解食盐水制备烧碱、氢气和氯气
一
温故知新
惰性电极(石墨)电解饱和食盐水的电极反应和总反应方程式。
阴极:_____________________
阳极:_____________________
总反应:__________________________________
2Cl-+2H2O ==== Cl2↑+H2↑+2OH-
通电
2H++2e-===H2↑
2Cl--2e-===Cl2↑
石墨
石墨
饱和NaCl溶液
1.实验室电解饱和食盐水
1.实验室电解饱和食盐水
(1)实验装置
阴
阳
(2)实验现象
阴极:有无色气体产生,阴极附
近溶液变红色。
阳极:有刺激性气味的黄绿色气
体产生,湿润的淀粉碘化钾试纸变蓝色。
(3)原理分析
阳极:离子放电顺序为Cl->OH-,电极反应式为2Cl--2e-===Cl2↑
阴极:离子放电顺序为H+>Na+,电极反应式为2H++2e-===H2↑
因H+放电,故阴极区生成NaOH
通电前
氯化钠溶液中含有的离子:
Na+、Cl-、H+、OH-
通电后
Na+、H+移向阴极,Cl-、OH-移向阳极
(4)电解的总反应式
化学方程式:
离子方程式:
2NaCl+2H2O ==== 2NaOH+H2↑+Cl2↑
通电
2Cl-+2H2O ==== 2OH-+H2↑+Cl2↑
通电
阴极产物
阳极产物
2.氯碱工业
工业上,用隔膜阻止OH-移向阳极,则Na+和OH-可以在阴极附近的溶液中富集,这样就可以从阴极溶液中得到NaOH。这就是电解食盐水制备烧碱的原理,也称作氯碱工业。
思考交流
1.正误判断
(1)电解饱和食盐水时,阴极发生氧化反应:2Cl--2e-===Cl2↑
(2)氯碱工业电解槽中滴入酚酞溶液,变红色的区域为阳极区
(3)电解饱和食盐水时,阳极和阴极都可以选择金属材料(如铁)
(4)电解饱和NaCl溶液可以制取金属钠
×
×
×
×
思考交流
2.氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品,如图是离子交换膜法电解饱和食盐水的示意图,图中阳离子交换膜只允许Na+等通过,不允许OH-、Cl-等阴离子及气体分子通过。
思考交流
试完成下列问题:
(1)阳极(金属钛网)电极反应式:___________________;
阴极(碳钢网)电极反应式:___________________;
电解饱和食盐水总离子方程式:_________________________________。
2Cl--2e-===Cl2↑
2H++2e-===H2↑
思考交流
(2)阳离子交换膜的作用为______________________________________
____________________________________________________________
______________________。
从图中b位置补充的为含有少量NaOH的水,NaOH的作用为_________
_________________。
将电解槽隔成阳极室和阴极室,允许阳离子
Na+通过,阻止阴离子OH-和气体通过,使生成的NaOH更纯,并防
止H2、Cl2混合发生爆炸
增强导电
性,提高电解效率
思考交流
(3)精制饱和食盐水从图中___(填“a”“b”“c”或“d”,下同)位置补充,NaOH溶液从图中___位置流出。图中e位置排出的气体为______。
a
c
氯气
思考交流
3.84消毒液是常用的环境消毒液之一。某课外小组制作一种家用环保型消毒液发生器,用石墨做电极电解饱和氯化钠溶液,通电时,可以使Cl2被完全吸收制得有较强杀菌能力的消毒液,装置如图所示。c、d都为碳电极。
完成下列填空:
(1)a为电源的___极,c为电解池的___极(填“正”“负”
或“阴”“阳”)。
(2)d电极上发生的电极反应式:_________________,
负
阳
2H++2e-===H2↑
电解产生消毒液的总化学方程式为___________________________。
要让Cl2与NaOH充分混合反应,应在下端产生Cl2
﹣ ﹢
工业电解饱和食盐水制取烧碱
在氯碱工业中,采用了阳离子交换膜,阳离子交换膜将电解槽隔成阴极室和阳极室,它只允许阳离子(Na+、H+)通过,而阻止阴离子(Cl-、OH-)和气体通过。这样既能防止阴极产生的H2和阳极产生的Cl2混合而引起爆炸,又能避免Cl2和NaOH作用生成NaClO而影响烧碱的质量。
归纳总结
铜的电解精炼、电镀
二
粗铜中含锌、银、金等杂质,结合电解原理如何设计电解池进行粗铜的精炼
阴极
阳极
粗铜
纯铜
粗铜:Cu-2e-===Cu2+ 纯铜:Cu2++2e-===Cu
CuSO4溶液
阳极粗铜中金属锌失电子吗?
1.铜的电解精炼
粗铜
精铜
黄铜矿
1.铜的电解精炼
(1)粗铜成分
主要成分:Cu
杂质金属:Zn、Fe、Ni、Ag、Pt、Au等。
(2)装置
比铜活泼
不如铜活泼
(3)电解精炼的电极反应
Cu(粗铜) -2e-===Cu2+
Cu2+ +2e-=== Cu(精铜)
Ag、Pt 、Au等金属沉积在池底形成阳极泥
阴极:
阳极:
Zn-2e-===Zn2+
Fe-2e-===Fe2+
Ni-2e-===Ni2+
(主要反应)
(4)电解精炼的结果
粗铜中比铜活泼的金属Zn、Fe、Ni等失去电子形成的阳离子进入溶液;不如铜活泼的金属Ag、Au、Pt等以金属单质的形式沉积在电解池的底部,与其他不溶性杂质混在一起形成阳极泥;阴极上得到精铜。
2.电镀
(1)定义:应用电解原理,在金属表面镀上一薄层金属或合金的方法。
(2)目的:提高金属的抗腐蚀能力、耐磨性能或改善金属制品的外观。
(3)电镀池的设计
直流电源
﹢
﹣
阳极
阴极
镀层金属
镀件
电镀液:
含有镀层金属离子的盐溶液
阳 极:
镀层金属
(与直流电源正极相连)
阴 极:
镀件
(与直流电源负极相连)
(4)案例(铁钉镀铜实验)
阴极
阳极
离子导体
装置图与 实验现象
铁钉(镀件)
电极反应:Cu2++2e-===Cu
电极反应:Cu-2e-===Cu2+
铜片(镀层金属)
硫酸铜溶液
铜片:逐渐溶解
铁钉:表面覆盖一层红色物质
3.电解法用于冶炼较活泼的金属
电解熔融的氯化钠制取金属钠
电解工业上常利用电解法冶炼较活泼的金属(如钠、钙、镁、铝等),但不能电解其盐溶液,应电解其熔融态。
阳极:2Cl--2e-===Cl2↑
阴极:2Na++2e-===2Na
总反应:
电解熔融的氧化铝制取金属铝
阳极:6O2--12e-===3O2↑
阴极:4Al3++12e-===4Al
电解熔融的氯化镁制取金属镁
总反应:
2Al2O3(熔融) 4Al+3O2↑
阳极:2Cl--2e-===Cl2↑
阴极:Mg2++2e-===Mg
总反应:
MgCl2(熔融) Mg+Cl2↑
思考交流
1.正误判断
(1)在Fe上镀Ag,应用Fe作阳极,Ag作阴极,用AgNO3溶液作电镀液
(2)电解精炼铜和电镀铜,电解质溶液中的c(Cu2+)均保持不变
(3)电解冶炼镁、铝通常电解MgCl2和Al2O3,也可以电解MgO和AlCl3
(4)电解精炼时,阳极泥可以作为提炼贵重金属的原料
(5)电解精炼铜和电镀铜过程中,阳极质量的减少与阴极质量的增加都相等
×
×
√
×
×
思考交流
2.电镀和电解精炼时,电解液的浓度分别有何变化?
提示 电镀池中,电解液的浓度不变;电解精炼池中,电解液的浓度减小。
思考交流
3.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,思考回答下列问题:
(1)阳极发生_____反应,其电极反应式:________________________
__________________________。
氧化
Ni-2e-===Ni2+,Fe-2e-
===Fe2+,Zn-2e-===Zn2+
(2)电解过程中,阳极质量的减少与阴极质量的增加________(填“相等”或“不相等”)。
电解过程中阳极失电子的有Fe、Zn、Ni,阴极析出的是镍,依据得失电子守恒,阳极质量的减少与阴极质量的增加不相等。
不相等
思考交流
3.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,思考回答下列问题:
(3)电解后,溶液中存在的金属阳离子有_____、______、Ni2+等。
(4)电解后,电解池底部含有_______等金属。
Fe2+
Zn2+
Cu、Pt
粗镍作阳极,Fe、Zn在电极上失去电子形成阳离子进入溶液中,Cu和Pt沉降到电解池底部。
思考交流
4.如图为电解熔融的氧化铝冶炼铝的示意图。
(1)资料表明Al2O3的熔点2 054 ℃,冰晶石(Na3AlF6)的熔点1 000 ℃,用电解Al2O3制取金属铝时会加入冰晶石,其作用是__________________。
(2)该电解装置中的离子导体是__________________________。
降低氧化铝的熔点
熔融状态的冰晶石和Al2O3
思考交流
(3)该电解过程要在1 000 ℃以上进行,工业上冶炼铝过程中会发生阳
极损耗,可能发生的反应有___________________________________
__________________。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
