1.4 金属的腐蚀与防护-高中化学鲁科版选择性必修第一册(33张)
文档属性
| 名称 | 1.4 金属的腐蚀与防护-高中化学鲁科版选择性必修第一册(33张) |  | |
| 格式 | pptx | ||
| 文件大小 | 28.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-28 22:15:15 | ||
图片预览







文档简介
(共33张PPT)
第4节 金属的腐蚀与防护
第1章
1.了解金属腐蚀的现象及危害。
2.知道金属腐蚀的类型和本质及金属发生电化学腐蚀的条件,能解释金属发生
电化学腐蚀的原因(重、难点)。
3.掌握防止金属腐蚀的措施及原理(重点)。
学习目标
双吸剂(吸氧、吸水)
主要成分:铁粉、碳粉、钠盐、卤化物。
特点:反应迅速,可在2小时内使包装袋内氧的浓度降到0.01%
暖贴
主要成分:铁粉、活性炭、食盐、水、蛭石(保温材料)、吸水性树脂
铁生锈随处可见。为什么铁在潮湿的环境中比在干燥的环境中更容易生锈?
以下为双吸剂和暖贴的主要成分和作用,根据其主要成分思考:一包“双吸剂”为什么能快速吸收 O2?一片暖贴为什么能快速产生大量热?
联想质疑
金属电化学腐蚀的原理
一
1.金属腐蚀现象及危害
金属腐蚀现象普遍存在,每年因金属腐蚀造成的经济损失远远超过因自然灾害和各类事故造成的经济损失的总和。
2.金属腐蚀与分类
定义:
金属表面因与周围的物质发生氧化还原反应而遭到破坏的现象。
类型
化学腐蚀
电化学腐蚀
燃气灶的中心部位易生锈
化学腐蚀
电化学腐蚀
铁在潮湿空气中生成红褐色铁锈
(通过发生电化学反应产生的腐蚀)
(金属与化学物质直接接触发生反应而腐蚀)
3.化学腐蚀和电化学腐蚀
类型 化学腐蚀 电化学腐蚀
条件 金属与非金属等直接接触 不纯金属或合金与电解质溶液接触形成原电池
结果 金属被氧化 较活泼金属被氧化
实质 M-ne-===Mn+ 关系 ①化学腐蚀与电化学腐蚀往往同时发生; ②电化学腐蚀比化学腐蚀更普遍,危害更大
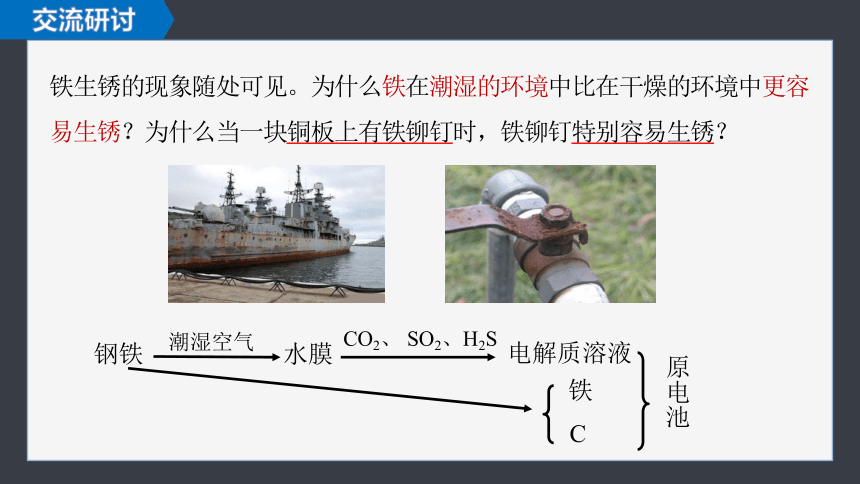
铁生锈的现象随处可见。为什么铁在潮湿的环境中比在干燥的环境中更容易生锈?为什么当一块铜板上有铁铆钉时,铁铆钉特别容易生锈?
交流研讨
钢铁
潮湿空气
水膜
CO2、 SO2、H2S
电解质溶液
铁
C
原电池
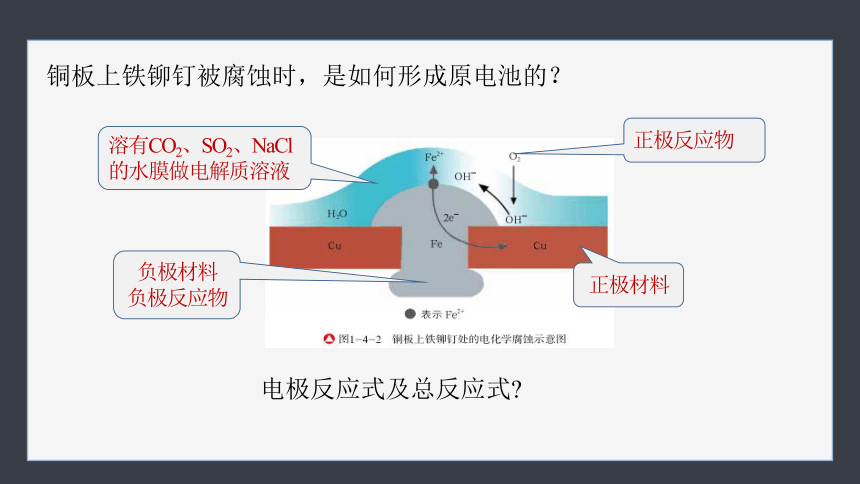
溶有CO2、SO2、NaCl的水膜做电解质溶液
负极材料
负极反应物
正极材料
正极反应物
铜板上铁铆钉被腐蚀时,是如何形成原电池的?
电极反应式及总反应式
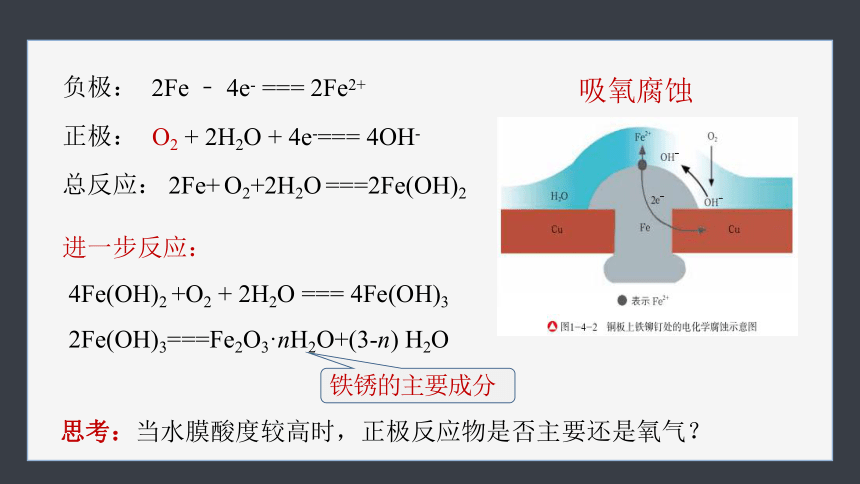
2Fe ﹣ 4e- === 2Fe2+
负极:
O2 + 2H2O + 4e-=== 4OH-
正极:
2Fe+ O2+2H2O ===2Fe(OH)2
总反应:
进一步反应:
4Fe(OH)2 +O2 + 2H2O === 4Fe(OH)3
2Fe(OH)3===Fe2O3·nH2O+(3-n) H2O
铁锈的主要成分
吸氧腐蚀
思考:
当水膜酸度较高时,正极反应物是否主要还是氧气?
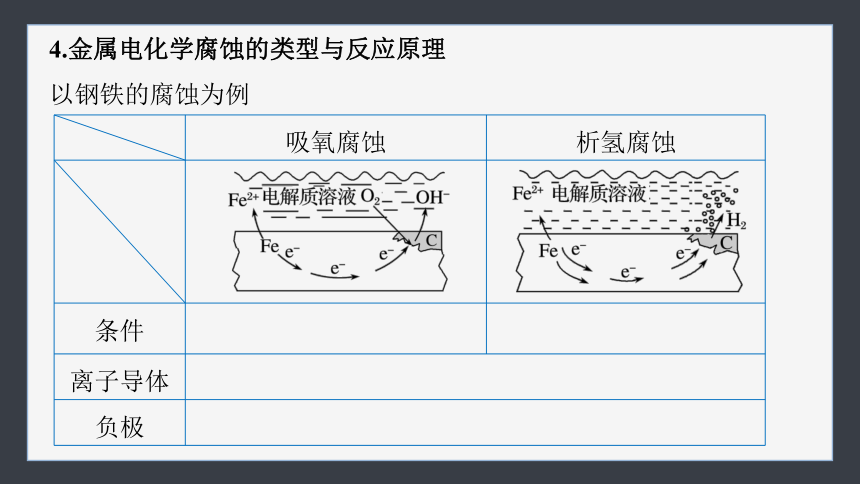
4.金属电化学腐蚀的类型与反应原理
以钢铁的腐蚀为例
吸氧腐蚀 析氢腐蚀
条件 水膜酸性很弱或呈中性 水膜酸性较强
离子导体 潮湿的空气或电解质溶液 负极 反应物均为铁,电极反应:Fe-2e-===Fe2+
正极 反应物:空气中的氧气 电极反应:O2+4e-+2H2O=== 4OH- 反应物:H+
电极反应:2H++2e-===
H2↑
总反应 2Fe+O2+2H2O===2Fe(OH)2 Fe+2H+===Fe2++H2↑
联系 通常两种腐蚀同时存在,但前者更普遍
思考交流
1.正误判断
(1)无论化学腐蚀还是电化学腐蚀,金属的腐蚀都是金属失电子被氧化的过程
(2)因为CO2普遍存在,所以钢铁腐蚀以析氢腐蚀为主
(3)铜在酸性条件下也可以发生析氢腐蚀
(4)纯铁不易被腐蚀,生铁易被腐蚀,是因为生铁中含碳,能形成原电池发生电化学腐蚀
(5)铁的电化学腐蚀的负极反应为Fe-3e-===Fe3+
×
×
√
√
×
思考交流
2.如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片。观察到:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面。
(1)导管内液面下降时,发生__________(填“析氢腐蚀”或“吸氧腐蚀”,下同)。
(2)红墨水回升时,发生_________,此时正极反应式为________________________。
析氢腐蚀
吸氧腐蚀
O2+2H2O+4e-===4OH-
思考交流
(3)析氢腐蚀时消耗____(填“H+”或“OH-”,下同),吸氧腐蚀时产生_____,具支试管中溶液pH逐渐____
(填“增大”或“减小”)。
H+
OH-
增大
思考交流
3.在一块抛光、干净的钢片上滴上一滴含有少量酚酞和铁氰化钾(K3[Fe(CN)6])的饱和食盐水,几分钟后,液滴中心部分主要呈现蓝色,液滴边缘为一红色圆环,而在两者之间有一棕褐色环。已知:Fe2+与K3[Fe(CN)6]溶液(黄色)反应生成KFe[Fe(CN)6]沉淀(带有特征蓝色)。这是一种检验溶液中Fe2+的常用方法。如图所示:
思考交流
思考下列问题:
(1)液滴中心出现蓝色的原因:_______________
__________________________________________________________________________________
_________________________。
(2)液滴边缘为一红色圆环的原因:___________
_________________________________________
________________________________。
液滴中心氧气的
浓度小,为负极,发生反应:Fe-2e-===Fe2+,然后发生反应:Fe2++K++[Fe(CN)6]3- === KFe[Fe(CN)6]↓(蓝色沉淀)
液滴边缘氧
气的浓度较大,为正极,电极反应为O2+2H2O+4e-===4OH-,使酚酞变红
思考交流
(3)棕褐色环的主要成分为铁锈,用化学用语表示产生铁锈的过程:_______________________
__________________________________________________________________________________
_________________________________________
_______________________________________。
中心区(负极)产生的Fe2+
向边缘(正极)移动,发生如下一系列变化:
Fe2++2OH-===Fe(OH)2
4Fe(OH)2+O2+2H2O===4Fe(OH)3
2Fe(OH)3===Fe2O3·nH2O+(3-n)H2O(铁锈)
金属腐蚀的防护
二
在印度德里城附近的麦哈洛里,矗立着一根公元五世纪铸造的很大铁柱,这根铁柱高6.7米,直径约1.37米,用熟铁铸成,实心,柱顶有着古色古香的装饰花纹,据说这根铁柱是为纪念旃陀罗王而铸造的。但最令人惊异的是,铁柱在露天中耸立了一千五百余年,经历了无数风吹雨打,至今仍没有一点生锈的痕迹!
印度铁柱为什么千年不朽
1.防护本质
阻止金属发生氧化反应。
2.防护方法
(1)在金属表面覆盖保护层
(2)改变金属内部组成、结构等
油漆、搪瓷、陶瓷、沥青、塑料、橡胶、电镀
不锈钢、硅钢、合金材料等
(3)电化学防护方法
电化学防护 牺牲阳极保护法 阴极电保护法
原理 原电池原理 电解池原理
措施 被保护的金属作正极,以一种活动性较强的金属作负极 被保护的金属作阴极,惰性电极作辅助阳极,连接直流电源
应用 如锅炉内壁、船舶外壳、铁塔、铁管道装上若干锌块,可保护钢铁设备 如钢闸门、输送酸性溶液的铁管道等
示意图
联系 被保护的金属都因为电子的流入而免遭腐蚀
思考交流
1.正误判断
(1)在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阴极保护法
(2)镀铜铁制品镀层受损后,铁制品比受损前更易生锈
(3)钢铁制造的暖气管道外常涂有一些沥青,这是钢铁的电化学保护法
(4)给铁件通入直流电,把铁件与电池负极相连接以防止铁腐蚀
(5)用电镀的方法,在钢铁制品表面镀上一层不易被腐蚀的金属,如锡、铬、镍等,能够减缓金属的腐蚀
√
×
√
×
√
思考交流
2.如图所示的各容器中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是______________。
④>②>①>③
金属腐蚀快慢的判断方法
(1)在同一电解质溶液中,同一种金属腐蚀由快到慢的顺序为电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极。
(2)同一种金属在不同介质中腐蚀由快到慢的顺序为强电解质溶液>弱电解质溶液>非电解质溶液。
(3)对同一种电解质溶液来说,电解质溶液浓度越大,金属腐蚀越快。
(4)金属活动性差别越大,活泼性强的金属腐蚀越快。
归纳总结
思考交流
3.利用如图装置,可以模拟铁的电化学防护。
(1)若X为铜,为减缓铁的腐蚀,开关K应置于_____处,铁棒上发生的电极反应为__________________,该种防护方法称为_____________。
(2)若X为锌棒,开关K置于M处,铁棒上的电极反应为___________
_______________,该电化学防护法称为_______________。
N
2H++2e-===H2↑
阴极电保护法
O2+4e-+
牺牲阳极保护法
返回
2H2O===4OH-
电化学腐蚀原理的应用
三
“保暖贴”是冬日保暖防护措施之一,热敷还能缓解因寒冷造成的肩周炎等各种疼痛。你知道保暖贴的发热原理吗?
思考讨论
1. 保暖贴在发热过程中,其主要成分分别起什么作用?
2. 为什么保暖贴能较持久而又稳定地提供热量?
3. 保暖贴使用的是双层包装。外层由不透气的明胶层制成,
内层由微孔透气膜制成,为什么要这样设计?
4. 为什么保暖贴使用后会变得较硬?
思考讨论
1.一次性保暖贴工作原理
铁与氧气的反应是一个放热反应,这个反应在自然条件下进行得很慢,但当它以电池反应的形式发生时则会变得很快,并放出大量的热。
负极 正极
电极材料 铁粉 活性炭
电极反应 Fe-2e-===Fe2+ O2+2H2O+4e-===4OH-
离子导体 食盐水 使用后固体主要成分 炭粉、氯化钠固体、三氧化二铁固体以及含镁和铝的盐
2.微电解技术处理工业废水
负极
正极
电解质溶液
铁
碳
废水
微电池
Fe-2e-===Fe2+
O2+2H2O+4e-===4OH-(碱性或中性条件)
2H++2e-===H2↑(酸性条件)
原理:新生成的电极反应产物具有很高的反应活性,能与废水中的某些污染物发生氧化还原反应,从而达到去除污染物的目的。
思考交流
1.(2022·长沙雅礼中学高二月考)食品保鲜所用的“双吸剂”是由还原铁粉、生石灰、氯化钠、炭粉等按一定比例组成的混合物,可吸收氧气和水,下列分析不正确的是
A.“双吸剂”中的生石灰有吸水作用
B.“双吸剂”吸收氧气时,发生了原电池反应
C.吸收氧气的过程中,铁为原电池的负极
D.炭粉上发生的反应为O2+4e-+4H+===2H2O
√
可构成原电池
O2+4e-+2H2O===4OH-
思考交流
2.利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯进行水体修复的过程如图所示,H+、O2、 等物种的存在会影响效果。
(1)有效腐蚀过程中,有效腐蚀①的电极反应式为___________________
_________________;生成1 mol乙烯所转移的电子物质的量为____mol。
(2)无效腐蚀过程④对应的电极反应式为________________________________。
C2HCl3+6e-+3H+
===C2H4↑+3Cl-
6
第4节 金属的腐蚀与防护
第1章
1.了解金属腐蚀的现象及危害。
2.知道金属腐蚀的类型和本质及金属发生电化学腐蚀的条件,能解释金属发生
电化学腐蚀的原因(重、难点)。
3.掌握防止金属腐蚀的措施及原理(重点)。
学习目标
双吸剂(吸氧、吸水)
主要成分:铁粉、碳粉、钠盐、卤化物。
特点:反应迅速,可在2小时内使包装袋内氧的浓度降到0.01%
暖贴
主要成分:铁粉、活性炭、食盐、水、蛭石(保温材料)、吸水性树脂
铁生锈随处可见。为什么铁在潮湿的环境中比在干燥的环境中更容易生锈?
以下为双吸剂和暖贴的主要成分和作用,根据其主要成分思考:一包“双吸剂”为什么能快速吸收 O2?一片暖贴为什么能快速产生大量热?
联想质疑
金属电化学腐蚀的原理
一
1.金属腐蚀现象及危害
金属腐蚀现象普遍存在,每年因金属腐蚀造成的经济损失远远超过因自然灾害和各类事故造成的经济损失的总和。
2.金属腐蚀与分类
定义:
金属表面因与周围的物质发生氧化还原反应而遭到破坏的现象。
类型
化学腐蚀
电化学腐蚀
燃气灶的中心部位易生锈
化学腐蚀
电化学腐蚀
铁在潮湿空气中生成红褐色铁锈
(通过发生电化学反应产生的腐蚀)
(金属与化学物质直接接触发生反应而腐蚀)
3.化学腐蚀和电化学腐蚀
类型 化学腐蚀 电化学腐蚀
条件 金属与非金属等直接接触 不纯金属或合金与电解质溶液接触形成原电池
结果 金属被氧化 较活泼金属被氧化
实质 M-ne-===Mn+ 关系 ①化学腐蚀与电化学腐蚀往往同时发生; ②电化学腐蚀比化学腐蚀更普遍,危害更大
铁生锈的现象随处可见。为什么铁在潮湿的环境中比在干燥的环境中更容易生锈?为什么当一块铜板上有铁铆钉时,铁铆钉特别容易生锈?
交流研讨
钢铁
潮湿空气
水膜
CO2、 SO2、H2S
电解质溶液
铁
C
原电池
溶有CO2、SO2、NaCl的水膜做电解质溶液
负极材料
负极反应物
正极材料
正极反应物
铜板上铁铆钉被腐蚀时,是如何形成原电池的?
电极反应式及总反应式
2Fe ﹣ 4e- === 2Fe2+
负极:
O2 + 2H2O + 4e-=== 4OH-
正极:
2Fe+ O2+2H2O ===2Fe(OH)2
总反应:
进一步反应:
4Fe(OH)2 +O2 + 2H2O === 4Fe(OH)3
2Fe(OH)3===Fe2O3·nH2O+(3-n) H2O
铁锈的主要成分
吸氧腐蚀
思考:
当水膜酸度较高时,正极反应物是否主要还是氧气?
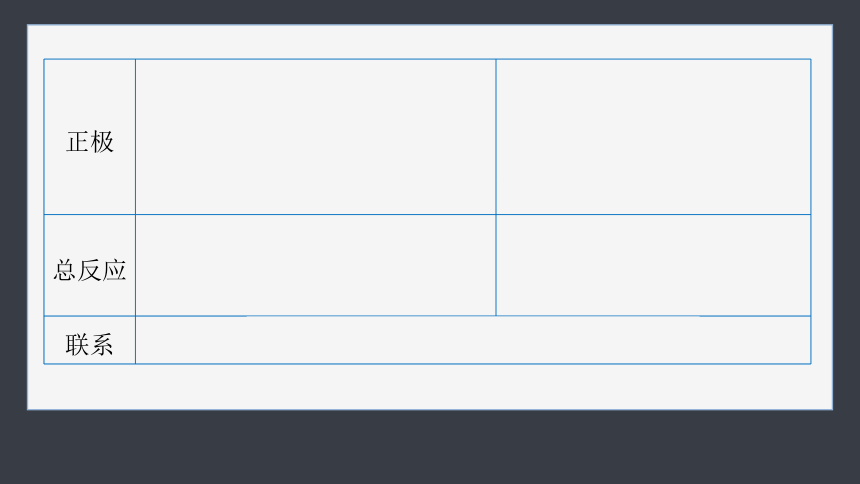
4.金属电化学腐蚀的类型与反应原理
以钢铁的腐蚀为例
吸氧腐蚀 析氢腐蚀
条件 水膜酸性很弱或呈中性 水膜酸性较强
离子导体 潮湿的空气或电解质溶液 负极 反应物均为铁,电极反应:Fe-2e-===Fe2+
正极 反应物:空气中的氧气 电极反应:O2+4e-+2H2O=== 4OH- 反应物:H+
电极反应:2H++2e-===
H2↑
总反应 2Fe+O2+2H2O===2Fe(OH)2 Fe+2H+===Fe2++H2↑
联系 通常两种腐蚀同时存在,但前者更普遍
思考交流
1.正误判断
(1)无论化学腐蚀还是电化学腐蚀,金属的腐蚀都是金属失电子被氧化的过程
(2)因为CO2普遍存在,所以钢铁腐蚀以析氢腐蚀为主
(3)铜在酸性条件下也可以发生析氢腐蚀
(4)纯铁不易被腐蚀,生铁易被腐蚀,是因为生铁中含碳,能形成原电池发生电化学腐蚀
(5)铁的电化学腐蚀的负极反应为Fe-3e-===Fe3+
×
×
√
√
×
思考交流
2.如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片。观察到:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面。
(1)导管内液面下降时,发生__________(填“析氢腐蚀”或“吸氧腐蚀”,下同)。
(2)红墨水回升时,发生_________,此时正极反应式为________________________。
析氢腐蚀
吸氧腐蚀
O2+2H2O+4e-===4OH-
思考交流
(3)析氢腐蚀时消耗____(填“H+”或“OH-”,下同),吸氧腐蚀时产生_____,具支试管中溶液pH逐渐____
(填“增大”或“减小”)。
H+
OH-
增大
思考交流
3.在一块抛光、干净的钢片上滴上一滴含有少量酚酞和铁氰化钾(K3[Fe(CN)6])的饱和食盐水,几分钟后,液滴中心部分主要呈现蓝色,液滴边缘为一红色圆环,而在两者之间有一棕褐色环。已知:Fe2+与K3[Fe(CN)6]溶液(黄色)反应生成KFe[Fe(CN)6]沉淀(带有特征蓝色)。这是一种检验溶液中Fe2+的常用方法。如图所示:
思考交流
思考下列问题:
(1)液滴中心出现蓝色的原因:_______________
__________________________________________________________________________________
_________________________。
(2)液滴边缘为一红色圆环的原因:___________
_________________________________________
________________________________。
液滴中心氧气的
浓度小,为负极,发生反应:Fe-2e-===Fe2+,然后发生反应:Fe2++K++[Fe(CN)6]3- === KFe[Fe(CN)6]↓(蓝色沉淀)
液滴边缘氧
气的浓度较大,为正极,电极反应为O2+2H2O+4e-===4OH-,使酚酞变红
思考交流
(3)棕褐色环的主要成分为铁锈,用化学用语表示产生铁锈的过程:_______________________
__________________________________________________________________________________
_________________________________________
_______________________________________。
中心区(负极)产生的Fe2+
向边缘(正极)移动,发生如下一系列变化:
Fe2++2OH-===Fe(OH)2
4Fe(OH)2+O2+2H2O===4Fe(OH)3
2Fe(OH)3===Fe2O3·nH2O+(3-n)H2O(铁锈)
金属腐蚀的防护
二
在印度德里城附近的麦哈洛里,矗立着一根公元五世纪铸造的很大铁柱,这根铁柱高6.7米,直径约1.37米,用熟铁铸成,实心,柱顶有着古色古香的装饰花纹,据说这根铁柱是为纪念旃陀罗王而铸造的。但最令人惊异的是,铁柱在露天中耸立了一千五百余年,经历了无数风吹雨打,至今仍没有一点生锈的痕迹!
印度铁柱为什么千年不朽
1.防护本质
阻止金属发生氧化反应。
2.防护方法
(1)在金属表面覆盖保护层
(2)改变金属内部组成、结构等
油漆、搪瓷、陶瓷、沥青、塑料、橡胶、电镀
不锈钢、硅钢、合金材料等
(3)电化学防护方法
电化学防护 牺牲阳极保护法 阴极电保护法
原理 原电池原理 电解池原理
措施 被保护的金属作正极,以一种活动性较强的金属作负极 被保护的金属作阴极,惰性电极作辅助阳极,连接直流电源
应用 如锅炉内壁、船舶外壳、铁塔、铁管道装上若干锌块,可保护钢铁设备 如钢闸门、输送酸性溶液的铁管道等
示意图
联系 被保护的金属都因为电子的流入而免遭腐蚀
思考交流
1.正误判断
(1)在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阴极保护法
(2)镀铜铁制品镀层受损后,铁制品比受损前更易生锈
(3)钢铁制造的暖气管道外常涂有一些沥青,这是钢铁的电化学保护法
(4)给铁件通入直流电,把铁件与电池负极相连接以防止铁腐蚀
(5)用电镀的方法,在钢铁制品表面镀上一层不易被腐蚀的金属,如锡、铬、镍等,能够减缓金属的腐蚀
√
×
√
×
√
思考交流
2.如图所示的各容器中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是______________。
④>②>①>③
金属腐蚀快慢的判断方法
(1)在同一电解质溶液中,同一种金属腐蚀由快到慢的顺序为电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极。
(2)同一种金属在不同介质中腐蚀由快到慢的顺序为强电解质溶液>弱电解质溶液>非电解质溶液。
(3)对同一种电解质溶液来说,电解质溶液浓度越大,金属腐蚀越快。
(4)金属活动性差别越大,活泼性强的金属腐蚀越快。
归纳总结
思考交流
3.利用如图装置,可以模拟铁的电化学防护。
(1)若X为铜,为减缓铁的腐蚀,开关K应置于_____处,铁棒上发生的电极反应为__________________,该种防护方法称为_____________。
(2)若X为锌棒,开关K置于M处,铁棒上的电极反应为___________
_______________,该电化学防护法称为_______________。
N
2H++2e-===H2↑
阴极电保护法
O2+4e-+
牺牲阳极保护法
返回
2H2O===4OH-
电化学腐蚀原理的应用
三
“保暖贴”是冬日保暖防护措施之一,热敷还能缓解因寒冷造成的肩周炎等各种疼痛。你知道保暖贴的发热原理吗?
思考讨论
1. 保暖贴在发热过程中,其主要成分分别起什么作用?
2. 为什么保暖贴能较持久而又稳定地提供热量?
3. 保暖贴使用的是双层包装。外层由不透气的明胶层制成,
内层由微孔透气膜制成,为什么要这样设计?
4. 为什么保暖贴使用后会变得较硬?
思考讨论
1.一次性保暖贴工作原理
铁与氧气的反应是一个放热反应,这个反应在自然条件下进行得很慢,但当它以电池反应的形式发生时则会变得很快,并放出大量的热。
负极 正极
电极材料 铁粉 活性炭
电极反应 Fe-2e-===Fe2+ O2+2H2O+4e-===4OH-
离子导体 食盐水 使用后固体主要成分 炭粉、氯化钠固体、三氧化二铁固体以及含镁和铝的盐
2.微电解技术处理工业废水
负极
正极
电解质溶液
铁
碳
废水
微电池
Fe-2e-===Fe2+
O2+2H2O+4e-===4OH-(碱性或中性条件)
2H++2e-===H2↑(酸性条件)
原理:新生成的电极反应产物具有很高的反应活性,能与废水中的某些污染物发生氧化还原反应,从而达到去除污染物的目的。
思考交流
1.(2022·长沙雅礼中学高二月考)食品保鲜所用的“双吸剂”是由还原铁粉、生石灰、氯化钠、炭粉等按一定比例组成的混合物,可吸收氧气和水,下列分析不正确的是
A.“双吸剂”中的生石灰有吸水作用
B.“双吸剂”吸收氧气时,发生了原电池反应
C.吸收氧气的过程中,铁为原电池的负极
D.炭粉上发生的反应为O2+4e-+4H+===2H2O
√
可构成原电池
O2+4e-+2H2O===4OH-
思考交流
2.利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯进行水体修复的过程如图所示,H+、O2、 等物种的存在会影响效果。
(1)有效腐蚀过程中,有效腐蚀①的电极反应式为___________________
_________________;生成1 mol乙烯所转移的电子物质的量为____mol。
(2)无效腐蚀过程④对应的电极反应式为________________________________。
C2HCl3+6e-+3H+
===C2H4↑+3Cl-
6
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
