1.1 第1课时 化学反应的反应热 课件(共28张PPT)-高中化学鲁科版选择性必修第一册
文档属性
| 名称 | 1.1 第1课时 化学反应的反应热 课件(共28张PPT)-高中化学鲁科版选择性必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 190.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-28 15:11:15 | ||
图片预览







文档简介
(共28张PPT)
第1课时 化学反应的反应热
第1章 第1节
1.了解反应热的概念,能正确判断吸热反应和放热反应。
2.知道通过实验可定量测定反应热,掌握中和反应反应热测定的实验及注意事
项(重、难点)。
学习目标
化学反应的反应热
一
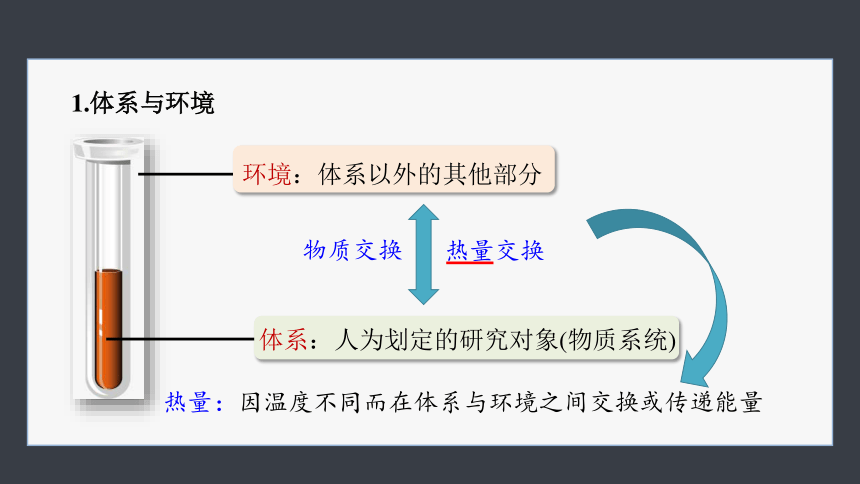
1.体系与环境
环境:体系以外的其他部分
体系:人为划定的研究对象(物质系统)
物质交换
热量交换
热量:因温度不同而在体系与环境之间交换或传递能量
2.吸热反应和放热反应
化学上把最终表现为吸收热量的化学反应叫作吸热反应,
把最终表现为释放热量的化学反应叫作放热反应。
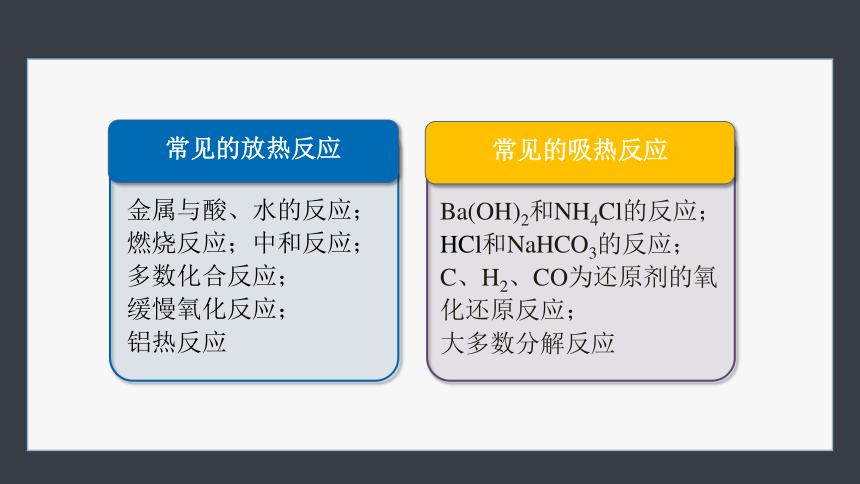
常见的放热反应
常见的吸热反应
金属与酸、水的反应;
燃烧反应;中和反应;
多数化合反应;
缓慢氧化反应;
铝热反应
Ba(OH)2和NH4Cl的反应;
HCl和NaHCO3的反应;
C、H2、CO为还原剂的氧化还原反应;
大多数分解反应
3.反应热
(2)表示方法
(1)反应热的概念
当化学反应在一定的温度下进行时,反应所释放或吸收的热量称为该反应在此温度下的热效应,简称反应热。
反应吸热时Q取正值,即Q>0;反应放热时Q取负值,即Q<0。
符号:Q
思考交流
1.科学家规定Q取正值或负值的依据是什么?
答案 吸热反应:反应物 反应产物,体系的能量增大,故Q取正值;
放热反应:反应物 反应产物,体系的能量减小,故Q取负值。
思考交流
2.有下列常见的化学反应:①Ba(OH)2·8H2O与NH4Cl的反应 ②大多数的分解反应 ③大多数的化合反应 ④铝热反应 ⑤C和H2O(g)、C和CO2的反应 ⑥中和反应 ⑦可燃物的燃烧 ⑧金属与酸的置换反应
其中属于放热反应的是____________(填序号,下同),属于吸热反应的是________。
③④⑥⑦⑧
①②⑤
思考交流
3.下列四个选项中,表示吸热反应的是
√
图像法判断吸热反应与放热反应
吸热反应:E(反应物)0
放热反应:E(反应物)>E(反应产物),Q<0
思考交流
4.SF6是一种优良的绝缘气体,分子结构中只存在S—F键。已知:
1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F键、
S—F键需吸收的能量分别为160 kJ、330 kJ。则常温下1 mol硫单质与 3 mol F2发生反应:S(s)+3F2(g)===SF6(g)的反应热Q=___________,该反应为______(填“放热”或“吸热”)反应。
-1 220 kJ
放热
反应物断裂化学键时吸收的总能量为280 kJ+3×160 kJ=760 kJ,1个SF6分子中有6个S—F键,形成化学键释放的总能量为330 kJ×6=
1 980 kJ,显然该反应为放热反应,Q=-(1 980-760) kJ=-1 220 kJ。
反应热与化学键的关系
归纳总结
Q=ΔE1-ΔE2
测定中和反应的反应热
二
1.反应热数值的获得方法
思考:如何准确测量一个化学反应释放或吸收的热量?
实验测得
理论计算
用实验方法和理论方法研究反应热的化学分支——
热化学
2.反应热测定的方法和装置
(1)测定反应热的仪器——量热计
温度计:测量反应前后体系的温度
搅拌器:
使反应充分进行、保持体系的温度均匀
外筒:保温作用
内筒:反应容器
反应物
(2)测定方法
将反应物加入内筒并搅拌使之迅速反应,测量反应前后溶液温度的变化值。
Q=-C(T2-T1)
(3)计算公式
C:溶液及量热计的热容
T1:反应前体系的温度
T2:反应后体系的温度
3.实验探究——中和反应的反应热的测定
(1)实验原理
酸碱中和反应是放热反应,利用一定质量的酸和碱发生反应,测出反应前后溶液温度差,再根据参加反应的酸溶液和碱溶液的体积求出混合溶液的质量。
换算成生成1 mol H2O(l)放出的热量。
公式:Q=-c·m·ΔT=-CΔT
c:比热容
m:酸碱溶液的质量和
ΔT=T2-T1
(2)实验步骤
③重复操作两次,取温度差的平均值作为计算依据。
①反应前体系的温度:分别测量盐酸与NaOH溶液的温度。
②反应后体系的温度:迅速混合并搅拌,记录最高温度。
思考交流1
问题 分析
实验装置仪器选择 (1)测量盐酸和NaOH溶液的温度时能否选用不同的温度计?
实验操作 (2)测完酸后能否直接测量碱的温度?应该如何操作?
否,不同的温度计会存在仪器误差
不能,残留的酸会与碱反应,造成酸碱消耗,热量损失。测定一种溶液后必须用水冲洗干净并用滤纸擦干后再测另一种溶液
思考交流1
实验操作 (3)为何将溶液迅速倒入内筒后,立即盖上杯盖?
(4)能否将NaOH溶液分多次倒入量热计中?
减少热量的损失
否,操作要迅速,尽量减少热量的散失
4.数据处理
(1)某化学小组用50 mL 0.50 mol·L-1盐酸与50 mL 0.50 mol·L-1 NaOH溶液进行实验。
实验次数 反应物的温度/℃ 反应前体系的 温度/K 反应后体系的温度/K 温度差/K
盐酸 NaOH溶液 T1 T2 T2-T1
1 25.0 25.2 298.1 301.5
2 24.9 25.1 298.0 301.3
3 25.6 25.4 298.5 302.0
3.4
3.3
3.5
设溶液的密度均为1 g·cm-3,反应后溶液的比热c=4.18 kJ·K-1·kg-1,反应放出的热量Q=cmΔT=c·[m(盐酸)+m(NaOH溶液)]·(T2-T1)=4.18 kJ·K-1·kg-1×(50+50)×10-3kg×(T2-T1)=0.418×3.4 kJ≈1.42 kJ,换算生成1 mol H2O放出的热量为 =_________= 。
(★误差太大的数据要舍去!!!)
取三次测量所得温度差的平均值作为计算依据
56.8 kJ
(2)该小组用上述同浓度的硝酸和KOH做同样的测定实验,初步处理后的数据见下表:
三次实验平均值 反应前后温差(T2-T1)/K 换算生成1 mol H2O放出的热量/kJ
KOH溶液、盐酸各50 mL 3.41
NaOH溶液、硝酸各100 mL 3.42
57.0
57.2
思考交流2
(1)大量精确实验测得,在25 ℃和101 kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1 mol H2O时,放出57.3 kJ的热量。
该小组三次不同的实验测得数据小于57.3 kJ·mol-1,试分析产生误差可能的原因。
提示 ①量取酸碱溶液时,操作或读数不当,量取体积小于50 mL;②量热计保温效果不好;③溶液混合时速度不够快,或没有及时盖上杯盖;④读取反应后温度时,过早或过晚,不是读取的最高温度。
思考交流2
(2)指导老师总结时说“若用0.55 mol·L-1NaOH或KOH代替原来的碱溶液实验,可能实验结果更准确”,请你帮老师解释原因。
提示 碱稍过量,盐酸能全部参加反应,最后用盐酸的物量的量换算生成1 mol水的反应热,所得数据更精确。
(3)上述测定实验中所用酸、碱溶液体积差别很大,测得生成1 mol H2O时,反应热却很接近,原因是什么?
提示 在中和反应反应热测定实验数据处理时,要用参加反应的n(H+)或n(OH-)换算生成1 mol水放出的热量,其数值与反应物的量的多少无关。
思考交流2
(4)用浓硫酸代替盐酸对结果会产生什么影响?用醋酸代替盐酸对结果会产生什么影响?
提示 浓硫酸溶于水时放热,使所测反应热的数值偏大;弱酸电离时吸热,使所测反应热的数值偏小。
第1课时 化学反应的反应热
第1章 第1节
1.了解反应热的概念,能正确判断吸热反应和放热反应。
2.知道通过实验可定量测定反应热,掌握中和反应反应热测定的实验及注意事
项(重、难点)。
学习目标
化学反应的反应热
一
1.体系与环境
环境:体系以外的其他部分
体系:人为划定的研究对象(物质系统)
物质交换
热量交换
热量:因温度不同而在体系与环境之间交换或传递能量
2.吸热反应和放热反应
化学上把最终表现为吸收热量的化学反应叫作吸热反应,
把最终表现为释放热量的化学反应叫作放热反应。
常见的放热反应
常见的吸热反应
金属与酸、水的反应;
燃烧反应;中和反应;
多数化合反应;
缓慢氧化反应;
铝热反应
Ba(OH)2和NH4Cl的反应;
HCl和NaHCO3的反应;
C、H2、CO为还原剂的氧化还原反应;
大多数分解反应
3.反应热
(2)表示方法
(1)反应热的概念
当化学反应在一定的温度下进行时,反应所释放或吸收的热量称为该反应在此温度下的热效应,简称反应热。
反应吸热时Q取正值,即Q>0;反应放热时Q取负值,即Q<0。
符号:Q
思考交流
1.科学家规定Q取正值或负值的依据是什么?
答案 吸热反应:反应物 反应产物,体系的能量增大,故Q取正值;
放热反应:反应物 反应产物,体系的能量减小,故Q取负值。
思考交流
2.有下列常见的化学反应:①Ba(OH)2·8H2O与NH4Cl的反应 ②大多数的分解反应 ③大多数的化合反应 ④铝热反应 ⑤C和H2O(g)、C和CO2的反应 ⑥中和反应 ⑦可燃物的燃烧 ⑧金属与酸的置换反应
其中属于放热反应的是____________(填序号,下同),属于吸热反应的是________。
③④⑥⑦⑧
①②⑤
思考交流
3.下列四个选项中,表示吸热反应的是
√
图像法判断吸热反应与放热反应
吸热反应:E(反应物)
放热反应:E(反应物)>E(反应产物),Q<0
思考交流
4.SF6是一种优良的绝缘气体,分子结构中只存在S—F键。已知:
1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F键、
S—F键需吸收的能量分别为160 kJ、330 kJ。则常温下1 mol硫单质与 3 mol F2发生反应:S(s)+3F2(g)===SF6(g)的反应热Q=___________,该反应为______(填“放热”或“吸热”)反应。
-1 220 kJ
放热
反应物断裂化学键时吸收的总能量为280 kJ+3×160 kJ=760 kJ,1个SF6分子中有6个S—F键,形成化学键释放的总能量为330 kJ×6=
1 980 kJ,显然该反应为放热反应,Q=-(1 980-760) kJ=-1 220 kJ。
反应热与化学键的关系
归纳总结
Q=ΔE1-ΔE2
测定中和反应的反应热
二
1.反应热数值的获得方法
思考:如何准确测量一个化学反应释放或吸收的热量?
实验测得
理论计算
用实验方法和理论方法研究反应热的化学分支——
热化学
2.反应热测定的方法和装置
(1)测定反应热的仪器——量热计
温度计:测量反应前后体系的温度
搅拌器:
使反应充分进行、保持体系的温度均匀
外筒:保温作用
内筒:反应容器
反应物
(2)测定方法
将反应物加入内筒并搅拌使之迅速反应,测量反应前后溶液温度的变化值。
Q=-C(T2-T1)
(3)计算公式
C:溶液及量热计的热容
T1:反应前体系的温度
T2:反应后体系的温度
3.实验探究——中和反应的反应热的测定
(1)实验原理
酸碱中和反应是放热反应,利用一定质量的酸和碱发生反应,测出反应前后溶液温度差,再根据参加反应的酸溶液和碱溶液的体积求出混合溶液的质量。
换算成生成1 mol H2O(l)放出的热量。
公式:Q=-c·m·ΔT=-CΔT
c:比热容
m:酸碱溶液的质量和
ΔT=T2-T1
(2)实验步骤
③重复操作两次,取温度差的平均值作为计算依据。
①反应前体系的温度:分别测量盐酸与NaOH溶液的温度。
②反应后体系的温度:迅速混合并搅拌,记录最高温度。
思考交流1
问题 分析
实验装置仪器选择 (1)测量盐酸和NaOH溶液的温度时能否选用不同的温度计?
实验操作 (2)测完酸后能否直接测量碱的温度?应该如何操作?
否,不同的温度计会存在仪器误差
不能,残留的酸会与碱反应,造成酸碱消耗,热量损失。测定一种溶液后必须用水冲洗干净并用滤纸擦干后再测另一种溶液
思考交流1
实验操作 (3)为何将溶液迅速倒入内筒后,立即盖上杯盖?
(4)能否将NaOH溶液分多次倒入量热计中?
减少热量的损失
否,操作要迅速,尽量减少热量的散失
4.数据处理
(1)某化学小组用50 mL 0.50 mol·L-1盐酸与50 mL 0.50 mol·L-1 NaOH溶液进行实验。
实验次数 反应物的温度/℃ 反应前体系的 温度/K 反应后体系的温度/K 温度差/K
盐酸 NaOH溶液 T1 T2 T2-T1
1 25.0 25.2 298.1 301.5
2 24.9 25.1 298.0 301.3
3 25.6 25.4 298.5 302.0
3.4
3.3
3.5
设溶液的密度均为1 g·cm-3,反应后溶液的比热c=4.18 kJ·K-1·kg-1,反应放出的热量Q=cmΔT=c·[m(盐酸)+m(NaOH溶液)]·(T2-T1)=4.18 kJ·K-1·kg-1×(50+50)×10-3kg×(T2-T1)=0.418×3.4 kJ≈1.42 kJ,换算生成1 mol H2O放出的热量为 =_________= 。
(★误差太大的数据要舍去!!!)
取三次测量所得温度差的平均值作为计算依据
56.8 kJ
(2)该小组用上述同浓度的硝酸和KOH做同样的测定实验,初步处理后的数据见下表:
三次实验平均值 反应前后温差(T2-T1)/K 换算生成1 mol H2O放出的热量/kJ
KOH溶液、盐酸各50 mL 3.41
NaOH溶液、硝酸各100 mL 3.42
57.0
57.2
思考交流2
(1)大量精确实验测得,在25 ℃和101 kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1 mol H2O时,放出57.3 kJ的热量。
该小组三次不同的实验测得数据小于57.3 kJ·mol-1,试分析产生误差可能的原因。
提示 ①量取酸碱溶液时,操作或读数不当,量取体积小于50 mL;②量热计保温效果不好;③溶液混合时速度不够快,或没有及时盖上杯盖;④读取反应后温度时,过早或过晚,不是读取的最高温度。
思考交流2
(2)指导老师总结时说“若用0.55 mol·L-1NaOH或KOH代替原来的碱溶液实验,可能实验结果更准确”,请你帮老师解释原因。
提示 碱稍过量,盐酸能全部参加反应,最后用盐酸的物量的量换算生成1 mol水的反应热,所得数据更精确。
(3)上述测定实验中所用酸、碱溶液体积差别很大,测得生成1 mol H2O时,反应热却很接近,原因是什么?
提示 在中和反应反应热测定实验数据处理时,要用参加反应的n(H+)或n(OH-)换算生成1 mol水放出的热量,其数值与反应物的量的多少无关。
思考交流2
(4)用浓硫酸代替盐酸对结果会产生什么影响?用醋酸代替盐酸对结果会产生什么影响?
提示 浓硫酸溶于水时放热,使所测反应热的数值偏大;弱酸电离时吸热,使所测反应热的数值偏小。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
