第3章不同聚集状态的物质与性质检测题(含解析)2022---2023学年下学期高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 第3章不同聚集状态的物质与性质检测题(含解析)2022---2023学年下学期高二化学鲁科版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-28 11:45:37 | ||
图片预览



文档简介
第3章不同聚集状态的物质与性质检测题
一、单选题
1.下列物质中,属于原子晶体的单质是( )
A.水晶 B.碳化硅 C.金刚石 D.干冰
2.下列说法不正确的是
A.液晶具有液体的流动性,在某些物理性质方面具有类似晶体的各向异性
B.超分子的特征是分子识别和分子自组装
C.电子跃迁时,会吸收或放出特定的能量产生原子光谱
D.等离子体基本构成粒子只有阴、阳离子
3.广泛存在于星际环境中,其结构如下图。下列有关说法错误的是
A.和互为同素异形体
B.的中子数是7
C.实验室可制取分子,该过程中被氧化
D.在常温下不导电,将钾放进它的内部得到掺钾的,推测该物质具有导电性
4.已知某离子晶体晶胞如图所示。已知该晶体的密度为ρ g/cm3,摩尔质量为M g/mol,阿伏加德罗常数的值为NA。下列说法中正确的是
A.该晶胞中阴、阳离子个数均为1
B.其中的阴、阳离子的配位数都是4
C.该晶胞可能是CsCl的晶胞
D.该晶胞中两个阳离子最近的核间距为
5.下列消毒剂中的有效成分属于离子化合物的是
A.双氧水() B.漂白粉[]
C.滴露() D.强氯精()
6.下列事实能说明刚玉(α—Al2O3)是一种共价晶体的是
①Al2O3是两性氧化物;②硬度很大;③熔点为2045℃;④几乎不溶于水;⑤自然界中的刚玉有红宝石和蓝宝石
A.①②③ B.②③④ C.④⑤ D.②⑤
7.我国女科学家屠呦呦发现青蒿素(青蒿素的化学式:C15H22O5),它是一种用于治疗疟疾的药物,曾经挽救了数百万人的生命,近日获得诺贝尔生理与医学奖,成为我国获得诺贝尔科学奖的第一人。下列关于青蒿素的叙述错误的是( )
A.青蒿素的一个分子中含有42个原子
B.青蒿素中碳元素的质量分数约为63.8%
C.青蒿素的相对分子质量为282
D.0.1 mol青蒿素的质量为28.2
8.下列有关比较正确的是
A.键角: H2O>PH3>NH3
B.熔点:金刚石<NaBr<NaCl<干冰
C.键的极性: N—H键>O一H键>F一H键
D.沸点:>
9.下列化合物中,沸点最高的是
A.CH3CH2CH2CH2CH2CH3 B.CH3CH2CH2CH2CH2CHO
C.CH3CH2CH2CH2CH2CH2OH D.
10.化学与社会、生产、科技等密切相关,下列说法不正确的是
A.用X射线衍射仪可测定菁蒿素的晶体结构
B.用电解还原法可在铝制品表面形成致密的Al2O3膜
C.用聚四氟乙烯可制造耐腐蚀的设备和仪器
D.用油水分离膜可以从石油和水的混合物中提取石油
11.下列说法不正确的是
A.晶体具有固定的熔、沸点,而非晶体没有固定的熔、沸点
B.晶体与非晶体具有相同的性质
C.部分电子表、电脑的显示器是由液晶材料制成的
D.等离子体是一种很好的导电体,在信息产业等领域有非常好的应用前景
12.下列说法正确的是
A.熔点:
B.向CuSO4溶液中加入过量稀氨水,再加入乙醇,析出的晶体产物中的外界离子的空间构型是平面正方形
C.NH3比PH3稳定是因为NH3分子间存在氢键
D.加热KHSO4使其熔化,这个过程破坏了KHSO4中的离子键和共价键
13.下列有关说法正确的是( )
A.含有金属阳离子的晶体就一定是离子晶体
B.熔点、沸点由高到低:金刚石>NaCl>HF>HCl
C.H2O比H2S稳定,这是由于H2O分子间有氢键
D.空间利用率:面心立方最密堆积>六方最密堆积>体心立方堆积
14.干冰晶体是面心立方结构,如图所示,若干冰晶体的晶胞棱长为a,则每个CO2分子周围与其相距a的CO2分子有
A.4个 B.8个 C.12个 D.6个
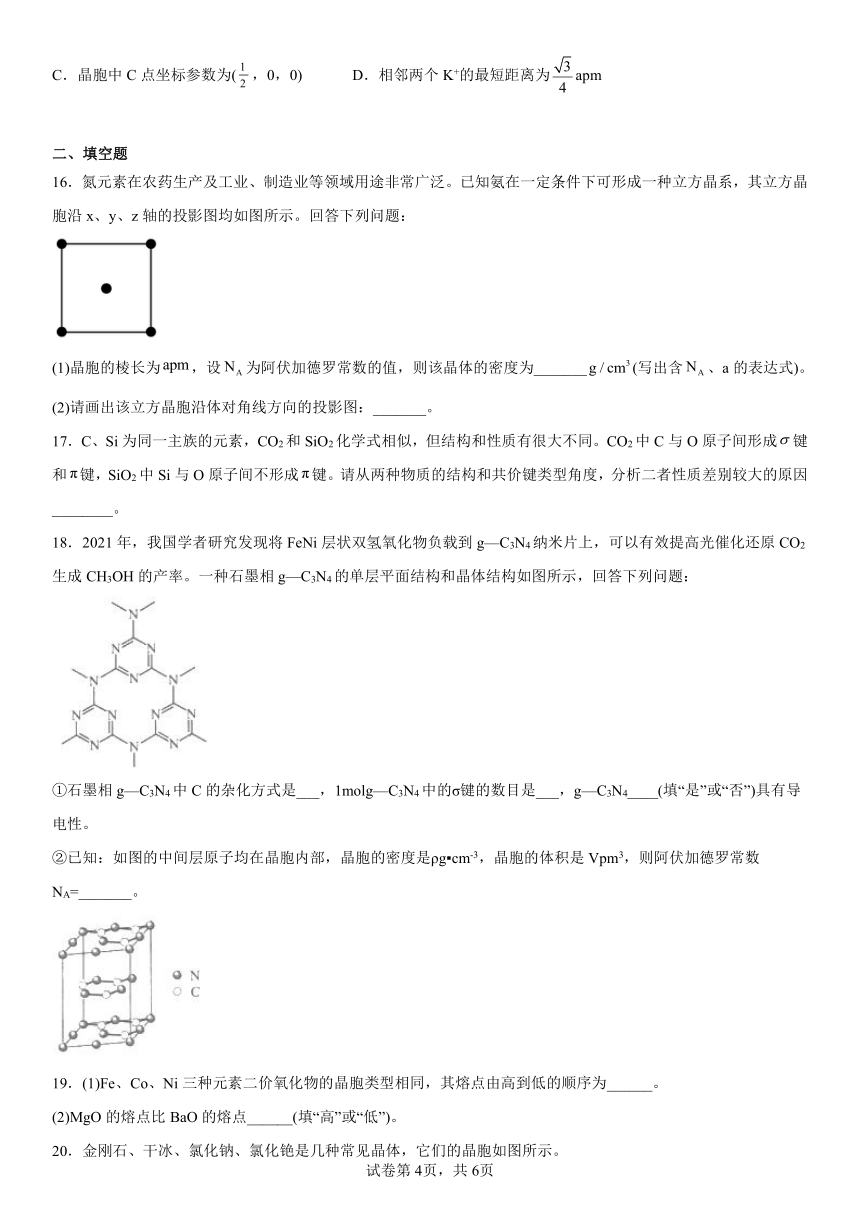
15.C60的晶体空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,已知:晶胞参数为apm,各点的坐标参数分别为A(0,0,0),B(,0,)。下列说法错误的是
A.该晶体的化学式为K3C60 B.K+位于由C60分子围成的正六面体中心
C.晶胞中C点坐标参数为(,0,0) D.相邻两个K+的最短距离为apm
二、填空题
16.氮元素在农药生产及工业、制造业等领域用途非常广泛。已知氨在一定条件下可形成一种立方晶系,其立方晶胞沿x、y、z轴的投影图均如图所示。回答下列问题:
(1)晶胞的棱长为,设为阿伏加德罗常数的值,则该晶体的密度为_______(写出含、a的表达式)。
(2)请画出该立方晶胞沿体对角线方向的投影图:_______。
17.C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成键和键,SiO2中Si与O原子间不形成键。请从两种物质的结构和共价键类型角度,分析二者性质差别较大的原因________。
18.2021年,我国学者研究发现将FeNi层状双氢氧化物负载到g—C3N4纳米片上,可以有效提高光催化还原CO2生成CH3OH的产率。一种石墨相g—C3N4的单层平面结构和晶体结构如图所示,回答下列问题:
①石墨相g—C3N4中C的杂化方式是___,1molg—C3N4中的σ键的数目是___,g—C3N4____(填“是”或“否”)具有导电性。
②已知:如图的中间层原子均在晶胞内部,晶胞的密度是ρg cm-3,晶胞的体积是Vpm3,则阿伏加德罗常数NA=_______。
19.(1)Fe、Co、Ni三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为______。
(2)MgO的熔点比BaO的熔点______(填“高”或“低”)。
20.金刚石、干冰、氯化钠、氯化铯是几种常见晶体,它们的晶胞如图所示。
回答下列问题:
(1)金刚石的晶体类型是_____________。
(2)氯化钠、金刚石、干冰中,熔点最低的是_____________。
(3)氯化钠晶体中,粒子间主要的化学键类型为_____________,其阴、阳离子数量的最简比为_____________。
(4)氯化铯晶体中,的配位数为_____________。
21.按要求回答下列问题:
(1)系统命名的名称为:______________________________________。
(2)下列物质的熔沸点由高到低的排序为______________________________________(填序号)。
①2-甲基丁烷 ②2,3-二甲基丁烷 ③ 2,2-二甲基丙烷 ④戊烷 ⑤3-甲基戊烷
(3)写出 2-丁烯在一定条件下加聚产物的结构简式______________________________________。
(4)某烃 A 0.2mol 在氧气中完全燃烧后,生成化合物 B、C 各 1.2mol,试回答:
①烃 A 的分子式为______________________________________。
②若烃 A 不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯代物只有一种,则此烃 A 的结构简式为______________________________________。
③若烃 A 能使溴水褪色,在催化剂作用下与 H2 加成,其加成产物分子中含有 4 个甲基,烃 A 可能的结构简式为______________________________________,______________________________________,______________________________________。
22.砷化镍激光在医学上用于治疗皮肤及黏膜创面的感染、溃疡等,砷化镍晶胞如图所示,该晶胞密度ρ为_______g·cm-3(列式即可,不必化简)。
23.(1)(CH3)3 NH+和可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂___________(填“大”或“小”),可用作___________(填序号)。
a.助燃剂 b.“绿色”溶剂 c.复合材料 d.绝热材料
(2)为了研究在纳米级的空间中水的结冰温度,科学家对不同直径碳纳米管中水的结冰温度进行分析。如图是四种不同直径碳纳米管中的冰柱结构及结冰温度,冰柱的大小取决于碳纳米管的直径。水在碳纳米管中结冰的规律是_________________。
24.的熔点为306℃,沸点为315℃,的晶体类型是_______。
25.磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料。 LiFePO4可用FeCl3、NH4H2PO4、LiCl和苯胺()等作为原料制备。
(1) Fe2+基态核外电子排布式为________,PO43-的空间构型为________(用文字描述)。
(2) NH4H2PO4中,除氢元素外,其余三种元素第一电离能最大的是____(填元素符号)。
(3) 1 mol含有的σ键数目为___,苯胺的沸点高于甲苯的主要原因是________。
(4) 一个LiCl晶胞(如图)中,Li+数目为________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A. 水晶成分为SiO2,是原子晶体,是化合物,故A不符;
B. 碳化硅是原子晶体,是化合物,故B不符;
C. 金刚石是原子晶体,是碳单质,故C符合;
D. 干冰属于分子晶体,是化合物,故D不符;
故选C。
2.D
【详解】A.在一定范围内存在液体流动性,也存在晶体各向异性的物质,称之为液晶,故A正确;
B.超分子的特征是分子识别和分子自组装,故B正确;
C.原子核外电子发射光子形成的光谱称为原子发射光谱,吸收光子能量形成的光谱称为原子吸收光谱,故C正确;
D.等离子体是由电子、阳离子和电中性粒子组成的整体上呈电中性的物质聚集体,故D错误;
故答案选D。
3.A
【详解】A.同素异形体指的是同种元素形成的不同单质,如石墨、金刚石、,而和则是同种元素形成的同种单质,只是在自然界中的含量有所不同,故A错误;
B.原子符号中,A为质量数,Z为质子数;在原子中,质子数=核电荷数=核外电子数=原子序数,所以,中质量数为13,而质子数为6,中子数=质量数-质子数=13-6=7;故B正确;
C.在的甲苯或二氯苯溶液中通入,可以得到的氧化产物,如等,使碳笼活性增大,进而发生碳笼部分开口及由此合成笼内金属包合物的可能性,故C正确;
D. 在常温下不导电,但其碳原子结合形状呈中空足球状,其中空部分可以填入其他原子或分子。其中,1991年发现钾掺杂的在18K时有超导行为。故D正确;
故合理选项为A。
4.D
【详解】A.晶胞中白球位于棱心和体心,晶胞单独占有白球数目=12×+1=4,黑球位于顶点和面心,晶胞单独占有黑球数目=8×+6×=4,故A错误;
B.由晶胞结构,体心的白球周围有6个黑球,每个黑球周围有6个白球,所以晶体中,阴、阳离子的配位数都为6,故B错误;
C.根据均摊法可知,在这个晶胞中阴、阳离子的个数都为4,阴、阳离子的配位数都为6,晶胞结构与NaCl晶胞相同,可能是NaCl的晶胞,CsCl的配位数是8,故C错误;
D.晶胞的棱长是cm,该晶胞中两个阳离子最近的距离是面对角线的一半,则为cm=,故D正确;
故选D。
5.B
【详解】A.过氧化氢中,氢原子与氧原子之间以共用电子对的形式形成稳定结构,是共价化合物,A错误;
B.漂白粉[Ca(ClO)2]中Ca失去两个电子被ClO得到,Ca2+与ClO-之间形成的是离子键,所以是离子化合物,B正确;
C.滴露()中都为非金属原子,其形成的都是共价键,所以是共价化合物,C错误;
D.强氯精()中都是非金属原子,并且形成的都是共价键,所以是共价化合物,D错误;
故选B。
6.B
【详解】是两性氧化物,属于物质的分类,与晶体类型无关,①错误;硬度很大、熔点为2045℃(很高),都是共价晶体的物理性质,②③正确;由于共价晶体中原子间都以共价键相结合形成三维骨架结构,故几乎不溶于水,④正确;红宝石、蓝宝石是刚玉在自然界中的存在形式,与晶体类型无关,⑤错误,正确的组合是②③④;
故选:B;
7.D
【详解】A、青蒿素的一个分子中的含有15个碳原子、22个氢原子和5个氧原子,共42个原子,故A正确;
B、碳元素的质量分数是×100%=63.8%,故B正确;
C、青蒿素的相对分子质量为15×12+22×1+5×16=282,故C正确;
D、0.1mol青蒿素的质量为0.1mol×282g/mol= 28.2g,故D错误;
故选D。
8.D
【详解】A.H2O、PH3、NH3的VSEPR模型为四面体形,H2O有2对孤电子对,PH3、NH3都有1对孤电子对,由于孤电子对间排斥力>孤电子对和成对电子对间的排斥力>成对电子对间的排斥力,PH3、NH3相比,P原子半径大,共价键排斥力较小,所以键角:NH3>PH3>H2O,A错误;
B.金刚石为共价晶体,熔点较高,NaBr和NaCl都是离子晶体,其中氯离子半径较小,氯化钠晶格能大,熔点高,故熔点顺序为:干冰<NaBr<NaCl<金刚石,B错误;
C.氢化物中H和X的电负性差值越大,极性越强,则共价键的极性:F一H键>O一H键>N—H键,C错误;
D.对羟基苯甲醛可以形成分子间氢键,沸点较高,邻羟基苯甲醛可以形成分子内氢键,熔点较低,D正确;
故选D。
9.C
【分析】四者均为分子晶体,影响分子晶体熔沸点的是范德华力和氢键,相对分子质量越大,范德华力越大,物质的熔沸点越高;氢键存在于含H-O或H- F或H- N间的分子间,氢键的存在能使物质的熔沸点反常升高,据此分析。
【详解】A.CH3CH2CH2CH2CH2CH3分子式是C6H14,相对分子质量是86,分子之间只存在分子间作用力;
B.CH3CH2CH2CH2CH2CHO分子式是C6H12O,相对分子质量是100,分子之间只存在分子间作用力;
C.CH3CH2CH2CH2CH2CH2OH分子式是C6H14O,相对分子质量是102,分子之间除存在分子间作用力外还存在氢键;
D.苯结构简式是,分子式是C6H6,相对分子质量是78,分子之间只存在分子间作用力;
根据上述分析可知:相对分子质量最大的物质是CH3CH2CH2CH2CH2CH2OH,该物质分子之间除存在分子间作用力外,还存在氢键,使其分子间作用力在四种物质中最强,因此该物质的熔沸点最高,故合理选项是C。
10.B
【详解】A.X射线衍射仪可以测定晶体结构,A正确;
B.用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,B错误;
C.聚四氟乙烯具有耐高温、耐腐蚀性,可以做化学仪器,C正确;
D.油水分离膜可以分离所有的油类(如植物油、矿物油等)与水,具有超亲水性,超疏油性,D正确;
故选:B。
11.B
【详解】A.晶体有固定的熔点,自范性、各向异性,非晶体无固定的熔点,故A正确;
B.晶体与非晶体内部结构不同,故表现的性质不同,故B错误;
C.部分电子表、电脑的显示器是由液晶材料制成的,需要的驱动电压很低,故C正确;
D.等离子体是一种很好的导电体,在信息产业等领域有非常好的应用前景,等离子体技术在新能源行业、聚合物薄膜、材料防腐蚀等方面前景可观,故D正确;
故选B。
12.A
【详解】A.已知MgO、NaCl是离子晶体,且Mg2+、O2-所带电荷比Na+、Cl-多,且Mg2+的半径比Na+的小,O2-的半径小于Cl-的,则MgO中晶格能大于NaCl的,MgO熔点高于NaCl,H2O、CO2、H2形成分子晶体,且H2O中存在分子间氢键,导致熔点异常升高,CO2的相对分子质量比H2大,分子间作用力CO2的比H2大,故熔点:,A正确;
B.向CuSO4溶液中加入过量稀氨水,再加入乙醇,析出的晶体产物为Cu(NH3)4SO4,则其外界离子为,中中心原子S周围的价层电子对数为:4+=4,的空间构型是正四面体形,B错误;
C.NH3比PH3稳定是NH3中N-H的键能大于PH3中P-H的键能,与存在NH3分子间氢键无关,C错误;
D.加热KHSO4使其熔化,电离出Na+和,这个过程破坏了KHSO4中的离子键,未破坏共价键,D错误;
故答案为A。
13.B
【详解】A.金属晶体含有金属阳离子的晶体,但不是离子晶体,故A错误;
B.金刚石属于原子晶体,NaCl属于离子晶体,原子晶体的熔沸点高于离子晶体,HF和HCl属于分子晶体,由于HF分子间存在氢键,熔沸点高于HCl,熔点、沸点由高到低:金刚石>NaCl>HF>HCl,故B正确;
C.化学键影响物质的稳定性,氢键属于分子间作用力,主要影响物质的熔沸点;H2O比H2S稳定,这是由于O原子的半径小于S原子,H-O键长比H-S键长短,键长越短键能越大,化学键越稳定,故C错误;
D.面心立方最密堆积空间利用率为74%,体心立方堆积空间利用率为68%,六方最密堆积空间利用率为74%,则空间利用率:面心立方最密堆积=六方最密堆积>体心立方堆积,故D错误;
答案选B。
14.C
【详解】以顶点CO2分子为研究对象,若干冰晶体的晶胞棱长为a,该CO2分子周围与其相距a的CO2分子处于面心,由于顶点CO2分子为8个晶胞共有,则每个CO2分子周围与其相距a的CO2分子有=12个;
答案选C。
15.B
【详解】A.该晶体中,含C60的个数为=4,含K+个数为=12,所以化学式为K3C60,A正确;
B.晶体中,6个面心上的C60围成正八面体,K+ 位于其中心,晶体可以分成8个小立方体,在小立方体中,含有4个C60,构成正四面体,K+位于其中心,B错误;
C.晶胞中C点位于X轴上,且位于棱的中点,则其坐标参数为(,0,0),C正确;
D.同一面上相邻两个棱心(K+)之间的距离为apm,8个小立方体中,顶点(K+)与体心(K+)之间的距离为apm,大立方体的斜对角线中,三个K+将其均分为4份,两个K+之间的距离为apm,所以相邻两个K+的最短距离为apm,D正确;
故选B。
16.(1)
(2)
【详解】(1)立方晶胞沿x、y、z轴的投影均如题图所示,说明氨形成的晶体类型为体心立方堆积,配位数为8,每个晶胞中含有2个,则该晶体的密度为
(2)立方晶胞沿体对角线方向的投影图为正六边形,即投影图为。
【点睛】本题是先利用体心立方晶胞在三个坐标轴上的投影逆推晶胞类型,虽是逆向思维,但因为是非常熟悉、典型的晶胞,所以识别难度不大,难点在于推出体心立方堆积后,求其在体对角线上的投影,需要较强的空间思维能力,命题角度比较新颖。
17.C的原子半径较小,C、O原子能充分接近,p-p轨道肩并肩重叠程度较大,形成稳定的π键,则能通过C、O之间的键和键形成CO2,即CO2晶体是分子晶体,而Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键,Si只能与周围的4个O形成键,每个O只能与周围的2个Si形成键,则SiO2形成共价晶体,故二者性质和结构均有较大差别
【详解】由于C的原子半径较小,C、O原子能充分接近,p-p轨道肩并肩重叠程度较大,形成稳定的π键,则能够形成CO2,即CO2晶体是分子晶体,而Si原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键,Si只能与周围的4个O形成键,每个O只能与周围的2个Si形成键,则SiO2形成共价晶体,故二者性质和结构均有较大差别,故答案为:C的原子半径较小,C、O原子能充分接近,p-p轨道肩并肩重叠程度较大,形成稳定的π键,则能通过C、O之间的键和键形成CO2,即CO2晶体是分子晶体,而Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键,Si只能与周围的4个O形成键,每个O只能与周围的2个Si形成键,则SiO2形成共价晶体,故二者性质和结构均有较大差别。
18. sp2 9NA 是 ×1030mol-1
【详解】①石墨相g—C3N4中C形成3个σ键,1个π键,价层电子对为3,杂化方式是sp2,平移过去完全重叠就是最小重复单元,每个最小重复单元中有9个σ键,1molg—C3N4中的σ键的数目是9NA,与石墨结构相似,结构中有自由电子,g—C3N4具有导电性。故答案为:sp2;9NA;是;
②晶胞的密度是ρg cm-3,晶胞的体积是Vpm3,晶胞质量为=,晶胞体积为Vcm3,该晶胞的密度为ρg cm-3=,则阿伏加德罗常数NA=×1030mol-1,故答案为:×1030mol-1。
19. NiO>CoO>FeO 高
【详解】(1)因为Fe、CO、Ni的二价氧化物是离子化合物,Fe2+、Co2+、Ni2+半径依次减小,晶体的晶格能依次增大,熔点依次升高,故熔点顺序是NiO>CoO>FeO;故答案为NiO>CoO>FeO;
(2)离子半径越小,离子所带电荷数越多,离子键越强,熔点越高,离子半径:Ba2+>Mg2+,则MgO的熔点更高;故答案为高。
20.(1)原子晶体
(2)干冰
(3) 离子键 1:1
(4)8
【详解】(1)金刚石中碳原子通过共价键形成空间立体网状结构,其晶体类型是原子晶体。
(2)氯化钠是离子晶体,熔化时破坏离子键,金刚石为原子晶体,熔化时破坏共价键,干冰是分子晶体,熔化时破坏范德毕力,范德华力比化学键弱的多,故熔点最低的是干冰。
(3)氯化钠是离子晶体,粒子间主要的化学键类型为离子键,其阴、阳离子数量的最简比为。
(4)氯化铯晶体中,距离最近且相等的Cl-有8个,故的配位数为8。
21. 3,6-二甲基-3-庚烯 ⑤②④①③ C6H12
【分析】(1) 根据烯烃的命名原则对该有机物进行命名;
(2) 由烷烃中碳原子个数越多,沸点越大,则沸点戊烷>丁烷;同分异构体中支链越多,沸点越低;
(3) 加聚反应是通过加成反应聚合成高分子化合物的反应;
(4) ①根据元素守恒,计算烃A的分子式为;
②若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,这说明A是环己烷;
③若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,这说明A是烯烃,据此作答。
【详解】(1) 含有碳碳双键为烯烃,含有双键的最长链上有7个碳为庚烯,从离双键近的一端给碳原子编号,3、4号碳原子之间有双键,3、6号碳原子连有甲基,所以该烯烃的名称是:3,6-二甲基-3-庚烯,故答案为:3,6-二甲基-3-庚烯;
(2) 由烷烃中碳原子个数越多,沸点越大,则沸点戊烷>丁烷;同分异构体中支链越多,沸点越低,则2,2-二甲基丙烷<2-甲基丁烷<戊烷<2,3-二甲基丁烷<3-甲基戊烷,故沸点大小顺序为:⑤>②>④>①>③,故答案为:⑤②④①③;’
(3) 2-丁烯的结构简式为CH3CH=CHCH3,烯烃的加聚反应,从形式上看就是碳碳双键中断开一个键,然后首尾相连,所以异丁烯加聚后的高分子化合物的结构简式为,故答案为:;
(4) ①烃含有C、H两种元素,某烃A0.2mol在氧气的充分燃烧后生成化合物B,C各1.2mol,即生成CO2、H2O各1.2mol,所以碳原子和氢原子的个数是6、12,因此烃A的分子式为C6H12,故答案为:C6H12;
②若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,这说明A是环己烷,则烃A的结构简式是,故答案为:;
③若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,这说明A是烯烃,则烃A可能有的结构简式是、、,故答案为:;;。
【点睛】本题重点(1),关键要掌握烷烃的沸点规律:随碳原子数的增多而升高,碳原子数相同时,支链越多,沸点越低;则可根据烃类物质中,烃含有的C原子数目越多,相对分子质量越大,熔沸点越高,同分异构体分子中,烃含有的支链越多,分子间的作用力越小,熔沸点越小,据此分析解题。
22.
【详解】该晶胞中Ni原子个数=4×+4×+2×+2×=2、As原子个数为2,Ni和As原子个数之比为2∶2=1∶1,晶胞体积V=(a×10-10cm)2×sin60°×b×10-10cm=a2b×10-30,晶胞密度====g·cm-3;
故答案为:。
23. 小 b 碳纳米管直径越大,结冰温度越低
【分析】(1)离子液体中的作用力是离子键,强于氢键和分子间作用力,以此分析解答;
(2)根据图示,随着碳纳米管直径的增大,结冰温度依次为27℃、7℃、-53℃、-83℃,据此分析归纳。
【详解】(1)由(CH3)3NH+和[AlCl4]-形成的离子液体,阴、阳离子间的作用力是离子键,大于有机溶剂分子间的范德华力,因此其挥发性一般比有机溶剂小;该离子液体中不含氧,则其不助燃;液体一般不能用作复合材料;由阴、阳离子形成的离子液体应该具有导热性,不可能用作绝热材料,其挥发性就小,不会污染环境,是“绿色”溶剂,故答案为:小;b;
(2)根据图示,随着碳纳米管直径的增大,结冰温度依次为27℃、7℃、-53℃、-83℃,即碳纳米管直径越大,结冰温度越低(或纳米管直径越小,结冰温度越高),故答案为:碳纳米管直径越大,结冰温度越低(或纳米管直径越小,结冰温度越高)。
24.分子晶体
【详解】的熔点为306℃,沸点为315℃,氯化铁熔沸点较低,则氯化铁属于分子晶体,
故答案为:分子晶体。
25. 1s22s22p63s23p63d6或[Ar]3d6 正四面体 N 14 mol 苯胺可形成分子间氢键,而甲苯分子间没有氢键 4
【详解】(1)Fe是26号元素,核外电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2,Fe2+是Fe失去两个电子形成的,故Fe2+的核外电子排布式为1s22s22p63s23p63d6或[Ar]3d6;PO43-中心原子的孤电子对数为,中心原子的σ键为4条,故PO43-中心原子的价层电子对数为4,故PO43-的空间构型为正四面体;
(2)同主族元素第一电离能从上到下依次减小,故N>P,第ⅤA族元素由于p轨道半满,第一电离能大于第ⅥA族,故N>O,所以N、O、P第一电离能最大的是N;
(3)1分子苯胺(),苯环中C与C之间的σ键有6条,C与H之间的σ键有5条,C和N之间的σ键有1条,N和H之间的σ键有2条,共有14条σ键,故1 mol含有的σ键数目为14 mol;苯胺和甲苯都是分子晶体,苯胺分子中有氨基,氨基之间可以形成氢键,而甲苯分子之间没有氢键,所以苯胺的沸点高于甲苯;
(4)由图可知,Li+在晶胞的棱上和晶胞内,每条棱被4个晶胞共用,故每个晶胞含有Li+个数为个;
【点睛】本题要注意第(2)问,同一周期第一电离从左到右有依次增大的趋势,但第ⅡA族元素s轨道全满,第ⅤA族元素p轨道半满,导致这两个主族原子的第一电离能异常,比后一个主族的原子大,故同一周期元素第一电离能第ⅡA族>第ⅢA族,第ⅤA族>第ⅥA族。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列物质中,属于原子晶体的单质是( )
A.水晶 B.碳化硅 C.金刚石 D.干冰
2.下列说法不正确的是
A.液晶具有液体的流动性,在某些物理性质方面具有类似晶体的各向异性
B.超分子的特征是分子识别和分子自组装
C.电子跃迁时,会吸收或放出特定的能量产生原子光谱
D.等离子体基本构成粒子只有阴、阳离子
3.广泛存在于星际环境中,其结构如下图。下列有关说法错误的是
A.和互为同素异形体
B.的中子数是7
C.实验室可制取分子,该过程中被氧化
D.在常温下不导电,将钾放进它的内部得到掺钾的,推测该物质具有导电性
4.已知某离子晶体晶胞如图所示。已知该晶体的密度为ρ g/cm3,摩尔质量为M g/mol,阿伏加德罗常数的值为NA。下列说法中正确的是
A.该晶胞中阴、阳离子个数均为1
B.其中的阴、阳离子的配位数都是4
C.该晶胞可能是CsCl的晶胞
D.该晶胞中两个阳离子最近的核间距为
5.下列消毒剂中的有效成分属于离子化合物的是
A.双氧水() B.漂白粉[]
C.滴露() D.强氯精()
6.下列事实能说明刚玉(α—Al2O3)是一种共价晶体的是
①Al2O3是两性氧化物;②硬度很大;③熔点为2045℃;④几乎不溶于水;⑤自然界中的刚玉有红宝石和蓝宝石
A.①②③ B.②③④ C.④⑤ D.②⑤
7.我国女科学家屠呦呦发现青蒿素(青蒿素的化学式:C15H22O5),它是一种用于治疗疟疾的药物,曾经挽救了数百万人的生命,近日获得诺贝尔生理与医学奖,成为我国获得诺贝尔科学奖的第一人。下列关于青蒿素的叙述错误的是( )
A.青蒿素的一个分子中含有42个原子
B.青蒿素中碳元素的质量分数约为63.8%
C.青蒿素的相对分子质量为282
D.0.1 mol青蒿素的质量为28.2
8.下列有关比较正确的是
A.键角: H2O>PH3>NH3
B.熔点:金刚石<NaBr<NaCl<干冰
C.键的极性: N—H键>O一H键>F一H键
D.沸点:>
9.下列化合物中,沸点最高的是
A.CH3CH2CH2CH2CH2CH3 B.CH3CH2CH2CH2CH2CHO
C.CH3CH2CH2CH2CH2CH2OH D.
10.化学与社会、生产、科技等密切相关,下列说法不正确的是
A.用X射线衍射仪可测定菁蒿素的晶体结构
B.用电解还原法可在铝制品表面形成致密的Al2O3膜
C.用聚四氟乙烯可制造耐腐蚀的设备和仪器
D.用油水分离膜可以从石油和水的混合物中提取石油
11.下列说法不正确的是
A.晶体具有固定的熔、沸点,而非晶体没有固定的熔、沸点
B.晶体与非晶体具有相同的性质
C.部分电子表、电脑的显示器是由液晶材料制成的
D.等离子体是一种很好的导电体,在信息产业等领域有非常好的应用前景
12.下列说法正确的是
A.熔点:
B.向CuSO4溶液中加入过量稀氨水,再加入乙醇,析出的晶体产物中的外界离子的空间构型是平面正方形
C.NH3比PH3稳定是因为NH3分子间存在氢键
D.加热KHSO4使其熔化,这个过程破坏了KHSO4中的离子键和共价键
13.下列有关说法正确的是( )
A.含有金属阳离子的晶体就一定是离子晶体
B.熔点、沸点由高到低:金刚石>NaCl>HF>HCl
C.H2O比H2S稳定,这是由于H2O分子间有氢键
D.空间利用率:面心立方最密堆积>六方最密堆积>体心立方堆积
14.干冰晶体是面心立方结构,如图所示,若干冰晶体的晶胞棱长为a,则每个CO2分子周围与其相距a的CO2分子有
A.4个 B.8个 C.12个 D.6个
15.C60的晶体空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,已知:晶胞参数为apm,各点的坐标参数分别为A(0,0,0),B(,0,)。下列说法错误的是
A.该晶体的化学式为K3C60 B.K+位于由C60分子围成的正六面体中心
C.晶胞中C点坐标参数为(,0,0) D.相邻两个K+的最短距离为apm
二、填空题
16.氮元素在农药生产及工业、制造业等领域用途非常广泛。已知氨在一定条件下可形成一种立方晶系,其立方晶胞沿x、y、z轴的投影图均如图所示。回答下列问题:
(1)晶胞的棱长为,设为阿伏加德罗常数的值,则该晶体的密度为_______(写出含、a的表达式)。
(2)请画出该立方晶胞沿体对角线方向的投影图:_______。
17.C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成键和键,SiO2中Si与O原子间不形成键。请从两种物质的结构和共价键类型角度,分析二者性质差别较大的原因________。
18.2021年,我国学者研究发现将FeNi层状双氢氧化物负载到g—C3N4纳米片上,可以有效提高光催化还原CO2生成CH3OH的产率。一种石墨相g—C3N4的单层平面结构和晶体结构如图所示,回答下列问题:
①石墨相g—C3N4中C的杂化方式是___,1molg—C3N4中的σ键的数目是___,g—C3N4____(填“是”或“否”)具有导电性。
②已知:如图的中间层原子均在晶胞内部,晶胞的密度是ρg cm-3,晶胞的体积是Vpm3,则阿伏加德罗常数NA=_______。
19.(1)Fe、Co、Ni三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为______。
(2)MgO的熔点比BaO的熔点______(填“高”或“低”)。
20.金刚石、干冰、氯化钠、氯化铯是几种常见晶体,它们的晶胞如图所示。
回答下列问题:
(1)金刚石的晶体类型是_____________。
(2)氯化钠、金刚石、干冰中,熔点最低的是_____________。
(3)氯化钠晶体中,粒子间主要的化学键类型为_____________,其阴、阳离子数量的最简比为_____________。
(4)氯化铯晶体中,的配位数为_____________。
21.按要求回答下列问题:
(1)系统命名的名称为:______________________________________。
(2)下列物质的熔沸点由高到低的排序为______________________________________(填序号)。
①2-甲基丁烷 ②2,3-二甲基丁烷 ③ 2,2-二甲基丙烷 ④戊烷 ⑤3-甲基戊烷
(3)写出 2-丁烯在一定条件下加聚产物的结构简式______________________________________。
(4)某烃 A 0.2mol 在氧气中完全燃烧后,生成化合物 B、C 各 1.2mol,试回答:
①烃 A 的分子式为______________________________________。
②若烃 A 不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯代物只有一种,则此烃 A 的结构简式为______________________________________。
③若烃 A 能使溴水褪色,在催化剂作用下与 H2 加成,其加成产物分子中含有 4 个甲基,烃 A 可能的结构简式为______________________________________,______________________________________,______________________________________。
22.砷化镍激光在医学上用于治疗皮肤及黏膜创面的感染、溃疡等,砷化镍晶胞如图所示,该晶胞密度ρ为_______g·cm-3(列式即可,不必化简)。
23.(1)(CH3)3 NH+和可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂___________(填“大”或“小”),可用作___________(填序号)。
a.助燃剂 b.“绿色”溶剂 c.复合材料 d.绝热材料
(2)为了研究在纳米级的空间中水的结冰温度,科学家对不同直径碳纳米管中水的结冰温度进行分析。如图是四种不同直径碳纳米管中的冰柱结构及结冰温度,冰柱的大小取决于碳纳米管的直径。水在碳纳米管中结冰的规律是_________________。
24.的熔点为306℃,沸点为315℃,的晶体类型是_______。
25.磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料。 LiFePO4可用FeCl3、NH4H2PO4、LiCl和苯胺()等作为原料制备。
(1) Fe2+基态核外电子排布式为________,PO43-的空间构型为________(用文字描述)。
(2) NH4H2PO4中,除氢元素外,其余三种元素第一电离能最大的是____(填元素符号)。
(3) 1 mol含有的σ键数目为___,苯胺的沸点高于甲苯的主要原因是________。
(4) 一个LiCl晶胞(如图)中,Li+数目为________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A. 水晶成分为SiO2,是原子晶体,是化合物,故A不符;
B. 碳化硅是原子晶体,是化合物,故B不符;
C. 金刚石是原子晶体,是碳单质,故C符合;
D. 干冰属于分子晶体,是化合物,故D不符;
故选C。
2.D
【详解】A.在一定范围内存在液体流动性,也存在晶体各向异性的物质,称之为液晶,故A正确;
B.超分子的特征是分子识别和分子自组装,故B正确;
C.原子核外电子发射光子形成的光谱称为原子发射光谱,吸收光子能量形成的光谱称为原子吸收光谱,故C正确;
D.等离子体是由电子、阳离子和电中性粒子组成的整体上呈电中性的物质聚集体,故D错误;
故答案选D。
3.A
【详解】A.同素异形体指的是同种元素形成的不同单质,如石墨、金刚石、,而和则是同种元素形成的同种单质,只是在自然界中的含量有所不同,故A错误;
B.原子符号中,A为质量数,Z为质子数;在原子中,质子数=核电荷数=核外电子数=原子序数,所以,中质量数为13,而质子数为6,中子数=质量数-质子数=13-6=7;故B正确;
C.在的甲苯或二氯苯溶液中通入,可以得到的氧化产物,如等,使碳笼活性增大,进而发生碳笼部分开口及由此合成笼内金属包合物的可能性,故C正确;
D. 在常温下不导电,但其碳原子结合形状呈中空足球状,其中空部分可以填入其他原子或分子。其中,1991年发现钾掺杂的在18K时有超导行为。故D正确;
故合理选项为A。
4.D
【详解】A.晶胞中白球位于棱心和体心,晶胞单独占有白球数目=12×+1=4,黑球位于顶点和面心,晶胞单独占有黑球数目=8×+6×=4,故A错误;
B.由晶胞结构,体心的白球周围有6个黑球,每个黑球周围有6个白球,所以晶体中,阴、阳离子的配位数都为6,故B错误;
C.根据均摊法可知,在这个晶胞中阴、阳离子的个数都为4,阴、阳离子的配位数都为6,晶胞结构与NaCl晶胞相同,可能是NaCl的晶胞,CsCl的配位数是8,故C错误;
D.晶胞的棱长是cm,该晶胞中两个阳离子最近的距离是面对角线的一半,则为cm=,故D正确;
故选D。
5.B
【详解】A.过氧化氢中,氢原子与氧原子之间以共用电子对的形式形成稳定结构,是共价化合物,A错误;
B.漂白粉[Ca(ClO)2]中Ca失去两个电子被ClO得到,Ca2+与ClO-之间形成的是离子键,所以是离子化合物,B正确;
C.滴露()中都为非金属原子,其形成的都是共价键,所以是共价化合物,C错误;
D.强氯精()中都是非金属原子,并且形成的都是共价键,所以是共价化合物,D错误;
故选B。
6.B
【详解】是两性氧化物,属于物质的分类,与晶体类型无关,①错误;硬度很大、熔点为2045℃(很高),都是共价晶体的物理性质,②③正确;由于共价晶体中原子间都以共价键相结合形成三维骨架结构,故几乎不溶于水,④正确;红宝石、蓝宝石是刚玉在自然界中的存在形式,与晶体类型无关,⑤错误,正确的组合是②③④;
故选:B;
7.D
【详解】A、青蒿素的一个分子中的含有15个碳原子、22个氢原子和5个氧原子,共42个原子,故A正确;
B、碳元素的质量分数是×100%=63.8%,故B正确;
C、青蒿素的相对分子质量为15×12+22×1+5×16=282,故C正确;
D、0.1mol青蒿素的质量为0.1mol×282g/mol= 28.2g,故D错误;
故选D。
8.D
【详解】A.H2O、PH3、NH3的VSEPR模型为四面体形,H2O有2对孤电子对,PH3、NH3都有1对孤电子对,由于孤电子对间排斥力>孤电子对和成对电子对间的排斥力>成对电子对间的排斥力,PH3、NH3相比,P原子半径大,共价键排斥力较小,所以键角:NH3>PH3>H2O,A错误;
B.金刚石为共价晶体,熔点较高,NaBr和NaCl都是离子晶体,其中氯离子半径较小,氯化钠晶格能大,熔点高,故熔点顺序为:干冰<NaBr<NaCl<金刚石,B错误;
C.氢化物中H和X的电负性差值越大,极性越强,则共价键的极性:F一H键>O一H键>N—H键,C错误;
D.对羟基苯甲醛可以形成分子间氢键,沸点较高,邻羟基苯甲醛可以形成分子内氢键,熔点较低,D正确;
故选D。
9.C
【分析】四者均为分子晶体,影响分子晶体熔沸点的是范德华力和氢键,相对分子质量越大,范德华力越大,物质的熔沸点越高;氢键存在于含H-O或H- F或H- N间的分子间,氢键的存在能使物质的熔沸点反常升高,据此分析。
【详解】A.CH3CH2CH2CH2CH2CH3分子式是C6H14,相对分子质量是86,分子之间只存在分子间作用力;
B.CH3CH2CH2CH2CH2CHO分子式是C6H12O,相对分子质量是100,分子之间只存在分子间作用力;
C.CH3CH2CH2CH2CH2CH2OH分子式是C6H14O,相对分子质量是102,分子之间除存在分子间作用力外还存在氢键;
D.苯结构简式是,分子式是C6H6,相对分子质量是78,分子之间只存在分子间作用力;
根据上述分析可知:相对分子质量最大的物质是CH3CH2CH2CH2CH2CH2OH,该物质分子之间除存在分子间作用力外,还存在氢键,使其分子间作用力在四种物质中最强,因此该物质的熔沸点最高,故合理选项是C。
10.B
【详解】A.X射线衍射仪可以测定晶体结构,A正确;
B.用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,B错误;
C.聚四氟乙烯具有耐高温、耐腐蚀性,可以做化学仪器,C正确;
D.油水分离膜可以分离所有的油类(如植物油、矿物油等)与水,具有超亲水性,超疏油性,D正确;
故选:B。
11.B
【详解】A.晶体有固定的熔点,自范性、各向异性,非晶体无固定的熔点,故A正确;
B.晶体与非晶体内部结构不同,故表现的性质不同,故B错误;
C.部分电子表、电脑的显示器是由液晶材料制成的,需要的驱动电压很低,故C正确;
D.等离子体是一种很好的导电体,在信息产业等领域有非常好的应用前景,等离子体技术在新能源行业、聚合物薄膜、材料防腐蚀等方面前景可观,故D正确;
故选B。
12.A
【详解】A.已知MgO、NaCl是离子晶体,且Mg2+、O2-所带电荷比Na+、Cl-多,且Mg2+的半径比Na+的小,O2-的半径小于Cl-的,则MgO中晶格能大于NaCl的,MgO熔点高于NaCl,H2O、CO2、H2形成分子晶体,且H2O中存在分子间氢键,导致熔点异常升高,CO2的相对分子质量比H2大,分子间作用力CO2的比H2大,故熔点:,A正确;
B.向CuSO4溶液中加入过量稀氨水,再加入乙醇,析出的晶体产物为Cu(NH3)4SO4,则其外界离子为,中中心原子S周围的价层电子对数为:4+=4,的空间构型是正四面体形,B错误;
C.NH3比PH3稳定是NH3中N-H的键能大于PH3中P-H的键能,与存在NH3分子间氢键无关,C错误;
D.加热KHSO4使其熔化,电离出Na+和,这个过程破坏了KHSO4中的离子键,未破坏共价键,D错误;
故答案为A。
13.B
【详解】A.金属晶体含有金属阳离子的晶体,但不是离子晶体,故A错误;
B.金刚石属于原子晶体,NaCl属于离子晶体,原子晶体的熔沸点高于离子晶体,HF和HCl属于分子晶体,由于HF分子间存在氢键,熔沸点高于HCl,熔点、沸点由高到低:金刚石>NaCl>HF>HCl,故B正确;
C.化学键影响物质的稳定性,氢键属于分子间作用力,主要影响物质的熔沸点;H2O比H2S稳定,这是由于O原子的半径小于S原子,H-O键长比H-S键长短,键长越短键能越大,化学键越稳定,故C错误;
D.面心立方最密堆积空间利用率为74%,体心立方堆积空间利用率为68%,六方最密堆积空间利用率为74%,则空间利用率:面心立方最密堆积=六方最密堆积>体心立方堆积,故D错误;
答案选B。
14.C
【详解】以顶点CO2分子为研究对象,若干冰晶体的晶胞棱长为a,该CO2分子周围与其相距a的CO2分子处于面心,由于顶点CO2分子为8个晶胞共有,则每个CO2分子周围与其相距a的CO2分子有=12个;
答案选C。
15.B
【详解】A.该晶体中,含C60的个数为=4,含K+个数为=12,所以化学式为K3C60,A正确;
B.晶体中,6个面心上的C60围成正八面体,K+ 位于其中心,晶体可以分成8个小立方体,在小立方体中,含有4个C60,构成正四面体,K+位于其中心,B错误;
C.晶胞中C点位于X轴上,且位于棱的中点,则其坐标参数为(,0,0),C正确;
D.同一面上相邻两个棱心(K+)之间的距离为apm,8个小立方体中,顶点(K+)与体心(K+)之间的距离为apm,大立方体的斜对角线中,三个K+将其均分为4份,两个K+之间的距离为apm,所以相邻两个K+的最短距离为apm,D正确;
故选B。
16.(1)
(2)
【详解】(1)立方晶胞沿x、y、z轴的投影均如题图所示,说明氨形成的晶体类型为体心立方堆积,配位数为8,每个晶胞中含有2个,则该晶体的密度为
(2)立方晶胞沿体对角线方向的投影图为正六边形,即投影图为。
【点睛】本题是先利用体心立方晶胞在三个坐标轴上的投影逆推晶胞类型,虽是逆向思维,但因为是非常熟悉、典型的晶胞,所以识别难度不大,难点在于推出体心立方堆积后,求其在体对角线上的投影,需要较强的空间思维能力,命题角度比较新颖。
17.C的原子半径较小,C、O原子能充分接近,p-p轨道肩并肩重叠程度较大,形成稳定的π键,则能通过C、O之间的键和键形成CO2,即CO2晶体是分子晶体,而Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键,Si只能与周围的4个O形成键,每个O只能与周围的2个Si形成键,则SiO2形成共价晶体,故二者性质和结构均有较大差别
【详解】由于C的原子半径较小,C、O原子能充分接近,p-p轨道肩并肩重叠程度较大,形成稳定的π键,则能够形成CO2,即CO2晶体是分子晶体,而Si原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键,Si只能与周围的4个O形成键,每个O只能与周围的2个Si形成键,则SiO2形成共价晶体,故二者性质和结构均有较大差别,故答案为:C的原子半径较小,C、O原子能充分接近,p-p轨道肩并肩重叠程度较大,形成稳定的π键,则能通过C、O之间的键和键形成CO2,即CO2晶体是分子晶体,而Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键,Si只能与周围的4个O形成键,每个O只能与周围的2个Si形成键,则SiO2形成共价晶体,故二者性质和结构均有较大差别。
18. sp2 9NA 是 ×1030mol-1
【详解】①石墨相g—C3N4中C形成3个σ键,1个π键,价层电子对为3,杂化方式是sp2,平移过去完全重叠就是最小重复单元,每个最小重复单元中有9个σ键,1molg—C3N4中的σ键的数目是9NA,与石墨结构相似,结构中有自由电子,g—C3N4具有导电性。故答案为:sp2;9NA;是;
②晶胞的密度是ρg cm-3,晶胞的体积是Vpm3,晶胞质量为=,晶胞体积为Vcm3,该晶胞的密度为ρg cm-3=,则阿伏加德罗常数NA=×1030mol-1,故答案为:×1030mol-1。
19. NiO>CoO>FeO 高
【详解】(1)因为Fe、CO、Ni的二价氧化物是离子化合物,Fe2+、Co2+、Ni2+半径依次减小,晶体的晶格能依次增大,熔点依次升高,故熔点顺序是NiO>CoO>FeO;故答案为NiO>CoO>FeO;
(2)离子半径越小,离子所带电荷数越多,离子键越强,熔点越高,离子半径:Ba2+>Mg2+,则MgO的熔点更高;故答案为高。
20.(1)原子晶体
(2)干冰
(3) 离子键 1:1
(4)8
【详解】(1)金刚石中碳原子通过共价键形成空间立体网状结构,其晶体类型是原子晶体。
(2)氯化钠是离子晶体,熔化时破坏离子键,金刚石为原子晶体,熔化时破坏共价键,干冰是分子晶体,熔化时破坏范德毕力,范德华力比化学键弱的多,故熔点最低的是干冰。
(3)氯化钠是离子晶体,粒子间主要的化学键类型为离子键,其阴、阳离子数量的最简比为。
(4)氯化铯晶体中,距离最近且相等的Cl-有8个,故的配位数为8。
21. 3,6-二甲基-3-庚烯 ⑤②④①③ C6H12
【分析】(1) 根据烯烃的命名原则对该有机物进行命名;
(2) 由烷烃中碳原子个数越多,沸点越大,则沸点戊烷>丁烷;同分异构体中支链越多,沸点越低;
(3) 加聚反应是通过加成反应聚合成高分子化合物的反应;
(4) ①根据元素守恒,计算烃A的分子式为;
②若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,这说明A是环己烷;
③若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,这说明A是烯烃,据此作答。
【详解】(1) 含有碳碳双键为烯烃,含有双键的最长链上有7个碳为庚烯,从离双键近的一端给碳原子编号,3、4号碳原子之间有双键,3、6号碳原子连有甲基,所以该烯烃的名称是:3,6-二甲基-3-庚烯,故答案为:3,6-二甲基-3-庚烯;
(2) 由烷烃中碳原子个数越多,沸点越大,则沸点戊烷>丁烷;同分异构体中支链越多,沸点越低,则2,2-二甲基丙烷<2-甲基丁烷<戊烷<2,3-二甲基丁烷<3-甲基戊烷,故沸点大小顺序为:⑤>②>④>①>③,故答案为:⑤②④①③;’
(3) 2-丁烯的结构简式为CH3CH=CHCH3,烯烃的加聚反应,从形式上看就是碳碳双键中断开一个键,然后首尾相连,所以异丁烯加聚后的高分子化合物的结构简式为,故答案为:;
(4) ①烃含有C、H两种元素,某烃A0.2mol在氧气的充分燃烧后生成化合物B,C各1.2mol,即生成CO2、H2O各1.2mol,所以碳原子和氢原子的个数是6、12,因此烃A的分子式为C6H12,故答案为:C6H12;
②若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,这说明A是环己烷,则烃A的结构简式是,故答案为:;
③若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,这说明A是烯烃,则烃A可能有的结构简式是、、,故答案为:;;。
【点睛】本题重点(1),关键要掌握烷烃的沸点规律:随碳原子数的增多而升高,碳原子数相同时,支链越多,沸点越低;则可根据烃类物质中,烃含有的C原子数目越多,相对分子质量越大,熔沸点越高,同分异构体分子中,烃含有的支链越多,分子间的作用力越小,熔沸点越小,据此分析解题。
22.
【详解】该晶胞中Ni原子个数=4×+4×+2×+2×=2、As原子个数为2,Ni和As原子个数之比为2∶2=1∶1,晶胞体积V=(a×10-10cm)2×sin60°×b×10-10cm=a2b×10-30,晶胞密度====g·cm-3;
故答案为:。
23. 小 b 碳纳米管直径越大,结冰温度越低
【分析】(1)离子液体中的作用力是离子键,强于氢键和分子间作用力,以此分析解答;
(2)根据图示,随着碳纳米管直径的增大,结冰温度依次为27℃、7℃、-53℃、-83℃,据此分析归纳。
【详解】(1)由(CH3)3NH+和[AlCl4]-形成的离子液体,阴、阳离子间的作用力是离子键,大于有机溶剂分子间的范德华力,因此其挥发性一般比有机溶剂小;该离子液体中不含氧,则其不助燃;液体一般不能用作复合材料;由阴、阳离子形成的离子液体应该具有导热性,不可能用作绝热材料,其挥发性就小,不会污染环境,是“绿色”溶剂,故答案为:小;b;
(2)根据图示,随着碳纳米管直径的增大,结冰温度依次为27℃、7℃、-53℃、-83℃,即碳纳米管直径越大,结冰温度越低(或纳米管直径越小,结冰温度越高),故答案为:碳纳米管直径越大,结冰温度越低(或纳米管直径越小,结冰温度越高)。
24.分子晶体
【详解】的熔点为306℃,沸点为315℃,氯化铁熔沸点较低,则氯化铁属于分子晶体,
故答案为:分子晶体。
25. 1s22s22p63s23p63d6或[Ar]3d6 正四面体 N 14 mol 苯胺可形成分子间氢键,而甲苯分子间没有氢键 4
【详解】(1)Fe是26号元素,核外电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2,Fe2+是Fe失去两个电子形成的,故Fe2+的核外电子排布式为1s22s22p63s23p63d6或[Ar]3d6;PO43-中心原子的孤电子对数为,中心原子的σ键为4条,故PO43-中心原子的价层电子对数为4,故PO43-的空间构型为正四面体;
(2)同主族元素第一电离能从上到下依次减小,故N>P,第ⅤA族元素由于p轨道半满,第一电离能大于第ⅥA族,故N>O,所以N、O、P第一电离能最大的是N;
(3)1分子苯胺(),苯环中C与C之间的σ键有6条,C与H之间的σ键有5条,C和N之间的σ键有1条,N和H之间的σ键有2条,共有14条σ键,故1 mol含有的σ键数目为14 mol;苯胺和甲苯都是分子晶体,苯胺分子中有氨基,氨基之间可以形成氢键,而甲苯分子之间没有氢键,所以苯胺的沸点高于甲苯;
(4)由图可知,Li+在晶胞的棱上和晶胞内,每条棱被4个晶胞共用,故每个晶胞含有Li+个数为个;
【点睛】本题要注意第(2)问,同一周期第一电离从左到右有依次增大的趋势,但第ⅡA族元素s轨道全满,第ⅤA族元素p轨道半满,导致这两个主族原子的第一电离能异常,比后一个主族的原子大,故同一周期元素第一电离能第ⅡA族>第ⅢA族,第ⅤA族>第ⅥA族。
答案第1页,共2页
答案第1页,共2页
