专题6《化学反应与能量变化》单元检测题(含解析)2022--2023学年下学期高一化学苏教版(2019)必修第二册
文档属性
| 名称 | 专题6《化学反应与能量变化》单元检测题(含解析)2022--2023学年下学期高一化学苏教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 535.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-28 15:18:01 | ||
图片预览




文档简介
专题6《化学反应与能量变化》单元检测题
一、单选题
1.下列变化符合图示的是
①冰雪融化 ②KMnO4分解制 O2 ③铝与氧化铁的反应 ④钠与水反应⑤二氧化碳与灼热的木炭反应 ⑥碘的升华 ⑦Ba(OH)2 8H2O 和 NH4Cl 的反应
A.②⑥⑦ B.②⑤⑦ C.①②⑤⑥⑦ D.③④
2.在一固定容积的密闭容器中进行如下反应:2SO2(g)+O2(g)2SO3(g),已知反应进行到10秒时,SO2、O2、SO3的物质的量分别为0.2mol、0.1mol、0.2mol,则下列说法正确的是
A.10秒时,用O2表示该反应的平均反应速率为0.01mol/(L·s)
B.向容器内充入SO2,可以提高反应速率
C.当SO2和O2的生成速率之比为2:1时,达到该条件下化学反应限度
D.当反应达平衡时,SO2的物质的量可能为0.4mol
3.下列四个常用电化学装置的叙述错误的是
图I水果电池 图II干电池 图III铅蓄电池 图IV氢氧燃料电池
A.图 所示电池中,电子从锌片流出
B.图 所示干电池中石墨作负极
C.图 所示电池为二次电池
D.图 所示电池中正极反应为:
4.液体锌电池是一种电压较高的二次电池,具有成本低、安全性强、可循环使用等特点,其示意图如右图。下列说法不正确的是
已知:①Zn(OH)2+2OH == Zn(OH)42 。 ②KOH凝胶中允许离子存在、生成或迁移。
A.放电过程中,H+由正极向负极迁移
B.放电过程中,正极的电极反应:MnO2+4H++2e == Mn2++2H2O
C.充电过程中,阴极的电极反应:Zn(OH)42 +2e == Zn+4OH
D.充电过程中,凝胶中的KOH可再生
5.下列说法不正确的是
A.铅酸蓄电池属于二次电池,其充电过程是将电能转化为化学能
B.向密闭容器中充入64g和48gO2,充分反应后生成的的分子数小于NA
C.常温下可以用铁制或铝制容器盛装浓硫酸
D.粗盐中含有可溶性硫酸盐及、等杂质,可选用①溶液、②溶液、③溶液、④稀盐酸去除。这些试剂在使用时的正确顺序可以是③①②④
6.一定条件下,对于反应A2(g)+3B2(g) 2AB3(g)来说,下列所表示的化学反应速率中最大的是
A.v(A2)=0.8 mol/(L·s) B.v(A2)=6 mol/(L·min)
C.v(AB3)=1.0 mol/(L·s) D.v(B2)=1.2 mol/(L·s)
7.在一定条件下的密闭容器中存在下列四个化学反应,增大容器的体积对化学反应速率没有影响的是
A.Fe3+(aq) + 3SCN-(aq) Fe(SCN)3(aq)
B.CO(g) + H2O(g) CO2(g) + H2(g)
C.CO2(g) + H2O(l) H2CO3(aq)
D.2SO2(g) + O2(g) 2SO3(g)
8.关于如图的说法不正确的是
A.1mol固态碘与1molH2化合生成2molHI气体时,需要吸收5kJ的能量
B.2molHI气体分解生成1mol碘蒸气与1molH2时需要吸收12kJ的能量
C.1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量
D.碘蒸气与H2生成HI气体的反应是吸热反应
9.已知:某些化学键的键能数据如表所示:
注:键能为1mol气态分子完全离解成气态原子所吸收的能量。
化学键 H—H Cl—Cl H—Cl S=S H—S
键能/(kJ·mol-1) 436 243 431 255 339
下列说法正确的是
A.1molH2(g)与2molCl2(g)反应生成HCl(g)时放出370kJ热量
B.2H2(g)+S2(s)2H2S(g) ΔH>-229kJ/mol
C.反应的焓变△H=生成物的键能之和-反应物的键能之和
D.1molH2S(g)分解吸收的热量比1molHCl(g)分解吸收的热量多,所以H2S(g)比HCl(g)稳定
10.我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如下:
下列说法正确的是
A.过程Ⅰ、过程Ⅱ均为放热过程
B.使用催化剂降低了水煤气变换反应的ΔH
C.该催化过程中:有极性键的断裂,极性键和非极性键的形成
D.图示显示:起始时的2个H2O在反应过程中并未都参与了反应
11.碘与氢气反应的热化学方程式如下,下列说法正确的是
①I2(g)+H2(g)2HI(g) H=-9.48kJ·mol-1
②I2(s)+H2(g)2HI(g) H=+26.48kJ·mol-1
A.I2(s)=I2(g) H=+17.00kJ·mol-1
B.1mol I2(g)总能量一定比1mol HI(g)总能量高
C.1mol I2(g)中通入1mol H2(g),充分反应后放热9.48kJ
D.2HI(g)I2(s)+H2(g) H=-26.48kJ·mol-1
12.95℃时,将Ni片浸入不同质量分数的硫酸溶液中,经4小时腐蚀后的质量损失情况如图所示。
下列有关说法错误的是
A.ω( H2SO4) <63%时.增大硫酸浓度,单位体积内活化分子数增大,腐蚀速率增大
B.95℃ 时,Ni片在63%硫酸溶液中的腐蚀速率最大
C.ω(H2SO4) >63%时,增大硫酸浓度,活化分子百分数降低,腐蚀速率减慢
D.如果将镍片换成铁片,在常温下进行类似实验,也可绘制出类似的铁质量损失图象
13.下列有关化学反应方向及其判据的说法中错误的是
A.1mol在不同状态时的嫡值:
B.反应 能否自发进行与温度有关
C.分解和HClO分解均是自发过程,故这两个反应的和的变化相同
D.常温下,反应能自发进行,则该反应的
14.2020年,“嫦娥五号”着陆月球,采样返回;2021年,“天问一号”着陆巡视器在火星着陆,“祝融号”火星车在火星表面进行科学实验。下列有关说法不正确的是
A.运载火箭燃料使用的液氢是高能清洁燃料
B.“嫦娥五号”带回的月球土壤中含有,与地球上的互为同位素
C.“祝融号”火星车使用的太阳能电池板将电能转化为化学能
D.“天问一号”的太阳翼使用石墨纤维作增强体,金属为基体的复合材料
15.下列反应既是氧化还原反应,又是吸热反应的是
A.锌片与稀硫酸反应 B.石灰石的分解反应
C.碳与水蒸气反应 D.盐酸与碳酸氢钠反应
二、填空题
16.回答下列问题:
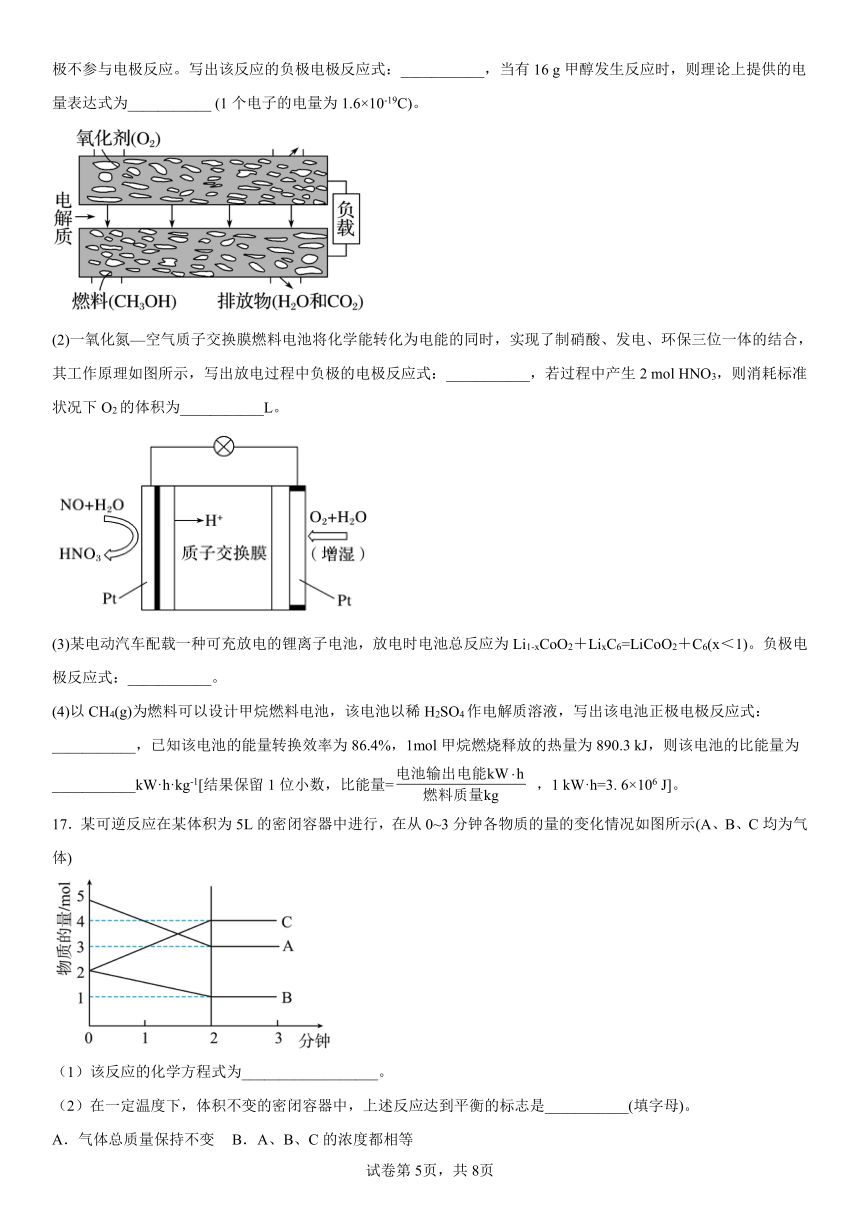
(1)新型固体燃料电池的电解质是固体氧化锆和氧化钇,高温下允许氧离子(O2-)在其间通过。如图所示,其中多孔电极不参与电极反应。写出该反应的负极电极反应式:___________,当有16 g甲醇发生反应时,则理论上提供的电量表达式为___________ (1个电子的电量为1.6×10-19C)。
(2)一氧化氮—空气质子交换膜燃料电池将化学能转化为电能的同时,实现了制硝酸、发电、环保三位一体的结合,其工作原理如图所示,写出放电过程中负极的电极反应式:___________,若过程中产生2 mol HNO3,则消耗标准状况下O2的体积为___________L。
(3)某电动汽车配载一种可充放电的锂离子电池,放电时电池总反应为Li1-xCoO2+LixC6=LiCoO2+C6(x<1)。负极电极反应式:___________。
(4)以CH4(g)为燃料可以设计甲烷燃料电池,该电池以稀H2SO4作电解质溶液,写出该电池正极电极反应式:___________,已知该电池的能量转换效率为86.4%,1mol甲烷燃烧释放的热量为890.3 kJ,则该电池的比能量为___________kW·h·kg-1[结果保留1位小数,比能量= ,1 kW·h=3. 6×106 J]。
17.某可逆反应在某体积为5L的密闭容器中进行,在从0~3分钟各物质的量的变化情况如图所示(A、B、C均为气体)
(1)该反应的化学方程式为__________________。
(2)在一定温度下,体积不变的密闭容器中,上述反应达到平衡的标志是___________(填字母)。
A.气体总质量保持不变 B.A、B、C的浓度都相等
C.A、B、C的浓度不再发生变化 D.A、B、C的分子数之比为2:1:2
E.正反应和逆反应都已停止 F.容器内气体密度不再发生变化
18.化学反应速率的定义:_______、计算公式:_______、单位:_______。
19.化学反应中伴随着能量的变化。
(1)下列变化中属于吸热反应的是_______(填字母)。
①液态水汽化 ②将胆矾加热变为白色粉末 ③苛性钠固体溶于水 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰 ⑥干冰升华
A.①② B.②④ C.③ D.①⑥
(2)断开键、键、键分别需要吸收的能量为436kJ、391 kJ、946 kJ,则生成理论上能_______(填“吸收”或“放出”)能量_______kJ。
20.已知反应4CO(g)+2NO2(g)=N2(g)+4CO2(g)在不同条件下的化学反应速率如下:
①v(CO)=1.5mol·L-1·min-1
②v(NO2)=0.7mol·L-1·min-1
③v(N2)=0.4mol·L-1·min-1
④v(CO2)=1.1mol·L-1·min-1
⑤v(NO2)=0.01 mol·L-1·s-1
则上述5种情况的反应速率由大到小的顺序为_____(用序号表示)。
21.镁、铝是重要的金属,回答下列问题:
(1)镁的原子结构示意图为_______________。
(2)MgH2是一种重要的储氢材料,其与水反应放出氢气,将反应生成的氢气与氧气设计成氢氧燃料电池(如下图)。
①写出MgH2与水反应的化学方程式:__________________。
②负极电极反应式为__________________。
③若①中反应生成20molH2,且能量转化率为80%,则导线中通过电子的物质的量为__________mol。
(3)某同学在实验室设计了如图所示的原电池:
①A池中负极为:____;B池中负极为:_______________。
②写出B池中负极电极反应式:_________________。
判断正误
22.理论上,任何自发的氧化还原反应都可设计成原电池。______
23.在原电池中,发生氧化反应的一极一定是负极。______
24.在锌铜原电池中,因为有电子通过电解质溶液形成闭合回路,所以有电流产生。______
25.在原电池中,负极材料的活泼性一定比正极材料强。______
26.在原电池中,正极本身一定不参与电极反应,负极本身一定要发生氧化反应。______
27.在锌铜原电池中,因为有电子通过电解质溶液形成闭合回路,所以有电流产生。______
28.两种活泼性不同的金属组成原电池的两极,活泼金属一定作负极。______
29.原电池工作时,溶液中的阳离子向负极移动,盐桥中的阳离子向正极移动。______
30.两种活泼性不同的金属组成原电池的两极,活泼金属一定作负极。______
31.一般来说,带有“盐桥”的原电池比不带“盐桥”的原电池效率高。______
32.对于反应3X(g)+Y(g) Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
(1)升高温度:____________;
(2)增大压强:____________;
(3)增大容器容积:______________;
(4)加入X:______________;
(5)加入Y:______________;
(6)压缩体积:______________.
33.将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试分析
(1)负极电极反应式_________________________正极电极反应式_________________________
(2)计算:①产生氢气的体积_______L(标准状况);②通过导线的电子有_____ mol
34.分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。
请回答下列问题:
(1)以下叙述中,正确的是__ 。
A.甲中锌片是负极,乙中铜片是正极 B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大 D.产生气泡的速度甲中比乙中慢
(2)乙装置中,外电路中电子移动方向 ___极流向____极(填“Zn”、“Cu”)。
(3)乙装置中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是________ 。
(4)若开始时乙装置中加入2L,lmol/LH2SO4,当电路中通过0.7mol e-,溶液中Zn2+的浓度是__mol/L。
(5)乙装置中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式: ____。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【分析】图象分析可知反应物能量低于生成物,说明反应是吸热反应。
【详解】①冰雪融化属于物理变化,故错误;
②KMnO4分解制 O2是吸热反应,故正确;
③铝与氧化铁的反应是放热反应,故错误;
④钠与水反应是放热反应,故错误;
⑤二氧化碳与灼热的木炭反应是吸热反应,故正确;
⑥碘的升华是物理变化,故错误;
⑦Ba(OH)2 8H2O 和 NH4Cl 的反应是吸热反应,故正确;
故选B。
2.B
【详解】A.该容器的体积以及氧气的变化量未知,不能计算出反应速率,故A错误;
B.向容器内充入二氧化硫,因容器体积固定,体系内压强增大,反应速率加快,故B正确;
C.二氧化硫和氧气生成速率之比始终等于系数之比,与是否达到化学反应限度无关,故C错误;
D.由于该反应为可逆反应,不可能全部反应完全,二氧化硫的物质的量少于0.4mol,故D错误;
故选B。
3.B
【详解】A.图I水果电池中,锌的活动性比铜强,锌作负极,铜作正极,电子由负极流向正极,A正确;
B.图II为酸性锌锰干电池,锌为金属,锌作负极,石墨作正极,B错误;
C.图III为铅蓄电池,铅作负极,二氧化铅作正极,是二次电池,即可充电的电池,C正确;
D.图IV为氢氧燃料电池,氢气作负极失电子,氧气作正极得电子,氧气得电子生成氧离子,氧离子在水溶液中不能稳定存在,要找氢结合,而电解质溶液呈酸性,因此正极电极反应式为:,D正确;
答案选B。
4.A
【分析】放电过程中,Zn为负极,电极反应式为: Zn -2e +4OH == Zn(OH)42 ,MnO2为正极,电极反应式为:MnO2+4H++2e == Mn2++2H2O,充电时的阴极反应式为:Zn(OH)42 +2e == Zn +4OH ,阳极反应式为: Mn2++2H2O-2e == MnO2+4H+。
【详解】A、放电时正极反应式为:MnO2+4H++2e == Mn2++2H2O,消耗氢离子,应该是硫酸根离子向锌电极迁移,故A错误;
B、MnO2为正极,电极反应式为:MnO2+4H++2e == Mn2++2H2O,故B正确;
C、充电时,由负极反应式写阴极反应式为:Zn(OH)42 +2e == Zn+4OH ,故C正确;
D、充电过程中,阴极反应式为:Zn(OH)42 +2e == Zn +4OH ,氢氧根与钾离子组成氢氧化钾,故D正确。
答案选A。
【点睛】该题考查可充电电池,一般先分析放电过程的负极反应式、正极反应式;再分析充电过程的阴极反应式和阳极反应式。
5.D
【详解】A.铅酸蓄电池属于二次电池,放电时化学能转化为电能,其充电过程是将电能转化为化学能,A正确;
B.二氧化硫和氧气的反应为可逆反应,反应物不能完全转化,64g的物质的量为,48gO2的物质的量为,由可知充分反应后生成的小于1mol,则分子数小于NA,B正确;
C.常温下浓硫酸可以是铁、铝钝化,故可以用铁制或铝制容器盛装浓硫酸,C正确;
D.除杂过程中碳酸钠要除去钙离子和过量的钡离子,故碳酸钠要在氯化钡之后,D错误;
故选D。
6.A
【详解】首先比较A、C、D项的大小,因为,即0.8 mol/(L·s)> 0.5 mol/(L·s)> 0.4 mol/(L·s),故选项A表示的速率大;然后再比较A、B项,B项中将v(A2)除以60得到v(A2)=0.1mol/(L·s),故选项A表示的速率最大;
答案选A。
7.A
【详解】一定条件下的密闭容器中,增大容器的体积对化学反应速率没有影响,即为减小压强对化学反应速率没有影响,说明该反应体系没有气体参与或生成,B、C、D反应体系均有气体参与反应或生成,而A中无气体参与或生成,故答案为A。
8.D
【详解】A.由图可知,1molI2(s)+1molH2(g)吸收5kJ热量生成2molHI(g),故A正确;
B.由图可知,1molI2(g)+1molH2(g)放出12kJ热量生成2molHI(g),则2molHI气体分解生成1mol碘蒸气与1molH2时需要吸收12kJ的能量,故B正确;
C.由图可知,1molI2(g)变为1molI2(s)放出17kJ的热量,则1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量,故C正确;
D.由图可知,1molI2(g)+1molH2(g)放出12kJ热量生成2molHI(g),应为放热反应,故D错误;
故选:D。
9.B
【详解】A.反应H2(g)+Cl2(g)=2HCl(g)的△H=E(Cl-Cl)+E(H-H)-2E(H-Cl)=(243kJ/mol+436kol)-2×432kJ/mol=-185kJ/mol,当2mol Cl2 (g)与1mol H2 (g)反应时,只有1mol Cl2 (g)参加反应,所以放出的热量为185kJ,选项A错误;
B.根据表中键能数据可得热化学方程式: 2H2(g)+S2(g)2H2S(g) △H=-229 kJ/mol,结合S2(s)=S(g) △H<0,可得热化学方程式: 2H2(g)+S2(s)2H2S(g) ΔH>-229kJ/mol,选项B正确;
C.△H=反应物的键能之和-生成物的键能之和,选项C错误;
D.由于H-Cl键的键能大于H-S键,所以HCl(g)比 H2S(g)稳定,选项D错误;
答案选B。
10.C
【分析】化学反应的实质是旧键的断裂和新键的形成,断键需要吸收能量,形成化学键需要释放能量,使用催化剂能够降低活化能,但对焓变无影响,据此分析;
【详解】A.根据反应过程,过程Ⅰ和过程Ⅱ都有H-O键的断裂,断键要吸收热量,故A错误;
B.△H只与始态和终态有关,与反应的途径无关,使用催化剂对△H无影响,故B错误;
C.催化过程中,H2O中的O-H键断裂,O-H为极性键,生成CO2,有极性键的生成,生成H2,H-H键为非极性键,故C正确;
D.过程I中有1个水分子参与反应,故D错误;
答案为C。
11.D
【详解】A.根据盖斯定律,由②-①可得I2(s)=I2(g) H=+35.96kJ·mol-1,故A错误;
B.反应①为放热反应, 1mol I2(g)和1mol H2(g)的总能量比1mol HI(g)总能量高,不能单独比较1mol I2(g)与1mol HI(g)的能量高低,故B错误;
C.反应①为可逆反应,不能彻底进行,因此1mol I2(g)中通入1mol H2(g),充分反应后放出的热量小于9.48kJ,故C错误;
D.I2(s)+H2(g)2HI(g) H=+26.48kJ·mol-1,该反应为吸热反应,其逆反应为放热反应,即为2HI(g)I2(s)+H2(g) H=-26.48kJ·mol-1,故D正确;
答案选D。
12.C
【详解】A. ω( H2SO4) <63%时增大硫酸浓度,单位体积分子数增多,活化分子百分数不变,单位体积内活化分子数增大,腐蚀速率增大,故A不选;
B. 由图可知,95℃ 时,Ni片在63%硫酸溶液中的腐蚀速率最大,故B不选;
C.ω(H2SO4) >63%时,增大硫酸浓度,单位体积分子数增多,活化分子百分数增多,而腐蚀速率减慢的原因是镍的表面形成致密的氧化物保护膜,阻止镍进一步被腐蚀,故C选;
D. 如果将镍片换成铁片,在常温下进行类似实验,铁的腐蚀速率也会在ω( H2SO4) <63%时,增大硫酸浓度,腐蚀速率加快,ω(H2SO4) >63%时,增大硫酸浓度,增大硫酸的浓度,腐蚀速率逐渐降低,铁的表面形成致密的氧化物保护膜,所以也可绘制出类似的铁质量损失图象,故D不选;
故选:C。
13.C
【详解】A.物质聚集状态不同熵值不同,气体S>液体S>固体S,1mol H2O在不同状态时的熵值:,故A正确;
B.△H>0,△S>0,能否自发进行,△H T△S<0与温度有关,故B正确;
C.反应自发只能说明△H T△S<0,不能说明和的变化相同,故C错误;
D.反应物有4mol固体、2mol液态物质、1mol气体物质,生成物只有固体,△S<0,若能自发进行,△H T△S<0,则△H必须小于0,故D正确;
故答案选C。
14.C
【详解】A.液氢燃烧时放出大量的热,产物只有水,是高能清洁燃料,A正确;
B.同位素是指质子数相同而中子数不同的同一元素的不同原子互称为同位素,则与互为同位素,B正确;
C.“祝融号”火星车使用的太阳能电池板将太阳能转化为电能,C错误;
D.复合材料指多种材料经过人工组合得到的新型材料,复合材料包含基体和增强体两部分,天问一号的太阳翼所使用材料符合复合材料定义,D正确;
故选C。
15.C
【分析】有元素化合价变化的反应为氧化还原反应;常见的吸热反应有Ba(OH)2 8H2O与NH4Cl反应、高温下C做还原剂的氧化还原反应、大多数的分解反应等。
【详解】A. 锌片与稀硫酸反应有化合价的变化属于氧化还原反应,但属于放热反应,故A错误;
B. 石灰石的分解反应不属于氧化还原反应,故B错误;
C. 碳与水蒸气反应有化合价的变化属于氧化还原反应,且属于吸热反应,故C正确;
D. 盐酸与碳酸氢钠反应属于吸热反应,不属于氧化还原反应,故D错误;
故选C。
16.(1) CH3OH-6e-+3O2-=CO2+2H2O 2.89×105C
(2) NO-3e-+2H2O=+4H+ 33.6
(3)LixC6 - xe- = xLi+ + C6
(4) O2+4e-+4H+=2H2O 13.4
【详解】(1)原电池中负极发生氧化反应,由图知,燃料电池中的燃料为甲醇,在负极上反应失去电子转化为水和二氧化碳,由题知反应离子为氧离子,因此可写出负极反应式为CH3OH-6e-+3O2-=CO2+2H2O;
16g甲醇物质的量为32g/ mol1,由负极反应式可知,1mol甲醇反应时,转移6mol电子,1个电子的电量为1.60-19C,则所求电量表达式为66.021023mol-11.60-19C =2.89×105C;
(2)由原电池的工作原理图示可知,左端的铂电极为负极,其电极反应式为NO-3e-+2H2O=+4H+,当过程中产生2molHNO3时转移6mole-,而1molO2参与反应转移4mol e- ,故需要 1.5 mol O2参与反应,标准状况下的体积为33.6 L;
(3)放电时,负极上LixC6失电子产生Li+,电极反应式为LixC6 - xe- = xLi+ + C6;
(4)甲烷燃料电池中,氧气在正极被还原,电解质为硫酸,正极反应式为O2+4e-+4H+=2H2O;
该电池的能量转换效率为86.4%,甲烷的燃烧热为- 890.3kJ/mol,1mol甲烷燃烧输出的电能约为=0.214kW·h,比能量= =13.4kW·h·kg-1。
17. 2A(g)+B(g)2C(g) C
【详解】(1)根据图象可知A、B物质的量减少,为反应物,C物质的量增大为生成物,2分钟时达到平衡,该反应为可逆反应,0~2分钟A、B、C物质的量改变量分别为2mol、1mol、2mol;所以该反应的化学方程式为:2A(g)+B(g) 2C(g);
(2)A.根据质量守恒,不论反应是否平衡,气体总质量保持不变,所以气体总质量保持不变不能判断反应达到平衡,A错误;
B.A、B、C的浓度是否相等与反应是否平衡无关,B错误;
C.A、B、C的浓度不再发生变化,说明正反应速率等于逆反应速率,说明反应达到平衡,C正确;
D.A、B、C的分子数之比与反应是否平衡无关,D错误;
E.反应平衡时正反应速率等于逆反应速率,不是0,E错误;
F.根据质量守恒定律,气体质量不变,容器的体积固定,则不论是否平衡,密度保持不变,所以容器内气体密度不再发生变化,不能判断反应达到平衡,F错误;
答案为:C。
【点睛】判断可逆反应是否平衡,心里明白是通过 “等”、“定”来判断,“等”,需同一物质的正、逆反应速率相等,“定”即各成分的浓度等保持不变。
18. 用单位时间内某反应物浓度的减少量(绝对值)或生成物浓度的增加量来表示 v=Δc/t mol·L-1·s-1 或 mol·L-1·min-1
【解析】略
19.(1)B
(2) 放出 92
【解析】(1)
①液态水汽化吸收热量,但不是化学变化,不是吸热反应;
②将胆矾加热变为白色粉末,CuSO4·5H2O失去结晶水转化为CuSO4,吸收热量,为吸热反应;
③苛性钠固体溶于水放出大量的热,不是化学变化,不是吸热反应;
④氯酸钾受热分解生成氯化钾和氧气,吸收热量,为吸热反应;
⑤生石灰跟水反应生成熟石灰,放出大量的热,为放热反应;
⑥干冰升华吸收热量,但不是化学变化,不是吸热反应;
综上分析,属于吸热反应的是②④,答案选B。
(2)
氮气和氢气反应生成氨气的化学方程式为:N2+3H22NH3,旧化学键断裂吸收能量,新化学键形成释放能量,则生成的能量变化为946 kJ+3436kJ-23391 kJ=-92kJ,即生成理论上能放出能量92kJ。
20.③①②⑤④
【详解】将②③④⑤均转化为用表示的化学反应速率,则
②;
③;
④;
⑤;
故反应速率由大到小的顺序为。
21. MgH2+2H2O=Mg(OH)2+2H2↑ H2+2OH--2e-=2H2O 32 Mg Al Al+4OH--3e-=AlO+2H2O
【详解】(1)镁的原子序数是12,其原子结构示意图为。
(2)①MgH2与水反应放出氢气,根据原子守恒可知还有氢氧化镁生成,则反应的化学方程式:MgH2+2H2O=Mg(OH)2+2H2↑。
②负极是氢气失去电子,由于是氢氧化钾最电解质,则负极电极反应式为H2+2OH--2e-=2H2O。
③若①中反应生成20molH2,且能量转化率为80%,则导线中通过电子的物质的量为20mol×2×80%=32mol。
(3)①A池中电解质是硫酸,金属性镁强于铝,则负极为Mg;B池中电解质是氢氧化钠,铝和氢氧化钠溶液反应,则负极为Al。
②B池中负极铝失去电子,转化为偏铝酸根离子,则电极反应式为:Al+4OH--3e-=AlO+2H2O。
22.正确 23.正确 24.错误 25.错误 26.错误 27.错误 28.错误 29.错误 30.错误 31.正确
【解析】22.原电池中负极上发生失电子的氧化反应,正极上发生得电子的还原反应,原电池将化学能转化为电能,故理论上任何自发的氧化还原反应都可设计成原电池,正确;
23.原电池中负极上发生氧化反应,正极上发生还原反应,故发生氧化反应的电极一定是负极,正确;
24.在锌铜原电池中,电子由负极经外电路流向正极,电子不能通过电解质溶液,在电解质溶液中通过阴、阳离子的定向移动形成闭合回路,错误;
25.原电池中,负极材料的活泼性不一定比正极材料强,如Mg、Al、NaOH溶液组成的原电池中,活泼的Mg作正极,Al为负极,错误;
26.在原电池中,正极本身不一定不参与电极反应如铅蓄电池中正极PbO2发生得电子的还原反应,负极本身不一定发生氧化反应如燃料电池中的惰性电极不参与反应,错误;
27.在锌铜原电池中,电子由负极经外电路流向正极,电子不能通过电解质溶液,在电解质溶液中通过阴、阳离子的定向移动形成闭合回路,错误;
28.两种活泼性不同的金属组成原电池的两极,活泼金属不一定作负极,如Mg、Al、NaOH溶液组成的原电池中,活泼的Mg作正极,Al为负极,错误;
29.原电池工作时,溶液中的阳离子向正极移动,盐桥中的阳离子向正极移动,错误;
30.两种活泼性不同的金属组成原电池的两极,活泼金属不一定作负极,如Mg、Al、NaOH溶液组成的原电池中,活泼的Mg作正极,Al为负极,错误;
31.一般来说,带有“盐桥”的原电池还原剂在负极区,氧化剂在正极区,可避免还原剂与氧化剂直接接触发生反应,故带有“盐桥”的原电池比不带“盐桥”的原电池效率高,正确。
32. 增大 增大 减小 增大 增大 增大
【分析】
【详解】(1)升高温度,活化分子数增大,会加快反应速率;
(2)对于反应物有气体的反应,增大压强,各物质浓度增大,会加快反应速率;
(3)增大容器的容积,相当于减小其中各物质的浓度,所以减慢反应速率;
(4)加入X,增大反应物浓度,加快反应速率;
(5)加入Y,增大反应物浓度,加快反应速率;
(6)压缩体积,会增大所有物质的浓度,加快反应速率。
33. Zn-2e-=Zn2+ 2H++2e-=H2↑ 4.48 L 0.4mol
【详解】(1)将锌片和银片浸入稀硫酸中组成原电池,锌做负极,失电子发生氧化反应,电极反应为:Zn-2e-=Zn2+,银片做正极,溶液中氢离子在银电极得到电子发生还原反应,电极反应为:2H++2e-=H2↑,故答案为:Zn-2e-=Zn2+;2H++2e-=H2↑;
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g,分析可知电极质量减小的是负极反应的锌的质量,物质的量 =0.2mol,锌做负极,失电子发生氧化反应,电极反应为:Zn-2e-=Zn2+,银片做正极,溶液中氢离子在银电极得到电子发生还原反应,电极反应为:2H++2e-=H2↑,依据电子守恒可知,转移电子物质的量为0.4mol,生成氢气物质的量为0.2mol,标准状况下体积=0.2mol×22.4L/mol=4.48L,故答案为:4.48L;0.4mol。
34. CD Zn Cu 锌片含有杂质,其表面形成原电池 0.175mol/L Cu2++2e-=Cu
【分析】锌比铜活泼,能与稀硫酸反应,铜为金属活动性顺序表H元素之后的金属,不能与稀硫酸反应,甲没有形成闭合回路,不能形成原电池,乙形成闭合回路,形成原电池,根据原电池的组成条件和工作原理解答该题.
【详解】(1)A.甲没有形成闭合回路,不能形成原电池,故A错误; B.铜为金属活动性顺序表H元素之后的金属,不能与稀硫酸反应,甲烧杯中铜片表面没有气泡产生,故B错误;C.两烧杯中硫酸都参加反应,氢离子浓度减小,溶液的pH均增大,故C正确; D.乙能形成原电池反应,较一般化学反应速率更大,所以产生气泡的速率甲中比乙中慢,故D正确;故选CD。(2)乙形成原电池,Zn为负极,Cu为正极,则电流方向Cu→Zn,乙装置中,外电路中电子移动方向Zn极流向Cu极。(3)乙装置中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是是由于锌片不纯,在锌片上形成原电池导致。(4)若开始时乙装置中加入2L,lmol/LH2SO4,当电路中通过0.7mol e-,溶液中Zn2+的浓度是n(Zn2+)/V= = 0.175mol/L。(5)乙装置中,如果把硫酸换成硫酸铜溶液,Cu2+在正极上得电子被还原产生Cu,电极反应式为Cu2++2e-=Cu。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列变化符合图示的是
①冰雪融化 ②KMnO4分解制 O2 ③铝与氧化铁的反应 ④钠与水反应⑤二氧化碳与灼热的木炭反应 ⑥碘的升华 ⑦Ba(OH)2 8H2O 和 NH4Cl 的反应
A.②⑥⑦ B.②⑤⑦ C.①②⑤⑥⑦ D.③④
2.在一固定容积的密闭容器中进行如下反应:2SO2(g)+O2(g)2SO3(g),已知反应进行到10秒时,SO2、O2、SO3的物质的量分别为0.2mol、0.1mol、0.2mol,则下列说法正确的是
A.10秒时,用O2表示该反应的平均反应速率为0.01mol/(L·s)
B.向容器内充入SO2,可以提高反应速率
C.当SO2和O2的生成速率之比为2:1时,达到该条件下化学反应限度
D.当反应达平衡时,SO2的物质的量可能为0.4mol
3.下列四个常用电化学装置的叙述错误的是
图I水果电池 图II干电池 图III铅蓄电池 图IV氢氧燃料电池
A.图 所示电池中,电子从锌片流出
B.图 所示干电池中石墨作负极
C.图 所示电池为二次电池
D.图 所示电池中正极反应为:
4.液体锌电池是一种电压较高的二次电池,具有成本低、安全性强、可循环使用等特点,其示意图如右图。下列说法不正确的是
已知:①Zn(OH)2+2OH == Zn(OH)42 。 ②KOH凝胶中允许离子存在、生成或迁移。
A.放电过程中,H+由正极向负极迁移
B.放电过程中,正极的电极反应:MnO2+4H++2e == Mn2++2H2O
C.充电过程中,阴极的电极反应:Zn(OH)42 +2e == Zn+4OH
D.充电过程中,凝胶中的KOH可再生
5.下列说法不正确的是
A.铅酸蓄电池属于二次电池,其充电过程是将电能转化为化学能
B.向密闭容器中充入64g和48gO2,充分反应后生成的的分子数小于NA
C.常温下可以用铁制或铝制容器盛装浓硫酸
D.粗盐中含有可溶性硫酸盐及、等杂质,可选用①溶液、②溶液、③溶液、④稀盐酸去除。这些试剂在使用时的正确顺序可以是③①②④
6.一定条件下,对于反应A2(g)+3B2(g) 2AB3(g)来说,下列所表示的化学反应速率中最大的是
A.v(A2)=0.8 mol/(L·s) B.v(A2)=6 mol/(L·min)
C.v(AB3)=1.0 mol/(L·s) D.v(B2)=1.2 mol/(L·s)
7.在一定条件下的密闭容器中存在下列四个化学反应,增大容器的体积对化学反应速率没有影响的是
A.Fe3+(aq) + 3SCN-(aq) Fe(SCN)3(aq)
B.CO(g) + H2O(g) CO2(g) + H2(g)
C.CO2(g) + H2O(l) H2CO3(aq)
D.2SO2(g) + O2(g) 2SO3(g)
8.关于如图的说法不正确的是
A.1mol固态碘与1molH2化合生成2molHI气体时,需要吸收5kJ的能量
B.2molHI气体分解生成1mol碘蒸气与1molH2时需要吸收12kJ的能量
C.1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量
D.碘蒸气与H2生成HI气体的反应是吸热反应
9.已知:某些化学键的键能数据如表所示:
注:键能为1mol气态分子完全离解成气态原子所吸收的能量。
化学键 H—H Cl—Cl H—Cl S=S H—S
键能/(kJ·mol-1) 436 243 431 255 339
下列说法正确的是
A.1molH2(g)与2molCl2(g)反应生成HCl(g)时放出370kJ热量
B.2H2(g)+S2(s)2H2S(g) ΔH>-229kJ/mol
C.反应的焓变△H=生成物的键能之和-反应物的键能之和
D.1molH2S(g)分解吸收的热量比1molHCl(g)分解吸收的热量多,所以H2S(g)比HCl(g)稳定
10.我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如下:
下列说法正确的是
A.过程Ⅰ、过程Ⅱ均为放热过程
B.使用催化剂降低了水煤气变换反应的ΔH
C.该催化过程中:有极性键的断裂,极性键和非极性键的形成
D.图示显示:起始时的2个H2O在反应过程中并未都参与了反应
11.碘与氢气反应的热化学方程式如下,下列说法正确的是
①I2(g)+H2(g)2HI(g) H=-9.48kJ·mol-1
②I2(s)+H2(g)2HI(g) H=+26.48kJ·mol-1
A.I2(s)=I2(g) H=+17.00kJ·mol-1
B.1mol I2(g)总能量一定比1mol HI(g)总能量高
C.1mol I2(g)中通入1mol H2(g),充分反应后放热9.48kJ
D.2HI(g)I2(s)+H2(g) H=-26.48kJ·mol-1
12.95℃时,将Ni片浸入不同质量分数的硫酸溶液中,经4小时腐蚀后的质量损失情况如图所示。
下列有关说法错误的是
A.ω( H2SO4) <63%时.增大硫酸浓度,单位体积内活化分子数增大,腐蚀速率增大
B.95℃ 时,Ni片在63%硫酸溶液中的腐蚀速率最大
C.ω(H2SO4) >63%时,增大硫酸浓度,活化分子百分数降低,腐蚀速率减慢
D.如果将镍片换成铁片,在常温下进行类似实验,也可绘制出类似的铁质量损失图象
13.下列有关化学反应方向及其判据的说法中错误的是
A.1mol在不同状态时的嫡值:
B.反应 能否自发进行与温度有关
C.分解和HClO分解均是自发过程,故这两个反应的和的变化相同
D.常温下,反应能自发进行,则该反应的
14.2020年,“嫦娥五号”着陆月球,采样返回;2021年,“天问一号”着陆巡视器在火星着陆,“祝融号”火星车在火星表面进行科学实验。下列有关说法不正确的是
A.运载火箭燃料使用的液氢是高能清洁燃料
B.“嫦娥五号”带回的月球土壤中含有,与地球上的互为同位素
C.“祝融号”火星车使用的太阳能电池板将电能转化为化学能
D.“天问一号”的太阳翼使用石墨纤维作增强体,金属为基体的复合材料
15.下列反应既是氧化还原反应,又是吸热反应的是
A.锌片与稀硫酸反应 B.石灰石的分解反应
C.碳与水蒸气反应 D.盐酸与碳酸氢钠反应
二、填空题
16.回答下列问题:
(1)新型固体燃料电池的电解质是固体氧化锆和氧化钇,高温下允许氧离子(O2-)在其间通过。如图所示,其中多孔电极不参与电极反应。写出该反应的负极电极反应式:___________,当有16 g甲醇发生反应时,则理论上提供的电量表达式为___________ (1个电子的电量为1.6×10-19C)。
(2)一氧化氮—空气质子交换膜燃料电池将化学能转化为电能的同时,实现了制硝酸、发电、环保三位一体的结合,其工作原理如图所示,写出放电过程中负极的电极反应式:___________,若过程中产生2 mol HNO3,则消耗标准状况下O2的体积为___________L。
(3)某电动汽车配载一种可充放电的锂离子电池,放电时电池总反应为Li1-xCoO2+LixC6=LiCoO2+C6(x<1)。负极电极反应式:___________。
(4)以CH4(g)为燃料可以设计甲烷燃料电池,该电池以稀H2SO4作电解质溶液,写出该电池正极电极反应式:___________,已知该电池的能量转换效率为86.4%,1mol甲烷燃烧释放的热量为890.3 kJ,则该电池的比能量为___________kW·h·kg-1[结果保留1位小数,比能量= ,1 kW·h=3. 6×106 J]。
17.某可逆反应在某体积为5L的密闭容器中进行,在从0~3分钟各物质的量的变化情况如图所示(A、B、C均为气体)
(1)该反应的化学方程式为__________________。
(2)在一定温度下,体积不变的密闭容器中,上述反应达到平衡的标志是___________(填字母)。
A.气体总质量保持不变 B.A、B、C的浓度都相等
C.A、B、C的浓度不再发生变化 D.A、B、C的分子数之比为2:1:2
E.正反应和逆反应都已停止 F.容器内气体密度不再发生变化
18.化学反应速率的定义:_______、计算公式:_______、单位:_______。
19.化学反应中伴随着能量的变化。
(1)下列变化中属于吸热反应的是_______(填字母)。
①液态水汽化 ②将胆矾加热变为白色粉末 ③苛性钠固体溶于水 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰 ⑥干冰升华
A.①② B.②④ C.③ D.①⑥
(2)断开键、键、键分别需要吸收的能量为436kJ、391 kJ、946 kJ,则生成理论上能_______(填“吸收”或“放出”)能量_______kJ。
20.已知反应4CO(g)+2NO2(g)=N2(g)+4CO2(g)在不同条件下的化学反应速率如下:
①v(CO)=1.5mol·L-1·min-1
②v(NO2)=0.7mol·L-1·min-1
③v(N2)=0.4mol·L-1·min-1
④v(CO2)=1.1mol·L-1·min-1
⑤v(NO2)=0.01 mol·L-1·s-1
则上述5种情况的反应速率由大到小的顺序为_____(用序号表示)。
21.镁、铝是重要的金属,回答下列问题:
(1)镁的原子结构示意图为_______________。
(2)MgH2是一种重要的储氢材料,其与水反应放出氢气,将反应生成的氢气与氧气设计成氢氧燃料电池(如下图)。
①写出MgH2与水反应的化学方程式:__________________。
②负极电极反应式为__________________。
③若①中反应生成20molH2,且能量转化率为80%,则导线中通过电子的物质的量为__________mol。
(3)某同学在实验室设计了如图所示的原电池:
①A池中负极为:____;B池中负极为:_______________。
②写出B池中负极电极反应式:_________________。
判断正误
22.理论上,任何自发的氧化还原反应都可设计成原电池。______
23.在原电池中,发生氧化反应的一极一定是负极。______
24.在锌铜原电池中,因为有电子通过电解质溶液形成闭合回路,所以有电流产生。______
25.在原电池中,负极材料的活泼性一定比正极材料强。______
26.在原电池中,正极本身一定不参与电极反应,负极本身一定要发生氧化反应。______
27.在锌铜原电池中,因为有电子通过电解质溶液形成闭合回路,所以有电流产生。______
28.两种活泼性不同的金属组成原电池的两极,活泼金属一定作负极。______
29.原电池工作时,溶液中的阳离子向负极移动,盐桥中的阳离子向正极移动。______
30.两种活泼性不同的金属组成原电池的两极,活泼金属一定作负极。______
31.一般来说,带有“盐桥”的原电池比不带“盐桥”的原电池效率高。______
32.对于反应3X(g)+Y(g) Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
(1)升高温度:____________;
(2)增大压强:____________;
(3)增大容器容积:______________;
(4)加入X:______________;
(5)加入Y:______________;
(6)压缩体积:______________.
33.将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试分析
(1)负极电极反应式_________________________正极电极反应式_________________________
(2)计算:①产生氢气的体积_______L(标准状况);②通过导线的电子有_____ mol
34.分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。
请回答下列问题:
(1)以下叙述中,正确的是__ 。
A.甲中锌片是负极,乙中铜片是正极 B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大 D.产生气泡的速度甲中比乙中慢
(2)乙装置中,外电路中电子移动方向 ___极流向____极(填“Zn”、“Cu”)。
(3)乙装置中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是________ 。
(4)若开始时乙装置中加入2L,lmol/LH2SO4,当电路中通过0.7mol e-,溶液中Zn2+的浓度是__mol/L。
(5)乙装置中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式: ____。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【分析】图象分析可知反应物能量低于生成物,说明反应是吸热反应。
【详解】①冰雪融化属于物理变化,故错误;
②KMnO4分解制 O2是吸热反应,故正确;
③铝与氧化铁的反应是放热反应,故错误;
④钠与水反应是放热反应,故错误;
⑤二氧化碳与灼热的木炭反应是吸热反应,故正确;
⑥碘的升华是物理变化,故错误;
⑦Ba(OH)2 8H2O 和 NH4Cl 的反应是吸热反应,故正确;
故选B。
2.B
【详解】A.该容器的体积以及氧气的变化量未知,不能计算出反应速率,故A错误;
B.向容器内充入二氧化硫,因容器体积固定,体系内压强增大,反应速率加快,故B正确;
C.二氧化硫和氧气生成速率之比始终等于系数之比,与是否达到化学反应限度无关,故C错误;
D.由于该反应为可逆反应,不可能全部反应完全,二氧化硫的物质的量少于0.4mol,故D错误;
故选B。
3.B
【详解】A.图I水果电池中,锌的活动性比铜强,锌作负极,铜作正极,电子由负极流向正极,A正确;
B.图II为酸性锌锰干电池,锌为金属,锌作负极,石墨作正极,B错误;
C.图III为铅蓄电池,铅作负极,二氧化铅作正极,是二次电池,即可充电的电池,C正确;
D.图IV为氢氧燃料电池,氢气作负极失电子,氧气作正极得电子,氧气得电子生成氧离子,氧离子在水溶液中不能稳定存在,要找氢结合,而电解质溶液呈酸性,因此正极电极反应式为:,D正确;
答案选B。
4.A
【分析】放电过程中,Zn为负极,电极反应式为: Zn -2e +4OH == Zn(OH)42 ,MnO2为正极,电极反应式为:MnO2+4H++2e == Mn2++2H2O,充电时的阴极反应式为:Zn(OH)42 +2e == Zn +4OH ,阳极反应式为: Mn2++2H2O-2e == MnO2+4H+。
【详解】A、放电时正极反应式为:MnO2+4H++2e == Mn2++2H2O,消耗氢离子,应该是硫酸根离子向锌电极迁移,故A错误;
B、MnO2为正极,电极反应式为:MnO2+4H++2e == Mn2++2H2O,故B正确;
C、充电时,由负极反应式写阴极反应式为:Zn(OH)42 +2e == Zn+4OH ,故C正确;
D、充电过程中,阴极反应式为:Zn(OH)42 +2e == Zn +4OH ,氢氧根与钾离子组成氢氧化钾,故D正确。
答案选A。
【点睛】该题考查可充电电池,一般先分析放电过程的负极反应式、正极反应式;再分析充电过程的阴极反应式和阳极反应式。
5.D
【详解】A.铅酸蓄电池属于二次电池,放电时化学能转化为电能,其充电过程是将电能转化为化学能,A正确;
B.二氧化硫和氧气的反应为可逆反应,反应物不能完全转化,64g的物质的量为,48gO2的物质的量为,由可知充分反应后生成的小于1mol,则分子数小于NA,B正确;
C.常温下浓硫酸可以是铁、铝钝化,故可以用铁制或铝制容器盛装浓硫酸,C正确;
D.除杂过程中碳酸钠要除去钙离子和过量的钡离子,故碳酸钠要在氯化钡之后,D错误;
故选D。
6.A
【详解】首先比较A、C、D项的大小,因为,即0.8 mol/(L·s)> 0.5 mol/(L·s)> 0.4 mol/(L·s),故选项A表示的速率大;然后再比较A、B项,B项中将v(A2)除以60得到v(A2)=0.1mol/(L·s),故选项A表示的速率最大;
答案选A。
7.A
【详解】一定条件下的密闭容器中,增大容器的体积对化学反应速率没有影响,即为减小压强对化学反应速率没有影响,说明该反应体系没有气体参与或生成,B、C、D反应体系均有气体参与反应或生成,而A中无气体参与或生成,故答案为A。
8.D
【详解】A.由图可知,1molI2(s)+1molH2(g)吸收5kJ热量生成2molHI(g),故A正确;
B.由图可知,1molI2(g)+1molH2(g)放出12kJ热量生成2molHI(g),则2molHI气体分解生成1mol碘蒸气与1molH2时需要吸收12kJ的能量,故B正确;
C.由图可知,1molI2(g)变为1molI2(s)放出17kJ的热量,则1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量,故C正确;
D.由图可知,1molI2(g)+1molH2(g)放出12kJ热量生成2molHI(g),应为放热反应,故D错误;
故选:D。
9.B
【详解】A.反应H2(g)+Cl2(g)=2HCl(g)的△H=E(Cl-Cl)+E(H-H)-2E(H-Cl)=(243kJ/mol+436kol)-2×432kJ/mol=-185kJ/mol,当2mol Cl2 (g)与1mol H2 (g)反应时,只有1mol Cl2 (g)参加反应,所以放出的热量为185kJ,选项A错误;
B.根据表中键能数据可得热化学方程式: 2H2(g)+S2(g)2H2S(g) △H=-229 kJ/mol,结合S2(s)=S(g) △H<0,可得热化学方程式: 2H2(g)+S2(s)2H2S(g) ΔH>-229kJ/mol,选项B正确;
C.△H=反应物的键能之和-生成物的键能之和,选项C错误;
D.由于H-Cl键的键能大于H-S键,所以HCl(g)比 H2S(g)稳定,选项D错误;
答案选B。
10.C
【分析】化学反应的实质是旧键的断裂和新键的形成,断键需要吸收能量,形成化学键需要释放能量,使用催化剂能够降低活化能,但对焓变无影响,据此分析;
【详解】A.根据反应过程,过程Ⅰ和过程Ⅱ都有H-O键的断裂,断键要吸收热量,故A错误;
B.△H只与始态和终态有关,与反应的途径无关,使用催化剂对△H无影响,故B错误;
C.催化过程中,H2O中的O-H键断裂,O-H为极性键,生成CO2,有极性键的生成,生成H2,H-H键为非极性键,故C正确;
D.过程I中有1个水分子参与反应,故D错误;
答案为C。
11.D
【详解】A.根据盖斯定律,由②-①可得I2(s)=I2(g) H=+35.96kJ·mol-1,故A错误;
B.反应①为放热反应, 1mol I2(g)和1mol H2(g)的总能量比1mol HI(g)总能量高,不能单独比较1mol I2(g)与1mol HI(g)的能量高低,故B错误;
C.反应①为可逆反应,不能彻底进行,因此1mol I2(g)中通入1mol H2(g),充分反应后放出的热量小于9.48kJ,故C错误;
D.I2(s)+H2(g)2HI(g) H=+26.48kJ·mol-1,该反应为吸热反应,其逆反应为放热反应,即为2HI(g)I2(s)+H2(g) H=-26.48kJ·mol-1,故D正确;
答案选D。
12.C
【详解】A. ω( H2SO4) <63%时增大硫酸浓度,单位体积分子数增多,活化分子百分数不变,单位体积内活化分子数增大,腐蚀速率增大,故A不选;
B. 由图可知,95℃ 时,Ni片在63%硫酸溶液中的腐蚀速率最大,故B不选;
C.ω(H2SO4) >63%时,增大硫酸浓度,单位体积分子数增多,活化分子百分数增多,而腐蚀速率减慢的原因是镍的表面形成致密的氧化物保护膜,阻止镍进一步被腐蚀,故C选;
D. 如果将镍片换成铁片,在常温下进行类似实验,铁的腐蚀速率也会在ω( H2SO4) <63%时,增大硫酸浓度,腐蚀速率加快,ω(H2SO4) >63%时,增大硫酸浓度,增大硫酸的浓度,腐蚀速率逐渐降低,铁的表面形成致密的氧化物保护膜,所以也可绘制出类似的铁质量损失图象,故D不选;
故选:C。
13.C
【详解】A.物质聚集状态不同熵值不同,气体S>液体S>固体S,1mol H2O在不同状态时的熵值:,故A正确;
B.△H>0,△S>0,能否自发进行,△H T△S<0与温度有关,故B正确;
C.反应自发只能说明△H T△S<0,不能说明和的变化相同,故C错误;
D.反应物有4mol固体、2mol液态物质、1mol气体物质,生成物只有固体,△S<0,若能自发进行,△H T△S<0,则△H必须小于0,故D正确;
故答案选C。
14.C
【详解】A.液氢燃烧时放出大量的热,产物只有水,是高能清洁燃料,A正确;
B.同位素是指质子数相同而中子数不同的同一元素的不同原子互称为同位素,则与互为同位素,B正确;
C.“祝融号”火星车使用的太阳能电池板将太阳能转化为电能,C错误;
D.复合材料指多种材料经过人工组合得到的新型材料,复合材料包含基体和增强体两部分,天问一号的太阳翼所使用材料符合复合材料定义,D正确;
故选C。
15.C
【分析】有元素化合价变化的反应为氧化还原反应;常见的吸热反应有Ba(OH)2 8H2O与NH4Cl反应、高温下C做还原剂的氧化还原反应、大多数的分解反应等。
【详解】A. 锌片与稀硫酸反应有化合价的变化属于氧化还原反应,但属于放热反应,故A错误;
B. 石灰石的分解反应不属于氧化还原反应,故B错误;
C. 碳与水蒸气反应有化合价的变化属于氧化还原反应,且属于吸热反应,故C正确;
D. 盐酸与碳酸氢钠反应属于吸热反应,不属于氧化还原反应,故D错误;
故选C。
16.(1) CH3OH-6e-+3O2-=CO2+2H2O 2.89×105C
(2) NO-3e-+2H2O=+4H+ 33.6
(3)LixC6 - xe- = xLi+ + C6
(4) O2+4e-+4H+=2H2O 13.4
【详解】(1)原电池中负极发生氧化反应,由图知,燃料电池中的燃料为甲醇,在负极上反应失去电子转化为水和二氧化碳,由题知反应离子为氧离子,因此可写出负极反应式为CH3OH-6e-+3O2-=CO2+2H2O;
16g甲醇物质的量为32g/ mol1,由负极反应式可知,1mol甲醇反应时,转移6mol电子,1个电子的电量为1.60-19C,则所求电量表达式为66.021023mol-11.60-19C =2.89×105C;
(2)由原电池的工作原理图示可知,左端的铂电极为负极,其电极反应式为NO-3e-+2H2O=+4H+,当过程中产生2molHNO3时转移6mole-,而1molO2参与反应转移4mol e- ,故需要 1.5 mol O2参与反应,标准状况下的体积为33.6 L;
(3)放电时,负极上LixC6失电子产生Li+,电极反应式为LixC6 - xe- = xLi+ + C6;
(4)甲烷燃料电池中,氧气在正极被还原,电解质为硫酸,正极反应式为O2+4e-+4H+=2H2O;
该电池的能量转换效率为86.4%,甲烷的燃烧热为- 890.3kJ/mol,1mol甲烷燃烧输出的电能约为=0.214kW·h,比能量= =13.4kW·h·kg-1。
17. 2A(g)+B(g)2C(g) C
【详解】(1)根据图象可知A、B物质的量减少,为反应物,C物质的量增大为生成物,2分钟时达到平衡,该反应为可逆反应,0~2分钟A、B、C物质的量改变量分别为2mol、1mol、2mol;所以该反应的化学方程式为:2A(g)+B(g) 2C(g);
(2)A.根据质量守恒,不论反应是否平衡,气体总质量保持不变,所以气体总质量保持不变不能判断反应达到平衡,A错误;
B.A、B、C的浓度是否相等与反应是否平衡无关,B错误;
C.A、B、C的浓度不再发生变化,说明正反应速率等于逆反应速率,说明反应达到平衡,C正确;
D.A、B、C的分子数之比与反应是否平衡无关,D错误;
E.反应平衡时正反应速率等于逆反应速率,不是0,E错误;
F.根据质量守恒定律,气体质量不变,容器的体积固定,则不论是否平衡,密度保持不变,所以容器内气体密度不再发生变化,不能判断反应达到平衡,F错误;
答案为:C。
【点睛】判断可逆反应是否平衡,心里明白是通过 “等”、“定”来判断,“等”,需同一物质的正、逆反应速率相等,“定”即各成分的浓度等保持不变。
18. 用单位时间内某反应物浓度的减少量(绝对值)或生成物浓度的增加量来表示 v=Δc/t mol·L-1·s-1 或 mol·L-1·min-1
【解析】略
19.(1)B
(2) 放出 92
【解析】(1)
①液态水汽化吸收热量,但不是化学变化,不是吸热反应;
②将胆矾加热变为白色粉末,CuSO4·5H2O失去结晶水转化为CuSO4,吸收热量,为吸热反应;
③苛性钠固体溶于水放出大量的热,不是化学变化,不是吸热反应;
④氯酸钾受热分解生成氯化钾和氧气,吸收热量,为吸热反应;
⑤生石灰跟水反应生成熟石灰,放出大量的热,为放热反应;
⑥干冰升华吸收热量,但不是化学变化,不是吸热反应;
综上分析,属于吸热反应的是②④,答案选B。
(2)
氮气和氢气反应生成氨气的化学方程式为:N2+3H22NH3,旧化学键断裂吸收能量,新化学键形成释放能量,则生成的能量变化为946 kJ+3436kJ-23391 kJ=-92kJ,即生成理论上能放出能量92kJ。
20.③①②⑤④
【详解】将②③④⑤均转化为用表示的化学反应速率,则
②;
③;
④;
⑤;
故反应速率由大到小的顺序为。
21. MgH2+2H2O=Mg(OH)2+2H2↑ H2+2OH--2e-=2H2O 32 Mg Al Al+4OH--3e-=AlO+2H2O
【详解】(1)镁的原子序数是12,其原子结构示意图为。
(2)①MgH2与水反应放出氢气,根据原子守恒可知还有氢氧化镁生成,则反应的化学方程式:MgH2+2H2O=Mg(OH)2+2H2↑。
②负极是氢气失去电子,由于是氢氧化钾最电解质,则负极电极反应式为H2+2OH--2e-=2H2O。
③若①中反应生成20molH2,且能量转化率为80%,则导线中通过电子的物质的量为20mol×2×80%=32mol。
(3)①A池中电解质是硫酸,金属性镁强于铝,则负极为Mg;B池中电解质是氢氧化钠,铝和氢氧化钠溶液反应,则负极为Al。
②B池中负极铝失去电子,转化为偏铝酸根离子,则电极反应式为:Al+4OH--3e-=AlO+2H2O。
22.正确 23.正确 24.错误 25.错误 26.错误 27.错误 28.错误 29.错误 30.错误 31.正确
【解析】22.原电池中负极上发生失电子的氧化反应,正极上发生得电子的还原反应,原电池将化学能转化为电能,故理论上任何自发的氧化还原反应都可设计成原电池,正确;
23.原电池中负极上发生氧化反应,正极上发生还原反应,故发生氧化反应的电极一定是负极,正确;
24.在锌铜原电池中,电子由负极经外电路流向正极,电子不能通过电解质溶液,在电解质溶液中通过阴、阳离子的定向移动形成闭合回路,错误;
25.原电池中,负极材料的活泼性不一定比正极材料强,如Mg、Al、NaOH溶液组成的原电池中,活泼的Mg作正极,Al为负极,错误;
26.在原电池中,正极本身不一定不参与电极反应如铅蓄电池中正极PbO2发生得电子的还原反应,负极本身不一定发生氧化反应如燃料电池中的惰性电极不参与反应,错误;
27.在锌铜原电池中,电子由负极经外电路流向正极,电子不能通过电解质溶液,在电解质溶液中通过阴、阳离子的定向移动形成闭合回路,错误;
28.两种活泼性不同的金属组成原电池的两极,活泼金属不一定作负极,如Mg、Al、NaOH溶液组成的原电池中,活泼的Mg作正极,Al为负极,错误;
29.原电池工作时,溶液中的阳离子向正极移动,盐桥中的阳离子向正极移动,错误;
30.两种活泼性不同的金属组成原电池的两极,活泼金属不一定作负极,如Mg、Al、NaOH溶液组成的原电池中,活泼的Mg作正极,Al为负极,错误;
31.一般来说,带有“盐桥”的原电池还原剂在负极区,氧化剂在正极区,可避免还原剂与氧化剂直接接触发生反应,故带有“盐桥”的原电池比不带“盐桥”的原电池效率高,正确。
32. 增大 增大 减小 增大 增大 增大
【分析】
【详解】(1)升高温度,活化分子数增大,会加快反应速率;
(2)对于反应物有气体的反应,增大压强,各物质浓度增大,会加快反应速率;
(3)增大容器的容积,相当于减小其中各物质的浓度,所以减慢反应速率;
(4)加入X,增大反应物浓度,加快反应速率;
(5)加入Y,增大反应物浓度,加快反应速率;
(6)压缩体积,会增大所有物质的浓度,加快反应速率。
33. Zn-2e-=Zn2+ 2H++2e-=H2↑ 4.48 L 0.4mol
【详解】(1)将锌片和银片浸入稀硫酸中组成原电池,锌做负极,失电子发生氧化反应,电极反应为:Zn-2e-=Zn2+,银片做正极,溶液中氢离子在银电极得到电子发生还原反应,电极反应为:2H++2e-=H2↑,故答案为:Zn-2e-=Zn2+;2H++2e-=H2↑;
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g,分析可知电极质量减小的是负极反应的锌的质量,物质的量 =0.2mol,锌做负极,失电子发生氧化反应,电极反应为:Zn-2e-=Zn2+,银片做正极,溶液中氢离子在银电极得到电子发生还原反应,电极反应为:2H++2e-=H2↑,依据电子守恒可知,转移电子物质的量为0.4mol,生成氢气物质的量为0.2mol,标准状况下体积=0.2mol×22.4L/mol=4.48L,故答案为:4.48L;0.4mol。
34. CD Zn Cu 锌片含有杂质,其表面形成原电池 0.175mol/L Cu2++2e-=Cu
【分析】锌比铜活泼,能与稀硫酸反应,铜为金属活动性顺序表H元素之后的金属,不能与稀硫酸反应,甲没有形成闭合回路,不能形成原电池,乙形成闭合回路,形成原电池,根据原电池的组成条件和工作原理解答该题.
【详解】(1)A.甲没有形成闭合回路,不能形成原电池,故A错误; B.铜为金属活动性顺序表H元素之后的金属,不能与稀硫酸反应,甲烧杯中铜片表面没有气泡产生,故B错误;C.两烧杯中硫酸都参加反应,氢离子浓度减小,溶液的pH均增大,故C正确; D.乙能形成原电池反应,较一般化学反应速率更大,所以产生气泡的速率甲中比乙中慢,故D正确;故选CD。(2)乙形成原电池,Zn为负极,Cu为正极,则电流方向Cu→Zn,乙装置中,外电路中电子移动方向Zn极流向Cu极。(3)乙装置中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是是由于锌片不纯,在锌片上形成原电池导致。(4)若开始时乙装置中加入2L,lmol/LH2SO4,当电路中通过0.7mol e-,溶液中Zn2+的浓度是n(Zn2+)/V= = 0.175mol/L。(5)乙装置中,如果把硫酸换成硫酸铜溶液,Cu2+在正极上得电子被还原产生Cu,电极反应式为Cu2++2e-=Cu。
答案第1页,共2页
答案第1页,共2页
