1.1物质及其反应分类课时练习(含解析)高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 1.1物质及其反应分类课时练习(含解析)高一上学期化学苏教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 330.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-28 19:17:09 | ||
图片预览




文档简介
1.1物质及其反应分类 课时练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列反应方程式中正确的是
A.
B.
C.
D.
2.根据某种共性,将CO2、P2O5、SiO2归为一类,下列物质中符合此共性而被归为一类的是
A.SO2 B.CaO C.H2O D.CO
3.对下列化学物质进行分类,正确的是
A.海水、冰水混合物为混合物 B.盐酸、醋酸均为强酸
C.烧碱、纯碱均为碱 D.SO3、CO2均为酸性氧化物
4.下列物质属于钠盐的是
A.Na2SO4 B.Na2O C.MgSO4 D.BaCl2
5.下列叙述正确的是
A.金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物
B.酸性氧化物和水都能反应生成酸,碱性氧化物和水都能反应生成碱
C.由同种元素组成的物质均为纯净物
D.同素异形体彼此间物理性质是有差异的
6.按照不同的分类标准,H2SO4应属于
①酸 ②硫酸盐 ③含氧酸 ④混合物 ⑤化合物 ⑥二元酸
A.①②③④ B.①③⑤⑥ C.①②③⑤ D.②③⑤⑥
7.已知:的酸酐为。向次磷酸(分子式为)溶液中加入足量的NaOH溶液,充分反应后,生成和水,则可看成次磷酸酸酐的是
A. B. C. D.
8.下列各组物质,按化合物、单质、混合物顺序排列的是
A.烧碱,液态氧、碘酒 B.生石灰、白磷、熟石灰
C.干冰、铁、过氧化氢 D.空气、氮气、胆矾
9.下列物质属于碱的是
A. B. C. D.
10.下列应用中发生的不是化学变化的是
A.漂粉精等用于游泳池的消毒 B.氘、氚用作“人造太阳”核聚变燃料
C.偏二甲肼用作发射火箭燃料 D.过年放烟花
二、多选题
11.下列说法正确的是
A.含有氧元素的化合物一定是氧化物
B.所有的氧化物都能溶于水
C.水溶液中能电离出H+的化合物不一定是酸
D.盐酸属于无氧酸,H2SO4属于含氧酸
12.下列列物质种类、名称(或俗名)及化学式完全相符的是
A.碱性氧化物 氧化铁 Fe2O3
B.酸性氧化物 干冰 CO2
C.酸 硫酸 H2S
D.碱 纯碱 Na2CO3
13.下列有关物质分类的叙述正确的是
A.硫酸、烧碱、硝酸钠和生石灰分别属于酸、碱、盐和碱性氧化物
B.CaCl2、NaOH、HCl、O2四种物质都属于化合物
C.溶液、浊液、胶体都属于混合物
D.CO2、CO等非金属氧化物均属于酸性氧化物
14.已知在太阳光作用下,植物体内的叶绿素能将水、CO2转化为葡萄糖。如图为海水吸收CO2并进行碳循环的原理示意图:
下列说法正确的是
A.该碳循环是无机物之间的循环
B.该碳循环中涉及1种氧化物
C.该碳循环中涉及4种盐
D.该碳循环中涉及反应Na2CO3+CaCl2=2NaCl+CaCO3↓
15.某化学兴趣小组欲研究H2SO4、NaCl、KCl、Na2CO3、FeCl3、NaOH的性质,对于如何研究,他们设计了两种实验方案。
方案①:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验;
方案②:将它们按照钠盐、钾盐、铁盐和其他化合物分类,然后分别溶于水得到溶液,进行实验。
下列说法不正确的是
A.常温时,将少量铜粉分别投入上述溶液中,按照方案①的分类,能够完全溶解铜粉的是稀硫酸溶液
B.取某种溶液,向其中加入上述方案②中的钾盐溶液,有白色沉淀产生,再加入稀硝酸,沉淀不消失,则该溶液中含有Ag+
C.按照方案①的分类,属于碱的有NaOH
D.按照方案②的分类,属于钠盐的有NaCl、Na2CO3、NaOH
三、有机推断题
16.乙烯是一种重要的化工原料,其相关物质间的转化如下。
(1)CH2=CH2→B的反应类型是_______。
(2)C→D的化学方程式是_______。
(3)D中含有的官能团的名称是_______。
(4)C和E生成C4H8O2的化学方程式是_______。
(5)CH2=CH2在一定条件下发生聚合反应生成A,化学方程式是_______。
四、工业流程题
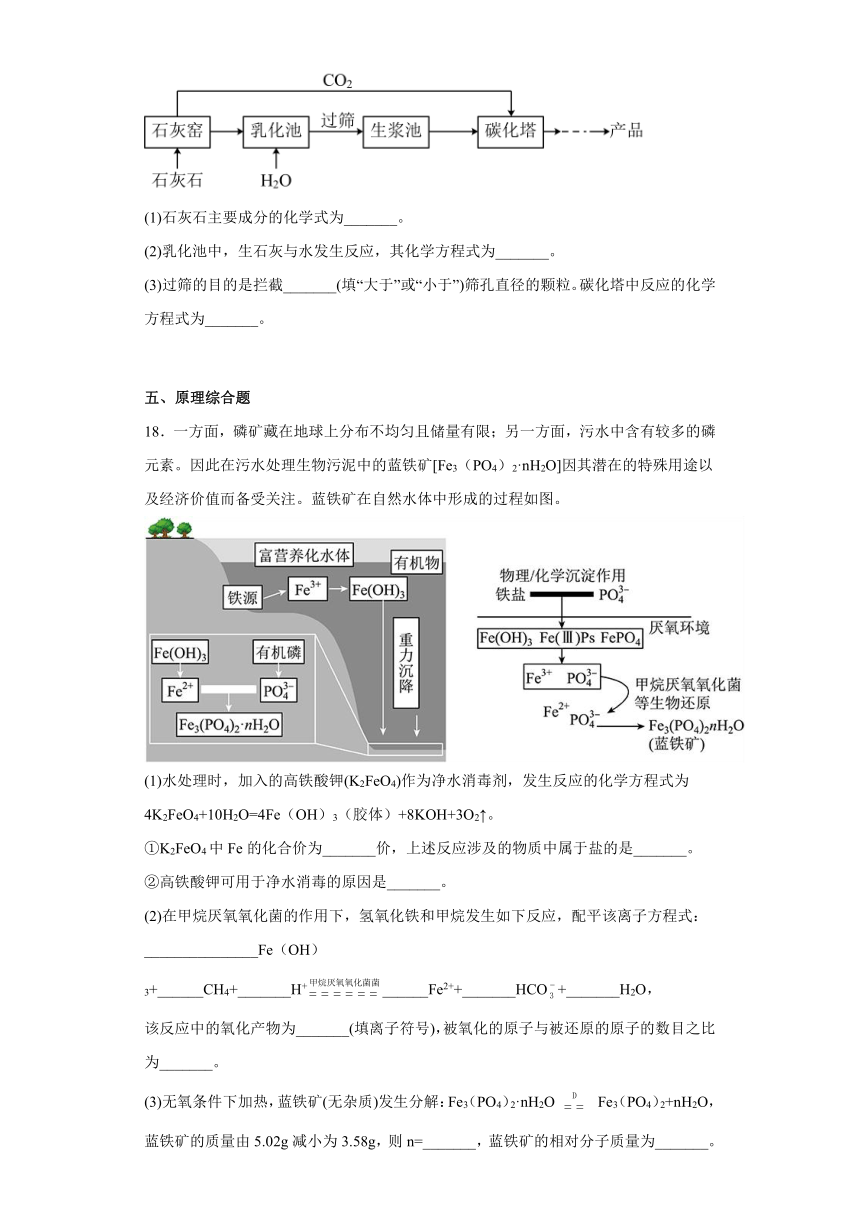
17.超细碳酸钙可用于生产钙片、牙膏等产品。利用碳化法生产超细碳酸钙的主要流程示意如下:
(1)石灰石主要成分的化学式为_______。
(2)乳化池中,生石灰与水发生反应,其化学方程式为_______。
(3)过筛的目的是拦截_______(填“大于”或“小于”)筛孔直径的颗粒。碳化塔中反应的化学方程式为_______。
五、原理综合题
18.一方面,磷矿藏在地球上分布不均匀且储量有限;另一方面,污水中含有较多的磷元素。因此在污水处理生物污泥中的蓝铁矿[Fe3(PO4)2·nH2O]因其潜在的特殊用途以及经济价值而备受关注。蓝铁矿在自然水体中形成的过程如图。
(1)水处理时,加入的高铁酸钾(K2FeO4)作为净水消毒剂,发生反应的化学方程式为4K2FeO4+10H2O=4Fe(OH)3(胶体)+8KOH+3O2↑。
①K2FeO4中Fe的化合价为_______价,上述反应涉及的物质中属于盐的是_______。
②高铁酸钾可用于净水消毒的原因是_______。
(2)在甲烷厌氧氧化菌的作用下,氢氧化铁和甲烷发生如下反应,配平该离子方程式:_______________Fe(OH)3+______CH4+_______H+______Fe2++_______HCO+_______H2O,
该反应中的氧化产物为_______(填离子符号),被氧化的原子与被还原的原子的数目之比为_______。
(3)无氧条件下加热,蓝铁矿(无杂质)发生分解:Fe3(PO4)2·nH2O Fe3(PO4)2+nH2O,蓝铁矿的质量由5.02g减小为3.58g,则n=_______,蓝铁矿的相对分子质量为_______。
19.下表是某城市场上销售的一种“加碘盐”包装上的部分文字说明。
配料表 精制海盐、碘酸钾(KIO3)
含碘量 20~40 mg·kg-1
储藏方法 密封、避光、防潮
食用方法 烹调时待食品熟后加入碘盐
回答下列问题:
(1)结合物质分类中的树状分类法的有关知识,根据物质的组成对物质进行分类。在下列五种____(填“混合物”“化合物”“盐”或“氧化物”)中与碘酸钾(KIO3)属于同类物质的是____(填序号)。
①HIO3 ②NaIO3 ③KOH ④I2O5 ⑤NaCl
(2)推测碘酸钾(KIO3)的物理性质:碘酸钾(KIO3)____(填“能”或“不能”)溶于水;
化学性质:碘酸钾(KIO3)在受热时____(填“易分解”或“不易分解”)。
(3)碘酸钾是一种电解质,写出其在水溶液中的电离方程式:____________。
六、结构与性质
20.根据要求,回答下列问题:
Ⅰ. 从铁、盐酸、氧气、过氧化氢、硝酸银溶液五种物质中选出一种或两种为反应物,按下列反应类型各写出一个化学方程式。
(1)化合反应:_______。
(2)分解反应:_______。
(3)置换反应:_______。
(4)复分解反应:_______。
Ⅱ. 按下列要求各写出一个化学方程式。
(5)有水生成的化合反应:_______。
(6)生成一种碱性氧化物和一种酸性氧化物的分解反应:_______。
(7)有硝酸银参加反应生成硝酸铜的置换反应:_______。
(8)生成两种沉淀的复分解反应:_______。
参考答案:
1.D
【详解】A.铁丝在纯氧里燃烧,生成四氧化三铁:,A错误;
B.铁和盐酸反应生成氯化亚铁和氢气:,B错误;
C.铁和硫酸铜发生反应,生成硫酸亚铁和铜:,C错误;
D.铁和稀硫酸反应,生成硫酸亚铁和氢气:,D正确;
答案选D。
2.A
【分析】CO2、P2O5、SiO2既是非金属氧化物,也是酸性氧化物。
【详解】A.SO2既是非金属氧化物,也是酸性氧化物,故A符合题意;
B.CaO为金属氧化物,碱性氧化物,故B不符合题意;
C.H2O是非金属氧化物,但不属于酸性氧化物,故C不符合题意;
D.CO是非金属氧化物,既不能与酸反应,不能与碱反应,不是酸性氧化物,故D不符合题意;
答案选A。
3.D
【详解】A.冰水混合物的成分为水,是纯净物、是氧化物,A错误;
B. 盐酸为强酸、醋酸为弱酸,B错误;
C. 烧碱为碱,纯碱是碳酸钠的俗称、属于盐,C错误;
D. SO3、CO2均能与酸反应生成盐和水、均属于酸性氧化物,D正确;
答案选D。
4.A
【解析】由钠离子和酸根离子组成的盐是钠盐,据此解答。
【详解】A. Na2SO4属于钠盐,A正确;
B. Na2O属于碱性氧化物,不是盐,B错误;
C. MgSO4不含钠,属于镁盐,C错误;
D. BaCl2不含钠,属于钡盐,D错误;
答案选A。
5.D
【详解】A.金属氧化物不一定是碱性氧化物,非金属氧化物也一定是酸性氧化物,如Al2O3是金属氧化物,但属于两性氧化物;CO是非金属氧化物,但属于不成盐氧化物,A错误;
B.SiO2是酸性氧化物,但不能与水反应产生相应的酸,故酸性氧化物不一定都可以和水反应生成酸;Fe2O3是碱性氧化物,但不能与水反应产生相应的碱Fe(OH)3,故碱性氧化物不一定能和水反应生成碱,B错误;
C.由同种元素组成的物质可能为纯净物,也可能为混合物,如氧气中仅存在O2一种微粒,属于纯净物,而O2和O3组成的混合气体中也只含有O元素,但由于有两种不同的微粒,因此属于混合物,C错误;
D.同素异形体是由同一元素组成的不同性质的单质,由于二者结构不同,因此彼此间物理性质是有差异的,D正确;
故合理选项是D。
6.B
【详解】1分子的硫酸能电离出2个氢离子,属于酸,且是二元酸,含有氧元素,属于含氧酸,硫酸属于纯净物,即为化合物,因此①③⑤⑥正确,答案选B。
7.C
【详解】的酸酐为,2分子分子间脱水形成,向次磷酸(分子式为)溶液中加入足量的NaOH溶液,充分反应后,生成和水,说明为一元弱酸,2分子分子间脱水形成酸酐,为,故C正确;
故选C。
8.A
【详解】A.烧碱为NaOH属于化合物,液态氧为单质,碘酒为溶液属于混合物,A项正确;
B.生石灰为CaO属于化合物,白磷为单质,熟石灰为Ca(OH)2属于化合物,B项错误;
C.干冰为固态二氧化碳属于化合物,铁属于单质,过氧化氢为H2O2属于化合物,C项错误;
D.空气属于混合物,氮气为单质,胆矾为属于化合物,D项错误;
答案选A。
9.A
【详解】A.电离出铵根离子和氢氧根离子,属于碱,故选A;
B.电离出氢离子和硫酸根离子,属于酸,故不选B;
C.不能电离,遇水生成一水合氨,是碱性气体,不是碱,故不选C;
D.不能电离,和水反应生成亚硫酸,是酸性气体,故不选D;
选A。
10.B
【详解】A.漂粉精等用于游泳池的消毒,发生氧化还原反应,故不选A;
B.氘、氚用作“人造太阳”核聚变燃料,核变不属于化学变化,故选B;
C.偏二甲肼用作发射火箭燃料,燃料燃烧发生氧化还原反应,故不选C;
D.过年放烟花,属于与燃烧反应,发生化学变化,故不选D;
选B。
11.CD
【详解】A.含有氧元素的化合物不一定是氧化物,如含氧酸、碱盐等,故A错误;
B.有的氧化物不一定能溶于水,如二氧化硅,故B错误;
C.水溶液中能电离出H+的化合物不一定是酸,如NaHSO4电离出氢离子,为盐,故C正确;
D.盐酸属于无氧酸,H2SO4属于含氧酸,故D正确
故答案选CD。
12.AB
【详解】A.氧化铁的化学式Fe2O3,氧化铁属于碱性氧化物,故A说法正确;
B.干冰化学式为CO2,CO2属于酸性氧化物,故B说法正确;
C.硫酸的化学式H2SO4,H2S是氢硫酸,故C说法错误;
D.纯碱的化学式为Na2CO3,属于盐,不属于碱,故D说法错误;
答案为AB。
13.AC
【详解】A.硫酸、烧碱(NaOH)、硝酸钠和生石灰(CaO)分别属于酸、碱、盐和碱性氧化物,A正确;
B.O2只含一种元素为单质,B错误;
C.溶液、浊液、胶体都包含分散质和分散剂,都是混合物,C正确;
D.CO与氢氧化钠不反应,不是酸性氧化物,D正确;
故选AC。
14.CD
【详解】A.循环中涉及到的水、二氧化碳、碳酸盐均为无机物,葡萄糖为有机物,A错误;
B.循环中涉及到的二氧化碳和水均为氧化物,B错误;
C.该碳循环中涉及到四种盐,为碳酸钠、碳酸氢钠、氯化钙和碳酸钙,C正确;
D.碳循环过程中发生了Na2CO3+CaCl2═2NaCl+CaCO3↓,D正确。
故答案为:CD。
15.AD
【分析】依据方案①:H2SO4为酸,NaOH为碱,NaCl、KCl、Na2CO3、FeCl3为盐;
依据方案②:钠盐为NaCl、Na2CO3,钾盐为KCl,铁盐为FeCl3,其他化合物为H2SO4、NaOH。
【详解】A.常温时,铜粉与稀硫酸不反应,所以稀硫酸不能溶解铜粉,能够完全溶解铜粉的是FeCl3溶液,A不正确;
B.上述方案②中的钾盐只有KCl,能生成白色沉淀,且不溶于入稀硝酸,则沉淀为AgCl,该溶液中含有Ag+,B正确;
C.由分析可知,按照方案①的分类,属于碱的有NaOH,C正确;
D.按照方案②的分类,属于钠盐的有NaCl、Na2CO3,NaOH属于碱,D不正确;
故 AD。
16.(1)加成反应
(2)
(3)醛基
(4)
(5)n CH2=CH2
【分析】CH2=CH2在一定条件下发生聚合反应生成A为聚乙烯,乙烯与氢气发生加成反应生成为B乙烷,乙烯与水发生催化加成生成C为乙醇,乙醇催化氧化生成D为乙醛,乙醛氧化生成E为乙酸,乙酸与乙醇发生酯化反应(也属于取代反应)生成乙酸乙酯。
(1)CH2=CH2→B是乙烯与氢气发生加成反应生成乙烷,反应类型是加成反应;
(2)C→D是乙醇催化氧化生成乙醛和水,反应的化学方程式是 ;
(3)D为乙醛,含有的官能团的名称是醛基;
(4)C和E生成C4H8O2的化学方程式是;
(5)CH2=CH2在一定条件下发生聚合反应生成A,化学方程式是n CH2=CH2 。
17.(1)CaCO3
(2)CaO+H2O=Ca(OH)2
(3) 大于; CO2+Ca(OH)2=CaCO3↓+H2O
【分析】流程的目的是得到超细的碳酸钙。原料石灰石在石灰窑中受热分解得到氧化钙合二氧化碳,氧化钙在乳化池中与水反应生成氢氧化钙,经过筛后的氢氧化钙在碳化塔中与二氧化碳反应得到想要的产品。
(1)
石灰石的主要成分是碳酸钙;
(2)
生石灰是氧化钙,与水反应生成氢氧化钙,反应方程式为CaO+H2O=Ca(OH)2;
(3)
过筛即是过滤,根据过滤的目的知过筛的目的是拦截大于筛孔直径的颗粒。碳化塔中的物质是通入的CO2和生浆池中产生的氢氧化钙,反应的方程式为CO2+Ca(OH)2=CaCO3↓+H2O。
18.(1) +6 K2FeO4 K2FeO4有强氧化性,可以杀灭细菌,生成的氢氧化铁胶体具有吸附性,能吸附水中的悬浮物
(2) 8Fe(OH)3+1CH4+15H+8Fe2++1HCO+21H2O HCO 1:8
(3) 8 502
【详解】(1)①根据K为+1价,O为-2价,则K2FeO4中Fe的化合价为+6价,由酸根离子和金属阳离子、铵根离子组成的化合物属于盐,上述反应涉及的物质中属于盐的是K2FeO4。
②高铁酸钾可用于净水消毒的原因为K2FeO4有强氧化性,可以杀灭细菌,生成的氢氧化铁胶体具有吸附性,能吸附水中的悬浮物。
(2)甲烷中的C由-4价升高为+4价,被氧化生成氧化产物HCO,氢氧化铁中的Fe由+3价降低为+2价,生成还原产物亚铁离子,根据得失电子守恒配平为8Fe(OH)3+1CH4+15H+8Fe2++1HCO+21H2O,结合离子方程式,被氧化的原子与被还原的原子的数目之比为1:8。
(3)无氧条件下加热,蓝铁矿(无杂质)发生分解:Fe3(PO4)2·nH2O Fe3(PO4)2+nH2O,蓝铁矿的质量由5.02g减小为3.58g,n[Fe3(PO4)2·nH2O)=n[Fe3(PO4)2]==0.01mol,则n==8,蓝铁矿的分子式为Fe3(PO4)2·8H2O,相对分子质量为502。
19. 化合物 ②⑤ 能 易分解 KIO3=K++
【分析】(1)由不同种元素组成的纯净物是化合物,能电离出金属阳离子或铵根离子和酸根离子的化合物叫做盐;
(2)根据储藏方法和食用方法确定碘酸钾的溶水性和热稳定性;
(3)盐电离产生金属阳离子和酸根离子。
【详解】(1)HIO3、NaIO3、KOH、I2O5、NaCl都是由不同种元素组成的纯净物,属于化合物,其中的NaIO3、NaCl、碘酸钾(KIO3)均属于盐类,HIO3属于酸;I2O5属于氧化物,故答案为:化合物;②⑤;
(2)碘酸钾(KIO3)储存时要防潮,说明碘酸钾易溶于水;由食用方法:烹调时待食品熟后加入碘盐,说明碘酸钾不稳定,受热易分解生成碘化钾和氧气,故答案为:能;易分解;
(3)碘酸钾是盐,属于电解质,电离产生K+、,故其在水中的电离方程式为:KIO3=K++。
20.(1)
(2)
(3)
(4)
(5)
(6)
(7)
(8)
【分析】该题旨在根据各个反应类型的定义和限定条件写出相应的化学方程式。
(1)
化合反应的特征是“多变一”,故可以是,也可以是;
(2)
分解反应的特征是“一变多”,故可以是,也可以是;
(3)
由题中所给物质可知,能发生置换反应的可能为:或;
(4)
题中所给物质可知,能发生复分解反应的可能为:或;
(5)
有水生成的化合反应为双氧水在二氧化锰做催化剂且加热的条件下分解生成水和氧气的反应,故化学方程式为:;
(6)
碳酸钙高温下分解生成氧化钙和二氧化碳,其中氧化钙为碱性氧化物,二氧化碳为酸性氧化物,故化学方程式为:;
(7)
铜和硝酸银反应生成硝酸铜和银,故化学方程式为:;
(8)
硝酸铜和氢氧化钡反应生成硫酸钡沉淀和氢氧化铜沉淀,故化学方程式为:;
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列反应方程式中正确的是
A.
B.
C.
D.
2.根据某种共性,将CO2、P2O5、SiO2归为一类,下列物质中符合此共性而被归为一类的是
A.SO2 B.CaO C.H2O D.CO
3.对下列化学物质进行分类,正确的是
A.海水、冰水混合物为混合物 B.盐酸、醋酸均为强酸
C.烧碱、纯碱均为碱 D.SO3、CO2均为酸性氧化物
4.下列物质属于钠盐的是
A.Na2SO4 B.Na2O C.MgSO4 D.BaCl2
5.下列叙述正确的是
A.金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物
B.酸性氧化物和水都能反应生成酸,碱性氧化物和水都能反应生成碱
C.由同种元素组成的物质均为纯净物
D.同素异形体彼此间物理性质是有差异的
6.按照不同的分类标准,H2SO4应属于
①酸 ②硫酸盐 ③含氧酸 ④混合物 ⑤化合物 ⑥二元酸
A.①②③④ B.①③⑤⑥ C.①②③⑤ D.②③⑤⑥
7.已知:的酸酐为。向次磷酸(分子式为)溶液中加入足量的NaOH溶液,充分反应后,生成和水,则可看成次磷酸酸酐的是
A. B. C. D.
8.下列各组物质,按化合物、单质、混合物顺序排列的是
A.烧碱,液态氧、碘酒 B.生石灰、白磷、熟石灰
C.干冰、铁、过氧化氢 D.空气、氮气、胆矾
9.下列物质属于碱的是
A. B. C. D.
10.下列应用中发生的不是化学变化的是
A.漂粉精等用于游泳池的消毒 B.氘、氚用作“人造太阳”核聚变燃料
C.偏二甲肼用作发射火箭燃料 D.过年放烟花
二、多选题
11.下列说法正确的是
A.含有氧元素的化合物一定是氧化物
B.所有的氧化物都能溶于水
C.水溶液中能电离出H+的化合物不一定是酸
D.盐酸属于无氧酸,H2SO4属于含氧酸
12.下列列物质种类、名称(或俗名)及化学式完全相符的是
A.碱性氧化物 氧化铁 Fe2O3
B.酸性氧化物 干冰 CO2
C.酸 硫酸 H2S
D.碱 纯碱 Na2CO3
13.下列有关物质分类的叙述正确的是
A.硫酸、烧碱、硝酸钠和生石灰分别属于酸、碱、盐和碱性氧化物
B.CaCl2、NaOH、HCl、O2四种物质都属于化合物
C.溶液、浊液、胶体都属于混合物
D.CO2、CO等非金属氧化物均属于酸性氧化物
14.已知在太阳光作用下,植物体内的叶绿素能将水、CO2转化为葡萄糖。如图为海水吸收CO2并进行碳循环的原理示意图:
下列说法正确的是
A.该碳循环是无机物之间的循环
B.该碳循环中涉及1种氧化物
C.该碳循环中涉及4种盐
D.该碳循环中涉及反应Na2CO3+CaCl2=2NaCl+CaCO3↓
15.某化学兴趣小组欲研究H2SO4、NaCl、KCl、Na2CO3、FeCl3、NaOH的性质,对于如何研究,他们设计了两种实验方案。
方案①:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验;
方案②:将它们按照钠盐、钾盐、铁盐和其他化合物分类,然后分别溶于水得到溶液,进行实验。
下列说法不正确的是
A.常温时,将少量铜粉分别投入上述溶液中,按照方案①的分类,能够完全溶解铜粉的是稀硫酸溶液
B.取某种溶液,向其中加入上述方案②中的钾盐溶液,有白色沉淀产生,再加入稀硝酸,沉淀不消失,则该溶液中含有Ag+
C.按照方案①的分类,属于碱的有NaOH
D.按照方案②的分类,属于钠盐的有NaCl、Na2CO3、NaOH
三、有机推断题
16.乙烯是一种重要的化工原料,其相关物质间的转化如下。
(1)CH2=CH2→B的反应类型是_______。
(2)C→D的化学方程式是_______。
(3)D中含有的官能团的名称是_______。
(4)C和E生成C4H8O2的化学方程式是_______。
(5)CH2=CH2在一定条件下发生聚合反应生成A,化学方程式是_______。
四、工业流程题
17.超细碳酸钙可用于生产钙片、牙膏等产品。利用碳化法生产超细碳酸钙的主要流程示意如下:
(1)石灰石主要成分的化学式为_______。
(2)乳化池中,生石灰与水发生反应,其化学方程式为_______。
(3)过筛的目的是拦截_______(填“大于”或“小于”)筛孔直径的颗粒。碳化塔中反应的化学方程式为_______。
五、原理综合题
18.一方面,磷矿藏在地球上分布不均匀且储量有限;另一方面,污水中含有较多的磷元素。因此在污水处理生物污泥中的蓝铁矿[Fe3(PO4)2·nH2O]因其潜在的特殊用途以及经济价值而备受关注。蓝铁矿在自然水体中形成的过程如图。
(1)水处理时,加入的高铁酸钾(K2FeO4)作为净水消毒剂,发生反应的化学方程式为4K2FeO4+10H2O=4Fe(OH)3(胶体)+8KOH+3O2↑。
①K2FeO4中Fe的化合价为_______价,上述反应涉及的物质中属于盐的是_______。
②高铁酸钾可用于净水消毒的原因是_______。
(2)在甲烷厌氧氧化菌的作用下,氢氧化铁和甲烷发生如下反应,配平该离子方程式:_______________Fe(OH)3+______CH4+_______H+______Fe2++_______HCO+_______H2O,
该反应中的氧化产物为_______(填离子符号),被氧化的原子与被还原的原子的数目之比为_______。
(3)无氧条件下加热,蓝铁矿(无杂质)发生分解:Fe3(PO4)2·nH2O Fe3(PO4)2+nH2O,蓝铁矿的质量由5.02g减小为3.58g,则n=_______,蓝铁矿的相对分子质量为_______。
19.下表是某城市场上销售的一种“加碘盐”包装上的部分文字说明。
配料表 精制海盐、碘酸钾(KIO3)
含碘量 20~40 mg·kg-1
储藏方法 密封、避光、防潮
食用方法 烹调时待食品熟后加入碘盐
回答下列问题:
(1)结合物质分类中的树状分类法的有关知识,根据物质的组成对物质进行分类。在下列五种____(填“混合物”“化合物”“盐”或“氧化物”)中与碘酸钾(KIO3)属于同类物质的是____(填序号)。
①HIO3 ②NaIO3 ③KOH ④I2O5 ⑤NaCl
(2)推测碘酸钾(KIO3)的物理性质:碘酸钾(KIO3)____(填“能”或“不能”)溶于水;
化学性质:碘酸钾(KIO3)在受热时____(填“易分解”或“不易分解”)。
(3)碘酸钾是一种电解质,写出其在水溶液中的电离方程式:____________。
六、结构与性质
20.根据要求,回答下列问题:
Ⅰ. 从铁、盐酸、氧气、过氧化氢、硝酸银溶液五种物质中选出一种或两种为反应物,按下列反应类型各写出一个化学方程式。
(1)化合反应:_______。
(2)分解反应:_______。
(3)置换反应:_______。
(4)复分解反应:_______。
Ⅱ. 按下列要求各写出一个化学方程式。
(5)有水生成的化合反应:_______。
(6)生成一种碱性氧化物和一种酸性氧化物的分解反应:_______。
(7)有硝酸银参加反应生成硝酸铜的置换反应:_______。
(8)生成两种沉淀的复分解反应:_______。
参考答案:
1.D
【详解】A.铁丝在纯氧里燃烧,生成四氧化三铁:,A错误;
B.铁和盐酸反应生成氯化亚铁和氢气:,B错误;
C.铁和硫酸铜发生反应,生成硫酸亚铁和铜:,C错误;
D.铁和稀硫酸反应,生成硫酸亚铁和氢气:,D正确;
答案选D。
2.A
【分析】CO2、P2O5、SiO2既是非金属氧化物,也是酸性氧化物。
【详解】A.SO2既是非金属氧化物,也是酸性氧化物,故A符合题意;
B.CaO为金属氧化物,碱性氧化物,故B不符合题意;
C.H2O是非金属氧化物,但不属于酸性氧化物,故C不符合题意;
D.CO是非金属氧化物,既不能与酸反应,不能与碱反应,不是酸性氧化物,故D不符合题意;
答案选A。
3.D
【详解】A.冰水混合物的成分为水,是纯净物、是氧化物,A错误;
B. 盐酸为强酸、醋酸为弱酸,B错误;
C. 烧碱为碱,纯碱是碳酸钠的俗称、属于盐,C错误;
D. SO3、CO2均能与酸反应生成盐和水、均属于酸性氧化物,D正确;
答案选D。
4.A
【解析】由钠离子和酸根离子组成的盐是钠盐,据此解答。
【详解】A. Na2SO4属于钠盐,A正确;
B. Na2O属于碱性氧化物,不是盐,B错误;
C. MgSO4不含钠,属于镁盐,C错误;
D. BaCl2不含钠,属于钡盐,D错误;
答案选A。
5.D
【详解】A.金属氧化物不一定是碱性氧化物,非金属氧化物也一定是酸性氧化物,如Al2O3是金属氧化物,但属于两性氧化物;CO是非金属氧化物,但属于不成盐氧化物,A错误;
B.SiO2是酸性氧化物,但不能与水反应产生相应的酸,故酸性氧化物不一定都可以和水反应生成酸;Fe2O3是碱性氧化物,但不能与水反应产生相应的碱Fe(OH)3,故碱性氧化物不一定能和水反应生成碱,B错误;
C.由同种元素组成的物质可能为纯净物,也可能为混合物,如氧气中仅存在O2一种微粒,属于纯净物,而O2和O3组成的混合气体中也只含有O元素,但由于有两种不同的微粒,因此属于混合物,C错误;
D.同素异形体是由同一元素组成的不同性质的单质,由于二者结构不同,因此彼此间物理性质是有差异的,D正确;
故合理选项是D。
6.B
【详解】1分子的硫酸能电离出2个氢离子,属于酸,且是二元酸,含有氧元素,属于含氧酸,硫酸属于纯净物,即为化合物,因此①③⑤⑥正确,答案选B。
7.C
【详解】的酸酐为,2分子分子间脱水形成,向次磷酸(分子式为)溶液中加入足量的NaOH溶液,充分反应后,生成和水,说明为一元弱酸,2分子分子间脱水形成酸酐,为,故C正确;
故选C。
8.A
【详解】A.烧碱为NaOH属于化合物,液态氧为单质,碘酒为溶液属于混合物,A项正确;
B.生石灰为CaO属于化合物,白磷为单质,熟石灰为Ca(OH)2属于化合物,B项错误;
C.干冰为固态二氧化碳属于化合物,铁属于单质,过氧化氢为H2O2属于化合物,C项错误;
D.空气属于混合物,氮气为单质,胆矾为属于化合物,D项错误;
答案选A。
9.A
【详解】A.电离出铵根离子和氢氧根离子,属于碱,故选A;
B.电离出氢离子和硫酸根离子,属于酸,故不选B;
C.不能电离,遇水生成一水合氨,是碱性气体,不是碱,故不选C;
D.不能电离,和水反应生成亚硫酸,是酸性气体,故不选D;
选A。
10.B
【详解】A.漂粉精等用于游泳池的消毒,发生氧化还原反应,故不选A;
B.氘、氚用作“人造太阳”核聚变燃料,核变不属于化学变化,故选B;
C.偏二甲肼用作发射火箭燃料,燃料燃烧发生氧化还原反应,故不选C;
D.过年放烟花,属于与燃烧反应,发生化学变化,故不选D;
选B。
11.CD
【详解】A.含有氧元素的化合物不一定是氧化物,如含氧酸、碱盐等,故A错误;
B.有的氧化物不一定能溶于水,如二氧化硅,故B错误;
C.水溶液中能电离出H+的化合物不一定是酸,如NaHSO4电离出氢离子,为盐,故C正确;
D.盐酸属于无氧酸,H2SO4属于含氧酸,故D正确
故答案选CD。
12.AB
【详解】A.氧化铁的化学式Fe2O3,氧化铁属于碱性氧化物,故A说法正确;
B.干冰化学式为CO2,CO2属于酸性氧化物,故B说法正确;
C.硫酸的化学式H2SO4,H2S是氢硫酸,故C说法错误;
D.纯碱的化学式为Na2CO3,属于盐,不属于碱,故D说法错误;
答案为AB。
13.AC
【详解】A.硫酸、烧碱(NaOH)、硝酸钠和生石灰(CaO)分别属于酸、碱、盐和碱性氧化物,A正确;
B.O2只含一种元素为单质,B错误;
C.溶液、浊液、胶体都包含分散质和分散剂,都是混合物,C正确;
D.CO与氢氧化钠不反应,不是酸性氧化物,D正确;
故选AC。
14.CD
【详解】A.循环中涉及到的水、二氧化碳、碳酸盐均为无机物,葡萄糖为有机物,A错误;
B.循环中涉及到的二氧化碳和水均为氧化物,B错误;
C.该碳循环中涉及到四种盐,为碳酸钠、碳酸氢钠、氯化钙和碳酸钙,C正确;
D.碳循环过程中发生了Na2CO3+CaCl2═2NaCl+CaCO3↓,D正确。
故答案为:CD。
15.AD
【分析】依据方案①:H2SO4为酸,NaOH为碱,NaCl、KCl、Na2CO3、FeCl3为盐;
依据方案②:钠盐为NaCl、Na2CO3,钾盐为KCl,铁盐为FeCl3,其他化合物为H2SO4、NaOH。
【详解】A.常温时,铜粉与稀硫酸不反应,所以稀硫酸不能溶解铜粉,能够完全溶解铜粉的是FeCl3溶液,A不正确;
B.上述方案②中的钾盐只有KCl,能生成白色沉淀,且不溶于入稀硝酸,则沉淀为AgCl,该溶液中含有Ag+,B正确;
C.由分析可知,按照方案①的分类,属于碱的有NaOH,C正确;
D.按照方案②的分类,属于钠盐的有NaCl、Na2CO3,NaOH属于碱,D不正确;
故 AD。
16.(1)加成反应
(2)
(3)醛基
(4)
(5)n CH2=CH2
【分析】CH2=CH2在一定条件下发生聚合反应生成A为聚乙烯,乙烯与氢气发生加成反应生成为B乙烷,乙烯与水发生催化加成生成C为乙醇,乙醇催化氧化生成D为乙醛,乙醛氧化生成E为乙酸,乙酸与乙醇发生酯化反应(也属于取代反应)生成乙酸乙酯。
(1)CH2=CH2→B是乙烯与氢气发生加成反应生成乙烷,反应类型是加成反应;
(2)C→D是乙醇催化氧化生成乙醛和水,反应的化学方程式是 ;
(3)D为乙醛,含有的官能团的名称是醛基;
(4)C和E生成C4H8O2的化学方程式是;
(5)CH2=CH2在一定条件下发生聚合反应生成A,化学方程式是n CH2=CH2 。
17.(1)CaCO3
(2)CaO+H2O=Ca(OH)2
(3) 大于; CO2+Ca(OH)2=CaCO3↓+H2O
【分析】流程的目的是得到超细的碳酸钙。原料石灰石在石灰窑中受热分解得到氧化钙合二氧化碳,氧化钙在乳化池中与水反应生成氢氧化钙,经过筛后的氢氧化钙在碳化塔中与二氧化碳反应得到想要的产品。
(1)
石灰石的主要成分是碳酸钙;
(2)
生石灰是氧化钙,与水反应生成氢氧化钙,反应方程式为CaO+H2O=Ca(OH)2;
(3)
过筛即是过滤,根据过滤的目的知过筛的目的是拦截大于筛孔直径的颗粒。碳化塔中的物质是通入的CO2和生浆池中产生的氢氧化钙,反应的方程式为CO2+Ca(OH)2=CaCO3↓+H2O。
18.(1) +6 K2FeO4 K2FeO4有强氧化性,可以杀灭细菌,生成的氢氧化铁胶体具有吸附性,能吸附水中的悬浮物
(2) 8Fe(OH)3+1CH4+15H+8Fe2++1HCO+21H2O HCO 1:8
(3) 8 502
【详解】(1)①根据K为+1价,O为-2价,则K2FeO4中Fe的化合价为+6价,由酸根离子和金属阳离子、铵根离子组成的化合物属于盐,上述反应涉及的物质中属于盐的是K2FeO4。
②高铁酸钾可用于净水消毒的原因为K2FeO4有强氧化性,可以杀灭细菌,生成的氢氧化铁胶体具有吸附性,能吸附水中的悬浮物。
(2)甲烷中的C由-4价升高为+4价,被氧化生成氧化产物HCO,氢氧化铁中的Fe由+3价降低为+2价,生成还原产物亚铁离子,根据得失电子守恒配平为8Fe(OH)3+1CH4+15H+8Fe2++1HCO+21H2O,结合离子方程式,被氧化的原子与被还原的原子的数目之比为1:8。
(3)无氧条件下加热,蓝铁矿(无杂质)发生分解:Fe3(PO4)2·nH2O Fe3(PO4)2+nH2O,蓝铁矿的质量由5.02g减小为3.58g,n[Fe3(PO4)2·nH2O)=n[Fe3(PO4)2]==0.01mol,则n==8,蓝铁矿的分子式为Fe3(PO4)2·8H2O,相对分子质量为502。
19. 化合物 ②⑤ 能 易分解 KIO3=K++
【分析】(1)由不同种元素组成的纯净物是化合物,能电离出金属阳离子或铵根离子和酸根离子的化合物叫做盐;
(2)根据储藏方法和食用方法确定碘酸钾的溶水性和热稳定性;
(3)盐电离产生金属阳离子和酸根离子。
【详解】(1)HIO3、NaIO3、KOH、I2O5、NaCl都是由不同种元素组成的纯净物,属于化合物,其中的NaIO3、NaCl、碘酸钾(KIO3)均属于盐类,HIO3属于酸;I2O5属于氧化物,故答案为:化合物;②⑤;
(2)碘酸钾(KIO3)储存时要防潮,说明碘酸钾易溶于水;由食用方法:烹调时待食品熟后加入碘盐,说明碘酸钾不稳定,受热易分解生成碘化钾和氧气,故答案为:能;易分解;
(3)碘酸钾是盐,属于电解质,电离产生K+、,故其在水中的电离方程式为:KIO3=K++。
20.(1)
(2)
(3)
(4)
(5)
(6)
(7)
(8)
【分析】该题旨在根据各个反应类型的定义和限定条件写出相应的化学方程式。
(1)
化合反应的特征是“多变一”,故可以是,也可以是;
(2)
分解反应的特征是“一变多”,故可以是,也可以是;
(3)
由题中所给物质可知,能发生置换反应的可能为:或;
(4)
题中所给物质可知,能发生复分解反应的可能为:或;
(5)
有水生成的化合反应为双氧水在二氧化锰做催化剂且加热的条件下分解生成水和氧气的反应,故化学方程式为:;
(6)
碳酸钙高温下分解生成氧化钙和二氧化碳,其中氧化钙为碱性氧化物,二氧化碳为酸性氧化物,故化学方程式为:;
(7)
铜和硝酸银反应生成硝酸铜和银,故化学方程式为:;
(8)
硝酸铜和氢氧化钡反应生成硫酸钡沉淀和氢氧化铜沉淀,故化学方程式为:;
