专题8有机化合物的获得与应用单元检测题(含解析)高一下学期化学苏教版(2019)必修第二册
文档属性
| 名称 | 专题8有机化合物的获得与应用单元检测题(含解析)高一下学期化学苏教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-29 07:06:18 | ||
图片预览




文档简介
专题8《有机化合物的获得与应用》单元检测题
一、单选题
1.在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,则这个碳原子被称为“手性碳原子”,凡含有手性碳原子的物质一定具有光学活性,如物质有光学活性,发生下列反应后生成的有机物无光学活性的是
①与甲酸发生酯化反应 ②与银氨溶液作用 ③与NaOH溶液反应 ④在催化剂存在下与氢气作用
A.①③ B.②④ C.③④ D.②③
2.人体需要从食物中获取各种营养物质,营养师可结合服务对象的特殊需求进行膳食指导,下列营养物质不能被人体消化吸收的是
A.纤维素 B.油脂 C.蛋白质 D.葡萄糖
3.碳元素的化合价与其形成物质类别的关系如图所示。下列说法错误的是
A.a的硬度可能很大,也可能较小
B.除去c中混有的b,可将混合气体通入NaOH溶液中
C.1mold完全燃烧时,理论上消耗2mol氧气
D.相同条件下,形成的酸式盐的溶解度一定比其形成的正盐大
4.糖类、油脂、蛋白质都是饮食中常见的有机化合物,下列说法正确的是
A.淀粉、纤维素、油脂、蛋白质都属于高分子化合物
B.淀粉和纤维素的化学式都是(C6H10O5)n,二者互为同分异构体
C.向鸡蛋清溶液中加入饱和(NH4)2SO4溶液,会使鸡蛋清变性而出现白色沉淀
D.油脂在一定条件下能水解生成高级脂肪酸和甘油
5.化学与生产、生活密切相关。下列有关说法正确的是
A.我国率先研制了预防新冠病毒的灭活疫苗,灭活疫苗利用了蛋白质变性原理
B.神舟载人飞船搭载的太阳能电池板的核心材料是二氧化硅
C.我国古代精美金属器皿表面使用了鎏金工艺,利用的是电镀原理
D.石墨烯片常用于保暖材料,石墨烯和碳纳米管互为同分异构体
6.下表中所列为古丝绸之路中的部分重要贸易商品,主要成分属于无机物的是
A.瓷器 B.丝绸 C.茶叶 D.白酒
A.A B.B C.C D.D
7.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,2.24L CHCl3的原子总数为0.1NA
B.4.2g C3H6中含有的碳碳双键数一定为0.1NA
C.1mol -OH中电子数为10NA
D.常温常压下,28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
8.多巴是一种有机物,可用于帕金森综合征的治疗,其结构简式如下:
下列关于多巴的叙述中不正确的是
A.该分子含有三种官能团
B.既显酸性,又显碱性
C.一定条件下能发生聚合反应
D.分子中只有6个碳原子共平面
9.要合成带有放射性氧元素(*O)的乙酸乙酯,除必要的反应条件外,下列各组反应物能满足合成要求的是( )
①CH3CO*OH和C2H5OH
②CH3COOH和C2H5*OH
③CH3C*OOH和C2H5OH
④CH3CO*OH和C2H5*OH.
A.①②③④ B.①③④ C.①②④ D.②③④
10.化学与生产、生活、环境等密切相关,下列说法正确的是
A.煤的干馏、石油的分馏和油脂的皂化都属于化学变化
B.聚氯乙烯膜具有塑性和弹性,可用作食品保鲜膜
C.政府鼓励科研和生产部门开发利用太阳能
D.棉、丝、油脂都属于天然高分子化合物
11.下列叙述中,不正确的是( )
A.蔗糖的水解产物,在一定条件下,能发生银镜反应
B.蔗糖是多羟基的醛类化合物
C.蔗糖不是淀粉水解的最终产物
D.麦芽糖是多羟基的醛类化合物
12.氯乙烷是一种沸点较低(沸点为12.27℃),极易挥发的无色液体,常作为运动员肌肉挫伤或扭伤的冷冻麻醉剂,下列有关氯乙烷的制法,最好的是
A.乙烷与氯气发生取代反应 B.乙烯与氯气发生加成反应
C.乙烷与氯化氢混合 D.乙烯与氯化氢发生加成反应
13.下列有关实验描述正确的是
A.将木炭和浓硫酸共热产生的气体通入到澄清石灰水中,澄清石灰水变浑浊,说明反应产生了CO2
B.在试管中加入2mL淀粉溶液和少量稀硫酸,加热3-4分钟,冷却后加入少量新制悬浊液,加热后会产生砖红色沉淀
C.向某溶液中滴加溶液,再滴加足量的稀硝酸,有白色沉淀产生,该溶液中一定含有
D.向某溶液中滴加较浓NaOH溶液,加热后若能产生使湿润红色石蕊试纸变蓝的气体,说明溶液中
14.化学物质在体育领域有广泛用途。下列说法错误的是
A.涤纶可作为制作运动服的材料
B.纤维素可以为运动员提供能量
C.木糖醇可用作运动饮料的甜味剂
D.“复方氯乙烷气雾剂”可用于运动中急性损伤的镇痛
15.下列关于乙醇和乙酸的说法中不正确的是
A.它们都能与金属钠反应放出氢气
B.它们都能发生酯化反应和氧化反应
C.乙醇能发生取代反应,乙酸不能发生取代反应
D.用重铬酸钾溶液可以证明乙醇的还原性
二、填空题
16.某学生进行淀粉的水解实验,操作如下:
(1)取少量淀粉溶液,加入3~5滴稀硫酸,加热几分钟,淀粉水解反应的化学方程式为_______。
(2)取少量冷却后的水解液,向其中加入新制氢氧化铜悬浊液,加热至沸腾后无砖红色沉淀生成。他由此认为:水解产物中没有葡萄糖。他的结论是否正确?_______,理由是_______。
(3)用5t含淀粉80%的粮食,可以制得葡萄糖的质量为_______。(假设淀粉的转化率为81%)
(4)氨基酸是组成蛋白质的基本结构单元,人体中共有二十多种氨基酸,其中人体自身_______(填“能”或“不能”)合成的氨基酸称为人体必需氨基酸。
(5)某蛋白质分子中含铁0.28%,测知该分子的相对分子质量为20000,则该分子中含铁原子_______个。(已知铁的相对原子质量为56)。
17.煤干馏得到的煤焦油可以分离出来,苯是无色无味的液态烃。( )
三、计算题
18.在120℃、101kPa条件下,由H2、CH4组成的混合气体amL,通入一定量(设为VmL)氧气使其完全燃烧。
(1)若amL混合气体完全燃烧消耗相同条件下氧气的体积也为amL(即V=a),则原混合气体中CH4的体积分数是_______。
(2)若完全燃烧生成CO2和H2O(g)的总体积在相同条件下为2amL,则原混合气体中CH4的体积分数是_______。
(3)若原混合气体完全燃烧时,生成的气体只有CO2和H2O(g)则V的取值范围是_______。
19.将6.48g淀粉和6. 84g蔗糖的混合物加水,一定条件下使其完全水解,所得溶液中葡萄糖与果糖的物质的量之比是多少______?
四、实验题
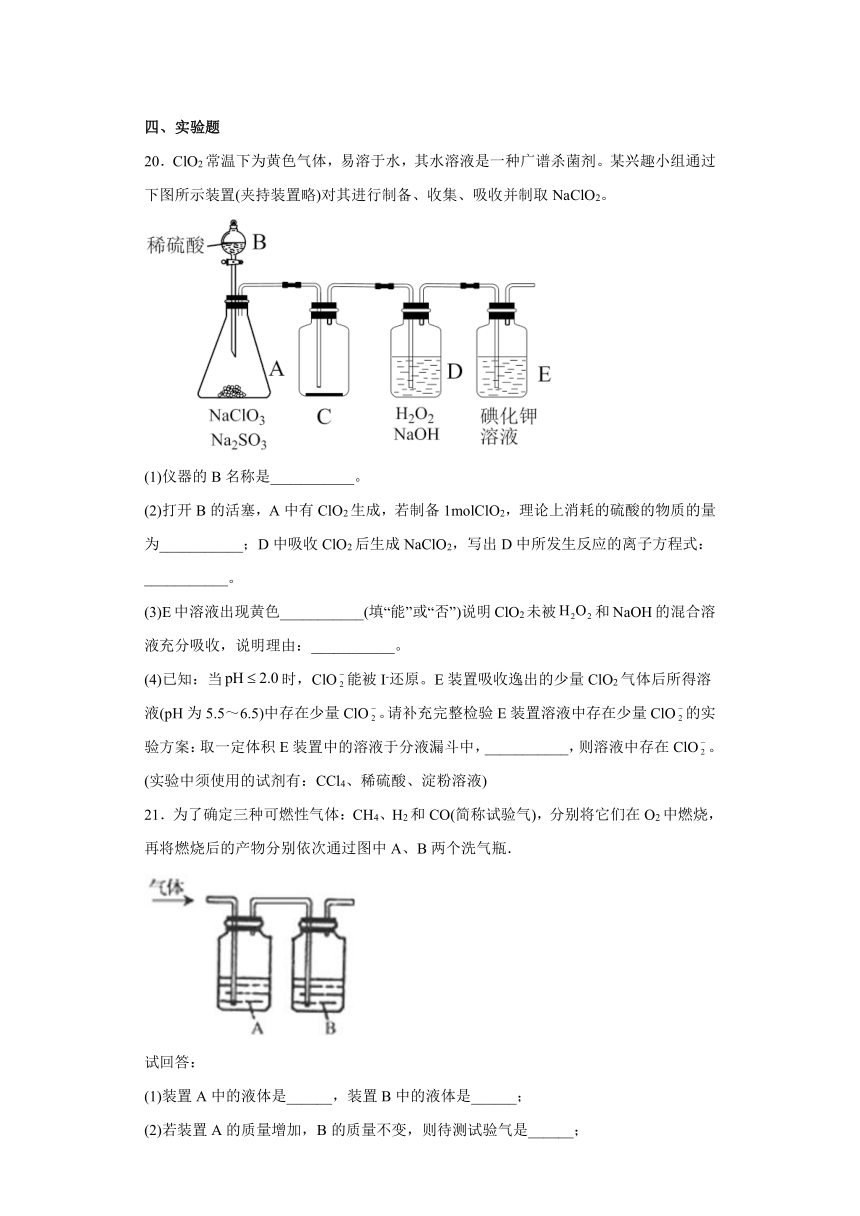
20.ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。某兴趣小组通过下图所示装置(夹持装置略)对其进行制备、收集、吸收并制取NaClO2。
(1)仪器的B名称是___________。
(2)打开B的活塞,A中有ClO2生成,若制备1molClO2,理论上消耗的硫酸的物质的量为___________;D中吸收ClO2后生成NaClO2,写出D中所发生反应的离子方程式:___________。
(3)E中溶液出现黄色___________(填“能”或“否”)说明ClO2未被和NaOH的混合溶液充分吸收,说明理由:___________。
(4)已知:当时,ClO能被I-还原。E装置吸收逸出的少量ClO2气体后所得溶液(pH为5.5~6.5)中存在少量ClO。请补充完整检验E装置溶液中存在少量ClO的实验方案:取一定体积E装置中的溶液于分液漏斗中,___________,则溶液中存在ClO。(实验中须使用的试剂有:CCl4、稀硫酸、淀粉溶液)
21.为了确定三种可燃性气体:CH4、H2和CO(简称试验气),分别将它们在O2中燃烧,再将燃烧后的产物分别依次通过图中A、B两个洗气瓶.
试回答:
(1)装置A中的液体是______,装置B中的液体是______;
(2)若装置A的质量增加,B的质量不变,则待测试验气是______;
(3)若装置A质量不变,B的质量增加,则试验气是______;
(4)若装置A、B的质量都增加,则试验气是______,若这时装置B的质量增加m g,则装置A的质量增加______.
参考答案:
1.C
【详解】①与甲酸发生酯化反应,生成,仍含手性碳原子,仍有光学活性;
②与银氨溶液作用生成,仍含手性碳原子,仍有光学活性;
③与NaOH溶液发生水解反应生成,原手性C原子连接2个-CH2OH,不含手性碳原子,失去光学活性;
④在催化剂存在下与氢气加成后生成的中,原手性C原子连接2个-CH2OH,不含手性碳原子,失去光学活性;
根据分析,③④的产物中不再含手性碳原子,无光学活性,答案为C。
2.A
【详解】人体内不含消化纤维素的酶,所以纤维素不能被人体消化吸收,而油脂、蛋白质、葡萄糖均能被人体消化吸收,故选A。
3.D
【分析】a为C,b为CO,c为CO2,d为CH4,e为H2CO3,f为碳酸盐。
【详解】A.a为C,若a为石墨,硬度很小,若a为金刚石,硬度很大,A正确;
B.除去CO中混有的CO2,CO2能与NaOH反应,可将混合气体通入NaOH溶液中,B正确;
C.甲烷完全燃烧的化学方程式为:,1molCH4完全燃烧时,理论上消耗2molO2,C正确;
D.相同条件下,的溶解度比的溶解度小,D错误;
故选D。
4.D
【详解】A.淀粉纤维素蛋白质均为天然高分子化合物,而油脂不是高分子,A项错误;
B.纤维素和淀粉虽然均写为(C6H10O5)n,但化学式中它们的n值不同,所以分子式不同不是同分异构体,B项错误;
C.鸡蛋清为蛋白质,向其中加入盐溶液可以发生盐析导致蛋白质溶解性降低析出固体,C项错误;
D.油脂中含有酯基-COOR可以在酸性条件下发生水解,生成高级脂肪酸和甘油,D项正确;
故选B。
5.A
【详解】A.病毒的主要成分为蛋白质,灭活疫苗利用了蛋白质变性原理,A选项正确;
B.单质硅是太阳能电池板的核心材料,B选项错误;
C.古代没有电镀工艺,C选项错误;
D.石墨烯和碳纳米管是由碳元素组成的不同性质的单质,互为同素异形体,D选项错误;
故选A。
6.A
【详解】A.瓷器的主要成分是硅酸盐,属于无机物;
B.丝绸的主要成分是蛋白质,属于有机物;
C.茶叶主要含有茶多酚,是茶叶中多酚类物质的总称,包括黄烷醇类、花色苷类、黄酮类、黄酮醇类和酚酸类等,属于有机物;
D.白酒的主要成分是乙醇,属于有机物;
故选A。
7.D
【详解】A.标准状况下,CHCl3是液态,无法使用Vm=22.4L/mol计算,故A错误;
B.4.2g C3H6可以是环丙烷,没有碳碳双键,B错误;
C.1mol -OH中电子数为9NA,C错误;
D.乙烯和环丁烷(C4H8)的最简式相同,故质量一定含有的碳原子数为定值,计算为2NA,D正确;
故选D。
8.D
【详解】A.由结构简式可知,L—多巴分子中含有羟基、氨基,羧基三种官能团,故A正确;
B.由结构简式可知,多巴分子中含有羧基和氨基,既显酸性又显碱性,故B正确;
C.由结构简式可知,L—多巴分子中含有羟基、氨基,羧基三种官能团,一定条件下羧基能与羟基或氨基能发生缩聚反应生成高分子化合物,故C正确;
D.由结构简式可知,L—多巴分子中含有苯环,与苯环相连的碳原子与苯环共平面,则分子中至少有7个碳原子共平面,故D错误;
故选D。
9.D
【分析】根据酯化反应的原理“酸脱羟基醇脱氢”,乙酸乙酯的两个氧原子分别来乙酸的碳氧双键中的O(羰基中的O)和乙醇中羟基中的O,即只要乙酸的碳氧双键的氧原子或乙醇中羟基的氧原子含有放射性氧元素(*O),生成的乙酸乙酯就含有放射性氧元素(*O)。
【详解】①CH3CO*OH和C2H5OH,酯化反应中,乙酸中的羟基脱去生成了水,所以乙酸乙酯中不会含有放射性氧元素(*O),故①错误;
②CH3COOH和C2H5*OH,乙醇在酯化反应中只是失去氢原子,乙醇中的放射性氧元素(*O)会保留在乙酸乙酯中,故②正确;
③CH3C*OOH和C2H5OH,乙酸中的碳氧双键中的放射性氧元素(*O)会保留在乙酸乙酯中,即生成的乙酸乙酯含含放射性氧元素(*O),故③正确;
④CH3CO*OH和C2H5*OH,乙酸的羟基中的放射性氧元素(*O)不会保留在乙酸乙酯中,但是乙醇中的放射性氧元素(*O)会保留在乙酸乙酯中,即生成的乙酸乙酯含含放射性氧元素(*O),故④正确;
答案选D。
【点睛】本题考查了酯化反应的原理,题目难度中等,注意熟练掌握酯化反应的原理“酸脱羟基醇脱氢”,试题具有新颖性,是一道不错的题目,有利于培养学生的分析能力、理解能力和灵活应用所学知识解决实际问题的能力。
10.C
【详解】A.石油的分馏属于物理变化,故A不选;
B.聚氯乙烯加热时,会释放有毒物质,不能用于食品包装,故B不选;
C.太阳能属于可再生的清洁能源,政府鼓励科研和生产部门开发利用太阳能,故选C;
D.高分子化合物的相对分子质量为几万甚至几百万,油脂是高级脂肪酸甘油酯,不属于高分子化合物,D错。
答案选C
11.B
【详解】A、蔗糖在硫酸催化作用下,发生水解,生成葡萄糖和果糖,葡萄糖含有醛基,能发生银镜反应,A正确;
B、蔗糖分子中不含醛基,不发生银镜反应,也不能还原新制的氢氧化铜,B错误;
C、淀粉是最重要的多糖,在催化剂存在和加热的条件下逐步水解,最终生成还原性单糖--葡萄糖;蔗糖不是淀粉水解的产物,C正确;
D、蔗糖和麦芽糖的分子式均为C12H22O11,分子式相同但结构不同,蔗糖分子中不含醛基,麦芽糖分子中含有醛基,具有还原性,所以蔗糖与麦芽互为同分异构体,D正确;
正确选项B。
【点睛】糖类中,葡萄糖和果糖属于还原性糖,不能发生水解;蔗糖和麦芽糖属于二糖,都能发生水解,但是麦芽糖属于还原性糖;淀粉和纤维素属于多糖,都能发生水解,但都不是还原性糖,二者属于天然高分子。
12.D
【详解】A.乙烷与氯气发生取代反应,不易控制取代个数;
B.乙烯与氯气发生加成反应,得到的是二氯乙烷;
C.乙烷与氯化氢混合,两者不反应,得不到氯乙烷;
D.乙烯与氯化氢发生加成反应,产物是氯乙烷;
故最后的制法选择D。
13.D
【详解】A.木炭与浓硫酸反应C+H2SO4(浓)CO2↑+SO2↑+H2O,CO2、SO2都能使澄清石灰水变浑浊,故A错误;
B.淀粉水解最终产物是葡萄糖,验证葡萄糖与新制氢氧化铜悬浊液反应,环境应是碱性,但题中没有中和稀硫酸,使溶液显碱性,因此加热后不能观察到砖红色沉淀产生,故B错误;
C.NO(H+)具有强氧化性,能将SO氧化成SO,同样也会产生白色沉淀,即该溶液中可能含有SO,故C错误;
D.氨气是中学阶段学过唯一一种能使湿润红色石蕊试纸变蓝的气体,因此该操作能够说明原溶液中含有,故D正确;
答案为D。
14.B
【详解】A.涤纶属于合成纤维,其抗皱性和保形性很好,具有较高的强度与弹性恢复能力,可作为制作运动服的材料,A正确;
B.人体没有分解纤维素的酶,故纤维素不能为运动员提供能量,B错误;
C.木糖醇具有甜味,可用作运动饮料的甜味剂,C正确;
D.氯乙烷具有冷冻麻醉作用,从而使局部产生快速镇痛效果,所以“复方氯乙烷气雾剂”可用于运动中急性损伤的阵痛,D正确;
答案选B。
15.C
【详解】A.乙醇和乙酸分别含有羟基,羧基,都可以和钠反应生成氢气,故A正确;
B.酸和醇一定条件下发生酯化反应,醇能燃烧,属于氧化反应,乙酸可以被过氧化氢氧化生成过氧乙酸,也属于氧化反应,故B正确;
C.乙酸、乙醇的酯化反应就是取代反应,即二者都能发生取代反应,故C错误;
D.重铬酸钾(K2Cr2O7)可以检测司机是否酒后驾车,酒精中的乙醇能使红色的重铬酸钾变为绿色的硫酸铬[Cr2(SO4)3],证明乙醇的还原性,故D正确;
故选:C。
16.(1)
(2) 不正确 没有向水解液中加入氢氧化钠溶液调节溶液至碱性
(3)3.6t
(4)不能
(5)1
【详解】(1)淀粉为多糖,在稀硫酸做催化剂的条件下,淀粉溶液中淀粉共热发生水解反应生成葡萄糖,反应的化学方程式为,故答案为:;
(2)葡萄糖在碱性条件下才能与新制氢氧化铜悬浊液共热发生氧化反应,所以淀粉在溶液中发生水解后,若没有加入氢氧化钠溶液中和稀硫酸,直接加入新制氢氧化铜悬浊液共热不可能有砖红色沉淀生成,所以无砖红色沉淀生成不能确定水解产物中是否含有葡萄糖,故答案为:不正确;没有向水解液中加入氢氧化钠溶液调节溶液至碱性;
(3)由淀粉的转化率为81%可知,5t含淀粉80%的粮食可以制得葡萄糖的质量为×n×180g/mol×10—6t/g=3.6t,故答案为:3.6t;
(4)人体中共有二十多种氨基酸,其中人体自身不能合成的氨基酸称为人体必需氨基酸,故答案为:不能;
(5)由相对分子质量为20000的蛋白质分子中含铁0.28%可知,蛋白质分子中含铁原子个数为=1,故答案为:1。
17.错误
【详解】煤干馏得到的煤焦油可以分离出苯,苯为具有芳香气味的液体,故错误。
18.(1)33.3%
(2)50%
(3)0.5a【解析】(1)
设氢气的体积为x,CH4的体积为y,则,解得y∶x=1∶2,所以CH4的体积分数为33.3%。故答案为:33.3%;
(2)
设H2燃烧生成H2O(g)的体积为x,CH4的体积为y,CH4燃烧生成2y体积的H2O(g)和y体积的CO2所以x+3y=2(x+y),解得y∶x=1∶1,所以CH4的体积分数为50%。故答案为:50%;
(3)
若a mL全部是H2则完全燃烧时消耗O2的体积为0.5a mL,若a mL全部是CH4则完全燃烧时消耗O2的体积为2a mL,所以得0.5a19.3∶1
【分析】根据蔗糖水解的化学方程式C12H22O11+H2O→C6H12O6(葡萄糖)+C6H12O6(果糖)和淀粉水解的化学方程式(C6H10O5)n+nH2O→nC6H12O6,计算生成的葡萄糖与果糖的质量,二者摩尔质量相等,物质的量之比等于质量之比,据此计算判断。
【详解】C12H22O11+H2O→C6H12O6(葡萄糖)+C6H12O6(果糖)
342 180 180
6.84g 3.6g 3.6g
(C6H10O5)n+nH2O→nC6H12O6
162n 180n
6.48g 7.2g
故葡萄糖的质量为7.2g+3.6g=10.8g,果糖质量为3.6g,葡萄糖与果糖的摩尔质量相等,其物质的量之比等于质量之比为10.8g:3.6g=3:1,
答:所得溶液中葡萄糖与果糖的物质的量之比是3:1。
20.(1)分液漏斗
(2) 0.5mol
(3) 否 因为D装置中有氧气产生,氧气也可能将I-氧化为I2
(4)用多次萃取、分液,直至溶液中滴加淀粉溶液不显蓝色。向溶液中滴加稀硫酸至溶液的,滴加淀粉溶液,溶液变蓝
【分析】装置A中盛放NaClO3和Na2SO3的固体混合物,当分液漏斗滴加稀硫酸进入A中后,三者混合发生反应,装置C的作用是收集ClO2,多余的ClO2在装置D中被双氧水和氢氧化钠溶液的混合溶液完全吸收生成NaClO2,E装置吸收逸出的少量ClO2气体。
(1)
根据仪器的外形可知, B名称是分液漏斗;
(2)
打开B的活塞,A中有ClO2生成,发生的化学方程式为:, 若制备1 mol ClO2,理论上消耗的硫酸的物质的量为0.5 mol;D中双氧水吸收ClO2,在碱性条件下发生氧化还原反应,生成NaClO2,NaClO2是还原产物,氧气为氧化产物,则 D中所发生反应的离子方程式为;
(3)
E中溶液出现黄色不能说明ClO2未被H2O2和NaOH的混合溶液充分吸收,因为D装置中有氧气产生,氧气也可能将I 氧化为I2;
(4)
由于E装置的溶液中存在 I2,为了防止其干扰检验,检验之前必须除去碘单质,根据已知:当pH≤2.0时,ClO能被I-还原,发生的反应为,因此在除去碘单质的溶液中加入稀硫酸酸化到pH≤2.0,再滴入淀粉,观察是否变蓝即可,故检验E装置溶液中存在少量ClO的实验方案为:取一定体积E装置中的溶液于分液漏斗中用CCl4多次萃取、分液,直至溶液中滴加淀粉溶液不显蓝色,向溶液中滴加稀硫酸至溶液的pH≤2,滴加淀粉溶液,溶液变蓝,则溶液中存在ClO。
21. 浓H2SO4 NaOH溶液 氢气 CO CH4 9/11m g
【分析】CH4燃烧生成二氧化碳和水,H2燃烧生成水,CO燃烧生成二氧化碳;浓硫酸可吸收水分,质量增加,NaOH溶液可以吸收二氧化碳,质量增加。
【详解】(1)如果气体先通过氢氧化钠溶液,水蒸气会溶于氢氧化钠溶液中,导致测量不准确,所以应该先通过浓硫酸再通过氢氧化钠溶液,所以A是浓硫酸,B是氢氧化钠溶液;
(2)若装置A的质量增加,B的质量不变,说明该气体燃烧后只生成水,气体是氢气;
(3)若装置A质量不变,B的质量增加,说明该气体燃烧后只生成二氧化碳,气体是一氧化碳;
(4)若装置A、B的质量都增加,说明该气体燃烧后生成二氧化碳和水,该气体是甲烷,B质量增加的量是二氧化碳,方程式CH4+2O2CO2+2H2O知,A质量增加的量=mg/44×(2×18)=9m/11g。
一、单选题
1.在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,则这个碳原子被称为“手性碳原子”,凡含有手性碳原子的物质一定具有光学活性,如物质有光学活性,发生下列反应后生成的有机物无光学活性的是
①与甲酸发生酯化反应 ②与银氨溶液作用 ③与NaOH溶液反应 ④在催化剂存在下与氢气作用
A.①③ B.②④ C.③④ D.②③
2.人体需要从食物中获取各种营养物质,营养师可结合服务对象的特殊需求进行膳食指导,下列营养物质不能被人体消化吸收的是
A.纤维素 B.油脂 C.蛋白质 D.葡萄糖
3.碳元素的化合价与其形成物质类别的关系如图所示。下列说法错误的是
A.a的硬度可能很大,也可能较小
B.除去c中混有的b,可将混合气体通入NaOH溶液中
C.1mold完全燃烧时,理论上消耗2mol氧气
D.相同条件下,形成的酸式盐的溶解度一定比其形成的正盐大
4.糖类、油脂、蛋白质都是饮食中常见的有机化合物,下列说法正确的是
A.淀粉、纤维素、油脂、蛋白质都属于高分子化合物
B.淀粉和纤维素的化学式都是(C6H10O5)n,二者互为同分异构体
C.向鸡蛋清溶液中加入饱和(NH4)2SO4溶液,会使鸡蛋清变性而出现白色沉淀
D.油脂在一定条件下能水解生成高级脂肪酸和甘油
5.化学与生产、生活密切相关。下列有关说法正确的是
A.我国率先研制了预防新冠病毒的灭活疫苗,灭活疫苗利用了蛋白质变性原理
B.神舟载人飞船搭载的太阳能电池板的核心材料是二氧化硅
C.我国古代精美金属器皿表面使用了鎏金工艺,利用的是电镀原理
D.石墨烯片常用于保暖材料,石墨烯和碳纳米管互为同分异构体
6.下表中所列为古丝绸之路中的部分重要贸易商品,主要成分属于无机物的是
A.瓷器 B.丝绸 C.茶叶 D.白酒
A.A B.B C.C D.D
7.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,2.24L CHCl3的原子总数为0.1NA
B.4.2g C3H6中含有的碳碳双键数一定为0.1NA
C.1mol -OH中电子数为10NA
D.常温常压下,28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
8.多巴是一种有机物,可用于帕金森综合征的治疗,其结构简式如下:
下列关于多巴的叙述中不正确的是
A.该分子含有三种官能团
B.既显酸性,又显碱性
C.一定条件下能发生聚合反应
D.分子中只有6个碳原子共平面
9.要合成带有放射性氧元素(*O)的乙酸乙酯,除必要的反应条件外,下列各组反应物能满足合成要求的是( )
①CH3CO*OH和C2H5OH
②CH3COOH和C2H5*OH
③CH3C*OOH和C2H5OH
④CH3CO*OH和C2H5*OH.
A.①②③④ B.①③④ C.①②④ D.②③④
10.化学与生产、生活、环境等密切相关,下列说法正确的是
A.煤的干馏、石油的分馏和油脂的皂化都属于化学变化
B.聚氯乙烯膜具有塑性和弹性,可用作食品保鲜膜
C.政府鼓励科研和生产部门开发利用太阳能
D.棉、丝、油脂都属于天然高分子化合物
11.下列叙述中,不正确的是( )
A.蔗糖的水解产物,在一定条件下,能发生银镜反应
B.蔗糖是多羟基的醛类化合物
C.蔗糖不是淀粉水解的最终产物
D.麦芽糖是多羟基的醛类化合物
12.氯乙烷是一种沸点较低(沸点为12.27℃),极易挥发的无色液体,常作为运动员肌肉挫伤或扭伤的冷冻麻醉剂,下列有关氯乙烷的制法,最好的是
A.乙烷与氯气发生取代反应 B.乙烯与氯气发生加成反应
C.乙烷与氯化氢混合 D.乙烯与氯化氢发生加成反应
13.下列有关实验描述正确的是
A.将木炭和浓硫酸共热产生的气体通入到澄清石灰水中,澄清石灰水变浑浊,说明反应产生了CO2
B.在试管中加入2mL淀粉溶液和少量稀硫酸,加热3-4分钟,冷却后加入少量新制悬浊液,加热后会产生砖红色沉淀
C.向某溶液中滴加溶液,再滴加足量的稀硝酸,有白色沉淀产生,该溶液中一定含有
D.向某溶液中滴加较浓NaOH溶液,加热后若能产生使湿润红色石蕊试纸变蓝的气体,说明溶液中
14.化学物质在体育领域有广泛用途。下列说法错误的是
A.涤纶可作为制作运动服的材料
B.纤维素可以为运动员提供能量
C.木糖醇可用作运动饮料的甜味剂
D.“复方氯乙烷气雾剂”可用于运动中急性损伤的镇痛
15.下列关于乙醇和乙酸的说法中不正确的是
A.它们都能与金属钠反应放出氢气
B.它们都能发生酯化反应和氧化反应
C.乙醇能发生取代反应,乙酸不能发生取代反应
D.用重铬酸钾溶液可以证明乙醇的还原性
二、填空题
16.某学生进行淀粉的水解实验,操作如下:
(1)取少量淀粉溶液,加入3~5滴稀硫酸,加热几分钟,淀粉水解反应的化学方程式为_______。
(2)取少量冷却后的水解液,向其中加入新制氢氧化铜悬浊液,加热至沸腾后无砖红色沉淀生成。他由此认为:水解产物中没有葡萄糖。他的结论是否正确?_______,理由是_______。
(3)用5t含淀粉80%的粮食,可以制得葡萄糖的质量为_______。(假设淀粉的转化率为81%)
(4)氨基酸是组成蛋白质的基本结构单元,人体中共有二十多种氨基酸,其中人体自身_______(填“能”或“不能”)合成的氨基酸称为人体必需氨基酸。
(5)某蛋白质分子中含铁0.28%,测知该分子的相对分子质量为20000,则该分子中含铁原子_______个。(已知铁的相对原子质量为56)。
17.煤干馏得到的煤焦油可以分离出来,苯是无色无味的液态烃。( )
三、计算题
18.在120℃、101kPa条件下,由H2、CH4组成的混合气体amL,通入一定量(设为VmL)氧气使其完全燃烧。
(1)若amL混合气体完全燃烧消耗相同条件下氧气的体积也为amL(即V=a),则原混合气体中CH4的体积分数是_______。
(2)若完全燃烧生成CO2和H2O(g)的总体积在相同条件下为2amL,则原混合气体中CH4的体积分数是_______。
(3)若原混合气体完全燃烧时,生成的气体只有CO2和H2O(g)则V的取值范围是_______。
19.将6.48g淀粉和6. 84g蔗糖的混合物加水,一定条件下使其完全水解,所得溶液中葡萄糖与果糖的物质的量之比是多少______?
四、实验题
20.ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。某兴趣小组通过下图所示装置(夹持装置略)对其进行制备、收集、吸收并制取NaClO2。
(1)仪器的B名称是___________。
(2)打开B的活塞,A中有ClO2生成,若制备1molClO2,理论上消耗的硫酸的物质的量为___________;D中吸收ClO2后生成NaClO2,写出D中所发生反应的离子方程式:___________。
(3)E中溶液出现黄色___________(填“能”或“否”)说明ClO2未被和NaOH的混合溶液充分吸收,说明理由:___________。
(4)已知:当时,ClO能被I-还原。E装置吸收逸出的少量ClO2气体后所得溶液(pH为5.5~6.5)中存在少量ClO。请补充完整检验E装置溶液中存在少量ClO的实验方案:取一定体积E装置中的溶液于分液漏斗中,___________,则溶液中存在ClO。(实验中须使用的试剂有:CCl4、稀硫酸、淀粉溶液)
21.为了确定三种可燃性气体:CH4、H2和CO(简称试验气),分别将它们在O2中燃烧,再将燃烧后的产物分别依次通过图中A、B两个洗气瓶.
试回答:
(1)装置A中的液体是______,装置B中的液体是______;
(2)若装置A的质量增加,B的质量不变,则待测试验气是______;
(3)若装置A质量不变,B的质量增加,则试验气是______;
(4)若装置A、B的质量都增加,则试验气是______,若这时装置B的质量增加m g,则装置A的质量增加______.
参考答案:
1.C
【详解】①与甲酸发生酯化反应,生成,仍含手性碳原子,仍有光学活性;
②与银氨溶液作用生成,仍含手性碳原子,仍有光学活性;
③与NaOH溶液发生水解反应生成,原手性C原子连接2个-CH2OH,不含手性碳原子,失去光学活性;
④在催化剂存在下与氢气加成后生成的中,原手性C原子连接2个-CH2OH,不含手性碳原子,失去光学活性;
根据分析,③④的产物中不再含手性碳原子,无光学活性,答案为C。
2.A
【详解】人体内不含消化纤维素的酶,所以纤维素不能被人体消化吸收,而油脂、蛋白质、葡萄糖均能被人体消化吸收,故选A。
3.D
【分析】a为C,b为CO,c为CO2,d为CH4,e为H2CO3,f为碳酸盐。
【详解】A.a为C,若a为石墨,硬度很小,若a为金刚石,硬度很大,A正确;
B.除去CO中混有的CO2,CO2能与NaOH反应,可将混合气体通入NaOH溶液中,B正确;
C.甲烷完全燃烧的化学方程式为:,1molCH4完全燃烧时,理论上消耗2molO2,C正确;
D.相同条件下,的溶解度比的溶解度小,D错误;
故选D。
4.D
【详解】A.淀粉纤维素蛋白质均为天然高分子化合物,而油脂不是高分子,A项错误;
B.纤维素和淀粉虽然均写为(C6H10O5)n,但化学式中它们的n值不同,所以分子式不同不是同分异构体,B项错误;
C.鸡蛋清为蛋白质,向其中加入盐溶液可以发生盐析导致蛋白质溶解性降低析出固体,C项错误;
D.油脂中含有酯基-COOR可以在酸性条件下发生水解,生成高级脂肪酸和甘油,D项正确;
故选B。
5.A
【详解】A.病毒的主要成分为蛋白质,灭活疫苗利用了蛋白质变性原理,A选项正确;
B.单质硅是太阳能电池板的核心材料,B选项错误;
C.古代没有电镀工艺,C选项错误;
D.石墨烯和碳纳米管是由碳元素组成的不同性质的单质,互为同素异形体,D选项错误;
故选A。
6.A
【详解】A.瓷器的主要成分是硅酸盐,属于无机物;
B.丝绸的主要成分是蛋白质,属于有机物;
C.茶叶主要含有茶多酚,是茶叶中多酚类物质的总称,包括黄烷醇类、花色苷类、黄酮类、黄酮醇类和酚酸类等,属于有机物;
D.白酒的主要成分是乙醇,属于有机物;
故选A。
7.D
【详解】A.标准状况下,CHCl3是液态,无法使用Vm=22.4L/mol计算,故A错误;
B.4.2g C3H6可以是环丙烷,没有碳碳双键,B错误;
C.1mol -OH中电子数为9NA,C错误;
D.乙烯和环丁烷(C4H8)的最简式相同,故质量一定含有的碳原子数为定值,计算为2NA,D正确;
故选D。
8.D
【详解】A.由结构简式可知,L—多巴分子中含有羟基、氨基,羧基三种官能团,故A正确;
B.由结构简式可知,多巴分子中含有羧基和氨基,既显酸性又显碱性,故B正确;
C.由结构简式可知,L—多巴分子中含有羟基、氨基,羧基三种官能团,一定条件下羧基能与羟基或氨基能发生缩聚反应生成高分子化合物,故C正确;
D.由结构简式可知,L—多巴分子中含有苯环,与苯环相连的碳原子与苯环共平面,则分子中至少有7个碳原子共平面,故D错误;
故选D。
9.D
【分析】根据酯化反应的原理“酸脱羟基醇脱氢”,乙酸乙酯的两个氧原子分别来乙酸的碳氧双键中的O(羰基中的O)和乙醇中羟基中的O,即只要乙酸的碳氧双键的氧原子或乙醇中羟基的氧原子含有放射性氧元素(*O),生成的乙酸乙酯就含有放射性氧元素(*O)。
【详解】①CH3CO*OH和C2H5OH,酯化反应中,乙酸中的羟基脱去生成了水,所以乙酸乙酯中不会含有放射性氧元素(*O),故①错误;
②CH3COOH和C2H5*OH,乙醇在酯化反应中只是失去氢原子,乙醇中的放射性氧元素(*O)会保留在乙酸乙酯中,故②正确;
③CH3C*OOH和C2H5OH,乙酸中的碳氧双键中的放射性氧元素(*O)会保留在乙酸乙酯中,即生成的乙酸乙酯含含放射性氧元素(*O),故③正确;
④CH3CO*OH和C2H5*OH,乙酸的羟基中的放射性氧元素(*O)不会保留在乙酸乙酯中,但是乙醇中的放射性氧元素(*O)会保留在乙酸乙酯中,即生成的乙酸乙酯含含放射性氧元素(*O),故④正确;
答案选D。
【点睛】本题考查了酯化反应的原理,题目难度中等,注意熟练掌握酯化反应的原理“酸脱羟基醇脱氢”,试题具有新颖性,是一道不错的题目,有利于培养学生的分析能力、理解能力和灵活应用所学知识解决实际问题的能力。
10.C
【详解】A.石油的分馏属于物理变化,故A不选;
B.聚氯乙烯加热时,会释放有毒物质,不能用于食品包装,故B不选;
C.太阳能属于可再生的清洁能源,政府鼓励科研和生产部门开发利用太阳能,故选C;
D.高分子化合物的相对分子质量为几万甚至几百万,油脂是高级脂肪酸甘油酯,不属于高分子化合物,D错。
答案选C
11.B
【详解】A、蔗糖在硫酸催化作用下,发生水解,生成葡萄糖和果糖,葡萄糖含有醛基,能发生银镜反应,A正确;
B、蔗糖分子中不含醛基,不发生银镜反应,也不能还原新制的氢氧化铜,B错误;
C、淀粉是最重要的多糖,在催化剂存在和加热的条件下逐步水解,最终生成还原性单糖--葡萄糖;蔗糖不是淀粉水解的产物,C正确;
D、蔗糖和麦芽糖的分子式均为C12H22O11,分子式相同但结构不同,蔗糖分子中不含醛基,麦芽糖分子中含有醛基,具有还原性,所以蔗糖与麦芽互为同分异构体,D正确;
正确选项B。
【点睛】糖类中,葡萄糖和果糖属于还原性糖,不能发生水解;蔗糖和麦芽糖属于二糖,都能发生水解,但是麦芽糖属于还原性糖;淀粉和纤维素属于多糖,都能发生水解,但都不是还原性糖,二者属于天然高分子。
12.D
【详解】A.乙烷与氯气发生取代反应,不易控制取代个数;
B.乙烯与氯气发生加成反应,得到的是二氯乙烷;
C.乙烷与氯化氢混合,两者不反应,得不到氯乙烷;
D.乙烯与氯化氢发生加成反应,产物是氯乙烷;
故最后的制法选择D。
13.D
【详解】A.木炭与浓硫酸反应C+H2SO4(浓)CO2↑+SO2↑+H2O,CO2、SO2都能使澄清石灰水变浑浊,故A错误;
B.淀粉水解最终产物是葡萄糖,验证葡萄糖与新制氢氧化铜悬浊液反应,环境应是碱性,但题中没有中和稀硫酸,使溶液显碱性,因此加热后不能观察到砖红色沉淀产生,故B错误;
C.NO(H+)具有强氧化性,能将SO氧化成SO,同样也会产生白色沉淀,即该溶液中可能含有SO,故C错误;
D.氨气是中学阶段学过唯一一种能使湿润红色石蕊试纸变蓝的气体,因此该操作能够说明原溶液中含有,故D正确;
答案为D。
14.B
【详解】A.涤纶属于合成纤维,其抗皱性和保形性很好,具有较高的强度与弹性恢复能力,可作为制作运动服的材料,A正确;
B.人体没有分解纤维素的酶,故纤维素不能为运动员提供能量,B错误;
C.木糖醇具有甜味,可用作运动饮料的甜味剂,C正确;
D.氯乙烷具有冷冻麻醉作用,从而使局部产生快速镇痛效果,所以“复方氯乙烷气雾剂”可用于运动中急性损伤的阵痛,D正确;
答案选B。
15.C
【详解】A.乙醇和乙酸分别含有羟基,羧基,都可以和钠反应生成氢气,故A正确;
B.酸和醇一定条件下发生酯化反应,醇能燃烧,属于氧化反应,乙酸可以被过氧化氢氧化生成过氧乙酸,也属于氧化反应,故B正确;
C.乙酸、乙醇的酯化反应就是取代反应,即二者都能发生取代反应,故C错误;
D.重铬酸钾(K2Cr2O7)可以检测司机是否酒后驾车,酒精中的乙醇能使红色的重铬酸钾变为绿色的硫酸铬[Cr2(SO4)3],证明乙醇的还原性,故D正确;
故选:C。
16.(1)
(2) 不正确 没有向水解液中加入氢氧化钠溶液调节溶液至碱性
(3)3.6t
(4)不能
(5)1
【详解】(1)淀粉为多糖,在稀硫酸做催化剂的条件下,淀粉溶液中淀粉共热发生水解反应生成葡萄糖,反应的化学方程式为,故答案为:;
(2)葡萄糖在碱性条件下才能与新制氢氧化铜悬浊液共热发生氧化反应,所以淀粉在溶液中发生水解后,若没有加入氢氧化钠溶液中和稀硫酸,直接加入新制氢氧化铜悬浊液共热不可能有砖红色沉淀生成,所以无砖红色沉淀生成不能确定水解产物中是否含有葡萄糖,故答案为:不正确;没有向水解液中加入氢氧化钠溶液调节溶液至碱性;
(3)由淀粉的转化率为81%可知,5t含淀粉80%的粮食可以制得葡萄糖的质量为×n×180g/mol×10—6t/g=3.6t,故答案为:3.6t;
(4)人体中共有二十多种氨基酸,其中人体自身不能合成的氨基酸称为人体必需氨基酸,故答案为:不能;
(5)由相对分子质量为20000的蛋白质分子中含铁0.28%可知,蛋白质分子中含铁原子个数为=1,故答案为:1。
17.错误
【详解】煤干馏得到的煤焦油可以分离出苯,苯为具有芳香气味的液体,故错误。
18.(1)33.3%
(2)50%
(3)0.5a
设氢气的体积为x,CH4的体积为y,则,解得y∶x=1∶2,所以CH4的体积分数为33.3%。故答案为:33.3%;
(2)
设H2燃烧生成H2O(g)的体积为x,CH4的体积为y,CH4燃烧生成2y体积的H2O(g)和y体积的CO2所以x+3y=2(x+y),解得y∶x=1∶1,所以CH4的体积分数为50%。故答案为:50%;
(3)
若a mL全部是H2则完全燃烧时消耗O2的体积为0.5a mL,若a mL全部是CH4则完全燃烧时消耗O2的体积为2a mL,所以得0.5a
【分析】根据蔗糖水解的化学方程式C12H22O11+H2O→C6H12O6(葡萄糖)+C6H12O6(果糖)和淀粉水解的化学方程式(C6H10O5)n+nH2O→nC6H12O6,计算生成的葡萄糖与果糖的质量,二者摩尔质量相等,物质的量之比等于质量之比,据此计算判断。
【详解】C12H22O11+H2O→C6H12O6(葡萄糖)+C6H12O6(果糖)
342 180 180
6.84g 3.6g 3.6g
(C6H10O5)n+nH2O→nC6H12O6
162n 180n
6.48g 7.2g
故葡萄糖的质量为7.2g+3.6g=10.8g,果糖质量为3.6g,葡萄糖与果糖的摩尔质量相等,其物质的量之比等于质量之比为10.8g:3.6g=3:1,
答:所得溶液中葡萄糖与果糖的物质的量之比是3:1。
20.(1)分液漏斗
(2) 0.5mol
(3) 否 因为D装置中有氧气产生,氧气也可能将I-氧化为I2
(4)用多次萃取、分液,直至溶液中滴加淀粉溶液不显蓝色。向溶液中滴加稀硫酸至溶液的,滴加淀粉溶液,溶液变蓝
【分析】装置A中盛放NaClO3和Na2SO3的固体混合物,当分液漏斗滴加稀硫酸进入A中后,三者混合发生反应,装置C的作用是收集ClO2,多余的ClO2在装置D中被双氧水和氢氧化钠溶液的混合溶液完全吸收生成NaClO2,E装置吸收逸出的少量ClO2气体。
(1)
根据仪器的外形可知, B名称是分液漏斗;
(2)
打开B的活塞,A中有ClO2生成,发生的化学方程式为:, 若制备1 mol ClO2,理论上消耗的硫酸的物质的量为0.5 mol;D中双氧水吸收ClO2,在碱性条件下发生氧化还原反应,生成NaClO2,NaClO2是还原产物,氧气为氧化产物,则 D中所发生反应的离子方程式为;
(3)
E中溶液出现黄色不能说明ClO2未被H2O2和NaOH的混合溶液充分吸收,因为D装置中有氧气产生,氧气也可能将I 氧化为I2;
(4)
由于E装置的溶液中存在 I2,为了防止其干扰检验,检验之前必须除去碘单质,根据已知:当pH≤2.0时,ClO能被I-还原,发生的反应为,因此在除去碘单质的溶液中加入稀硫酸酸化到pH≤2.0,再滴入淀粉,观察是否变蓝即可,故检验E装置溶液中存在少量ClO的实验方案为:取一定体积E装置中的溶液于分液漏斗中用CCl4多次萃取、分液,直至溶液中滴加淀粉溶液不显蓝色,向溶液中滴加稀硫酸至溶液的pH≤2,滴加淀粉溶液,溶液变蓝,则溶液中存在ClO。
21. 浓H2SO4 NaOH溶液 氢气 CO CH4 9/11m g
【分析】CH4燃烧生成二氧化碳和水,H2燃烧生成水,CO燃烧生成二氧化碳;浓硫酸可吸收水分,质量增加,NaOH溶液可以吸收二氧化碳,质量增加。
【详解】(1)如果气体先通过氢氧化钠溶液,水蒸气会溶于氢氧化钠溶液中,导致测量不准确,所以应该先通过浓硫酸再通过氢氧化钠溶液,所以A是浓硫酸,B是氢氧化钠溶液;
(2)若装置A的质量增加,B的质量不变,说明该气体燃烧后只生成水,气体是氢气;
(3)若装置A质量不变,B的质量增加,说明该气体燃烧后只生成二氧化碳,气体是一氧化碳;
(4)若装置A、B的质量都增加,说明该气体燃烧后生成二氧化碳和水,该气体是甲烷,B质量增加的量是二氧化碳,方程式CH4+2O2CO2+2H2O知,A质量增加的量=mg/44×(2×18)=9m/11g。
