化学人教版(2019)选择性必修3 3.5有机合成(共29张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 3.5有机合成(共29张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-29 00:00:00 | ||
图片预览


文档简介
(共29张PPT)
人教版选择性必修三
3.5有机合成
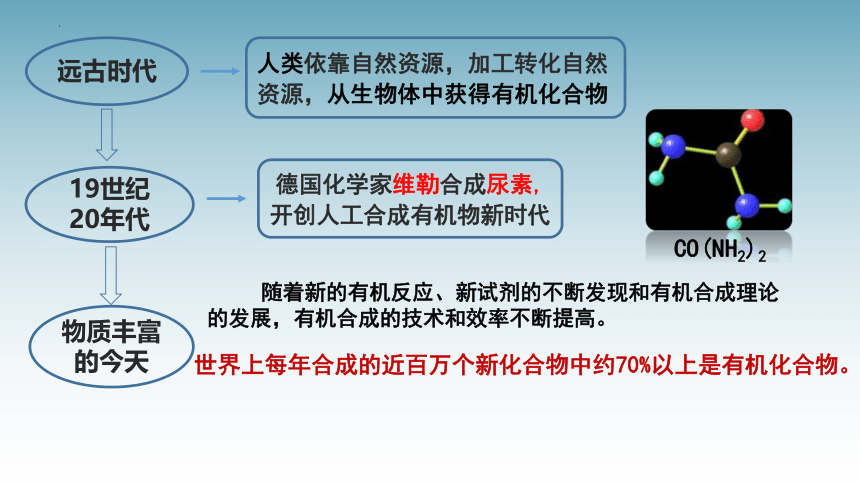
远古时代
19世纪20年代
物质丰富的今天
人类依靠自然资源,加工转化自然资源,从生物体中获得有机化合物
德国化学家维勒合成尿素,开创人工合成有机物新时代
世界上每年合成的近百万个新化合物中约70%以上是有机化合物。
CO(NH2)2
随着新的有机反应、新试剂的不断发现和有机合成理论的发展,有机合成的技术和效率不断提高。
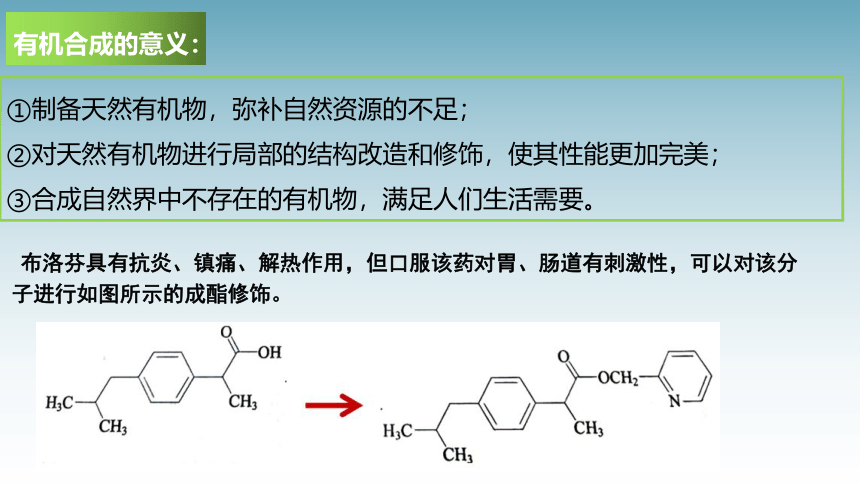
有机合成的意义:
①制备天然有机物,弥补自然资源的不足;
②对天然有机物进行局部的结构改造和修饰,使其性能更加完美;
③合成自然界中不存在的有机物,满足人们生活需要。
布洛芬具有抗炎、镇痛、解热作用,但口服该药对胃、肠道有刺激性,可以对该分子进行如图所示的成酯修饰。
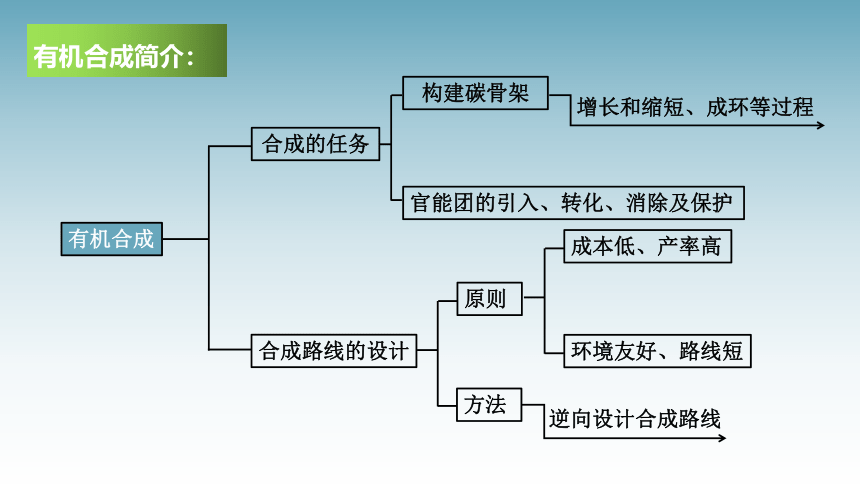
有机合成
合成的任务
合成路线的设计
构建碳骨架
官能团的引入、转化、消除及保护
原则
成本低、产率高
环境友好、路线短
方法
逆向设计合成路线
增长和缩短、成环等过程
有机合成简介:
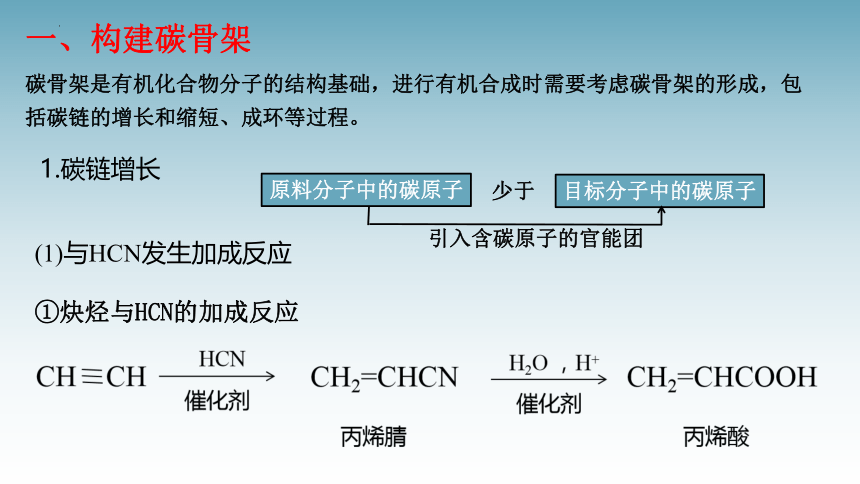
一、构建碳骨架
碳骨架是有机化合物分子的结构基础,进行有机合成时需要考虑碳骨架的形成,包括碳链的增长和缩短、成环等过程。
原料分子中的碳原子
目标分子中的碳原子
少于
引入含碳原子的官能团
1.碳链增长
(1)与HCN发生加成反应
①炔烃与HCN的加成反应
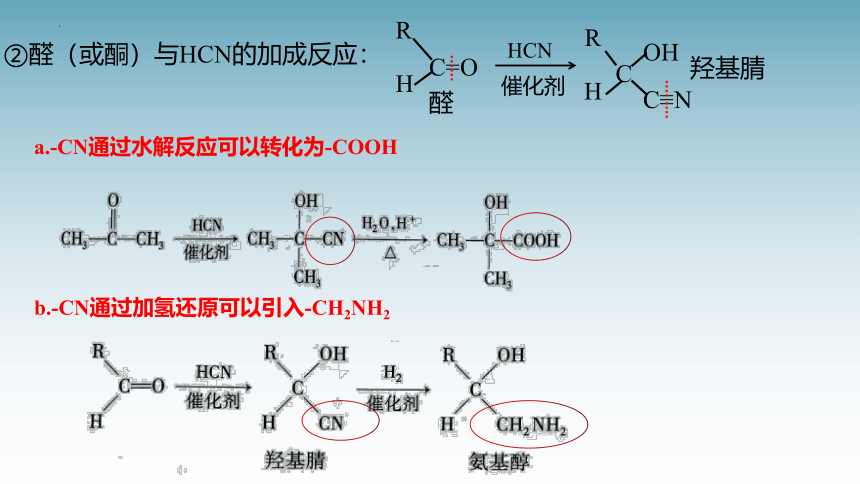
②醛(或酮)与HCN的加成反应:
C=O
R
H
C
R
H
OH
C≡N
HCN
催化剂
羟基腈
醛
a.-CN通过水解反应可以转化为-COOH
b.-CN通过加氢还原可以引入-CH2NH2
(2)羟醛缩合反应
醛分子中在醛基邻位碳原子上的氢原子(α-H)受羰基吸电子的影响,具有一定的活泼性。分子内含有α-H的醛在一定条件下可与醛基发生加成反应,生成β-羟基醛,该产物易失水,得到α,β-不饱和醛。这类反应被称为羟醛缩合反应,是一种常用的增长碳链的方法。
催化剂
α
CH3— C—CH2CHO
OH
H
催化剂
△
CH3—CH=CHCHO+H2O
α
α
β
β
CH3—C—H+CH3CHO
O
实质:先发生加成反应,再发生消去反应。
羟醛缩合反应:至少一种醛含有α-H!可用来成倍增长碳链。
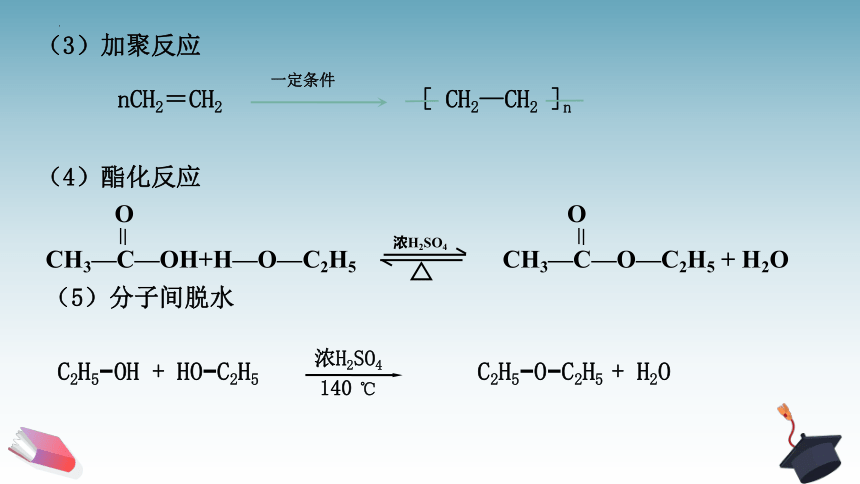
(3)加聚反应
(4)酯化反应
(5)分子间脱水
nCH2=CH2 [ CH2—CH2 ]n
一定条件
C2H5 OH + HO C2H5 C2H5 O C2H5 + H2O
浓H2SO4
140 ℃
O O
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
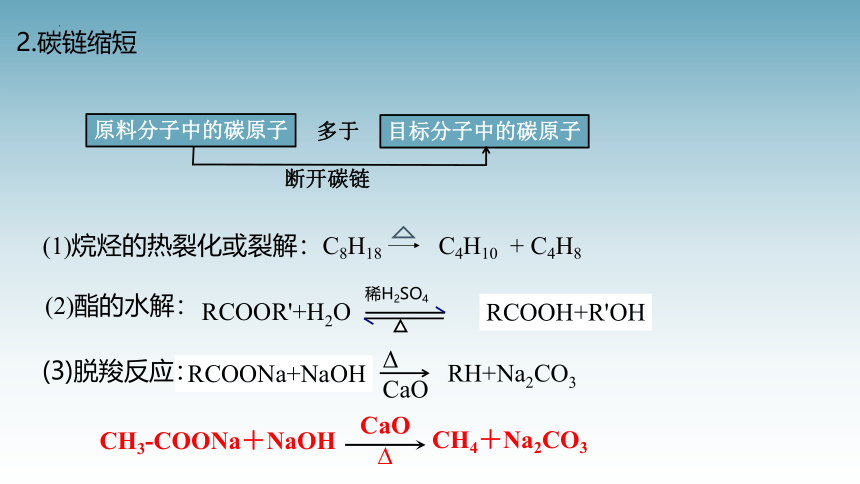
2.碳链缩短
(1)烷烃的热裂化或裂解:C8H18 C4H10 + C4H8
RCOONa+NaOH
RCOOR'+H2O
(3)脱羧反应:
(2)酯的水解:
稀H2SO4
Δ
CaO
RCOOH+R'OH
RH+Na2CO3
CH3-COONa+NaOH
CaO
CH4+Na2CO3
原料分子中的碳原子
目标分子中的碳原子
多于
断开碳链
(4)烯烃、炔烃及芳香烃的侧链被酸性高锰酸钾溶液氧化
①烯烃:
二氢成CO2
一氢成酸
无氢成酮
CH≡C—R
KMnO4
H+
CO2+RCOOH
②炔烃:
C=CH—R
R'
R''
KMnO4
H+
C=O+R—COOH
R'
R''
一氢成CO2
无氢成酸
③芳香化合物的侧链:
与苯环相连的碳原子上至少连有一个氢原子才能被酸性KMnO4氧化。
CH—R
R'
KMnO4
H+
COOH
(5)烯烃的臭氧化
3.碳链成环
COOH
COOH
CH2OH
CH2OH
+
+ 2H2O
COOCH2
COOCH2
浓硫酸
△
(1)形成环酯
CH3CHCH2CH2C—OH
O
═
OH
CH—CH2
O CH2
C
O
═
H3C
+H2O
2CH3—CH—C—OH
O
═
OH
+2H2O
CH3
O
C
═
O
O
C
═
O
CH3
一.构建碳骨架
3.碳链成环
(2)形成环醚
+ H2O
浓硫酸
CH2OH
CH2OH
HOCH2
HOCH2
+
H2C
H2C
CH2
CH2
O
O
CH2═CH2
OH
OH
浓H2SO4
CH2—CH2
O
+H2O
3CH2═O
O
O
O
(3)形成环酸酐
HOOC—CH2CH2—COOH
丁二酸
O
O
O
═
═
+H2O
共轭二烯烃(含有两个碳碳双键,且两个双键被一个单键隔开的烯烃,如1,3-丁二烯)与含碳碳双键的化合物在一定条件下发生双烯合成反应(Diels-Alder reaction),得到环加成产物,构建了环状碳骨架。
COOH
+
△
COOH
1
2
3
4
6
5
1
2
3
4
6
5
(4)共轭二烯烃加成
+
CHO
△
CHO
1.引入碳碳双键
(1)醇或卤代烃的消去反应
CH3CH2OH
CH2=CH2↑+H2O
CH3CH2Br+NaOH CH2=CH2↑+NaBr+H2O
乙醇
△
(2)炔烃的不完全加成反应
CH≡CH+HCl
CH2=CHCl
二、官能团的引入
2.引入碳卤键的方法
(1)醇(或酚)的取代
C2H5 OH + HBr C2H5Br + H2O
△
+3Br2
+3HBr
(过量)
OH
OH
Br
Br
Br
(2)烯烃(或炔烃)的与X2、HX加成
CH3CH=CH2+Br2 CH3CHBrCH2Br
(3)烷烃(或苯及苯的同系物)的取代
CH4 + Cl2 CH3Cl + HCl
光
(1)烯烃与水的加成
(3)卤代烃的水解
CH3CH2CH2Cl + NaOH CH3CH2CH2OH + NaCl
H2O
△
3.羟基的引入
(4)酯的水解
CH3COOC2H5+NaOH CH3COONa+C2H5OH
△
CH3COOC2H5+H2O CH3COOH+C2H5OH
稀硫酸
△
CH3CH=CH2+H2O CH3—CH—CH3
催化剂
加热、加压
OH
(2)醛(酮)与H2的加成
O
C
CH3
CH3
+
H2
催化剂
OH
CH
CH3
CH3
CH3CHO +H2 CH3CH2OH
催化剂
Δ
酚盐溶液与CO2、HCl等反应
+NaCl
OH
+ HCl
ONa
+NaHCO3
OH
+ CO2+H2O
ONa
(5)酚羟基的引入方法
4.引入羧基的方法
(1)醛的氧化反应
(2)酯、酰胺的水解反应
2CH3CHO+O2
2CH3COOH
CH3COOC2H5+H2O CH3COOH+C2H5OH
稀硫酸
△
(3)某些烯烃、炔烃、芳香烃被酸性高锰酸钾溶液氧化的反应
C=CH—R
R'
R''
KMnO4
H+
C=O+R—COOH
R'
R''
CH≡C—R
KMnO4
H+
CO2+RCOOH
CH—
R
R'
KMnO4
H+
HOOC—
1.利用衍变关系进行转化
三、官能团的转化
2.增加官能团个数
R-CH2-CH2OH
R-CH=CH2
CH3CH2CH2OH
CH3CH=CH2
3.改变官能团位置
CH2=CHCH2OH
CH2=CHCOOH
KMnO4/H+
1.碳碳双键的保护
三、官能团的保护
:通常用加成反应保护,消去反应恢复。
HBr
催化剂
CH3CHCH2OH
Br
KMnO4/H+
CH3CHCOOH
Br
NaOH/醇
CH2=CHCOONa
H+
碳碳双键恢复
碳碳双键保护
含有多个官能团的有机物在进行反应时,非目标官能团也可能受到影响。此时需要将该官能团保护起来,先将其转化为不受该反应影响的其他官能团,反应后再转化复原。如—OH保护过程:
四、官能团的保护
碳碳双键易被氧化通常用加成反应保护,消去反应恢复。
C=C
+HX
—C—C—
X
H
NaOH/醇
△
C=C
C=C
+H2O
—C—C—
OH
H
浓硫酸
△
C=C
1.碳碳双键的保护
因酚羟基易被氧化,故在加入氧化剂之前将-OH转化为醚键(-OCH3),待其他基氧化后,再酸化使其转化为-OH,其过程表示为
OCH3
COOH
OH
COOH
CH3I
KMnO4/H+
H+
OCH3
CH3
OH
CH3
2.酚羟基的保护
ONa
COOH
KMnO4/H+
ONa
CH3
NaOH
H+
—OH转化为—ONa
人教版选择性必修三
3.5有机合成
远古时代
19世纪20年代
物质丰富的今天
人类依靠自然资源,加工转化自然资源,从生物体中获得有机化合物
德国化学家维勒合成尿素,开创人工合成有机物新时代
世界上每年合成的近百万个新化合物中约70%以上是有机化合物。
CO(NH2)2
随着新的有机反应、新试剂的不断发现和有机合成理论的发展,有机合成的技术和效率不断提高。
有机合成的意义:
①制备天然有机物,弥补自然资源的不足;
②对天然有机物进行局部的结构改造和修饰,使其性能更加完美;
③合成自然界中不存在的有机物,满足人们生活需要。
布洛芬具有抗炎、镇痛、解热作用,但口服该药对胃、肠道有刺激性,可以对该分子进行如图所示的成酯修饰。
有机合成
合成的任务
合成路线的设计
构建碳骨架
官能团的引入、转化、消除及保护
原则
成本低、产率高
环境友好、路线短
方法
逆向设计合成路线
增长和缩短、成环等过程
有机合成简介:
一、构建碳骨架
碳骨架是有机化合物分子的结构基础,进行有机合成时需要考虑碳骨架的形成,包括碳链的增长和缩短、成环等过程。
原料分子中的碳原子
目标分子中的碳原子
少于
引入含碳原子的官能团
1.碳链增长
(1)与HCN发生加成反应
①炔烃与HCN的加成反应
②醛(或酮)与HCN的加成反应:
C=O
R
H
C
R
H
OH
C≡N
HCN
催化剂
羟基腈
醛
a.-CN通过水解反应可以转化为-COOH
b.-CN通过加氢还原可以引入-CH2NH2
(2)羟醛缩合反应
醛分子中在醛基邻位碳原子上的氢原子(α-H)受羰基吸电子的影响,具有一定的活泼性。分子内含有α-H的醛在一定条件下可与醛基发生加成反应,生成β-羟基醛,该产物易失水,得到α,β-不饱和醛。这类反应被称为羟醛缩合反应,是一种常用的增长碳链的方法。
催化剂
α
CH3— C—CH2CHO
OH
H
催化剂
△
CH3—CH=CHCHO+H2O
α
α
β
β
CH3—C—H+CH3CHO
O
实质:先发生加成反应,再发生消去反应。
羟醛缩合反应:至少一种醛含有α-H!可用来成倍增长碳链。
(3)加聚反应
(4)酯化反应
(5)分子间脱水
nCH2=CH2 [ CH2—CH2 ]n
一定条件
C2H5 OH + HO C2H5 C2H5 O C2H5 + H2O
浓H2SO4
140 ℃
O O
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
2.碳链缩短
(1)烷烃的热裂化或裂解:C8H18 C4H10 + C4H8
RCOONa+NaOH
RCOOR'+H2O
(3)脱羧反应:
(2)酯的水解:
稀H2SO4
Δ
CaO
RCOOH+R'OH
RH+Na2CO3
CH3-COONa+NaOH
CaO
CH4+Na2CO3
原料分子中的碳原子
目标分子中的碳原子
多于
断开碳链
(4)烯烃、炔烃及芳香烃的侧链被酸性高锰酸钾溶液氧化
①烯烃:
二氢成CO2
一氢成酸
无氢成酮
CH≡C—R
KMnO4
H+
CO2+RCOOH
②炔烃:
C=CH—R
R'
R''
KMnO4
H+
C=O+R—COOH
R'
R''
一氢成CO2
无氢成酸
③芳香化合物的侧链:
与苯环相连的碳原子上至少连有一个氢原子才能被酸性KMnO4氧化。
CH—R
R'
KMnO4
H+
COOH
(5)烯烃的臭氧化
3.碳链成环
COOH
COOH
CH2OH
CH2OH
+
+ 2H2O
COOCH2
COOCH2
浓硫酸
△
(1)形成环酯
CH3CHCH2CH2C—OH
O
═
OH
CH—CH2
O CH2
C
O
═
H3C
+H2O
2CH3—CH—C—OH
O
═
OH
+2H2O
CH3
O
C
═
O
O
C
═
O
CH3
一.构建碳骨架
3.碳链成环
(2)形成环醚
+ H2O
浓硫酸
CH2OH
CH2OH
HOCH2
HOCH2
+
H2C
H2C
CH2
CH2
O
O
CH2═CH2
OH
OH
浓H2SO4
CH2—CH2
O
+H2O
3CH2═O
O
O
O
(3)形成环酸酐
HOOC—CH2CH2—COOH
丁二酸
O
O
O
═
═
+H2O
共轭二烯烃(含有两个碳碳双键,且两个双键被一个单键隔开的烯烃,如1,3-丁二烯)与含碳碳双键的化合物在一定条件下发生双烯合成反应(Diels-Alder reaction),得到环加成产物,构建了环状碳骨架。
COOH
+
△
COOH
1
2
3
4
6
5
1
2
3
4
6
5
(4)共轭二烯烃加成
+
CHO
△
CHO
1.引入碳碳双键
(1)醇或卤代烃的消去反应
CH3CH2OH
CH2=CH2↑+H2O
CH3CH2Br+NaOH CH2=CH2↑+NaBr+H2O
乙醇
△
(2)炔烃的不完全加成反应
CH≡CH+HCl
CH2=CHCl
二、官能团的引入
2.引入碳卤键的方法
(1)醇(或酚)的取代
C2H5 OH + HBr C2H5Br + H2O
△
+3Br2
+3HBr
(过量)
OH
OH
Br
Br
Br
(2)烯烃(或炔烃)的与X2、HX加成
CH3CH=CH2+Br2 CH3CHBrCH2Br
(3)烷烃(或苯及苯的同系物)的取代
CH4 + Cl2 CH3Cl + HCl
光
(1)烯烃与水的加成
(3)卤代烃的水解
CH3CH2CH2Cl + NaOH CH3CH2CH2OH + NaCl
H2O
△
3.羟基的引入
(4)酯的水解
CH3COOC2H5+NaOH CH3COONa+C2H5OH
△
CH3COOC2H5+H2O CH3COOH+C2H5OH
稀硫酸
△
CH3CH=CH2+H2O CH3—CH—CH3
催化剂
加热、加压
OH
(2)醛(酮)与H2的加成
O
C
CH3
CH3
+
H2
催化剂
OH
CH
CH3
CH3
CH3CHO +H2 CH3CH2OH
催化剂
Δ
酚盐溶液与CO2、HCl等反应
+NaCl
OH
+ HCl
ONa
+NaHCO3
OH
+ CO2+H2O
ONa
(5)酚羟基的引入方法
4.引入羧基的方法
(1)醛的氧化反应
(2)酯、酰胺的水解反应
2CH3CHO+O2
2CH3COOH
CH3COOC2H5+H2O CH3COOH+C2H5OH
稀硫酸
△
(3)某些烯烃、炔烃、芳香烃被酸性高锰酸钾溶液氧化的反应
C=CH—R
R'
R''
KMnO4
H+
C=O+R—COOH
R'
R''
CH≡C—R
KMnO4
H+
CO2+RCOOH
CH—
R
R'
KMnO4
H+
HOOC—
1.利用衍变关系进行转化
三、官能团的转化
2.增加官能团个数
R-CH2-CH2OH
R-CH=CH2
CH3CH2CH2OH
CH3CH=CH2
3.改变官能团位置
CH2=CHCH2OH
CH2=CHCOOH
KMnO4/H+
1.碳碳双键的保护
三、官能团的保护
:通常用加成反应保护,消去反应恢复。
HBr
催化剂
CH3CHCH2OH
Br
KMnO4/H+
CH3CHCOOH
Br
NaOH/醇
CH2=CHCOONa
H+
碳碳双键恢复
碳碳双键保护
含有多个官能团的有机物在进行反应时,非目标官能团也可能受到影响。此时需要将该官能团保护起来,先将其转化为不受该反应影响的其他官能团,反应后再转化复原。如—OH保护过程:
四、官能团的保护
碳碳双键易被氧化通常用加成反应保护,消去反应恢复。
C=C
+HX
—C—C—
X
H
NaOH/醇
△
C=C
C=C
+H2O
—C—C—
OH
H
浓硫酸
△
C=C
1.碳碳双键的保护
因酚羟基易被氧化,故在加入氧化剂之前将-OH转化为醚键(-OCH3),待其他基氧化后,再酸化使其转化为-OH,其过程表示为
OCH3
COOH
OH
COOH
CH3I
KMnO4/H+
H+
OCH3
CH3
OH
CH3
2.酚羟基的保护
ONa
COOH
KMnO4/H+
ONa
CH3
NaOH
H+
—OH转化为—ONa
