1.3 氧化还原反应 同步练习题(含解析) 2022-2023学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3 氧化还原反应 同步练习题(含解析) 2022-2023学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 894.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-29 08:13:08 | ||
图片预览




文档简介
1.3 氧化还原反应 同步练习题
一、选择题
1.关于反应Zn+(极稀),下列说法正确的是
A.生成1 mol ,转移个电子
B.氧化剂和还原剂之比为1∶2
C.是还原产物
D.该反应只体现了硝酸的强氧化性
2.光催化反应机理如图所示,当催化剂受到能量大于禁带宽度的光照时,价带上的电子被激发,跃迁到导带,同时形成空穴。导带上的光生电子()作还原剂,价带上的光生空穴( )作氧化剂,下列说法不正确的是
A.在价带上被氧化 B.推测起催化作用
C.反应过程中光能转化为化学能 D.生成得到电子
3.下列判断正确的是
A.、、、能在溶液中大量共存
B.、、、能大量共存
C.三氯化铁酸性溶液中通入足量硫化氢的离子方程式为:
D.用“示踪原子法”来判断反应的历程:
4.“宏观辨识—微观探析—符号表征是化学学习的重要方法。某化学反应的微观示意图如下,下列分析错误的是
A.分析反应类型:该反应属于氧化还原反应
B.分析物质种类:图中反应物均为电解质
C.分析反应价值:该反应实现了有机物向无机物的转化
D.分析表示方法:该反应的化学方程式为:
5.亚氯酸钠是一种高效的漂白剂和氧化剂,制备亚氯酸钠的流程如下。
已知:①纯易分解爆炸,一般稀释到10%以下安全
②“有效氯含量”是指每克含氯消毒剂的氧化能力相当于多少克的氧化能力
下列说法错误的是
A.的“有效氯含量”约为
B.鼓入空气的主要目的是稀释以防爆炸
C.反应Ⅰ中氧化产物与还原产物的物质的量之比为2∶1
D.反应Ⅱ条件下,的氧化性大于
6.是一种杀菌消毒效率高、二次污染小的水处理剂。实验室可通过以下反应制得:(未配平)。下列说法正确的是
A.是还原产物 B.Cl元素在反应中被还原
C.在反应中作氧化剂 D.氧化剂与还原剂的物质的量之比为1∶1
7.某工厂的一个生产工艺流程如图所示,下列叙述正确的是
A.该工艺流程是用来制备
B.参加反应时氧化剂和还原剂的物质的量之比是1∶1
C.气体M参加的反应是化合反应
D.该流程需要定期补充溶液
8.通常利用反应Cl2+2NaBr=2NaCl+Br2从海水中提取Br2。该反应属于
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
9.已知反应①、②分别是从海藻灰和智利硝石中提取碘的主要反应:
①2NaI + MnO2 + 3H2SO4 = 2NaHSO4 + MnSO4 + 2H2O+I2
②2NaIO3 + 5NaHSO3 = 2Na2SO4 + 3NaHSO4 + H2O + I2
下列说法正确的是
A.两个反应中I2均为氧化产物
B.反应①中氧化性:MnO2>I2
C.反应②中氧化剂和还原剂的物质的量之比为5∶2
D.反应①和反应②生成等量的I2时转移电子数之比为1∶1
10.化学与生活、生产、科技息息相关。下列叙述中涉及氧化还原反应的是
A.用糯米石灰浆复合材料修筑长城 B.用高铁酸钾()净水
C.夏季涂抹甘油防止皮肤干燥 D.纳米马桶可有效防止异味的产生
11.下列反应属于氧化还原反应的是
A.Na2O+H2O=2NaOH
B.CaCO3+2HCl=CaCl2+CO2↑+H2O
C.AgNO3+KCl=AgCl↓+KNO3
D.2H2+O22H2O
12.中国传统文化中包含大量化学知识,下列说法错误的是
A.“石硫磺(S)能化……银、铜、铁,奇物”,这句话体现了石硫磺的氧化性
B.“春蚕到死丝方尽,蜡炬成灰泪始干”,其中的“蜡炬成灰”属于化学变化
C.《本草纲目》中多次提到“烧酒”,用高梁酿酒中的“馏酒”是指蒸馏操作
D.“至于矾现五色之形,硫为群石之将,皆变化于烈火”,其中的“矾”指的是金属硫化物
13.(NH4)2Cr2O7是一种受热易发生氧化还原反应而分解的盐。下列各组对(NH4)2Cr2O7受热分解产物的判断,符合实际的是
A.CrO3+ NH3+ H2O B.Cr2O3+ NH3+ H2O
C.CrO3+N2+ H2O D.Cr2O3+ N2+ H2O
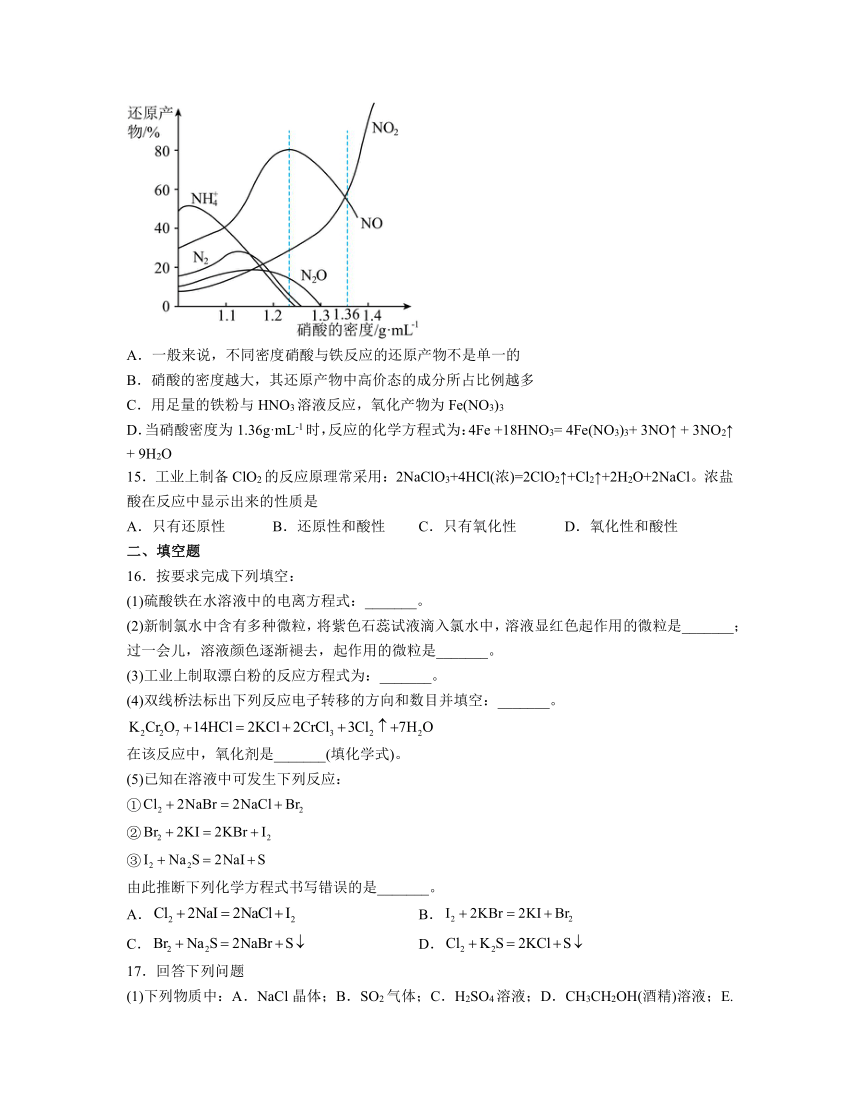
14.如图表示铁与不同密度硝酸反应时,还原产物百分比与硝酸密度的关系,下列说法不正确的是
A.一般来说,不同密度硝酸与铁反应的还原产物不是单一的
B.硝酸的密度越大,其还原产物中高价态的成分所占比例越多
C.用足量的铁粉与HNO3溶液反应,氧化产物为Fe(NO3)3
D.当硝酸密度为1.36g·mL-1时,反应的化学方程式为:4Fe +18HNO3= 4Fe(NO3)3+ 3NO↑ + 3NO2↑ + 9H2O
15.工业上制备ClO2的反应原理常采用:2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2H2O+2NaCl。浓盐酸在反应中显示出来的性质是
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
二、填空题
16.按要求完成下列填空:
(1)硫酸铁在水溶液中的电离方程式:_______。
(2)新制氯水中含有多种微粒,将紫色石蕊试液滴入氯水中,溶液显红色起作用的微粒是_______;过一会儿,溶液颜色逐渐褪去,起作用的微粒是_______。
(3)工业上制取漂白粉的反应方程式为:_______。
(4)双线桥法标出下列反应电子转移的方向和数目并填空:_______。
在该反应中,氧化剂是_______(填化学式)。
(5)已知在溶液中可发生下列反应:
①
②
③
由此推断下列化学方程式书写错误的是_______。
A. B.
C. D.
17.回答下列问题
(1)下列物质中:A.NaCl晶体;B.SO2气体;C.H2SO4溶液;D.CH3CH2OH(酒精)溶液;E. 单质铜;F.熔融氯化钾;G.液态氯化氢
① 能够直接导电的是_______;
②虽溶于水能导电,但不属于电解质的是_______;
③ 虽不能直接导电,但属于电解质的是_______。
(2)已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下: (未配平)
①被还原的元素是_______。
②请用单线桥法标出电子转移的方向和数目_______。
③HNO3在上述反应中显示出来的性质有_______。
A.氧化性 B.还原性 C.酸性 D.碱性
三、计算题
18.现有一份部分被氧化的铜片(氧化产物为CuO),称取4.32g铜片,溶于140mL 1.00mol/L稀硝酸中,反应恰好完全进行,收集到无色气体448mL(已折算为标况)。
(1)该稀硝酸中所含HNO3的物质的量为_______。
(2)4.32g铜片中CuO的质量为_______。
(3)该铜片被氧化的百分数为_______。
四、元素或物质推断题
19.红色固体X由两种元素组成,为探究其组成和性质,设计了如下实验:
请回答:
(1)气体Y的一种同素异形体的分子式是______,红褐色沉淀的化学式______。
(2)X在隔绝空气条件下受高温分解为Y和Z的化学方程式____________。
(3)取黄色溶液W滴加在淀粉 KI试纸上,试纸变蓝色,用离子方程式表示试纸变蓝的原因____________。
五、实验题
20.根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用如图装置进行实验,测定CN-被处理的百分率。
现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出相关主要反应的离子方程式:甲中的反应_________________,乙中的反应:_____________________。
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。丙装置中的试剂是______________,丁装置的目的是________________________;干燥管Ⅱ的作用是______________________。
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比_____(填“偏高”或“偏低”),简述可能的原因:______________________。
(4)含氰废水也可采用电化学方法进行处理。在碱性条件下,使用惰性电极电解含氰废水,氰离子被氧化为无毒的物质,其中阳极电极反应式是___________________。
【参考答案】
一、选择题
1.A
【分析】反应中Zn失电子,做还原剂,硝酸一部分表现酸性,一部分表现氧化性。
解析:A.N元素由+5价降低到-3价,生成1 mol ,转移个电子,A正确;
B.氧化剂是硝酸,还原剂是锌,1mol硝酸做氧化剂得8mol电子,1mol锌做还原剂失2mol电子,根据得失电子守恒,氧化剂和还原剂之比为1∶4,B错误;
C.是氧化产物,C错误;
D.该反应体现了硝酸的强氧化性和酸性,D错误;
故正确答案选A。
2.D
【分析】如图,在催化剂作用下,在价带上生成,其中氧元素化合价升高,被氧化;和在导带上生成和;
解析:A.如图,在价带上生成,其中氧元素化合价升高,被氧化,故A正确;
B.如图,在反应前后性质不变,可推测整个过程中可推测起催化作用,故B正确;
C.如图,该反应是在和光共同作用下进行,反应过程中光能转化为化学能,故C正确;
D.生成,C元素化合价降低8,即生成得到电子,故D错误;
故选D。
3.A
解析:A.、、、都不反应而能在溶液中大量共存,故A正确;
B.与反应而不能大量共存,故B错误;
C.三氯化铁酸性溶液中通入足量硫化氢,反应为配平,其离子方程式为:,故C错误;
D.用“示踪原子法”来判断反应的历程,双氧水中的氧全部被氧化:,故D错误。
综上所述,答案为A。
4.B
解析:A.氧气转化为水,有元素化合价变化,则该反应属于氧化还原反应,故A正确;
B.甲烷是有机物,是非酸性气态氢化物,属于非电解质,氧气是单质,既不是电解质也不是非电解质,故B错误;
C.甲烷是有机物,甲烷与氧气点燃生成二氧化碳和水,该反应实现了有机物向无机物的转化,故C正确;
D.该反应是甲烷和氧气点燃反应生成二氧化碳和水,其反应的化学方程式为:,故D正确。
综上所述,答案为B。
5.C
【分析】由制备流程可知,NaClO3在酸性条件下与二氧化硫发生氧化还原反应生成NaHSO4和ClO2,反应I为2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,ClO2与过氧化氢在碱性条件下反应生成NaClO2,反应II为2NaOH+2ClO2+H2O2=O2↑+2H2O+2NaClO2,将溶液蒸发浓缩、冷却结晶、过滤可得到NaClO2。
解析:A.“有效氯含量”是指每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力,则NaClO2的“有效氯含量”为≈1.57g,A正确;
B.纯ClO2易分解爆炸,鼓入空气可以稀释ClO2以防爆炸,B正确;
C.反应I为2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,氧化产物NaHSO4和还原产物ClO2的物质的量之比为1∶2,C错误;
D.反应II为2NaOH+2ClO2+H2O2=O2↑+2H2O+2NaClO2,H2O2作还原剂,ClO2为氧化剂,ClO2的氧化性大于H2O2,D正确;
故选C。
6.B
解析:A.反应中碳元素的化合价升高被氧化,草酸是还原剂、二氧化碳是氧化产物,故A错误;
B.反应中氯元素的化合价降低被还原,故B正确;
C.反应中中各元素没有发生化合价变化,说明在反应中起酸的作用,故C错误;
D.Cl元素的化合价由+5价降低为+4价,C元素的化合价由+3价升高到+4价,根据电子转移守恒可知,反应方程式为:,氯酸钾是反应的氧化剂,草酸是还原剂,则氧化剂与还原剂的物质的量之比为2:1,故D错误;
故选B。
7.B
【分析】由工艺流程的箭头指向可知,该过程中硫酸亚铁、硫酸铁可以循环使用,气体M和SO2为反应物,指向流程之外的箭头只有硫酸(部分硫酸又参与循环),即硫酸铁和二氧化硫反应生成硫酸和硫酸亚铁,气体M和硫酸、硫酸亚铁作用生成硫酸铁,气体M为氧气,所以该工艺流程是用来制备硫酸的。
解析:A.根据流程图可知,最终反应完离开体系的为硫酸,因此该工艺流程的目的是制备硫酸,故A错误;
B.二氧化硫参加反应的化学方程式为:SO2+ Fe2(SO4)3+2H2O=2FeSO4+2H2SO4,反应中二氧化硫中硫元素的化合价升高,二氧化硫为还原剂,硫酸铁中铁元素的化合价降低,硫酸铁是氧化剂,因此氧化剂和还原剂的物质的量之比是1∶1,故B正确;
C.根据反应关系分析,气体M、H2SO4和FeSO4反应生成Fe2(SO4)3和水,铁元素的价态发生了变化,M是具有氧化性的氧气,反应的化学方程式为O2+4FeSO4+2H2SO4=2Fe2(SO4)3+2H2O,不是化合反应,故C错误;
D.根据流程图可知,气体M、SO2进入体系内,最终有硫酸离开体系,所以该流程的总反应方程式为:2SO2+O2+2H2O=2H2SO4,作反应的催化剂,不需要补充,故D正确;
故选:B。
8.C
解析:该反应是一种单质和一种化合物,反应生成另一种单质和另一种化合物,这样的反应为置换反应;答案选C。
9.B
解析:A.反应①中I元素的化合价由-1价升至0价,NaI为还原剂,I2为氧化产物,反应②中I元素的化合价由+5价降至0价,NaIO3为氧化剂,I2为还原产物,A项错误;
B.反应①中I元素的化合价由-1价升至0价,NaI为还原剂,I2为氧化产物,Mn元素的化合价由+4价降至+2价,MnO2为氧化剂,根据氧化性:氧化剂>氧化产物,则氧化性MnO2>I2,B项正确;
C.应②中I元素的化合价由+5价降至0价,NaIO3为氧化剂,S元素的化合价由+4价升至+6价,NaHSO3为还原剂,根据得失电子守恒,氧化剂与还原剂物质的量之比为2∶5,C项错误;
D.根据A项分析知,反应①生成1molI2转移2mol电子,反应②生成1molI2转移10mol电子,反应①和反应②生成等量的I2时转移电子数之比为1∶5,D项错误;
答案选B。
10.B
解析:A.将糯米参杂进石灰砂浆,这种复合材料极大地增加了两块石头之间的紧密性,没有发生氧化还原反应,故A不符合题意;
B.高铁酸钾()净水原理是,发生氧化还原反应,故B符合题意;
C.夏季涂抹甘油防止皮肤干燥是利用甘油吸水性,故C不符合题意;
D.纳米马桶可有效防止异味的产生是利用材料的吸附性,没有发生氧化还原反应,故D不符合题意;
故答案选B。
11.D
解析:A.各元素化合价均为发生变化,不属于氧化还原反应,A错误;
B.该反应属于复分解反应,各元素化合价均为发生变化,不属于氧化还原反应,B错误;
C.该反应属于复分解反应,各元素化合价均为发生变化,不属于氧化还原反应,C错误;
D.氢元素化合价由0价升高到+1价失去电子,氧元素化合价由0价降到-2价得到电子,有元素化合价升降属于氧化还原反应,D正确;
故选D。
12.D
解析:A.硫黄与金属反应生成金属硫化物,硫元素化合价降低,硫作氧化剂,表现氧化性,故A正确;
B.石蜡燃烧生成二氧化碳、水,属于化学变化,故B正确;
C.“馏酒”是指用蒸馏方法将乙醇蒸出,故C正确;
D.“矾”指的是金属(如钠、锌、铁、铜等)的硫酸盐,故D错误;
选D。
13.D
【分析】已知(NH4)2Cr2O7中N的化合价为-3价,Cr的化合价为+6价,CrO3中Cr的化合价为+6价,NH3中N的化合价为-3价,Cr2O3中的Cr的化合价为+3价,N2中N的化合价为0价,结合氧化还原反应中“有降必有升”的规律解题即可。
解析:A.结合分析可知,若产物为CrO3+ NH3+ H2O,则所有的元素化合价均未改变,属于非氧化还原反应,A不合题意;
B.结合分析可知,若产物为Cr2O3+ NH3+ H2O,则只有元素的化合价降低,未有元素的化合价升高,B不合题意;
C.结合分析可知,若产物为CrO3+N2+ H2O,则只有元素的化合价升高,未有元素化合价降低,C不合题意;
D.结合分析可知,若产物为Cr2O3+ N2+ H2O,既有元素化合价升高,也有元素化合价降低,D符合题意;
故答案为:D。
14.C
解析:A.根据图像可知,随硝酸密度被还原产物不同,在浓硝酸密度为1.4g/mL中,主要产物NO2,随着硝酸密度逐渐降低,产物NO2逐渐减少而NO的相对含量逐渐增多,当密度为1.36g/mL时,主要产物是NO2和NO,当的密度降到1.1g/mL时,离子成为主要产物,故A正确;
B.还原产物中的物质的量分数随硝酸密度减少而增大,铵根离子中氮元素化合价最低是-3价,在浓硝酸浓度为1.4mol/L中,主要产物NO2,硝酸的密度越大、浓度越大,其还原产物中高价态的成分所占比例越多,故B正确;
C.用足量的铁粉与HNO3溶液反应,铁过量时,三价铁可以和单质铁反应生成二价铁,故产物为:Fe(NO3)2,故C错误;
D.当硝酸溶液的密度为1.36g mL-1时,由图像可看出,生成的NO和NO2物质的量相等,反应的化学方程式应为4Fe+18HNO3=4Fe(NO3)3+3NO↑3NO2↑+9H2O,故D正确;
故选C。
15.B
解析:反应为浓盐酸和盐的反应,体现了浓盐酸的酸性;反应HCl中氯元素化合价部分升高,发生氧化反应,HCl为还原剂,体现了其还原性;
故选B。
二、填空题
16.(1)Fe2(SO4)3=2Fe3++3
(2) H+ HClO
(3)2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O
(4) K2Cr2O7
(5)B
解析:(1)硫酸铁为强电解质,在水中完全电离生成铁离子、硫酸根离子,电离方程式为Fe2(SO4)3=2Fe3++3,故答案为:Fe2(SO4)3=2Fe3++3;
(2)新制氯水因氯气与水的反应不完全,故溶液中存在的微粒有:Cl2、HClO、H2O、H+、Cl-、ClO-、极少量OH-;加入紫色石蕊试液后,溶液变红,说明溶液呈酸性,故起作用的粒子是H+;因HClO具有漂白性,故红色溶液逐渐褪色;起作用的微粒是HClO;
(3)漂白粉的主要成分为CaCl2和Ca(ClO)2,工业上制取漂白粉,利用氯气与石灰乳反应,化学方程式为2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O;
(4)氧化还原反应K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O中,化合价升高元素Cl失电子,化合价降低元素Cr得电子,得失电子数目相等=反应中转移电子数=6e-,双线桥表示电子转移为;在该反应中K2Cr2O7中Cr元素由+6价降为+3价被还原,氧化剂是K2Cr2O7;
(5)①Cl2+2NaBr═2NaCl+Br2中,氧化性顺序是:Cl2>Br2,
②Br2+2KI═2KBr+I2中,氧化性顺序是:Br2>I2,
③I2+Na2S═2NaI+S中,氧化性顺序是:I2>S,综上得到氧化性顺序是:Cl2>Br2>I2>S,
A.Cl2+2NaI═2NaCl+I2氧化性顺序是:Cl2>I2,符合氧化性顺序,反应方程式正确;
B.I2+2KBr═2KI+Br2氧化性顺序是:I2>Br2,不符合氧化性顺序,反应方程式错误;
C.Br2+Na2S═2NaBr+S↓氧化性顺序是:Br2>S,符合氧化性顺序,反应方程式正确;
D.Cl2+K2S═2KCl+S↓氧化性顺序是:Cl2>S,符合氧化性顺序,反应方程式正确;
故答案选B。
17.(1) CEF B AG
(2) N AC
解析:(1)金属单质能导电,电解质在水溶液中或者熔融状态下能导电,故能导电的有:C.溶液、E. 单质铜、F.熔融氯化钾,选CEF;溶于水,生成溶液能导电,但是为非电解质;A. NaCl晶体和G.液态氯化氢不能导电,但是其水溶液可以导电。
(2)根据反应,,化合价降低,氮元素被还原;单线桥法表示为:,生成盐,体现硝酸的酸性,生成,体现硝酸的氧化性,故选AC。
三、计算题
18.(1)0.140mol
(2)2.40g
(3)50.0%
解析:(1)由题干信息可得,该稀硝酸中所含HNO3的物质的量为0.14L×1.00mol·L-1=0.140mol;
故答案为:0.140mol。
(2)部分被氧化的铜片溶于稀硝酸中,反应恰好完全进行,收集到448mLNO气体,则由化学方程式3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O可得,参与反应的n(Cu)=0.03mol,则4.32g铜片中CuO的质量=4.32g-0.03mol×64g·mol-1=2.4g;
故答案为:2.4g。
(3)由上述计算可得部分被氧化的铜片中各组分的物质的量为:n(Cu)=0.03mol,n(CuO)= 2.4g÷ 80g·mol-1=0.03mol,因此该铜片被氧化的百分数为50%;
故答案为:50%。
四、元素或物质推断题
19. O3 Fe(OH)3 6Fe2O34Fe3O4+O2↑ 2I-+2Fe3+=2Fe2++I2
【分析】无色气体Y为O2,同素异形体的分子式是O3,且X中含有铁元素,结合“红褐色”沉淀灼烧后能得到X,可以推断得到X为氧化铁,再根据X分解得到Y与Z的量的关系可知,Z为Fe3O4,W为FeCl3,红褐色沉淀为Fe(OH)3。由于FeCl3具有较强的氧化性,所以将FeCl3溶液滴加在淀粉 KI试纸上时会有I2生成,而使试纸变蓝色,据此分析解答。
解析:无色气体Y为O2,同素异形体的分子式是O3,且X中含有铁元素,结合“红褐色”沉淀灼烧后能得到X,可以推断得到X为氧化铁,再根据X分解得到Y与Z的量的关系可知,Z为Fe3O4,W为FeCl3,红褐色沉淀为Fe(OH)3;由于FeCl3具有较强的氧化性,所以将FeCl3溶液滴加在淀粉 KI试纸上时会有I2生成,而使试纸变蓝色,
(1)无色气体Y为O2,其同素异形体的分子式是O3;红褐色沉淀为Fe(OH)3;
故答案为:O3;Fe(OH)3;
(2)X为Fe2O3,Y为O2,Z为Fe3O4,Fe2O3在隔绝空气条件下受热高温分解为Fe3O4和O2,化学反应方程式为6Fe2O34Fe3O4+O2↑;
故答案为:6Fe2O34Fe3O4+O2↑;
(3)W为FeCl3,FeCl3具有较强的氧化性,能将KI氧化为I2,试纸变蓝色,反应的离子方程式为2I-+2Fe3+=2Fe2++I2;
故答案为:2I-+2Fe3+=2Fe2++I2。
五、实验题
20. CN-+ClO-CNO-+Cl- 2CNO-+6ClO-+8H+=N2↑+2CO2↑+3Cl2↑+4H2O 浓硫酸 除去Cl2 防止空气中的CO2、水蒸气进入干燥管I,影响CO2的测量 偏低 前面装置中残留有CO2未被完全吸收 CN- +12OH--10e- =2CO32- +N2↑+6H2O
【分析】利用干燥管I吸收二氧化碳,在吸收之前要处理水蒸气和氯气,用铜来处理氯气,用浓硫酸干燥,为了减少实验误差,干燥管II防止空气中二氧化碳和水蒸气进入干燥管I。据此分析解答。
解析:(1)根据题意,甲中是CN-与ClO-在催化剂作用下反应生成CNO-和Cl-,因此甲中的反应CN-+ClO-CNO-+Cl-,CNO-和Cl-在酸性条件下继续与NaClO反应生成N2、CO2和Cl2,因此乙中的反应:2CNO-+6ClO-+8H+ =N2↑+2CO2↑+3Cl2↑+4H2O;故答案为:CN-+ClO-CNO-+Cl-;2CNO-+6ClO-+8H+ = N2↑+2CO2↑+3Cl2↑+4H2O。
(2)利用干燥管I吸收二氧化碳,在吸收之前要处理水蒸气和氯气,用铜来处理氯气,用浓硫酸干燥,为了减少实验误差,干燥管II防止空气中二氧化碳和水蒸气进入干燥管I,因此丙装置中的试剂是浓硫酸,丁装置的目的是除去Cl2;干燥管Ⅱ的作用是防止空气中的CO2、水蒸气进入干燥管I,影响CO2的测量;故答案为:浓硫酸;除去Cl2;防止空气中的CO2、水蒸气进入干燥管I,影响CO2的测量。
(3)由于装置中反应生成的二氧化碳会留在装置中没有被吹出,未完全被干燥管I吸收,因此利用该装置测得的CN-被处理的百分率与实际值相比偏低;故答案为:偏低;前面装置中残留有CO2未被完全吸收。
(4)在碱性条件下,使用惰性电极电解含氰废水,氰离子被氧化为无毒的氮气和碳酸根离子,因此阳极电极反应式是CN- +12OH--10e- =2CO32- +N2↑+6H2O
一、选择题
1.关于反应Zn+(极稀),下列说法正确的是
A.生成1 mol ,转移个电子
B.氧化剂和还原剂之比为1∶2
C.是还原产物
D.该反应只体现了硝酸的强氧化性
2.光催化反应机理如图所示,当催化剂受到能量大于禁带宽度的光照时,价带上的电子被激发,跃迁到导带,同时形成空穴。导带上的光生电子()作还原剂,价带上的光生空穴( )作氧化剂,下列说法不正确的是
A.在价带上被氧化 B.推测起催化作用
C.反应过程中光能转化为化学能 D.生成得到电子
3.下列判断正确的是
A.、、、能在溶液中大量共存
B.、、、能大量共存
C.三氯化铁酸性溶液中通入足量硫化氢的离子方程式为:
D.用“示踪原子法”来判断反应的历程:
4.“宏观辨识—微观探析—符号表征是化学学习的重要方法。某化学反应的微观示意图如下,下列分析错误的是
A.分析反应类型:该反应属于氧化还原反应
B.分析物质种类:图中反应物均为电解质
C.分析反应价值:该反应实现了有机物向无机物的转化
D.分析表示方法:该反应的化学方程式为:
5.亚氯酸钠是一种高效的漂白剂和氧化剂,制备亚氯酸钠的流程如下。
已知:①纯易分解爆炸,一般稀释到10%以下安全
②“有效氯含量”是指每克含氯消毒剂的氧化能力相当于多少克的氧化能力
下列说法错误的是
A.的“有效氯含量”约为
B.鼓入空气的主要目的是稀释以防爆炸
C.反应Ⅰ中氧化产物与还原产物的物质的量之比为2∶1
D.反应Ⅱ条件下,的氧化性大于
6.是一种杀菌消毒效率高、二次污染小的水处理剂。实验室可通过以下反应制得:(未配平)。下列说法正确的是
A.是还原产物 B.Cl元素在反应中被还原
C.在反应中作氧化剂 D.氧化剂与还原剂的物质的量之比为1∶1
7.某工厂的一个生产工艺流程如图所示,下列叙述正确的是
A.该工艺流程是用来制备
B.参加反应时氧化剂和还原剂的物质的量之比是1∶1
C.气体M参加的反应是化合反应
D.该流程需要定期补充溶液
8.通常利用反应Cl2+2NaBr=2NaCl+Br2从海水中提取Br2。该反应属于
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
9.已知反应①、②分别是从海藻灰和智利硝石中提取碘的主要反应:
①2NaI + MnO2 + 3H2SO4 = 2NaHSO4 + MnSO4 + 2H2O+I2
②2NaIO3 + 5NaHSO3 = 2Na2SO4 + 3NaHSO4 + H2O + I2
下列说法正确的是
A.两个反应中I2均为氧化产物
B.反应①中氧化性:MnO2>I2
C.反应②中氧化剂和还原剂的物质的量之比为5∶2
D.反应①和反应②生成等量的I2时转移电子数之比为1∶1
10.化学与生活、生产、科技息息相关。下列叙述中涉及氧化还原反应的是
A.用糯米石灰浆复合材料修筑长城 B.用高铁酸钾()净水
C.夏季涂抹甘油防止皮肤干燥 D.纳米马桶可有效防止异味的产生
11.下列反应属于氧化还原反应的是
A.Na2O+H2O=2NaOH
B.CaCO3+2HCl=CaCl2+CO2↑+H2O
C.AgNO3+KCl=AgCl↓+KNO3
D.2H2+O22H2O
12.中国传统文化中包含大量化学知识,下列说法错误的是
A.“石硫磺(S)能化……银、铜、铁,奇物”,这句话体现了石硫磺的氧化性
B.“春蚕到死丝方尽,蜡炬成灰泪始干”,其中的“蜡炬成灰”属于化学变化
C.《本草纲目》中多次提到“烧酒”,用高梁酿酒中的“馏酒”是指蒸馏操作
D.“至于矾现五色之形,硫为群石之将,皆变化于烈火”,其中的“矾”指的是金属硫化物
13.(NH4)2Cr2O7是一种受热易发生氧化还原反应而分解的盐。下列各组对(NH4)2Cr2O7受热分解产物的判断,符合实际的是
A.CrO3+ NH3+ H2O B.Cr2O3+ NH3+ H2O
C.CrO3+N2+ H2O D.Cr2O3+ N2+ H2O
14.如图表示铁与不同密度硝酸反应时,还原产物百分比与硝酸密度的关系,下列说法不正确的是
A.一般来说,不同密度硝酸与铁反应的还原产物不是单一的
B.硝酸的密度越大,其还原产物中高价态的成分所占比例越多
C.用足量的铁粉与HNO3溶液反应,氧化产物为Fe(NO3)3
D.当硝酸密度为1.36g·mL-1时,反应的化学方程式为:4Fe +18HNO3= 4Fe(NO3)3+ 3NO↑ + 3NO2↑ + 9H2O
15.工业上制备ClO2的反应原理常采用:2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2H2O+2NaCl。浓盐酸在反应中显示出来的性质是
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
二、填空题
16.按要求完成下列填空:
(1)硫酸铁在水溶液中的电离方程式:_______。
(2)新制氯水中含有多种微粒,将紫色石蕊试液滴入氯水中,溶液显红色起作用的微粒是_______;过一会儿,溶液颜色逐渐褪去,起作用的微粒是_______。
(3)工业上制取漂白粉的反应方程式为:_______。
(4)双线桥法标出下列反应电子转移的方向和数目并填空:_______。
在该反应中,氧化剂是_______(填化学式)。
(5)已知在溶液中可发生下列反应:
①
②
③
由此推断下列化学方程式书写错误的是_______。
A. B.
C. D.
17.回答下列问题
(1)下列物质中:A.NaCl晶体;B.SO2气体;C.H2SO4溶液;D.CH3CH2OH(酒精)溶液;E. 单质铜;F.熔融氯化钾;G.液态氯化氢
① 能够直接导电的是_______;
②虽溶于水能导电,但不属于电解质的是_______;
③ 虽不能直接导电,但属于电解质的是_______。
(2)已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下: (未配平)
①被还原的元素是_______。
②请用单线桥法标出电子转移的方向和数目_______。
③HNO3在上述反应中显示出来的性质有_______。
A.氧化性 B.还原性 C.酸性 D.碱性
三、计算题
18.现有一份部分被氧化的铜片(氧化产物为CuO),称取4.32g铜片,溶于140mL 1.00mol/L稀硝酸中,反应恰好完全进行,收集到无色气体448mL(已折算为标况)。
(1)该稀硝酸中所含HNO3的物质的量为_______。
(2)4.32g铜片中CuO的质量为_______。
(3)该铜片被氧化的百分数为_______。
四、元素或物质推断题
19.红色固体X由两种元素组成,为探究其组成和性质,设计了如下实验:
请回答:
(1)气体Y的一种同素异形体的分子式是______,红褐色沉淀的化学式______。
(2)X在隔绝空气条件下受高温分解为Y和Z的化学方程式____________。
(3)取黄色溶液W滴加在淀粉 KI试纸上,试纸变蓝色,用离子方程式表示试纸变蓝的原因____________。
五、实验题
20.根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用如图装置进行实验,测定CN-被处理的百分率。
现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出相关主要反应的离子方程式:甲中的反应_________________,乙中的反应:_____________________。
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。丙装置中的试剂是______________,丁装置的目的是________________________;干燥管Ⅱ的作用是______________________。
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比_____(填“偏高”或“偏低”),简述可能的原因:______________________。
(4)含氰废水也可采用电化学方法进行处理。在碱性条件下,使用惰性电极电解含氰废水,氰离子被氧化为无毒的物质,其中阳极电极反应式是___________________。
【参考答案】
一、选择题
1.A
【分析】反应中Zn失电子,做还原剂,硝酸一部分表现酸性,一部分表现氧化性。
解析:A.N元素由+5价降低到-3价,生成1 mol ,转移个电子,A正确;
B.氧化剂是硝酸,还原剂是锌,1mol硝酸做氧化剂得8mol电子,1mol锌做还原剂失2mol电子,根据得失电子守恒,氧化剂和还原剂之比为1∶4,B错误;
C.是氧化产物,C错误;
D.该反应体现了硝酸的强氧化性和酸性,D错误;
故正确答案选A。
2.D
【分析】如图,在催化剂作用下,在价带上生成,其中氧元素化合价升高,被氧化;和在导带上生成和;
解析:A.如图,在价带上生成,其中氧元素化合价升高,被氧化,故A正确;
B.如图,在反应前后性质不变,可推测整个过程中可推测起催化作用,故B正确;
C.如图,该反应是在和光共同作用下进行,反应过程中光能转化为化学能,故C正确;
D.生成,C元素化合价降低8,即生成得到电子,故D错误;
故选D。
3.A
解析:A.、、、都不反应而能在溶液中大量共存,故A正确;
B.与反应而不能大量共存,故B错误;
C.三氯化铁酸性溶液中通入足量硫化氢,反应为配平,其离子方程式为:,故C错误;
D.用“示踪原子法”来判断反应的历程,双氧水中的氧全部被氧化:,故D错误。
综上所述,答案为A。
4.B
解析:A.氧气转化为水,有元素化合价变化,则该反应属于氧化还原反应,故A正确;
B.甲烷是有机物,是非酸性气态氢化物,属于非电解质,氧气是单质,既不是电解质也不是非电解质,故B错误;
C.甲烷是有机物,甲烷与氧气点燃生成二氧化碳和水,该反应实现了有机物向无机物的转化,故C正确;
D.该反应是甲烷和氧气点燃反应生成二氧化碳和水,其反应的化学方程式为:,故D正确。
综上所述,答案为B。
5.C
【分析】由制备流程可知,NaClO3在酸性条件下与二氧化硫发生氧化还原反应生成NaHSO4和ClO2,反应I为2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,ClO2与过氧化氢在碱性条件下反应生成NaClO2,反应II为2NaOH+2ClO2+H2O2=O2↑+2H2O+2NaClO2,将溶液蒸发浓缩、冷却结晶、过滤可得到NaClO2。
解析:A.“有效氯含量”是指每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力,则NaClO2的“有效氯含量”为≈1.57g,A正确;
B.纯ClO2易分解爆炸,鼓入空气可以稀释ClO2以防爆炸,B正确;
C.反应I为2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,氧化产物NaHSO4和还原产物ClO2的物质的量之比为1∶2,C错误;
D.反应II为2NaOH+2ClO2+H2O2=O2↑+2H2O+2NaClO2,H2O2作还原剂,ClO2为氧化剂,ClO2的氧化性大于H2O2,D正确;
故选C。
6.B
解析:A.反应中碳元素的化合价升高被氧化,草酸是还原剂、二氧化碳是氧化产物,故A错误;
B.反应中氯元素的化合价降低被还原,故B正确;
C.反应中中各元素没有发生化合价变化,说明在反应中起酸的作用,故C错误;
D.Cl元素的化合价由+5价降低为+4价,C元素的化合价由+3价升高到+4价,根据电子转移守恒可知,反应方程式为:,氯酸钾是反应的氧化剂,草酸是还原剂,则氧化剂与还原剂的物质的量之比为2:1,故D错误;
故选B。
7.B
【分析】由工艺流程的箭头指向可知,该过程中硫酸亚铁、硫酸铁可以循环使用,气体M和SO2为反应物,指向流程之外的箭头只有硫酸(部分硫酸又参与循环),即硫酸铁和二氧化硫反应生成硫酸和硫酸亚铁,气体M和硫酸、硫酸亚铁作用生成硫酸铁,气体M为氧气,所以该工艺流程是用来制备硫酸的。
解析:A.根据流程图可知,最终反应完离开体系的为硫酸,因此该工艺流程的目的是制备硫酸,故A错误;
B.二氧化硫参加反应的化学方程式为:SO2+ Fe2(SO4)3+2H2O=2FeSO4+2H2SO4,反应中二氧化硫中硫元素的化合价升高,二氧化硫为还原剂,硫酸铁中铁元素的化合价降低,硫酸铁是氧化剂,因此氧化剂和还原剂的物质的量之比是1∶1,故B正确;
C.根据反应关系分析,气体M、H2SO4和FeSO4反应生成Fe2(SO4)3和水,铁元素的价态发生了变化,M是具有氧化性的氧气,反应的化学方程式为O2+4FeSO4+2H2SO4=2Fe2(SO4)3+2H2O,不是化合反应,故C错误;
D.根据流程图可知,气体M、SO2进入体系内,最终有硫酸离开体系,所以该流程的总反应方程式为:2SO2+O2+2H2O=2H2SO4,作反应的催化剂,不需要补充,故D正确;
故选:B。
8.C
解析:该反应是一种单质和一种化合物,反应生成另一种单质和另一种化合物,这样的反应为置换反应;答案选C。
9.B
解析:A.反应①中I元素的化合价由-1价升至0价,NaI为还原剂,I2为氧化产物,反应②中I元素的化合价由+5价降至0价,NaIO3为氧化剂,I2为还原产物,A项错误;
B.反应①中I元素的化合价由-1价升至0价,NaI为还原剂,I2为氧化产物,Mn元素的化合价由+4价降至+2价,MnO2为氧化剂,根据氧化性:氧化剂>氧化产物,则氧化性MnO2>I2,B项正确;
C.应②中I元素的化合价由+5价降至0价,NaIO3为氧化剂,S元素的化合价由+4价升至+6价,NaHSO3为还原剂,根据得失电子守恒,氧化剂与还原剂物质的量之比为2∶5,C项错误;
D.根据A项分析知,反应①生成1molI2转移2mol电子,反应②生成1molI2转移10mol电子,反应①和反应②生成等量的I2时转移电子数之比为1∶5,D项错误;
答案选B。
10.B
解析:A.将糯米参杂进石灰砂浆,这种复合材料极大地增加了两块石头之间的紧密性,没有发生氧化还原反应,故A不符合题意;
B.高铁酸钾()净水原理是,发生氧化还原反应,故B符合题意;
C.夏季涂抹甘油防止皮肤干燥是利用甘油吸水性,故C不符合题意;
D.纳米马桶可有效防止异味的产生是利用材料的吸附性,没有发生氧化还原反应,故D不符合题意;
故答案选B。
11.D
解析:A.各元素化合价均为发生变化,不属于氧化还原反应,A错误;
B.该反应属于复分解反应,各元素化合价均为发生变化,不属于氧化还原反应,B错误;
C.该反应属于复分解反应,各元素化合价均为发生变化,不属于氧化还原反应,C错误;
D.氢元素化合价由0价升高到+1价失去电子,氧元素化合价由0价降到-2价得到电子,有元素化合价升降属于氧化还原反应,D正确;
故选D。
12.D
解析:A.硫黄与金属反应生成金属硫化物,硫元素化合价降低,硫作氧化剂,表现氧化性,故A正确;
B.石蜡燃烧生成二氧化碳、水,属于化学变化,故B正确;
C.“馏酒”是指用蒸馏方法将乙醇蒸出,故C正确;
D.“矾”指的是金属(如钠、锌、铁、铜等)的硫酸盐,故D错误;
选D。
13.D
【分析】已知(NH4)2Cr2O7中N的化合价为-3价,Cr的化合价为+6价,CrO3中Cr的化合价为+6价,NH3中N的化合价为-3价,Cr2O3中的Cr的化合价为+3价,N2中N的化合价为0价,结合氧化还原反应中“有降必有升”的规律解题即可。
解析:A.结合分析可知,若产物为CrO3+ NH3+ H2O,则所有的元素化合价均未改变,属于非氧化还原反应,A不合题意;
B.结合分析可知,若产物为Cr2O3+ NH3+ H2O,则只有元素的化合价降低,未有元素的化合价升高,B不合题意;
C.结合分析可知,若产物为CrO3+N2+ H2O,则只有元素的化合价升高,未有元素化合价降低,C不合题意;
D.结合分析可知,若产物为Cr2O3+ N2+ H2O,既有元素化合价升高,也有元素化合价降低,D符合题意;
故答案为:D。
14.C
解析:A.根据图像可知,随硝酸密度被还原产物不同,在浓硝酸密度为1.4g/mL中,主要产物NO2,随着硝酸密度逐渐降低,产物NO2逐渐减少而NO的相对含量逐渐增多,当密度为1.36g/mL时,主要产物是NO2和NO,当的密度降到1.1g/mL时,离子成为主要产物,故A正确;
B.还原产物中的物质的量分数随硝酸密度减少而增大,铵根离子中氮元素化合价最低是-3价,在浓硝酸浓度为1.4mol/L中,主要产物NO2,硝酸的密度越大、浓度越大,其还原产物中高价态的成分所占比例越多,故B正确;
C.用足量的铁粉与HNO3溶液反应,铁过量时,三价铁可以和单质铁反应生成二价铁,故产物为:Fe(NO3)2,故C错误;
D.当硝酸溶液的密度为1.36g mL-1时,由图像可看出,生成的NO和NO2物质的量相等,反应的化学方程式应为4Fe+18HNO3=4Fe(NO3)3+3NO↑3NO2↑+9H2O,故D正确;
故选C。
15.B
解析:反应为浓盐酸和盐的反应,体现了浓盐酸的酸性;反应HCl中氯元素化合价部分升高,发生氧化反应,HCl为还原剂,体现了其还原性;
故选B。
二、填空题
16.(1)Fe2(SO4)3=2Fe3++3
(2) H+ HClO
(3)2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O
(4) K2Cr2O7
(5)B
解析:(1)硫酸铁为强电解质,在水中完全电离生成铁离子、硫酸根离子,电离方程式为Fe2(SO4)3=2Fe3++3,故答案为:Fe2(SO4)3=2Fe3++3;
(2)新制氯水因氯气与水的反应不完全,故溶液中存在的微粒有:Cl2、HClO、H2O、H+、Cl-、ClO-、极少量OH-;加入紫色石蕊试液后,溶液变红,说明溶液呈酸性,故起作用的粒子是H+;因HClO具有漂白性,故红色溶液逐渐褪色;起作用的微粒是HClO;
(3)漂白粉的主要成分为CaCl2和Ca(ClO)2,工业上制取漂白粉,利用氯气与石灰乳反应,化学方程式为2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O;
(4)氧化还原反应K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O中,化合价升高元素Cl失电子,化合价降低元素Cr得电子,得失电子数目相等=反应中转移电子数=6e-,双线桥表示电子转移为;在该反应中K2Cr2O7中Cr元素由+6价降为+3价被还原,氧化剂是K2Cr2O7;
(5)①Cl2+2NaBr═2NaCl+Br2中,氧化性顺序是:Cl2>Br2,
②Br2+2KI═2KBr+I2中,氧化性顺序是:Br2>I2,
③I2+Na2S═2NaI+S中,氧化性顺序是:I2>S,综上得到氧化性顺序是:Cl2>Br2>I2>S,
A.Cl2+2NaI═2NaCl+I2氧化性顺序是:Cl2>I2,符合氧化性顺序,反应方程式正确;
B.I2+2KBr═2KI+Br2氧化性顺序是:I2>Br2,不符合氧化性顺序,反应方程式错误;
C.Br2+Na2S═2NaBr+S↓氧化性顺序是:Br2>S,符合氧化性顺序,反应方程式正确;
D.Cl2+K2S═2KCl+S↓氧化性顺序是:Cl2>S,符合氧化性顺序,反应方程式正确;
故答案选B。
17.(1) CEF B AG
(2) N AC
解析:(1)金属单质能导电,电解质在水溶液中或者熔融状态下能导电,故能导电的有:C.溶液、E. 单质铜、F.熔融氯化钾,选CEF;溶于水,生成溶液能导电,但是为非电解质;A. NaCl晶体和G.液态氯化氢不能导电,但是其水溶液可以导电。
(2)根据反应,,化合价降低,氮元素被还原;单线桥法表示为:,生成盐,体现硝酸的酸性,生成,体现硝酸的氧化性,故选AC。
三、计算题
18.(1)0.140mol
(2)2.40g
(3)50.0%
解析:(1)由题干信息可得,该稀硝酸中所含HNO3的物质的量为0.14L×1.00mol·L-1=0.140mol;
故答案为:0.140mol。
(2)部分被氧化的铜片溶于稀硝酸中,反应恰好完全进行,收集到448mLNO气体,则由化学方程式3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O可得,参与反应的n(Cu)=0.03mol,则4.32g铜片中CuO的质量=4.32g-0.03mol×64g·mol-1=2.4g;
故答案为:2.4g。
(3)由上述计算可得部分被氧化的铜片中各组分的物质的量为:n(Cu)=0.03mol,n(CuO)= 2.4g÷ 80g·mol-1=0.03mol,因此该铜片被氧化的百分数为50%;
故答案为:50%。
四、元素或物质推断题
19. O3 Fe(OH)3 6Fe2O34Fe3O4+O2↑ 2I-+2Fe3+=2Fe2++I2
【分析】无色气体Y为O2,同素异形体的分子式是O3,且X中含有铁元素,结合“红褐色”沉淀灼烧后能得到X,可以推断得到X为氧化铁,再根据X分解得到Y与Z的量的关系可知,Z为Fe3O4,W为FeCl3,红褐色沉淀为Fe(OH)3。由于FeCl3具有较强的氧化性,所以将FeCl3溶液滴加在淀粉 KI试纸上时会有I2生成,而使试纸变蓝色,据此分析解答。
解析:无色气体Y为O2,同素异形体的分子式是O3,且X中含有铁元素,结合“红褐色”沉淀灼烧后能得到X,可以推断得到X为氧化铁,再根据X分解得到Y与Z的量的关系可知,Z为Fe3O4,W为FeCl3,红褐色沉淀为Fe(OH)3;由于FeCl3具有较强的氧化性,所以将FeCl3溶液滴加在淀粉 KI试纸上时会有I2生成,而使试纸变蓝色,
(1)无色气体Y为O2,其同素异形体的分子式是O3;红褐色沉淀为Fe(OH)3;
故答案为:O3;Fe(OH)3;
(2)X为Fe2O3,Y为O2,Z为Fe3O4,Fe2O3在隔绝空气条件下受热高温分解为Fe3O4和O2,化学反应方程式为6Fe2O34Fe3O4+O2↑;
故答案为:6Fe2O34Fe3O4+O2↑;
(3)W为FeCl3,FeCl3具有较强的氧化性,能将KI氧化为I2,试纸变蓝色,反应的离子方程式为2I-+2Fe3+=2Fe2++I2;
故答案为:2I-+2Fe3+=2Fe2++I2。
五、实验题
20. CN-+ClO-CNO-+Cl- 2CNO-+6ClO-+8H+=N2↑+2CO2↑+3Cl2↑+4H2O 浓硫酸 除去Cl2 防止空气中的CO2、水蒸气进入干燥管I,影响CO2的测量 偏低 前面装置中残留有CO2未被完全吸收 CN- +12OH--10e- =2CO32- +N2↑+6H2O
【分析】利用干燥管I吸收二氧化碳,在吸收之前要处理水蒸气和氯气,用铜来处理氯气,用浓硫酸干燥,为了减少实验误差,干燥管II防止空气中二氧化碳和水蒸气进入干燥管I。据此分析解答。
解析:(1)根据题意,甲中是CN-与ClO-在催化剂作用下反应生成CNO-和Cl-,因此甲中的反应CN-+ClO-CNO-+Cl-,CNO-和Cl-在酸性条件下继续与NaClO反应生成N2、CO2和Cl2,因此乙中的反应:2CNO-+6ClO-+8H+ =N2↑+2CO2↑+3Cl2↑+4H2O;故答案为:CN-+ClO-CNO-+Cl-;2CNO-+6ClO-+8H+ = N2↑+2CO2↑+3Cl2↑+4H2O。
(2)利用干燥管I吸收二氧化碳,在吸收之前要处理水蒸气和氯气,用铜来处理氯气,用浓硫酸干燥,为了减少实验误差,干燥管II防止空气中二氧化碳和水蒸气进入干燥管I,因此丙装置中的试剂是浓硫酸,丁装置的目的是除去Cl2;干燥管Ⅱ的作用是防止空气中的CO2、水蒸气进入干燥管I,影响CO2的测量;故答案为:浓硫酸;除去Cl2;防止空气中的CO2、水蒸气进入干燥管I,影响CO2的测量。
(3)由于装置中反应生成的二氧化碳会留在装置中没有被吹出,未完全被干燥管I吸收,因此利用该装置测得的CN-被处理的百分率与实际值相比偏低;故答案为:偏低;前面装置中残留有CO2未被完全吸收。
(4)在碱性条件下,使用惰性电极电解含氰废水,氰离子被氧化为无毒的氮气和碳酸根离子,因此阳极电极反应式是CN- +12OH--10e- =2CO32- +N2↑+6H2O
