第六章 化学反应与能量的 教学思考 课件 (共36张PPT) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第六章 化学反应与能量的 教学思考 课件 (共36张PPT) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-29 09:18:41 | ||
图片预览







文档简介
(共36张PPT)
教学思考
第二册 第六章 化学反应与能量
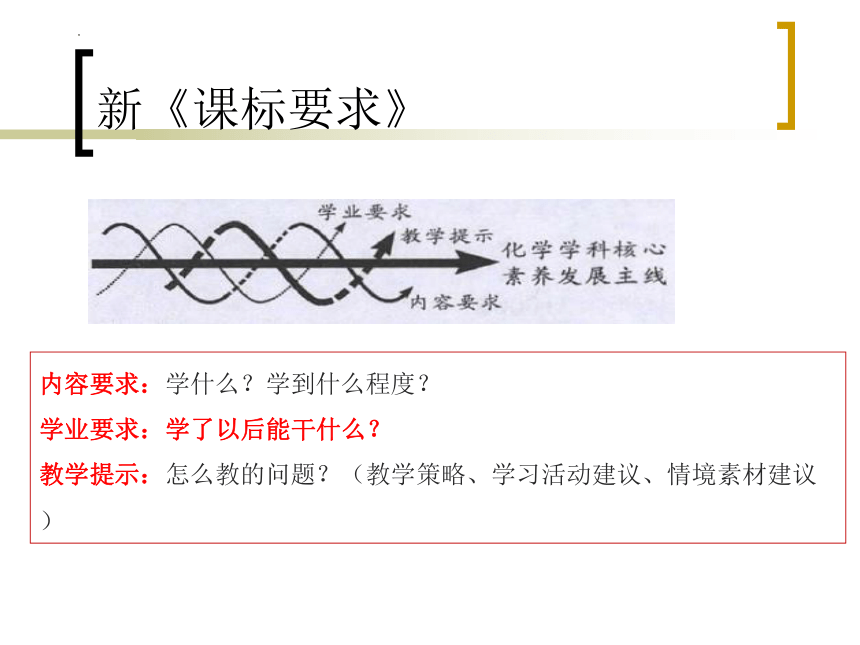
新《课标要求》
内容要求:学什么?学到什么程度?
学业要求:学了以后能干什么?
教学提示:怎么教的问题?(教学策略、学习活动建议、情境素材建议)
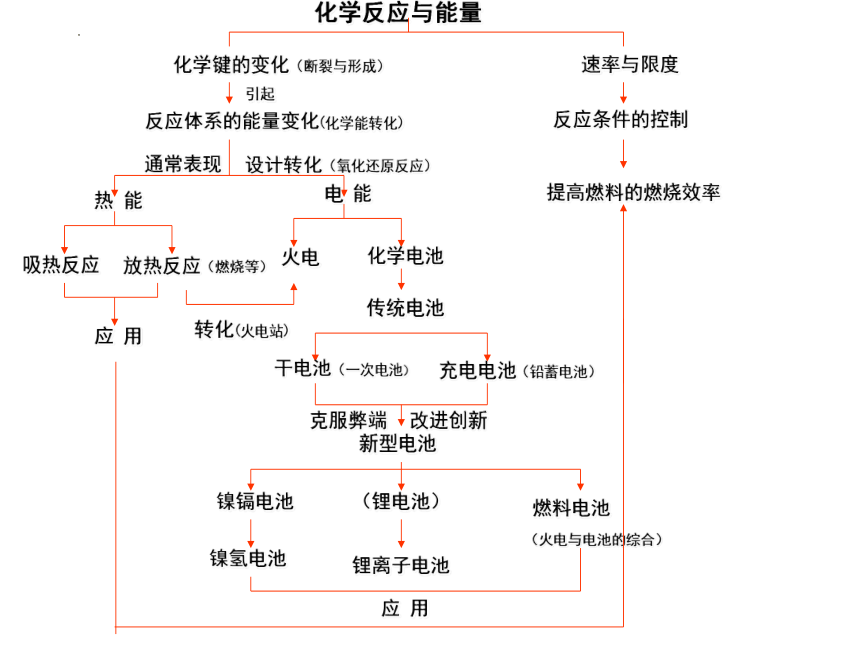
化学反应与能量
化学键的变化(断裂与形成)
速率与限度
反应体系的能量变化(化学能转化)
反应条件的控制
提高燃料的燃烧效率
通常表现
设计转化(氧化还原反应)
热 能
电 能
引起
应 用
吸热反应
放热反应(燃烧等)
火电
化学电池
转化(火电站)
传统电池
干电池(一次电池)
充电电池(铅蓄电池)
克服弊端
改进创新
新型电池
镍镉电池
(锂电池)
燃料电池
镍氢电池
锂离子电池
(火电与电池的综合)
应 用
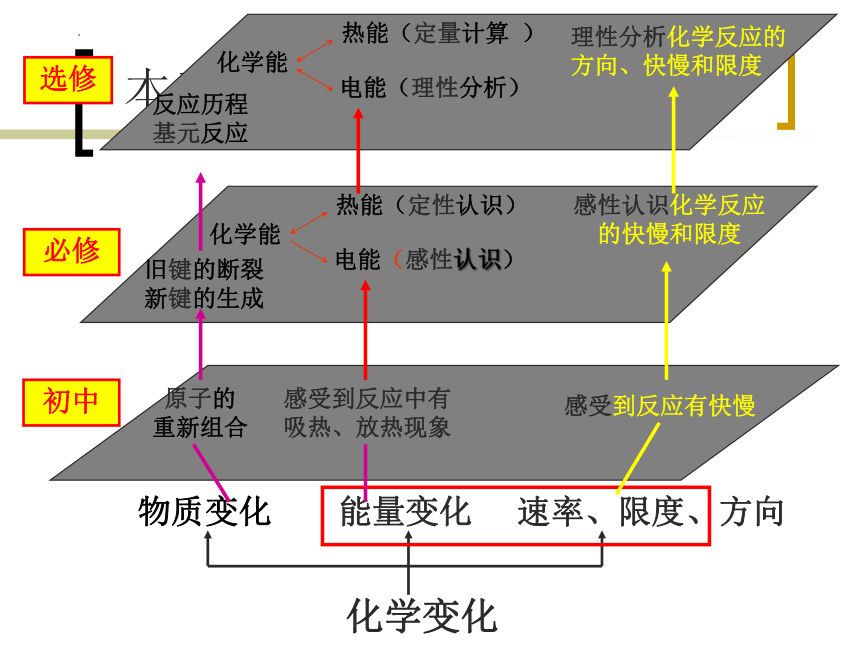
本章教学内容的地位与作用
初中
选修
必修
物质变化
能量变化
化学变化
感受到反应有快慢
感受到反应中有
吸热、放热现象
理性分析化学反应的
方向、快慢和限度
化学能
热能(定量计算 )
电能(理性分析)
感性认识化学反应
的快慢和限度
化学能
热能(定性认识)
电能(感性认识)
速率、限度、方向
原子的
重新组合
反应历程
基元反应
旧键的断裂
新键的生成
学习要求
必修2
1. 知道化学键的断裂和形成是化学反应中能量变化的主要原因。
2. 通过生产、生活中的实例,了解化学能与热能的相互转化。
3. 举例说明化学能与电能的转化关系及其应用。
4. 认识提高燃料的燃烧效率、开发高能清洁燃料和研制新型电池的重要性。
5. 通过实验认识化学反应的速率和化学反应的限度,了解控制反应条件在生产和科学研究中的作用。
1.能量观
①化学键的断裂和形成是化学反应中能量变化的主要因素
②通过设计装置,可以将化学能转化为化学能
③各种形式的能量在转化过程中是守恒的
本章形成的学科思想方法
2.化学研究方法
控制变量的方法认识条件对化学反应速率的影响
3.化学与社会的和谐发展
充分利用化学能,同时关注环境的保护,实现可持续发展
素养1 宏观辨识与微观探析
素养2 变化观念与平衡思想
素养3 科学态度与社会责任
①化学反应中能量变化和化学键断裂与形成的关系
②原电池放电时的现象与电子的得失、溶液中微粒的
反应、运动方向的关系。
③从微观的角度认识化学平衡
本章化学学科核心素养的培养
三种教学设计思路
设计1:
理论
思考
为切
入点
三种教学设计思路
设计2:
实验
探究
为切
入点
三种教学设计思路
设计3:
实际
应用
为切
入点
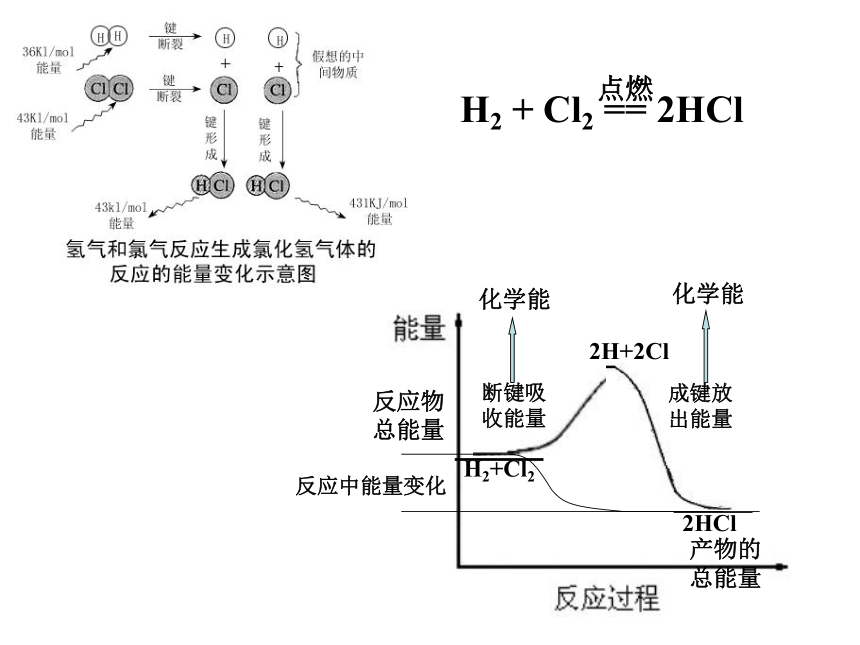
H2+Cl2
2H+2Cl
2HCl
断键吸
收能量
成键放
出能量
化学能
化学能
反应中能量变化
反应物
总能量
产物的
总能量
H2 + Cl2 == 2HCl
点燃
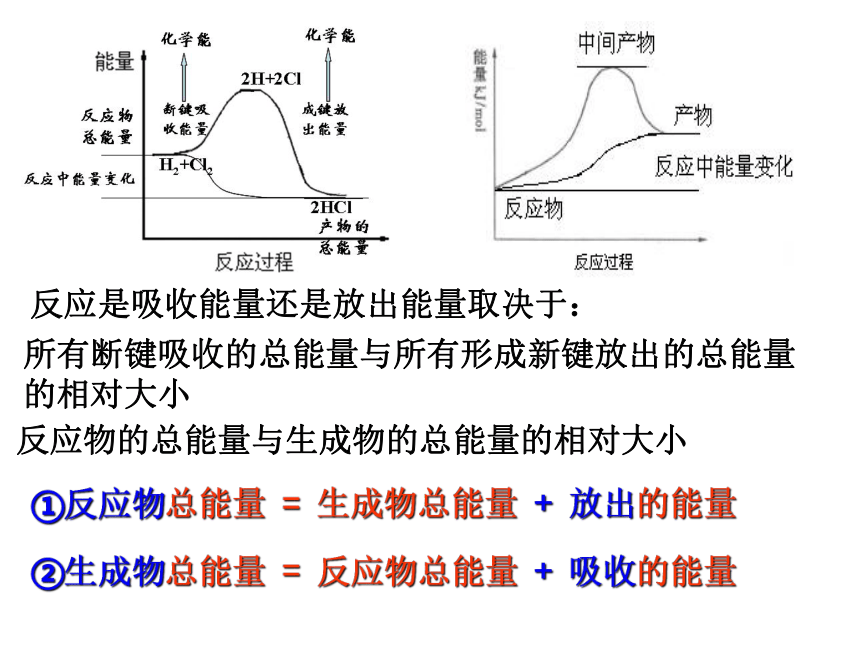
反应是吸收能量还是放出能量取决于:
所有断键吸收的总能量与所有形成新键放出的总能量的相对大小
反应物的总能量与生成物的总能量的相对大小
①反应物总能量 = 生成物总能量 + 放出的能量
②生成物总能量 = 反应物总能量 + 吸收的能量
关于本节实验的思考
反应物及其用量 酸 HCl 20mL 1mol/L HNO3 20mL 1mol/L
碱 NaOH 20mL1mol/L KOH 20mL1mol/L
混合前温度 室温 室温
混合后温度 升高3-5℃ 升高3-5℃
结 论
归纳与概括
化学能与电能
深化能量观—不同形式的能量可以相互转化
实际问题—抽象为化学问题—形成原电池模型
注重实际问题向化学问题的转化,注重原电池模型的生成过程,强调氧化还原反应中的电子转移是化学电池的反应基础
介绍化学电池的发展,突出化学技术在电池发展中
的重要贡献,感悟研制新型电池的重要性和化学电
池引起的环境的问题,形成辩证的能源观
煤燃烧
煤堆
发电机
涡轮机
燃煤发电简要流程
化学能
电能
机械能
热能
直接转化
实际问题
电流表
指针偏转
铜、锌、西红柿
化学物质
有电能产生
储有化学能
化学问题
实验一
稀H2SO4
Zn片
写出离子方程式
指明氧化剂、还原剂
用单线桥标出电子转移的方向和数目
回顾实验现象
原电池的形成
实验二
稀H2SO4
Zn片
Cu丝
接触锌片
仔细观察现象
插入铜丝
1.气体是什么?
实验二
稀H2SO4
Zn片
Cu丝
2.来源于溶液中的哪种微粒?
3.铜丝上发生了什么反应?
稀H2SO4
Zn片
稀H2SO4
Zn片
Cu丝
实验一
实验二
Zn + 2H+ = Zn2+ + H2 ↑
稀H2SO4
Zn片
Cu丝
A
稀H2SO4
Cu片
Zn片
稀H2SO4
Zn片
稀H2SO4
Zn片
Cu丝
A
稀H2SO4
Cu片
Zn片
Zn + 2H+ = Zn2+ + H2 ↑
反应装置
改变
反应方式
不同
能量转化形式
改变
原电池构成条件
归纳总结
化学电池反应的本质
化学能
电能
化学电池
氧化还原反应
以“化学电池发展”为明线,以“化学与社会和谐发展”为暗线,重在介绍化学技术在电池发展中的重要作用;围绕化学电池的发展与环境的保护问题,突出化学的重要贡献,形成辩证的能量观。进而培养学生的科学态度和社会责任感。
发展中的化学电源的教学建议
化学反应的速率和限度
化学反应速率
1.化学反应速率的概念及定量表达
2.学习控制变量的实验方法,研究影响化学
反应速率的因素
实验目的 比较MnO2 、FeCl3催化H2O2分解的效果
实验步骤
实验现象
实验结论
取两支规格相同的试管编好序号,1号试管加入0.5g的MnO2固体、2号试管加入相同质量的FeCl3固体,用两个插有相同规格注射器(盛有2ml的2%的H2O2溶液)的胶塞分别塞好。实验开始后,同时将两支注射器的溶液全部压入试管。比较两支注射器拉杆上升的快慢?
MnO2催化H2O2分解的效果比FeCl3好
1号试管上的注射器拉杆迅速上升
2号试管上的注射器拉杆缓慢上升
实验目的 比较不同温度下H2O2的分解速率
实验步骤
实验现象
实验结论
其他条件不变时,升温H2O2的分解速率加快,降温H2O2的分解速率减慢。
化学反应的速率和限度
化学反应的限度
1. 通过各种方式体会化学变化存在反应限度
2. 利用化学反应速率,建立化学平衡
3. 从反应速率和限度的角度讨论化学反应条
件的控制
感受化学反应限度
实验感受
Fe3+ + 3SCN - = Fe(SCN)3
运用对比实验证明反应未进行完全
某温度和压强下的密闭容器中,发生下列反应
2SO2+O2 2SO3
△
催化剂
时间 (min) 物质的量 浓度(mol/L) 0 10 20 30 40 50 60 70
SO2 1 0.7 0.5 0.35 0.2 0.1 0.1 0.1
O2 0.5 0.35 0.25 0.18 0.1 0.05 0.05 0.05
SO3 0 0.3 0.5 0.65 0.8 0.9 0.9 0.9
感受化学反应限度
c(SO2)
c(O2)
c(SO3)
时间 (min) 物质的量 浓度(mol/L) 0 10 20 30 40 50 60 70
SO2 1 0.7 0.5 0.35 0.2 0.1 0.1 0.1
O2 0.5 0.35 0.25 0.18 0.1 0.05 0.05 0.05
SO3 0 0.3 0.5 0.65 0.8 0.9 0.9 0.9
10 20 30 40 50 60 70
0.7 0.5 0.35 0.2 0.1 0.1 0.1
0.35 0.25 0.18 0.1 0.05 0.05 0.05
0.3 0.5 0.65 0.8 0.9 0.9 0.9
感受化学反应限度
*此条件下进行到什么时候达到了这个反应的限度
*此时的反应是否停止了?
*此时为何3种物质的浓度保持不变
某温度和压强下的密闭容器中,2SO2+O2 2SO3
△
催化剂
时间 (min) 物质的量 浓度(mol/L) 0
SO2 1
O2 0.5
SO3 0
理想
0
0
1
化学教学策略
模式:素材(手段)+ 活动 + 素养
具体:利用……素材(手段),通过……活动,实现……素养。
例如:结合生产实例,组织学生开展关于反应条件的选择与优化的讨论,促使学生形成从限度、快慢、能耗等多角度综合调控化学反应的基本思路,发展学生绿色化学的观念和辩证思维的能力。
33
注重化学认识视角和化学认识思路的培养
化学认识视角:是指对物质及其变化的特征及规律进行认识的侧面、角度或切入点。——从哪儿想?怎么想?(方法论价值)
例如:4NH3+5O2=4NO+6H2O
从反应物来看:涉及物料的种类与配比;
从反应条件来看:涉及温度与压强的控制和催化剂的选择;
从反应产物来看:设计反应的产率等一系列问题。
“从……来看”,就是认识上述反应的侧面,也是化学认识视角。
34
同样一个学习内容,可以设计出各种各样的学习任务。任务层次不同指向不同,教学结果不同。
总之,教学过程中把学习内容转化成任务,让任务与问题承载落实能力与素养的功能,在任务完成的过程中提升问题解决能力与学科素养。
35
为了培养出更多的拔尖创新人才,我们要适当设计较高层次的问题。
谢谢
教学思考
第二册 第六章 化学反应与能量
新《课标要求》
内容要求:学什么?学到什么程度?
学业要求:学了以后能干什么?
教学提示:怎么教的问题?(教学策略、学习活动建议、情境素材建议)
化学反应与能量
化学键的变化(断裂与形成)
速率与限度
反应体系的能量变化(化学能转化)
反应条件的控制
提高燃料的燃烧效率
通常表现
设计转化(氧化还原反应)
热 能
电 能
引起
应 用
吸热反应
放热反应(燃烧等)
火电
化学电池
转化(火电站)
传统电池
干电池(一次电池)
充电电池(铅蓄电池)
克服弊端
改进创新
新型电池
镍镉电池
(锂电池)
燃料电池
镍氢电池
锂离子电池
(火电与电池的综合)
应 用
本章教学内容的地位与作用
初中
选修
必修
物质变化
能量变化
化学变化
感受到反应有快慢
感受到反应中有
吸热、放热现象
理性分析化学反应的
方向、快慢和限度
化学能
热能(定量计算 )
电能(理性分析)
感性认识化学反应
的快慢和限度
化学能
热能(定性认识)
电能(感性认识)
速率、限度、方向
原子的
重新组合
反应历程
基元反应
旧键的断裂
新键的生成
学习要求
必修2
1. 知道化学键的断裂和形成是化学反应中能量变化的主要原因。
2. 通过生产、生活中的实例,了解化学能与热能的相互转化。
3. 举例说明化学能与电能的转化关系及其应用。
4. 认识提高燃料的燃烧效率、开发高能清洁燃料和研制新型电池的重要性。
5. 通过实验认识化学反应的速率和化学反应的限度,了解控制反应条件在生产和科学研究中的作用。
1.能量观
①化学键的断裂和形成是化学反应中能量变化的主要因素
②通过设计装置,可以将化学能转化为化学能
③各种形式的能量在转化过程中是守恒的
本章形成的学科思想方法
2.化学研究方法
控制变量的方法认识条件对化学反应速率的影响
3.化学与社会的和谐发展
充分利用化学能,同时关注环境的保护,实现可持续发展
素养1 宏观辨识与微观探析
素养2 变化观念与平衡思想
素养3 科学态度与社会责任
①化学反应中能量变化和化学键断裂与形成的关系
②原电池放电时的现象与电子的得失、溶液中微粒的
反应、运动方向的关系。
③从微观的角度认识化学平衡
本章化学学科核心素养的培养
三种教学设计思路
设计1:
理论
思考
为切
入点
三种教学设计思路
设计2:
实验
探究
为切
入点
三种教学设计思路
设计3:
实际
应用
为切
入点
H2+Cl2
2H+2Cl
2HCl
断键吸
收能量
成键放
出能量
化学能
化学能
反应中能量变化
反应物
总能量
产物的
总能量
H2 + Cl2 == 2HCl
点燃
反应是吸收能量还是放出能量取决于:
所有断键吸收的总能量与所有形成新键放出的总能量的相对大小
反应物的总能量与生成物的总能量的相对大小
①反应物总能量 = 生成物总能量 + 放出的能量
②生成物总能量 = 反应物总能量 + 吸收的能量
关于本节实验的思考
反应物及其用量 酸 HCl 20mL 1mol/L HNO3 20mL 1mol/L
碱 NaOH 20mL1mol/L KOH 20mL1mol/L
混合前温度 室温 室温
混合后温度 升高3-5℃ 升高3-5℃
结 论
归纳与概括
化学能与电能
深化能量观—不同形式的能量可以相互转化
实际问题—抽象为化学问题—形成原电池模型
注重实际问题向化学问题的转化,注重原电池模型的生成过程,强调氧化还原反应中的电子转移是化学电池的反应基础
介绍化学电池的发展,突出化学技术在电池发展中
的重要贡献,感悟研制新型电池的重要性和化学电
池引起的环境的问题,形成辩证的能源观
煤燃烧
煤堆
发电机
涡轮机
燃煤发电简要流程
化学能
电能
机械能
热能
直接转化
实际问题
电流表
指针偏转
铜、锌、西红柿
化学物质
有电能产生
储有化学能
化学问题
实验一
稀H2SO4
Zn片
写出离子方程式
指明氧化剂、还原剂
用单线桥标出电子转移的方向和数目
回顾实验现象
原电池的形成
实验二
稀H2SO4
Zn片
Cu丝
接触锌片
仔细观察现象
插入铜丝
1.气体是什么?
实验二
稀H2SO4
Zn片
Cu丝
2.来源于溶液中的哪种微粒?
3.铜丝上发生了什么反应?
稀H2SO4
Zn片
稀H2SO4
Zn片
Cu丝
实验一
实验二
Zn + 2H+ = Zn2+ + H2 ↑
稀H2SO4
Zn片
Cu丝
A
稀H2SO4
Cu片
Zn片
稀H2SO4
Zn片
稀H2SO4
Zn片
Cu丝
A
稀H2SO4
Cu片
Zn片
Zn + 2H+ = Zn2+ + H2 ↑
反应装置
改变
反应方式
不同
能量转化形式
改变
原电池构成条件
归纳总结
化学电池反应的本质
化学能
电能
化学电池
氧化还原反应
以“化学电池发展”为明线,以“化学与社会和谐发展”为暗线,重在介绍化学技术在电池发展中的重要作用;围绕化学电池的发展与环境的保护问题,突出化学的重要贡献,形成辩证的能量观。进而培养学生的科学态度和社会责任感。
发展中的化学电源的教学建议
化学反应的速率和限度
化学反应速率
1.化学反应速率的概念及定量表达
2.学习控制变量的实验方法,研究影响化学
反应速率的因素
实验目的 比较MnO2 、FeCl3催化H2O2分解的效果
实验步骤
实验现象
实验结论
取两支规格相同的试管编好序号,1号试管加入0.5g的MnO2固体、2号试管加入相同质量的FeCl3固体,用两个插有相同规格注射器(盛有2ml的2%的H2O2溶液)的胶塞分别塞好。实验开始后,同时将两支注射器的溶液全部压入试管。比较两支注射器拉杆上升的快慢?
MnO2催化H2O2分解的效果比FeCl3好
1号试管上的注射器拉杆迅速上升
2号试管上的注射器拉杆缓慢上升
实验目的 比较不同温度下H2O2的分解速率
实验步骤
实验现象
实验结论
其他条件不变时,升温H2O2的分解速率加快,降温H2O2的分解速率减慢。
化学反应的速率和限度
化学反应的限度
1. 通过各种方式体会化学变化存在反应限度
2. 利用化学反应速率,建立化学平衡
3. 从反应速率和限度的角度讨论化学反应条
件的控制
感受化学反应限度
实验感受
Fe3+ + 3SCN - = Fe(SCN)3
运用对比实验证明反应未进行完全
某温度和压强下的密闭容器中,发生下列反应
2SO2+O2 2SO3
△
催化剂
时间 (min) 物质的量 浓度(mol/L) 0 10 20 30 40 50 60 70
SO2 1 0.7 0.5 0.35 0.2 0.1 0.1 0.1
O2 0.5 0.35 0.25 0.18 0.1 0.05 0.05 0.05
SO3 0 0.3 0.5 0.65 0.8 0.9 0.9 0.9
感受化学反应限度
c(SO2)
c(O2)
c(SO3)
时间 (min) 物质的量 浓度(mol/L) 0 10 20 30 40 50 60 70
SO2 1 0.7 0.5 0.35 0.2 0.1 0.1 0.1
O2 0.5 0.35 0.25 0.18 0.1 0.05 0.05 0.05
SO3 0 0.3 0.5 0.65 0.8 0.9 0.9 0.9
10 20 30 40 50 60 70
0.7 0.5 0.35 0.2 0.1 0.1 0.1
0.35 0.25 0.18 0.1 0.05 0.05 0.05
0.3 0.5 0.65 0.8 0.9 0.9 0.9
感受化学反应限度
*此条件下进行到什么时候达到了这个反应的限度
*此时的反应是否停止了?
*此时为何3种物质的浓度保持不变
某温度和压强下的密闭容器中,2SO2+O2 2SO3
△
催化剂
时间 (min) 物质的量 浓度(mol/L) 0
SO2 1
O2 0.5
SO3 0
理想
0
0
1
化学教学策略
模式:素材(手段)+ 活动 + 素养
具体:利用……素材(手段),通过……活动,实现……素养。
例如:结合生产实例,组织学生开展关于反应条件的选择与优化的讨论,促使学生形成从限度、快慢、能耗等多角度综合调控化学反应的基本思路,发展学生绿色化学的观念和辩证思维的能力。
33
注重化学认识视角和化学认识思路的培养
化学认识视角:是指对物质及其变化的特征及规律进行认识的侧面、角度或切入点。——从哪儿想?怎么想?(方法论价值)
例如:4NH3+5O2=4NO+6H2O
从反应物来看:涉及物料的种类与配比;
从反应条件来看:涉及温度与压强的控制和催化剂的选择;
从反应产物来看:设计反应的产率等一系列问题。
“从……来看”,就是认识上述反应的侧面,也是化学认识视角。
34
同样一个学习内容,可以设计出各种各样的学习任务。任务层次不同指向不同,教学结果不同。
总之,教学过程中把学习内容转化成任务,让任务与问题承载落实能力与素养的功能,在任务完成的过程中提升问题解决能力与学科素养。
35
为了培养出更多的拔尖创新人才,我们要适当设计较高层次的问题。
谢谢
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
