高中化学 人教版(2019) 必修 第二册 第八章 化学与可持续发展 8.1.2海水资源的开发利用(共27张PPT)
文档属性
| 名称 | 高中化学 人教版(2019) 必修 第二册 第八章 化学与可持续发展 8.1.2海水资源的开发利用(共27张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 219.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-29 07:32:34 | ||
图片预览





文档简介
(共27张PPT)
吴 彦
海水资源的开发利用
第八章 化学与可持续发展
第1节自然资源的开发利用
一、信息设疑,引入新课
海水中蕴含哪些丰富的资源呢
水资源以及盐类资源
二、创设情境,知识迁移
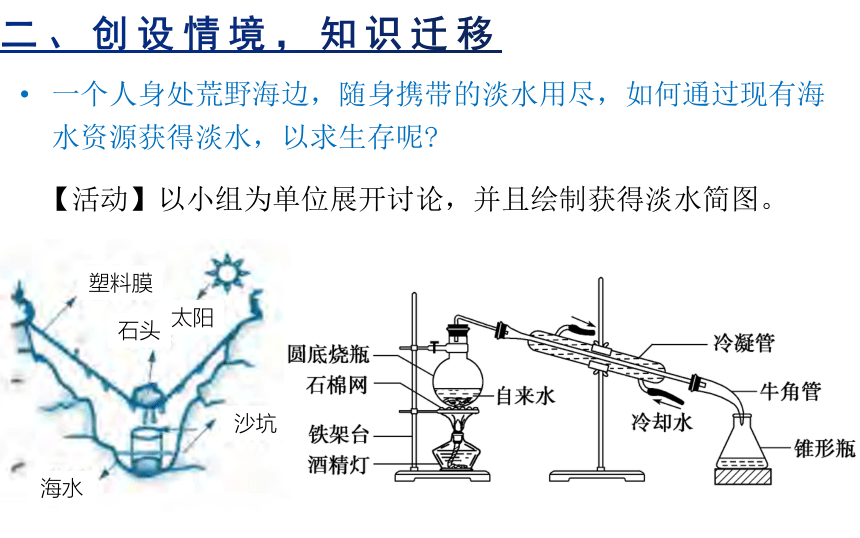
一个人身处荒野海边,随身携带的淡水用尽,如何通过现有海水资源获得淡水,以求生存呢
【活动】以小组为单位展开讨论,并且绘制获得淡水简图。
塑料膜
石头
太阳
沙坑
海水
二、创设情境,知识迁移
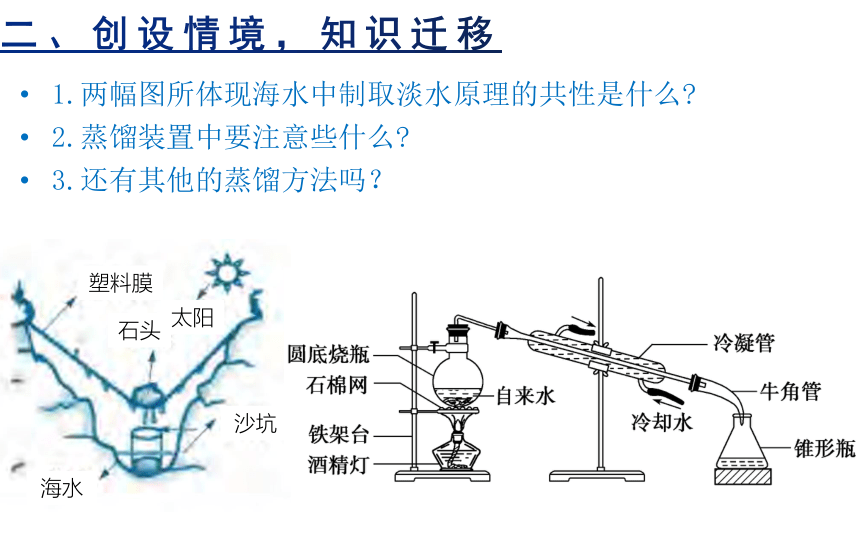
1.两幅图所体现海水中制取淡水原理的共性是什么
2.蒸馏装置中要注意些什么
3.还有其他的蒸馏方法吗?
塑料膜
石头
太阳
沙坑
海水
二、创设情境,知识迁移
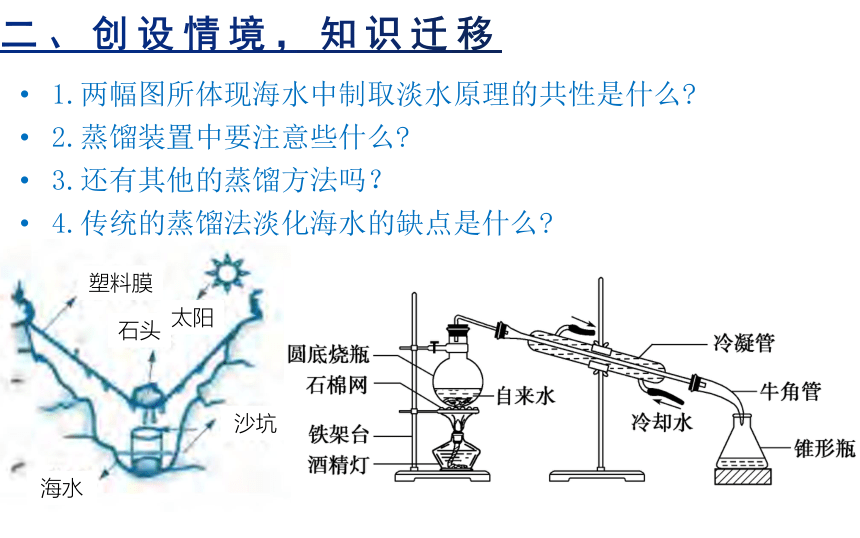
1.两幅图所体现海水中制取淡水原理的共性是什么
2.蒸馏装置中要注意些什么
3.还有其他的蒸馏方法吗?
4.传统的蒸馏法淡化海水的缺点是什么
塑料膜
石头
太阳
沙坑
海水
加热装置
一级闪蒸室
二级闪蒸室
盐水
盐水
海水
淡水
淡水
水蒸气
冷却
水蒸气
加热
二、创设情境,知识迁移
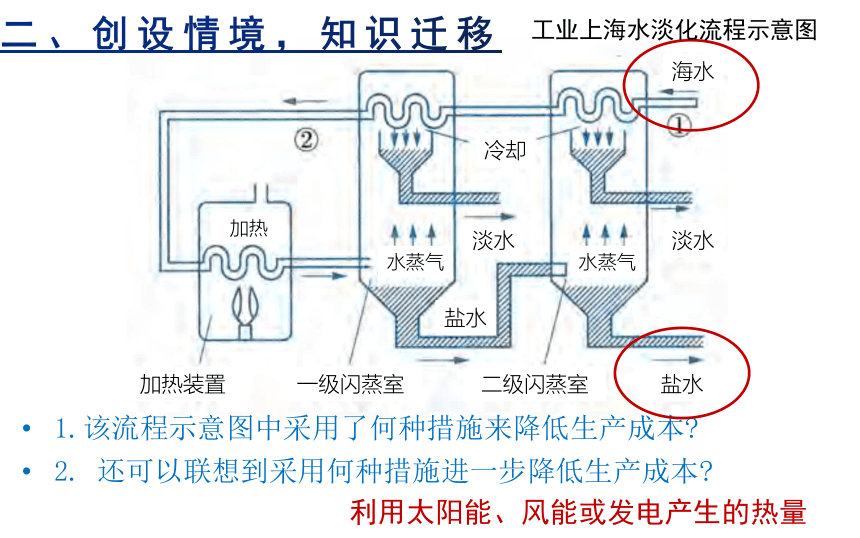
1.该流程示意图中采用了何种措施来降低生产成本
2. 还可以联想到采用何种措施进一步降低生产成本
利用太阳能、风能或发电产生的热量
工业上海水淡化流程示意图
三、融汇知识,构建关系
海水制得的粗盐中主要有哪些杂质呢
粗盐中主要含有:
泥沙等不溶性杂质,Ca2+、Mg2+、SO42-等可溶性杂质离子。
【活动】以学习小组为单位绘制海水提取 NaCl的流程简图。
海水
粗盐
苦卤
溶解
BaCl2溶液
NaOH溶液
Na2CO3溶液
沉淀
滤液
盐酸
蒸发、结晶
烘干
精盐
石灰乳
Mg(OH)2
盐酸
MgCl2溶液
一定条件
MgCl2
Mg
Cl2
四、史话引导,宏微结合
那我们从海水能否获取非金属单质呢
地球上99%溴元素以Br-的形式分布在海水中。
海水中的 Br 离子浓度很低,我们如何实现溴元素的富集呢?
四、史话引导,宏微结合
下图是工业上使用“空气吹出法”提取溴单质的过程,请你独立分析每个步骤所加试剂及各塔的作用,书写涉及的反应方程式。已知:Br2的沸点为58.76℃,NaBr的沸点为1390℃。
四、史话引导,宏微结合
海水提溴主要解决两个问题:将 Br-转化为Br2 ,再分离提纯 得到纯净的Br2 。假如你是提溴工厂的工程师,会选择哪种氧化剂,为什么?
四、史话引导,宏微结合
不同pH下氯气的用量即配氯率(实际通入氯气与理论需要氯气的体积比)与溶液中所得的Br2含量关系
四、史话引导,宏微结合
Br2 易挥发、易溶于有机溶剂,故蒸馏与萃取均可实现Br2的分离。
四、史话引导,宏微结合
四、史话引导,宏微结合
Br2 易挥发、易溶于有机溶剂,故蒸馏与萃取均可实现Br2的分离。
工业提取Br2所用卤水中溴含量约为6g/L,若用CCl4 作萃取剂,当萃取率达90% 时 ,萃取出1t 海水中的Br2,大约需要CCl4 492.4kg 。(注:工业级CCl4价格约为 7000-9000元/吨 。 )
四、史话引导,宏微结合
吹出法
1 氧化
(用氯气氧化海水中的溴离子)
2 吹出
(用空气将生成的溴吹出)
3 吸收
(用二氧化硫作还原剂使溴转化为氢溴酸,以使其与空气分离)
4 蒸馏
(再用氯气将氢溴酸氧化为溴后蒸馏分离)
四、史话引导,宏微结合
海水
富集
(浓缩)
氧化室
吹出塔
吸收塔
蒸馏塔
冷凝器
Br2
酸和Cl2
空气
SO2和H2O
Cl2和H2O(g)
工业原料
富集
物质转化、分离提纯
目标产品
环节 作用 离子方程式
氧化 氧化海水中的溴离子 Cl2+2Br-=Br2+2Cl-
吹出 用空气将生成溴吹出
吸收 用SO2做还原剂富集溴 Br2+SO2+2H2O=4H++SO42-+2Br-
蒸馏 用氯气氧化氢溴酸再蒸馏 Cl2+2Br-=Br2+2Cl-
海水提溴工艺流程示意图
四、史话引导,宏微结合
【活动】设计实验,模拟工业制取溴 Br2的过程。
热空气
含Br-的酸性溶液
a
b
A
B
C
水
NaOH溶液
五、流程建模,归纳整合
总结由工业原料制备具体化工产品的一般思路和方法。
富集
①酸碱性
②氧化性
工业原料
中间产物1
中间产物2
目标产物
转化
①除去杂质
②提纯产物
分离提纯
......
物质制备一般思路
如何实现将 I-转化成 I2?
是否直接在海水中通入氯气制备 I2 呢?
五、流程建模,归纳整合
碘单质与浓 NaOH 溶液发生的反应为:
3I2 + 6NaOH = 5NaI + NaIO3 + 3H2O
像这种将富集在四氯化碳中的碘单质利用化学转化法重新富集在水中的方法即为反萃取法。
IO3-+5I-+6H+=+3I2+3H2O
例题:碘在自然界中有很多存在形式,在地壳中主要以NaIO3形式存在,在海水中主要以I-
形式存在,其转化关系如图∶
下列说法正确的是( )。
A.反应①、②均为置换反应
B.I-与过量Cl2能发生反应∶I-+3Cl2+3H2O=IO3-+6Cl-+6H+
C.淀粉KI溶液与新制氯水互滴,现象相同
D.氧化性由强到弱的顺序是∶Cl2>I2>IO3-
五、流程建模,归纳整合
适量Cl2
②
I-
单质X
IO3-
过量Cl2
①
B
五、流程建模,归纳整合
acd
过滤
向水溶液中加入淀粉,观察溶液是否变蓝
⑤
梳理总结
海水资源的开发利用
1.海水淡化 蒸馏(物理方法)
2. 海水制盐 海水蒸馏、粗盐提纯、蒸发结晶、洗涤干燥
3.海水提溴
氧化:Cl2+2Br-=Br2+2Cl-
吹出:
吸收:Br2+SO2+2H2O=4H++SO42-+2Br-
蒸馏:Cl2+2Br-=Br2+2Cl-
4.化工流程
今日作业
1.梳理课堂笔记。
2.练透。
吴 彦
海水资源的开发利用
第八章 化学与可持续发展
第1节自然资源的开发利用
一、信息设疑,引入新课
海水中蕴含哪些丰富的资源呢
水资源以及盐类资源
二、创设情境,知识迁移
一个人身处荒野海边,随身携带的淡水用尽,如何通过现有海水资源获得淡水,以求生存呢
【活动】以小组为单位展开讨论,并且绘制获得淡水简图。
塑料膜
石头
太阳
沙坑
海水
二、创设情境,知识迁移
1.两幅图所体现海水中制取淡水原理的共性是什么
2.蒸馏装置中要注意些什么
3.还有其他的蒸馏方法吗?
塑料膜
石头
太阳
沙坑
海水
二、创设情境,知识迁移
1.两幅图所体现海水中制取淡水原理的共性是什么
2.蒸馏装置中要注意些什么
3.还有其他的蒸馏方法吗?
4.传统的蒸馏法淡化海水的缺点是什么
塑料膜
石头
太阳
沙坑
海水
加热装置
一级闪蒸室
二级闪蒸室
盐水
盐水
海水
淡水
淡水
水蒸气
冷却
水蒸气
加热
二、创设情境,知识迁移
1.该流程示意图中采用了何种措施来降低生产成本
2. 还可以联想到采用何种措施进一步降低生产成本
利用太阳能、风能或发电产生的热量
工业上海水淡化流程示意图
三、融汇知识,构建关系
海水制得的粗盐中主要有哪些杂质呢
粗盐中主要含有:
泥沙等不溶性杂质,Ca2+、Mg2+、SO42-等可溶性杂质离子。
【活动】以学习小组为单位绘制海水提取 NaCl的流程简图。
海水
粗盐
苦卤
溶解
BaCl2溶液
NaOH溶液
Na2CO3溶液
沉淀
滤液
盐酸
蒸发、结晶
烘干
精盐
石灰乳
Mg(OH)2
盐酸
MgCl2溶液
一定条件
MgCl2
Mg
Cl2
四、史话引导,宏微结合
那我们从海水能否获取非金属单质呢
地球上99%溴元素以Br-的形式分布在海水中。
海水中的 Br 离子浓度很低,我们如何实现溴元素的富集呢?
四、史话引导,宏微结合
下图是工业上使用“空气吹出法”提取溴单质的过程,请你独立分析每个步骤所加试剂及各塔的作用,书写涉及的反应方程式。已知:Br2的沸点为58.76℃,NaBr的沸点为1390℃。
四、史话引导,宏微结合
海水提溴主要解决两个问题:将 Br-转化为Br2 ,再分离提纯 得到纯净的Br2 。假如你是提溴工厂的工程师,会选择哪种氧化剂,为什么?
四、史话引导,宏微结合
不同pH下氯气的用量即配氯率(实际通入氯气与理论需要氯气的体积比)与溶液中所得的Br2含量关系
四、史话引导,宏微结合
Br2 易挥发、易溶于有机溶剂,故蒸馏与萃取均可实现Br2的分离。
四、史话引导,宏微结合
四、史话引导,宏微结合
Br2 易挥发、易溶于有机溶剂,故蒸馏与萃取均可实现Br2的分离。
工业提取Br2所用卤水中溴含量约为6g/L,若用CCl4 作萃取剂,当萃取率达90% 时 ,萃取出1t 海水中的Br2,大约需要CCl4 492.4kg 。(注:工业级CCl4价格约为 7000-9000元/吨 。 )
四、史话引导,宏微结合
吹出法
1 氧化
(用氯气氧化海水中的溴离子)
2 吹出
(用空气将生成的溴吹出)
3 吸收
(用二氧化硫作还原剂使溴转化为氢溴酸,以使其与空气分离)
4 蒸馏
(再用氯气将氢溴酸氧化为溴后蒸馏分离)
四、史话引导,宏微结合
海水
富集
(浓缩)
氧化室
吹出塔
吸收塔
蒸馏塔
冷凝器
Br2
酸和Cl2
空气
SO2和H2O
Cl2和H2O(g)
工业原料
富集
物质转化、分离提纯
目标产品
环节 作用 离子方程式
氧化 氧化海水中的溴离子 Cl2+2Br-=Br2+2Cl-
吹出 用空气将生成溴吹出
吸收 用SO2做还原剂富集溴 Br2+SO2+2H2O=4H++SO42-+2Br-
蒸馏 用氯气氧化氢溴酸再蒸馏 Cl2+2Br-=Br2+2Cl-
海水提溴工艺流程示意图
四、史话引导,宏微结合
【活动】设计实验,模拟工业制取溴 Br2的过程。
热空气
含Br-的酸性溶液
a
b
A
B
C
水
NaOH溶液
五、流程建模,归纳整合
总结由工业原料制备具体化工产品的一般思路和方法。
富集
①酸碱性
②氧化性
工业原料
中间产物1
中间产物2
目标产物
转化
①除去杂质
②提纯产物
分离提纯
......
物质制备一般思路
如何实现将 I-转化成 I2?
是否直接在海水中通入氯气制备 I2 呢?
五、流程建模,归纳整合
碘单质与浓 NaOH 溶液发生的反应为:
3I2 + 6NaOH = 5NaI + NaIO3 + 3H2O
像这种将富集在四氯化碳中的碘单质利用化学转化法重新富集在水中的方法即为反萃取法。
IO3-+5I-+6H+=+3I2+3H2O
例题:碘在自然界中有很多存在形式,在地壳中主要以NaIO3形式存在,在海水中主要以I-
形式存在,其转化关系如图∶
下列说法正确的是( )。
A.反应①、②均为置换反应
B.I-与过量Cl2能发生反应∶I-+3Cl2+3H2O=IO3-+6Cl-+6H+
C.淀粉KI溶液与新制氯水互滴,现象相同
D.氧化性由强到弱的顺序是∶Cl2>I2>IO3-
五、流程建模,归纳整合
适量Cl2
②
I-
单质X
IO3-
过量Cl2
①
B
五、流程建模,归纳整合
acd
过滤
向水溶液中加入淀粉,观察溶液是否变蓝
⑤
梳理总结
海水资源的开发利用
1.海水淡化 蒸馏(物理方法)
2. 海水制盐 海水蒸馏、粗盐提纯、蒸发结晶、洗涤干燥
3.海水提溴
氧化:Cl2+2Br-=Br2+2Cl-
吹出:
吸收:Br2+SO2+2H2O=4H++SO42-+2Br-
蒸馏:Cl2+2Br-=Br2+2Cl-
4.化工流程
今日作业
1.梳理课堂笔记。
2.练透。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
