化学人教版(2019)必修第二册6.2化学反应速率和限度 课件(共35张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册6.2化学反应速率和限度 课件(共35张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-29 10:27:51 | ||
图片预览











文档简介
(共35张PPT)
第二节 化学反应速率和限度
第1课时 化学反应的速率
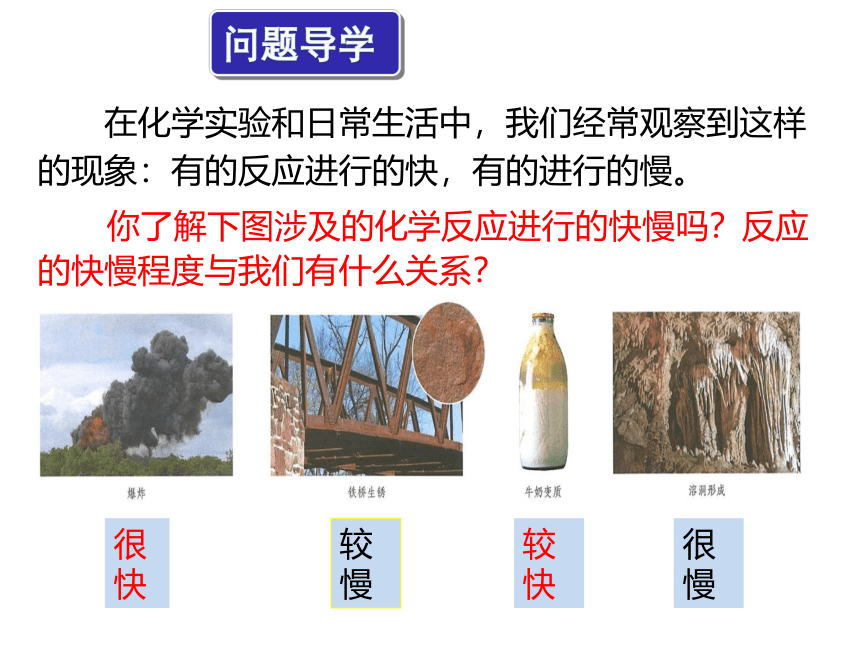
问题导学
在化学实验和日常生活中,我们经常观察到这样的现象:有的反应进行的快,有的进行的慢。
你了解下图涉及的化学反应进行的快慢吗?反应的快慢程度与我们有什么关系?
很快
较快
较慢
很慢
不同的化学反应进行的快慢千差万别,快和慢是相对而言的,我们以上的判断方法都是定性地描述反应的快慢。而在科学研究和实际应用中,往往需要定量地描述一个反应的快慢。
什么是定性?什么是定量?
例如:我们学过物理都知道:
(1) 光的传播速度是很快的;
(2) 光在空气中的传播速度3×108m/s。
定性描述
定量描述
那么化学上又是如何定量地判断一个化学反应的快慢的呢?
1. 定义:化学反应速率用来衡量化学反应过程进行的快慢的物理量。通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)表示。
2. 表示方法:
mol/(L·min) = mol·L-1·min-1
或 mol/(L·s) = mol·L-1·s-1
3. 单位:
一、化学反应速率
常用 mol · L-1
常用 s 或 min
点拨精讲
4. 单位换算:
1 mol·L-1·s-1 = 60 mol·L-1·min-1
探究内容 展示小组 点评小组 要求
当堂练习例(1) 10组(前黑板) 10组
讨论要求:
1.站起来讨论,凳子轻拿轻放;
2.学习小组长负责组织,明确小组承担的任务并做好任务分工,带领全组同学攻克难题。
展示要求:
1.书写认真、工整,规范书写每一个字,一笔一画,不连笔;
2.规范书写计算步骤,白色粉笔展示,黄色粉笔补充纠错;
点评要求:
1.对黑板上展示的内容(思路、方法、规范方面)进行点评;
2.如果自己组的思路跟展示或点评的不同,则自动起立和同学们分享自己小组的思路和方法;
3.点评结束问一问下面的同学有没有补充或者质疑;
SO2的浓度变化和速率计算 9组(后黑板) 9组
O2的浓度变化和速率计算 7组(后黑板) 7组
SO3的浓度变化和速率计算 5组(后黑板) 5组
小组讨论、展示点评
实验探究:影响化学反应速率的因素
1.实验用品:
5%H2O2,FeCl3溶液,0.1mol/LHCl,6mol/LHCl,铁粉,MnO2,冷水,热水,试管,试管夹,烧杯,钥匙,纸槽
根据以上提供药品完成课本44页实验探究:
A组完成44页(1)“反应温度影响”的实验探究,记录现象并总结;
B组设计实验方案探究(2)“反应物浓度影响”,记录现象并总结
C组根据药品设计实验探究“催化剂”对H2O2分解速率的影响
2.展示交流实验实物成果,补充分享
课堂小结
1. 定义:单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)表示。
2. 表示方法:
mol/(L·min) 或 mol/(L·s) 或 mol·L-1·min-1
3. 单位:
一、化学反应速率
4. 规律:
5. 影响化学反应速率的因素:
化学计量数之比=化学反应速率之比
温度、浓度、催化剂、表面积、压强等等
1. 在某一化学反应中,生成物B的浓度在5s内从0.5mol/L变成2.0mol/L,在这5s内B的化学反应速率为_____________。
2. 一个5L容器中,盛入8.0mol某气体反应物,5min后,测得这种气体反应物还剩余6.8mol,这种反应物的化学反应速率为________________。
0.3mol/(L·s)
0.048mol/(L·min)
【练习】
(1)指明具体物质并取正值
(2)固体和纯液体的浓度视为常数,故不用固体和纯液体表示反应速率
(3)是平均速率,而非瞬时速率。
(4)速率之比等于化学计量数之比。
即对于反应:aA + bB = cC + dD
v(A):v(B):v(C):v(D) = a:b:c:d
【注意】
(5)比较快慢:单位统一、转化为同种物质
3. 已知 4NH3+5O2=4NO+6H2O,则下列关系式正确的是( )
4/5v(NH3)=v(O2) B.4/5v(NH3)=v(H2O)
C. 5/6v(O2)=v(H2O) D. 4/5v(O2)=v(NO)
D
4. 反应 A + 3B = 2C + 2D 在四种不同条件下的化学反应速率为:
(1)v(A)=0.3mol/(L·s) (2)v(B)=0.6mol/(L·s)
(3)v(C)=0.4mol/(L·s) (4)v(D)=0.45mol/(L·s)
则该反应速率的快慢顺序为 。
(1)>(4)>(2)=(3)
【练习】比较速率大小
【注意】(5)比较快慢:单位统一、转化为同种物质
课堂小结
1. 定义:单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)表示。
2. 表示方法:
mol/(L·min) 或 mol/(L·s) 或 mol·L-1·min-1
3. 单位:
一、化学反应速率
4. 注意事项:
1. 反应4NH3+5O2 4NO+6H2O 在5L的密闭容器中进行,30s后,NO 的物质的量增加了0.3mol,此反应的平均反应速率用NO来表示为多少?
= 0.002mol/(L·s)
△c (NO) =
△n (NO)
V
=
0.3mol
5L
= 0.06 mol/L
v (NO) =
△c (NO)
△t
=
0.06mol/L
30s
当堂检测
第六章 化学反应与能量
第二节 化学反应速率和限度
第2课时 “三段式”法在化学反应速率计算中的应用
点拨精讲
例1:一定条件下,向2L容器中通入3mol氮气和10mol氢气及催化剂反应,2min后,生成氨气的物质的量为2mol,
0-2min则内v(NH3)=__________,
2min末,c(N2)=_________,H2的转化率为____________。
“三段式”
= 0.5mol/(L·min)
= 1mol/L
= 30%
转化率×100%
基本步骤:
1. 写出正确的化学反应方程式。
2. 根据题意,依次在反应方程式下列出各反应物和生成物的n始、△n及n末。
3. 根据n始与n末的差的绝对值等于△n、△n之比等于对应物质的化学计量数之比,列出关系式计算。
“三段式”
运用“三段式”法解题时的注意事项:
1. 起始量、变化量、一段时间后的量,三者物理量及单位要统一,可以是物质的量或物质的量浓度。
2. 起始量、变化量、一段时间后的量中,只有各物质的变化量之比等于对应物质的化学计量数之比,不同物质的起始量或一段时间后的量之间没有必然的关系,不能列比例式计算。
1. 某温度时在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图。由图中数据分析:
1) 反应开始2min内的X、Y、Z的化学反应速率
2.)该反应的化学方程式为:___________。
当堂检测
第六章 化学反应与能量
第二节 化学反应速率和限度
第3课时 化学反应的限度
回顾氯水的成分
思考
氯水呈浅黄绿色
说明溶解的Cl2只有一部分与水发生了化学反应,
反应只能进行到一定的限度。
溶液中微粒 三分子 _________________
四离子 ______________________
H2O、Cl2、HClO
H+、Cl-、ClO-、OH-
还有氯气,说明什么?
Cl2+H2O HCl+HClO
化学反应的限度
一、化学反应限度:
是在给定的条件下,化学反应所能达到或完成的最大程度,即该反应的限度。
决定了反应物在该条件下的最大转化率
条件改变,化学反应的限度是可能被可改变的;
同一可逆反应在不同条件(如温度、浓度、压强等)下,其反应的限度不同。
化学反应的限度
二、可逆反应
Cl2+H2O HCl+HClO
(1)定义:在同一条件下,既能向 进行,
还能向 进行的化学反应。
书写可逆反应的化学方程式时,不用“=”,用“ ”。
正反应方向
逆反应方向
化学反应的限度
二、可逆反应
①双向性:反应物 生成物
②双同性:正、逆反应是在 下同时进行的。
③共存性:反应物和生成物 存在,
即:反应物不能完全转化为生成物。
同一条件
同时
正向反应
逆向反应
(2)特征:
化学平衡状态
化学平衡状态
不平衡状态
各物质的浓度保持不变
化学平衡状态
(一)定义:如果外界条件(温度、浓度、压强等)不发生改变,
当 反应进行到一定程度时, 与 相等,反应物的浓度与生成物的浓度都 ,达到一种表面静止的状态,称为化学平衡状态,简称化学平衡。
正反应速率
逆反应速率
不再改变
标志
反应混合物中各组分的浓度保持不变
实质
v正(B)= v逆(B) ≠0
适用
可逆反应
可逆
化学平衡状态
(二)化学平衡状态的特征
化学平衡状态
1、可逆反应达到化学平衡状态,就是反应停止了?
思考
2、可逆反应达到化学平衡状态时,
各物质的浓度一定相等吗?
各物质的浓度一定成比例?
平衡时,反应并没有停止,正、逆反应仍在进行,只是正、逆反应速率相等。
平衡时,反应混合物各组分的浓度是相对自身保持一定,各组分的含量保持不变,彼此的浓度不一定相等或成比例。
化学平衡状态
1.直接标志——“正逆相等”(以合成氨为例)
(1)v正=v逆
①同一种物质的生成速率等于消耗速率;
②在化学方程式同一边的不同物质的生成速率与消耗速率之比等于化学计量数之比;
③在化学方程式两边的不同物质的生成(或消耗)速率之比等于化学计量数之比。
(三)化学平衡状态的判断依据
v正(N2)=v逆(N2)
v正(N2):v逆(H2)=1:3
v正(N2):v逆(NH3)=1:2
化学平衡状态
(2)各组分的浓度保持一定
①各组分的浓度不随时间的改变而改变;
②各组分的质量分数、物质的量分数、体积分数不随时间的改变而改变。
C(N2)不变
体系中N2的质量分数、物质的量分数、体积分数不变
化学平衡状态
2.间接标志——“变量不变”
(1)反应体系中的总压强不随时间的改变而变化(适用于反应前后气体体积不等的反应)。
(2)对于反应混合物中存在有颜色变化的物质的可逆反应,若体系中颜色不再改变,则反应达到平衡状态。
合成氨的反应体系压强不变
Cl2+H2O HCl+HClO 氯水颜色不变
化学平衡状态
(3)全是气体参加的且反应前后化学计量数改变的可逆反应,平均相对分子质量保持不变。
(4)对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等。
1mol H-H键的同时有1mol H-H键形成
化学平衡状态
1mol N≡N键断裂的同时,有 H-H键形成
1mol N≡N键断裂的同时,有 N-H键断裂
对不同物质而言,如何用化学键的断裂和形成比较?
思考
3 mol
6 mol
化学反应速率和反应限度图像
分析方法
看面,弄清楚横、纵坐标所表示的含义
看点,弄清楚曲线上点的含义,特别是曲线上的转折点、交点、最高点、最低点等
1
2
3
4
5
看量的变化,弄清楚是物质的量的变化、浓度的变化,还是转化率的变化
看辅助线,作横轴或纵轴的垂直线(如等温线、等压线、平衡线等
看线,弄清楚线的走向和变化趋势
一、看图像
化学反应速率和反应限度图像
1.在温度和容积不变的密闭容器中,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图所示,则下列叙述正确的是( )
A.该反应的化学方程式为
A(g)+3B(g) 2C(g)
B.到达t1 s时刻该反应停止
C.(t1+10) s时,升高温度,正、逆反应速率加快
D.若该反应在绝热容器中进行,也在t1时刻达到平衡
C
(2)一段时间后,该反应达到化学平衡,下列能说明反应达到化学平衡状态的是_________(填序号)。
①v正(SO2)=2v逆(O2)
②v(SO2)=v(SO3)
③单位时间内消耗a mol SO2,同时生成a mol SO3
④SO2、O2和SO3的浓度之比为2∶1∶2
⑤混合气体的总的物质的量不再改变
⑥混合气体的压强不再改变
⑦混合气体的密度不再改变
⑧混合气体的平均相对分子质量不再改变
①⑤⑥⑧
当堂检测
化学平衡状态
可逆反应
定义、特征及判断依据、变式应用
特征及判断
定义
化学反应限度
化学反应限度
看图像、想规律、做判断
化学反应速率和反应限度图像
课堂小结
第二节 化学反应速率和限度
第1课时 化学反应的速率
问题导学
在化学实验和日常生活中,我们经常观察到这样的现象:有的反应进行的快,有的进行的慢。
你了解下图涉及的化学反应进行的快慢吗?反应的快慢程度与我们有什么关系?
很快
较快
较慢
很慢
不同的化学反应进行的快慢千差万别,快和慢是相对而言的,我们以上的判断方法都是定性地描述反应的快慢。而在科学研究和实际应用中,往往需要定量地描述一个反应的快慢。
什么是定性?什么是定量?
例如:我们学过物理都知道:
(1) 光的传播速度是很快的;
(2) 光在空气中的传播速度3×108m/s。
定性描述
定量描述
那么化学上又是如何定量地判断一个化学反应的快慢的呢?
1. 定义:化学反应速率用来衡量化学反应过程进行的快慢的物理量。通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)表示。
2. 表示方法:
mol/(L·min) = mol·L-1·min-1
或 mol/(L·s) = mol·L-1·s-1
3. 单位:
一、化学反应速率
常用 mol · L-1
常用 s 或 min
点拨精讲
4. 单位换算:
1 mol·L-1·s-1 = 60 mol·L-1·min-1
探究内容 展示小组 点评小组 要求
当堂练习例(1) 10组(前黑板) 10组
讨论要求:
1.站起来讨论,凳子轻拿轻放;
2.学习小组长负责组织,明确小组承担的任务并做好任务分工,带领全组同学攻克难题。
展示要求:
1.书写认真、工整,规范书写每一个字,一笔一画,不连笔;
2.规范书写计算步骤,白色粉笔展示,黄色粉笔补充纠错;
点评要求:
1.对黑板上展示的内容(思路、方法、规范方面)进行点评;
2.如果自己组的思路跟展示或点评的不同,则自动起立和同学们分享自己小组的思路和方法;
3.点评结束问一问下面的同学有没有补充或者质疑;
SO2的浓度变化和速率计算 9组(后黑板) 9组
O2的浓度变化和速率计算 7组(后黑板) 7组
SO3的浓度变化和速率计算 5组(后黑板) 5组
小组讨论、展示点评
实验探究:影响化学反应速率的因素
1.实验用品:
5%H2O2,FeCl3溶液,0.1mol/LHCl,6mol/LHCl,铁粉,MnO2,冷水,热水,试管,试管夹,烧杯,钥匙,纸槽
根据以上提供药品完成课本44页实验探究:
A组完成44页(1)“反应温度影响”的实验探究,记录现象并总结;
B组设计实验方案探究(2)“反应物浓度影响”,记录现象并总结
C组根据药品设计实验探究“催化剂”对H2O2分解速率的影响
2.展示交流实验实物成果,补充分享
课堂小结
1. 定义:单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)表示。
2. 表示方法:
mol/(L·min) 或 mol/(L·s) 或 mol·L-1·min-1
3. 单位:
一、化学反应速率
4. 规律:
5. 影响化学反应速率的因素:
化学计量数之比=化学反应速率之比
温度、浓度、催化剂、表面积、压强等等
1. 在某一化学反应中,生成物B的浓度在5s内从0.5mol/L变成2.0mol/L,在这5s内B的化学反应速率为_____________。
2. 一个5L容器中,盛入8.0mol某气体反应物,5min后,测得这种气体反应物还剩余6.8mol,这种反应物的化学反应速率为________________。
0.3mol/(L·s)
0.048mol/(L·min)
【练习】
(1)指明具体物质并取正值
(2)固体和纯液体的浓度视为常数,故不用固体和纯液体表示反应速率
(3)是平均速率,而非瞬时速率。
(4)速率之比等于化学计量数之比。
即对于反应:aA + bB = cC + dD
v(A):v(B):v(C):v(D) = a:b:c:d
【注意】
(5)比较快慢:单位统一、转化为同种物质
3. 已知 4NH3+5O2=4NO+6H2O,则下列关系式正确的是( )
4/5v(NH3)=v(O2) B.4/5v(NH3)=v(H2O)
C. 5/6v(O2)=v(H2O) D. 4/5v(O2)=v(NO)
D
4. 反应 A + 3B = 2C + 2D 在四种不同条件下的化学反应速率为:
(1)v(A)=0.3mol/(L·s) (2)v(B)=0.6mol/(L·s)
(3)v(C)=0.4mol/(L·s) (4)v(D)=0.45mol/(L·s)
则该反应速率的快慢顺序为 。
(1)>(4)>(2)=(3)
【练习】比较速率大小
【注意】(5)比较快慢:单位统一、转化为同种物质
课堂小结
1. 定义:单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)表示。
2. 表示方法:
mol/(L·min) 或 mol/(L·s) 或 mol·L-1·min-1
3. 单位:
一、化学反应速率
4. 注意事项:
1. 反应4NH3+5O2 4NO+6H2O 在5L的密闭容器中进行,30s后,NO 的物质的量增加了0.3mol,此反应的平均反应速率用NO来表示为多少?
= 0.002mol/(L·s)
△c (NO) =
△n (NO)
V
=
0.3mol
5L
= 0.06 mol/L
v (NO) =
△c (NO)
△t
=
0.06mol/L
30s
当堂检测
第六章 化学反应与能量
第二节 化学反应速率和限度
第2课时 “三段式”法在化学反应速率计算中的应用
点拨精讲
例1:一定条件下,向2L容器中通入3mol氮气和10mol氢气及催化剂反应,2min后,生成氨气的物质的量为2mol,
0-2min则内v(NH3)=__________,
2min末,c(N2)=_________,H2的转化率为____________。
“三段式”
= 0.5mol/(L·min)
= 1mol/L
= 30%
转化率×100%
基本步骤:
1. 写出正确的化学反应方程式。
2. 根据题意,依次在反应方程式下列出各反应物和生成物的n始、△n及n末。
3. 根据n始与n末的差的绝对值等于△n、△n之比等于对应物质的化学计量数之比,列出关系式计算。
“三段式”
运用“三段式”法解题时的注意事项:
1. 起始量、变化量、一段时间后的量,三者物理量及单位要统一,可以是物质的量或物质的量浓度。
2. 起始量、变化量、一段时间后的量中,只有各物质的变化量之比等于对应物质的化学计量数之比,不同物质的起始量或一段时间后的量之间没有必然的关系,不能列比例式计算。
1. 某温度时在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图。由图中数据分析:
1) 反应开始2min内的X、Y、Z的化学反应速率
2.)该反应的化学方程式为:___________。
当堂检测
第六章 化学反应与能量
第二节 化学反应速率和限度
第3课时 化学反应的限度
回顾氯水的成分
思考
氯水呈浅黄绿色
说明溶解的Cl2只有一部分与水发生了化学反应,
反应只能进行到一定的限度。
溶液中微粒 三分子 _________________
四离子 ______________________
H2O、Cl2、HClO
H+、Cl-、ClO-、OH-
还有氯气,说明什么?
Cl2+H2O HCl+HClO
化学反应的限度
一、化学反应限度:
是在给定的条件下,化学反应所能达到或完成的最大程度,即该反应的限度。
决定了反应物在该条件下的最大转化率
条件改变,化学反应的限度是可能被可改变的;
同一可逆反应在不同条件(如温度、浓度、压强等)下,其反应的限度不同。
化学反应的限度
二、可逆反应
Cl2+H2O HCl+HClO
(1)定义:在同一条件下,既能向 进行,
还能向 进行的化学反应。
书写可逆反应的化学方程式时,不用“=”,用“ ”。
正反应方向
逆反应方向
化学反应的限度
二、可逆反应
①双向性:反应物 生成物
②双同性:正、逆反应是在 下同时进行的。
③共存性:反应物和生成物 存在,
即:反应物不能完全转化为生成物。
同一条件
同时
正向反应
逆向反应
(2)特征:
化学平衡状态
化学平衡状态
不平衡状态
各物质的浓度保持不变
化学平衡状态
(一)定义:如果外界条件(温度、浓度、压强等)不发生改变,
当 反应进行到一定程度时, 与 相等,反应物的浓度与生成物的浓度都 ,达到一种表面静止的状态,称为化学平衡状态,简称化学平衡。
正反应速率
逆反应速率
不再改变
标志
反应混合物中各组分的浓度保持不变
实质
v正(B)= v逆(B) ≠0
适用
可逆反应
可逆
化学平衡状态
(二)化学平衡状态的特征
化学平衡状态
1、可逆反应达到化学平衡状态,就是反应停止了?
思考
2、可逆反应达到化学平衡状态时,
各物质的浓度一定相等吗?
各物质的浓度一定成比例?
平衡时,反应并没有停止,正、逆反应仍在进行,只是正、逆反应速率相等。
平衡时,反应混合物各组分的浓度是相对自身保持一定,各组分的含量保持不变,彼此的浓度不一定相等或成比例。
化学平衡状态
1.直接标志——“正逆相等”(以合成氨为例)
(1)v正=v逆
①同一种物质的生成速率等于消耗速率;
②在化学方程式同一边的不同物质的生成速率与消耗速率之比等于化学计量数之比;
③在化学方程式两边的不同物质的生成(或消耗)速率之比等于化学计量数之比。
(三)化学平衡状态的判断依据
v正(N2)=v逆(N2)
v正(N2):v逆(H2)=1:3
v正(N2):v逆(NH3)=1:2
化学平衡状态
(2)各组分的浓度保持一定
①各组分的浓度不随时间的改变而改变;
②各组分的质量分数、物质的量分数、体积分数不随时间的改变而改变。
C(N2)不变
体系中N2的质量分数、物质的量分数、体积分数不变
化学平衡状态
2.间接标志——“变量不变”
(1)反应体系中的总压强不随时间的改变而变化(适用于反应前后气体体积不等的反应)。
(2)对于反应混合物中存在有颜色变化的物质的可逆反应,若体系中颜色不再改变,则反应达到平衡状态。
合成氨的反应体系压强不变
Cl2+H2O HCl+HClO 氯水颜色不变
化学平衡状态
(3)全是气体参加的且反应前后化学计量数改变的可逆反应,平均相对分子质量保持不变。
(4)对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等。
1mol H-H键的同时有1mol H-H键形成
化学平衡状态
1mol N≡N键断裂的同时,有 H-H键形成
1mol N≡N键断裂的同时,有 N-H键断裂
对不同物质而言,如何用化学键的断裂和形成比较?
思考
3 mol
6 mol
化学反应速率和反应限度图像
分析方法
看面,弄清楚横、纵坐标所表示的含义
看点,弄清楚曲线上点的含义,特别是曲线上的转折点、交点、最高点、最低点等
1
2
3
4
5
看量的变化,弄清楚是物质的量的变化、浓度的变化,还是转化率的变化
看辅助线,作横轴或纵轴的垂直线(如等温线、等压线、平衡线等
看线,弄清楚线的走向和变化趋势
一、看图像
化学反应速率和反应限度图像
1.在温度和容积不变的密闭容器中,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图所示,则下列叙述正确的是( )
A.该反应的化学方程式为
A(g)+3B(g) 2C(g)
B.到达t1 s时刻该反应停止
C.(t1+10) s时,升高温度,正、逆反应速率加快
D.若该反应在绝热容器中进行,也在t1时刻达到平衡
C
(2)一段时间后,该反应达到化学平衡,下列能说明反应达到化学平衡状态的是_________(填序号)。
①v正(SO2)=2v逆(O2)
②v(SO2)=v(SO3)
③单位时间内消耗a mol SO2,同时生成a mol SO3
④SO2、O2和SO3的浓度之比为2∶1∶2
⑤混合气体的总的物质的量不再改变
⑥混合气体的压强不再改变
⑦混合气体的密度不再改变
⑧混合气体的平均相对分子质量不再改变
①⑤⑥⑧
当堂检测
化学平衡状态
可逆反应
定义、特征及判断依据、变式应用
特征及判断
定义
化学反应限度
化学反应限度
看图像、想规律、做判断
化学反应速率和反应限度图像
课堂小结
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
