第一章:化学反应与能量转化课后练习(含解析)2022-2023学年上学期高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第一章:化学反应与能量转化课后练习(含解析)2022-2023学年上学期高二化学鲁科版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-29 00:00:00 | ||
图片预览




文档简介
第一章:化学反应与能量转化 课后练习
一、单选题
1.根据如图所示的过程中的能量变化情况,判断下列说法正确的是
A.H2(g)转化为氢原子是一个放热过程
B.1molH2和1molCl2的总能量比2molHCl的总能量高
C.1个HCl(g)分子中的化学键断裂时需要吸收431kJ能量
D.2HCl(g)=H2(g)+Cl2(g)的反应热ΔH=—183kJ mol-1
2.实验室中利用固体KMnO4进行如图实验,下列说法正确的是
A.本实验中若用稀盐酸代替浓盐酸会减慢反应速率,但不影响单质H的生成量
B.气体H的量小于0.25mol
C.根据盖斯定律,直接用KMnO4和浓盐酸反应的热效应与本实验中的总热效应相等
D.气体H是一种常见的氧化性气体,一般在反应中只表现氧化性
3.有关如图装置的叙述错误的是
A.Fe电极的电极反应式为:Fe – 3e- = Fe3 +
B.Pt电极上的反应为:O2 + 2H2O + 4e-=4OH-
C.该装置中Fe被腐蚀
D.电流由Pt电极经导线流向Fe极
4.下列有关热化学方程式的叙述正确的是
A.同温同压下,反应在光照和点燃条件下的不同
B.,则石墨比金刚石稳定
C.由可知,稀醋酸与溶液反应生成液态水时释放的热量
D.,表示甲烷的燃烧热为
5.下列正确的是
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3kJ·mol-1
B.500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)2NH3(g)ΔH=-38.6kJ·mol-1
C.已知C(石墨,s)=C(金刚石,s)△H=+1.9kJ·mol 1,则石墨比金刚石稳定
D.S(g)+O2(g)=SO2(g)ΔH1;S(s)+O2(g)=SO2(g)ΔH2,则ΔH1>ΔH2
6.有关CO2(g)+CH4(g) = 2CO(g)+2H2(g) ΔH1=+247 kJ·mol-1的说法正确的是
A.该反应在任何温度下都可自发进行
B.反应CO2(s)+CH4(g) = 2CO(g)+2H2(g) ΔH2<+247 kJ·mol-1
C.选择高效催化剂可以降低反应的活化能,提高化学反应速率
D.反应中每生成1 mol H2,转移电子的数目为2×6.02×1023
7.利用点滴板进行实验,既可以节约药品用量,又便于观察实验现象。下列关于如图的实验,说法正确的是
A.试纸变红不褪色,体现新制氯水有酸性
B.孔穴2中溶液变黄,发生置换反应
C.向孔穴3中滴加铁氰化钾试液,溶液变血红色
D.露置空气一段时间后,孔穴4中固体黄色加深
8.有关键能(破坏1mol共价键吸收的能量)数据如表
化学键 Si-O O=O Si-Si
键能/kJ mol-1 X 498.8 176
晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s)△H=-989.2kJ mol-1,则X的值为( )
(已知1molSi中含有2molSi-Si键,1molSiO2中含有4molSi-O键)A.460 B.423.3 C.832 D.920
9.电池比能量高,可用于汽车、航天等领域。电池反应式为:,放电时,下列说法不正确的是
A.在负极失去电子 B.在正极发生还原反应
C.阳离子由正极移向负极 D.电极不能直接与水溶液接触
10.下列有关放热反应、吸热反应的说法不正确的是
A.吸热反应的发生都需要加热,放热反应在常温下一定容易发生
B.若某反应正向进行时为放热反应,则该反应逆向进行时必为吸热反应
C.由“C(石墨)=C(金刚石)是吸热反应”可知石墨比金刚石稳定
D.不管是吸热反应还是放热反应,升高温度,反应速率均增大
11.下列热化学方程式正确的是
A.甲烷的标准燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa 下,将0.5 mol N2 和 1.5 mol H2 置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)2NH3(g)ΔH=-38.6 kJ·mol-1
C.已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为:H2(g)+O2(g)H2O(g) ΔH=-242 kJ/mol
D.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)= 2CO(g)+O2(g)反应的ΔH=+283.0 kJ·mol-1
12.下列叙述不正确的是
A.金属的化学腐蚀比金属的电化学腐蚀更普遍
B.用铜质铆钉铆接铁板,铁板易被腐蚀
C.钢铁在干燥的空气中不易被腐蚀
D.把铜片和锌片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
13.下列关于实验现象的描述错误的是
A.把铜片和铁片紧靠在一起浸入稀H2SO4中,铜片表面出现气泡
B.用石墨棒作阳极,铁片作阴极,电解NaCl溶液,石墨棒和铁片表面都出现气泡
C.把铜片插入FeCl3溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴CuCl2溶液,气泡放出速率加快
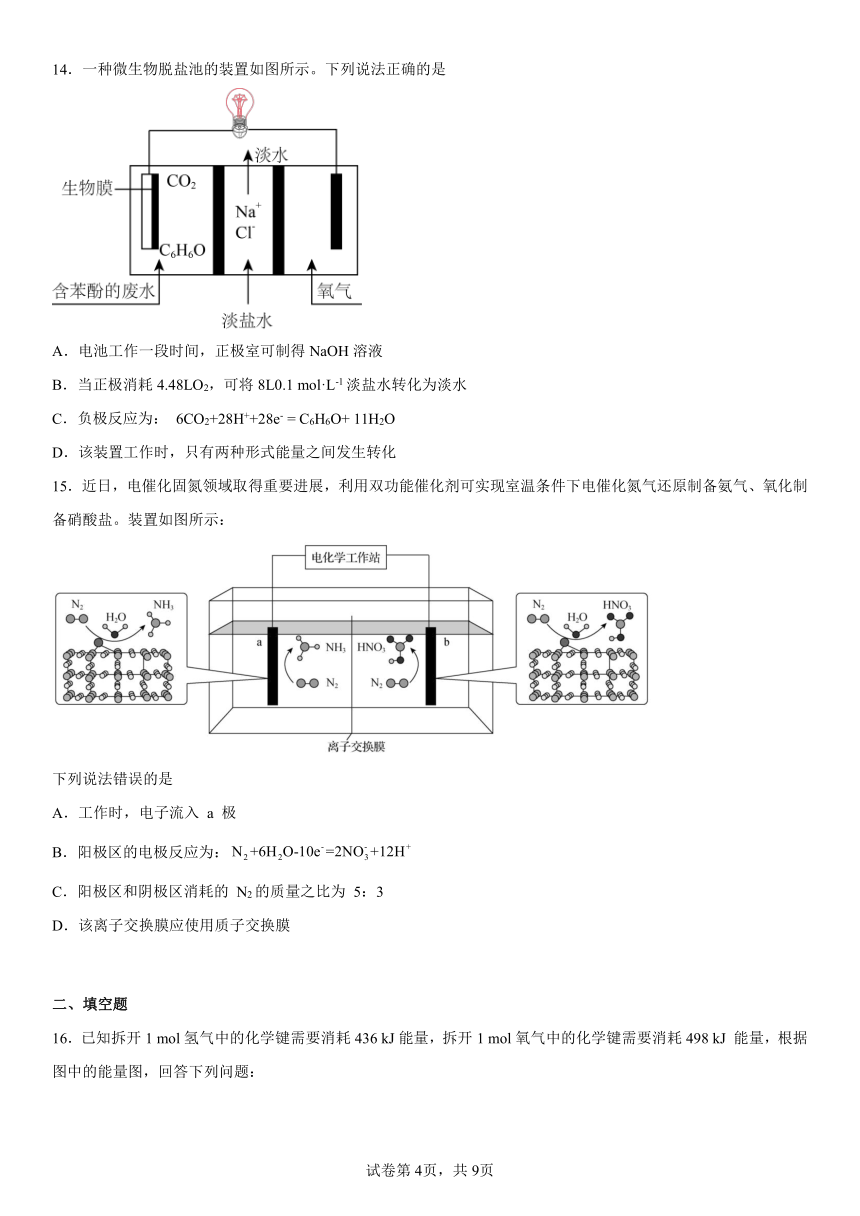
14.一种微生物脱盐池的装置如图所示。下列说法正确的是
A.电池工作一段时间,正极室可制得NaOH溶液
B.当正极消耗4.48LO2,可将8L0.1 mol·L-1淡盐水转化为淡水
C.负极反应为: 6CO2+28H++28e- = C6H6O+ 11H2O
D.该装置工作时,只有两种形式能量之间发生转化
15.近日,电催化固氮领域取得重要进展,利用双功能催化剂可实现室温条件下电催化氮气还原制备氨气、氧化制备硝酸盐。装置如图所示:
下列说法错误的是
A.工作时,电子流入 a 极
B.阳极区的电极反应为:
C.阳极区和阴极区消耗的 N2的质量之比为 5:3
D.该离子交换膜应使用质子交换膜
二、填空题
16.已知拆开1 mol氢气中的化学键需要消耗436 kJ能量,拆开1 mol氧气中的化学键需要消耗498 kJ 能量,根据图中的能量图,回答下列问题:
(1)分别写出①②的数值:①___________kJ;②____________kJ。
(2)生成H2O(g)中的1 mol H—O键放出_____________kJ的能量。
(3)已知:H2O(l)=H2O(g) ΔH = + 44 kJ·mol-1,试写出2 mol氢气在足量氧气中完全燃烧生成液态水的热化学方程式__________________。
17.2021年9月7日11时01分,长征四号丙遥四十运载火箭在太原卫星发射中心点火升空,成功将高光谱观测卫星(又名高分五号02星)送入预定轨道。该星将全面提升我国大气、水体、陆地的高光谱观测能力,满足我国在环境综合监测等方面的迫切需求。该系列火箭各级全部使用和偏二甲肼()作推进剂。
Ⅰ.完成下列问题
(1)与偏二甲肼燃烧产物只有、、,并放出大量热,已知10.0g液态偏二甲肼与液态完全燃烧可放出425kJ热量,该反应的热化学方程式为___________。
Ⅱ.目前火箭推进剂中较普遍的组合是肼()和,两者反应生成和水蒸气。已知:
①
②
③
(2)和反应的热化学方程式为___________。
(3)和可作为火箭推进剂的主要原因是___________。
(4)试用化学反应能量图表示该反应过程中能量的变化___________。
(5)已知相关反应的化学键键能数据如表所示:
化学键 N—H N—N N≡N O—H
E/(kJ/mol) 390 190 946 460
则使1mol分子中化学键完全断裂时需要吸收的能量是___________kJ。
(6)有人认为若用氟气代替作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:
①写出肼和氟气反应的热化学方程式:___________。
②尽管氟气与肼反应释放的能量更大,但是氟气至今未被应用在火箭上,主要的原因是___________。
18.1909年,化学家哈伯用N2和H2在高温高压条件下首次合成了氨气,反应原理为N2(g)+3H2(g)2NH3(g),该反应的能量变化如图所示(a、b均大于零),回答下列问题:
(1)根据图示写出生成2molNH3时的热化学方程式:___。
(2)在500℃、30MPa下,断裂11molH—H键、1molN—H键、1molN≡N键需要吸收的能量分别为436kJ、391kJ、946.5kJ。
①每消耗0.6molN2该反应放出的热量为___。
②向某一密闭容器中充入1.5molH2(g)和0.5molN2(g),在催化剂条件下进行上述反应,此时断裂的H—H键吸收的热量___(填“>”、“<”“=”)654,原因是___。
19.回答下列问题:
(1)指出下列变化能量是怎样转化的:学校燃烧煤煮饭_________,给手机的电池充电_________。
(2)磷元素有多种性质不同的单质,红磷(结构复杂用“P”表示)和白磷(P4)是磷的两种同素异形体,充分燃烧之后的产物都是五氧化二磷。在25 ℃、101 kPa下,31 g白磷完全转化为红磷,放出11 kJ的热量,根据以上事实回答下列问题:
①红磷转化为白磷属于_________反应(填“放热”或“吸热”)。
②二者更稳定的是_________。(填“白磷”或“红磷”)。
(3)拆开1 mol H—H键、1 mol I—I、1 mol H—I键需要吸收的能量为436kJ、151k J、299k J。则氢气和碘生成1 mol HI需要_________(填“放出”或“吸收”)_________k J的热量。
20.科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。”利用盖斯定律可计算某些特殊反应的热效应。
(1)已知:①P4(s,白磷)+5O2(g)=P4O10(s) △H1=-2983.2kJ/mol;
②P(s,红磷)+O2(g)=P4O10(s) △H2=-738.5kJ/mol。
则白磷转化为红磷的热化学方程式____,相同的状况下,白磷的稳定性比红磷____(填“高”或“低”)。
(2)红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
①PCl5分解生成PCl3和Cl2的热化学方程式____。
②P和Cl2分两步反应生成1molPCl5的△H3=____。
21.(1)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,下图是N2(g)和H2(g)反应生成1mo1NH3(g)过程中能量变化示意图,
请写出N2和H2反应的热化学方程式:_____________________________;
(2)若已知下列数据:
化学键 H-H N≡N
键能/kJ mol-1 435 943
试根据表中及图中数据计算N-H的键能______kJ mol-1
(3)已知100ml lmol/L的氢氧化钠溶液与适量硫酸溶液完全反应放出5.73kJ的热量,请写出表示中和热的热化学方程式________________________________;
(4)已知1克氢气完全燃烧生成液态水时放出akJ的热量,请写出表示氢气燃烧热的热化学方程式____________________________________________。
22.由锌片、铜片和200mL稀硫酸组成的原电池如图所示。
(1)原电池的负极反应是___,正极反应是___。
(2)电流的方向是___。
(3)一段时间后,当在铜片上放出1.12L(标准状况下)气体时,H2SO4恰好消耗一半。则产生这些气体的同时,共消耗___g锌,___个电子通过了导线,原硫酸的物质的量浓度是__ (设溶液体积不变)。
23.乙炔()气体在氧气中完全燃烧放出大量热,形成高温火焰(氧炔焰),可以用于焊接或切割钢板。已知乙炔在氧气中完全燃烧的热化学方程式是: 。则1kg乙炔在氧气中完全燃烧放出多少热__________?
24.回答下列问题:
(1)实验测得10g液态甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出227kJ的热量。试写出甲醇燃烧的热化学方程式:_____。
(2)现已知A2(g)和B2(g)反应生成1 molAB3(g)过程中能量变化示意如下图。根据下列已知键能数据计算A-B键键能为___________kJ/mol。
化学键 A≡A B-B
键能(kJ/mol) 946 436
(3)在如图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
①从实验装置上看,图中缺少的一种玻璃仪器是___________。烧杯间填满碎纸条的作用是___________。若大烧杯上不盖硬纸板,求得的中和热ΔH___________(填“偏大”“偏小”或“无影响”)。
②甲同学用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液进行中和反应,通过计算得到ΔH=-54.8kJ/mol,该结果与ΔH=-57.3kJ·mol-1有偏差,产生此偏差的原因可能是___________。
A、用温度计测定HCl溶液起始温度后直接测定NaOH溶液的温度
B、一次性把NaOH溶液倒入盛有硫酸的小烧杯中
C.实验装置保温、隔热效果差
③若改用60 mL 0.50 mol·L-1盐酸与60 mL 0.55 mol·L-1NaOH溶液进行反应,两个实验相比,所放出的热量___________(填“相等”或“不相等”),所求中和热___________(填“相等”或“不相等”)若用50mL0.5mol·L-1醋酸代替盐酸溶液进行上述实验,测得反应前后温度的变化值会___________(填“偏大”、“偏小”或“不受影响”)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【分析】由反应热与反应物键能之和与生成物的键能之和的差值相等可得,氢气与氯气生成氯化氢的反应热ΔH=(436kj/mol+243kJ/mol)—431kJ/mol×2=—183kJ/mol,反应的热化学方程式为H2(g)+Cl2(g)=2HCl(g) ΔH=—183kJ/mol。
【详解】A.氢气转化为氢原子时,破坏共价键需要吸收热量,故A错误;
B.由分析可知,该反应为放热反应,1mol氢气和1mol氯气的总能量比2mol氯化氢的总能量高,故B正确;
C.由图可知,1mol氯化氢分子中的化学键断裂时需要吸收431kJ能量,故C错误;
D.由分析可知,氢气与氯气生成氯化氢的的热化学方程式为H2(g)+Cl2(g)=2HCl(g) ΔH=—183kJ/mol,逆反应的焓变与正反应的数值相同、符号相反,则2HCl(g)=H2(g)+Cl2(g)的反应热ΔH=+183kJ mol-1,故D错误;
故选B。
2.B
【详解】A.稀盐酸与MnO2不反应,氯气的生成量减小,故A错误;
B.分析反应整个过程可知化合价降低的元素是锰,化合价升高的元素是氧和氯,反应中转移总电子数为0.1×5=0.5mol,则生成氧气和氯气时转移电子数之和为0.5mol,故氯气的量少于0.25mol,故B正确 ;
C.直接用KMnO4和浓盐酸反应与本实验的产物不同,不符合盖斯定律,故C错误;
D.氯气是一种常见的氧化性气体,在与水或碱等反应中都既表现氧化性又表现还原性,故D错误;
选B。
3.A
【分析】该装置是原电池,根据电极的活泼性知Fe电极是负极,Pt电极是正极
【详解】A.Fe电极是负极,发生氧化反应,电极反应式为,A项符合题意;
B.Pt电极是正极且通入空气,发生还原反应的是氧气,根据碱性环境,电极反应式为,B项不符合题意;
C.Fe发生了氧化反应生成了Fe2+,故Fe被腐蚀,C项不符合题意;
D.电流由正极流向负极,故由Pt电极经导线流向Fe电极,D项不符合题意;
故正确选项为A
4.B
【详解】A.反应焓变与条件无关,同温同压下,反应在光照和点燃条件下的相同,A错误;
B.,反应放热,石墨的能量更低,石墨比金刚石稳定,B正确;
C.稀醋酸为弱酸,电离时要吸热,稀醋酸与反应生成液态水时释放的能量小于57.3kJ,C错误;
D.燃烧热是1mol可燃物完全燃烧生成指定产物所放出的热量,甲烷完全燃烧的产物中的水应为液态,D错误;
故选B。
5.C
【详解】A.燃烧热指的是1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,注意生成的水应为液态而不能为气态,故A错误;
B.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,则1molN2完全反应放热大于38.6kJ,其热化学反应方程式为:N2(g)+3H2(g) 2NH3(g)△H<-38.6 kJ/mol,故B错误;
C.已知C(石墨,s)→C(金刚石,s)△H>0,石墨的能量低于金刚石,石墨的稳定性高于金刚石,故C正确;
D.S(s)比S(g)稳定,能量低,ΔH1<ΔH2,故D错误;
故选:C。
6.C
【详解】A.该反应为气体体积增大的吸热反应,ΔH>0,ΔS>0,则高温时ΔG=ΔH-TΔS<0,反应自发进行,A错误;
B.CO2(g)+CH4(g) = 2CO(g)+2H2(g) ΔH1=+247 kJ·mol-1,CO2的固态比气态的能量低,则反应CO2(s)+CH4(g) = 2CO(g)+2H2(g) ΔH2>+247 kJ·mol-1,B错误;
C.选择高效催化剂可以降低反应的活化能,从而提高化学反应速率,C正确;
D.根据反应方程式CO2(g)+CH4(g) = 2CO(g)+2H2(g)可知,CO2转化为CO,C元素化合价降低2价,CH4转化为CO,C元素化合价升高6价,CH4转化为H2,H元素化合价共降低4价,所以每生成2molH2,转移6mol电子,则反应中每生成1 mol H2,转移电子的数目为3×6.02×1023,D错误;
故选C。
7.B
【详解】A.新制氯水中存在Cl2+H2OH++Cl-+HClO,H+能使pH试纸变红,HClO具有漂白性,使pH试纸最后褪色,故A错误;
B.孔穴2中发生Cl2+2NaBr=2NaCl + Br2,该反应属于置换反应,现象是溶液变黄,故B正确;
C.孔穴3中发生Fe2O3+6H+=2Fe3++3H2O,若铁过量,会发生Fe+2Fe3+=3Fe2+,则向孔穴3中滴加铁氰化钾试液,铁氰化钾和溶液中Fe2+反应出现蓝色沉淀,故C错误;
D.Na2O2露置空气一段时间后,发生2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,而氢氧化钠极易与二氧化碳反应生产碳酸钠,则Na2O2露置空气一段时间后最终变为Na2CO3,现象为固体颜色由黄色变为白色,故D错误;
故选B。
8.A
【详解】△H=反应物断键吸收的热量-生成物成键放出的热量=2×176+498.8-4 X=-989.2,解之得X=460 kJ mol-1,正确答案:A。
9.C
【详解】A.放电时,锂失去电子发生氧化反应,为负极,A正确;
B. O2 得到电子,在正极发生还原反应,B正确;
C.原电池中阳离子向正极移动,C错误;
D.Li与水发生反应,故不能直接与水溶液接触,D正确;
故选C。
10.A
【详解】A.放热反应在常温下不一定很容易发生,如碳与氧气的反应为放热反应,但须点燃,故A错误;
B.因为正逆反应的焓变数值相等符号相反,所以若某反应正向进行时为放热反应,则该反应逆向进行时必为吸热反应,故B正确;
C.石墨转化为金刚石要吸收能量,说明石墨的能量低,能量越低越稳定,所以石墨稳定,故C正确;
D.温度升高,正逆反应速率都会加快,与反应吸热放热无关,故D正确;
故选A。
11.C
【详解】A.燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量。甲烷的燃烧热为890.3kJ mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═2CO2(g)+2H2O(l)△H=-890.3kJ mol-1,水不能是气态,故A错误;
B.氨的合成为可逆反应,0.5 molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,放热焓变为负值,则反应N2(g)+3H2(g)2NH3(g)的反应热ΔH<-38.6kJ·mol-1,故B错误;
C.1gH2燃烧生成水蒸气放出121kJ热量,即1molH2燃烧放热242kJ,故其热化学方程式为:H2(g)+O2(g) H2O(g) ΔH=-242kJ/mol,故C正确;
D.CO(g)的燃烧热是283.0kJ·mol-1,则CO(g)+O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0kJ·mol-1,逆向反应时反应热的数值相等,符号相反,故D错误。
故选C。
12.A
【详解】A.金属的电化学腐蚀比金属的化学腐蚀更普遍,故A错误;
B.用铜质铆钉铆接铁板,构成原电池,铁作负极,铁板易被腐蚀,故B正确;
C.钢铁在干燥的空气中,不构成原电池,不易被腐蚀,故C正确;
D.把铜片和锌片紧靠在一起浸入稀硫酸中,构成原电池,铜作正极,铜片表面出现气泡,故D正确;
选A。
13.C
【详解】A.把铜片和铁片紧靠在一起浸入稀H2SO4中,形成原电池,铁为负极,铜片为正极,电极反应为:2H++2e-=H2↑,表面出现气泡,A正确;
B.用石墨棒作阳极,铁片作阴极,电解NaCl溶液,阳极反应为:2Cl--2e-=Cl2↑,阴极反应为:2H++2e-=H2↑,故石墨棒和铁片表面都出现气泡,B正确;
C.把铜片插入FeCl3溶液中,发生的反应为:Cu+2FeCl3=CuCl2+2FeCl2,故在铜片表面不会出现一层铁,而是观察到铜在不断的减少,C错误;
D.把锌粒放入盛有盐酸的试管中,加入几滴CuCl2溶液,锌置换出铜附在锌粒上,形成微小的原电池反应,加快反应速率,故气泡放出速率加快,D正确;
故答案为:C。
14.A
【分析】由图可知,微生物脱盐池是原电池,正极通入O2,负极上含苯酚的废水中的C6H6O发生氧化反应生成CO2,正极上O2发生得电子的还原反应生成H2O,原电池工作时,阳离子通过阳离子交换膜移向正极、阴离子通过阴离子交换膜移向负极,从而使淡盐水NaCl含量减少形成淡水,达到脱盐目的,据此分析解答。
【详解】A.正极上O2发生得电子的还原反应生成H2O,正极反应式为:O2+4H++4e- =2H2O,正极消耗H+,使OH-浓度增大,Na+通过阳离子交换膜移向正极,正极室可制得NaOH溶液,A正确;
B.未指明标准状况,不能计算4.48LO2的物质的量,B错误;
C.负极上含苯酚的废水中的C6H6O发生氧化反应生成O2,负极反应为:
C6H6O2+11H2O -28e- =6CO2 + 28H+,C错误;
D.该装置工作时,化学能转化成电能,电能转化成光能,D错误;
故本题选A。
15.C
【详解】A.由图可知,a极N2生成NH3,发生还原反应,为阴极,电子由电源负极流入阴极,A项正确;
B.由图可知,阳极是N2反应生成HNO3,失去电子,电极反应为:,B项正确;
C.由图可知,a极N2→2NH3,得到6e-,b极N2→2,失去10 e-,根据电子得失相等计算,阳极区和阴极区消耗的 N2 的质量之比为 3:5,C项错误;
D.阳极反应为,生成H+,阴极反应为,消耗H+,该离子交换膜应使用质子交换膜,D项正确;
答案选C。
16. 1370 1852 463 2H2(g)+O2(g)=2H2O(l)ΔH =-570kJ·mol-1
【详解】(1)2molH2和1molO2变成4molH 和2molO吸收的能量就是断开2molH2和1molO2中的化学键的键能之和,所以吸收的能量为436 kJ×2+498 kJ=1370kJ;据图可知放出的能量数值等于吸收能量的数值和反应热数值之和,所以放出的能量=1370 kJ +482 kJ =1852 kJ。
(2)4molH和2molO生成的2mol气态水含有4mol H—O键,所以每形成H2O(g)中的1 mol H—O键放出的能量为1852 kJ÷4=463kJ。
(3)由图象可知生成2mol气态水放出的热量为482kJ,2mol气态水转变为2mol液态水放热44 kJ×2=88 kJ,所以每生成2mol液态水放出的热量为482kJ+88kJ=570kJ,故完全燃烧生成液态水的热化学方程式为:2H2(g)+O2(g)=2H2O(l) △H=-570kJ/mol。
17.(1)
(2)
(3)肼()和反应释放出大量热、产物无污染、产生大量气体等
(4)
(5)1940.9
(6) 氟气有剧毒
【解析】(1)
10g即=mol液态偏二甲肼()与足量的液态四氧化二氮(N2O4)完全反应生成N2(g)、CO2(g)、H2O(g),放出425kJ的热量,所以1mol液态偏二甲肼()与足量的液态四氧化二氮(N2O4)完全反应生成N2(g)、CO2(g)、H2O(g),放出425KJ×6=2250kJ的热量,则热化学方程式为(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g) ΔH=-2250kJ mol-1;答案为(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g) ΔH=-2250kJ mol-1;
(2)
由①,② ,③ 可知,根据盖斯定律③×2-①-②×2得ΔH=(-483.6kJ mol-1)×2-(+8.7 kJ mol-1)-(+50.6 kJ mol-1)×2=-1077.1 kJ mol-1,所以和反应的热化学方程式为ΔH=-1077.1 kJ mol-1;答案为ΔH=-1077.1 kJ mol-1;
(3)
由ΔH=-1077.1 kJ mol-1可知,和可作为火箭推进剂的主要原因是肼()和反应释放出大量热、产物无污染、产生大量气体等;答案为肼()和反应释放出大量热、产物无污染、产生大量气体等;
(4)
由ΔH=-1077.1 kJ mol-1可知,该反应是一个放热反应,反应物的总能量高,生成物的总能量低,焓变为-1077.1 kJ mol-1,所以用化学反应能量图表示该反应过程中能量的变化是;答案为;
(5)
由ΔH=-1077.1 kJ mol-1可知,ΔH=反应物的键能总和-生成物的键能总和,设1mol分子中化学键完全断裂时需要吸收的能量为x,则2×(390×4+190)+x-3×946 -4×2×460 =-1077.1,解之x=1940.9(kJ);答案为1940.9;
(6)
①由①、②、③ 可知,根据盖斯定律①+②×4-③×2得ΔH=(-534.0kJ mol-1)+(-269.0 kJ mol-1)×4-(-242.0 kJ mol-1)×2=-1126.0 kJ mol-1,所以肼和氟气反应的热化学方程式为ΔH=-1126.0 kJ mol-1;答案为ΔH=-1126.0 kJ mol-1;
②尽管氟气与肼反应释放的能量更大,但是氟气至今未被应用在火箭上,主要的原因是氟气有剧毒;答案为氟气有剧毒。
18.(1)N2(g)+3H2(g)2NH3(g) ΔH=-2(b-a)kJ·mol-1
(2) 54.9 kJ < N2(g)+3H2(g)2NH3(g)反应可逆
【解析】(1)
根据图示,氮气和氢气反应生成1mol氨气放出(b-a)KJ的能量,则生成2molNH3时的热化学方程式为N2(g)+3H2(g)2NH3(g)ΔH=-2(b-a)kJ·mol-1;
(2)
①焓变=反应物总键能-生成物总键能,则N2(g)+3H2(g)2NH3(g)ΔH= (946.5+436×3-391×3)kJ·mol-1=-91.5 kJ·mol-1;每消耗0.6molN2该反应放出的热量为91.5×0.6=54.9 kJ。
②N2(g)+3H2(g)2NH3(g)反应可逆,向某一密闭容器中充入1.5molH2(g)和0.5molN2(g),参加反应的氢气的物质的量小于1.5mol,所以断裂H—H键吸收的热量<654。
19.(1) 化学能转化为热能 电能转化为化学能
(2) 吸热 红磷
(3) 放出 5.5kJ
【详解】(1)学校燃烧煤煮饭,燃烧放热,将化学能转化为热能;给手机的电池充电利用的是电解池原理,能量变化为电能转化为化学能;
(2)在25℃、101 kPa下,31 g白磷完全转化为红磷,放出11 kJ的热量,说明同一条件下白磷比红磷能量高,则
①红磷转化为白磷属于吸热反应;
②能量越低越稳定,则上述二者更稳定的是红磷;
(3)根据=断键吸收的能量-成键放出的能量,因为拆开1 mol H—H键、1 mol I—I、1 mol H—I键需要吸收的能量为436kJ、151k J、299kJ,所以氢气和碘生成1 mol HI对应的反应焓变==-5.5 kJ/mol,故答案为:放出;5.5kJ。
20.(1) P4(s,白磷)=4 P(s,红磷),△H=-29.2kJ/mol 低
(2) PCl5(g)=PCl3(g)+Cl2(g) △H=+93kJ/mol -399 kJ/mol
【解析】(1)
①P4(s,白磷)+5O2(g)=P4O10(s) △H1=-2983.2kJ/mol;
②P(s,红磷)+O2(g)=P4O10(s) △H2=-738.5kJ/mol。
根据盖斯定律①-②×4得,P4(s,白磷)=4 P(s,红磷),△H=-2983.2kJ/mol-(-738.5kJ/mol) ×4=-29.2kJ/mol;能量越低越稳定,相同的状况下,白磷的稳定性比红磷低。
(2)
①1molPCl5的能量比1molPCl3和1molCl2的能量和小93KJ,PCl5分解生成PCl3和Cl2为吸热反应,热化学方程式为PCl5(g)=PCl3(g)+Cl2(g) △H=+93kJ/mol。
②根据图示,P(s)+32Cl2(g)=PCl3(g)△H1=-306 kJ/mol,
Cl2(g)+PCl3(g)=PCl5(g)△H2=-93 kJ/mol;
P和Cl2分两步反应生成1molPCl5的△H3=-306 kJ/mol+(-93 kJ/mol)=-399 kJ/mol。
21. N2(g)+3H2(g)2NH3(g) ΔH=92kJ·mol-1 390 1/2H2SO4(aq)+NaOH(aq)= 1/2Na2SO4(aq)+H2O(l) ΔH-573 kJ·mol-1 H2(g)+1/2O2(g)=H2O(l) ΔH=-2a kJ·mol-1
【详解】(1)根据能量与反应过程的图象,反应物总能量大于生成物的总能量,此反应是放热反应,△H=(254-300)kJ·mol-1=-46kJ·mol-1,N2(g)+H2(g) NH3(g)△H=-46kJ·mol-1,或者是N2(g)+3H2(g) 2NH3(g)ΔH=-92kJ·mol-1;
(2)设N-H的键能为xkJ·mol-1,根据反应热=反应物键能总和-生成物键能总和=943kJ·mol-1+3×435kJ·mol-1-6×xkJ·mol-1=-92kJ·mol-1,解得x=390kJ·mol-1;
(3)根据中和热的定义,生成1molH2O放出的热量为kJ=57.3kJ,中和热的热化学反应方程式为:H2SO4(aq)+NaOH(aq)= Na2SO4(aq)+H2O(l)ΔH=-57.3 kJ·mol-1;
(4)根据燃烧热的定义,1molH2完全燃烧放出的热量为2akJ,氢气燃烧热的热化学反应方程式为:H2(g)+O2(g)=H2O(l)ΔH=-2a kJ·mol-1;
22. Zn - 2e- ═ Zn2+; 2H+ + 2e- ═ H2↑ 由Cu极流向Zn极 3.25 0.1NA 0.5mol L-1
【分析】根据题给图可知,该装置为原电池,Zn比Cu活泼,作负极,发生氧化反应:Zn - 2e- ═ Zn2+;铜为正极,发生还原反应:2H+ + 2e- ═ H2↑;总反应为:Zn + H2SO4 = ZnSO4 +H2↑。可在此基础上解各小题。
【详解】(1)该原电池中,锌为负极,发生氧化反应,电极反应为Zn - 2e- ═ Zn2+,铜为正极,发生还原反应,电极反应为:2H+ + 2e- ═ H2↑。
答案为:Zn - 2e- ═ Zn2+;2H+ + 2e- ═ H2↑;
(2)电流由正极流向负极,即由Cu极流向Zn极。
答案为:由Cu极流向Zn极;
(3)根据总反应:Zn + H2SO4 = ZnSO4 +H2↑,计算如下:
m(Zn) =3.25g,n(H2SO4)=0.05mol,N(e-)=0.1NA。
则原硫酸溶液的浓度为:。
答案为:3.25;0.1NA;0.5mol L-1。
【点睛】原电池是以氧化还原反应为基础的,所以可从氧化还原反应的角度分析原电池中电子转移问题。
23.49982.6kJ
【详解】1kg乙炔的物质的量为,由热化学方程式 可知,38.46mol乙炔完全燃烧放出的热量为38.46mol×=49982.6kJ。
24.(1)2CH3OH(l)+3O2(g)═ 2CO2(g) + 4H2O(l)△H=-1452.8 kJ·mol-1
(2)391
(3) 环形玻璃搅拌棒 保温或隔热或减少实验过程中热量损失 偏大 AC 不相等 相等 偏小
【解析】(1)
根据2CH3OH(l)+3O2(g)═ 2CO2(g) + 4H2O(l)可知,10g液态甲醇的物质的量n=,在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出227kJ的热量,则2molCH3OH完全燃烧放出Q==1452.8 kJ·mol-1。该甲醇燃烧的热化学方程式:2CH3OH(l)+3O2(g)═ 2CO2(g) + 4H2O(l)△H=-1452.8 kJ·mol-1,故答案:2CH3OH(l)+3O2(g)═ 2CO2(g) + 4H2O(l)△H=-1452.8 kJ·mol-1。
(2)
由已知A2(g)+3B2(g)=2AB3(g)和能量变化图可知,A2(g)和B2(g)反应生成1 molAB3(g)的反应为放热反应,△H=-1127 kJ·mol-1-(-1173 kJ/mol)=-46 kJ/mol。从化学键的角度来算反应热,△H =反应物的键能之和-生成物的键能之和=946 kJ/mol+436 kJ/mol3-(A-B) kJ/mol6=-46 kJ/mol2,(A-B)=391 kJ/mol,故答案:391。
(3)
①该实验装置是中和热测定的装置,图中缺少的一种玻璃仪器是环形玻璃搅拌棒。为了保温或隔热或减少实验过程中热量损失,烧杯间填满碎纸条。若大烧杯上不盖硬纸板,会有热量散失,测得的中和热数值减小,则ΔH偏大,故答案:环形玻璃搅拌棒;保温或隔热或减少实验过程中热量损失;偏大。
② A.用温度计测定HCl溶液起始温度后,没有冲洗、冷却温度计,直接测定NaOH溶液的温度导致测量温度偏高,使得Δt减小,故A符合题意;
B.一次性把NaOH溶液倒入盛有硫酸的小烧杯中,符合操作,不会造成误差,故B不符合题意,
C.实验装置保温、隔热效果差,造成热量损失,使测得结构偏低,故C符合题意;
故答案:AC
③所放出的热量与反应物的物质的量有关,若改用60 mL 0.50 mol·L-1盐酸与60 mL 0.55 mol·L-1NaOH溶液进行反应,参加反应的盐酸和NaOH的量增大,放出的热量增多,所以两个实验相比,所放出的热量不相等;中和热是指酸和碱生成1mol水放出的热量,与参加反应的盐酸和NaOH的量多少无关,所以所求中和热相等;醋酸为弱酸,电离要吸热,所以若用50mL0.5mol·L-1醋酸代替盐酸溶液进行上述实验,测得反应前后温度的变化值会偏小。故答案:不相等;相等;偏小。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.根据如图所示的过程中的能量变化情况,判断下列说法正确的是
A.H2(g)转化为氢原子是一个放热过程
B.1molH2和1molCl2的总能量比2molHCl的总能量高
C.1个HCl(g)分子中的化学键断裂时需要吸收431kJ能量
D.2HCl(g)=H2(g)+Cl2(g)的反应热ΔH=—183kJ mol-1
2.实验室中利用固体KMnO4进行如图实验,下列说法正确的是
A.本实验中若用稀盐酸代替浓盐酸会减慢反应速率,但不影响单质H的生成量
B.气体H的量小于0.25mol
C.根据盖斯定律,直接用KMnO4和浓盐酸反应的热效应与本实验中的总热效应相等
D.气体H是一种常见的氧化性气体,一般在反应中只表现氧化性
3.有关如图装置的叙述错误的是
A.Fe电极的电极反应式为:Fe – 3e- = Fe3 +
B.Pt电极上的反应为:O2 + 2H2O + 4e-=4OH-
C.该装置中Fe被腐蚀
D.电流由Pt电极经导线流向Fe极
4.下列有关热化学方程式的叙述正确的是
A.同温同压下,反应在光照和点燃条件下的不同
B.,则石墨比金刚石稳定
C.由可知,稀醋酸与溶液反应生成液态水时释放的热量
D.,表示甲烷的燃烧热为
5.下列正确的是
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3kJ·mol-1
B.500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)2NH3(g)ΔH=-38.6kJ·mol-1
C.已知C(石墨,s)=C(金刚石,s)△H=+1.9kJ·mol 1,则石墨比金刚石稳定
D.S(g)+O2(g)=SO2(g)ΔH1;S(s)+O2(g)=SO2(g)ΔH2,则ΔH1>ΔH2
6.有关CO2(g)+CH4(g) = 2CO(g)+2H2(g) ΔH1=+247 kJ·mol-1的说法正确的是
A.该反应在任何温度下都可自发进行
B.反应CO2(s)+CH4(g) = 2CO(g)+2H2(g) ΔH2<+247 kJ·mol-1
C.选择高效催化剂可以降低反应的活化能,提高化学反应速率
D.反应中每生成1 mol H2,转移电子的数目为2×6.02×1023
7.利用点滴板进行实验,既可以节约药品用量,又便于观察实验现象。下列关于如图的实验,说法正确的是
A.试纸变红不褪色,体现新制氯水有酸性
B.孔穴2中溶液变黄,发生置换反应
C.向孔穴3中滴加铁氰化钾试液,溶液变血红色
D.露置空气一段时间后,孔穴4中固体黄色加深
8.有关键能(破坏1mol共价键吸收的能量)数据如表
化学键 Si-O O=O Si-Si
键能/kJ mol-1 X 498.8 176
晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s)△H=-989.2kJ mol-1,则X的值为( )
(已知1molSi中含有2molSi-Si键,1molSiO2中含有4molSi-O键)A.460 B.423.3 C.832 D.920
9.电池比能量高,可用于汽车、航天等领域。电池反应式为:,放电时,下列说法不正确的是
A.在负极失去电子 B.在正极发生还原反应
C.阳离子由正极移向负极 D.电极不能直接与水溶液接触
10.下列有关放热反应、吸热反应的说法不正确的是
A.吸热反应的发生都需要加热,放热反应在常温下一定容易发生
B.若某反应正向进行时为放热反应,则该反应逆向进行时必为吸热反应
C.由“C(石墨)=C(金刚石)是吸热反应”可知石墨比金刚石稳定
D.不管是吸热反应还是放热反应,升高温度,反应速率均增大
11.下列热化学方程式正确的是
A.甲烷的标准燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa 下,将0.5 mol N2 和 1.5 mol H2 置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)2NH3(g)ΔH=-38.6 kJ·mol-1
C.已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为:H2(g)+O2(g)H2O(g) ΔH=-242 kJ/mol
D.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)= 2CO(g)+O2(g)反应的ΔH=+283.0 kJ·mol-1
12.下列叙述不正确的是
A.金属的化学腐蚀比金属的电化学腐蚀更普遍
B.用铜质铆钉铆接铁板,铁板易被腐蚀
C.钢铁在干燥的空气中不易被腐蚀
D.把铜片和锌片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
13.下列关于实验现象的描述错误的是
A.把铜片和铁片紧靠在一起浸入稀H2SO4中,铜片表面出现气泡
B.用石墨棒作阳极,铁片作阴极,电解NaCl溶液,石墨棒和铁片表面都出现气泡
C.把铜片插入FeCl3溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴CuCl2溶液,气泡放出速率加快
14.一种微生物脱盐池的装置如图所示。下列说法正确的是
A.电池工作一段时间,正极室可制得NaOH溶液
B.当正极消耗4.48LO2,可将8L0.1 mol·L-1淡盐水转化为淡水
C.负极反应为: 6CO2+28H++28e- = C6H6O+ 11H2O
D.该装置工作时,只有两种形式能量之间发生转化
15.近日,电催化固氮领域取得重要进展,利用双功能催化剂可实现室温条件下电催化氮气还原制备氨气、氧化制备硝酸盐。装置如图所示:
下列说法错误的是
A.工作时,电子流入 a 极
B.阳极区的电极反应为:
C.阳极区和阴极区消耗的 N2的质量之比为 5:3
D.该离子交换膜应使用质子交换膜
二、填空题
16.已知拆开1 mol氢气中的化学键需要消耗436 kJ能量,拆开1 mol氧气中的化学键需要消耗498 kJ 能量,根据图中的能量图,回答下列问题:
(1)分别写出①②的数值:①___________kJ;②____________kJ。
(2)生成H2O(g)中的1 mol H—O键放出_____________kJ的能量。
(3)已知:H2O(l)=H2O(g) ΔH = + 44 kJ·mol-1,试写出2 mol氢气在足量氧气中完全燃烧生成液态水的热化学方程式__________________。
17.2021年9月7日11时01分,长征四号丙遥四十运载火箭在太原卫星发射中心点火升空,成功将高光谱观测卫星(又名高分五号02星)送入预定轨道。该星将全面提升我国大气、水体、陆地的高光谱观测能力,满足我国在环境综合监测等方面的迫切需求。该系列火箭各级全部使用和偏二甲肼()作推进剂。
Ⅰ.完成下列问题
(1)与偏二甲肼燃烧产物只有、、,并放出大量热,已知10.0g液态偏二甲肼与液态完全燃烧可放出425kJ热量,该反应的热化学方程式为___________。
Ⅱ.目前火箭推进剂中较普遍的组合是肼()和,两者反应生成和水蒸气。已知:
①
②
③
(2)和反应的热化学方程式为___________。
(3)和可作为火箭推进剂的主要原因是___________。
(4)试用化学反应能量图表示该反应过程中能量的变化___________。
(5)已知相关反应的化学键键能数据如表所示:
化学键 N—H N—N N≡N O—H
E/(kJ/mol) 390 190 946 460
则使1mol分子中化学键完全断裂时需要吸收的能量是___________kJ。
(6)有人认为若用氟气代替作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:
①写出肼和氟气反应的热化学方程式:___________。
②尽管氟气与肼反应释放的能量更大,但是氟气至今未被应用在火箭上,主要的原因是___________。
18.1909年,化学家哈伯用N2和H2在高温高压条件下首次合成了氨气,反应原理为N2(g)+3H2(g)2NH3(g),该反应的能量变化如图所示(a、b均大于零),回答下列问题:
(1)根据图示写出生成2molNH3时的热化学方程式:___。
(2)在500℃、30MPa下,断裂11molH—H键、1molN—H键、1molN≡N键需要吸收的能量分别为436kJ、391kJ、946.5kJ。
①每消耗0.6molN2该反应放出的热量为___。
②向某一密闭容器中充入1.5molH2(g)和0.5molN2(g),在催化剂条件下进行上述反应,此时断裂的H—H键吸收的热量___(填“>”、“<”“=”)654,原因是___。
19.回答下列问题:
(1)指出下列变化能量是怎样转化的:学校燃烧煤煮饭_________,给手机的电池充电_________。
(2)磷元素有多种性质不同的单质,红磷(结构复杂用“P”表示)和白磷(P4)是磷的两种同素异形体,充分燃烧之后的产物都是五氧化二磷。在25 ℃、101 kPa下,31 g白磷完全转化为红磷,放出11 kJ的热量,根据以上事实回答下列问题:
①红磷转化为白磷属于_________反应(填“放热”或“吸热”)。
②二者更稳定的是_________。(填“白磷”或“红磷”)。
(3)拆开1 mol H—H键、1 mol I—I、1 mol H—I键需要吸收的能量为436kJ、151k J、299k J。则氢气和碘生成1 mol HI需要_________(填“放出”或“吸收”)_________k J的热量。
20.科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。”利用盖斯定律可计算某些特殊反应的热效应。
(1)已知:①P4(s,白磷)+5O2(g)=P4O10(s) △H1=-2983.2kJ/mol;
②P(s,红磷)+O2(g)=P4O10(s) △H2=-738.5kJ/mol。
则白磷转化为红磷的热化学方程式____,相同的状况下,白磷的稳定性比红磷____(填“高”或“低”)。
(2)红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
①PCl5分解生成PCl3和Cl2的热化学方程式____。
②P和Cl2分两步反应生成1molPCl5的△H3=____。
21.(1)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,下图是N2(g)和H2(g)反应生成1mo1NH3(g)过程中能量变化示意图,
请写出N2和H2反应的热化学方程式:_____________________________;
(2)若已知下列数据:
化学键 H-H N≡N
键能/kJ mol-1 435 943
试根据表中及图中数据计算N-H的键能______kJ mol-1
(3)已知100ml lmol/L的氢氧化钠溶液与适量硫酸溶液完全反应放出5.73kJ的热量,请写出表示中和热的热化学方程式________________________________;
(4)已知1克氢气完全燃烧生成液态水时放出akJ的热量,请写出表示氢气燃烧热的热化学方程式____________________________________________。
22.由锌片、铜片和200mL稀硫酸组成的原电池如图所示。
(1)原电池的负极反应是___,正极反应是___。
(2)电流的方向是___。
(3)一段时间后,当在铜片上放出1.12L(标准状况下)气体时,H2SO4恰好消耗一半。则产生这些气体的同时,共消耗___g锌,___个电子通过了导线,原硫酸的物质的量浓度是__ (设溶液体积不变)。
23.乙炔()气体在氧气中完全燃烧放出大量热,形成高温火焰(氧炔焰),可以用于焊接或切割钢板。已知乙炔在氧气中完全燃烧的热化学方程式是: 。则1kg乙炔在氧气中完全燃烧放出多少热__________?
24.回答下列问题:
(1)实验测得10g液态甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出227kJ的热量。试写出甲醇燃烧的热化学方程式:_____。
(2)现已知A2(g)和B2(g)反应生成1 molAB3(g)过程中能量变化示意如下图。根据下列已知键能数据计算A-B键键能为___________kJ/mol。
化学键 A≡A B-B
键能(kJ/mol) 946 436
(3)在如图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
①从实验装置上看,图中缺少的一种玻璃仪器是___________。烧杯间填满碎纸条的作用是___________。若大烧杯上不盖硬纸板,求得的中和热ΔH___________(填“偏大”“偏小”或“无影响”)。
②甲同学用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液进行中和反应,通过计算得到ΔH=-54.8kJ/mol,该结果与ΔH=-57.3kJ·mol-1有偏差,产生此偏差的原因可能是___________。
A、用温度计测定HCl溶液起始温度后直接测定NaOH溶液的温度
B、一次性把NaOH溶液倒入盛有硫酸的小烧杯中
C.实验装置保温、隔热效果差
③若改用60 mL 0.50 mol·L-1盐酸与60 mL 0.55 mol·L-1NaOH溶液进行反应,两个实验相比,所放出的热量___________(填“相等”或“不相等”),所求中和热___________(填“相等”或“不相等”)若用50mL0.5mol·L-1醋酸代替盐酸溶液进行上述实验,测得反应前后温度的变化值会___________(填“偏大”、“偏小”或“不受影响”)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【分析】由反应热与反应物键能之和与生成物的键能之和的差值相等可得,氢气与氯气生成氯化氢的反应热ΔH=(436kj/mol+243kJ/mol)—431kJ/mol×2=—183kJ/mol,反应的热化学方程式为H2(g)+Cl2(g)=2HCl(g) ΔH=—183kJ/mol。
【详解】A.氢气转化为氢原子时,破坏共价键需要吸收热量,故A错误;
B.由分析可知,该反应为放热反应,1mol氢气和1mol氯气的总能量比2mol氯化氢的总能量高,故B正确;
C.由图可知,1mol氯化氢分子中的化学键断裂时需要吸收431kJ能量,故C错误;
D.由分析可知,氢气与氯气生成氯化氢的的热化学方程式为H2(g)+Cl2(g)=2HCl(g) ΔH=—183kJ/mol,逆反应的焓变与正反应的数值相同、符号相反,则2HCl(g)=H2(g)+Cl2(g)的反应热ΔH=+183kJ mol-1,故D错误;
故选B。
2.B
【详解】A.稀盐酸与MnO2不反应,氯气的生成量减小,故A错误;
B.分析反应整个过程可知化合价降低的元素是锰,化合价升高的元素是氧和氯,反应中转移总电子数为0.1×5=0.5mol,则生成氧气和氯气时转移电子数之和为0.5mol,故氯气的量少于0.25mol,故B正确 ;
C.直接用KMnO4和浓盐酸反应与本实验的产物不同,不符合盖斯定律,故C错误;
D.氯气是一种常见的氧化性气体,在与水或碱等反应中都既表现氧化性又表现还原性,故D错误;
选B。
3.A
【分析】该装置是原电池,根据电极的活泼性知Fe电极是负极,Pt电极是正极
【详解】A.Fe电极是负极,发生氧化反应,电极反应式为,A项符合题意;
B.Pt电极是正极且通入空气,发生还原反应的是氧气,根据碱性环境,电极反应式为,B项不符合题意;
C.Fe发生了氧化反应生成了Fe2+,故Fe被腐蚀,C项不符合题意;
D.电流由正极流向负极,故由Pt电极经导线流向Fe电极,D项不符合题意;
故正确选项为A
4.B
【详解】A.反应焓变与条件无关,同温同压下,反应在光照和点燃条件下的相同,A错误;
B.,反应放热,石墨的能量更低,石墨比金刚石稳定,B正确;
C.稀醋酸为弱酸,电离时要吸热,稀醋酸与反应生成液态水时释放的能量小于57.3kJ,C错误;
D.燃烧热是1mol可燃物完全燃烧生成指定产物所放出的热量,甲烷完全燃烧的产物中的水应为液态,D错误;
故选B。
5.C
【详解】A.燃烧热指的是1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,注意生成的水应为液态而不能为气态,故A错误;
B.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,则1molN2完全反应放热大于38.6kJ,其热化学反应方程式为:N2(g)+3H2(g) 2NH3(g)△H<-38.6 kJ/mol,故B错误;
C.已知C(石墨,s)→C(金刚石,s)△H>0,石墨的能量低于金刚石,石墨的稳定性高于金刚石,故C正确;
D.S(s)比S(g)稳定,能量低,ΔH1<ΔH2,故D错误;
故选:C。
6.C
【详解】A.该反应为气体体积增大的吸热反应,ΔH>0,ΔS>0,则高温时ΔG=ΔH-TΔS<0,反应自发进行,A错误;
B.CO2(g)+CH4(g) = 2CO(g)+2H2(g) ΔH1=+247 kJ·mol-1,CO2的固态比气态的能量低,则反应CO2(s)+CH4(g) = 2CO(g)+2H2(g) ΔH2>+247 kJ·mol-1,B错误;
C.选择高效催化剂可以降低反应的活化能,从而提高化学反应速率,C正确;
D.根据反应方程式CO2(g)+CH4(g) = 2CO(g)+2H2(g)可知,CO2转化为CO,C元素化合价降低2价,CH4转化为CO,C元素化合价升高6价,CH4转化为H2,H元素化合价共降低4价,所以每生成2molH2,转移6mol电子,则反应中每生成1 mol H2,转移电子的数目为3×6.02×1023,D错误;
故选C。
7.B
【详解】A.新制氯水中存在Cl2+H2OH++Cl-+HClO,H+能使pH试纸变红,HClO具有漂白性,使pH试纸最后褪色,故A错误;
B.孔穴2中发生Cl2+2NaBr=2NaCl + Br2,该反应属于置换反应,现象是溶液变黄,故B正确;
C.孔穴3中发生Fe2O3+6H+=2Fe3++3H2O,若铁过量,会发生Fe+2Fe3+=3Fe2+,则向孔穴3中滴加铁氰化钾试液,铁氰化钾和溶液中Fe2+反应出现蓝色沉淀,故C错误;
D.Na2O2露置空气一段时间后,发生2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,而氢氧化钠极易与二氧化碳反应生产碳酸钠,则Na2O2露置空气一段时间后最终变为Na2CO3,现象为固体颜色由黄色变为白色,故D错误;
故选B。
8.A
【详解】△H=反应物断键吸收的热量-生成物成键放出的热量=2×176+498.8-4 X=-989.2,解之得X=460 kJ mol-1,正确答案:A。
9.C
【详解】A.放电时,锂失去电子发生氧化反应,为负极,A正确;
B. O2 得到电子,在正极发生还原反应,B正确;
C.原电池中阳离子向正极移动,C错误;
D.Li与水发生反应,故不能直接与水溶液接触,D正确;
故选C。
10.A
【详解】A.放热反应在常温下不一定很容易发生,如碳与氧气的反应为放热反应,但须点燃,故A错误;
B.因为正逆反应的焓变数值相等符号相反,所以若某反应正向进行时为放热反应,则该反应逆向进行时必为吸热反应,故B正确;
C.石墨转化为金刚石要吸收能量,说明石墨的能量低,能量越低越稳定,所以石墨稳定,故C正确;
D.温度升高,正逆反应速率都会加快,与反应吸热放热无关,故D正确;
故选A。
11.C
【详解】A.燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量。甲烷的燃烧热为890.3kJ mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═2CO2(g)+2H2O(l)△H=-890.3kJ mol-1,水不能是气态,故A错误;
B.氨的合成为可逆反应,0.5 molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,放热焓变为负值,则反应N2(g)+3H2(g)2NH3(g)的反应热ΔH<-38.6kJ·mol-1,故B错误;
C.1gH2燃烧生成水蒸气放出121kJ热量,即1molH2燃烧放热242kJ,故其热化学方程式为:H2(g)+O2(g) H2O(g) ΔH=-242kJ/mol,故C正确;
D.CO(g)的燃烧热是283.0kJ·mol-1,则CO(g)+O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0kJ·mol-1,逆向反应时反应热的数值相等,符号相反,故D错误。
故选C。
12.A
【详解】A.金属的电化学腐蚀比金属的化学腐蚀更普遍,故A错误;
B.用铜质铆钉铆接铁板,构成原电池,铁作负极,铁板易被腐蚀,故B正确;
C.钢铁在干燥的空气中,不构成原电池,不易被腐蚀,故C正确;
D.把铜片和锌片紧靠在一起浸入稀硫酸中,构成原电池,铜作正极,铜片表面出现气泡,故D正确;
选A。
13.C
【详解】A.把铜片和铁片紧靠在一起浸入稀H2SO4中,形成原电池,铁为负极,铜片为正极,电极反应为:2H++2e-=H2↑,表面出现气泡,A正确;
B.用石墨棒作阳极,铁片作阴极,电解NaCl溶液,阳极反应为:2Cl--2e-=Cl2↑,阴极反应为:2H++2e-=H2↑,故石墨棒和铁片表面都出现气泡,B正确;
C.把铜片插入FeCl3溶液中,发生的反应为:Cu+2FeCl3=CuCl2+2FeCl2,故在铜片表面不会出现一层铁,而是观察到铜在不断的减少,C错误;
D.把锌粒放入盛有盐酸的试管中,加入几滴CuCl2溶液,锌置换出铜附在锌粒上,形成微小的原电池反应,加快反应速率,故气泡放出速率加快,D正确;
故答案为:C。
14.A
【分析】由图可知,微生物脱盐池是原电池,正极通入O2,负极上含苯酚的废水中的C6H6O发生氧化反应生成CO2,正极上O2发生得电子的还原反应生成H2O,原电池工作时,阳离子通过阳离子交换膜移向正极、阴离子通过阴离子交换膜移向负极,从而使淡盐水NaCl含量减少形成淡水,达到脱盐目的,据此分析解答。
【详解】A.正极上O2发生得电子的还原反应生成H2O,正极反应式为:O2+4H++4e- =2H2O,正极消耗H+,使OH-浓度增大,Na+通过阳离子交换膜移向正极,正极室可制得NaOH溶液,A正确;
B.未指明标准状况,不能计算4.48LO2的物质的量,B错误;
C.负极上含苯酚的废水中的C6H6O发生氧化反应生成O2,负极反应为:
C6H6O2+11H2O -28e- =6CO2 + 28H+,C错误;
D.该装置工作时,化学能转化成电能,电能转化成光能,D错误;
故本题选A。
15.C
【详解】A.由图可知,a极N2生成NH3,发生还原反应,为阴极,电子由电源负极流入阴极,A项正确;
B.由图可知,阳极是N2反应生成HNO3,失去电子,电极反应为:,B项正确;
C.由图可知,a极N2→2NH3,得到6e-,b极N2→2,失去10 e-,根据电子得失相等计算,阳极区和阴极区消耗的 N2 的质量之比为 3:5,C项错误;
D.阳极反应为,生成H+,阴极反应为,消耗H+,该离子交换膜应使用质子交换膜,D项正确;
答案选C。
16. 1370 1852 463 2H2(g)+O2(g)=2H2O(l)ΔH =-570kJ·mol-1
【详解】(1)2molH2和1molO2变成4molH 和2molO吸收的能量就是断开2molH2和1molO2中的化学键的键能之和,所以吸收的能量为436 kJ×2+498 kJ=1370kJ;据图可知放出的能量数值等于吸收能量的数值和反应热数值之和,所以放出的能量=1370 kJ +482 kJ =1852 kJ。
(2)4molH和2molO生成的2mol气态水含有4mol H—O键,所以每形成H2O(g)中的1 mol H—O键放出的能量为1852 kJ÷4=463kJ。
(3)由图象可知生成2mol气态水放出的热量为482kJ,2mol气态水转变为2mol液态水放热44 kJ×2=88 kJ,所以每生成2mol液态水放出的热量为482kJ+88kJ=570kJ,故完全燃烧生成液态水的热化学方程式为:2H2(g)+O2(g)=2H2O(l) △H=-570kJ/mol。
17.(1)
(2)
(3)肼()和反应释放出大量热、产物无污染、产生大量气体等
(4)
(5)1940.9
(6) 氟气有剧毒
【解析】(1)
10g即=mol液态偏二甲肼()与足量的液态四氧化二氮(N2O4)完全反应生成N2(g)、CO2(g)、H2O(g),放出425kJ的热量,所以1mol液态偏二甲肼()与足量的液态四氧化二氮(N2O4)完全反应生成N2(g)、CO2(g)、H2O(g),放出425KJ×6=2250kJ的热量,则热化学方程式为(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g) ΔH=-2250kJ mol-1;答案为(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g) ΔH=-2250kJ mol-1;
(2)
由①,② ,③ 可知,根据盖斯定律③×2-①-②×2得ΔH=(-483.6kJ mol-1)×2-(+8.7 kJ mol-1)-(+50.6 kJ mol-1)×2=-1077.1 kJ mol-1,所以和反应的热化学方程式为ΔH=-1077.1 kJ mol-1;答案为ΔH=-1077.1 kJ mol-1;
(3)
由ΔH=-1077.1 kJ mol-1可知,和可作为火箭推进剂的主要原因是肼()和反应释放出大量热、产物无污染、产生大量气体等;答案为肼()和反应释放出大量热、产物无污染、产生大量气体等;
(4)
由ΔH=-1077.1 kJ mol-1可知,该反应是一个放热反应,反应物的总能量高,生成物的总能量低,焓变为-1077.1 kJ mol-1,所以用化学反应能量图表示该反应过程中能量的变化是;答案为;
(5)
由ΔH=-1077.1 kJ mol-1可知,ΔH=反应物的键能总和-生成物的键能总和,设1mol分子中化学键完全断裂时需要吸收的能量为x,则2×(390×4+190)+x-3×946 -4×2×460 =-1077.1,解之x=1940.9(kJ);答案为1940.9;
(6)
①由①、②、③ 可知,根据盖斯定律①+②×4-③×2得ΔH=(-534.0kJ mol-1)+(-269.0 kJ mol-1)×4-(-242.0 kJ mol-1)×2=-1126.0 kJ mol-1,所以肼和氟气反应的热化学方程式为ΔH=-1126.0 kJ mol-1;答案为ΔH=-1126.0 kJ mol-1;
②尽管氟气与肼反应释放的能量更大,但是氟气至今未被应用在火箭上,主要的原因是氟气有剧毒;答案为氟气有剧毒。
18.(1)N2(g)+3H2(g)2NH3(g) ΔH=-2(b-a)kJ·mol-1
(2) 54.9 kJ < N2(g)+3H2(g)2NH3(g)反应可逆
【解析】(1)
根据图示,氮气和氢气反应生成1mol氨气放出(b-a)KJ的能量,则生成2molNH3时的热化学方程式为N2(g)+3H2(g)2NH3(g)ΔH=-2(b-a)kJ·mol-1;
(2)
①焓变=反应物总键能-生成物总键能,则N2(g)+3H2(g)2NH3(g)ΔH= (946.5+436×3-391×3)kJ·mol-1=-91.5 kJ·mol-1;每消耗0.6molN2该反应放出的热量为91.5×0.6=54.9 kJ。
②N2(g)+3H2(g)2NH3(g)反应可逆,向某一密闭容器中充入1.5molH2(g)和0.5molN2(g),参加反应的氢气的物质的量小于1.5mol,所以断裂H—H键吸收的热量<654。
19.(1) 化学能转化为热能 电能转化为化学能
(2) 吸热 红磷
(3) 放出 5.5kJ
【详解】(1)学校燃烧煤煮饭,燃烧放热,将化学能转化为热能;给手机的电池充电利用的是电解池原理,能量变化为电能转化为化学能;
(2)在25℃、101 kPa下,31 g白磷完全转化为红磷,放出11 kJ的热量,说明同一条件下白磷比红磷能量高,则
①红磷转化为白磷属于吸热反应;
②能量越低越稳定,则上述二者更稳定的是红磷;
(3)根据=断键吸收的能量-成键放出的能量,因为拆开1 mol H—H键、1 mol I—I、1 mol H—I键需要吸收的能量为436kJ、151k J、299kJ,所以氢气和碘生成1 mol HI对应的反应焓变==-5.5 kJ/mol,故答案为:放出;5.5kJ。
20.(1) P4(s,白磷)=4 P(s,红磷),△H=-29.2kJ/mol 低
(2) PCl5(g)=PCl3(g)+Cl2(g) △H=+93kJ/mol -399 kJ/mol
【解析】(1)
①P4(s,白磷)+5O2(g)=P4O10(s) △H1=-2983.2kJ/mol;
②P(s,红磷)+O2(g)=P4O10(s) △H2=-738.5kJ/mol。
根据盖斯定律①-②×4得,P4(s,白磷)=4 P(s,红磷),△H=-2983.2kJ/mol-(-738.5kJ/mol) ×4=-29.2kJ/mol;能量越低越稳定,相同的状况下,白磷的稳定性比红磷低。
(2)
①1molPCl5的能量比1molPCl3和1molCl2的能量和小93KJ,PCl5分解生成PCl3和Cl2为吸热反应,热化学方程式为PCl5(g)=PCl3(g)+Cl2(g) △H=+93kJ/mol。
②根据图示,P(s)+32Cl2(g)=PCl3(g)△H1=-306 kJ/mol,
Cl2(g)+PCl3(g)=PCl5(g)△H2=-93 kJ/mol;
P和Cl2分两步反应生成1molPCl5的△H3=-306 kJ/mol+(-93 kJ/mol)=-399 kJ/mol。
21. N2(g)+3H2(g)2NH3(g) ΔH=92kJ·mol-1 390 1/2H2SO4(aq)+NaOH(aq)= 1/2Na2SO4(aq)+H2O(l) ΔH-573 kJ·mol-1 H2(g)+1/2O2(g)=H2O(l) ΔH=-2a kJ·mol-1
【详解】(1)根据能量与反应过程的图象,反应物总能量大于生成物的总能量,此反应是放热反应,△H=(254-300)kJ·mol-1=-46kJ·mol-1,N2(g)+H2(g) NH3(g)△H=-46kJ·mol-1,或者是N2(g)+3H2(g) 2NH3(g)ΔH=-92kJ·mol-1;
(2)设N-H的键能为xkJ·mol-1,根据反应热=反应物键能总和-生成物键能总和=943kJ·mol-1+3×435kJ·mol-1-6×xkJ·mol-1=-92kJ·mol-1,解得x=390kJ·mol-1;
(3)根据中和热的定义,生成1molH2O放出的热量为kJ=57.3kJ,中和热的热化学反应方程式为:H2SO4(aq)+NaOH(aq)= Na2SO4(aq)+H2O(l)ΔH=-57.3 kJ·mol-1;
(4)根据燃烧热的定义,1molH2完全燃烧放出的热量为2akJ,氢气燃烧热的热化学反应方程式为:H2(g)+O2(g)=H2O(l)ΔH=-2a kJ·mol-1;
22. Zn - 2e- ═ Zn2+; 2H+ + 2e- ═ H2↑ 由Cu极流向Zn极 3.25 0.1NA 0.5mol L-1
【分析】根据题给图可知,该装置为原电池,Zn比Cu活泼,作负极,发生氧化反应:Zn - 2e- ═ Zn2+;铜为正极,发生还原反应:2H+ + 2e- ═ H2↑;总反应为:Zn + H2SO4 = ZnSO4 +H2↑。可在此基础上解各小题。
【详解】(1)该原电池中,锌为负极,发生氧化反应,电极反应为Zn - 2e- ═ Zn2+,铜为正极,发生还原反应,电极反应为:2H+ + 2e- ═ H2↑。
答案为:Zn - 2e- ═ Zn2+;2H+ + 2e- ═ H2↑;
(2)电流由正极流向负极,即由Cu极流向Zn极。
答案为:由Cu极流向Zn极;
(3)根据总反应:Zn + H2SO4 = ZnSO4 +H2↑,计算如下:
m(Zn) =3.25g,n(H2SO4)=0.05mol,N(e-)=0.1NA。
则原硫酸溶液的浓度为:。
答案为:3.25;0.1NA;0.5mol L-1。
【点睛】原电池是以氧化还原反应为基础的,所以可从氧化还原反应的角度分析原电池中电子转移问题。
23.49982.6kJ
【详解】1kg乙炔的物质的量为,由热化学方程式 可知,38.46mol乙炔完全燃烧放出的热量为38.46mol×=49982.6kJ。
24.(1)2CH3OH(l)+3O2(g)═ 2CO2(g) + 4H2O(l)△H=-1452.8 kJ·mol-1
(2)391
(3) 环形玻璃搅拌棒 保温或隔热或减少实验过程中热量损失 偏大 AC 不相等 相等 偏小
【解析】(1)
根据2CH3OH(l)+3O2(g)═ 2CO2(g) + 4H2O(l)可知,10g液态甲醇的物质的量n=,在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出227kJ的热量,则2molCH3OH完全燃烧放出Q==1452.8 kJ·mol-1。该甲醇燃烧的热化学方程式:2CH3OH(l)+3O2(g)═ 2CO2(g) + 4H2O(l)△H=-1452.8 kJ·mol-1,故答案:2CH3OH(l)+3O2(g)═ 2CO2(g) + 4H2O(l)△H=-1452.8 kJ·mol-1。
(2)
由已知A2(g)+3B2(g)=2AB3(g)和能量变化图可知,A2(g)和B2(g)反应生成1 molAB3(g)的反应为放热反应,△H=-1127 kJ·mol-1-(-1173 kJ/mol)=-46 kJ/mol。从化学键的角度来算反应热,△H =反应物的键能之和-生成物的键能之和=946 kJ/mol+436 kJ/mol3-(A-B) kJ/mol6=-46 kJ/mol2,(A-B)=391 kJ/mol,故答案:391。
(3)
①该实验装置是中和热测定的装置,图中缺少的一种玻璃仪器是环形玻璃搅拌棒。为了保温或隔热或减少实验过程中热量损失,烧杯间填满碎纸条。若大烧杯上不盖硬纸板,会有热量散失,测得的中和热数值减小,则ΔH偏大,故答案:环形玻璃搅拌棒;保温或隔热或减少实验过程中热量损失;偏大。
② A.用温度计测定HCl溶液起始温度后,没有冲洗、冷却温度计,直接测定NaOH溶液的温度导致测量温度偏高,使得Δt减小,故A符合题意;
B.一次性把NaOH溶液倒入盛有硫酸的小烧杯中,符合操作,不会造成误差,故B不符合题意,
C.实验装置保温、隔热效果差,造成热量损失,使测得结构偏低,故C符合题意;
故答案:AC
③所放出的热量与反应物的物质的量有关,若改用60 mL 0.50 mol·L-1盐酸与60 mL 0.55 mol·L-1NaOH溶液进行反应,参加反应的盐酸和NaOH的量增大,放出的热量增多,所以两个实验相比,所放出的热量不相等;中和热是指酸和碱生成1mol水放出的热量,与参加反应的盐酸和NaOH的量多少无关,所以所求中和热相等;醋酸为弱酸,电离要吸热,所以若用50mL0.5mol·L-1醋酸代替盐酸溶液进行上述实验,测得反应前后温度的变化值会偏小。故答案:不相等;相等;偏小。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
