8.1. 自然资源的开发利用第1课时同步教学 课件(共33张PPT)2022-2023学年下学期高一化学人教版(2019)必修第二册
文档属性
| 名称 | 8.1. 自然资源的开发利用第1课时同步教学 课件(共33张PPT)2022-2023学年下学期高一化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 23.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-29 12:22:20 | ||
图片预览











文档简介
(共33张PPT)
同学们好
欢迎来到化学课堂
新人教版 化学 必修第二册
请你描述!
联系生活,了解自然资源的分类和可持续发展
课本P98
第一节
自然资源的开发利用
第八章 化学与可持续发展
第1课时
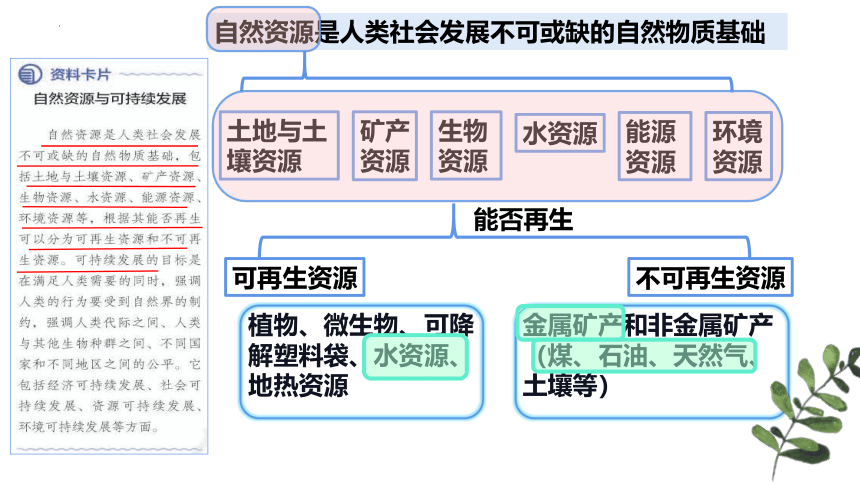
自然资源是人类社会发展不可或缺的自然物质基础
土地与土壤资源
矿产资源
生物资源
水资源
能源资源
环境资源
能否再生
可再生资源
不可再生资源
植物、微生物、可降解塑料袋、水资源、地热资源
金属矿产和非金属矿产(煤、石油、天然气、土壤等)
01
金属矿物的开发利用
铂矿
蓝铜矿
赤铁矿
赤铜矿
铅锌矿
钨矿
铝矿
金属元素在自然界的存在
游离态
化合态
少数不活波金属
铜
银
陨铁
金矿
绝大多数金属以矿物质形式存在
孔雀石
铅锌矿
菱镁矿
黄铜矿
春秋、战国的青铜剑
你知道吗?
古代使用的金属有哪些?为什么?
和冶炼金属相关
高压钠灯
铁锅
不锈钢锅
钛合金羽毛球拍
镍合金门锁
金属的冶炼
02
金属的冶炼
(1)定义:将金属从其化合物中还原出来的过程,工业上称之为金属的冶炼。
(2)实质:
Mn+ M
+ne-
得电子,被还原
(3)冶炼步骤:
矿石的富集
精炼
冶炼
(4)冶炼方法:
金属的冶炼
金属被人类利用的早晚与什么有关?
明代炼丹炉
丹砂烧之成水银
金属冶炼方法
加热的是金属氧化物
2HgO 2Hg+O2↑
2Ag2O 4Ag+O2↑
热分解法
铜是人类第一种大量使用的金属,结束了漫长的“石器时代”
铜 镜
汉武帝时铜币
先秦刀币
司母戊鼎
铜虎头
铜的冶炼
炼矿曰扯铜,其法矿千斤(氧化矿,灼烧得CuO)用炭七八百斤不等,炉如来墙,底作圆窠,铺以炭末,始加矿炭……而铜沉于低,有流碣,即铜成之候矣——清·张泓《滇南新语》
CuO+C Cu+CO↑
请写出冶炼铜的化学方程式
热还原法
Cu2(OH)2CO3 2CuO+CO2↑+H2O
人类很早就发现,孔雀石在熊熊燃烧的树木中灼烧,树木余烬里会有一种红色光亮的金属凝固出来,试用化学方程式表示所发生的反应:
铜的冶炼
Cu2(OH)2CO3
孔雀石
资料
孔雀石的主要成分为Cu2(OH)2CO3 加热可分解生成三种氧化物
CuO+C Cu+CO↑
课本P105--2
Fe2O3+3CO === 2Fe + 3CO2
高温
CuO+H2 === Cu + H2O
高温
热还原法:常用的还原剂有:CO、H2、C(焦炭)、活泼金属
金属冶炼方法
热还原法
金属冶炼方法
热还原法
Fe2O3+2Al 2Fe + Al2O3
高温
铝热法:用金属铝做还原剂冶炼活泼性不如铝且“高熔点”的金属(Fe、V、Cr、Mn等)
应用:①冶炼熔点较高的金属,如铬、锰、钨、钒等
②金属焊接,如焊接钢轨。
Fe2O3+2Al 2Fe + Al2O3
高温
3MnO2+4Al 3Mn+ 2Al2O3
高温
Cr2O3+2Al 2Cr + Al2O3
高温
3Co3O4+8Al 9Co + 4Al2O3
高温
3V2O5+10Al 6V+ 5Al2O3
高温
铝热剂
热还原法
钨棒
三氧化钨
钨矿
WO3+3H2 W+3H2O
2Al+WO3 W+Al2O3
高温
课本P105--2
1827年,德国化学家维勒用金属钾制得了铝
1854 年,法国的德维尔用金属钠制得铝
铝的发现史
首先是由于19世纪70年代西门子改进了发电机后,有了廉价的电力
其次是由于两位22岁的大学生,于1886年分别发明了一种炼铝的方法。
这项创举使铝以大规模生产,奠定了今天世界制铝的工业方法。
到19世纪末,铝的价格发生了成千倍的跌落!
电解法
金属冶炼方法
拿破仑大帝喜欢炫耀自己。每次宴会,餐桌上的用具几乎全是用银制成的,唯有他自己用的那一个碗却是铝制品。为什么贵为法国皇帝用色泽要暗得多的铝碗呢?
电解法
电解法——适用于很活泼的金属(K Ca Na Mg Al )
电解铝
MgCl2 (熔融) Mg + Cl2 ↑
电解
2NaCl (熔融) 2Na+Cl2 ↑
电解
2Al2O3 (熔融) 4Al + 3O2 ↑
电解
冰晶石
电解法
[思考] 冶炼Mg时电解MgCl2,不能电解MgO?冶炼Al时电解Al2O3不能 电解AlCl3?
电解法制取镁时需要电解化合物的熔融状态,而MgO的熔点太高,将MgO加热熔融消耗的能量太高不经济。
AlCl3是共价化合物,熔融状态下无自由移动的离子
其他方法
信州铅山县有苦泉,流以为涧。其水熬之,则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之异化为铜。
—沈括《梦溪笔谈》
用矿(硫化矿,主要成分为Cu2S)二百五十箩……入大旋风炉,连烹(灼烧) 三日三夜,方见成铜。
—明·陆容《菽园杂记》
湿法炼铜 Fe+CuSO4===FeSO4+Cu
火法炼铜 Cu2S+O2===2Cu+SO2
高温
由于不同的金属离子得电子的能力不同,所以冶炼的方法不同
不活泼的金属
K、Ca、Na、Mg、Al、
Zn、Fe、Sn、Pb、(H)、Cu、
Hg、Ag、Pt、Au
非常活泼的金属
中等活泼的金属
金属冶炼方法
即:Mn+ + ne- M
课本P99
铝土矿
萤石
氧化铝
冰晶石
铝锭
碳素电极
液态铝
石油焦和沥青焦
电解
(1) 提高金属矿物的利用率
(2) 开发环保高效的金属冶炼方法
(4) 加强金属资源的回收和再利用
(5) 使用其他材料代替金属材料,
减少金属的使用量
(3) 防止金属的腐蚀
启示1:从铝土矿制铝消耗的能量要远远高于回收铝质饮料罐得到铝消耗的能量,可知在实际生产过程中必须考虑投入与产出,要考虑成本。
启示2:加强度旧金属的回收和再利用是合理开发和利用金属资源的重要途径。要树立金属垃圾也是一种宝贵资源的理念。在日常生活中,要大力倡导金属垃圾的分类回收和再利用,养成自觉珍惜自然资源、节约资源、爱惜环境和保护环境的意识。
启示3:实际工业生产中,从金属矿物到纯净金属的冶炼过程是一个复杂的过程,往往涉及许多其他物质和反应,在得到所需产品的同时,也会产生废弃物。因此必须考虑废弃物的处理和生产对环境的影响,形成绿色化学观念和可持续发展意识。
废旧金属制作的艺术品
铝土矿中提取铝工艺路线
问3:如何从铝土矿制取氧化铝?
问1:冰晶石的作用?
助熔剂,降低Al2O3的熔化温度
问2:为啥要定期更换碳素电极?
高温下,碳会被氧气氧化
利用铝土矿制取氧化铝
a.酸溶法的工艺流程:
上述过程中①、②反应的离子方程式分别为
① ;
② ;
反应③的化学方程式: 。
b.碱溶法的工艺流程:
上述过程中①、②反应的离子方程式分别为
① ;
② 。
AlO2-+2H2O+CO2===Al(OH)3↓+HCO3-
利用铝土矿制取氧化铝
课堂小结
金属矿物的开发利用
练习1
(1)在自然界中金属元素都以化合态的形式存在( )
(2)利用化合物冶炼金属时,金属元素一定发生还原反应( )
(3)越活泼的金属元素,人类利用的越晚( )
(4)用热还原法冶炼金属时,可以用H2将Mg从化合物中还原出来( )
(5)铝热反应的本质是用铝将比铝活泼性弱的金属从其化合物中置换出来( )
(6)可以通过电解饱和食盐水的方法获取金属钠( )
(7)可以通过电解熔融的MgO和AlCl3来制备金属Mg、Al( )
×
√
×
√
×
×
√
练习2
冶炼金属常用以下几种方法:
①以C或H2、CO作为还原剂还原法 ;②热分解法 ;③电解法 ;④铝热法。
现冶炼下列金属:Al、Mg、Cu、Hg、Mn,试标明适宜的冶炼方法。
Al: ;Mg: ;Cu: ; Hg: ;Mn: 。
③
③
①
②
④
3.工业上冶炼金属一般用热分解法、热还原法和电解法。你认为选择方法的主要依据是 ( )
A.金属在自然界的存在形式 B.金属元素在地壳中的含量
C.金属熔点高低 D.金属阳离子得电子的能力
D
4.下列氧化物不能跟铝粉组成铝热剂的是 ( )
A.WO3 B.MnO2 C.MgO D.V2O5
C
练习
谢谢观看
同学们好
欢迎来到化学课堂
新人教版 化学 必修第二册
请你描述!
联系生活,了解自然资源的分类和可持续发展
课本P98
第一节
自然资源的开发利用
第八章 化学与可持续发展
第1课时
自然资源是人类社会发展不可或缺的自然物质基础
土地与土壤资源
矿产资源
生物资源
水资源
能源资源
环境资源
能否再生
可再生资源
不可再生资源
植物、微生物、可降解塑料袋、水资源、地热资源
金属矿产和非金属矿产(煤、石油、天然气、土壤等)
01
金属矿物的开发利用
铂矿
蓝铜矿
赤铁矿
赤铜矿
铅锌矿
钨矿
铝矿
金属元素在自然界的存在
游离态
化合态
少数不活波金属
铜
银
陨铁
金矿
绝大多数金属以矿物质形式存在
孔雀石
铅锌矿
菱镁矿
黄铜矿
春秋、战国的青铜剑
你知道吗?
古代使用的金属有哪些?为什么?
和冶炼金属相关
高压钠灯
铁锅
不锈钢锅
钛合金羽毛球拍
镍合金门锁
金属的冶炼
02
金属的冶炼
(1)定义:将金属从其化合物中还原出来的过程,工业上称之为金属的冶炼。
(2)实质:
Mn+ M
+ne-
得电子,被还原
(3)冶炼步骤:
矿石的富集
精炼
冶炼
(4)冶炼方法:
金属的冶炼
金属被人类利用的早晚与什么有关?
明代炼丹炉
丹砂烧之成水银
金属冶炼方法
加热的是金属氧化物
2HgO 2Hg+O2↑
2Ag2O 4Ag+O2↑
热分解法
铜是人类第一种大量使用的金属,结束了漫长的“石器时代”
铜 镜
汉武帝时铜币
先秦刀币
司母戊鼎
铜虎头
铜的冶炼
炼矿曰扯铜,其法矿千斤(氧化矿,灼烧得CuO)用炭七八百斤不等,炉如来墙,底作圆窠,铺以炭末,始加矿炭……而铜沉于低,有流碣,即铜成之候矣——清·张泓《滇南新语》
CuO+C Cu+CO↑
请写出冶炼铜的化学方程式
热还原法
Cu2(OH)2CO3 2CuO+CO2↑+H2O
人类很早就发现,孔雀石在熊熊燃烧的树木中灼烧,树木余烬里会有一种红色光亮的金属凝固出来,试用化学方程式表示所发生的反应:
铜的冶炼
Cu2(OH)2CO3
孔雀石
资料
孔雀石的主要成分为Cu2(OH)2CO3 加热可分解生成三种氧化物
CuO+C Cu+CO↑
课本P105--2
Fe2O3+3CO === 2Fe + 3CO2
高温
CuO+H2 === Cu + H2O
高温
热还原法:常用的还原剂有:CO、H2、C(焦炭)、活泼金属
金属冶炼方法
热还原法
金属冶炼方法
热还原法
Fe2O3+2Al 2Fe + Al2O3
高温
铝热法:用金属铝做还原剂冶炼活泼性不如铝且“高熔点”的金属(Fe、V、Cr、Mn等)
应用:①冶炼熔点较高的金属,如铬、锰、钨、钒等
②金属焊接,如焊接钢轨。
Fe2O3+2Al 2Fe + Al2O3
高温
3MnO2+4Al 3Mn+ 2Al2O3
高温
Cr2O3+2Al 2Cr + Al2O3
高温
3Co3O4+8Al 9Co + 4Al2O3
高温
3V2O5+10Al 6V+ 5Al2O3
高温
铝热剂
热还原法
钨棒
三氧化钨
钨矿
WO3+3H2 W+3H2O
2Al+WO3 W+Al2O3
高温
课本P105--2
1827年,德国化学家维勒用金属钾制得了铝
1854 年,法国的德维尔用金属钠制得铝
铝的发现史
首先是由于19世纪70年代西门子改进了发电机后,有了廉价的电力
其次是由于两位22岁的大学生,于1886年分别发明了一种炼铝的方法。
这项创举使铝以大规模生产,奠定了今天世界制铝的工业方法。
到19世纪末,铝的价格发生了成千倍的跌落!
电解法
金属冶炼方法
拿破仑大帝喜欢炫耀自己。每次宴会,餐桌上的用具几乎全是用银制成的,唯有他自己用的那一个碗却是铝制品。为什么贵为法国皇帝用色泽要暗得多的铝碗呢?
电解法
电解法——适用于很活泼的金属(K Ca Na Mg Al )
电解铝
MgCl2 (熔融) Mg + Cl2 ↑
电解
2NaCl (熔融) 2Na+Cl2 ↑
电解
2Al2O3 (熔融) 4Al + 3O2 ↑
电解
冰晶石
电解法
[思考] 冶炼Mg时电解MgCl2,不能电解MgO?冶炼Al时电解Al2O3不能 电解AlCl3?
电解法制取镁时需要电解化合物的熔融状态,而MgO的熔点太高,将MgO加热熔融消耗的能量太高不经济。
AlCl3是共价化合物,熔融状态下无自由移动的离子
其他方法
信州铅山县有苦泉,流以为涧。其水熬之,则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之异化为铜。
—沈括《梦溪笔谈》
用矿(硫化矿,主要成分为Cu2S)二百五十箩……入大旋风炉,连烹(灼烧) 三日三夜,方见成铜。
—明·陆容《菽园杂记》
湿法炼铜 Fe+CuSO4===FeSO4+Cu
火法炼铜 Cu2S+O2===2Cu+SO2
高温
由于不同的金属离子得电子的能力不同,所以冶炼的方法不同
不活泼的金属
K、Ca、Na、Mg、Al、
Zn、Fe、Sn、Pb、(H)、Cu、
Hg、Ag、Pt、Au
非常活泼的金属
中等活泼的金属
金属冶炼方法
即:Mn+ + ne- M
课本P99
铝土矿
萤石
氧化铝
冰晶石
铝锭
碳素电极
液态铝
石油焦和沥青焦
电解
(1) 提高金属矿物的利用率
(2) 开发环保高效的金属冶炼方法
(4) 加强金属资源的回收和再利用
(5) 使用其他材料代替金属材料,
减少金属的使用量
(3) 防止金属的腐蚀
启示1:从铝土矿制铝消耗的能量要远远高于回收铝质饮料罐得到铝消耗的能量,可知在实际生产过程中必须考虑投入与产出,要考虑成本。
启示2:加强度旧金属的回收和再利用是合理开发和利用金属资源的重要途径。要树立金属垃圾也是一种宝贵资源的理念。在日常生活中,要大力倡导金属垃圾的分类回收和再利用,养成自觉珍惜自然资源、节约资源、爱惜环境和保护环境的意识。
启示3:实际工业生产中,从金属矿物到纯净金属的冶炼过程是一个复杂的过程,往往涉及许多其他物质和反应,在得到所需产品的同时,也会产生废弃物。因此必须考虑废弃物的处理和生产对环境的影响,形成绿色化学观念和可持续发展意识。
废旧金属制作的艺术品
铝土矿中提取铝工艺路线
问3:如何从铝土矿制取氧化铝?
问1:冰晶石的作用?
助熔剂,降低Al2O3的熔化温度
问2:为啥要定期更换碳素电极?
高温下,碳会被氧气氧化
利用铝土矿制取氧化铝
a.酸溶法的工艺流程:
上述过程中①、②反应的离子方程式分别为
① ;
② ;
反应③的化学方程式: 。
b.碱溶法的工艺流程:
上述过程中①、②反应的离子方程式分别为
① ;
② 。
AlO2-+2H2O+CO2===Al(OH)3↓+HCO3-
利用铝土矿制取氧化铝
课堂小结
金属矿物的开发利用
练习1
(1)在自然界中金属元素都以化合态的形式存在( )
(2)利用化合物冶炼金属时,金属元素一定发生还原反应( )
(3)越活泼的金属元素,人类利用的越晚( )
(4)用热还原法冶炼金属时,可以用H2将Mg从化合物中还原出来( )
(5)铝热反应的本质是用铝将比铝活泼性弱的金属从其化合物中置换出来( )
(6)可以通过电解饱和食盐水的方法获取金属钠( )
(7)可以通过电解熔融的MgO和AlCl3来制备金属Mg、Al( )
×
√
×
√
×
×
√
练习2
冶炼金属常用以下几种方法:
①以C或H2、CO作为还原剂还原法 ;②热分解法 ;③电解法 ;④铝热法。
现冶炼下列金属:Al、Mg、Cu、Hg、Mn,试标明适宜的冶炼方法。
Al: ;Mg: ;Cu: ; Hg: ;Mn: 。
③
③
①
②
④
3.工业上冶炼金属一般用热分解法、热还原法和电解法。你认为选择方法的主要依据是 ( )
A.金属在自然界的存在形式 B.金属元素在地壳中的含量
C.金属熔点高低 D.金属阳离子得电子的能力
D
4.下列氧化物不能跟铝粉组成铝热剂的是 ( )
A.WO3 B.MnO2 C.MgO D.V2O5
C
练习
谢谢观看
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
