人教版九年级化学 第八单元 课题2 金属的化学性质 课时2 金属活动性顺序课件(共24张PPT)
文档属性
| 名称 | 人教版九年级化学 第八单元 课题2 金属的化学性质 课时2 金属活动性顺序课件(共24张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 691.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-29 10:22:15 | ||
图片预览








文档简介
(共24张PPT)
第八单元 金属和金属材料
课题2 金属的化学性质
课时2 金属活动性顺序
目录
01
课程要求
02
课前预习
03
知识点精讲
04
课堂检测
1. 通过实验探究等活动认识金属活动性顺序。
2. 能依据金属活动性顺序,初步预测常见的金属的主要性质,设计实验方案,分析、解释有关的实验现象,进行证据推理,得出合理的结论。
写出下列物质的化学式。
氯化亚铁 FeCl2 硫酸铝 Al2(SO4)3
硫酸铜 CuSO4 硝酸银 AgNO3
FeCl2
Al2(SO4)3
CuSO4
AgNO3
知识点1 金属与盐溶液反应
2. 完成课本P11~12“探究 金属活动性顺序”,填写下表。
Fe+
实 验 现 象 反应化学方程式 结 论
(1)铝丝浸入硫酸铜溶液中 铝丝表面有 紫红色 物质生成,溶液由 蓝 色逐渐变为 无 色 金属活动性:铝 > 铜
紫
红色
蓝
无
2Al+
Al2(SO4)3
+3Cu
>
实 验 现 象 反应化学方程式 结 论
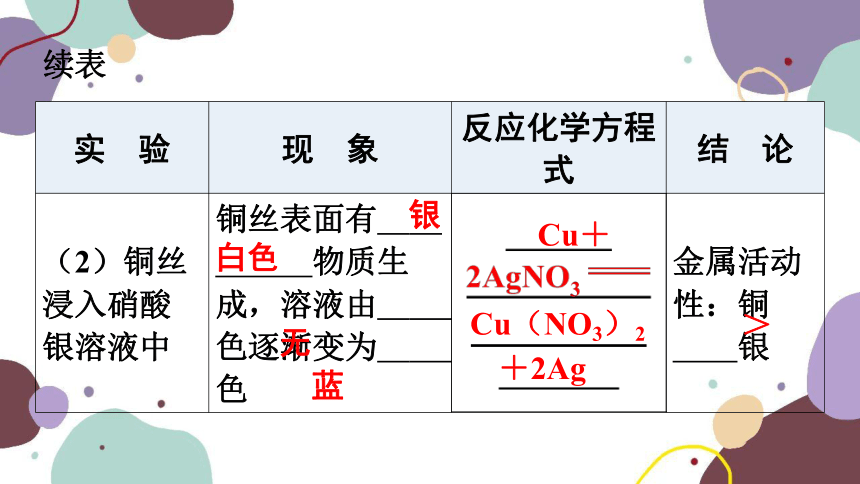
(2)铜丝浸入硝酸银溶液中 铜丝表面有 银白色 物质生成,溶液由 无 色逐渐变为 蓝 色 金属活动性:铜 > 银
银
白色
无
蓝
Cu+
Cu(NO3)2
+2Ag
>
续表
实 验 现 象 反应化学方程式 结 论
(3)铜丝浸入硫酸铝溶液中 无明显现象 — 金属活动性:铜 < 铝
<
续表
【结论】根据上述实验,铝、铜、银三种金属活动性由强到弱的顺序是 铝、铜、银 。
注意:CuSO4、CuCl2、Cu(NO3)2溶液都呈蓝色,是因为其溶液中都含有铜离子(Cu2+) 。FeSO4、FeCl2、Fe(NO3)2溶液都呈浅绿色,是因为其溶液中都含有亚铁离子(Fe2+) 。熟记常见的金属及金属离子的颜色:Cu2+——蓝色、Fe2+——浅绿色、Fe3+——黄色。
铝、铜、银
课堂练习
A. 该反应属于置换反应
B. 锰的金属活动性比铁强
C. 氯化亚铁溶液呈浅绿色
D. 反应前后元素化合价都不变
D
思路点拨 (1)根据金属是否与盐溶液反应,判断金属的活动性强弱。(2)溶液质量是否增加根据置换反应后,金属化合物的相对分子质量是否增加来判断。
知识点2 金属活动性顺序
3. 金属活动性顺序
K、Ca、Na、 Mg 、 Al 、 Zn 、 Fe 、Sn、Pb、(H)、 Cu 、 Hg 、 Ag 、Pt、Au
Mg
Al
Zn
Fe
Cu
Hg
Ag
金属活动性由强逐渐减弱
4. 金属活动性顺序的应用
(1)在金属活动性顺序里,金属的位置越 靠前 ,它的活动性就越 强 。
(2)在金属活动性顺序里,位于 氢前面 的金属能置换出盐酸、稀硫酸中的 氢 。
靠前
强
氢前面
氢
(3)在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的 化合物的溶液 里置换出来。
化合物的溶液
注意:(1)金属与酸或其他金属化合物溶液的反应一般不选择钾、钙、钠等金属,因为它们能与水反应。(2)初中阶段,金属与酸反应,所用的酸是盐酸或稀硫酸,不考虑使用浓硫酸和硝酸。
课堂练习
2. 下列四个化学反应中,符合图8-2-3中的漫画情景的是( A )
图8-2-3
A
思路点拨 根据金属活动性顺序判断反应是否发生,在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的化合物的溶液中置换出来(强换弱)。注意铁参加置换反应,生成的是+2价的亚铁化合物。
1. 下列事实不能用金属活动性解释的是( C )
A. 出土文物中,铜制品明显多于铁制品
B. 锌与稀硫酸反应速率适中,更适于实验室制氢气
C. 铝比铁更耐腐蚀
D. 不宜用铁制容器盛放波尔多液(含硫酸铜)
C
2. 下列事实可用于判断X、Y两种金属的活动性顺序的是( A )
①X能和稀盐酸反应而Y不能 ②在化合物中X显+3价,Y显+2价 ③X能在空气中燃烧而Y不能 ④X能从Y的化合物溶液中置换出Y
A. ①③④ B. ①②③④
C. ①②③ D. ①②
A
A. 该反应是置换反应
B. 金属活动性是M>银
C. 金属M可能是铝
D. 金属M表面有固体析出
C
4. 金属X在化合物中显+2价,它在金属活动性顺序中的位置如图8-2-4所示。下列化学方程式错误的是( C )
图8-2-4
C
5. “宏观—微观—符号”三重表征是化学独有的表示物质及其变化的方法。请结合图8-2-5回答下列问题。
图8-2-5
(1)图甲的实验中,金属R表面有银白色固体物质析出;图乙的实验中,锌表面有黑色固体物质析出。比较R、Zn、Ag的活动性强弱: Zn>R>Ag 。
(2)图丙是图甲实验的微观示意图。根据图丙分析图甲实验,溶液增加的离子是 R2+ (填离子符号,下同),减少的离子是 Ag+ 。
Zn>R>Ag
R2+
Ag+
R+
置换反应
谢 谢!
第八单元 金属和金属材料
课题2 金属的化学性质
课时2 金属活动性顺序
目录
01
课程要求
02
课前预习
03
知识点精讲
04
课堂检测
1. 通过实验探究等活动认识金属活动性顺序。
2. 能依据金属活动性顺序,初步预测常见的金属的主要性质,设计实验方案,分析、解释有关的实验现象,进行证据推理,得出合理的结论。
写出下列物质的化学式。
氯化亚铁 FeCl2 硫酸铝 Al2(SO4)3
硫酸铜 CuSO4 硝酸银 AgNO3
FeCl2
Al2(SO4)3
CuSO4
AgNO3
知识点1 金属与盐溶液反应
2. 完成课本P11~12“探究 金属活动性顺序”,填写下表。
Fe+
实 验 现 象 反应化学方程式 结 论
(1)铝丝浸入硫酸铜溶液中 铝丝表面有 紫红色 物质生成,溶液由 蓝 色逐渐变为 无 色 金属活动性:铝 > 铜
紫
红色
蓝
无
2Al+
Al2(SO4)3
+3Cu
>
实 验 现 象 反应化学方程式 结 论
(2)铜丝浸入硝酸银溶液中 铜丝表面有 银白色 物质生成,溶液由 无 色逐渐变为 蓝 色 金属活动性:铜 > 银
银
白色
无
蓝
Cu+
Cu(NO3)2
+2Ag
>
续表
实 验 现 象 反应化学方程式 结 论
(3)铜丝浸入硫酸铝溶液中 无明显现象 — 金属活动性:铜 < 铝
<
续表
【结论】根据上述实验,铝、铜、银三种金属活动性由强到弱的顺序是 铝、铜、银 。
注意:CuSO4、CuCl2、Cu(NO3)2溶液都呈蓝色,是因为其溶液中都含有铜离子(Cu2+) 。FeSO4、FeCl2、Fe(NO3)2溶液都呈浅绿色,是因为其溶液中都含有亚铁离子(Fe2+) 。熟记常见的金属及金属离子的颜色:Cu2+——蓝色、Fe2+——浅绿色、Fe3+——黄色。
铝、铜、银
课堂练习
A. 该反应属于置换反应
B. 锰的金属活动性比铁强
C. 氯化亚铁溶液呈浅绿色
D. 反应前后元素化合价都不变
D
思路点拨 (1)根据金属是否与盐溶液反应,判断金属的活动性强弱。(2)溶液质量是否增加根据置换反应后,金属化合物的相对分子质量是否增加来判断。
知识点2 金属活动性顺序
3. 金属活动性顺序
K、Ca、Na、 Mg 、 Al 、 Zn 、 Fe 、Sn、Pb、(H)、 Cu 、 Hg 、 Ag 、Pt、Au
Mg
Al
Zn
Fe
Cu
Hg
Ag
金属活动性由强逐渐减弱
4. 金属活动性顺序的应用
(1)在金属活动性顺序里,金属的位置越 靠前 ,它的活动性就越 强 。
(2)在金属活动性顺序里,位于 氢前面 的金属能置换出盐酸、稀硫酸中的 氢 。
靠前
强
氢前面
氢
(3)在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的 化合物的溶液 里置换出来。
化合物的溶液
注意:(1)金属与酸或其他金属化合物溶液的反应一般不选择钾、钙、钠等金属,因为它们能与水反应。(2)初中阶段,金属与酸反应,所用的酸是盐酸或稀硫酸,不考虑使用浓硫酸和硝酸。
课堂练习
2. 下列四个化学反应中,符合图8-2-3中的漫画情景的是( A )
图8-2-3
A
思路点拨 根据金属活动性顺序判断反应是否发生,在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的化合物的溶液中置换出来(强换弱)。注意铁参加置换反应,生成的是+2价的亚铁化合物。
1. 下列事实不能用金属活动性解释的是( C )
A. 出土文物中,铜制品明显多于铁制品
B. 锌与稀硫酸反应速率适中,更适于实验室制氢气
C. 铝比铁更耐腐蚀
D. 不宜用铁制容器盛放波尔多液(含硫酸铜)
C
2. 下列事实可用于判断X、Y两种金属的活动性顺序的是( A )
①X能和稀盐酸反应而Y不能 ②在化合物中X显+3价,Y显+2价 ③X能在空气中燃烧而Y不能 ④X能从Y的化合物溶液中置换出Y
A. ①③④ B. ①②③④
C. ①②③ D. ①②
A
A. 该反应是置换反应
B. 金属活动性是M>银
C. 金属M可能是铝
D. 金属M表面有固体析出
C
4. 金属X在化合物中显+2价,它在金属活动性顺序中的位置如图8-2-4所示。下列化学方程式错误的是( C )
图8-2-4
C
5. “宏观—微观—符号”三重表征是化学独有的表示物质及其变化的方法。请结合图8-2-5回答下列问题。
图8-2-5
(1)图甲的实验中,金属R表面有银白色固体物质析出;图乙的实验中,锌表面有黑色固体物质析出。比较R、Zn、Ag的活动性强弱: Zn>R>Ag 。
(2)图丙是图甲实验的微观示意图。根据图丙分析图甲实验,溶液增加的离子是 R2+ (填离子符号,下同),减少的离子是 Ag+ 。
Zn>R>Ag
R2+
Ag+
R+
置换反应
谢 谢!
同课章节目录
