第二章 分子结构与性质 测试卷(含解析) 2022-2023学年高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 第二章 分子结构与性质 测试卷(含解析) 2022-2023学年高二下学期化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-29 15:33:40 | ||
图片预览



文档简介
第二章《分子结构与性质》测试卷
一、单选题
1.下列化学用语和化学符号正确的是
A.次氯酸的结构式
B.的球棍模型
C.碳酸氢钠在水溶液中的电离方程式:
D.的电子式:
2.下列关于粒子结构的描述错误的是
A.CS2、C2H2、BeCl2都是直线形分子
B.CCl4和CH2Cl2均是四面体构型的非极性分子
C.H2S和NH3均是由极性键构成的极性分子
D.HCl和HS-均是含有一个极性键的18电子粒子
3.科学研究发现:红橙色更容易招蚊子,蚊子能闻到气味。下列有关的说法错误的是
A.是直线形分子 B.是由极性键形成的非极性分子
C.中键角为180° D.干冰气化时克服共价键
4.下列描述正确的是
①CS2为V形的极性分子
②ClO的空间构型为平面三角形
③SF6中有6对完全相同的成键电子对
④SiF4和SO的中心原子均为sp3杂化
⑤HCHO分子中既含σ键又含π键
A.①②③④ B.②③④ C.③④⑤ D.①④⑤
5.化合物M是一种用于有机合成的催化剂,其三维空间伸展的部分网状结构如图所示。其中X、Y、Z、W为原子序数依次增大的短周期主族元素。下列说法正确的是
A.W的最高价氧化物可以用于干燥氨气
B.Y的氟化物YF3中各原子均满足8电子稳定结构
C.简单氢化物的沸点:Z>W
D.元素非金属性:W>Z>X
6.下列叙述不正确的是( )
①和互为同位素
②金属性:
③四氯化碳的电子式为
④离子键就是阴、阳离子间的静电引力
⑤通常活泼金属与活泼非金属元素形成离子化合物
⑥在熔融状态下电离,破坏了离子键和共价键
⑦用电子式表示溴化氢的形成过程为
A.①④⑥ B.④⑤⑥ C.③④⑥⑦ D.全部都不正确
7.LiAlH4是重要的还原剂与储氢材料,在120℃下的干燥空气中相对稳定,其合成方法为:。下列说法正确的是( )
A.基态铝原子核外有7种不同空间运动状态的电子 B.该反应可以在水溶液中进行
C.AlH与AlCl3中Al原子杂化方式相同 D.AlH与互为等电子体,其空间构型均为正方形
8.下列分子的空间结构模型或键角正确的是
A. B.
C. D.
9.下列物质的性质与氢键无关的是
A.冰的密度比水的密度小
B.氨气极易溶于水
C.SbH3的沸点比PH3高
D.沸点:邻羟基苯甲醛<对羟基苯甲醛
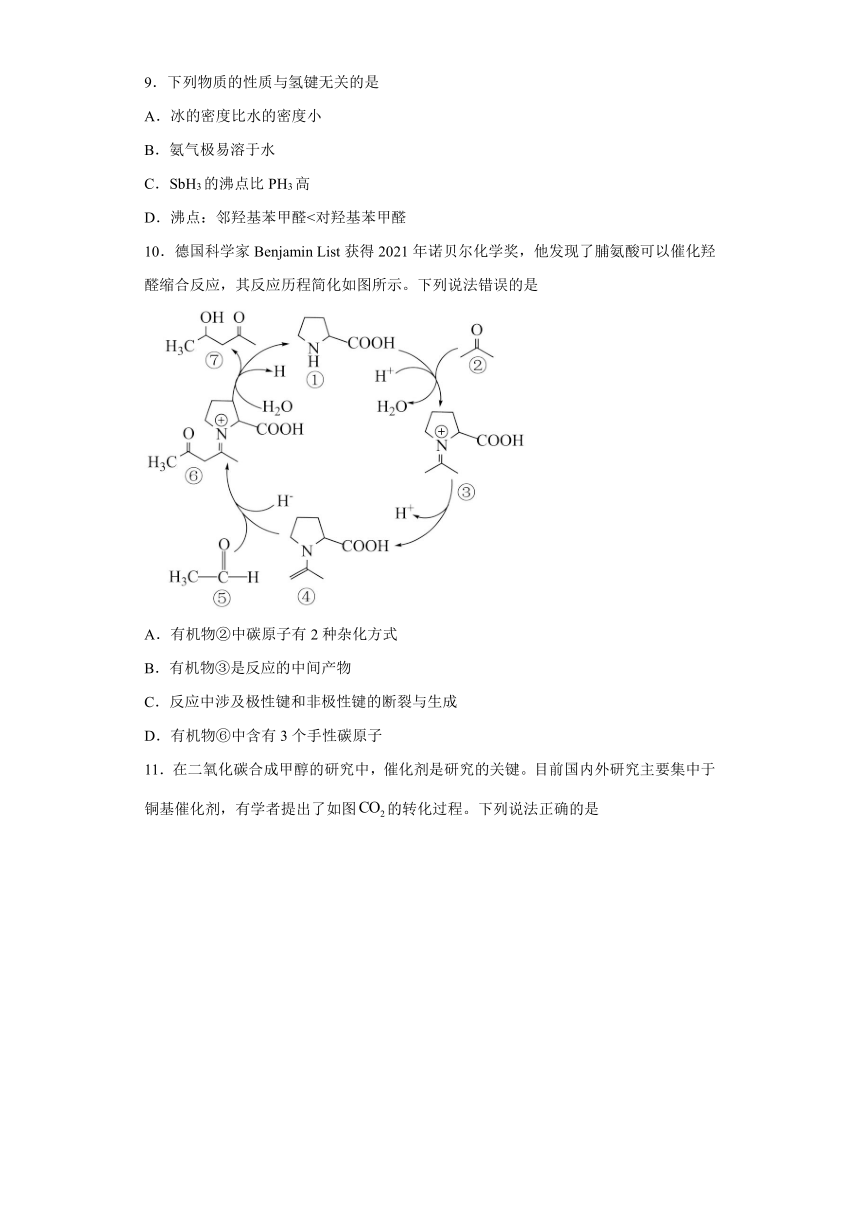
10.德国科学家Benjamin List获得2021年诺贝尔化学奖,他发现了脯氨酸可以催化羟醛缩合反应,其反应历程简化如图所示。下列说法错误的是
A.有机物②中碳原子有2种杂化方式
B.有机物③是反应的中间产物
C.反应中涉及极性键和非极性键的断裂与生成
D.有机物⑥中含有3个手性碳原子
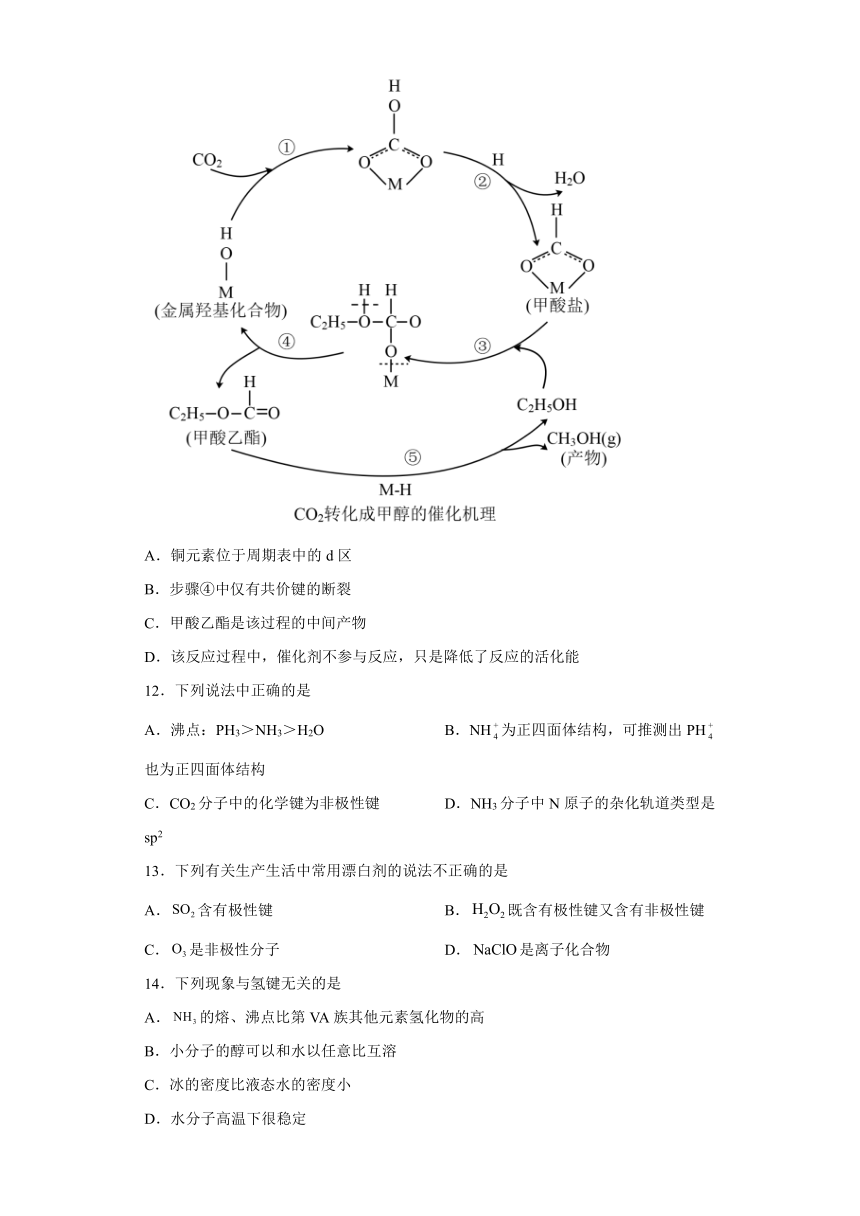
11.在二氧化碳合成甲醇的研究中,催化剂是研究的关键。目前国内外研究主要集中于铜基催化剂,有学者提出了如图的转化过程。下列说法正确的是
A.铜元素位于周期表中的d区
B.步骤④中仅有共价键的断裂
C.甲酸乙酯是该过程的中间产物
D.该反应过程中,催化剂不参与反应,只是降低了反应的活化能
12.下列说法中正确的是
A.沸点:PH3>NH3>H2O B.NH为正四面体结构,可推测出PH也为正四面体结构
C.CO2分子中的化学键为非极性键 D.NH3分子中N原子的杂化轨道类型是sp2
13.下列有关生产生活中常用漂白剂的说法不正确的是
A.含有极性键 B.既含有极性键又含有非极性键
C.是非极性分子 D.是离子化合物
14.下列现象与氢键无关的是
A.的熔、沸点比第VA族其他元素氢化物的高
B.小分子的醇可以和水以任意比互溶
C.冰的密度比液态水的密度小
D.水分子高温下很稳定
15.科学家合成出了一种用于分离镧系金属的化合物A(结构如图所示),短周期元素X、Y、Z原子序数依次增大,其中Z位于第三周期。Z与Y2可以形成分子ZY6,该分子常用作高压电气设备的绝缘介质。下列关于X、Y、Z的叙述正确的是
A.X、Y、Z的电负性:Y>X>Z
B.Y、Z对应离子的还原性:Y>Z
C.XY3的空间构型为三角锥形
D.X和Z最高价氧化物对应水化物的酸性:X<Z
二、填空题
16.结构化学家鲍林(Pauling)曾提出一条经验规则:设含氧酸的化学式为HnROm,其中(m-n)为非羟基氧的原子数。而含氧酸的强弱与非羟基氧原子数(m-n)有如下关系:
m-n 0 1 2 3
含氧酸强度 弱酸 中强 强 很强
实例 HClO H3PO4 HNO3 HClO4
请回答:
(1)按此规则判断:H3AsO4,H2SO4,HMnO4三处酸性由强到弱的顺序是_________。
(2)H3PO3和H3AsO3的分子组成相似,但酸性强弱相差很大,已知H3PO3为中强酸而H3AsO3为弱酸,试推断它们的结构式,H3PO3为__________,H3AsO3为_________。
17.回答下列问题:
(1)Cd与Zn同族且相邻,写出基态Cd原子的价层电子排布式:___________。
(2)原子中运动的电子有两种相反的自旋状态,一种自旋状态用表示,与之相反的用表示,称为电子的自旋磁量子数。对于基态Si原子,其价电子自旋磁量子数的代数和为___________。
(3)O和S处于同一主族,第一电离能较大的是___________。和分子中的键角较大的是___________,键长较短的是___________。单质硫与热的浓溶液反应的产物之一为,的空间构型为___________。
(4)已知多个相邻且平行的p轨道重叠则形成大键,分子中的大键可用符号表示,其中代表参与形成大键的原子数,代表参与形成大键的电子数(如苯分子的大键可表示为)。吡咯( )中所有原子共平面。则吡咯分子中的大键应表示为___________。吡咯分子中N原子的杂化类型为___________,1mol吡咯分子中含有___________键, 噻吩的沸点为84℃,吡咯( )的沸点在129-131℃之间,吡洛沸点较高,其原因是___________。
(5)键的极性对物质的化学性质有重要影响。已知一些常见电子基团的吸电子效应的强度:,则下列物质酸性由强到弱的顺序是___________(填序号)。
A. B.
C. D.
(6)是离子晶体,其形成过程中的能量变化如图(a)所示。
可知,Li原子的第一电离能为_______,键键能为_______。
三、实验题
18.某化学兴趣小组拟实验探究锡及其化合物的部分性质。经查阅资料知:Sn 的熔点为231 °C;SnCl2易被氧化,且易水解; Sn(OH)2常温下易分解; SnCl4常温下为无色液体,熔点为.-33°C,沸点为114°C,易水解。回答下列问题:
(1)该小组用以下流程制备SnSO4晶体:
①Sn为50号元素,请写出Sn在元素周期表的位置___________________;
②在上述流程中,加入锡粉的作用为________________;
③反应Ⅰ的离子方程式为_______________________;
④操作Ⅰ为沉淀的洗涤,请简述如何判断沉淀已洗涤干净 ________;操作Ⅱ中,实验操作包括_______、过滤、洗涤、干燥等一系列操作。
(2)用熔融的锡与干燥的氯气制备SnCl4,实验装置如下:
①SnCl4是______分子(填“极性”或“非极性”)。
②装置Ⅲ中盛装药品Sn的仪器名称是_______;装置Ⅵ中碱石灰的作用为______。
(3)该小组通过下列方法测定所用锡粉的纯度:取锡粉1.226g溶于稀硫酸中,加入过量的FeCl3溶液,再用0.1000mol·L-1的K2Cr2O7溶液滴定含有Fe2+的溶液,消耗K2Cr2O7溶液32.00mL。已知①Sn+H+→H2↑+Sn2+; ②Sn2++ Fe3+→Sn4+ + Fe2+;③+ Fe2+→Cr3++Fe3+ (方程式均未配平)。则锡粉的质量分数为(杂质不参与反应)______(结果保留三位有效数字)。
19.I.磷酸是一种重要的化工原料,是生产磷肥的原料,也是食品添加剂之一。
(1)工业上可以用磷单质与硝酸作用得到纯的磷酸(熔点)。的VSEPR模型是_______(填名称)。磷酸易形成过饱和溶液,难以结晶,可向其过饱和溶液中加入_______促进其结晶,但是所制得的磷酸中仍含有少量的水极难除去,其可能的原因是_______。
Ⅱ.研究小组以无水甲苯为溶剂,(易水解)和(叠氮化钠)为反应物制备纳米球状红磷。
(2)甲苯干燥和收集的回流装置如图1所示(夹持及加热装置略)。以二苯甲酮为指示剂,无水时体系呈蓝色。
①金属的作用是_______。
②回流过程中,除水时打开的活塞是_______;体系变蓝后,改变开关状态收集甲苯。
(3)纳米球状红磷的制备装置如图2所示(夹持、搅拌、加热装置已略)。
①在氩气保护下,反应物在装置A中混匀后转入装置B,于加热12小时,反应物完全反应,其化学方程式为_______;用氩气赶走空气的目的是_______。
②经冷却、离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是_______、_______。
四、计算题
20.C70分子是形如椭球状的多面体,该结构的建立基于以下考虑:
①C70分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②C70分子中只含有五边形和六边形;
③多面体的顶点数、面数和棱边数的关系遵循欧拉定理:顶点数+面数-棱边数=2。
根据以上所述确定:
(1)C70分子中所含的单键数为______,双键数_______;
(2)C70分子中的五边形和六边形各有多少__________?
21.填空
(1)下列物质中,互为同位素的有_______,互为同素异形体的有_______,互为同系物的有_______,互为同分异构体的有_______,属于同种物质有_______。
①O2和O3②35Cl和37Cl③和④+和⑤CH3(CH2)2CH3和(CH3)2CHCH3⑥乙醇和甲醚(CH3OCH3)
(2)立方烷结构为,它的结构高度对称,其二氯代物有_______种。
(3)化合物甲只含C、H两种元素,化合物乙只含C、H、F三种元素,甲、乙都是饱和化合物,且分子中都含有26个电子,据此推断:
①甲的分子式是_______;若甲分子中有两个H原子被F原子代替,所得产物可能有_______种结构。
②乙是性能优异的环保产品,可替代某些会破坏臭氧层的氟里昂产品,用作制冷剂。已知乙分子中C、H、F原子个数比为1∶2∶2,则下列对于乙的描述正确的是_______
A.其分子空间构型为正四面体 B.碳为sp3杂化
C.具有两种同分异构体 D.没有同分异构体
试卷第2页,共9页
参考答案:
1.B
【详解】A.次氯酸分子中各原子均为稳定结构,其结构式为:,A错误;
B.为三角锥形,其球棍模型为: ,B正确;
C.碳酸氢钠为强电解质,所以在水中能完全电离生成钠离子和碳酸氢根离子,其电离方程式为:,C错误;
D.的各原子均满足8电子稳定结构,其电子式为: ,D错误;
故选B。
2.B
【详解】A.CS2、C2H2、BeCl2的中心原子杂化轨道类型均为sp杂化,都是直线形分子,故A正确;
B.由于C—H键的键长小于C—Cl键的键长,故CH2Cl2的空间结构不是对称的正四面体构型,因而属于极性分子,故B错误;
C.H2S为V形构型,NH3为三角锥形构型,均是由极性键构成的极性分子,故C正确;
D.不同非金属原子间形成极性键,HCl中含有H-Cl极性键,HS-中含有H-S极性键,二者含有18电子,故D正确;
答案选B。
3.D
【详解】A.CO2结构式为O=C=O,属于直线形分子,故A正确;
B.CO2分子中含有C=O键,为极性共价键,其分子结构为直线型,正负电荷中心重合,为非极性分子,故B正确;
C.CO2结构式为O=C=O,属于直线形分子,其键角为180°,故C正确;
D.干冰是分子晶体,分子晶体是分子靠分子间作用力形成的晶体,气化时克服分子间作用力,不破坏共价键,故D错误;
答案选D。
4.C
【详解】①CS2与CO2分子构型相同,二氧化碳的分子结构为O=C=O,则CS2的结构为S=C=S,属于直线形分子,是非极性分子,故①错误;
②ClO3-中Cl的价层电子对数=3+(7+1-2×3)=4,含有一个孤电子对,则离子的空间构型为三角锥形,故②错误;
③SF6中S-F含有一个成键电子对,所以SF6中含有6个S-F键,则分子中有6对完全相同的成键电子对,故③正确;
④SiF4中Si的价层电子对数=4+(4-1×4)=4,SO32-中S的价层电子对数=3+(6+2-2×3)=4,所以中心原子均为sp3杂化,故④正确;
⑤所有的共价双键中有一个是σ键一个是π键,HCHO分子中有碳氧双键,故HCHO分子中既含σ键又含π键。故⑤正确;
③、④和⑤正确,故答案为C。
5.C
【分析】
【详解】A.W的最高价氧化物为,为酸性干燥剂,不可以用于干燥碱性气体,A错误;
B.中硼原子最外层是6个电子,不满足8电子稳定结构,B错误;
C.分子中存在分子间氢键,其沸点高于,C正确;
D.X、Z、W分别为H、O、P元素,元素非金属性:,D错误;
故选C。
6.C
【详解】①具有相同质子数、不同中子数的核素互称为同位素,和互为同位素,①正确;
②同一周期主族元素,元素金属性随着原子序数的增大逐渐减弱,同一主族元素,元素金属性随着原子序数的增大逐渐增强,所以金属性:,②正确;
③四氯化碳的电子式为,③错误;
④离子键为阴、阳离子之间的相互作用力,包括静电引力、静电斥力,④错误;
⑤通常活泼金属与活泼非金属元素形成离子化合物,⑤正确;
⑥在熔融状态下电离,只破坏离子键,电离方程式为,⑥错误;
⑦为共价化合物,用电子式表示溴化氢的形成过程为,⑦错误;
综上所述,叙述不正确的是③④⑥⑦,故答案为C。
7.A
【详解】A.基态铝原子核外电子排布式为1s22s22p63s23p1,共占据7个轨道,所以有7种不同空间运动状态的电子,A正确;
B.LiAlH4会和水反应,该反应不能在水溶液中进行,B错误;
C.AlH中Al原子价层电子对数为=4,为sp3杂化,AlCl3中Al原子价层电子对数为3,为sp2杂化,C错误;
D.AlH和PH中心原子的价层电子对数为4,不含孤电子对,为正四面体构型,D错误;
综上所述答案为A。
8.A
【详解】A.甲烷是正四面体结构,碳原子在正四面体中心,键角为109°28',故A正确;
B.H2S的中心原子S的价层电子对数=2+(6-2×1)=2+2=4,所以H2S是V形结构,不是直线形结构,故B错误;
C.NH3的中心原子N的价层电子对数=3+(5-3×1)=3+1=4,所以NH3是三角锥形结构,键角小于109°28',大约为107°,故C错误;
D.CO2的中心原子C的价层电子对数=2+(4-2×2)=2,所以CO2是直线形结构,故D错误;
故选A。
9.C
【详解】A.冰中的氢键比液态水中的强,使得水分子排列得很规则,造成体积膨胀,密度变小,故A不选;
B.氨气分子之间存在氢键,沸点相对较高,故氨气容易液化,故B不选;
C.SbH3的相对分子质量比PH3的大,且两者都为分子晶体,故SbH3沸点比PH3的沸点高,与氢键无关,故C选;
D.与水能形成分子间氢键的物质,在水中的溶解度较大,邻羟基苯甲醛容易形成分子内氢键,对羟基苯甲醛与水分子间易形成氢键,所以溶解度:邻羟基苯甲醛<对羟基苯甲醛,故D不选;
故选:C。
10.D
【详解】A.有机物②中甲基碳原子采取sp3杂化,羰基碳原子采取sp2杂化,所以含有、种杂化方式,A项正确;
B.中间产物是在反应过程中产生,又参与下一步反应被消耗的物质,有机物①③④⑥都是反应的中间产物,B项正确;
C.反应中有碳氧、碳氮、碳氢、碳碳等极性键和非极性键的断裂与生成,C项正确;
D.手性碳原子是连有4个不同原子或原子团的碳原子,有机物⑥中含有2个手性碳原子,D项错误;
故选D。
11.C
【详解】A.铜是29号元素,为ⅠB族元素,位于周期表中的ds区,故A错误;
B.步骤④中有O-H、C-O键的断裂,有C=O键的生成,故B错误;
C.甲酸乙酯是反应④的生成物,是反应⑤的反应物,所以甲酸乙酯是该过程的中间产物,故C正确;
D.催化剂通过参与化学反应降低反应的活化能,故D错误;
选C。
12.B
【详解】A.含有氢键的氢化物的沸点较高,分子间形成氢键数目越多,沸点越高,所以沸点:PH3<NH3<H2O,故A错误;
B.NH和PH中,中心原子都形成4个键,没有孤电子对,为正四面体结构,故B正确;
C.二氧化碳结构为O=C=O,CO2分子中的化学键为极性键,故C错误;
D.NH3中价层电子对个数=σ键个数+孤电子对个数=3+×(5-3×1)=4,中心原子是以sp3杂化,故D错误;
故选B。
13.C
【详解】A.不同非金属元素形成的共用电子对发生偏移,形成极性键,分子内硫与氧原子之间为极性键,A项正确;
B.分子中O—H键为极性键、O—O键为非极性键,B项正确;
C.与是等电子体,是具有微弱极性的极性分子,C项错误;
D.由钠离子和次氯酸根构成、是离子化合物,D项正确。
答案选C。
14.D
【详解】A.氮元素的电负性大,能与氢元素形成氢键,因此NH3的熔、沸点比第ⅤA族其他元素氢化物的熔、沸点高,与氢键有关系,A项不符合题意;
B.由于醇和羧酸结构中含有羟基,且小分子的醇、羧酸的烃基对形成分子间氢键影响比较小,故小分子的醇、羧酸可以和水以任意比互溶,B项不符合题意;
C.水为冰时,分子间距离变小,形成的氢键数目比液态水多,导致同质量时,冰比液态水体积大,所以冰的密度比液态水的密度小,C项不符合题意;
D.水分子高温下很稳定,是由于水中共价键键能大,与氢键没有关系,D项符合题意;
答案选D。
15.D
【分析】短周期元素X、Y、Z原子序数依次增大,其中Z位于第三周期,根据结构式可知,Z可形成3个共价键,带一个单位正电荷,所以Z的最外层电子数应为6,推知Z为S元素,Z与Y2可以形成分子ZY6,该分子常用作高压电气设备的绝缘介质,说明该分子为SF6,即Y为F元素,X形成4个共价键,带一个单位负电荷,则X最外层电子数为3,所以推知X为B,根据以上分析可知,X、Y、Z分别为B、F、S。
【详解】A.元素非金属性越强,其电负性越大,非金属性:F>S>B,则X、Y、Z的电负性:Y>Z>X,A错误;
B.元素非金属性越强,其氧化性越强,对应离子的还原性越弱,F元素非金属性强于S元素,则Y、Z对应离子的还原性:YC.XY3为BF3,BF3中B形成3个键,孤对电子数为(3-3×1)=0,其空间构型为平面三角形,C错误;
D.元素非金属性越强,其对应最高价氧化物对应水化物的酸性越强,非金属性:B故选D。
16. HMnO4>H2SO4>H3AsO3
【分析】(1)根据题中非羟基氧原子数与酸性强弱的关系分析;
(2)H3PO3和H3AsO3的酸性不同,说明二者分子中非羟基氧原子数不同,据此分析。
【详解】(1)根据题中表格数据可知,非羟基氧原子数越多,酸性越强,H3AsO4非羟基氧原子数为1,H2CrO4非羟基氧原子数为2,HMnO4非羟基氧原子数为3,则酸性:H3AsO4<H2CrO4<HMnO4;
(2)因为酸性H3PO3>H3AsO3,则H3PO3中非羟基氧的数目应大于H3AsO3,且H3AsO3为弱酸,所以可以推知H3AsO3没有非羟基氧,其分子结构分别为:、。
17.(1)4d105s2
(2)+1或-1
(3) O H2O H2O V形
(4) sp2 10 吡咯分子间有氢键
(5)BCDA
(6) 520 498
【详解】(1)Cd与Zn同族且相邻,Zn的价电子排布式为3d104s2,则基态Cd原子的价层电子排布式为4d105s2。
(2)Si的价电子排布式为3s23p2,3s2上的两个电子自旋方向相反,自旋磁量子数的代数和为0,3p上的两个电子自旋方向相同,则自旋磁量子数的代数和为+1或-1。
(3)同主族元素从上到下,电子层数逐渐增多,对核外电子的引力逐渐减弱,所以第一电离能逐渐减小,所以O和S第一电离能较大的是O;H2O 和H2S分子的中心原子均为sp3杂化,都有两个孤电子对,由于O的电负性比S大,所以O原子周围的电子较多,排斥力较大,键角较大,所以键角较大的是H2O;O原子的半径比S小,所以H2O中的键长比H2S中的键长短;中心原子的价电子对数=2+(6+2-2×2)=2+2=4,其VSEPR模型为四面体形,去掉两个孤电子对,其空间结构为V形。
(4)吡咯是平面结构,C原子和N原子均采取sp2杂化,C原子杂化后还剩一个未参加杂化的p轨道上的电子,N原子杂化后还剩余一对电子,所以吡咯分子中的大π键是5个原子共用6个电子形成的,表示为;吡咯分子中有C-Cσ键、C-Nσ键、C-Hσ键和N-Hσ键,1mol吡咯分子中有10molσ键;吡咯分子中有N原子,N原子上连着H原子,可以形成分子间氢键,而噻吩不能形成分子间氢键,所以吡咯的沸点比噻吩高。
(5)根据吸电子效应的强度可知, Cl> C≡CH> C6H5> H ,所以四种物质酸性由强到弱的顺序为B>C>D>A。
(6)第一电离能是气态基态电中性原子失去一个电子形成气态基态正离子时所需吸收的最低能量,根据图示可知,Li原子的第一电离能为1040kJ/mol÷2=520kJ/mol;键能是拆开1mol共价键需要吸收的能量,根据图示可知,O=O键键能为249kJ/mol×2=498kJ/mol。
18.(1) 第五周期第ⅣA族 防止SnCl2被氧化 Sn2++= SnO↓+CO2↑ 取最后一次洗涤液少许于试管中,滴入硝酸酸化的硝酸银溶液,若无明显现象,则证明沉淀已洗涤干净 蒸发浓缩,冷却结晶
(2) 非极性 蒸馏烧瓶 吸收多余的Cl2,防止环境污染;防止空气中的水蒸气进入到SnCl4收集装置中,使SnCl4水解
(3)93.2%
【详解】(1)Sn与C同主族,位于元素周期表第五周期ⅣA族,可采用0族定位法确定位置,原子序数50与Xe(54)接近,与Xe同周期往前进四,为ⅣA族;由题给信息可知SnCl2易氧化,加入锡粉可防止其氧化;由流程信息可知,SnCl2与碳酸钠反应,生成SnO与一种气体,可知气体为CO2,反应的离子方程式为Sn2++= SnO↓+CO2↑。沉淀洗涤主要洗去表面的NaCl,可通过检验洗涤液中是否含有Cl-来确定是否洗净,具体操作为取最后一次洗涤液少许于试管中,滴入硝酸酸化的硝酸银溶液,若无明显现象,则证明沉淀已洗涤干净;因为Sn2+易水解,为防止其水解,需在低温下结晶,因此结晶操作为:蒸发浓缩,冷却结晶。
(2)Sn位于ⅣA族,价电子数为4,SnCl4为sp3杂化,无孤电子对,空间构型为正四面体型,正负电中心重合,为非极性分子;装置Ⅲ中盛放Sn的仪器有支管,是蒸馏烧瓶;装置Ⅵ位于实验装置末尾,可以吸收未反应的氯气,防止环境污染,同时也可以防止空气中的水蒸气进入装置Ⅴ,引起SnCl4的水解。
(3)根据题给反应,结合化合价变化可知,滴定过程中消耗离子的比例为1:6Fe2+:3Sn2+,消耗重铬酸钾的物质的量为0.1mol/L×0.032L=0.0032mol,则Sn的物质的量为0.0096mol,质量为1.1424g,由此可知锡粉的质量分数为≈93.2%。
19.(1) 四面体形 磷酸晶体 磷酸分子与水分子能形成氢键
(2) 干燥甲苯 K1、K3
(3) 防止五氯化磷遇空气中的水蒸气而发生水解 甲苯 氯化钠
【分析】利用苯来干燥甲苯,通过回流得到的水与钠反应,二苯甲酮为指示剂,无水时体系呈蓝色,改变开关状态收集甲苯,将甲苯、五氯化磷、NaN3在Ar气氛围中充分混合后转入装置B中,在反应釜中于加热12小时使其充分反应。
【详解】(1)中心原子价层电子对数为4+0=4,其VSEPR模型是四面体形。磷酸易形成过饱和溶液,难以结晶,可以引入晶种来促进溶液中的磷酸结晶析出,可向其过饱和溶液中加入磷酸晶体促进其结晶,磷酸分子含有羟基,容易与水分子形成氢键,因此磷酸具有较强的吸水性,所制得的磷酸中仍含有少量的水极难除去;故答案为:四面体形;磷酸晶体;磷酸分子与水分子能形成氢键。
(2)①金属钠与水能发生反应,因此金属的作用是干燥甲苯;故答案为:干燥甲苯。
②回流过程中,水要回流到烧瓶中,因此除水时打开的活塞是K1、K3;体系变蓝后,改变开关状态收集甲苯;故答案为:K1、K3。
(3)①在氩气保护下,反应物在装置A中混匀后转入装置B,于加热12小时,反应物完全反应,五氯化磷和NaN3 反应生成红磷、氮气和氯化钠,其反应的化学方程式为;由于五氯化磷易水解,为防止五氯化磷遇见空气中的水蒸气发生水解,因此用氩气赶走空气;故答案为:;防止五氯化磷遇空气中的水蒸气而发生水解。
②根据反应可知,得到的产物上沾有甲苯和氯化钠,用乙醇洗去甲苯,用水洗去氯化钠;故答案为:甲苯、氯化钠。
20.(1) 70 35
(2)设C70分子中五边形数为x个,六边形数为y个。
依题意可得方程组:(键数,即棱边数); (欧拉定理);解得五边形数x=12,六边形数y=25。
【分析】C70分子中每个碳原子只跟相邻的3个碳原子形成化学键,则平均每个C原子可形成个共价键,则共价键总数为70×=105,设C70分子中五边形数为x个,六边形数为y个,结合循欧拉定理:顶点数+面数-棱边数=2计算。
【详解】(1)C70分子中每个碳原子只跟相邻的3个碳原子形成化学键,则平均每个C原子可形成
个共价键,则共价键总数为70×=105,每个碳原子只跟相邻的3个碳原子形成化学键,且核外最外层电子全部成键,则每个C原子形成2个单键、1个双键,即单键数=2倍的双键数,设单键数为m,双键数为n,则m+n=105,m=2n,解得m=70,n=35,故C70分子中所含的单键数为70,双键数为35。
(2)设C70分子中五边形数为x个,六边形数为y个。
依题意可得方程组:(键数,即棱边数); (欧拉定理);解得五边形数x=12,六边形数y=25。
21.(1) ② ① ③ ⑤⑥ ④
(2)3
(3) C3H8 4 BD
【详解】(1)①氧气和臭氧是氧元素形成的不同种单质,互为同素异形体;
②35Cl和37Cl的质子数相同、中子数不同,互为同位素;
③2—甲基丙烷和2—甲基丁烷的结构相似,相差1个CH2原子团,互为同系物;
④由结构式可知,两种结构都为二氯甲烷,是同种物质;
⑤丁烷和异丁烷的分子式相同,结构不同,互为同分异构体;
⑥乙醇和甲醚的分子式相同,结构不同,互为同分异构体;
则互为同位素的为②,互为同素异形体的为①,互为同系物的为③,互为同分异构体的为⑤⑥,属于同种物质的为④,故答案为:②;①;③;⑤⑥;④;
(2)由结构简式可知,立方烷的一氯代物有1种,二氯代物有3种,故答案为:3;
(3)由甲为只含C、H两种元素的饱和化合物可知,甲为烷烃,设甲的分子式为CnH2n+2,由分子中含有26个电子可得:6n+2n+2=26,解得n=3,则甲的分子式为C3H8;由化合物乙为只含C、H、F三种元素的饱和化合物可知,乙为氟代烃,设乙的分子式为CnH2n+2—xFx,由分子中含有26个电子可得:6n+(2n+2—x)+9x=26,由乙分子中C、H、F原子个数比为1∶2∶2可得n∶x=1∶2,解得n=1、x=2,则乙的分子式为CH2F2;
①由分析可知,甲的分子式为C3H8;丙烷的一氟代物有1—氟丙烷和2—氟丙烷,共2种,其中1—氟丙烷分子和2—氟丙烷分子中氢原子被氟原子取代所得结构有4种,分别为CH3CH2CHF2、CH3CF2CH3、CH2FCHFCH3、CH2FCH2CH2F,故答案为:C3H8;4;
②由分析可知,乙的分子式为CH2F2,名称为二氟甲烷;
A.二氟甲烷分子中碳氢键和碳氟键的键长不同,的空间构型为四面体形,不是正四面体形,故错误;
B.二氟甲烷分子中饱和碳原子的杂化方式为sp3杂化,故正确;
C.甲烷分子的空间构型为四面体形,二氟甲烷分子不存在同分异构体,故错误;
D.甲烷分子的空间构型为四面体形,二氟甲烷分子不存在同分异构体,故正确;
故选BD
一、单选题
1.下列化学用语和化学符号正确的是
A.次氯酸的结构式
B.的球棍模型
C.碳酸氢钠在水溶液中的电离方程式:
D.的电子式:
2.下列关于粒子结构的描述错误的是
A.CS2、C2H2、BeCl2都是直线形分子
B.CCl4和CH2Cl2均是四面体构型的非极性分子
C.H2S和NH3均是由极性键构成的极性分子
D.HCl和HS-均是含有一个极性键的18电子粒子
3.科学研究发现:红橙色更容易招蚊子,蚊子能闻到气味。下列有关的说法错误的是
A.是直线形分子 B.是由极性键形成的非极性分子
C.中键角为180° D.干冰气化时克服共价键
4.下列描述正确的是
①CS2为V形的极性分子
②ClO的空间构型为平面三角形
③SF6中有6对完全相同的成键电子对
④SiF4和SO的中心原子均为sp3杂化
⑤HCHO分子中既含σ键又含π键
A.①②③④ B.②③④ C.③④⑤ D.①④⑤
5.化合物M是一种用于有机合成的催化剂,其三维空间伸展的部分网状结构如图所示。其中X、Y、Z、W为原子序数依次增大的短周期主族元素。下列说法正确的是
A.W的最高价氧化物可以用于干燥氨气
B.Y的氟化物YF3中各原子均满足8电子稳定结构
C.简单氢化物的沸点:Z>W
D.元素非金属性:W>Z>X
6.下列叙述不正确的是( )
①和互为同位素
②金属性:
③四氯化碳的电子式为
④离子键就是阴、阳离子间的静电引力
⑤通常活泼金属与活泼非金属元素形成离子化合物
⑥在熔融状态下电离,破坏了离子键和共价键
⑦用电子式表示溴化氢的形成过程为
A.①④⑥ B.④⑤⑥ C.③④⑥⑦ D.全部都不正确
7.LiAlH4是重要的还原剂与储氢材料,在120℃下的干燥空气中相对稳定,其合成方法为:。下列说法正确的是( )
A.基态铝原子核外有7种不同空间运动状态的电子 B.该反应可以在水溶液中进行
C.AlH与AlCl3中Al原子杂化方式相同 D.AlH与互为等电子体,其空间构型均为正方形
8.下列分子的空间结构模型或键角正确的是
A. B.
C. D.
9.下列物质的性质与氢键无关的是
A.冰的密度比水的密度小
B.氨气极易溶于水
C.SbH3的沸点比PH3高
D.沸点:邻羟基苯甲醛<对羟基苯甲醛
10.德国科学家Benjamin List获得2021年诺贝尔化学奖,他发现了脯氨酸可以催化羟醛缩合反应,其反应历程简化如图所示。下列说法错误的是
A.有机物②中碳原子有2种杂化方式
B.有机物③是反应的中间产物
C.反应中涉及极性键和非极性键的断裂与生成
D.有机物⑥中含有3个手性碳原子
11.在二氧化碳合成甲醇的研究中,催化剂是研究的关键。目前国内外研究主要集中于铜基催化剂,有学者提出了如图的转化过程。下列说法正确的是
A.铜元素位于周期表中的d区
B.步骤④中仅有共价键的断裂
C.甲酸乙酯是该过程的中间产物
D.该反应过程中,催化剂不参与反应,只是降低了反应的活化能
12.下列说法中正确的是
A.沸点:PH3>NH3>H2O B.NH为正四面体结构,可推测出PH也为正四面体结构
C.CO2分子中的化学键为非极性键 D.NH3分子中N原子的杂化轨道类型是sp2
13.下列有关生产生活中常用漂白剂的说法不正确的是
A.含有极性键 B.既含有极性键又含有非极性键
C.是非极性分子 D.是离子化合物
14.下列现象与氢键无关的是
A.的熔、沸点比第VA族其他元素氢化物的高
B.小分子的醇可以和水以任意比互溶
C.冰的密度比液态水的密度小
D.水分子高温下很稳定
15.科学家合成出了一种用于分离镧系金属的化合物A(结构如图所示),短周期元素X、Y、Z原子序数依次增大,其中Z位于第三周期。Z与Y2可以形成分子ZY6,该分子常用作高压电气设备的绝缘介质。下列关于X、Y、Z的叙述正确的是
A.X、Y、Z的电负性:Y>X>Z
B.Y、Z对应离子的还原性:Y>Z
C.XY3的空间构型为三角锥形
D.X和Z最高价氧化物对应水化物的酸性:X<Z
二、填空题
16.结构化学家鲍林(Pauling)曾提出一条经验规则:设含氧酸的化学式为HnROm,其中(m-n)为非羟基氧的原子数。而含氧酸的强弱与非羟基氧原子数(m-n)有如下关系:
m-n 0 1 2 3
含氧酸强度 弱酸 中强 强 很强
实例 HClO H3PO4 HNO3 HClO4
请回答:
(1)按此规则判断:H3AsO4,H2SO4,HMnO4三处酸性由强到弱的顺序是_________。
(2)H3PO3和H3AsO3的分子组成相似,但酸性强弱相差很大,已知H3PO3为中强酸而H3AsO3为弱酸,试推断它们的结构式,H3PO3为__________,H3AsO3为_________。
17.回答下列问题:
(1)Cd与Zn同族且相邻,写出基态Cd原子的价层电子排布式:___________。
(2)原子中运动的电子有两种相反的自旋状态,一种自旋状态用表示,与之相反的用表示,称为电子的自旋磁量子数。对于基态Si原子,其价电子自旋磁量子数的代数和为___________。
(3)O和S处于同一主族,第一电离能较大的是___________。和分子中的键角较大的是___________,键长较短的是___________。单质硫与热的浓溶液反应的产物之一为,的空间构型为___________。
(4)已知多个相邻且平行的p轨道重叠则形成大键,分子中的大键可用符号表示,其中代表参与形成大键的原子数,代表参与形成大键的电子数(如苯分子的大键可表示为)。吡咯( )中所有原子共平面。则吡咯分子中的大键应表示为___________。吡咯分子中N原子的杂化类型为___________,1mol吡咯分子中含有___________键, 噻吩的沸点为84℃,吡咯( )的沸点在129-131℃之间,吡洛沸点较高,其原因是___________。
(5)键的极性对物质的化学性质有重要影响。已知一些常见电子基团的吸电子效应的强度:,则下列物质酸性由强到弱的顺序是___________(填序号)。
A. B.
C. D.
(6)是离子晶体,其形成过程中的能量变化如图(a)所示。
可知,Li原子的第一电离能为_______,键键能为_______。
三、实验题
18.某化学兴趣小组拟实验探究锡及其化合物的部分性质。经查阅资料知:Sn 的熔点为231 °C;SnCl2易被氧化,且易水解; Sn(OH)2常温下易分解; SnCl4常温下为无色液体,熔点为.-33°C,沸点为114°C,易水解。回答下列问题:
(1)该小组用以下流程制备SnSO4晶体:
①Sn为50号元素,请写出Sn在元素周期表的位置___________________;
②在上述流程中,加入锡粉的作用为________________;
③反应Ⅰ的离子方程式为_______________________;
④操作Ⅰ为沉淀的洗涤,请简述如何判断沉淀已洗涤干净 ________;操作Ⅱ中,实验操作包括_______、过滤、洗涤、干燥等一系列操作。
(2)用熔融的锡与干燥的氯气制备SnCl4,实验装置如下:
①SnCl4是______分子(填“极性”或“非极性”)。
②装置Ⅲ中盛装药品Sn的仪器名称是_______;装置Ⅵ中碱石灰的作用为______。
(3)该小组通过下列方法测定所用锡粉的纯度:取锡粉1.226g溶于稀硫酸中,加入过量的FeCl3溶液,再用0.1000mol·L-1的K2Cr2O7溶液滴定含有Fe2+的溶液,消耗K2Cr2O7溶液32.00mL。已知①Sn+H+→H2↑+Sn2+; ②Sn2++ Fe3+→Sn4+ + Fe2+;③+ Fe2+→Cr3++Fe3+ (方程式均未配平)。则锡粉的质量分数为(杂质不参与反应)______(结果保留三位有效数字)。
19.I.磷酸是一种重要的化工原料,是生产磷肥的原料,也是食品添加剂之一。
(1)工业上可以用磷单质与硝酸作用得到纯的磷酸(熔点)。的VSEPR模型是_______(填名称)。磷酸易形成过饱和溶液,难以结晶,可向其过饱和溶液中加入_______促进其结晶,但是所制得的磷酸中仍含有少量的水极难除去,其可能的原因是_______。
Ⅱ.研究小组以无水甲苯为溶剂,(易水解)和(叠氮化钠)为反应物制备纳米球状红磷。
(2)甲苯干燥和收集的回流装置如图1所示(夹持及加热装置略)。以二苯甲酮为指示剂,无水时体系呈蓝色。
①金属的作用是_______。
②回流过程中,除水时打开的活塞是_______;体系变蓝后,改变开关状态收集甲苯。
(3)纳米球状红磷的制备装置如图2所示(夹持、搅拌、加热装置已略)。
①在氩气保护下,反应物在装置A中混匀后转入装置B,于加热12小时,反应物完全反应,其化学方程式为_______;用氩气赶走空气的目的是_______。
②经冷却、离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是_______、_______。
四、计算题
20.C70分子是形如椭球状的多面体,该结构的建立基于以下考虑:
①C70分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②C70分子中只含有五边形和六边形;
③多面体的顶点数、面数和棱边数的关系遵循欧拉定理:顶点数+面数-棱边数=2。
根据以上所述确定:
(1)C70分子中所含的单键数为______,双键数_______;
(2)C70分子中的五边形和六边形各有多少__________?
21.填空
(1)下列物质中,互为同位素的有_______,互为同素异形体的有_______,互为同系物的有_______,互为同分异构体的有_______,属于同种物质有_______。
①O2和O3②35Cl和37Cl③和④+和⑤CH3(CH2)2CH3和(CH3)2CHCH3⑥乙醇和甲醚(CH3OCH3)
(2)立方烷结构为,它的结构高度对称,其二氯代物有_______种。
(3)化合物甲只含C、H两种元素,化合物乙只含C、H、F三种元素,甲、乙都是饱和化合物,且分子中都含有26个电子,据此推断:
①甲的分子式是_______;若甲分子中有两个H原子被F原子代替,所得产物可能有_______种结构。
②乙是性能优异的环保产品,可替代某些会破坏臭氧层的氟里昂产品,用作制冷剂。已知乙分子中C、H、F原子个数比为1∶2∶2,则下列对于乙的描述正确的是_______
A.其分子空间构型为正四面体 B.碳为sp3杂化
C.具有两种同分异构体 D.没有同分异构体
试卷第2页,共9页
参考答案:
1.B
【详解】A.次氯酸分子中各原子均为稳定结构,其结构式为:,A错误;
B.为三角锥形,其球棍模型为: ,B正确;
C.碳酸氢钠为强电解质,所以在水中能完全电离生成钠离子和碳酸氢根离子,其电离方程式为:,C错误;
D.的各原子均满足8电子稳定结构,其电子式为: ,D错误;
故选B。
2.B
【详解】A.CS2、C2H2、BeCl2的中心原子杂化轨道类型均为sp杂化,都是直线形分子,故A正确;
B.由于C—H键的键长小于C—Cl键的键长,故CH2Cl2的空间结构不是对称的正四面体构型,因而属于极性分子,故B错误;
C.H2S为V形构型,NH3为三角锥形构型,均是由极性键构成的极性分子,故C正确;
D.不同非金属原子间形成极性键,HCl中含有H-Cl极性键,HS-中含有H-S极性键,二者含有18电子,故D正确;
答案选B。
3.D
【详解】A.CO2结构式为O=C=O,属于直线形分子,故A正确;
B.CO2分子中含有C=O键,为极性共价键,其分子结构为直线型,正负电荷中心重合,为非极性分子,故B正确;
C.CO2结构式为O=C=O,属于直线形分子,其键角为180°,故C正确;
D.干冰是分子晶体,分子晶体是分子靠分子间作用力形成的晶体,气化时克服分子间作用力,不破坏共价键,故D错误;
答案选D。
4.C
【详解】①CS2与CO2分子构型相同,二氧化碳的分子结构为O=C=O,则CS2的结构为S=C=S,属于直线形分子,是非极性分子,故①错误;
②ClO3-中Cl的价层电子对数=3+(7+1-2×3)=4,含有一个孤电子对,则离子的空间构型为三角锥形,故②错误;
③SF6中S-F含有一个成键电子对,所以SF6中含有6个S-F键,则分子中有6对完全相同的成键电子对,故③正确;
④SiF4中Si的价层电子对数=4+(4-1×4)=4,SO32-中S的价层电子对数=3+(6+2-2×3)=4,所以中心原子均为sp3杂化,故④正确;
⑤所有的共价双键中有一个是σ键一个是π键,HCHO分子中有碳氧双键,故HCHO分子中既含σ键又含π键。故⑤正确;
③、④和⑤正确,故答案为C。
5.C
【分析】
【详解】A.W的最高价氧化物为,为酸性干燥剂,不可以用于干燥碱性气体,A错误;
B.中硼原子最外层是6个电子,不满足8电子稳定结构,B错误;
C.分子中存在分子间氢键,其沸点高于,C正确;
D.X、Z、W分别为H、O、P元素,元素非金属性:,D错误;
故选C。
6.C
【详解】①具有相同质子数、不同中子数的核素互称为同位素,和互为同位素,①正确;
②同一周期主族元素,元素金属性随着原子序数的增大逐渐减弱,同一主族元素,元素金属性随着原子序数的增大逐渐增强,所以金属性:,②正确;
③四氯化碳的电子式为,③错误;
④离子键为阴、阳离子之间的相互作用力,包括静电引力、静电斥力,④错误;
⑤通常活泼金属与活泼非金属元素形成离子化合物,⑤正确;
⑥在熔融状态下电离,只破坏离子键,电离方程式为,⑥错误;
⑦为共价化合物,用电子式表示溴化氢的形成过程为,⑦错误;
综上所述,叙述不正确的是③④⑥⑦,故答案为C。
7.A
【详解】A.基态铝原子核外电子排布式为1s22s22p63s23p1,共占据7个轨道,所以有7种不同空间运动状态的电子,A正确;
B.LiAlH4会和水反应,该反应不能在水溶液中进行,B错误;
C.AlH中Al原子价层电子对数为=4,为sp3杂化,AlCl3中Al原子价层电子对数为3,为sp2杂化,C错误;
D.AlH和PH中心原子的价层电子对数为4,不含孤电子对,为正四面体构型,D错误;
综上所述答案为A。
8.A
【详解】A.甲烷是正四面体结构,碳原子在正四面体中心,键角为109°28',故A正确;
B.H2S的中心原子S的价层电子对数=2+(6-2×1)=2+2=4,所以H2S是V形结构,不是直线形结构,故B错误;
C.NH3的中心原子N的价层电子对数=3+(5-3×1)=3+1=4,所以NH3是三角锥形结构,键角小于109°28',大约为107°,故C错误;
D.CO2的中心原子C的价层电子对数=2+(4-2×2)=2,所以CO2是直线形结构,故D错误;
故选A。
9.C
【详解】A.冰中的氢键比液态水中的强,使得水分子排列得很规则,造成体积膨胀,密度变小,故A不选;
B.氨气分子之间存在氢键,沸点相对较高,故氨气容易液化,故B不选;
C.SbH3的相对分子质量比PH3的大,且两者都为分子晶体,故SbH3沸点比PH3的沸点高,与氢键无关,故C选;
D.与水能形成分子间氢键的物质,在水中的溶解度较大,邻羟基苯甲醛容易形成分子内氢键,对羟基苯甲醛与水分子间易形成氢键,所以溶解度:邻羟基苯甲醛<对羟基苯甲醛,故D不选;
故选:C。
10.D
【详解】A.有机物②中甲基碳原子采取sp3杂化,羰基碳原子采取sp2杂化,所以含有、种杂化方式,A项正确;
B.中间产物是在反应过程中产生,又参与下一步反应被消耗的物质,有机物①③④⑥都是反应的中间产物,B项正确;
C.反应中有碳氧、碳氮、碳氢、碳碳等极性键和非极性键的断裂与生成,C项正确;
D.手性碳原子是连有4个不同原子或原子团的碳原子,有机物⑥中含有2个手性碳原子,D项错误;
故选D。
11.C
【详解】A.铜是29号元素,为ⅠB族元素,位于周期表中的ds区,故A错误;
B.步骤④中有O-H、C-O键的断裂,有C=O键的生成,故B错误;
C.甲酸乙酯是反应④的生成物,是反应⑤的反应物,所以甲酸乙酯是该过程的中间产物,故C正确;
D.催化剂通过参与化学反应降低反应的活化能,故D错误;
选C。
12.B
【详解】A.含有氢键的氢化物的沸点较高,分子间形成氢键数目越多,沸点越高,所以沸点:PH3<NH3<H2O,故A错误;
B.NH和PH中,中心原子都形成4个键,没有孤电子对,为正四面体结构,故B正确;
C.二氧化碳结构为O=C=O,CO2分子中的化学键为极性键,故C错误;
D.NH3中价层电子对个数=σ键个数+孤电子对个数=3+×(5-3×1)=4,中心原子是以sp3杂化,故D错误;
故选B。
13.C
【详解】A.不同非金属元素形成的共用电子对发生偏移,形成极性键,分子内硫与氧原子之间为极性键,A项正确;
B.分子中O—H键为极性键、O—O键为非极性键,B项正确;
C.与是等电子体,是具有微弱极性的极性分子,C项错误;
D.由钠离子和次氯酸根构成、是离子化合物,D项正确。
答案选C。
14.D
【详解】A.氮元素的电负性大,能与氢元素形成氢键,因此NH3的熔、沸点比第ⅤA族其他元素氢化物的熔、沸点高,与氢键有关系,A项不符合题意;
B.由于醇和羧酸结构中含有羟基,且小分子的醇、羧酸的烃基对形成分子间氢键影响比较小,故小分子的醇、羧酸可以和水以任意比互溶,B项不符合题意;
C.水为冰时,分子间距离变小,形成的氢键数目比液态水多,导致同质量时,冰比液态水体积大,所以冰的密度比液态水的密度小,C项不符合题意;
D.水分子高温下很稳定,是由于水中共价键键能大,与氢键没有关系,D项符合题意;
答案选D。
15.D
【分析】短周期元素X、Y、Z原子序数依次增大,其中Z位于第三周期,根据结构式可知,Z可形成3个共价键,带一个单位正电荷,所以Z的最外层电子数应为6,推知Z为S元素,Z与Y2可以形成分子ZY6,该分子常用作高压电气设备的绝缘介质,说明该分子为SF6,即Y为F元素,X形成4个共价键,带一个单位负电荷,则X最外层电子数为3,所以推知X为B,根据以上分析可知,X、Y、Z分别为B、F、S。
【详解】A.元素非金属性越强,其电负性越大,非金属性:F>S>B,则X、Y、Z的电负性:Y>Z>X,A错误;
B.元素非金属性越强,其氧化性越强,对应离子的还原性越弱,F元素非金属性强于S元素,则Y、Z对应离子的还原性:Y
D.元素非金属性越强,其对应最高价氧化物对应水化物的酸性越强,非金属性:B
16. HMnO4>H2SO4>H3AsO3
【分析】(1)根据题中非羟基氧原子数与酸性强弱的关系分析;
(2)H3PO3和H3AsO3的酸性不同,说明二者分子中非羟基氧原子数不同,据此分析。
【详解】(1)根据题中表格数据可知,非羟基氧原子数越多,酸性越强,H3AsO4非羟基氧原子数为1,H2CrO4非羟基氧原子数为2,HMnO4非羟基氧原子数为3,则酸性:H3AsO4<H2CrO4<HMnO4;
(2)因为酸性H3PO3>H3AsO3,则H3PO3中非羟基氧的数目应大于H3AsO3,且H3AsO3为弱酸,所以可以推知H3AsO3没有非羟基氧,其分子结构分别为:、。
17.(1)4d105s2
(2)+1或-1
(3) O H2O H2O V形
(4) sp2 10 吡咯分子间有氢键
(5)BCDA
(6) 520 498
【详解】(1)Cd与Zn同族且相邻,Zn的价电子排布式为3d104s2,则基态Cd原子的价层电子排布式为4d105s2。
(2)Si的价电子排布式为3s23p2,3s2上的两个电子自旋方向相反,自旋磁量子数的代数和为0,3p上的两个电子自旋方向相同,则自旋磁量子数的代数和为+1或-1。
(3)同主族元素从上到下,电子层数逐渐增多,对核外电子的引力逐渐减弱,所以第一电离能逐渐减小,所以O和S第一电离能较大的是O;H2O 和H2S分子的中心原子均为sp3杂化,都有两个孤电子对,由于O的电负性比S大,所以O原子周围的电子较多,排斥力较大,键角较大,所以键角较大的是H2O;O原子的半径比S小,所以H2O中的键长比H2S中的键长短;中心原子的价电子对数=2+(6+2-2×2)=2+2=4,其VSEPR模型为四面体形,去掉两个孤电子对,其空间结构为V形。
(4)吡咯是平面结构,C原子和N原子均采取sp2杂化,C原子杂化后还剩一个未参加杂化的p轨道上的电子,N原子杂化后还剩余一对电子,所以吡咯分子中的大π键是5个原子共用6个电子形成的,表示为;吡咯分子中有C-Cσ键、C-Nσ键、C-Hσ键和N-Hσ键,1mol吡咯分子中有10molσ键;吡咯分子中有N原子,N原子上连着H原子,可以形成分子间氢键,而噻吩不能形成分子间氢键,所以吡咯的沸点比噻吩高。
(5)根据吸电子效应的强度可知, Cl> C≡CH> C6H5> H ,所以四种物质酸性由强到弱的顺序为B>C>D>A。
(6)第一电离能是气态基态电中性原子失去一个电子形成气态基态正离子时所需吸收的最低能量,根据图示可知,Li原子的第一电离能为1040kJ/mol÷2=520kJ/mol;键能是拆开1mol共价键需要吸收的能量,根据图示可知,O=O键键能为249kJ/mol×2=498kJ/mol。
18.(1) 第五周期第ⅣA族 防止SnCl2被氧化 Sn2++= SnO↓+CO2↑ 取最后一次洗涤液少许于试管中,滴入硝酸酸化的硝酸银溶液,若无明显现象,则证明沉淀已洗涤干净 蒸发浓缩,冷却结晶
(2) 非极性 蒸馏烧瓶 吸收多余的Cl2,防止环境污染;防止空气中的水蒸气进入到SnCl4收集装置中,使SnCl4水解
(3)93.2%
【详解】(1)Sn与C同主族,位于元素周期表第五周期ⅣA族,可采用0族定位法确定位置,原子序数50与Xe(54)接近,与Xe同周期往前进四,为ⅣA族;由题给信息可知SnCl2易氧化,加入锡粉可防止其氧化;由流程信息可知,SnCl2与碳酸钠反应,生成SnO与一种气体,可知气体为CO2,反应的离子方程式为Sn2++= SnO↓+CO2↑。沉淀洗涤主要洗去表面的NaCl,可通过检验洗涤液中是否含有Cl-来确定是否洗净,具体操作为取最后一次洗涤液少许于试管中,滴入硝酸酸化的硝酸银溶液,若无明显现象,则证明沉淀已洗涤干净;因为Sn2+易水解,为防止其水解,需在低温下结晶,因此结晶操作为:蒸发浓缩,冷却结晶。
(2)Sn位于ⅣA族,价电子数为4,SnCl4为sp3杂化,无孤电子对,空间构型为正四面体型,正负电中心重合,为非极性分子;装置Ⅲ中盛放Sn的仪器有支管,是蒸馏烧瓶;装置Ⅵ位于实验装置末尾,可以吸收未反应的氯气,防止环境污染,同时也可以防止空气中的水蒸气进入装置Ⅴ,引起SnCl4的水解。
(3)根据题给反应,结合化合价变化可知,滴定过程中消耗离子的比例为1:6Fe2+:3Sn2+,消耗重铬酸钾的物质的量为0.1mol/L×0.032L=0.0032mol,则Sn的物质的量为0.0096mol,质量为1.1424g,由此可知锡粉的质量分数为≈93.2%。
19.(1) 四面体形 磷酸晶体 磷酸分子与水分子能形成氢键
(2) 干燥甲苯 K1、K3
(3) 防止五氯化磷遇空气中的水蒸气而发生水解 甲苯 氯化钠
【分析】利用苯来干燥甲苯,通过回流得到的水与钠反应,二苯甲酮为指示剂,无水时体系呈蓝色,改变开关状态收集甲苯,将甲苯、五氯化磷、NaN3在Ar气氛围中充分混合后转入装置B中,在反应釜中于加热12小时使其充分反应。
【详解】(1)中心原子价层电子对数为4+0=4,其VSEPR模型是四面体形。磷酸易形成过饱和溶液,难以结晶,可以引入晶种来促进溶液中的磷酸结晶析出,可向其过饱和溶液中加入磷酸晶体促进其结晶,磷酸分子含有羟基,容易与水分子形成氢键,因此磷酸具有较强的吸水性,所制得的磷酸中仍含有少量的水极难除去;故答案为:四面体形;磷酸晶体;磷酸分子与水分子能形成氢键。
(2)①金属钠与水能发生反应,因此金属的作用是干燥甲苯;故答案为:干燥甲苯。
②回流过程中,水要回流到烧瓶中,因此除水时打开的活塞是K1、K3;体系变蓝后,改变开关状态收集甲苯;故答案为:K1、K3。
(3)①在氩气保护下,反应物在装置A中混匀后转入装置B,于加热12小时,反应物完全反应,五氯化磷和NaN3 反应生成红磷、氮气和氯化钠,其反应的化学方程式为;由于五氯化磷易水解,为防止五氯化磷遇见空气中的水蒸气发生水解,因此用氩气赶走空气;故答案为:;防止五氯化磷遇空气中的水蒸气而发生水解。
②根据反应可知,得到的产物上沾有甲苯和氯化钠,用乙醇洗去甲苯,用水洗去氯化钠;故答案为:甲苯、氯化钠。
20.(1) 70 35
(2)设C70分子中五边形数为x个,六边形数为y个。
依题意可得方程组:(键数,即棱边数); (欧拉定理);解得五边形数x=12,六边形数y=25。
【分析】C70分子中每个碳原子只跟相邻的3个碳原子形成化学键,则平均每个C原子可形成个共价键,则共价键总数为70×=105,设C70分子中五边形数为x个,六边形数为y个,结合循欧拉定理:顶点数+面数-棱边数=2计算。
【详解】(1)C70分子中每个碳原子只跟相邻的3个碳原子形成化学键,则平均每个C原子可形成
个共价键,则共价键总数为70×=105,每个碳原子只跟相邻的3个碳原子形成化学键,且核外最外层电子全部成键,则每个C原子形成2个单键、1个双键,即单键数=2倍的双键数,设单键数为m,双键数为n,则m+n=105,m=2n,解得m=70,n=35,故C70分子中所含的单键数为70,双键数为35。
(2)设C70分子中五边形数为x个,六边形数为y个。
依题意可得方程组:(键数,即棱边数); (欧拉定理);解得五边形数x=12,六边形数y=25。
21.(1) ② ① ③ ⑤⑥ ④
(2)3
(3) C3H8 4 BD
【详解】(1)①氧气和臭氧是氧元素形成的不同种单质,互为同素异形体;
②35Cl和37Cl的质子数相同、中子数不同,互为同位素;
③2—甲基丙烷和2—甲基丁烷的结构相似,相差1个CH2原子团,互为同系物;
④由结构式可知,两种结构都为二氯甲烷,是同种物质;
⑤丁烷和异丁烷的分子式相同,结构不同,互为同分异构体;
⑥乙醇和甲醚的分子式相同,结构不同,互为同分异构体;
则互为同位素的为②,互为同素异形体的为①,互为同系物的为③,互为同分异构体的为⑤⑥,属于同种物质的为④,故答案为:②;①;③;⑤⑥;④;
(2)由结构简式可知,立方烷的一氯代物有1种,二氯代物有3种,故答案为:3;
(3)由甲为只含C、H两种元素的饱和化合物可知,甲为烷烃,设甲的分子式为CnH2n+2,由分子中含有26个电子可得:6n+2n+2=26,解得n=3,则甲的分子式为C3H8;由化合物乙为只含C、H、F三种元素的饱和化合物可知,乙为氟代烃,设乙的分子式为CnH2n+2—xFx,由分子中含有26个电子可得:6n+(2n+2—x)+9x=26,由乙分子中C、H、F原子个数比为1∶2∶2可得n∶x=1∶2,解得n=1、x=2,则乙的分子式为CH2F2;
①由分析可知,甲的分子式为C3H8;丙烷的一氟代物有1—氟丙烷和2—氟丙烷,共2种,其中1—氟丙烷分子和2—氟丙烷分子中氢原子被氟原子取代所得结构有4种,分别为CH3CH2CHF2、CH3CF2CH3、CH2FCHFCH3、CH2FCH2CH2F,故答案为:C3H8;4;
②由分析可知,乙的分子式为CH2F2,名称为二氟甲烷;
A.二氟甲烷分子中碳氢键和碳氟键的键长不同,的空间构型为四面体形,不是正四面体形,故错误;
B.二氟甲烷分子中饱和碳原子的杂化方式为sp3杂化,故正确;
C.甲烷分子的空间构型为四面体形,二氟甲烷分子不存在同分异构体,故错误;
D.甲烷分子的空间构型为四面体形,二氟甲烷分子不存在同分异构体,故正确;
故选BD
