高中化学人教版必修一 2.1.1活泼的金属单质——钠 氧化钠和过氧化钠 试题(含解析)
文档属性
| 名称 | 高中化学人教版必修一 2.1.1活泼的金属单质——钠 氧化钠和过氧化钠 试题(含解析) |
|
|
| 格式 | doc | ||
| 文件大小 | 695.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-30 07:52:20 | ||
图片预览


文档简介
第二章分层作业7 活泼的金属单质——钠氧化钠和过氧化钠
A级 必备知识基础练
1.[2023广东阳江四校高一联考]将一块金属钠投入滴有紫色石蕊溶液的盛冷水的烧杯中,甲同学认为可观察到下列现象,其中正确的有( )
①钠投入水中,先沉入水底,后浮出水面 ②钠立即与水反应,并有气体产生 ③反应后溶液变红 ④钠熔成闪亮的小球 ⑤小球在水面上四处游动 ⑥有“嘶嘶”的响声发出
A.①②③④ B.②③④⑤
C.②④⑤⑥ D.③④⑥
2.[2023山东济南章丘高一期中]下列关于钠及其化合物的说法正确的是( )
A.Na2O、Na2O2均为碱性氧化物
B.将Na、Na2O2投入水中,会生成同种气体
C.Na、Na2O、Na2O2久置在空气中均会因发生氧化还原反应而变质
D.将Na、Na2O固体分别投入滴加了紫色石蕊溶液的水中,均可以得到蓝色溶液
3.[2023广东惠州高一期中]将一定量的金属钠投入下列稀溶液中,充分反应后,最终不会产生沉淀的是( )
A.硫酸铜溶液 B.氯化钠溶液
C.氯化铁溶液 D.氯化镁溶液
4.对于反应2Na2O2+2H2O4NaOH+O2↑,下列说法正确的是( )
A.Na2O2既是氧化剂又是还原剂
B.该反应的氧化剂是H2O
C.该反应的氧化产物是NaOH
D.向反应后的溶液中滴加石蕊溶液,溶液变红色
5.下列各组物质,因反应条件(温度或者反应物用量)改变,不会引起生成物改变的是( )
A.Na和O2 B.NaOH和CO2
C.Na2O2和CO2 D.C和O2
6.[2023河北保定高一期中]过氧化钠与水反应后滴加酚酞,酚酞先变红后褪色。某小组欲探究其原因,进行以下实验:①取反应后溶液,加入二氧化锰后迅速产生大量气体;实验②③中红色均不褪去。下列分析错误的是 ( )
A.过氧化钠与水反应产生的气体为O2
B.过氧化钠与水反应需要MnO2作催化剂
C.实验②③证明使酚酞褪色的不是氢氧化钠和氧气
D.过氧化钠与水反应可能生成了具有漂白性的H2O2
7.[2023山西吕梁高一期中]某实验小组通过如图所示实验,探究Na2O2与水的反应。下列说法错误的是( )
A.关闭K1打开K2,分液漏斗中的水滴入B后,产生大量气泡,带火星的木条复燃
B.关闭K2打开K1,B中液体进入A,溶液变红,说明Na2O2与水反应的生成物显碱性
C.振荡烧杯红色褪去,加入氢氧化钠溶液又恢复红色
D.充分反应后取B中溶液加入MnO2又有气泡出现,MnO2起催化作用
8.为研究Na的性质,进行如下实验:
装置 实验
液体a 现象
蒸馏水 Ⅰ.Na浮在液面上,剧烈反应,产生少量白雾
稀盐酸 Ⅱ.Na浮在液面上,反应比Ⅰ中剧烈,产生白雾
浓盐酸 Ⅲ.Na浮在液面上,反应比Ⅰ中缓慢,产生大量白雾,烧杯底部有白色固体
下列说法不正确的是( )
A.Ⅰ中现象说明Na与水反应放热
B.Ⅰ中反应的离子方程式为2Na+2H2O2Na++2OH-+H2↑
C.Ⅲ中白雾比Ⅱ中多,说明Ⅲ中反应放热比Ⅱ中更多
D.推测Ⅲ中反应缓慢可能与Cl-的浓度以及生成的白色固体有关
B级 关键能力提升练
9.[2023河北邢台高一阶段考]如图所示,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4粉末与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成。据此判断下列说法中正确的是( )
A.上述反应是复分解反应
B.加热且有水条件下,Na可以与CuSO4反应并生成Cu
C.上述反应放出大量的热
D.上述反应的离子方程式为2Na+Cu2+2Na++Cu
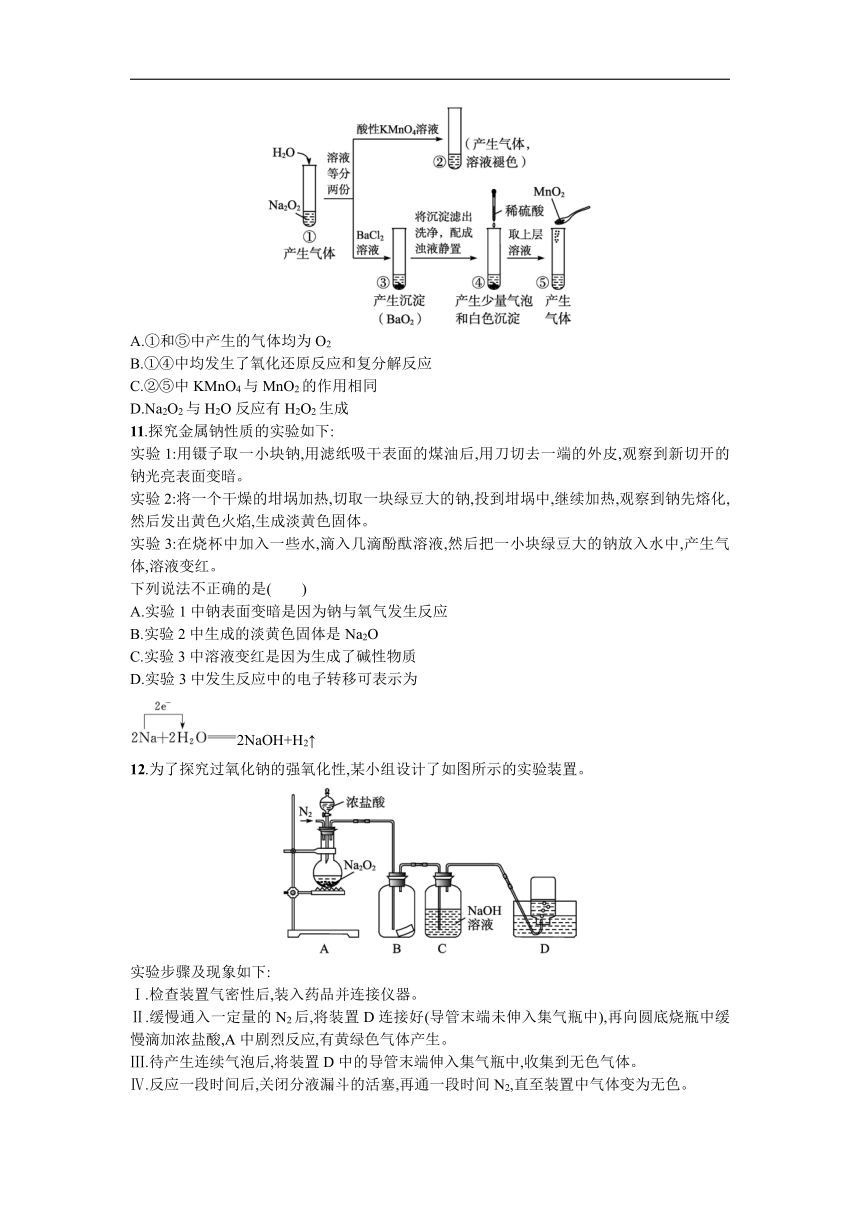
10.某实验小组通过下图所示实验,探究Na2O2与水的反应。下列分析不正确的是( )
A.①和⑤中产生的气体均为O2
B.①④中均发生了氧化还原反应和复分解反应
C.②⑤中KMnO4与MnO2的作用相同
D.Na2O2与H2O反应有H2O2生成
11.探究金属钠性质的实验如下:
实验1:用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察到新切开的钠光亮表面变暗。
实验2:将一个干燥的坩埚加热,切取一块绿豆大的钠,投到坩埚中,继续加热,观察到钠先熔化,然后发出黄色火焰,生成淡黄色固体。
实验3:在烧杯中加入一些水,滴入几滴酚酞溶液,然后把一小块绿豆大的钠放入水中,产生气体,溶液变红。
下列说法不正确的是( )
A.实验1中钠表面变暗是因为钠与氧气发生反应
B.实验2中生成的淡黄色固体是Na2O
C.实验3中溶液变红是因为生成了碱性物质
D.实验3中发生反应中的电子转移可表示为
2NaOH+H2↑
12.为了探究过氧化钠的强氧化性,某小组设计了如图所示的实验装置。
实验步骤及现象如下:
Ⅰ.检查装置气密性后,装入药品并连接仪器。
Ⅱ.缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,A中剧烈反应,有黄绿色气体产生。
Ⅲ.待产生连续气泡后,将装置D中的导管末端伸入集气瓶中,收集到无色气体。
Ⅳ.反应一段时间后,关闭分液漏斗的活塞,再通一段时间N2,直至装置中气体变为无色。
回答下列问题:
(1)装置D中收集的无色气体能使带火星的木条复燃,据此推断该气体是 ,解释产生该气体的原因是 (用离子方程式表示)。
(2)装置B中湿润的淀粉碘化钾试纸变蓝(生成I2)。甲同学认为是生成的氯气氧化了碘化钾;乙同学认为试纸变蓝的原因可能是 。
(3)资料显示,Na2O2与干燥的HCl能发生化学反应生成Cl2,该反应的化学方程式为 。
参考答案
分层作业7 活泼的金属单质——钠
氧化钠和过氧化钠
1.C 解析 钠投入水中,钠的密度小于水,钠不会沉入水底,①错误;钠是活泼的金属,钠立即与水反应2Na+2H2O2NaOH+H2↑,并有气体产生,②正确;生成氢氧化钠,溶液显碱性,使石蕊变蓝,即反应后溶液变蓝,③错误;钠熔点低,反应放热,钠熔成闪亮的小球,④正确;在氢气的推动下,小球在水面上四处游动,⑤正确;氢气在钠块与水之间的缝隙中逸出,有“嘶嘶”的响声发出,⑥正确。
2.D 解析 Na2O为碱性氧化物,Na2O2与水反应还有氧气生成,不是碱性氧化物,A错误;将Na、Na2O2投入水中,分别生成氢气和氧气,B错误;Na、Na2O2久置在空气中均会因发生氧化还原反应而变质,Na2O吸收水和二氧化碳最终变为碳酸钠,不是氧化还原反应,C错误;将Na、Na2O固体分别投入滴加了紫色石蕊溶液的水中,由于均得到氢氧化钠溶液,均可以得到蓝色溶液,D正确。
3.B 解析 钠和水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成Cu(OH)2沉淀,和氯化铁反应生成Fe(OH)3沉淀,和氯化镁反应生成Mg(OH)2沉淀。NaOH和氯化钠溶液不反应,不会产生沉淀。
4.A 解析 该反应中Na2O2中的-1价O元素发生“歧化反应”变成0价和-2价,则Na2O2既是氧化剂又是还原剂,H2O既不是氧化剂也不是还原剂,A正确,B错误;O2是氧化产物,C错误;由于Na2O2具有强氧化性,向反应后的溶液中滴加石蕊溶液,溶液先变蓝色后褪色,D错误。
5.C 解析 Na与O2反应的产物受温度影响,常温下生成Na2O,点燃或加热时生成Na2O2,A不符合题意;NaOH和CO2反应的产物受反应物用量影响,CO2少量时生成Na2CO3,CO2足量时生成NaHCO3,B不符合题意;Na2O2和CO2反应只生成Na2CO3和O2,与温度、反应物用量无关,C符合题意;C与足量O2反应生成CO2,与少量O2反应生成CO,生成物与反应物用量有关,D不符合题意。
6.B 解析 过氧化钠与水反应产生的气体为O2,A正确;过氧化钠与水反应不需要催化剂,MnO2作催化剂加速过氧化氢分解,B错误;实验②③作为对照实验,能证明使酚酞褪色的不是氢氧化钠和氧气,C正确;根据向反应后溶液中加入二氧化锰后迅速产生大量气体可判断过氧化钠与水反应可能生成了具有漂白性的H2O2,D正确。
7.C 解析 关闭K1打开K2,分液漏斗中的水滴入B后,产生大量气泡,带火星的木条复燃,证明产生的气体为氧气,A正确;关闭K2打开K1,B中液体被压入A,溶液变红,说明Na2O2与水反应的生成物显碱性,有氢氧化钠生成,B正确;振荡烧杯红色褪去,说明在溶液中有过氧化氢生成,把酚酞氧化漂白,再加入氢氧化钠溶液不会恢复红色,C错误;充分反应后取B中溶液加入MnO2又有气泡出现,MnO2加快了溶液中的过氧化氢的分解,则MnO2起催化作用,D正确。
8.C 解析 Ⅰ中钠与水剧烈反应:2Na+2H2O2Na++2OH-+H2↑,产生少量白雾,说明钠与水反应放热,使部分水变成水蒸气,A、B均正确;浓盐酸的挥发性比稀盐酸的挥发性强,Ⅲ中挥发出的HCl更多,故产生大量白雾,并非反应放出热量更多,C错误;Ⅲ与Ⅱ相比,Ⅲ中Cl-的浓度更大,可能影响Na与H+的反应,烧杯底部白色固体可能是生成的NaCl,D正确。
9.C 解析 熔化的钠与无水CuSO4粉末发生置换反应生成硫酸钠和铜,钠作还原剂,硫酸铜作氧化剂,该反应为置换反应,A错误;加热且无水条件下,Na可以与CuSO4发生置换反应生成Cu,B错误;Na与CuSO4发生置换反应时瞬间会产生耀眼的火花,说明该反应为放热反应,反应时放出热量,C正确;该反应不在溶液中进行,不能写离子方程式,D错误。
10.C 解析 试管①中Na2O2与水反应最终生成氢氧化钠与氧气,试管⑤中H2O2在二氧化锰催化剂作用下分解生成水和氧气,①⑤产生的气体都为O2,A正确;①中的反应机理可以认为Na2O2与水反应生成H2O2与氢氧化钠,过氧化氢分解生成水和氧气,④中过氧化钡再与稀硫酸反应生成过氧化氢与硫酸钡沉淀,过氧化氢分解产生了氧气,因此两个试管中均发生了氧化还原反应和复分解反应,B正确;②中KMnO4体现氧化性,而⑤中MnO2则起催化作用,两者作用不同,C错误;Na2O2与H2O反应有H2O2生成,D正确。
11.B 解析 实验1中钠表面变暗,其原因是Na与空气中O2反应生成Na2O,A正确;实验2中淡黄色固体是Na2O2,B错误;实验3中钠与水反应生成NaOH和H2,溶液呈碱性,使酚酞显红色,C正确;Na与水反应时,Na是还原剂,H2O是氧化剂,Na失去电子转移给H2O,D正确。
12.答案 (1)O2 2Na2O2+4H+4Na++2H2O+O2↑
(2)O2具有氧化性,也可能将I-氧化为I2
(3)Na2O2+4HClCl2↑+2NaCl+2H2O
A级 必备知识基础练
1.[2023广东阳江四校高一联考]将一块金属钠投入滴有紫色石蕊溶液的盛冷水的烧杯中,甲同学认为可观察到下列现象,其中正确的有( )
①钠投入水中,先沉入水底,后浮出水面 ②钠立即与水反应,并有气体产生 ③反应后溶液变红 ④钠熔成闪亮的小球 ⑤小球在水面上四处游动 ⑥有“嘶嘶”的响声发出
A.①②③④ B.②③④⑤
C.②④⑤⑥ D.③④⑥
2.[2023山东济南章丘高一期中]下列关于钠及其化合物的说法正确的是( )
A.Na2O、Na2O2均为碱性氧化物
B.将Na、Na2O2投入水中,会生成同种气体
C.Na、Na2O、Na2O2久置在空气中均会因发生氧化还原反应而变质
D.将Na、Na2O固体分别投入滴加了紫色石蕊溶液的水中,均可以得到蓝色溶液
3.[2023广东惠州高一期中]将一定量的金属钠投入下列稀溶液中,充分反应后,最终不会产生沉淀的是( )
A.硫酸铜溶液 B.氯化钠溶液
C.氯化铁溶液 D.氯化镁溶液
4.对于反应2Na2O2+2H2O4NaOH+O2↑,下列说法正确的是( )
A.Na2O2既是氧化剂又是还原剂
B.该反应的氧化剂是H2O
C.该反应的氧化产物是NaOH
D.向反应后的溶液中滴加石蕊溶液,溶液变红色
5.下列各组物质,因反应条件(温度或者反应物用量)改变,不会引起生成物改变的是( )
A.Na和O2 B.NaOH和CO2
C.Na2O2和CO2 D.C和O2
6.[2023河北保定高一期中]过氧化钠与水反应后滴加酚酞,酚酞先变红后褪色。某小组欲探究其原因,进行以下实验:①取反应后溶液,加入二氧化锰后迅速产生大量气体;实验②③中红色均不褪去。下列分析错误的是 ( )
A.过氧化钠与水反应产生的气体为O2
B.过氧化钠与水反应需要MnO2作催化剂
C.实验②③证明使酚酞褪色的不是氢氧化钠和氧气
D.过氧化钠与水反应可能生成了具有漂白性的H2O2
7.[2023山西吕梁高一期中]某实验小组通过如图所示实验,探究Na2O2与水的反应。下列说法错误的是( )
A.关闭K1打开K2,分液漏斗中的水滴入B后,产生大量气泡,带火星的木条复燃
B.关闭K2打开K1,B中液体进入A,溶液变红,说明Na2O2与水反应的生成物显碱性
C.振荡烧杯红色褪去,加入氢氧化钠溶液又恢复红色
D.充分反应后取B中溶液加入MnO2又有气泡出现,MnO2起催化作用
8.为研究Na的性质,进行如下实验:
装置 实验
液体a 现象
蒸馏水 Ⅰ.Na浮在液面上,剧烈反应,产生少量白雾
稀盐酸 Ⅱ.Na浮在液面上,反应比Ⅰ中剧烈,产生白雾
浓盐酸 Ⅲ.Na浮在液面上,反应比Ⅰ中缓慢,产生大量白雾,烧杯底部有白色固体
下列说法不正确的是( )
A.Ⅰ中现象说明Na与水反应放热
B.Ⅰ中反应的离子方程式为2Na+2H2O2Na++2OH-+H2↑
C.Ⅲ中白雾比Ⅱ中多,说明Ⅲ中反应放热比Ⅱ中更多
D.推测Ⅲ中反应缓慢可能与Cl-的浓度以及生成的白色固体有关
B级 关键能力提升练
9.[2023河北邢台高一阶段考]如图所示,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4粉末与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成。据此判断下列说法中正确的是( )
A.上述反应是复分解反应
B.加热且有水条件下,Na可以与CuSO4反应并生成Cu
C.上述反应放出大量的热
D.上述反应的离子方程式为2Na+Cu2+2Na++Cu
10.某实验小组通过下图所示实验,探究Na2O2与水的反应。下列分析不正确的是( )
A.①和⑤中产生的气体均为O2
B.①④中均发生了氧化还原反应和复分解反应
C.②⑤中KMnO4与MnO2的作用相同
D.Na2O2与H2O反应有H2O2生成
11.探究金属钠性质的实验如下:
实验1:用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察到新切开的钠光亮表面变暗。
实验2:将一个干燥的坩埚加热,切取一块绿豆大的钠,投到坩埚中,继续加热,观察到钠先熔化,然后发出黄色火焰,生成淡黄色固体。
实验3:在烧杯中加入一些水,滴入几滴酚酞溶液,然后把一小块绿豆大的钠放入水中,产生气体,溶液变红。
下列说法不正确的是( )
A.实验1中钠表面变暗是因为钠与氧气发生反应
B.实验2中生成的淡黄色固体是Na2O
C.实验3中溶液变红是因为生成了碱性物质
D.实验3中发生反应中的电子转移可表示为
2NaOH+H2↑
12.为了探究过氧化钠的强氧化性,某小组设计了如图所示的实验装置。
实验步骤及现象如下:
Ⅰ.检查装置气密性后,装入药品并连接仪器。
Ⅱ.缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,A中剧烈反应,有黄绿色气体产生。
Ⅲ.待产生连续气泡后,将装置D中的导管末端伸入集气瓶中,收集到无色气体。
Ⅳ.反应一段时间后,关闭分液漏斗的活塞,再通一段时间N2,直至装置中气体变为无色。
回答下列问题:
(1)装置D中收集的无色气体能使带火星的木条复燃,据此推断该气体是 ,解释产生该气体的原因是 (用离子方程式表示)。
(2)装置B中湿润的淀粉碘化钾试纸变蓝(生成I2)。甲同学认为是生成的氯气氧化了碘化钾;乙同学认为试纸变蓝的原因可能是 。
(3)资料显示,Na2O2与干燥的HCl能发生化学反应生成Cl2,该反应的化学方程式为 。
参考答案
分层作业7 活泼的金属单质——钠
氧化钠和过氧化钠
1.C 解析 钠投入水中,钠的密度小于水,钠不会沉入水底,①错误;钠是活泼的金属,钠立即与水反应2Na+2H2O2NaOH+H2↑,并有气体产生,②正确;生成氢氧化钠,溶液显碱性,使石蕊变蓝,即反应后溶液变蓝,③错误;钠熔点低,反应放热,钠熔成闪亮的小球,④正确;在氢气的推动下,小球在水面上四处游动,⑤正确;氢气在钠块与水之间的缝隙中逸出,有“嘶嘶”的响声发出,⑥正确。
2.D 解析 Na2O为碱性氧化物,Na2O2与水反应还有氧气生成,不是碱性氧化物,A错误;将Na、Na2O2投入水中,分别生成氢气和氧气,B错误;Na、Na2O2久置在空气中均会因发生氧化还原反应而变质,Na2O吸收水和二氧化碳最终变为碳酸钠,不是氧化还原反应,C错误;将Na、Na2O固体分别投入滴加了紫色石蕊溶液的水中,由于均得到氢氧化钠溶液,均可以得到蓝色溶液,D正确。
3.B 解析 钠和水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成Cu(OH)2沉淀,和氯化铁反应生成Fe(OH)3沉淀,和氯化镁反应生成Mg(OH)2沉淀。NaOH和氯化钠溶液不反应,不会产生沉淀。
4.A 解析 该反应中Na2O2中的-1价O元素发生“歧化反应”变成0价和-2价,则Na2O2既是氧化剂又是还原剂,H2O既不是氧化剂也不是还原剂,A正确,B错误;O2是氧化产物,C错误;由于Na2O2具有强氧化性,向反应后的溶液中滴加石蕊溶液,溶液先变蓝色后褪色,D错误。
5.C 解析 Na与O2反应的产物受温度影响,常温下生成Na2O,点燃或加热时生成Na2O2,A不符合题意;NaOH和CO2反应的产物受反应物用量影响,CO2少量时生成Na2CO3,CO2足量时生成NaHCO3,B不符合题意;Na2O2和CO2反应只生成Na2CO3和O2,与温度、反应物用量无关,C符合题意;C与足量O2反应生成CO2,与少量O2反应生成CO,生成物与反应物用量有关,D不符合题意。
6.B 解析 过氧化钠与水反应产生的气体为O2,A正确;过氧化钠与水反应不需要催化剂,MnO2作催化剂加速过氧化氢分解,B错误;实验②③作为对照实验,能证明使酚酞褪色的不是氢氧化钠和氧气,C正确;根据向反应后溶液中加入二氧化锰后迅速产生大量气体可判断过氧化钠与水反应可能生成了具有漂白性的H2O2,D正确。
7.C 解析 关闭K1打开K2,分液漏斗中的水滴入B后,产生大量气泡,带火星的木条复燃,证明产生的气体为氧气,A正确;关闭K2打开K1,B中液体被压入A,溶液变红,说明Na2O2与水反应的生成物显碱性,有氢氧化钠生成,B正确;振荡烧杯红色褪去,说明在溶液中有过氧化氢生成,把酚酞氧化漂白,再加入氢氧化钠溶液不会恢复红色,C错误;充分反应后取B中溶液加入MnO2又有气泡出现,MnO2加快了溶液中的过氧化氢的分解,则MnO2起催化作用,D正确。
8.C 解析 Ⅰ中钠与水剧烈反应:2Na+2H2O2Na++2OH-+H2↑,产生少量白雾,说明钠与水反应放热,使部分水变成水蒸气,A、B均正确;浓盐酸的挥发性比稀盐酸的挥发性强,Ⅲ中挥发出的HCl更多,故产生大量白雾,并非反应放出热量更多,C错误;Ⅲ与Ⅱ相比,Ⅲ中Cl-的浓度更大,可能影响Na与H+的反应,烧杯底部白色固体可能是生成的NaCl,D正确。
9.C 解析 熔化的钠与无水CuSO4粉末发生置换反应生成硫酸钠和铜,钠作还原剂,硫酸铜作氧化剂,该反应为置换反应,A错误;加热且无水条件下,Na可以与CuSO4发生置换反应生成Cu,B错误;Na与CuSO4发生置换反应时瞬间会产生耀眼的火花,说明该反应为放热反应,反应时放出热量,C正确;该反应不在溶液中进行,不能写离子方程式,D错误。
10.C 解析 试管①中Na2O2与水反应最终生成氢氧化钠与氧气,试管⑤中H2O2在二氧化锰催化剂作用下分解生成水和氧气,①⑤产生的气体都为O2,A正确;①中的反应机理可以认为Na2O2与水反应生成H2O2与氢氧化钠,过氧化氢分解生成水和氧气,④中过氧化钡再与稀硫酸反应生成过氧化氢与硫酸钡沉淀,过氧化氢分解产生了氧气,因此两个试管中均发生了氧化还原反应和复分解反应,B正确;②中KMnO4体现氧化性,而⑤中MnO2则起催化作用,两者作用不同,C错误;Na2O2与H2O反应有H2O2生成,D正确。
11.B 解析 实验1中钠表面变暗,其原因是Na与空气中O2反应生成Na2O,A正确;实验2中淡黄色固体是Na2O2,B错误;实验3中钠与水反应生成NaOH和H2,溶液呈碱性,使酚酞显红色,C正确;Na与水反应时,Na是还原剂,H2O是氧化剂,Na失去电子转移给H2O,D正确。
12.答案 (1)O2 2Na2O2+4H+4Na++2H2O+O2↑
(2)O2具有氧化性,也可能将I-氧化为I2
(3)Na2O2+4HClCl2↑+2NaCl+2H2O
