鲁科版(2019)必修第二册 3.2.3煤的干馏与苯课件(共89张PPT)
文档属性
| 名称 | 鲁科版(2019)必修第二册 3.2.3煤的干馏与苯课件(共89张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-30 08:57:35 | ||
图片预览









文档简介
(共89张PPT)
第3课时 煤的干馏与苯
一、煤的干馏
1.定义:将煤_________加强热使其分解的过程。
隔绝空气
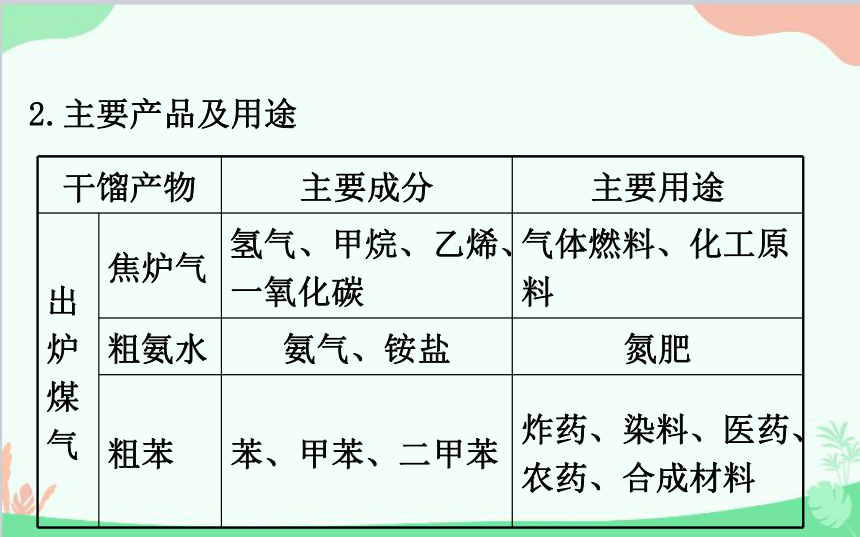
2.主要产品及用途
干馏产物 主要成分 主要用途
出
炉
煤
气 焦炉气 氢气、甲烷、乙烯、一氧化碳 气体燃料、化工原料
粗氨水 氨气、铵盐 氮肥
粗苯 苯、甲苯、二甲苯 炸药、染料、医药、农药、合成材料
干馏产物 主要成分 主要用途
_______ ___________
_______ 炸药、染料、医药、农药、合成材料
酚类、萘 医药、染料、农药、
合成材料
沥青 电极、筑路材料
_____ 碳 冶金、燃料、合成氨
煤焦油
苯、甲苯、
二甲苯
焦炭
【情境·思考】
煤和煤油均是十分重要的燃料,请同学们观察如图并思考:
煤油是煤的干馏产品吗
提示:不是。煤油是轻质石油产品的一类,由碳原子数为11~16的烷烃、芳烃组成,通常由石油经分馏或裂化而得。
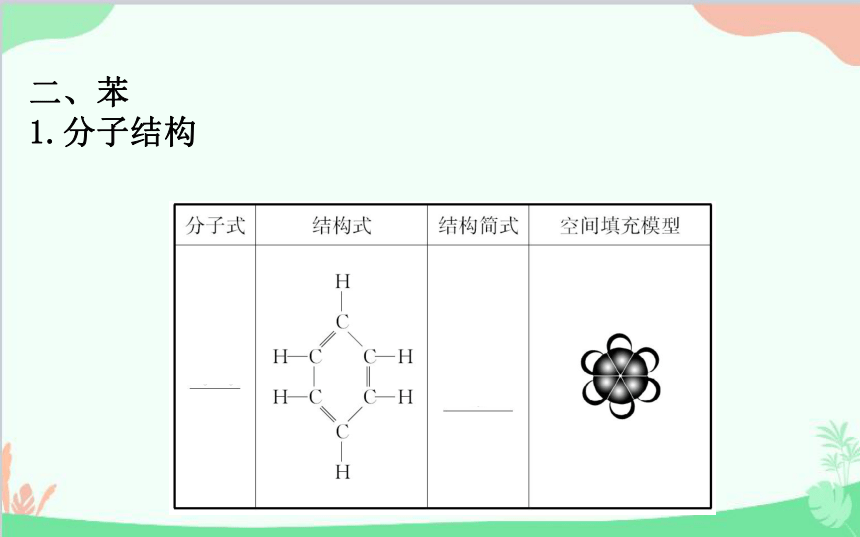
二、苯
1.分子结构
2.结构特点
(1)苯分子为平面_________结构。
(2)分子中__个碳原子和__个氢原子在同一平面内。
(3)6个碳碳键完全相同,是一种介于_______________
_____之间的特殊共价键。
正六边形
6
6
碳碳单键和碳碳
双键
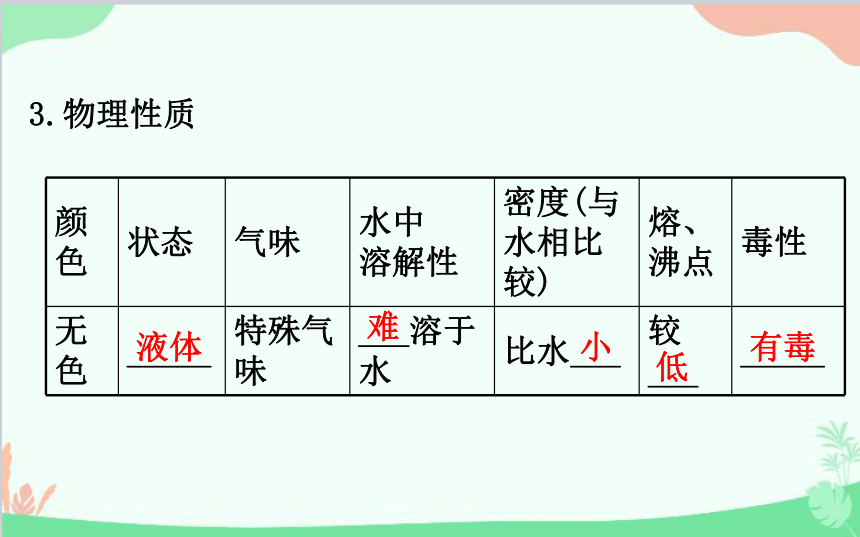
3.物理性质
颜色 状态 气味 水中
溶解性 密度(与水相比较) 熔、
沸点 毒性
无色 _____ 特殊气味 ___溶于水 比水___ 较
___ _____
液体
难
小
低
有毒
4.化学性质
(1)稳定性。
不能与_____________溶液发生加成反应而使其褪色,
也不能被_____________氧化而使其褪色。
溴的四氯化碳
酸性KMnO4溶液
(2)可燃性。
①现象:燃烧时产生_____而带有_____的火焰。
②原因:苯中_____________很大,苯不易_________。
③化学方程式:________________________。
明亮
浓烟
碳的质量分数
完全燃烧
2C6H6+15O2 12CO2+6H2O
(3)取代反应。
在有催化剂Fe存在时,苯与液溴发生反应生成
(4)加成反应。
在催化剂的条件下,苯可以与H2发生加成反应,化学方
程式为
5.用途
(1)一种重要的_____原料,广泛用于生产合成橡胶、合
成纤维、塑料、农药、医药、染料、香料等。
(2)常用作_________。
化工
有机溶剂
【巧判断】
(1)苯分子中所有化学键之间的夹角都是120°。( )
提示:√。苯分子是平面正六边形结构,所有共价键的夹角均为120°。
(2)苯分子中含有3个碳碳双键。 ( )
提示:×。苯分子中碳原子之间是介于碳碳单键和碳碳双键之间的特殊共价键。
(3)苯与溴水混合振荡后静置,溴水褪色说明苯分子中含有碳碳双键。 ( )
提示:×。苯与溴水混合振荡后静置,溴水褪色,是由于苯将溴单质从溴水中萃取出来。
【情境·思考】1890年的一天,凯库勒这样描述他发现苯分子的过程:1855年的一个傍晚,他坐在壁炉旁的椅子上睡着了。梦中见到一条蛇身体盘成一个圈咬自己的尾巴。醒来之后,凯库勒意识到自己找到了苯的分子式C6H6 。当时的化学家们对此不理解,认为这与1个碳原子带有4个氢原子的事实不相符。但是如果分子里面有6个碳原子,每个碳原子又有1个氢原子,而且原子交叉地呈环状排列,问题就解决了。
(1)苯中的碳碳键是否和烷烃或烯烃中的碳碳键一样
(2)苯能否发生加成反应
提示:(1)苯中的碳碳键既不是碳碳单键也不是碳碳双键,是介于二者之间的一种特殊的键。(2)苯能发生加成反应。
知识点一 甲烷、乙烯、苯的性质比较
【重点释疑】
【规律方法】从结构入手理解有机物的性质
(1)甲烷属于饱和烃,因此只能发生取代反应。
(2)乙烯分子中的官能团为碳碳双键,属于不饱和烃,因此能发生加成反应,能被酸性高锰酸钾溶液氧化。
(3)苯分子中的碳碳键是一种介于单键和双键之间的独特的键,具有一定的稳定性。具体为
①苯不能使酸性KMnO4溶液和溴水褪色,由此可知苯在化学性质上与烯烃有很大差别。
②苯在催化剂(Fe)作用下与液溴发生取代反应,说明苯具有类似烷烃的性质。
③苯又能与H2在催化剂作用下发生加成反应,说明苯具有烯烃的性质。
总之,苯易发生取代反应,能发生加成反应,难被氧化,其化学性质不同于烷烃、烯烃。
【知识拓展】苯的同系物与甲苯
(1)苯的同系物是指分子里含有一个苯环,且侧链为烷基的碳氢化合物,分子通式为CnH2n-6(n>6)。
(2)甲苯
①能与硝酸发生取代反应,生成2,4,6-三硝基甲苯,化学方程式为
2,4,6-三硝基甲苯俗名TNT,它是一种烈性炸药,可用于军事、开矿、筑路、水利建设等方面。
②甲苯能被酸性KMnO4溶液氧化,从而使酸性KMnO4溶液褪色。
【思考·讨论】
(1)如何用实验方法证明苯分子中没有碳碳双键
提示:方法一:向苯中加入酸性高锰酸钾溶液,振荡,观察是否褪色,若不褪色,说明苯分子中不存在碳碳双键。
方法二:向苯中加入溴的四氯化碳溶液,振荡,观察是否褪色,若不褪色,说明苯分子中不存在碳碳双键。
(2)能否用溴水除去苯中溶有的乙烯
提示:不能。乙烯与溴的加成产物以及可能剩余的溴仍然可以溶于苯中,无法除去。
【案例示范】
【典例】(2019·青岛高一检测)苯乙烯是一种重要的
有机化工原料,其结构简式为 ,关于苯乙
烯的有关说法中不正确的是 ( )
A.只能发生加成反应不能发生取代反应
B.在空气中燃烧产生黑烟
C.能使酸性高锰酸钾溶液褪色
D.能发生加成反应,在一定条件下可与4倍物质的量的氢气加成
【思维建模】解答有不同官能团的思路流程如下:
【解析】选A。含有碳碳双键,可以发生加成反应,含有
苯环,一定条件下也可以发生取代反应,A项错误;其分
子式为C8H8,与苯(C6H6)具有相同的最简式,故燃烧时现
象相同,B项正确;因分子中含 —CH=CH2,故能被酸性
KMnO4溶液氧化,C项正确;1 mol 能与3 mol H2发
生加成反应,1 mol CH2=CH—能与 1 mol H2发生加成
反应,故D项正确。
【母题追问】(1)如何用实验证明甲苯中含有苯乙烯 (假设不含有其他杂质)(科学探究与创新意识)
提示:苯乙烯可以使溴水褪色,而甲苯不能。取少量样品加入几滴溴水,振荡,若褪色证明甲苯中含有苯乙烯。
(2)苯乙烯和甲苯是否互为同系物 (宏观辨识与微观探析)
提示:否。二者结构不同,苯乙烯中含有碳碳双键,而甲苯中不含有。
【迁移·应用】
1.(2019·厦门高一检测)下列能说明苯与一般的烯烃性质不同的实验事实是 ( )
A.苯分子是高度对称的平面形分子
B.苯与溴水混合无明显现象
C.苯不与酸性KMnO4溶液反应
D.1 mol C6H6在一定条件下可与3 mol Cl2发生加成反应
【解析】选C。苯分子(C6H6)尽管不饱和,但不能与溴水反应,苯与溴水混合可将溴单质从溴水中萃取出来,故溴水褪色。苯也不能和酸性KMnO4溶液反应,这是苯明显不同于一般烯烃性质的事实。
2.(2019·宣威高一检测)与甲烷、乙烯相比,苯的独特性质具体来说是 ( )
A.难氧化,易加成,难取代
B.易取代,能加成,难氧化
C.易氧化,易加成,难取代
D.因是单双键交替结构,故易加成变为环己烷
【解析】选B。在50~60 ℃条件下,苯能与混合酸(浓硫酸与浓硝酸混合而成)发生取代反应,反应较易进行;在加热并有催化剂存在时,苯能跟H2发生加成反应,但不能与溴水发生加成反应,苯的加成反应较难进行;苯很难被氧化(燃烧除外),故不能使酸性KMnO4溶液褪色。
【补偿训练】
(2019·清远高一检测)下列关于有机化合物的说法正确的是 ( )
A.乙烯和苯都存在碳碳双键
B.甲烷和乙烯都可以与氯气反应
C.高锰酸钾可以氧化苯和甲烷
D.乙烯可以与氢气发生加成反应,苯不能与氢气加成
【解析】选B。乙烯和苯中只有乙烯存在碳碳双键;甲烷可与氯气发生取代反应,乙烯可与氯气发生加成反应;高锰酸钾不能氧化苯和甲烷;乙烯和苯都可与氢气发生加成反应。
【素养提升】
俗话说:“无醛不成胶,无苯不成漆。”
大部分人只知道甲醛有毒,而忽略了苯
的危害。苯是一种无色、具有特殊芳香
气味的液体。国际卫生组织已经把苯定为强烈致癌物质,苯可以引起白血病和再生障碍性贫血也被医学界公认。
已知分子式为C6H6的烃结构有多种,其中的三种为
(1)简述上述三种物质中分别与溴水混合后的现象。
提示:物质(Ⅰ)分子结构中含有碳碳双键,因此能与溴发生加成反应,故与溴水混合后溶液分层并褪色;物质(Ⅱ)、(Ⅲ)分别与溴水混合后的现象基本相同,均为混合后溶液分层,上层有机层为橙红色。
(2)能否用酸性KMnO4溶液鉴别上述三种物质
提示:不能。物质(Ⅰ)分子结构中含有碳碳双键,因此能与酸性KMnO4溶液发生氧化反应,从而使溶液褪色,因此可以用酸性KMnO4溶液鉴别出物质(Ⅰ)。而物质(Ⅱ)、(Ⅲ)均不与酸性KMnO4溶液反应,无法鉴别。
(3)等量的(Ⅰ)(Ⅱ)两种物质与足量氢气反应时,消耗的氢气的量之比为多少
提示:2∶3。物质(Ⅰ)的分子中含有2个碳碳双键,因此1 mol物质(Ⅰ)会消耗2 mol H2,而1 mol苯能与3 mol H2发生加成反应。
知识点二 有机物分子中的原子共线、共面问题
【重点释疑】
1.四种结构
掌握所学各类烃中代表物的分子构型特点。
(1)CH4为正四面体结构,三个碳以上的烷烃的碳链呈锯齿状。
(2)CH2=CH2为平面形(即6个原子共面)。
(3)CH≡CH为直线形(即4个原子共线)。
(4) 为平面六边形(即12个原子共面)。
2.一种方法——拆分组合法
判断有机物分子中的原子共线、共面时,只需要将已知有机物分子拆分为上述四种结构,对其进行分析、组合、综合,即可判断其中原子是否共线或共面。其中分子中的共价单键(如C—C)能绕对称轴旋转;但C=C不能旋转,如
可展开为 ,故其中所
有的原子可能处于同一个平面上,但不一定都处于同一
个平面上。
【思考·讨论】
(1)丁烯(C4H8)有三种同分异构体,分别是
CH2=CHCH2CH3、CH3CH=CHCH3、CH2=C(CH3)2,
碳原子一定处于同一个平面的有哪些
提示:碳原子一定共面的有CH3CH=CHCH3和
CH2=C(CH3)2, CH2=CHCH2CH3中碳原子不一定在同一平面上。
(2)苯分子中一定共线的原子有几个
提示:4个。如图所示, ,虚线上的2个碳原
子和2个氢原子一定位于同一直线上。
【案例示范】
【典例】(2019·延吉高一检测)已知异丙
苯的结构简式如图,下列说法错误的是( )
A.异丙苯的分子式为C9H12
B.异丙苯中处于同一直线上的原子至少有4个
C.异丙苯中碳原子可能都处于同一平面
D.异丙苯的一氯代物有5种
【解题指南】解答本题要注意以下两点:
(1)苯环是平面结构;
(2)饱和碳原子属于四面体形立体结构。
【解析】选C。A项,异丙苯的分子式为C9H12;B项,异丙苯中处于同一直线上的原子至少有4个;C项,异丙苯中与苯环相连的碳原子上有四个单键,所有碳原子不可能共面;D项,异丙苯中的氢原子被氯原子取代的产物,苯环上有“临、间、对”3种,侧链上有2种,共5种。
【方法规律】有机物共面问题的解题规律
(1)甲烷、苯、乙烯分子中的氢原子如果被其他原子所取代,则取代后的分子构型基本不变。
(2)当分子中出现碳原子与其他原子形成四个单键(即饱和碳原子)时,所有原子不可能共面。
(3)共价单键可以自由旋转,共价双键不能旋转。
【母题追问】正丙苯是重要的化工产品,可直接作为溶剂,也是合成其他重要化工原料的中间体,可用于纺织染料、印刷、作醋酸纤维溶剂及合成聚丙烯成核剂的中间体等,其结构简式如图所示。
正丙苯分子中所有的碳原子一定能处于同一个平面吗
提示:不一定。由于碳碳单键可以旋转,因此正丙苯侧链上的碳原子,除了与苯环相连的这个碳原子一定与苯环共面之外,另外两个碳原子不一定在这个平面上。
【迁移·应用】
1.(2019·雅安高一检测)下列有机物分子中,所有的原子不可能在同一平面上的是 ( )
【解析】选C。A项苯为平面分子, 中所有的原子
都在同一平面上;B项 可看作 替代
了乙烯中的一个氢原子,而 中所有的原子都在同一
平面内,而且相互间连接的原子都可在另一部分的平面
内,所以可判断这两部分可能在同一平面内;C项
中—CH3的碳原子与其他的原子形成四面体结构,所以
所有原子不可能在同一平面上;D项CH2=CHBr中的溴原子取代了乙烯分子中的一个氢原子,因此所有原子均在同一平面上。
2.(2019·深圳高一检测)某烃结构简式为
,有关其结构的说法,正确的是
世纪金榜导学号( )
A.所有原子可能在同一平面内
B.所有原子可能在同一条直线上
C.所有碳原子可能在同一平面内
D.所有氢原子可能在同一平面内
【解析】选C。该烃含有苯环、—C≡C—、 ,所
有碳原子可能都在同一平面内,但至多有19个原子共面,
即甲基上有2个氢原子不可能在该平面内,有5个碳原子
和1个氢原子共线。
【补偿训练】
(2019·成都高一检测)下列有机物分子中,所有原子可能在同一平面上的是 ( )
A.CH3CH=CH2
B.CH2=CH—CH=CH2
C.CH3—CH2—CH3
D.CH2Cl2
【解析】选B。A项CH3CH=CH2可看作乙烯分子中一个氢
原子被甲基取代,甲基上的碳原子与三个氢原子不可能
都在同一平面上;B项CH2=CH—CH=CH2相当于两个乙烯
基通过单键相连,乙烯基的所有原子共平面,两个平面
可以重合,故所有原子可能处于同一平面上;C项
CH3—CH2—CH3可看作两个甲基取代了甲烷中的两个氢
原子,甲烷为正四面体结构,CH3—CH2—CH3不可能所有
原子共平面;D项CH2Cl2可看作两个氯原子取代了甲烷分子中的两个氢原子,CH2Cl2为四面体结构,所有原子不可能在同一平面上,故选B项。
知识点三 烃燃烧规律总结
【重点释疑】
1.烃的燃烧化学方程式
不论是烷烃、烯烃还是苯,它们的组成均可用CxHy来表
示,当它在氧气或空气中完全燃烧时,其方程式可表示
为
2.气态烃燃烧的体积变化
在T>100 ℃时,ΔV=(x+ )-[1+(x+ )]= -1。
当y>4时,ΔV>0,即体积增大;
当y=4时,ΔV=0,即体积不变;
当y<4时,ΔV<0,即体积减小。
3.烃燃烧时耗氧量n(O2)、生成二氧化碳量n(CO2)、生成水量n(H2O)的比较
(1)1 mol 烃CxHy燃烧时
n(O2)=x+
n(CO2)=x
n(H2O)=
(2)质量相同的烃CxHy(转换成 )燃烧时
①质量相同、含氢质量分数较大的烃,即 值越大燃
烧时耗氧量较多、生成二氧化碳量较少、生成水量较
多。
②最简式相同的烃,不论以何种比例混合,只要混合物
的总质量一定,完全燃烧后的耗氧量、生成二氧化碳的
量、生成水的量也一定。
【规律方法】
差量法在烃燃烧计算中的应用
由于烃在燃烧过程中生成CO2和H2O,气体的物质的量或体积在反应的前后会发生变化,因此要灵活应用物质的量差量或体积差量进行分析或计算。同时注意以下两点:
(1)反应的温度条件决定了水的状态,在利用气体体积差量法计算时要注意水是否为气体。
(2)注意相应规律的应用,如氢原子为4时的燃烧的特点。
【思考·讨论】
(1)若某烃充分燃烧后生成的CO2与H2O物质的量相等,则该烃的组成有何特点
提示:根据烃的燃烧通式可知,若烃燃烧生成的CO2与H2O物质的量相等,则其分子组成应满足CnH2n。
(2)若某气态烃分子中氢原子数为4,则此烃完全燃烧前后气体的体积如何变化
提示:若燃烧时水为气态,则燃烧前后气体体积不变;若燃烧时水为非气态,则燃烧后气体体积将减小。
【案例示范】
【典例】(2019·榆林高一检测)在120 ℃,1.01×
105 Pa时,将3 L炔烃和烷烃的混合气体与相同状况下
的14 L O2混合,充分燃烧后,恢复到原来状态时,所得
气体的体积是17 L。则该混合气体可能是下列各组中
的 ( )
A.C2H4和C2H6 B.C3H4和CH4
C.C2H2和CH4 D.C4H6和C2H6
【解题指南】解答本题时应注意以下两点:
(1)水在120℃时为气态;
(2)此题中反应前后气体的体积没有发生改变。
【解析】选B。设混合烃的平均组成为CxHy,因为温度为120 ℃,生成物中的水呈气态,烃完全燃烧的化学方程式为
因为反应前后气体的体积没有发生变化(均为17 L)即
-1=0,所以y=4,说明混合烃分子中氢原子数的平均
值为4,则A、C、D三项均不符合题意。
【母题追问】若【典例】中燃烧后所得气体体积改为16 L,则混合物组成应选哪项
提示:所得气体体积为16 L,反应后气体总体积减小,说明混合烃分子中氢原子数平均值小于4,则只有C项符合。
【迁移·应用】
1.(2019·济南高一检测)25 ℃某气态烃与O2混合,在密闭容器中点燃爆炸后又恢复至25 ℃,此时容器内压强为原来的一半,再经NaOH溶液处理,容器内几乎成为真空。该烃的分子式可能为 世纪金榜导学号( )
A.C2H4 B.C2H6 C.C3H6 D.C4H8
【解析】选A。设该烃的分子式为CxHy,则CxHy+(x+
)O2 xCO2+ H2O,由题意可知,烃和O2的物质的
量之和应为CO2的物质的量的2倍,即1+(x+ )=2x,解
得x=1+ 。
讨论:当y=4时,x=2;当y=6时,x=2.5,不符合题意;当y=8
时,x=3,不符合题意,故正确答案为A。
2.(2019·宁阳高一检测)某有机物在氧气中充分燃烧,生成CO2和H2O的物质的量之比为1∶2,则 ( )
A.分子中C、H、O个数之比为1∶2∶3
B.分子中C、H个数之比为1∶2
C.分子中可能含有氧原子
D.此有机物的最简式为CH4
【解析】选C。有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量之比为1∶2,则根据原子守恒可知,有机物分子中碳、氢原子个数比为1∶4,所以选项A、B不正确,D也不正确。因为不能确定是否含有氧元素,所以正确的答案选C。
【补偿训练】
(2019·镇江高一检测)等物质的量的乙烷、乙烯、乙炔完全燃烧消耗氧气的物质的量之比为 ( )
A.1∶1∶1 B.30∶35∶42
C.5∶4∶3 D.7∶6∶5
【解析】选D。由烃类燃烧的通式CxHy+(x+ )O2
xCO2+ H2O知,等物质的量的乙烷、乙烯、乙炔完全燃
烧时耗氧量的大小取决于x+ 的值的大小,从而得出
等物质的量的三种有机物耗氧量之比为7∶6∶5。
【课堂回眸】
第3课时 煤的干馏与苯
一、煤的干馏
1.定义:将煤_________加强热使其分解的过程。
隔绝空气
2.主要产品及用途
干馏产物 主要成分 主要用途
出
炉
煤
气 焦炉气 氢气、甲烷、乙烯、一氧化碳 气体燃料、化工原料
粗氨水 氨气、铵盐 氮肥
粗苯 苯、甲苯、二甲苯 炸药、染料、医药、农药、合成材料
干馏产物 主要成分 主要用途
_______ ___________
_______ 炸药、染料、医药、农药、合成材料
酚类、萘 医药、染料、农药、
合成材料
沥青 电极、筑路材料
_____ 碳 冶金、燃料、合成氨
煤焦油
苯、甲苯、
二甲苯
焦炭
【情境·思考】
煤和煤油均是十分重要的燃料,请同学们观察如图并思考:
煤油是煤的干馏产品吗
提示:不是。煤油是轻质石油产品的一类,由碳原子数为11~16的烷烃、芳烃组成,通常由石油经分馏或裂化而得。
二、苯
1.分子结构
2.结构特点
(1)苯分子为平面_________结构。
(2)分子中__个碳原子和__个氢原子在同一平面内。
(3)6个碳碳键完全相同,是一种介于_______________
_____之间的特殊共价键。
正六边形
6
6
碳碳单键和碳碳
双键
3.物理性质
颜色 状态 气味 水中
溶解性 密度(与水相比较) 熔、
沸点 毒性
无色 _____ 特殊气味 ___溶于水 比水___ 较
___ _____
液体
难
小
低
有毒
4.化学性质
(1)稳定性。
不能与_____________溶液发生加成反应而使其褪色,
也不能被_____________氧化而使其褪色。
溴的四氯化碳
酸性KMnO4溶液
(2)可燃性。
①现象:燃烧时产生_____而带有_____的火焰。
②原因:苯中_____________很大,苯不易_________。
③化学方程式:________________________。
明亮
浓烟
碳的质量分数
完全燃烧
2C6H6+15O2 12CO2+6H2O
(3)取代反应。
在有催化剂Fe存在时,苯与液溴发生反应生成
(4)加成反应。
在催化剂的条件下,苯可以与H2发生加成反应,化学方
程式为
5.用途
(1)一种重要的_____原料,广泛用于生产合成橡胶、合
成纤维、塑料、农药、医药、染料、香料等。
(2)常用作_________。
化工
有机溶剂
【巧判断】
(1)苯分子中所有化学键之间的夹角都是120°。( )
提示:√。苯分子是平面正六边形结构,所有共价键的夹角均为120°。
(2)苯分子中含有3个碳碳双键。 ( )
提示:×。苯分子中碳原子之间是介于碳碳单键和碳碳双键之间的特殊共价键。
(3)苯与溴水混合振荡后静置,溴水褪色说明苯分子中含有碳碳双键。 ( )
提示:×。苯与溴水混合振荡后静置,溴水褪色,是由于苯将溴单质从溴水中萃取出来。
【情境·思考】1890年的一天,凯库勒这样描述他发现苯分子的过程:1855年的一个傍晚,他坐在壁炉旁的椅子上睡着了。梦中见到一条蛇身体盘成一个圈咬自己的尾巴。醒来之后,凯库勒意识到自己找到了苯的分子式C6H6 。当时的化学家们对此不理解,认为这与1个碳原子带有4个氢原子的事实不相符。但是如果分子里面有6个碳原子,每个碳原子又有1个氢原子,而且原子交叉地呈环状排列,问题就解决了。
(1)苯中的碳碳键是否和烷烃或烯烃中的碳碳键一样
(2)苯能否发生加成反应
提示:(1)苯中的碳碳键既不是碳碳单键也不是碳碳双键,是介于二者之间的一种特殊的键。(2)苯能发生加成反应。
知识点一 甲烷、乙烯、苯的性质比较
【重点释疑】
【规律方法】从结构入手理解有机物的性质
(1)甲烷属于饱和烃,因此只能发生取代反应。
(2)乙烯分子中的官能团为碳碳双键,属于不饱和烃,因此能发生加成反应,能被酸性高锰酸钾溶液氧化。
(3)苯分子中的碳碳键是一种介于单键和双键之间的独特的键,具有一定的稳定性。具体为
①苯不能使酸性KMnO4溶液和溴水褪色,由此可知苯在化学性质上与烯烃有很大差别。
②苯在催化剂(Fe)作用下与液溴发生取代反应,说明苯具有类似烷烃的性质。
③苯又能与H2在催化剂作用下发生加成反应,说明苯具有烯烃的性质。
总之,苯易发生取代反应,能发生加成反应,难被氧化,其化学性质不同于烷烃、烯烃。
【知识拓展】苯的同系物与甲苯
(1)苯的同系物是指分子里含有一个苯环,且侧链为烷基的碳氢化合物,分子通式为CnH2n-6(n>6)。
(2)甲苯
①能与硝酸发生取代反应,生成2,4,6-三硝基甲苯,化学方程式为
2,4,6-三硝基甲苯俗名TNT,它是一种烈性炸药,可用于军事、开矿、筑路、水利建设等方面。
②甲苯能被酸性KMnO4溶液氧化,从而使酸性KMnO4溶液褪色。
【思考·讨论】
(1)如何用实验方法证明苯分子中没有碳碳双键
提示:方法一:向苯中加入酸性高锰酸钾溶液,振荡,观察是否褪色,若不褪色,说明苯分子中不存在碳碳双键。
方法二:向苯中加入溴的四氯化碳溶液,振荡,观察是否褪色,若不褪色,说明苯分子中不存在碳碳双键。
(2)能否用溴水除去苯中溶有的乙烯
提示:不能。乙烯与溴的加成产物以及可能剩余的溴仍然可以溶于苯中,无法除去。
【案例示范】
【典例】(2019·青岛高一检测)苯乙烯是一种重要的
有机化工原料,其结构简式为 ,关于苯乙
烯的有关说法中不正确的是 ( )
A.只能发生加成反应不能发生取代反应
B.在空气中燃烧产生黑烟
C.能使酸性高锰酸钾溶液褪色
D.能发生加成反应,在一定条件下可与4倍物质的量的氢气加成
【思维建模】解答有不同官能团的思路流程如下:
【解析】选A。含有碳碳双键,可以发生加成反应,含有
苯环,一定条件下也可以发生取代反应,A项错误;其分
子式为C8H8,与苯(C6H6)具有相同的最简式,故燃烧时现
象相同,B项正确;因分子中含 —CH=CH2,故能被酸性
KMnO4溶液氧化,C项正确;1 mol 能与3 mol H2发
生加成反应,1 mol CH2=CH—能与 1 mol H2发生加成
反应,故D项正确。
【母题追问】(1)如何用实验证明甲苯中含有苯乙烯 (假设不含有其他杂质)(科学探究与创新意识)
提示:苯乙烯可以使溴水褪色,而甲苯不能。取少量样品加入几滴溴水,振荡,若褪色证明甲苯中含有苯乙烯。
(2)苯乙烯和甲苯是否互为同系物 (宏观辨识与微观探析)
提示:否。二者结构不同,苯乙烯中含有碳碳双键,而甲苯中不含有。
【迁移·应用】
1.(2019·厦门高一检测)下列能说明苯与一般的烯烃性质不同的实验事实是 ( )
A.苯分子是高度对称的平面形分子
B.苯与溴水混合无明显现象
C.苯不与酸性KMnO4溶液反应
D.1 mol C6H6在一定条件下可与3 mol Cl2发生加成反应
【解析】选C。苯分子(C6H6)尽管不饱和,但不能与溴水反应,苯与溴水混合可将溴单质从溴水中萃取出来,故溴水褪色。苯也不能和酸性KMnO4溶液反应,这是苯明显不同于一般烯烃性质的事实。
2.(2019·宣威高一检测)与甲烷、乙烯相比,苯的独特性质具体来说是 ( )
A.难氧化,易加成,难取代
B.易取代,能加成,难氧化
C.易氧化,易加成,难取代
D.因是单双键交替结构,故易加成变为环己烷
【解析】选B。在50~60 ℃条件下,苯能与混合酸(浓硫酸与浓硝酸混合而成)发生取代反应,反应较易进行;在加热并有催化剂存在时,苯能跟H2发生加成反应,但不能与溴水发生加成反应,苯的加成反应较难进行;苯很难被氧化(燃烧除外),故不能使酸性KMnO4溶液褪色。
【补偿训练】
(2019·清远高一检测)下列关于有机化合物的说法正确的是 ( )
A.乙烯和苯都存在碳碳双键
B.甲烷和乙烯都可以与氯气反应
C.高锰酸钾可以氧化苯和甲烷
D.乙烯可以与氢气发生加成反应,苯不能与氢气加成
【解析】选B。乙烯和苯中只有乙烯存在碳碳双键;甲烷可与氯气发生取代反应,乙烯可与氯气发生加成反应;高锰酸钾不能氧化苯和甲烷;乙烯和苯都可与氢气发生加成反应。
【素养提升】
俗话说:“无醛不成胶,无苯不成漆。”
大部分人只知道甲醛有毒,而忽略了苯
的危害。苯是一种无色、具有特殊芳香
气味的液体。国际卫生组织已经把苯定为强烈致癌物质,苯可以引起白血病和再生障碍性贫血也被医学界公认。
已知分子式为C6H6的烃结构有多种,其中的三种为
(1)简述上述三种物质中分别与溴水混合后的现象。
提示:物质(Ⅰ)分子结构中含有碳碳双键,因此能与溴发生加成反应,故与溴水混合后溶液分层并褪色;物质(Ⅱ)、(Ⅲ)分别与溴水混合后的现象基本相同,均为混合后溶液分层,上层有机层为橙红色。
(2)能否用酸性KMnO4溶液鉴别上述三种物质
提示:不能。物质(Ⅰ)分子结构中含有碳碳双键,因此能与酸性KMnO4溶液发生氧化反应,从而使溶液褪色,因此可以用酸性KMnO4溶液鉴别出物质(Ⅰ)。而物质(Ⅱ)、(Ⅲ)均不与酸性KMnO4溶液反应,无法鉴别。
(3)等量的(Ⅰ)(Ⅱ)两种物质与足量氢气反应时,消耗的氢气的量之比为多少
提示:2∶3。物质(Ⅰ)的分子中含有2个碳碳双键,因此1 mol物质(Ⅰ)会消耗2 mol H2,而1 mol苯能与3 mol H2发生加成反应。
知识点二 有机物分子中的原子共线、共面问题
【重点释疑】
1.四种结构
掌握所学各类烃中代表物的分子构型特点。
(1)CH4为正四面体结构,三个碳以上的烷烃的碳链呈锯齿状。
(2)CH2=CH2为平面形(即6个原子共面)。
(3)CH≡CH为直线形(即4个原子共线)。
(4) 为平面六边形(即12个原子共面)。
2.一种方法——拆分组合法
判断有机物分子中的原子共线、共面时,只需要将已知有机物分子拆分为上述四种结构,对其进行分析、组合、综合,即可判断其中原子是否共线或共面。其中分子中的共价单键(如C—C)能绕对称轴旋转;但C=C不能旋转,如
可展开为 ,故其中所
有的原子可能处于同一个平面上,但不一定都处于同一
个平面上。
【思考·讨论】
(1)丁烯(C4H8)有三种同分异构体,分别是
CH2=CHCH2CH3、CH3CH=CHCH3、CH2=C(CH3)2,
碳原子一定处于同一个平面的有哪些
提示:碳原子一定共面的有CH3CH=CHCH3和
CH2=C(CH3)2, CH2=CHCH2CH3中碳原子不一定在同一平面上。
(2)苯分子中一定共线的原子有几个
提示:4个。如图所示, ,虚线上的2个碳原
子和2个氢原子一定位于同一直线上。
【案例示范】
【典例】(2019·延吉高一检测)已知异丙
苯的结构简式如图,下列说法错误的是( )
A.异丙苯的分子式为C9H12
B.异丙苯中处于同一直线上的原子至少有4个
C.异丙苯中碳原子可能都处于同一平面
D.异丙苯的一氯代物有5种
【解题指南】解答本题要注意以下两点:
(1)苯环是平面结构;
(2)饱和碳原子属于四面体形立体结构。
【解析】选C。A项,异丙苯的分子式为C9H12;B项,异丙苯中处于同一直线上的原子至少有4个;C项,异丙苯中与苯环相连的碳原子上有四个单键,所有碳原子不可能共面;D项,异丙苯中的氢原子被氯原子取代的产物,苯环上有“临、间、对”3种,侧链上有2种,共5种。
【方法规律】有机物共面问题的解题规律
(1)甲烷、苯、乙烯分子中的氢原子如果被其他原子所取代,则取代后的分子构型基本不变。
(2)当分子中出现碳原子与其他原子形成四个单键(即饱和碳原子)时,所有原子不可能共面。
(3)共价单键可以自由旋转,共价双键不能旋转。
【母题追问】正丙苯是重要的化工产品,可直接作为溶剂,也是合成其他重要化工原料的中间体,可用于纺织染料、印刷、作醋酸纤维溶剂及合成聚丙烯成核剂的中间体等,其结构简式如图所示。
正丙苯分子中所有的碳原子一定能处于同一个平面吗
提示:不一定。由于碳碳单键可以旋转,因此正丙苯侧链上的碳原子,除了与苯环相连的这个碳原子一定与苯环共面之外,另外两个碳原子不一定在这个平面上。
【迁移·应用】
1.(2019·雅安高一检测)下列有机物分子中,所有的原子不可能在同一平面上的是 ( )
【解析】选C。A项苯为平面分子, 中所有的原子
都在同一平面上;B项 可看作 替代
了乙烯中的一个氢原子,而 中所有的原子都在同一
平面内,而且相互间连接的原子都可在另一部分的平面
内,所以可判断这两部分可能在同一平面内;C项
中—CH3的碳原子与其他的原子形成四面体结构,所以
所有原子不可能在同一平面上;D项CH2=CHBr中的溴原子取代了乙烯分子中的一个氢原子,因此所有原子均在同一平面上。
2.(2019·深圳高一检测)某烃结构简式为
,有关其结构的说法,正确的是
世纪金榜导学号( )
A.所有原子可能在同一平面内
B.所有原子可能在同一条直线上
C.所有碳原子可能在同一平面内
D.所有氢原子可能在同一平面内
【解析】选C。该烃含有苯环、—C≡C—、 ,所
有碳原子可能都在同一平面内,但至多有19个原子共面,
即甲基上有2个氢原子不可能在该平面内,有5个碳原子
和1个氢原子共线。
【补偿训练】
(2019·成都高一检测)下列有机物分子中,所有原子可能在同一平面上的是 ( )
A.CH3CH=CH2
B.CH2=CH—CH=CH2
C.CH3—CH2—CH3
D.CH2Cl2
【解析】选B。A项CH3CH=CH2可看作乙烯分子中一个氢
原子被甲基取代,甲基上的碳原子与三个氢原子不可能
都在同一平面上;B项CH2=CH—CH=CH2相当于两个乙烯
基通过单键相连,乙烯基的所有原子共平面,两个平面
可以重合,故所有原子可能处于同一平面上;C项
CH3—CH2—CH3可看作两个甲基取代了甲烷中的两个氢
原子,甲烷为正四面体结构,CH3—CH2—CH3不可能所有
原子共平面;D项CH2Cl2可看作两个氯原子取代了甲烷分子中的两个氢原子,CH2Cl2为四面体结构,所有原子不可能在同一平面上,故选B项。
知识点三 烃燃烧规律总结
【重点释疑】
1.烃的燃烧化学方程式
不论是烷烃、烯烃还是苯,它们的组成均可用CxHy来表
示,当它在氧气或空气中完全燃烧时,其方程式可表示
为
2.气态烃燃烧的体积变化
在T>100 ℃时,ΔV=(x+ )-[1+(x+ )]= -1。
当y>4时,ΔV>0,即体积增大;
当y=4时,ΔV=0,即体积不变;
当y<4时,ΔV<0,即体积减小。
3.烃燃烧时耗氧量n(O2)、生成二氧化碳量n(CO2)、生成水量n(H2O)的比较
(1)1 mol 烃CxHy燃烧时
n(O2)=x+
n(CO2)=x
n(H2O)=
(2)质量相同的烃CxHy(转换成 )燃烧时
①质量相同、含氢质量分数较大的烃,即 值越大燃
烧时耗氧量较多、生成二氧化碳量较少、生成水量较
多。
②最简式相同的烃,不论以何种比例混合,只要混合物
的总质量一定,完全燃烧后的耗氧量、生成二氧化碳的
量、生成水的量也一定。
【规律方法】
差量法在烃燃烧计算中的应用
由于烃在燃烧过程中生成CO2和H2O,气体的物质的量或体积在反应的前后会发生变化,因此要灵活应用物质的量差量或体积差量进行分析或计算。同时注意以下两点:
(1)反应的温度条件决定了水的状态,在利用气体体积差量法计算时要注意水是否为气体。
(2)注意相应规律的应用,如氢原子为4时的燃烧的特点。
【思考·讨论】
(1)若某烃充分燃烧后生成的CO2与H2O物质的量相等,则该烃的组成有何特点
提示:根据烃的燃烧通式可知,若烃燃烧生成的CO2与H2O物质的量相等,则其分子组成应满足CnH2n。
(2)若某气态烃分子中氢原子数为4,则此烃完全燃烧前后气体的体积如何变化
提示:若燃烧时水为气态,则燃烧前后气体体积不变;若燃烧时水为非气态,则燃烧后气体体积将减小。
【案例示范】
【典例】(2019·榆林高一检测)在120 ℃,1.01×
105 Pa时,将3 L炔烃和烷烃的混合气体与相同状况下
的14 L O2混合,充分燃烧后,恢复到原来状态时,所得
气体的体积是17 L。则该混合气体可能是下列各组中
的 ( )
A.C2H4和C2H6 B.C3H4和CH4
C.C2H2和CH4 D.C4H6和C2H6
【解题指南】解答本题时应注意以下两点:
(1)水在120℃时为气态;
(2)此题中反应前后气体的体积没有发生改变。
【解析】选B。设混合烃的平均组成为CxHy,因为温度为120 ℃,生成物中的水呈气态,烃完全燃烧的化学方程式为
因为反应前后气体的体积没有发生变化(均为17 L)即
-1=0,所以y=4,说明混合烃分子中氢原子数的平均
值为4,则A、C、D三项均不符合题意。
【母题追问】若【典例】中燃烧后所得气体体积改为16 L,则混合物组成应选哪项
提示:所得气体体积为16 L,反应后气体总体积减小,说明混合烃分子中氢原子数平均值小于4,则只有C项符合。
【迁移·应用】
1.(2019·济南高一检测)25 ℃某气态烃与O2混合,在密闭容器中点燃爆炸后又恢复至25 ℃,此时容器内压强为原来的一半,再经NaOH溶液处理,容器内几乎成为真空。该烃的分子式可能为 世纪金榜导学号( )
A.C2H4 B.C2H6 C.C3H6 D.C4H8
【解析】选A。设该烃的分子式为CxHy,则CxHy+(x+
)O2 xCO2+ H2O,由题意可知,烃和O2的物质的
量之和应为CO2的物质的量的2倍,即1+(x+ )=2x,解
得x=1+ 。
讨论:当y=4时,x=2;当y=6时,x=2.5,不符合题意;当y=8
时,x=3,不符合题意,故正确答案为A。
2.(2019·宁阳高一检测)某有机物在氧气中充分燃烧,生成CO2和H2O的物质的量之比为1∶2,则 ( )
A.分子中C、H、O个数之比为1∶2∶3
B.分子中C、H个数之比为1∶2
C.分子中可能含有氧原子
D.此有机物的最简式为CH4
【解析】选C。有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量之比为1∶2,则根据原子守恒可知,有机物分子中碳、氢原子个数比为1∶4,所以选项A、B不正确,D也不正确。因为不能确定是否含有氧元素,所以正确的答案选C。
【补偿训练】
(2019·镇江高一检测)等物质的量的乙烷、乙烯、乙炔完全燃烧消耗氧气的物质的量之比为 ( )
A.1∶1∶1 B.30∶35∶42
C.5∶4∶3 D.7∶6∶5
【解析】选D。由烃类燃烧的通式CxHy+(x+ )O2
xCO2+ H2O知,等物质的量的乙烷、乙烯、乙炔完全燃
烧时耗氧量的大小取决于x+ 的值的大小,从而得出
等物质的量的三种有机物耗氧量之比为7∶6∶5。
【课堂回眸】
