第二章《分子结构与性质》练习题(含解析)2022-2023学年下学期高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 第二章《分子结构与性质》练习题(含解析)2022-2023学年下学期高二化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 471.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-30 20:34:52 | ||
图片预览




文档简介
第二章《 分子结构与性质》练习题
一、单选题
1.下列物质发生变化时,所克服的粒子间相互作用完全相同的是
A.液态HF与液态HBr分别受热变为气体
B.氯化铵与苯分别受热变为气体
C.氯化钠与氯化氢分别溶解在水中
D.碘与干冰分别受热变为气体
2.下列说法不正确的是
A.金刚石、NaCl、、晶体的熔点依次降低
B.水晶、石英的主要成分都是二氧化硅,其分子式为
C.干冰加热易升华,但是却不易分解,说明化学键比分子间作用力要强
D.氯化铵受热变为气体的过程中破坏了离子键和共价键
3.下列相关数据或性质排列顺序不正确的是
A.沸点:AsH3>PH3>NH3 B.酸性:HClO4>H2SO4>H2SiO3
C.稳定性:H2O>CH4>SiH4 D.原子半径:Na>Mg>Al
4.一种用于合成治疗免疫疾病药物的物质,其结构如图所示,其中X、Y,Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述正确的是( )
A.WZX与W2Q化学键类型完全相同
B.此物质中各微粒都满足最外层8电子稳定结构
C.简单气态氢化物的稳定性:ZD.W2Q2Z3溶液在酸性条件下有黄色浑浊和无色气体产生
5.2-吡啶甲酸是一种稀土碱金属整合物,其合成原理如下图。下列说法错误的是
(甲基吡啶)(2-吡啶甲酸)
A.一个甲基吡啶分子中有14个σ键 B.甲基吡啶中所有原子可能共平面
C.沸点:2-吡啶甲酸大于甲基吡啶 D.在水中的溶解性:2-吡啶甲酸大于甲基吡啶
6.R、X、Y、Z是四种原子序数依次增大的短周期元素,甲、乙、丙、丁是由上述四种元素中两种或三种组成的化合物。已知:甲分子和乙、丙的阴离子都含18个电子,丁的阴、阳离子都含10个电子。它们之间有如图关系式,下列说法错误的是
A.R和X组成的化合物沸点一定低于R和Z组成化合物的沸点
B.Z的氧化物对应水化物不一定是强酸
C.R、X和Z三种元素组成的分子一定是极性分子
D.Y是所在周期中原子半径最大的元素
7.我国科学家分别攻克了两大催化技术,使合成“液态阳光”的两个生产环节效率大幅提高。“液态阳光”的合成示意图如下。下列说法不正确的是
A.甲醇的沸点远远高于乙烷,是由于甲醇分子之间存在氢键
B.催化剂通过降低相应反应的活化能使化学反应速率增大
C.理论上生成时,光催化过程至少转移电子
D.作燃料时,充分燃烧消耗
8.下列说法正确的是
A.键是由两个p电子“头碰头”重叠形成的
B.键是镜像对称,而键是轴对称
C.乙烷分子中的键全为键而乙烯分子中含有键和键
D.分子中含键而分子中除键外还含有键
9.工业上采用NH3和O2在钒基催化剂表面协同脱除烟气中的NO,一种反应过程如图所示,下列叙述正确的是
A.V5+—O-…H—N+H3是催化剂
B.整个过程中V的化合价未发生变化
C.反应过程中有极性键和非极性键的断裂和形成
D.总反应的化学方程式为4NH3+2O2+2NO=3N2+6H2O
10.在水中的溶解度很小,但在中的溶解度很大,这是因为
A.与的相对分子质量相差较小,而与的相对分子质量相差较大
B.与都是直线形分子,而不是直线形分子
C.和中都不含氢元素,而中含氢元素
D.和都是非极性分子,而是极性分子
11.下列各组物质性质的比较,结论正确的是
A.在中的溶解度: B.溶液酸性:
C.分子的极性: D.沸点:
12.现有处于不同主族的短周期元素A、B、C、D、E,其中B原子最外层电子数是电子层数的2倍,C是金属元素,0.1mol L-1的D的最高价氧化物对应的水化物溶液pH<1,五种元素的原子半径与原子序数的关系如图所示。下列说法错误的是
A.E的气态氢化物分子间易形成氢键
B.由C、E两种元素组成的化合物的水溶液能促进水的电离
C.最高价氧化物对应的水化物的酸性:B<D<E
D.B与D形成的化合物BD2是非极性分子
13.为正盐,其中P为价O为价,能将溶液中的还原为,可用于化学镀银。反应的离子方程式为。下列说法正确的是
A.上述反应中,氧化产物是
B.该反应氧化剂与还原剂的物质的量之比为1∶4
C.溶于水破坏离子键、极性共价键和非极性共价键
D.是三元酸,与反应可生成三种盐
14.普通碳纳米管是由石墨烯片层卷曲而成的一种纳米材料。我国科学家率先利用富勒烯(C60)作为客体分子进行组装,构建出新型碳纳米管片段,该材料具有显著的光电效应。下面说法正确的是
A.石墨与C60互为同位素
B.C60、金刚石均为共价晶体
C.石墨导电的原因是其晶体中自由移动的电子构成金属键
D.普通碳纳米管和C60中的C的杂化方式有相似之处
15.下列变化中,不存在化学键断裂的是
A.氯化氢气体溶于水 B.干冰升华
C.氯化钠固体溶于水 D.氢气在氧气中燃烧
二、填空题
16.共价键的形成过程
(1)氯化氢分子的形成过程
①H原子需获得____个电子达到稳定结构,Cl原子需获得___个电子达到稳定结构。
②H原子和Cl原子各提供____个电子组成____共用电子,使两原子最外电子层都达到_____并产生强烈的相互作用,从而形成了HCl分子。
(2)用电子式表示HCl的形成过程:____。
17.化学键
(1)概念:物质中_____的原子或离子之间存在的_____的_____叫做化学键。
(2)类型:_____和____是两种常见的化学键。
18.磷与氯气在一定条件下反应,可以生成PCl3、PCl5。
(1)写出磷原子的电子排布式:___________。
(2)PCl3分子中磷原子采用的杂化方式是___________,分子的空间构型为___________。
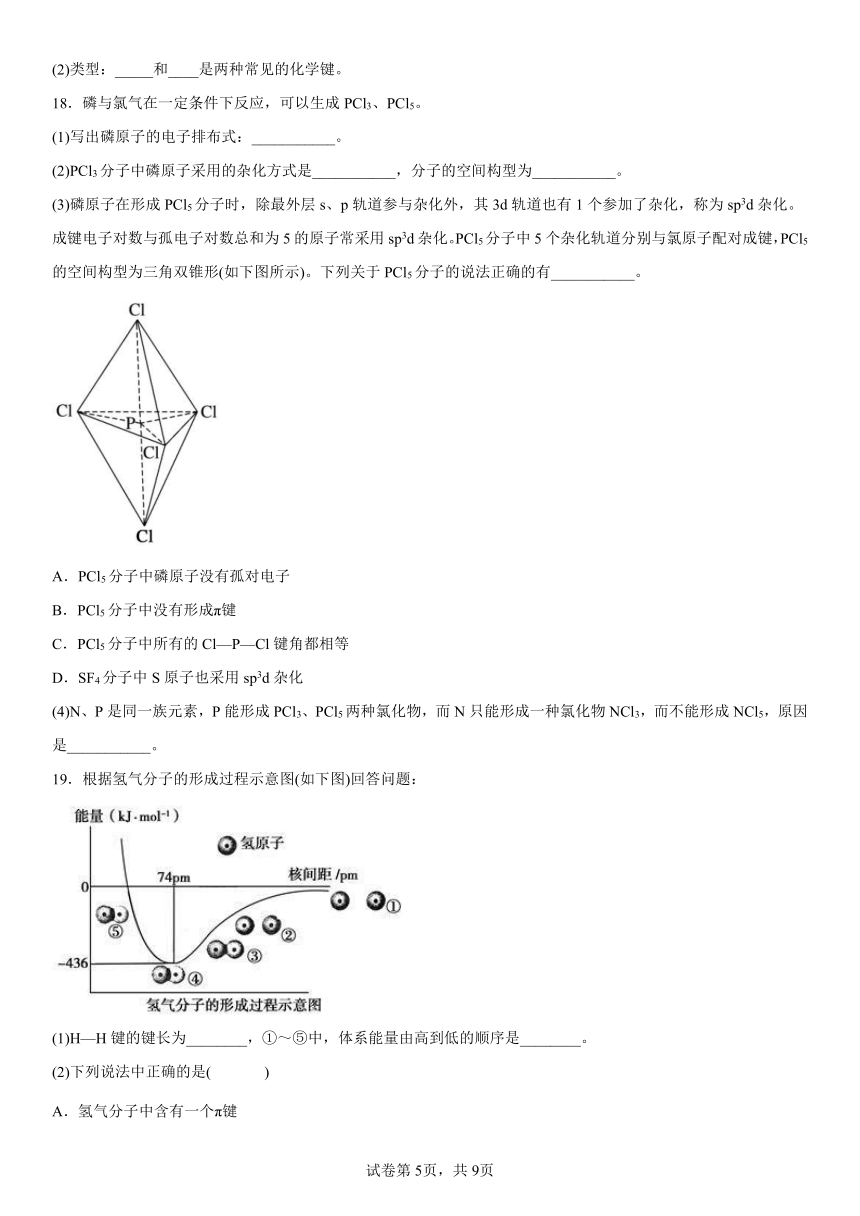
(3)磷原子在形成PCl5分子时,除最外层s、p轨道参与杂化外,其3d轨道也有1个参加了杂化,称为sp3d杂化。成键电子对数与孤电子对数总和为5的原子常采用sp3d杂化。PCl5分子中5个杂化轨道分别与氯原子配对成键,PCl5的空间构型为三角双锥形(如下图所示)。下列关于PCl5分子的说法正确的有___________。
A.PCl5分子中磷原子没有孤对电子
B.PCl5分子中没有形成π键
C.PCl5分子中所有的Cl—P—Cl键角都相等
D.SF4分子中S原子也采用sp3d杂化
(4)N、P是同一族元素,P能形成PCl3、PCl5两种氯化物,而N只能形成一种氯化物NCl3,而不能形成NCl5,原因是___________。
19.根据氢气分子的形成过程示意图(如下图)回答问题:
(1)H—H键的键长为________,①~⑤中,体系能量由高到低的顺序是________。
(2)下列说法中正确的是( )
A.氢气分子中含有一个π键
B.由①到④,电子在核间出现的几率增大
C.由④到⑤,必须消耗外界的能量
D.氢气分子中含有一个极性共价键
(3)几种常见化学键的键能如下表:
化学键 Si—O H—O O==O Si—Si Si—C
键能/kJ·mol-1 460 464 498 176 x
请回答下列问题:
①比较Si—Si键与Si—C键的键能大小:x________(填“>”、“<”或“=”)176。
②H2被称为21世纪人类最理想的燃料,而还有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。试计算:每千克H2燃烧(生成水蒸气)放出的热量约为________;每摩尔硅完全燃烧放出的热量约为________。
20.钙和铜合金可用作电解制钙的阴极电极材料,回答下列问题:
(1)基态铜原子的价电子排布式为_______。
(2)CaCO3高温分解可制得CaO。CaO与C在一定条件下可生成电石(CaC2),电石与水反应生成Ca(OH)2和一种4原子气体分子。
①写出电石与水反应的化学方程式_______;反应制得的气体中通常会含有硫化氢等杂质气体,可用_______吸收。
②CaCO3中阴离子的空间构型为_______。
③该气体分子中σ键与π键的数目之比为_______。
④写出2种与互为等电子体的分子的化学式_______。
(3)工业上电解CaCl2制Ca而不采用电解CaO的原因是_______。
(4)在碱性溶液中,缩二脲HN(CONH2)2与CuSO4反应得到一种特征紫色物质,其结构如图所示,该反应原理可用于检验蛋白质或其他含键的化合物。缩二脲分子中碳原子与氮原子的杂化类型分别为_______、_______。
21.NA为阿伏加德罗常数的值。下列说法正确的是___________。
A.1molCHCl3含有C-Cl键的数目为3NA
B.28gC2H4分子中含有的键数目为4NA
C.1mol[Cu(H2O)4]2+中配位键的个数为4NA
D.1molN2中,σ键的数目为3NA
E.3.9gNa2O2中含有的共价键的数目为0.1NA
F.CH2=CH2+H2CH3CH3,生成1mol乙烷时断裂的共价键总数为NA
G.32g环状S8()分子中含有的S-S键数为1NA
H.1molHC≡CH分子中所含σ键数为5NA
22.在建国70周年阅兵仪式上,“歼20”、“东风核导弹”等国之重器相继亮相,它们采用了大量合金材料.回答下列问题:
(1)早期战斗机主要采用铝合金,其中超硬铝属于系。
①第一电离能_______(填“>”、“<”或“=”)。
②已知金属锌晶体的堆积方式为六方最密堆积,则金属锌的配位数是_______。
③基态铜原子的价层电子排布式为_______。
(2)中期战斗机主要采用钛合金.按电子排布,钛元素位于元素周期表的____区。
(3)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成、,其中阴离子的立体构型为_______,S原子的_______杂化轨道与O原子的轨道形成_______键(填“”或“”)。
23.常见ABn型分子的极性
类型 实例 键的极性 空间构型 分子的极性
X2 H2、N2 ____ ____ ____
XY HCl、NO ____ ____ ____
XY2 (X2Y) CO2、CS2 ____ ____ ____
SO2 ____ ____ ____
H2O、H2S ____ ____ ____
XY3 BF3 ____ ____ ____
NH3 ____ ____ ____
XY4 CH4、CCl4 ____ ____ ____
24.几种主族元素在周期表中的位置如图。
族 周期 IA 0
1 ④ IIA IIIA IVA VA VIA VIIA
2 ⑤ ⑥
3 ① ③ ⑦
4 ② ⑧
根据上表回答下列问题:
(1)⑥元素的氢化物是_______(填化学式),_______(填结构式)。
(2)①③⑦三种元素原子半径由大到小的顺序是_______(用元素符号表示)。
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的离子电子式为_______,该元素在周期表中的位置是_______。
(4)①②③三种元素最高价氧化物对应水化物碱性最强的_______(填电子式)。
(5)①与水反应的离子方程式_______。
(6)⑦的非金属性强于⑧,下列表述中能证明这一事实的是_______(填字母)。
a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物对应的水化物的酸性强于⑧最高价氧化物对应的水化物的酸性
c.⑦的单质能将⑧从其钠盐溶液中置换出来
(7)④与⑤元素形成的分子可能是_______。
A. B. C.
25.(1)有下列四组混合物,请选择合适的分离方法进行分离。(填字母)
A.过滤 B.蒸发 C.分液 D.萃取 E.蒸馏 F.升华
①氯化钠溶液提取氯化钠晶体______。
②乙醚和苯的混合物______。(乙醚和苯沸点分别为34.6℃,80.1℃)
③水和溴苯的混合物______。
④氯化钠和碘的固体混合物______。
(2)请用下列10种物质的序号填空:只含有极性键的是______;既有离子键又有非极性键的是_____;既有离子键又有极性键的是_______。
①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2
(3)X、Y为前20号元素,能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,且X原子半径大于Y原子,其电子式为:___________;若XY2为共价化合物,且X、Y均为非金属元素,则XY2的结构式为:__________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.HF分子间存在氢键,HBr分子间存在分子间作用力,受热变成液体,克服的力不同,故错误;
B.氯化铵属于离子晶体,苯属于分子化合物,克服相互作用不同,故错误;
C.氯化钠属于离子化合物,溶于水破坏的离子键,氯化氢属于分子化合物,溶于水破坏共价键,故错误;
D.碘和冰属于分子化合物,分子之间为分子间作用力,受热变为气体,克服范德华力,故正确。
2.B
【分析】本题主要考查微粒间的相互作用力,比较简单,还有熔沸点高低的判断。
【详解】A.一般情况下物质熔点:原子晶体离子晶体分子晶体,金刚石是原子晶体,NaCl是离子晶体,、是分子晶体,分子间存在氢键,所以熔点大于,故A正确;
B.二氧化硅是原子晶体不是分子晶体,其化学式为,故B错误;
C.干冰是分子晶体,升华时破坏的是分子间作用力,分解时破坏的是化学键,故C正确;
D.氯化铵分子中存在离子键和共价键,是离子晶体,所以受热变为气体的过程中破坏了离子键和共价键,故D正确;
故选B。
3.A
【详解】A.NH3分子间能形成氢键,沸点高于同主族的其它氢化物,AsH3和PH3的结构相似,但不能形成氢键,相对分子质量越大,分子间作用力越强,分子的沸点越高,则沸点的大小顺序为应为NH3>AsH3>PH3,故A错误;
B.非金属元素的非金属性越强,最高价氧化物对应水化物的酸性越强,元素的非金属性的强弱顺序为Cl>S>Si,则酸性的强弱顺序为HClO4>H2SO4>H2SiO3,故B正确;
C.非金属元素的非金属性越强,简单氢化物的稳定性越强,元素的非金属性的强弱顺序为O>C>Si,则氢化物的稳定性为H2O>CH4>SiH4,故C正确;
D.同周期元素,从左到右原子半径依次减小,钠、镁、铝都为第三周期元素,则原子半径由大到小的顺序为Na>Mg>Al,故D正确;
故选A。
4.D
【分析】X、Y,Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,由结构可知,Z、Q的最外层有6个电子,Z为O,Q为S;Q和W的简单离子具有相同的电子层结构,W的原子序数最大,为K;Y形成4个共价键,X只能形成1个共价键,结合原子序数可知X为H,Y为C。
【详解】A.WZX为KOH,属于离子化合物,存在离子键和极性共价键;W2Q为K2S,属于离子化合物,只存在离子键,故A错误;
B.该物质中氢原子与碳原子形成一个共价键,氢原子最外层满足2电子的稳定结构,故B错误;
C.元素的非金属性越强,简单气态氢化物越稳定;而同一周期元素非金属性:O>C,所以简单气态氢化物的稳定性:Z>Y,故C错误;
D.W2Q2Z3为K2S2O3,在酸性条件下(如加入盐酸),发生歧化反应,生成氯化钾、硫单质、二氧化硫气体,因此看到有黄色浑浊和无色气体产生,故D正确;
故选D。
5.B
【详解】A.单键由1个σ键形成,双键由1个σ键和1个π键形成,一个甲基吡啶分子中有14个σ键,故A正确;
B.甲基吡啶中含有甲基,碳原子连接的4个原子形成四面体构型,所有原子不可能共面,故B错误;
C.2-吡啶甲酸中含有羧基,能与水形成氢键,沸点较高,故C正确;
D.2-吡啶羧酸中含有羧基,能与水形成氢键,在水中的溶解性大于甲基吡啶,故D正确;故选:B。
6.A
【分析】本题的切入点是甲分子含有18个电子,它可能是HCl、H2S、PH3、SiH4等,丁的阴、阳离子都含10个电子,且甲与丁连续反应,联系二元酸与碱的反应,容易想到H2S与NaOH的反应,即H2S+2NaOH=Na2S+2H2O,符合题给的转换关系和已知信息,故甲为H2S,乙为NaHS,丙为Na2S,丁为NaOH,由组成元素的原子序数大小关系知,R为H元素,X为O元素,Y为Na元素,Z为S元素。
【详解】A.H2O和H2O2分子间存在氢键,沸点高于H2S,故A错误;
B.H2SO3是弱酸,H2SO4是强酸,故B正确;
C.H2SO3、H2SO4等分子都是共价化合物,属于极性分子,故C正确;
D.在第三周期的主族元素中,Na原子半径最大,故D正确;
故选A。
7.C
【分析】由合成示意图可知H2O在催化剂①和光照条件下生成H2,然后H2和CO2在催化剂②催化下生成甲醇。
【详解】A.甲醇中存在醇羟基,能够形成氢键,所以甲醇的沸点远远高于乙烷,是由于甲醇分子之间存在氢键,A正确;
B.催化剂可以降低相应反应的活化能,使化学反应速率加快,B正确;
C.由示意图可知H2和CO2在催化剂②催化下生成甲醇,CO2的化合价由+4价降低到甲醇的-2价,理论上生成时,光催化过程至少转移电子,C错误;
D. 根据CH3OH燃烧方程式2CH3OH+3O22CO2+4H2O,充分燃烧消耗的物质的量为1.5,D正确;
故答案为:C。
8.C
【详解】A.π键是由两个原子的p轨道“肩并肩”重叠形成的,故A错误;
B.σ键是轴对称,而π键是镜面对称,故B错误;
C.乙烷分子的结构简式为CH3CH3,分子中全为σ键,而乙烯分子的结构简式为CH2=CH2,分子中含σ键和π键,故C正确;
D.H2分子、Cl2分子中的共价键都为单键,分子中只含σ键,故D错误;
故答案:C。
9.C
【详解】A.由转化示意图知,V5+—O-…H—N+H3是中间产物,A错误;
B. 由示意图知,氧气转化为水的过程中,含钒物质中V元素由+4升高到+5,被氧化了,另外也存在着含钒物质中V元素由+5降低到+4,被还原了,B错误;
C.反应过程中存在微粒转变为氮气、水和, N-N键、氮气中氮氮三键为非极性键、N=O、H-O等不同元素之间形成的为极性键,则有极性键和非极性键的断裂和形成,C正确;
D. 由转化示意图知,在催化剂作用下,总反应的化学方程式为4NH3+O2+4NO=4N2+6H2O,D错误;
答案选C。
10.D
【分析】根据相似相溶原理,极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂。
【详解】A.因分子为极性分子,、分子均为非极性分子,根据“相似相溶”规律,在水中的溶解度很小,但在中的溶解度很大,与相对分子质量无关,故A错误;
B.与相似相溶有关,与分子构型无关,故B错误;
C.与相似相溶有关,与所含元素无关,故C错误;
D.根据相似相溶原理,属于非极性溶剂,属于极性溶剂,碘单质属于非极性分子,易溶于非极性溶剂,故D正确;
故选D。
11.D
【详解】A.CS2是非极性溶剂,故在CS2中的溶解度:CCl4>H2O,A错误;
B.F原子电负性大于Cl,所以溶液酸性CF3COOH>CCl3COOH,故B错误;
C.BCl3空间构型为平面三角形,为非极性分子;NCl3分子空间构型为三角锥,NCl3是极性分子,分子极性,故C错误;
D.形成分子间氢键,形成分子内氢键,所以沸点>,故D正确;
选D。
12.A
【分析】0.1mol L-1的D的最高价氧化物对应的水化物溶液pH<1,则D的最高价含氧酸为二元强酸,由此得出D为S,E为Cl;B原子最外层电子数是电子层数的2倍,则B为C,A为H;C是金属元素,则C是Mg或Al。从而得出A、B、C、D、E分别为H、C、Mg或Al、S、Cl。
【详解】A.E的气态氢化物为HCl,由于Cl原子半径较大,所以HCl分子间不易形成氢键,A错误;
B.由C、E两种元素组成的化合物为MgCl2或AlCl3,它们都是强酸弱碱盐,在水溶液中都能发生水解,从而促进水的电离,B正确;
C.B、D、E分别为C、S、Cl,非金属性依次增强,则最高价氧化物对应水化物的酸性:H2CO3<H2SO4<HClO4,C正确;
D.B与D形成的化合物为CS2,是由极性键构成的非极性分子,D正确;
故选A。
13.A
【详解】A.该反应中中P失电子被氧化生成H3PO4,氧化产物为H3PO4,A正确;
B.该反应中还原剂为,氧化剂为Ag+,氧化剂和还原剂的物质的量之比为4:1,B错误;
C.NaH2PO2溶于水生成Na+和,破坏离子键,C错误;
D.H3PO2为一元酸,与NaOH反应生成一种盐,D错误;
故答案选A。
14.D
【详解】A.石墨与C60为C元素的不同单质,二者互为同素异形体,A错误;
B.C60是由分子构成的分子晶体,B错误;
C.金属阳离子与自由电子之间的强烈的相互作用所形成的化学键叫金属键,石墨中没有金属阳离子,不可能构成金属键,C错误;
D.普通碳纳米管是由石墨烯片层卷曲而成的一种纳米材料,所以具有六元环结构,C原子采取sp2杂化,C60中也有六元环结构,C原子采取sp2杂化,D正确;
综上所述答案为D。
15.B
【详解】A.氯化氢溶于水后,在水分子的作用下电离出阴阳离子,所以有化学键的断裂,A不符合题意;
B.干冰升华,只是物质状态的变化,化学键没有断裂,B符合题意;
C.氯化钠固体溶于水,在水分子的作用下电离出阴阳离子,所以有化学键的断裂,C不符合题意;
D.氢气在氯气中燃烧发生化学反应,有化学键的断裂和形成,D不符合题意;
故选:B。
16.(1) 1 1 1 一对 稳定结构
(2)
【解析】略
17.(1) 相邻 强烈 相互作用
(2) 离子键 共价键
【解析】略
18.(1)1s22s22p63s23p3
(2) sp3杂化 三角锥形
(3)ABD
(4)N原子最外层无d轨道,不能发生sp3d杂化,故无NCl5
【解析】(1)
P原子序数为15,结合能量最低原则、泡利不相容原理和洪特规则写出核外电子排布式为:1s22s22p63s23p3;
(2)
PCl3分子中磷原子的价层电子对数=3+=4,含有1对孤电子对,VSEPR模型为四面体,所以杂化类型为sp3,空间构型为三角锥形;
(3)
A.PCl5中,P化合价为+5,则5+5=10,磷原子没有孤对电子,故A正确;
B.PCl5分子中是由P-Cl单键构成的,没有π键,故B正确;
C.PCl5分子上下两个顶点与中心P原子形成的键角为180°,中间为平面三角形,构成三角形的键角为120°,顶点与平面形成的键角为90°,所以键角Cl-P-Cl有90°、120°、180°几种,键角不相等,故C错误;
D.SF4分子中S原子成键电子对数为3,孤电子对数为2,两者总和为5,由题意知采用sp3d杂化,故D正确;
故选:ABD;
(4)
因为氮的最外层电子排布式为2s22p3,该层没有d轨道,磷的最外层电子排布式为3s23p3,该层外面还有3d空轨道可以参与成键,所以有PCl5没有NCl5,故答案为:N原子最外层无d轨道,不能发生sp3d杂化,故无NCl5。
19. 74 pm ①⑤②③④ BC > 121500 kJ 990 kJ
【详解】(1)可以直接从题图上有关数据得出,H—H键的键长为74 pm;体系能量由高到低的顺序是①⑤②③④。(2)氢气分子中含有1个σ键,A错;共价键的本质就是高概率地出现在原子间的电子与原子间的电性作用,B正确;④已经达到稳定状态,C正确;氢气分子中含有一个非极性键,D错。(3)①Si—Si键的键长比Si—C键的键长长、键能小。②由题图可知H—H键的键能为436 kJ·mol-1,每千克H2燃烧(生成水蒸气)放出的热量约为1 000 g ÷ 2 g·mol-1 × (464 kJ·mol-1×2-436 kJ·mol-1-498 kJ·mol-1×)=121 500 kJ;每摩尔硅完全燃烧放出的热量约为460 kJ·mol-1×4 mol-498 kJ·mol-1×1 mol-176 kJ·mol-1×2 mol=990 kJ。
20.(1)3d104s1
(2) CaC2+2H2O=Ca(OH)2+C2H2↑ 硫酸铜溶液 平面三角形 3:2 CO、N2
(3)CaO熔点高于CaCl2,熔化时消耗能量高
(4) sp2 sp3
【解析】(1)
铜的原子序数为29,其基态原子的价电子排布式为:3d104s1。
(2)
①CaC2与水反应生成Ca(OH)2和一种4原子气体分子,该气体分子为C2H2,CaC2与水反应的化学方程式为:CaC2+2H2O=Ca(OH)2+C2H2↑,硫化氢能与硫酸铜溶液反应生成硫化铜沉淀,因此可用硫酸铜溶液吸收硫化氢。
②CaCO3中阴离子为CO,CO的中心原子价层电子对数为3+=3,采取sp2杂化,空间构型为平面三角形。
③该气体分子为C2H2,其结构式为H-C≡C-H,单键为σ键,三键为1个σ键、2个π键,则其中σ键与π键的数目之比为3:2。
④的原子数为2、价电子总数为10,依据同主族变换和左右移位法可知,与互为等电子体的分子的化学式为:CO、N2。
(3)
氧化钙熔点比氯化钙熔点高,熔融时要消耗更高能量,为减少成本,因此工业上电解CaCl2制Ca而不采用电解CaO。
(4)
缩二脲分子中碳为双键碳,采取sp2杂化,氮原子形成的均为单键,采取sp3杂化。
21.ACG
【详解】A.1个CHCl3分子中含有3个C-Cl键,微粒个数与物质的量成正比,故1molCHCl3含有3molC-Cl键,C-Cl键的数目为3NA,故A正确;
B.乙烯分子的结构式为,1个乙烯分子中含有5个键,28gC2H4的物质的量为1mol,所以28gC2H4分子中含有的键数目为5NA,故B错误;
C.1个[Cu(H2O)4]2+中含有4个配位键,1mol[Cu(H2O)4]2+含配位键的个数为4NA,故C正确;
D.1molN2中有1molσ键,故σ键的数目为NA,故D错误;
E.Na2O2的电子式为,含有1个共价键,3.9gNa2O2的物质的量为n(Na2O2)==0.05mol,故3.9gNa2O2中含有的共价键的数目为0.05NA,故E错误;
F.发生CH2=CH2+H2CH3CH3反应时,C=C中的一个C-C键和H-H键都断裂,故生成1mol乙烷时断裂的共价键总数为2NA,故F错误;
G.一个S8()分子中含有的S-S键数为8个,32gS8的物质的量为=mol,则含有的S-S键数为×8×NA=NA,故G正确;
H.HC≡CH中含有3个σ键和2个π键,所以1molHC≡CH分子中所含σ键数为3NA,故H错误;
故答案为:ACG。
22.(1) < 12
(2)d
(3) 正四面体 sp3
【解析】(1)
①Al、Mg为同周期元素,第一电离能从左到右呈增大趋势,但镁的最外成3s上为全满结构,铝原子3p轨道有一个电子,更容易失去电子,因此第一电离能Mg>Al,故答案为:<;
②金属锌晶体的堆积方式为六方最密堆积,六方最密堆积的配位数为12,故答案为:12;
③铜为29号元素,核外电子排布为:[Ar] ,价层电子排布式为,故答案为:;
(2)
钛元素为22号元素,位于第四周期IVB族,为d区元素,故答案为:d;
(3)
中心S的价电子对数为:,无孤对电子,离子为正四面体构型,中心S原子采用sp3杂化,与氧原子的p轨道头碰头形成键,故答案为:正四面体;sp3;;
23. 非极性键 直线形 非极性分子 极性键 直线形 极性分子 极性键 直线形 非极性分子 极性键 V形 极性分子 极性键 V形 极性分子 极性键 平面三角形 非极性分子 极性键 三角锥形 极性分子 极性键 正四面体 非极性分子
【分析】同种原子之间形成的共价键为非极性共价键,不同种原子之间形成的共价键为极性共价键,正电中心和负电中心重合的为非极性分子,正电中心和负电中心不重合的为极性分子。
【详解】同种原子之间形成的双原子分子为非极性键构成的非极性分子,空间结构为直线形,故答案为:非极性键;直线形;非极性分子;;
不同种原子之间形成的双原子分子为极性键构成的极性分子,空间结构为直线形,故答案为:极性键;直线形;极性分子;
CO2、CS2的中心原子均是C,均是直线形分子,故它们均是由极性键构成的非极性分子,故答案为:极性键;直线形;非极性分子;
SO2的中心S原子的价层电子对数为2+1=3,空间结构为V形,正电中心和负电中心不重合,为极性键构成的极性分子,故答案为:极性键;V形;极性分子;
H2O、H2S的空间结构均为V形,正电中心和负电中心不重合,为极性键构成的极性分子,故答案为:极性键;V形;极性分子;
BF3的中心B原子的价层电子对数为3+0=3,空间结构为平面三角形,正电中心和负电中心重合,为极性键构成的非极性分子,故答案为:极性键;平面三角形;非极性分子;
NH3的空间结构为三角锥形,正电中心和负电中心不重合,为极性键构成的极性分子,故答案为:极性键;三角锥形;极性分子;
CH4、CCl4的空间结构均为正四面体形,正电中心和负电中心重合,为极性键构成的非极性分子,故答案为:极性键;正四面体形;非极性分子。
【点睛】由极性键构成的多原子分子,若是结构对称,为非极性分子,若结构不对称,为极性分子。
24.(1)
(2)Na>Al>Cl
(3) Na+ 第三周期ⅠA族
(4)
(5)
(6)abc
(7)C
【分析】根据元素在周期表的位置,可推知:①是Na,②是K,③是Al,④是H,⑤是C,⑥是N,⑦是Cl,⑧是Br元素,然后结合元素周期律及物质的性质分析解答。
【详解】(1)⑥是N元素,其氢化物的化学式是,在该物质分子中N原子与3个H原子形成3个N-H键,的结构式是,故答案为:;;
(2)①是Na,③是Al,⑦是Cl,它们是同一周期元素,原子序数越大,原子半径就越小,则这三种元素的原子半径由大到小的顺序是:Na>Al>Cl,故答案为:Na>Al>Cl;
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,若原子最外层只有1个电子,则其电子层数是3,该元素的原子核外电子排布是2、8、1,该元素是Na元素,其离子的电子式为Na+,Na原子结构示意图为,则钠元素位于元素周期表第三周期第IA族,故答案为:Na+;第三周期ⅠA族;
(4)①是Na,②是K,③是Al,由于同一周期元素的金属性随原子序数的增大而减小;同一主族元素的金属性随原子序数的增大而增大,则三种元素的金属性强弱顺序为:K>Na>Al。元素的金属性越强,其最高价氧化物对应的水化物的碱性就越强,因此三种元素最高价氧化物对应水化物碱性最强的KOH,其电子式为,故答案为:;
(5)①是Na,Na与水反应产生NaOH、H2,反应的离子方程式为:,故答案为:;
(6)⑦是Cl,⑧是Br元素,二者是同一主族的元素,元素的非金属性Cl>Br。
a.元素的非金属性越强,其氢化物的稳定性就越强,元素的非金属性:Cl>Br,所以简单氢化物的稳定性:HCl>HBr,a正确;
b.元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。元素的非金属性:Cl>Br,所以酸性:HClO4>HBrO4,b正确;
c.元素的非金属性越强,其单质的氧化性就越强,活动性强的可以将活动性弱的从化合物中置换出来。由于元素的非金属性:Cl>Br,所以可以发生反应:Cl2+2NaBr=2NaCl+Br2,c正确;
故选abc。
(7)④是H,⑤是C,由于H原子核外只有1个电子,C原子最外层有4个电子,C原子可以与4个H原子形成的化合物分子CH4,使分子中各原子都达到稳定结构,该物质的分子的空间构型为正四面体,合理选项是C,故选C。
25. B E C F ⑥⑦⑨ ④ ③⑤ S=C=S
【分析】已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,X2+核外有18个电子,Y-有10个电子,则X为Ca,Y为F;若XY2为共价化合物,平均电子数约为13,则X为IVA族元素,为C;Y为VIA元素,为S。
【详解】(1)①蒸发氯化钠溶液即可得到氯化钠晶体,操作为蒸发;
②乙醚和苯的沸点不同,则分离两种混合物用蒸馏的方法;
③水和溴苯为互不相溶的两种液体,可用分液进行分离;
④碘加热易升华,而氯化钠加热不分解、不升华,可用升华方法分离氯化钠和碘的固体混合物;
(2)①O2只含有O=O,非极性共价键;
②H2只含有H-H非极性共价键;
③NH4NO3含有铵根离子与硝酸根离子间的离子键,又含有极性共价键;
④K2O2含有钾离子与过氧根离子间的离子键,又含有O-O非极性共价键;
⑤Ba(OH)2含有钡离子与氢氧根离子间的离子键,又含有O-H极性共价键;
⑥CH4只含有C-H极性共价键;
⑦CO2只含有C=O极性共价键;
⑧NaF只含有钠离子与氟离子间的离子键;
⑨NH3只含有N-H极性共价键;
⑩I2只含有I-I非极性共价键;
综上所述,只含有极性键的是⑥⑦⑨;既有离子键又有非极性键的是④;既有离子键又有极性键的是③⑤;
(3)已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,X2+核外有18个电子,Y-有10个电子,则X为Ca,Y为F,CaF2为离子化合物,电子式为;若XY2为共价化合物,平均电子数约为13,则X为IVA族元素,为C;Y为VIA元素,为S,该物质为CS2,结构式为S=C=S。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列物质发生变化时,所克服的粒子间相互作用完全相同的是
A.液态HF与液态HBr分别受热变为气体
B.氯化铵与苯分别受热变为气体
C.氯化钠与氯化氢分别溶解在水中
D.碘与干冰分别受热变为气体
2.下列说法不正确的是
A.金刚石、NaCl、、晶体的熔点依次降低
B.水晶、石英的主要成分都是二氧化硅,其分子式为
C.干冰加热易升华,但是却不易分解,说明化学键比分子间作用力要强
D.氯化铵受热变为气体的过程中破坏了离子键和共价键
3.下列相关数据或性质排列顺序不正确的是
A.沸点:AsH3>PH3>NH3 B.酸性:HClO4>H2SO4>H2SiO3
C.稳定性:H2O>CH4>SiH4 D.原子半径:Na>Mg>Al
4.一种用于合成治疗免疫疾病药物的物质,其结构如图所示,其中X、Y,Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述正确的是( )
A.WZX与W2Q化学键类型完全相同
B.此物质中各微粒都满足最外层8电子稳定结构
C.简单气态氢化物的稳定性:Z
5.2-吡啶甲酸是一种稀土碱金属整合物,其合成原理如下图。下列说法错误的是
(甲基吡啶)(2-吡啶甲酸)
A.一个甲基吡啶分子中有14个σ键 B.甲基吡啶中所有原子可能共平面
C.沸点:2-吡啶甲酸大于甲基吡啶 D.在水中的溶解性:2-吡啶甲酸大于甲基吡啶
6.R、X、Y、Z是四种原子序数依次增大的短周期元素,甲、乙、丙、丁是由上述四种元素中两种或三种组成的化合物。已知:甲分子和乙、丙的阴离子都含18个电子,丁的阴、阳离子都含10个电子。它们之间有如图关系式,下列说法错误的是
A.R和X组成的化合物沸点一定低于R和Z组成化合物的沸点
B.Z的氧化物对应水化物不一定是强酸
C.R、X和Z三种元素组成的分子一定是极性分子
D.Y是所在周期中原子半径最大的元素
7.我国科学家分别攻克了两大催化技术,使合成“液态阳光”的两个生产环节效率大幅提高。“液态阳光”的合成示意图如下。下列说法不正确的是
A.甲醇的沸点远远高于乙烷,是由于甲醇分子之间存在氢键
B.催化剂通过降低相应反应的活化能使化学反应速率增大
C.理论上生成时,光催化过程至少转移电子
D.作燃料时,充分燃烧消耗
8.下列说法正确的是
A.键是由两个p电子“头碰头”重叠形成的
B.键是镜像对称,而键是轴对称
C.乙烷分子中的键全为键而乙烯分子中含有键和键
D.分子中含键而分子中除键外还含有键
9.工业上采用NH3和O2在钒基催化剂表面协同脱除烟气中的NO,一种反应过程如图所示,下列叙述正确的是
A.V5+—O-…H—N+H3是催化剂
B.整个过程中V的化合价未发生变化
C.反应过程中有极性键和非极性键的断裂和形成
D.总反应的化学方程式为4NH3+2O2+2NO=3N2+6H2O
10.在水中的溶解度很小,但在中的溶解度很大,这是因为
A.与的相对分子质量相差较小,而与的相对分子质量相差较大
B.与都是直线形分子,而不是直线形分子
C.和中都不含氢元素,而中含氢元素
D.和都是非极性分子,而是极性分子
11.下列各组物质性质的比较,结论正确的是
A.在中的溶解度: B.溶液酸性:
C.分子的极性: D.沸点:
12.现有处于不同主族的短周期元素A、B、C、D、E,其中B原子最外层电子数是电子层数的2倍,C是金属元素,0.1mol L-1的D的最高价氧化物对应的水化物溶液pH<1,五种元素的原子半径与原子序数的关系如图所示。下列说法错误的是
A.E的气态氢化物分子间易形成氢键
B.由C、E两种元素组成的化合物的水溶液能促进水的电离
C.最高价氧化物对应的水化物的酸性:B<D<E
D.B与D形成的化合物BD2是非极性分子
13.为正盐,其中P为价O为价,能将溶液中的还原为,可用于化学镀银。反应的离子方程式为。下列说法正确的是
A.上述反应中,氧化产物是
B.该反应氧化剂与还原剂的物质的量之比为1∶4
C.溶于水破坏离子键、极性共价键和非极性共价键
D.是三元酸,与反应可生成三种盐
14.普通碳纳米管是由石墨烯片层卷曲而成的一种纳米材料。我国科学家率先利用富勒烯(C60)作为客体分子进行组装,构建出新型碳纳米管片段,该材料具有显著的光电效应。下面说法正确的是
A.石墨与C60互为同位素
B.C60、金刚石均为共价晶体
C.石墨导电的原因是其晶体中自由移动的电子构成金属键
D.普通碳纳米管和C60中的C的杂化方式有相似之处
15.下列变化中,不存在化学键断裂的是
A.氯化氢气体溶于水 B.干冰升华
C.氯化钠固体溶于水 D.氢气在氧气中燃烧
二、填空题
16.共价键的形成过程
(1)氯化氢分子的形成过程
①H原子需获得____个电子达到稳定结构,Cl原子需获得___个电子达到稳定结构。
②H原子和Cl原子各提供____个电子组成____共用电子,使两原子最外电子层都达到_____并产生强烈的相互作用,从而形成了HCl分子。
(2)用电子式表示HCl的形成过程:____。
17.化学键
(1)概念:物质中_____的原子或离子之间存在的_____的_____叫做化学键。
(2)类型:_____和____是两种常见的化学键。
18.磷与氯气在一定条件下反应,可以生成PCl3、PCl5。
(1)写出磷原子的电子排布式:___________。
(2)PCl3分子中磷原子采用的杂化方式是___________,分子的空间构型为___________。
(3)磷原子在形成PCl5分子时,除最外层s、p轨道参与杂化外,其3d轨道也有1个参加了杂化,称为sp3d杂化。成键电子对数与孤电子对数总和为5的原子常采用sp3d杂化。PCl5分子中5个杂化轨道分别与氯原子配对成键,PCl5的空间构型为三角双锥形(如下图所示)。下列关于PCl5分子的说法正确的有___________。
A.PCl5分子中磷原子没有孤对电子
B.PCl5分子中没有形成π键
C.PCl5分子中所有的Cl—P—Cl键角都相等
D.SF4分子中S原子也采用sp3d杂化
(4)N、P是同一族元素,P能形成PCl3、PCl5两种氯化物,而N只能形成一种氯化物NCl3,而不能形成NCl5,原因是___________。
19.根据氢气分子的形成过程示意图(如下图)回答问题:
(1)H—H键的键长为________,①~⑤中,体系能量由高到低的顺序是________。
(2)下列说法中正确的是( )
A.氢气分子中含有一个π键
B.由①到④,电子在核间出现的几率增大
C.由④到⑤,必须消耗外界的能量
D.氢气分子中含有一个极性共价键
(3)几种常见化学键的键能如下表:
化学键 Si—O H—O O==O Si—Si Si—C
键能/kJ·mol-1 460 464 498 176 x
请回答下列问题:
①比较Si—Si键与Si—C键的键能大小:x________(填“>”、“<”或“=”)176。
②H2被称为21世纪人类最理想的燃料,而还有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。试计算:每千克H2燃烧(生成水蒸气)放出的热量约为________;每摩尔硅完全燃烧放出的热量约为________。
20.钙和铜合金可用作电解制钙的阴极电极材料,回答下列问题:
(1)基态铜原子的价电子排布式为_______。
(2)CaCO3高温分解可制得CaO。CaO与C在一定条件下可生成电石(CaC2),电石与水反应生成Ca(OH)2和一种4原子气体分子。
①写出电石与水反应的化学方程式_______;反应制得的气体中通常会含有硫化氢等杂质气体,可用_______吸收。
②CaCO3中阴离子的空间构型为_______。
③该气体分子中σ键与π键的数目之比为_______。
④写出2种与互为等电子体的分子的化学式_______。
(3)工业上电解CaCl2制Ca而不采用电解CaO的原因是_______。
(4)在碱性溶液中,缩二脲HN(CONH2)2与CuSO4反应得到一种特征紫色物质,其结构如图所示,该反应原理可用于检验蛋白质或其他含键的化合物。缩二脲分子中碳原子与氮原子的杂化类型分别为_______、_______。
21.NA为阿伏加德罗常数的值。下列说法正确的是___________。
A.1molCHCl3含有C-Cl键的数目为3NA
B.28gC2H4分子中含有的键数目为4NA
C.1mol[Cu(H2O)4]2+中配位键的个数为4NA
D.1molN2中,σ键的数目为3NA
E.3.9gNa2O2中含有的共价键的数目为0.1NA
F.CH2=CH2+H2CH3CH3,生成1mol乙烷时断裂的共价键总数为NA
G.32g环状S8()分子中含有的S-S键数为1NA
H.1molHC≡CH分子中所含σ键数为5NA
22.在建国70周年阅兵仪式上,“歼20”、“东风核导弹”等国之重器相继亮相,它们采用了大量合金材料.回答下列问题:
(1)早期战斗机主要采用铝合金,其中超硬铝属于系。
①第一电离能_______(填“>”、“<”或“=”)。
②已知金属锌晶体的堆积方式为六方最密堆积,则金属锌的配位数是_______。
③基态铜原子的价层电子排布式为_______。
(2)中期战斗机主要采用钛合金.按电子排布,钛元素位于元素周期表的____区。
(3)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成、,其中阴离子的立体构型为_______,S原子的_______杂化轨道与O原子的轨道形成_______键(填“”或“”)。
23.常见ABn型分子的极性
类型 实例 键的极性 空间构型 分子的极性
X2 H2、N2 ____ ____ ____
XY HCl、NO ____ ____ ____
XY2 (X2Y) CO2、CS2 ____ ____ ____
SO2 ____ ____ ____
H2O、H2S ____ ____ ____
XY3 BF3 ____ ____ ____
NH3 ____ ____ ____
XY4 CH4、CCl4 ____ ____ ____
24.几种主族元素在周期表中的位置如图。
族 周期 IA 0
1 ④ IIA IIIA IVA VA VIA VIIA
2 ⑤ ⑥
3 ① ③ ⑦
4 ② ⑧
根据上表回答下列问题:
(1)⑥元素的氢化物是_______(填化学式),_______(填结构式)。
(2)①③⑦三种元素原子半径由大到小的顺序是_______(用元素符号表示)。
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的离子电子式为_______,该元素在周期表中的位置是_______。
(4)①②③三种元素最高价氧化物对应水化物碱性最强的_______(填电子式)。
(5)①与水反应的离子方程式_______。
(6)⑦的非金属性强于⑧,下列表述中能证明这一事实的是_______(填字母)。
a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物对应的水化物的酸性强于⑧最高价氧化物对应的水化物的酸性
c.⑦的单质能将⑧从其钠盐溶液中置换出来
(7)④与⑤元素形成的分子可能是_______。
A. B. C.
25.(1)有下列四组混合物,请选择合适的分离方法进行分离。(填字母)
A.过滤 B.蒸发 C.分液 D.萃取 E.蒸馏 F.升华
①氯化钠溶液提取氯化钠晶体______。
②乙醚和苯的混合物______。(乙醚和苯沸点分别为34.6℃,80.1℃)
③水和溴苯的混合物______。
④氯化钠和碘的固体混合物______。
(2)请用下列10种物质的序号填空:只含有极性键的是______;既有离子键又有非极性键的是_____;既有离子键又有极性键的是_______。
①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2
(3)X、Y为前20号元素,能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,且X原子半径大于Y原子,其电子式为:___________;若XY2为共价化合物,且X、Y均为非金属元素,则XY2的结构式为:__________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.HF分子间存在氢键,HBr分子间存在分子间作用力,受热变成液体,克服的力不同,故错误;
B.氯化铵属于离子晶体,苯属于分子化合物,克服相互作用不同,故错误;
C.氯化钠属于离子化合物,溶于水破坏的离子键,氯化氢属于分子化合物,溶于水破坏共价键,故错误;
D.碘和冰属于分子化合物,分子之间为分子间作用力,受热变为气体,克服范德华力,故正确。
2.B
【分析】本题主要考查微粒间的相互作用力,比较简单,还有熔沸点高低的判断。
【详解】A.一般情况下物质熔点:原子晶体离子晶体分子晶体,金刚石是原子晶体,NaCl是离子晶体,、是分子晶体,分子间存在氢键,所以熔点大于,故A正确;
B.二氧化硅是原子晶体不是分子晶体,其化学式为,故B错误;
C.干冰是分子晶体,升华时破坏的是分子间作用力,分解时破坏的是化学键,故C正确;
D.氯化铵分子中存在离子键和共价键,是离子晶体,所以受热变为气体的过程中破坏了离子键和共价键,故D正确;
故选B。
3.A
【详解】A.NH3分子间能形成氢键,沸点高于同主族的其它氢化物,AsH3和PH3的结构相似,但不能形成氢键,相对分子质量越大,分子间作用力越强,分子的沸点越高,则沸点的大小顺序为应为NH3>AsH3>PH3,故A错误;
B.非金属元素的非金属性越强,最高价氧化物对应水化物的酸性越强,元素的非金属性的强弱顺序为Cl>S>Si,则酸性的强弱顺序为HClO4>H2SO4>H2SiO3,故B正确;
C.非金属元素的非金属性越强,简单氢化物的稳定性越强,元素的非金属性的强弱顺序为O>C>Si,则氢化物的稳定性为H2O>CH4>SiH4,故C正确;
D.同周期元素,从左到右原子半径依次减小,钠、镁、铝都为第三周期元素,则原子半径由大到小的顺序为Na>Mg>Al,故D正确;
故选A。
4.D
【分析】X、Y,Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,由结构可知,Z、Q的最外层有6个电子,Z为O,Q为S;Q和W的简单离子具有相同的电子层结构,W的原子序数最大,为K;Y形成4个共价键,X只能形成1个共价键,结合原子序数可知X为H,Y为C。
【详解】A.WZX为KOH,属于离子化合物,存在离子键和极性共价键;W2Q为K2S,属于离子化合物,只存在离子键,故A错误;
B.该物质中氢原子与碳原子形成一个共价键,氢原子最外层满足2电子的稳定结构,故B错误;
C.元素的非金属性越强,简单气态氢化物越稳定;而同一周期元素非金属性:O>C,所以简单气态氢化物的稳定性:Z>Y,故C错误;
D.W2Q2Z3为K2S2O3,在酸性条件下(如加入盐酸),发生歧化反应,生成氯化钾、硫单质、二氧化硫气体,因此看到有黄色浑浊和无色气体产生,故D正确;
故选D。
5.B
【详解】A.单键由1个σ键形成,双键由1个σ键和1个π键形成,一个甲基吡啶分子中有14个σ键,故A正确;
B.甲基吡啶中含有甲基,碳原子连接的4个原子形成四面体构型,所有原子不可能共面,故B错误;
C.2-吡啶甲酸中含有羧基,能与水形成氢键,沸点较高,故C正确;
D.2-吡啶羧酸中含有羧基,能与水形成氢键,在水中的溶解性大于甲基吡啶,故D正确;故选:B。
6.A
【分析】本题的切入点是甲分子含有18个电子,它可能是HCl、H2S、PH3、SiH4等,丁的阴、阳离子都含10个电子,且甲与丁连续反应,联系二元酸与碱的反应,容易想到H2S与NaOH的反应,即H2S+2NaOH=Na2S+2H2O,符合题给的转换关系和已知信息,故甲为H2S,乙为NaHS,丙为Na2S,丁为NaOH,由组成元素的原子序数大小关系知,R为H元素,X为O元素,Y为Na元素,Z为S元素。
【详解】A.H2O和H2O2分子间存在氢键,沸点高于H2S,故A错误;
B.H2SO3是弱酸,H2SO4是强酸,故B正确;
C.H2SO3、H2SO4等分子都是共价化合物,属于极性分子,故C正确;
D.在第三周期的主族元素中,Na原子半径最大,故D正确;
故选A。
7.C
【分析】由合成示意图可知H2O在催化剂①和光照条件下生成H2,然后H2和CO2在催化剂②催化下生成甲醇。
【详解】A.甲醇中存在醇羟基,能够形成氢键,所以甲醇的沸点远远高于乙烷,是由于甲醇分子之间存在氢键,A正确;
B.催化剂可以降低相应反应的活化能,使化学反应速率加快,B正确;
C.由示意图可知H2和CO2在催化剂②催化下生成甲醇,CO2的化合价由+4价降低到甲醇的-2价,理论上生成时,光催化过程至少转移电子,C错误;
D. 根据CH3OH燃烧方程式2CH3OH+3O22CO2+4H2O,充分燃烧消耗的物质的量为1.5,D正确;
故答案为:C。
8.C
【详解】A.π键是由两个原子的p轨道“肩并肩”重叠形成的,故A错误;
B.σ键是轴对称,而π键是镜面对称,故B错误;
C.乙烷分子的结构简式为CH3CH3,分子中全为σ键,而乙烯分子的结构简式为CH2=CH2,分子中含σ键和π键,故C正确;
D.H2分子、Cl2分子中的共价键都为单键,分子中只含σ键,故D错误;
故答案:C。
9.C
【详解】A.由转化示意图知,V5+—O-…H—N+H3是中间产物,A错误;
B. 由示意图知,氧气转化为水的过程中,含钒物质中V元素由+4升高到+5,被氧化了,另外也存在着含钒物质中V元素由+5降低到+4,被还原了,B错误;
C.反应过程中存在微粒转变为氮气、水和, N-N键、氮气中氮氮三键为非极性键、N=O、H-O等不同元素之间形成的为极性键,则有极性键和非极性键的断裂和形成,C正确;
D. 由转化示意图知,在催化剂作用下,总反应的化学方程式为4NH3+O2+4NO=4N2+6H2O,D错误;
答案选C。
10.D
【分析】根据相似相溶原理,极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂。
【详解】A.因分子为极性分子,、分子均为非极性分子,根据“相似相溶”规律,在水中的溶解度很小,但在中的溶解度很大,与相对分子质量无关,故A错误;
B.与相似相溶有关,与分子构型无关,故B错误;
C.与相似相溶有关,与所含元素无关,故C错误;
D.根据相似相溶原理,属于非极性溶剂,属于极性溶剂,碘单质属于非极性分子,易溶于非极性溶剂,故D正确;
故选D。
11.D
【详解】A.CS2是非极性溶剂,故在CS2中的溶解度:CCl4>H2O,A错误;
B.F原子电负性大于Cl,所以溶液酸性CF3COOH>CCl3COOH,故B错误;
C.BCl3空间构型为平面三角形,为非极性分子;NCl3分子空间构型为三角锥,NCl3是极性分子,分子极性,故C错误;
D.形成分子间氢键,形成分子内氢键,所以沸点>,故D正确;
选D。
12.A
【分析】0.1mol L-1的D的最高价氧化物对应的水化物溶液pH<1,则D的最高价含氧酸为二元强酸,由此得出D为S,E为Cl;B原子最外层电子数是电子层数的2倍,则B为C,A为H;C是金属元素,则C是Mg或Al。从而得出A、B、C、D、E分别为H、C、Mg或Al、S、Cl。
【详解】A.E的气态氢化物为HCl,由于Cl原子半径较大,所以HCl分子间不易形成氢键,A错误;
B.由C、E两种元素组成的化合物为MgCl2或AlCl3,它们都是强酸弱碱盐,在水溶液中都能发生水解,从而促进水的电离,B正确;
C.B、D、E分别为C、S、Cl,非金属性依次增强,则最高价氧化物对应水化物的酸性:H2CO3<H2SO4<HClO4,C正确;
D.B与D形成的化合物为CS2,是由极性键构成的非极性分子,D正确;
故选A。
13.A
【详解】A.该反应中中P失电子被氧化生成H3PO4,氧化产物为H3PO4,A正确;
B.该反应中还原剂为,氧化剂为Ag+,氧化剂和还原剂的物质的量之比为4:1,B错误;
C.NaH2PO2溶于水生成Na+和,破坏离子键,C错误;
D.H3PO2为一元酸,与NaOH反应生成一种盐,D错误;
故答案选A。
14.D
【详解】A.石墨与C60为C元素的不同单质,二者互为同素异形体,A错误;
B.C60是由分子构成的分子晶体,B错误;
C.金属阳离子与自由电子之间的强烈的相互作用所形成的化学键叫金属键,石墨中没有金属阳离子,不可能构成金属键,C错误;
D.普通碳纳米管是由石墨烯片层卷曲而成的一种纳米材料,所以具有六元环结构,C原子采取sp2杂化,C60中也有六元环结构,C原子采取sp2杂化,D正确;
综上所述答案为D。
15.B
【详解】A.氯化氢溶于水后,在水分子的作用下电离出阴阳离子,所以有化学键的断裂,A不符合题意;
B.干冰升华,只是物质状态的变化,化学键没有断裂,B符合题意;
C.氯化钠固体溶于水,在水分子的作用下电离出阴阳离子,所以有化学键的断裂,C不符合题意;
D.氢气在氯气中燃烧发生化学反应,有化学键的断裂和形成,D不符合题意;
故选:B。
16.(1) 1 1 1 一对 稳定结构
(2)
【解析】略
17.(1) 相邻 强烈 相互作用
(2) 离子键 共价键
【解析】略
18.(1)1s22s22p63s23p3
(2) sp3杂化 三角锥形
(3)ABD
(4)N原子最外层无d轨道,不能发生sp3d杂化,故无NCl5
【解析】(1)
P原子序数为15,结合能量最低原则、泡利不相容原理和洪特规则写出核外电子排布式为:1s22s22p63s23p3;
(2)
PCl3分子中磷原子的价层电子对数=3+=4,含有1对孤电子对,VSEPR模型为四面体,所以杂化类型为sp3,空间构型为三角锥形;
(3)
A.PCl5中,P化合价为+5,则5+5=10,磷原子没有孤对电子,故A正确;
B.PCl5分子中是由P-Cl单键构成的,没有π键,故B正确;
C.PCl5分子上下两个顶点与中心P原子形成的键角为180°,中间为平面三角形,构成三角形的键角为120°,顶点与平面形成的键角为90°,所以键角Cl-P-Cl有90°、120°、180°几种,键角不相等,故C错误;
D.SF4分子中S原子成键电子对数为3,孤电子对数为2,两者总和为5,由题意知采用sp3d杂化,故D正确;
故选:ABD;
(4)
因为氮的最外层电子排布式为2s22p3,该层没有d轨道,磷的最外层电子排布式为3s23p3,该层外面还有3d空轨道可以参与成键,所以有PCl5没有NCl5,故答案为:N原子最外层无d轨道,不能发生sp3d杂化,故无NCl5。
19. 74 pm ①⑤②③④ BC > 121500 kJ 990 kJ
【详解】(1)可以直接从题图上有关数据得出,H—H键的键长为74 pm;体系能量由高到低的顺序是①⑤②③④。(2)氢气分子中含有1个σ键,A错;共价键的本质就是高概率地出现在原子间的电子与原子间的电性作用,B正确;④已经达到稳定状态,C正确;氢气分子中含有一个非极性键,D错。(3)①Si—Si键的键长比Si—C键的键长长、键能小。②由题图可知H—H键的键能为436 kJ·mol-1,每千克H2燃烧(生成水蒸气)放出的热量约为1 000 g ÷ 2 g·mol-1 × (464 kJ·mol-1×2-436 kJ·mol-1-498 kJ·mol-1×)=121 500 kJ;每摩尔硅完全燃烧放出的热量约为460 kJ·mol-1×4 mol-498 kJ·mol-1×1 mol-176 kJ·mol-1×2 mol=990 kJ。
20.(1)3d104s1
(2) CaC2+2H2O=Ca(OH)2+C2H2↑ 硫酸铜溶液 平面三角形 3:2 CO、N2
(3)CaO熔点高于CaCl2,熔化时消耗能量高
(4) sp2 sp3
【解析】(1)
铜的原子序数为29,其基态原子的价电子排布式为:3d104s1。
(2)
①CaC2与水反应生成Ca(OH)2和一种4原子气体分子,该气体分子为C2H2,CaC2与水反应的化学方程式为:CaC2+2H2O=Ca(OH)2+C2H2↑,硫化氢能与硫酸铜溶液反应生成硫化铜沉淀,因此可用硫酸铜溶液吸收硫化氢。
②CaCO3中阴离子为CO,CO的中心原子价层电子对数为3+=3,采取sp2杂化,空间构型为平面三角形。
③该气体分子为C2H2,其结构式为H-C≡C-H,单键为σ键,三键为1个σ键、2个π键,则其中σ键与π键的数目之比为3:2。
④的原子数为2、价电子总数为10,依据同主族变换和左右移位法可知,与互为等电子体的分子的化学式为:CO、N2。
(3)
氧化钙熔点比氯化钙熔点高,熔融时要消耗更高能量,为减少成本,因此工业上电解CaCl2制Ca而不采用电解CaO。
(4)
缩二脲分子中碳为双键碳,采取sp2杂化,氮原子形成的均为单键,采取sp3杂化。
21.ACG
【详解】A.1个CHCl3分子中含有3个C-Cl键,微粒个数与物质的量成正比,故1molCHCl3含有3molC-Cl键,C-Cl键的数目为3NA,故A正确;
B.乙烯分子的结构式为,1个乙烯分子中含有5个键,28gC2H4的物质的量为1mol,所以28gC2H4分子中含有的键数目为5NA,故B错误;
C.1个[Cu(H2O)4]2+中含有4个配位键,1mol[Cu(H2O)4]2+含配位键的个数为4NA,故C正确;
D.1molN2中有1molσ键,故σ键的数目为NA,故D错误;
E.Na2O2的电子式为,含有1个共价键,3.9gNa2O2的物质的量为n(Na2O2)==0.05mol,故3.9gNa2O2中含有的共价键的数目为0.05NA,故E错误;
F.发生CH2=CH2+H2CH3CH3反应时,C=C中的一个C-C键和H-H键都断裂,故生成1mol乙烷时断裂的共价键总数为2NA,故F错误;
G.一个S8()分子中含有的S-S键数为8个,32gS8的物质的量为=mol,则含有的S-S键数为×8×NA=NA,故G正确;
H.HC≡CH中含有3个σ键和2个π键,所以1molHC≡CH分子中所含σ键数为3NA,故H错误;
故答案为:ACG。
22.(1) < 12
(2)d
(3) 正四面体 sp3
【解析】(1)
①Al、Mg为同周期元素,第一电离能从左到右呈增大趋势,但镁的最外成3s上为全满结构,铝原子3p轨道有一个电子,更容易失去电子,因此第一电离能Mg>Al,故答案为:<;
②金属锌晶体的堆积方式为六方最密堆积,六方最密堆积的配位数为12,故答案为:12;
③铜为29号元素,核外电子排布为:[Ar] ,价层电子排布式为,故答案为:;
(2)
钛元素为22号元素,位于第四周期IVB族,为d区元素,故答案为:d;
(3)
中心S的价电子对数为:,无孤对电子,离子为正四面体构型,中心S原子采用sp3杂化,与氧原子的p轨道头碰头形成键,故答案为:正四面体;sp3;;
23. 非极性键 直线形 非极性分子 极性键 直线形 极性分子 极性键 直线形 非极性分子 极性键 V形 极性分子 极性键 V形 极性分子 极性键 平面三角形 非极性分子 极性键 三角锥形 极性分子 极性键 正四面体 非极性分子
【分析】同种原子之间形成的共价键为非极性共价键,不同种原子之间形成的共价键为极性共价键,正电中心和负电中心重合的为非极性分子,正电中心和负电中心不重合的为极性分子。
【详解】同种原子之间形成的双原子分子为非极性键构成的非极性分子,空间结构为直线形,故答案为:非极性键;直线形;非极性分子;;
不同种原子之间形成的双原子分子为极性键构成的极性分子,空间结构为直线形,故答案为:极性键;直线形;极性分子;
CO2、CS2的中心原子均是C,均是直线形分子,故它们均是由极性键构成的非极性分子,故答案为:极性键;直线形;非极性分子;
SO2的中心S原子的价层电子对数为2+1=3,空间结构为V形,正电中心和负电中心不重合,为极性键构成的极性分子,故答案为:极性键;V形;极性分子;
H2O、H2S的空间结构均为V形,正电中心和负电中心不重合,为极性键构成的极性分子,故答案为:极性键;V形;极性分子;
BF3的中心B原子的价层电子对数为3+0=3,空间结构为平面三角形,正电中心和负电中心重合,为极性键构成的非极性分子,故答案为:极性键;平面三角形;非极性分子;
NH3的空间结构为三角锥形,正电中心和负电中心不重合,为极性键构成的极性分子,故答案为:极性键;三角锥形;极性分子;
CH4、CCl4的空间结构均为正四面体形,正电中心和负电中心重合,为极性键构成的非极性分子,故答案为:极性键;正四面体形;非极性分子。
【点睛】由极性键构成的多原子分子,若是结构对称,为非极性分子,若结构不对称,为极性分子。
24.(1)
(2)Na>Al>Cl
(3) Na+ 第三周期ⅠA族
(4)
(5)
(6)abc
(7)C
【分析】根据元素在周期表的位置,可推知:①是Na,②是K,③是Al,④是H,⑤是C,⑥是N,⑦是Cl,⑧是Br元素,然后结合元素周期律及物质的性质分析解答。
【详解】(1)⑥是N元素,其氢化物的化学式是,在该物质分子中N原子与3个H原子形成3个N-H键,的结构式是,故答案为:;;
(2)①是Na,③是Al,⑦是Cl,它们是同一周期元素,原子序数越大,原子半径就越小,则这三种元素的原子半径由大到小的顺序是:Na>Al>Cl,故答案为:Na>Al>Cl;
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,若原子最外层只有1个电子,则其电子层数是3,该元素的原子核外电子排布是2、8、1,该元素是Na元素,其离子的电子式为Na+,Na原子结构示意图为,则钠元素位于元素周期表第三周期第IA族,故答案为:Na+;第三周期ⅠA族;
(4)①是Na,②是K,③是Al,由于同一周期元素的金属性随原子序数的增大而减小;同一主族元素的金属性随原子序数的增大而增大,则三种元素的金属性强弱顺序为:K>Na>Al。元素的金属性越强,其最高价氧化物对应的水化物的碱性就越强,因此三种元素最高价氧化物对应水化物碱性最强的KOH,其电子式为,故答案为:;
(5)①是Na,Na与水反应产生NaOH、H2,反应的离子方程式为:,故答案为:;
(6)⑦是Cl,⑧是Br元素,二者是同一主族的元素,元素的非金属性Cl>Br。
a.元素的非金属性越强,其氢化物的稳定性就越强,元素的非金属性:Cl>Br,所以简单氢化物的稳定性:HCl>HBr,a正确;
b.元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。元素的非金属性:Cl>Br,所以酸性:HClO4>HBrO4,b正确;
c.元素的非金属性越强,其单质的氧化性就越强,活动性强的可以将活动性弱的从化合物中置换出来。由于元素的非金属性:Cl>Br,所以可以发生反应:Cl2+2NaBr=2NaCl+Br2,c正确;
故选abc。
(7)④是H,⑤是C,由于H原子核外只有1个电子,C原子最外层有4个电子,C原子可以与4个H原子形成的化合物分子CH4,使分子中各原子都达到稳定结构,该物质的分子的空间构型为正四面体,合理选项是C,故选C。
25. B E C F ⑥⑦⑨ ④ ③⑤ S=C=S
【分析】已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,X2+核外有18个电子,Y-有10个电子,则X为Ca,Y为F;若XY2为共价化合物,平均电子数约为13,则X为IVA族元素,为C;Y为VIA元素,为S。
【详解】(1)①蒸发氯化钠溶液即可得到氯化钠晶体,操作为蒸发;
②乙醚和苯的沸点不同,则分离两种混合物用蒸馏的方法;
③水和溴苯为互不相溶的两种液体,可用分液进行分离;
④碘加热易升华,而氯化钠加热不分解、不升华,可用升华方法分离氯化钠和碘的固体混合物;
(2)①O2只含有O=O,非极性共价键;
②H2只含有H-H非极性共价键;
③NH4NO3含有铵根离子与硝酸根离子间的离子键,又含有极性共价键;
④K2O2含有钾离子与过氧根离子间的离子键,又含有O-O非极性共价键;
⑤Ba(OH)2含有钡离子与氢氧根离子间的离子键,又含有O-H极性共价键;
⑥CH4只含有C-H极性共价键;
⑦CO2只含有C=O极性共价键;
⑧NaF只含有钠离子与氟离子间的离子键;
⑨NH3只含有N-H极性共价键;
⑩I2只含有I-I非极性共价键;
综上所述,只含有极性键的是⑥⑦⑨;既有离子键又有非极性键的是④;既有离子键又有极性键的是③⑤;
(3)已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,X2+核外有18个电子,Y-有10个电子,则X为Ca,Y为F,CaF2为离子化合物,电子式为;若XY2为共价化合物,平均电子数约为13,则X为IVA族元素,为C;Y为VIA元素,为S,该物质为CS2,结构式为S=C=S。
答案第1页,共2页
答案第1页,共2页
