第一章《原子结构与性质》强化基础(含解析)2022-2023学年下学期高二 化学人教版(2019)选择性必修2
文档属性
| 名称 | 第一章《原子结构与性质》强化基础(含解析)2022-2023学年下学期高二 化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 542.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-30 20:42:38 | ||
图片预览




文档简介
第一章《原子结构与性质》强化基础
一、单选题
1.我国嫦娥五号探测器带回1.731的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素W、X、Y、Z,原子序数依次增大,W元素基态原子2p能级仅有一对成对电子。基态X原子的价电子排布式为。基态Z元素原子最外电子层上s、p电子数相等,下列结论正确的是
A.原子半径大小顺序为XB.第一电离能大小顺序为XC.电负性大小顺序为XD.最高正化合价大小顺序为X2.如图为元素周期表的一部分,X、Y、Z 代表 3 种不同的元素,以下判断不正确的是( )
A.原子序数:Z>X B.X 的核内质子数为 8
C.Y 和X 化学性质相似 D.Y 处于第二周期
3.下列各组元素中,属于同一周期的是
A.Na、Al B. C、Cl C. C.N、Mg D.O、S
4.核外电子的能量不仅与电子所处的能层、能级有关,还与核外电子的数目及核电荷数有关。氩原子与硫离子的核外电子排布相同,都是1s22s22p63s23p6。下列说法中正确的是
A.两粒子的1s能级上电子的能量相同
B.两粒子的3p能级上的电子离核的距离相同
C.两粒子的电子发生跃迁时,产生的光谱不同
D.两粒子都达8电子稳定结构,化学性质相同
5.下列叙述正确的是
A.同一周期元素的原子,半径越小越容易失去电子
B.周期表中所有元素都是从自然界中发现的,过渡元素都是金属元素
C.非金属元素形成的共价化合物中,原子的最外层都达到8电子稳定结构
D.IA族与VIIA族元素间可形成共价化合物或离子化合物
6.化合物A由原子序数依次增大的三种短周期元素X、Y、Z组成,其结构式如图 ,是一种绿色生态杀菌剂。已知Z的常见单质在常温常压下为气态。下列叙述正确的是
A.元素Y位于元素周期表第二周期第VIA族
B.该化合物中Z的化合价均呈-2 价
C.元素的非金属性:Y>Z>X
D.Z的简单阴离子半径比Na+半径大
7.下列有关化学用语的说法不正确的是
A.中子数为7的碳原子: B.氯乙烯的结构简式:CH3CH2Cl
C.羟基的电子式: D.乙酸分子的空间填充模型:
8.下列电子层中,能量比M层高的是
A.L层 B.K层 C.N层 D.G层
9.下列说法错误的是
A.ns电子的能量可能低于(n-1)p电子的能量
B.6C的电子排布式为,违背了洪特规则
C.电子排布式(21Sc)1s22s22p63s23p63d3,违背了能量最低原理
D.电子排布式(22Ti)1s22s22p63s23p10,违背了泡利原理
10.2019年三场大火:巴西亚马孙大火,美国加州大火,澳洲大火。其中澳洲大火面积最大,火势最猛。原因是干燥的地面,加上澳洲特有的物种桉树富含油脂,一旦燃烧起来,不易熄灭。下列有关油脂(C57H110O6)的说法正确的是
A.由三种元素构成 B.所占元素质量分数最大的是氢元素
C.油脂均为固态 D.有些脂肪酸是人体必需的,但人体内却不能合成
11.下列说法中正确的是
A.所有非金属元素都分布在p区
B.最外层电子数为2的元素都分布在s区
C.元素周期表中第ⅢB族到第ⅡB族10个纵列的元素都是金属元素
D.同一主族元素从上到下,金属性依次减弱
12.元素X、Y、Z在周期表中的相对位置如表所示。已知Y元素原子的价层电子排布为,则下列说法不正确的是
X
Y
Z
A.X元素原子的价层电子排布为
B.Y元素在周期表的第三周期ⅥA族
C.X元素所在周期所含非金属元素种类最多
D.三种元素原子半径的大小顺序为:Z>Y>X
13.X、Y、Z三种元素位于周期表中同一周期,其最高价氧化物分别为酸性氧化物、碱性氧化物、两性氧化物,则这三种元素原子序数的大小顺序是
A.X>Y>Z B.Y>X>Z C.X>Z>Y D.Y>Z>X
14.下列轨道表示式正确且所表示的元素原子的能量处于最低状态的是
A. B.
C. D.
二、填空题
15.按要求写出电子排布式或轨道表示式。
(1)基态的电子排布式为______。
(2)基态P原子的价层电子排布式为______。
(3)的轨道表示式为______。
(4)第四周期中最外层仅有1个电子的所有基态原子的电子排布式为______。
16.I.自门捷列夫发现元素周期律以来,人类对自然的认识程度逐步加深,元素周期表中的成员数目不断增加。回答下列问题:
(1)2016年IUPAC确认了四种新元素,其中一种为,中文为“镆”。元素可由反应得到。该元素的质子数为_____,与互为_____。
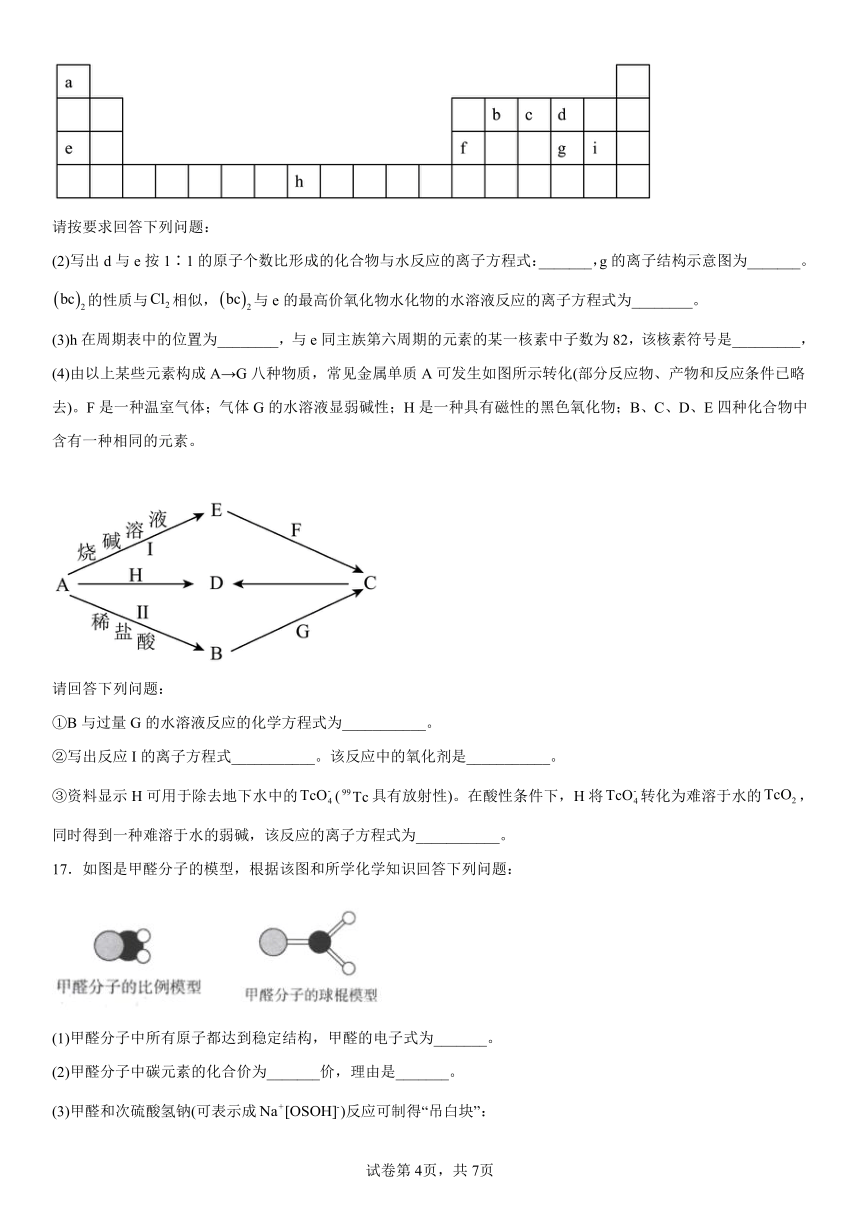
II.如图是元素周期表的一部分,其中每个字母代表对应的一种元素。
请按要求回答下列问题:
(2)写出d与e按1∶1的原子个数比形成的化合物与水反应的离子方程式:_______,g的离子结构示意图为_______。的性质与相似,与e的最高价氧化物水化物的水溶液反应的离子方程式为________。
(3)h在周期表中的位置为________,与e同主族第六周期的元素的某一核素中子数为82,该核素符号是_________,
(4)由以上某些元素构成A→G八种物质,常见金属单质A可发生如图所示转化(部分反应物、产物和反应条件已略去)。F是一种温室气体;气体G的水溶液显弱碱性;H是一种具有磁性的黑色氧化物;B、C、D、E四种化合物中含有一种相同的元素。
请回答下列问题:
①B与过量G的水溶液反应的化学方程式为___________。
②写出反应I的离子方程式___________。该反应中的氧化剂是___________。
③资料显示H可用于除去地下水中的(具有放射性)。在酸性条件下,H将转化为难溶于水的,同时得到一种难溶于水的弱碱,该反应的离子方程式为___________。
17.如图是甲醛分子的模型,根据该图和所学化学知识回答下列问题:
(1)甲醛分子中所有原子都达到稳定结构,甲醛的电子式为_______。
(2)甲醛分子中碳元素的化合价为_______价,理由是_______。
(3)甲醛和次硫酸氢钠(可表示成)反应可制得“吊白块”:
反应类型为_______,常用甲醛浓溶液保存动物标本的原因是_______。
18.氟及其化合物在生产生活中被广泛使用,造福人类。
(1)氟在元素周期表中的位置是___________。
(2)氢氟酸具有刻蚀玻璃的特性,写出该反应的化学方程式____________。已知25℃时,氢氟酸的电离平衡常数Ka=3.6×10-4,若将0.01 mol·L-1的HF溶液与pH=12的NaOH溶液等体积混合,则溶液中离子浓度由大到小的顺序为_____。
(3)次氟酸(HOF)由科学家在1971年首次制得,次氟酸的电子式为_______。
(4)四氟肼(N2F4)用作高能燃料的氧化剂,1 mol N2F4分子中含有的共价键数目是________NA。N2F4气体可用Fe3+氧化二氟胺(HNF2)制得,写出该反应的离子方程式______________。
(5)六氟化铀(UF6)是铀的稳定气态化合物,用作核燃料,由U3O8制取UF6的三步反应原理如下:
①U3O8+H2 →UO2+H2O (未配平) ②UO2+4HF=UF4+2H2O ③UF4+ F2 = UF6
则下列说法正确的是 _____________。
A.反应①②③都是氧化还原反应
B.反应③中U元素被氧化
C.反应①中氧化剂和还原剂的物质的量之比为2:1
(6)六氟磷酸锂(LiPF6)是锂离子电池广泛使用的电解质。LiPF6与极少量水反应可生成POF3等三种含氟化合物,写出该反应的化学方程式:________。
19.(1)实验室可以用KMnO4制备氯气,反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
①该反应的氧化剂是____,氧化产物是_____,还原产物是____。
②当有15.8gKMnO4参加反应时,被氧化的HCl有___mol,标况下生成Cl2的体积为____L,有____mol电子转移。
(2)A的核电荷数为n,A2+和B3-的电子层结构相同,则B原子的质子数是__。
(3)在1H216O、2H217O、2H218O、1H35Cl、1H37Cl中,共存在__种原子,_种元素。
(4)将K(Al2Si3O9)(OH)改写为氧化物形式:____。
20.开发新型储氢材料是开发利用氢能的重要研究方向。
(1),是一种储氢材料,可由和反应制得。
①基态原子中,电子占据的最高能级符号为___________,原子核外电子有___________种空间运动状态。
②、B、H元素的电负性由大到小的排列顺序为___________。
(2)金属氢化物是具有良好发展前景的储氢材料。
①中,离子半径:___________(填“>”“=”或“<”),原因是___________。
②某储氢材料是短周期金属元素M的氢化物。M原子的部分电离能如表所示:
738 1451 7733 10540 13630
则M是___________(填元素名称)。下列状态的粒子中,电离出最外层一个电子所需能量最大的是___________(填字母)。
A. B. C. D.
(3)碳有很多同素异形体,就是其中一种,可用作储氢材料。已知金刚石为立体网状结构,其键的键长为,分子中键键长为,有同学据此认为的熔点高于金刚石,你认为是否正确?___________,阐述理由:___________。
21.黑火药在发生爆炸时,有可能发生如下的反应:16KNO3+8C+S8=8K2S+16NO2↑+8CO2↑。
(1)上述反应所涉及元素中,某元素易形成简单阳离子,其离子结构示意图是________;某元素原子核外电子中有三个未成对电子,请写出其原子最外层电子排布式_________;有两种元素最外层电子数相同,请写出其中原子序数较小的元素形成简单离子的电子式_________;发生氧化反应的元素,其原子核外电子的轨道表示式为_________。
(2)上述反应中,被还原的元素是______,氧化产物是________。
(3)请标出上述反应的电子转移方向和数目________。
22.(1)可正确表示原子轨道的是______。
A.2s B.2d C.3p D.3f
(2)如图是s能级、p能级的原子轨道图试回答问题:
①s能级的原子轨道呈______形,每个s能级有______个原子轨道;p能级的原子轨道分别相对于x、y、z轴______,每个p能级有______个原子轨道。
②s能级原子轨道、p能级原子轨道的半径与______有关,______越高,原子轨道半径越大。
23.向明矾溶液中逐滴加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,溶液的pH________7(填>、<、=),离子反应总方程式:________写出K元素的基态原子的电子排布式:________.
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【分析】W元素2p能级只有1对成对电子,则W原子对应电子排布式为:1s22s22p4,故W为O,X原子价电子排布式为ns2,其原子序数比W大,故X为Mg,由题意知,Y、Z两种元素与Mg在同一周期,都为第三周期,Z元素最外层s、p能级上电子数相等,则其排布式为:1s22s22p63s23p2,即Si元素,Y介于X、Z之间,故Y为Al。
【详解】A.一般,电子层数多半径大,电子层数相同,核电荷数大,半径小,故四种原子半径大小顺序为:O<Si<Al<Mg,A错误;
B.同周期从左往右,第一电离能呈现增大趋势,但第ⅡA和ⅤA价电子排布为稳定结构,故第一电离能比相邻元素要大,即四种元素第一电离能顺序为:Al<Mg<Si<O,B错误;
C.元素电负性周期性变化规律与非金属性一致,故四种元素电负性顺序为:Mg<Al<Si<O,C正确;
D.O元素无最高正价+6价,其最高正价为+2价,Mg、Al、Si最高正价依次为+2、+3、+4,D错误;
故答案选C。
2.D
【分析】根据元素在周期表中的相对位置可知X、Y、Z 分别是O、S、Cl,据此解答。
【详解】A.元素周期表是按原子序数递增的顺序排列的,原子序数:Z>X,故A选项说法正确。
B.X位于第2周期,位于氖元素之前的第二个,则X 的核内质子数为 8,故B选项说法正确。
C.Y 和X位于同一族,最外层电子数相同,Y 和X 化学性质相似,故C选项说法正确。
D.Y是S,位于第三周期,故D选项说法错误。
故答案选D。
3.A
【分析】原子结构中,具有相同电子层的原子,在同一周期,以此来解答。
【详解】A.Na、Al的原子结构中均有3个电子层,均位于第三周期,选项A选;
B.C、Cl分别在第二周期、第三周期,选项B不选;
C.N、Mg分别在第二周期、第三周期,选项C不选;
D.O、S分别在第二周期、第三周期,选项D不选;
答案选A。
【点睛】本题考查元素周期表的结构及应用,为高频考点,侧重元素位置的考查,注意把握原子的电子层数等于周期数的关系,熟悉常见元素的位置即可解答,题目难度不大。
4.C
【详解】A.Ar与S2-的原子核电荷数不同,1s能级上电子的能量不相同,A错误;
B.Ar与S2-的原子核电荷数不同,半径不同,3p能级上电子离核的距离不相同,B错误;
C.Ar与S2-的原子核电荷数不同,电子跃迁产生的光谱都不相同,C正确;
D.Ar与S2-的原子核电荷数不同,化学性质不相同,D错误;
故选C。
5.D
【详解】A.根据同周期元素性质递变规律判断,同一周期元素的原子,半径越小越容易得到电子,错误;
B.周期表中的元素有的是从自然界中发现的,有的元素是人造元素,错误;
C.非金属元素形成的共价化合物中,原子的最外层不一定都达到8电子稳定结构,如HCl中的氢原子最外层为2电子稳定结构,错误;
D.IA族与VIIA族元素间可形成共价化合物或离子化合物,如HCl为共价化合物,NaCl为离子化合物,正确;
答案选D。
6.D
【分析】杀菌剂通常具有强氧化性,根据结构中Z形成2条共价键、Y形成4条共价键、X形成1条共价键,可知X、Y、Z分别为H、C、O,该绿色生态杀菌剂为过氧乙酸CH3COOOH,据此可分析解答。
【详解】A.元素Y为碳,位于第二周期第IVA族,A选项错误;
B.该化合物中O的化合价有-2、-1,B选项错误;
C.三种元素的非金属性强弱顺序为:O>C>H,即Z>Y>X,C选项错误;
D.O2-和Na+的核外电子排布相同,核电荷数越大,离子半径越小,Na+半径比O2-小,D选项正确;
答案选D。
7.B
【详解】A.中子数为7的碳原子质量数为7+6=13,正确答案为:,A选项正确;
B.氯乙烯可看着是乙烯上的1个H被Cl取代的有机物,结构简式为:CH2=CHCl,B选项错误;
C.羟基不带电,所以H和O最外层电子数为1+6=7,所以电子式为:,C选项正确;
D.乙酸分子的比例模型:,连接正确,相对大小正确,D选项正确;
答案选B。
8.C
【分析】原子核外电子排布按其能量的高低分成七个能层,由里向外能量由低到高依次是K、L、M、N、O、P、Q,据此解答。
【详解】A.L层在M层里面,能量比M层低,故A不选;
B.K层在M层里面,能量比M层低,故B不选;
C.N层在M层外面,能量比M层高,故C选;
D.在原子核外电子排布中没有G层,故D不选。
故选C。
9.A
【详解】A.电子能量与能层和能级都有关,ns电子的能量一定高于(n-1)p电子的能量,故A错误;
B.p能级有3个轨道,2p能级有2个电子,电子应优先占据1轨道,且自旋方向相同,2px填充2个电子,违反了洪特规则,故B正确;
C.3d能级的能量高于4s能级,没有填充4s能级,就填充3d能级,违背能量最低原理,故C正确;
D.p能级有3个轨道,每个轨道最多容纳2个电子,且自旋方向相反,3p能级最多填充6个电子,而填充10个电子违反了泡利原理,故D正确;
故选A。
10.D
【详解】A.该油脂是由碳、氢、氧三种元素组成的,选项说法错误;
B.该油脂中,碳、氢、氧元素的质量比为:(12×57):(1×110):(16×6)=684:110:96,可见其中碳元素的质量分数最大,选项说法错误;
C.植物性油脂在常温下是液态的,选项说法错误;
D.有些脂肪酸是人体必需的,但人体内却不能合成,选项说法正确;
故答案选D。
11.C
【详解】A.非金属元素中的氢元素位于s区,其余非金属元素均分布在p区,故A错误;
B.最外层电子数为2的元素可能在s区(如Mg)、p区(如He)、ds区(如Zn)或d区(如Ti、Fe)等,故B错误;
C.从第ⅢB族到第ⅡB族共有10列,因为第Ⅷ族占有3列,副族元素均为金属元素,故C正确;
D.同主族元素从上到下,金属性逐渐增强,故D错误;
答案为C。
12.A
【分析】根据Y元素原子的价层电子排布为,n=3,故Y为S;则X为F,Z为As。
【详解】A.F原子的价电子排布式为2s22p5,故A错误;
B.S为16号元素,位于第三周期ⅥA族,故B正确;
C.F元素所在周期即第二周期非金属元素种类最多,故C正确;
D.一般,电子层数越多半径越大,故Z>Y>X,故D正确;
故选A。
13.C
【详解】同一周期从左到右金属性减弱、非金属性增强。其最高价氧化物从碱性氧化物过渡到酸性氧化物,三种元素原子序数的大小顺序是X>Z>Y,故C正确。
14.D
【详解】A.违背了构造原理,能量不处于最低,故A不符合题意;
B.违背了构造原理,能量不处于最低,故B不符合题意;
C.违背了洪特规则,能量不处于最低,故C不符合题意;
D.符合能量最低原理、泡利原理、洪特规则,能量处于最低,故D符合题意;
答案为D。
15. (或) 、、
【详解】(1)基态原子的电子排布式为,失去1个电子所得的电子排布式为或。故答案为:(或);
(2)P原子核外电子的最外层为第三层,且有5个电子,所以其价层电子排布式为。故答案为:;
(3)的电子排布式为,轨道表示式为。故答案为:;
(4)第四周期最外层只有1个电子的基态原子的最外层电子排布式为,此时、应已填满,轨道可能全空、半充满或全充满,即电子排布式为、、。故答案为:、、;
16.(1) 115 同位素
(2)
(3) 第四周期Ⅷ族
(4) H2O
【分析】根据元素在周期表中的位置,可知a是H元素、b是C元素、c是N元素、d是O元素、e是Na元素、f是Al元素、g是S元素、i是Cl元素、h是Fe元素。
由以上某些元素构成A→G八种物质,常见金属单质A既能与氢氧化钠反应又能与盐酸反应,A是Al单质,Al和氢氧化钠反应生成偏铝酸钠和氢气,E是偏铝酸钠;Al和盐酸反应生成氯化铝和氢气,B是氯化铝;气体G的水溶液显弱碱性,G是氨气,氯化铝和氨水反应生成氢氧化铝沉淀和氯化铵,C是氢氧化铝;偏铝酸钠溶液和二氧化碳反应 生成氢氧化铝,F是二氧化碳; H是一种具有磁性的黑色氧化物,H是四氧化三铁;铝和四氧化三铁反应生成铁和氧化铝,D是氧化铝。
(1)
元素可由反应得到,元素的质子数为95+20=115,与质子数相同、中子数不同,互为同位素;
(2)
O与Na按1∶1的原子个数比形成的化合物是Na2O2,Na2O2与水反应生成氢氧化钠和氧气,反应的离子方程式;S2-核外有18个电子,离子结构示意图为。Na的最高价氧化物水化物是氢氧化钠,氢氧化钠溶液和反应生成NaCN、NaCNO、H2O,反应的离子方程式为;
(3)
h是Fe元素,在周期表中的位置为第四周期Ⅷ族;与Na同主族第六周期的元素是55号Cs元素,某一核素中子数为82,则质量数是137,该核素符号是;
(4)
①氯化铝与过量氨水反应生成氢氧化铝沉淀和氯化铵,反应的化学方程式为;
②反应I是铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式是 。该反应中,水中氢元素化合价降低生成氢气,氧化剂是H2O。
③在酸性条件下,将转化为难溶于水的,同时得到一种难溶于水的弱碱是氢氧化铁,该反应的离子方程式为。
17. 0 氧的电负性比碳大,显负价,氢的电负性比碳小,显正价,根据化合价代数和为0,可知碳为0价 加成反应 甲醛能使蛋白质变性
【详解】(1)甲醛分子中所有原子都达到稳定结构,甲醛的电子式为,故答案为:;
(2)氧的电负性比碳大,显负价,氢的电负性比碳小,显正价,根据化合价代数和为0,可知碳为0,故答案为:0;氧的电负性比碳大,显负价,氢的电负性比碳小,显正价,根据化合价代数和为0,可知碳为0价;
(3)反应中键变成键,为加成反应,甲醛可使蛋白质变性,可用于动物标本的保存,故答案为:加成反应;甲醛能使蛋白质变性;
18. 第2周期ⅦA族 SiO2+4HF=SiF4↑+2H2O c(Na+)>c(F-)>c(OH-)>c(H+) 5 2HNF2 + 2Fe3+ = N2F4↑+ 2Fe2+ +2H+ B LiPF6+ H2O= POF3↑+ 2HF↑ + LiF
【详解】(1)氟是9号元素,核外9个电子,k、L层分别有2、7个电子,氟在元素周期表中的位置是第2周期ⅦA族。
(2)氢氟酸具有刻蚀玻璃的特性,与二氧化硅反应生成四氟化硅和水,该反应的化学方程式SiO2+4HF=SiF4↑+2H2O。
已知25℃时,氢氟酸的电离平衡常数Ka=3.6×10-4,说明HF为弱酸,pH=12的NaOH溶液,c(NaOH)=0.01 mol·L-1,若将0.01 mol·L-1的HF溶液与pH=12的NaOH溶液等体积混合,生成0.005mol·L-1NaF,F-离子水解生成HF和OH-,c(Na+)>c(F-),溶液呈碱性,c(OH-)>c(H+),则溶液中离子浓度由大到小的顺序为c(Na+)>c(F-)>c(OH-)>c(H+)。
(3)次氟酸(HOF)中心原子为O,分别与H和F各形成一个共价键,次氟酸的电子式为。
(4)四氟肼(N2F4)用作高能燃料的氧化剂,N2F4分子中有1个N-N,4个N-F,1 mol N2F4分子中含有的共价键数目是5NA。
N2F4气体可用Fe3+氧化二氟胺(HNF2)制得,生成Fe2+和H+,离子方程式:2HNF2 + 2Fe3+ = N2F4↑+ 2Fe2+ +2H+。
(5)A.反应①③都是氧化还原反应,②中元素化合价不变,故A错误;
B.反应③中U元素化合价由+4价升高为+6价,被氧化,故B正确;
C.反应①U3O8+2H2 →3UO2+2H2O 中U3O8是氧化剂,H2是还原剂的物质的量之比为1:2,故C错误;
故选B。
(6)LiPF6与极少量水反应可生成POF3、2HF、 LiF三种含氟化合物,该反应的化学方程式:LiPF6+ H2O= POF3↑+ 2HF↑ + LiF。
19. KMnO4 Cl2 MnCl2 0.5mol 5.6L 0.5mol n-5 7 3 K2O 2Al2O3 6SiO2 H2O
【分析】(1)①根据2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中化合价升降判断氧化剂、氧化产物和还原产物;②根据方程式可计算得失电子的数目进一步计算;
(2)A2+和B3-的电子层结构相同,又A的核电荷数为n,设B的质子数为x,根据n-2=x+3进行计算;
(3)根据1H216O、2H217O、2H218O、1H35Cl、1H37Cl找到不同的原子核元素;
(4)将硅酸盐携程盐氧化物的形式,金属氧化物在前,非金属氧化物在后,水写在最后面。
【详解】(1)根据2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O可知Mn从+7价降到+2价,化合价降低得电子,氧化剂是KMnO4,Cl从-1价升高到0价,化合价升高失电子,还原剂是HCl,氧化产物为Cl2,还原产物为MnCl2;②15.8gKMnO4的物质的量为0.1mol,2mol KMnO4发生反应电子转移10mol,那么0.1mol电子转移0.5mol,生成Cl2 0.25mol,体积为;
(2)A2+和B3-的电子层结构相同,又A的核电荷数为n,设B的质子数为x,则有n-2=x+3,解得x=n-5;
(3)根据1H216O、2H217O、2H218O、1H35Cl、1H37Cl可知,存在1H、2H两种氢原子,16O、17O、18O三种氧原子,35Cl、37Cl两种氯原子,因而共7种原子,3种元素
(4)将硅酸盐携程盐氧化物的形式,金属氧化物在前,非金属氧化物在后,水写在最后面,氧化物的形式为K2O 2Al2O3 6SiO2 H2O。
【点睛】本题的难点在于硅酸盐盐氧化物的书写,要注意根据金属活动性顺序表的顺序写出金属氧化物,再写非金属氧化物,最后写出水。
20. 3p 9 < 核电荷数较大 镁 A 不正确 熔化时不需要破坏化学键,破坏的是较弱的分子间作用力;金刚石熔化时需要破坏较强的共价键
【详解】(1) ①Cl原子核外电子数为17,基态原子核外电子排布为1S22S22P63S23P5,由此可得基态Cl原子中电子占据的最高能级符号为3P,该原子核外有3个s轨道、6个p轨道、共有9个原子轨道,即有9种空间运动状态,②元素的非金属性越强其电负性越大,非金属性最强的是H元素,其次是B元素,最小的是Li元素,所以Li、B、H元素的电负性由大到小的排列顺序为H> B>Li,故答案为:3P;9;;
(2)①核外电子排布相同的离子,核电荷数越大,其离子半径越小,和的电子层结构相同,锂元素的核电荷数大于氢元素,所以离子半径 <,②该元素的第三电离能剧增,则该元素属于第IIA族元素,而且该元素的原子核外电子数不少于5个,为Mg元素,AD微粒都是Mg原子失去一个电子后得到的,但是D微粒能量高于A,稳定性A > D,所以失电子能量A > D;BC都是原子,但是B是基态、C是激发态,能量:C> B,稳定性B > C;所以失去一个电子能量:B>C;A为Mg+、B为Mg原子,A再失去电子所需能量就是Mg原子失去2个电子的能量,为Mg原子的第二电离能,B失去一个电子的能量是Mg原子的第一电离能,其第二电离能大于第一电离能,所以电离最外层一个电子所需能量A> B,通过以上分析知,电离最外层一个电子所需能量最大的是A,故答案为:<;核电荷数较大;镁;A;
(3) 是分子晶体,分子间作用力弱,熔化时不破坏化学键,熔点低,而金刚石是原子晶体,原子间以较强的共价键结合,熔化时破坏共价键需要较大的能量,熔点高,所以晶体的熔点低于金刚石,故答案为:不正确;熔化时不需要破坏化学键,破坏的是较弱的分子间作用力;金刚石熔化时需要破坏较强的共价键;
21. 2s22p3 N、S CO2
【详解】(1) 反应所涉及元素有C、N、O、S、K,只有K元素易形成简单阳离子,K是19号元素,质子数为19,K+是K原子失去1个电子形成的,有18个电子,离子结构示意图是;N元素的原子核外电子中有三个未成对电子,N原子最外层电子排布式为2s22p3;O和S在同主族,最外层电子数相同,原子序数较小的元素为O元素,形成简单离子为O2-,电子式为;反应16KNO3+8C+S8=8K2S+16NO2↑+8CO2↑中,C元素的化合价由0价升为+4价,发生氧化反应,C原子的核外电子排布式为1s22s22p2,核外电子的轨道表示式为;
(2)反应16KNO3+8C+S8=8K2S+16NO2↑+8CO2↑中,N元素的化合价由+5价降为+4价,S元素的化合价由0价降为-2价,均被还原,因此被还原的元素是N和S;C元素的化合价由0价升为+4价,发生氧化反应,氧化产物为CO2;
(3)根据第(2)题的分析,16个N由+5价降为+4价,得16个电子,8个S由0价降为-2价,得16个电子,8个C由0价升为+4价,失32个电子,该反应的电子转移方向和数目可表示为;
22. AC 球 1 对称 3 能层 能层
【详解】(1)层只有、能级,层只有、、能级,故选AC,故答案为:AC;
(2)①轨道在三维空间分布的图形为球形,且每个s能级只有一个轨道;轨道空间分布的图形分别相对于x、y、z轴对称,每个p能级有3个轨道,故答案为:球;1;对称;3;
②原子轨道的半径与能层有关,并随能层升高而增大,故答案为:能层;能层。
23. > Al3++2+2Ba2++4OH﹣═2BaSO4↓++2H2O 1s22s22p63s23p634s1
【详解】明矾的化学式为KAl(SO4)2 12H2O,设明矾的物质的量为1mol,则明矾中含有1molAl3+,为2mol,若要使硫酸根离子完全沉淀,需加入Ba(OH)22mol。此时Al3+与4molOH-刚好完全反应生成,溶液显碱性,pH>7;离子反应总方程式:Al3++2+2Ba2++4OH﹣═2BaSO4↓++2H2O;K为19号元素,电子排布为2、8、8、1,所以电子排布式为1s22s22p63s23p634s1。答案为:>;Al3++2+2Ba2++4OH﹣═2BaSO4↓++2H2O;1s22s22p63s23p634s1。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.我国嫦娥五号探测器带回1.731的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素W、X、Y、Z,原子序数依次增大,W元素基态原子2p能级仅有一对成对电子。基态X原子的价电子排布式为。基态Z元素原子最外电子层上s、p电子数相等,下列结论正确的是
A.原子半径大小顺序为X
A.原子序数:Z>X B.X 的核内质子数为 8
C.Y 和X 化学性质相似 D.Y 处于第二周期
3.下列各组元素中,属于同一周期的是
A.Na、Al B. C、Cl C. C.N、Mg D.O、S
4.核外电子的能量不仅与电子所处的能层、能级有关,还与核外电子的数目及核电荷数有关。氩原子与硫离子的核外电子排布相同,都是1s22s22p63s23p6。下列说法中正确的是
A.两粒子的1s能级上电子的能量相同
B.两粒子的3p能级上的电子离核的距离相同
C.两粒子的电子发生跃迁时,产生的光谱不同
D.两粒子都达8电子稳定结构,化学性质相同
5.下列叙述正确的是
A.同一周期元素的原子,半径越小越容易失去电子
B.周期表中所有元素都是从自然界中发现的,过渡元素都是金属元素
C.非金属元素形成的共价化合物中,原子的最外层都达到8电子稳定结构
D.IA族与VIIA族元素间可形成共价化合物或离子化合物
6.化合物A由原子序数依次增大的三种短周期元素X、Y、Z组成,其结构式如图 ,是一种绿色生态杀菌剂。已知Z的常见单质在常温常压下为气态。下列叙述正确的是
A.元素Y位于元素周期表第二周期第VIA族
B.该化合物中Z的化合价均呈-2 价
C.元素的非金属性:Y>Z>X
D.Z的简单阴离子半径比Na+半径大
7.下列有关化学用语的说法不正确的是
A.中子数为7的碳原子: B.氯乙烯的结构简式:CH3CH2Cl
C.羟基的电子式: D.乙酸分子的空间填充模型:
8.下列电子层中,能量比M层高的是
A.L层 B.K层 C.N层 D.G层
9.下列说法错误的是
A.ns电子的能量可能低于(n-1)p电子的能量
B.6C的电子排布式为,违背了洪特规则
C.电子排布式(21Sc)1s22s22p63s23p63d3,违背了能量最低原理
D.电子排布式(22Ti)1s22s22p63s23p10,违背了泡利原理
10.2019年三场大火:巴西亚马孙大火,美国加州大火,澳洲大火。其中澳洲大火面积最大,火势最猛。原因是干燥的地面,加上澳洲特有的物种桉树富含油脂,一旦燃烧起来,不易熄灭。下列有关油脂(C57H110O6)的说法正确的是
A.由三种元素构成 B.所占元素质量分数最大的是氢元素
C.油脂均为固态 D.有些脂肪酸是人体必需的,但人体内却不能合成
11.下列说法中正确的是
A.所有非金属元素都分布在p区
B.最外层电子数为2的元素都分布在s区
C.元素周期表中第ⅢB族到第ⅡB族10个纵列的元素都是金属元素
D.同一主族元素从上到下,金属性依次减弱
12.元素X、Y、Z在周期表中的相对位置如表所示。已知Y元素原子的价层电子排布为,则下列说法不正确的是
X
Y
Z
A.X元素原子的价层电子排布为
B.Y元素在周期表的第三周期ⅥA族
C.X元素所在周期所含非金属元素种类最多
D.三种元素原子半径的大小顺序为:Z>Y>X
13.X、Y、Z三种元素位于周期表中同一周期,其最高价氧化物分别为酸性氧化物、碱性氧化物、两性氧化物,则这三种元素原子序数的大小顺序是
A.X>Y>Z B.Y>X>Z C.X>Z>Y D.Y>Z>X
14.下列轨道表示式正确且所表示的元素原子的能量处于最低状态的是
A. B.
C. D.
二、填空题
15.按要求写出电子排布式或轨道表示式。
(1)基态的电子排布式为______。
(2)基态P原子的价层电子排布式为______。
(3)的轨道表示式为______。
(4)第四周期中最外层仅有1个电子的所有基态原子的电子排布式为______。
16.I.自门捷列夫发现元素周期律以来,人类对自然的认识程度逐步加深,元素周期表中的成员数目不断增加。回答下列问题:
(1)2016年IUPAC确认了四种新元素,其中一种为,中文为“镆”。元素可由反应得到。该元素的质子数为_____,与互为_____。
II.如图是元素周期表的一部分,其中每个字母代表对应的一种元素。
请按要求回答下列问题:
(2)写出d与e按1∶1的原子个数比形成的化合物与水反应的离子方程式:_______,g的离子结构示意图为_______。的性质与相似,与e的最高价氧化物水化物的水溶液反应的离子方程式为________。
(3)h在周期表中的位置为________,与e同主族第六周期的元素的某一核素中子数为82,该核素符号是_________,
(4)由以上某些元素构成A→G八种物质,常见金属单质A可发生如图所示转化(部分反应物、产物和反应条件已略去)。F是一种温室气体;气体G的水溶液显弱碱性;H是一种具有磁性的黑色氧化物;B、C、D、E四种化合物中含有一种相同的元素。
请回答下列问题:
①B与过量G的水溶液反应的化学方程式为___________。
②写出反应I的离子方程式___________。该反应中的氧化剂是___________。
③资料显示H可用于除去地下水中的(具有放射性)。在酸性条件下,H将转化为难溶于水的,同时得到一种难溶于水的弱碱,该反应的离子方程式为___________。
17.如图是甲醛分子的模型,根据该图和所学化学知识回答下列问题:
(1)甲醛分子中所有原子都达到稳定结构,甲醛的电子式为_______。
(2)甲醛分子中碳元素的化合价为_______价,理由是_______。
(3)甲醛和次硫酸氢钠(可表示成)反应可制得“吊白块”:
反应类型为_______,常用甲醛浓溶液保存动物标本的原因是_______。
18.氟及其化合物在生产生活中被广泛使用,造福人类。
(1)氟在元素周期表中的位置是___________。
(2)氢氟酸具有刻蚀玻璃的特性,写出该反应的化学方程式____________。已知25℃时,氢氟酸的电离平衡常数Ka=3.6×10-4,若将0.01 mol·L-1的HF溶液与pH=12的NaOH溶液等体积混合,则溶液中离子浓度由大到小的顺序为_____。
(3)次氟酸(HOF)由科学家在1971年首次制得,次氟酸的电子式为_______。
(4)四氟肼(N2F4)用作高能燃料的氧化剂,1 mol N2F4分子中含有的共价键数目是________NA。N2F4气体可用Fe3+氧化二氟胺(HNF2)制得,写出该反应的离子方程式______________。
(5)六氟化铀(UF6)是铀的稳定气态化合物,用作核燃料,由U3O8制取UF6的三步反应原理如下:
①U3O8+H2 →UO2+H2O (未配平) ②UO2+4HF=UF4+2H2O ③UF4+ F2 = UF6
则下列说法正确的是 _____________。
A.反应①②③都是氧化还原反应
B.反应③中U元素被氧化
C.反应①中氧化剂和还原剂的物质的量之比为2:1
(6)六氟磷酸锂(LiPF6)是锂离子电池广泛使用的电解质。LiPF6与极少量水反应可生成POF3等三种含氟化合物,写出该反应的化学方程式:________。
19.(1)实验室可以用KMnO4制备氯气,反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
①该反应的氧化剂是____,氧化产物是_____,还原产物是____。
②当有15.8gKMnO4参加反应时,被氧化的HCl有___mol,标况下生成Cl2的体积为____L,有____mol电子转移。
(2)A的核电荷数为n,A2+和B3-的电子层结构相同,则B原子的质子数是__。
(3)在1H216O、2H217O、2H218O、1H35Cl、1H37Cl中,共存在__种原子,_种元素。
(4)将K(Al2Si3O9)(OH)改写为氧化物形式:____。
20.开发新型储氢材料是开发利用氢能的重要研究方向。
(1),是一种储氢材料,可由和反应制得。
①基态原子中,电子占据的最高能级符号为___________,原子核外电子有___________种空间运动状态。
②、B、H元素的电负性由大到小的排列顺序为___________。
(2)金属氢化物是具有良好发展前景的储氢材料。
①中,离子半径:___________(填“>”“=”或“<”),原因是___________。
②某储氢材料是短周期金属元素M的氢化物。M原子的部分电离能如表所示:
738 1451 7733 10540 13630
则M是___________(填元素名称)。下列状态的粒子中,电离出最外层一个电子所需能量最大的是___________(填字母)。
A. B. C. D.
(3)碳有很多同素异形体,就是其中一种,可用作储氢材料。已知金刚石为立体网状结构,其键的键长为,分子中键键长为,有同学据此认为的熔点高于金刚石,你认为是否正确?___________,阐述理由:___________。
21.黑火药在发生爆炸时,有可能发生如下的反应:16KNO3+8C+S8=8K2S+16NO2↑+8CO2↑。
(1)上述反应所涉及元素中,某元素易形成简单阳离子,其离子结构示意图是________;某元素原子核外电子中有三个未成对电子,请写出其原子最外层电子排布式_________;有两种元素最外层电子数相同,请写出其中原子序数较小的元素形成简单离子的电子式_________;发生氧化反应的元素,其原子核外电子的轨道表示式为_________。
(2)上述反应中,被还原的元素是______,氧化产物是________。
(3)请标出上述反应的电子转移方向和数目________。
22.(1)可正确表示原子轨道的是______。
A.2s B.2d C.3p D.3f
(2)如图是s能级、p能级的原子轨道图试回答问题:
①s能级的原子轨道呈______形,每个s能级有______个原子轨道;p能级的原子轨道分别相对于x、y、z轴______,每个p能级有______个原子轨道。
②s能级原子轨道、p能级原子轨道的半径与______有关,______越高,原子轨道半径越大。
23.向明矾溶液中逐滴加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,溶液的pH________7(填>、<、=),离子反应总方程式:________写出K元素的基态原子的电子排布式:________.
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【分析】W元素2p能级只有1对成对电子,则W原子对应电子排布式为:1s22s22p4,故W为O,X原子价电子排布式为ns2,其原子序数比W大,故X为Mg,由题意知,Y、Z两种元素与Mg在同一周期,都为第三周期,Z元素最外层s、p能级上电子数相等,则其排布式为:1s22s22p63s23p2,即Si元素,Y介于X、Z之间,故Y为Al。
【详解】A.一般,电子层数多半径大,电子层数相同,核电荷数大,半径小,故四种原子半径大小顺序为:O<Si<Al<Mg,A错误;
B.同周期从左往右,第一电离能呈现增大趋势,但第ⅡA和ⅤA价电子排布为稳定结构,故第一电离能比相邻元素要大,即四种元素第一电离能顺序为:Al<Mg<Si<O,B错误;
C.元素电负性周期性变化规律与非金属性一致,故四种元素电负性顺序为:Mg<Al<Si<O,C正确;
D.O元素无最高正价+6价,其最高正价为+2价,Mg、Al、Si最高正价依次为+2、+3、+4,D错误;
故答案选C。
2.D
【分析】根据元素在周期表中的相对位置可知X、Y、Z 分别是O、S、Cl,据此解答。
【详解】A.元素周期表是按原子序数递增的顺序排列的,原子序数:Z>X,故A选项说法正确。
B.X位于第2周期,位于氖元素之前的第二个,则X 的核内质子数为 8,故B选项说法正确。
C.Y 和X位于同一族,最外层电子数相同,Y 和X 化学性质相似,故C选项说法正确。
D.Y是S,位于第三周期,故D选项说法错误。
故答案选D。
3.A
【分析】原子结构中,具有相同电子层的原子,在同一周期,以此来解答。
【详解】A.Na、Al的原子结构中均有3个电子层,均位于第三周期,选项A选;
B.C、Cl分别在第二周期、第三周期,选项B不选;
C.N、Mg分别在第二周期、第三周期,选项C不选;
D.O、S分别在第二周期、第三周期,选项D不选;
答案选A。
【点睛】本题考查元素周期表的结构及应用,为高频考点,侧重元素位置的考查,注意把握原子的电子层数等于周期数的关系,熟悉常见元素的位置即可解答,题目难度不大。
4.C
【详解】A.Ar与S2-的原子核电荷数不同,1s能级上电子的能量不相同,A错误;
B.Ar与S2-的原子核电荷数不同,半径不同,3p能级上电子离核的距离不相同,B错误;
C.Ar与S2-的原子核电荷数不同,电子跃迁产生的光谱都不相同,C正确;
D.Ar与S2-的原子核电荷数不同,化学性质不相同,D错误;
故选C。
5.D
【详解】A.根据同周期元素性质递变规律判断,同一周期元素的原子,半径越小越容易得到电子,错误;
B.周期表中的元素有的是从自然界中发现的,有的元素是人造元素,错误;
C.非金属元素形成的共价化合物中,原子的最外层不一定都达到8电子稳定结构,如HCl中的氢原子最外层为2电子稳定结构,错误;
D.IA族与VIIA族元素间可形成共价化合物或离子化合物,如HCl为共价化合物,NaCl为离子化合物,正确;
答案选D。
6.D
【分析】杀菌剂通常具有强氧化性,根据结构中Z形成2条共价键、Y形成4条共价键、X形成1条共价键,可知X、Y、Z分别为H、C、O,该绿色生态杀菌剂为过氧乙酸CH3COOOH,据此可分析解答。
【详解】A.元素Y为碳,位于第二周期第IVA族,A选项错误;
B.该化合物中O的化合价有-2、-1,B选项错误;
C.三种元素的非金属性强弱顺序为:O>C>H,即Z>Y>X,C选项错误;
D.O2-和Na+的核外电子排布相同,核电荷数越大,离子半径越小,Na+半径比O2-小,D选项正确;
答案选D。
7.B
【详解】A.中子数为7的碳原子质量数为7+6=13,正确答案为:,A选项正确;
B.氯乙烯可看着是乙烯上的1个H被Cl取代的有机物,结构简式为:CH2=CHCl,B选项错误;
C.羟基不带电,所以H和O最外层电子数为1+6=7,所以电子式为:,C选项正确;
D.乙酸分子的比例模型:,连接正确,相对大小正确,D选项正确;
答案选B。
8.C
【分析】原子核外电子排布按其能量的高低分成七个能层,由里向外能量由低到高依次是K、L、M、N、O、P、Q,据此解答。
【详解】A.L层在M层里面,能量比M层低,故A不选;
B.K层在M层里面,能量比M层低,故B不选;
C.N层在M层外面,能量比M层高,故C选;
D.在原子核外电子排布中没有G层,故D不选。
故选C。
9.A
【详解】A.电子能量与能层和能级都有关,ns电子的能量一定高于(n-1)p电子的能量,故A错误;
B.p能级有3个轨道,2p能级有2个电子,电子应优先占据1轨道,且自旋方向相同,2px填充2个电子,违反了洪特规则,故B正确;
C.3d能级的能量高于4s能级,没有填充4s能级,就填充3d能级,违背能量最低原理,故C正确;
D.p能级有3个轨道,每个轨道最多容纳2个电子,且自旋方向相反,3p能级最多填充6个电子,而填充10个电子违反了泡利原理,故D正确;
故选A。
10.D
【详解】A.该油脂是由碳、氢、氧三种元素组成的,选项说法错误;
B.该油脂中,碳、氢、氧元素的质量比为:(12×57):(1×110):(16×6)=684:110:96,可见其中碳元素的质量分数最大,选项说法错误;
C.植物性油脂在常温下是液态的,选项说法错误;
D.有些脂肪酸是人体必需的,但人体内却不能合成,选项说法正确;
故答案选D。
11.C
【详解】A.非金属元素中的氢元素位于s区,其余非金属元素均分布在p区,故A错误;
B.最外层电子数为2的元素可能在s区(如Mg)、p区(如He)、ds区(如Zn)或d区(如Ti、Fe)等,故B错误;
C.从第ⅢB族到第ⅡB族共有10列,因为第Ⅷ族占有3列,副族元素均为金属元素,故C正确;
D.同主族元素从上到下,金属性逐渐增强,故D错误;
答案为C。
12.A
【分析】根据Y元素原子的价层电子排布为,n=3,故Y为S;则X为F,Z为As。
【详解】A.F原子的价电子排布式为2s22p5,故A错误;
B.S为16号元素,位于第三周期ⅥA族,故B正确;
C.F元素所在周期即第二周期非金属元素种类最多,故C正确;
D.一般,电子层数越多半径越大,故Z>Y>X,故D正确;
故选A。
13.C
【详解】同一周期从左到右金属性减弱、非金属性增强。其最高价氧化物从碱性氧化物过渡到酸性氧化物,三种元素原子序数的大小顺序是X>Z>Y,故C正确。
14.D
【详解】A.违背了构造原理,能量不处于最低,故A不符合题意;
B.违背了构造原理,能量不处于最低,故B不符合题意;
C.违背了洪特规则,能量不处于最低,故C不符合题意;
D.符合能量最低原理、泡利原理、洪特规则,能量处于最低,故D符合题意;
答案为D。
15. (或) 、、
【详解】(1)基态原子的电子排布式为,失去1个电子所得的电子排布式为或。故答案为:(或);
(2)P原子核外电子的最外层为第三层,且有5个电子,所以其价层电子排布式为。故答案为:;
(3)的电子排布式为,轨道表示式为。故答案为:;
(4)第四周期最外层只有1个电子的基态原子的最外层电子排布式为,此时、应已填满,轨道可能全空、半充满或全充满,即电子排布式为、、。故答案为:、、;
16.(1) 115 同位素
(2)
(3) 第四周期Ⅷ族
(4) H2O
【分析】根据元素在周期表中的位置,可知a是H元素、b是C元素、c是N元素、d是O元素、e是Na元素、f是Al元素、g是S元素、i是Cl元素、h是Fe元素。
由以上某些元素构成A→G八种物质,常见金属单质A既能与氢氧化钠反应又能与盐酸反应,A是Al单质,Al和氢氧化钠反应生成偏铝酸钠和氢气,E是偏铝酸钠;Al和盐酸反应生成氯化铝和氢气,B是氯化铝;气体G的水溶液显弱碱性,G是氨气,氯化铝和氨水反应生成氢氧化铝沉淀和氯化铵,C是氢氧化铝;偏铝酸钠溶液和二氧化碳反应 生成氢氧化铝,F是二氧化碳; H是一种具有磁性的黑色氧化物,H是四氧化三铁;铝和四氧化三铁反应生成铁和氧化铝,D是氧化铝。
(1)
元素可由反应得到,元素的质子数为95+20=115,与质子数相同、中子数不同,互为同位素;
(2)
O与Na按1∶1的原子个数比形成的化合物是Na2O2,Na2O2与水反应生成氢氧化钠和氧气,反应的离子方程式;S2-核外有18个电子,离子结构示意图为。Na的最高价氧化物水化物是氢氧化钠,氢氧化钠溶液和反应生成NaCN、NaCNO、H2O,反应的离子方程式为;
(3)
h是Fe元素,在周期表中的位置为第四周期Ⅷ族;与Na同主族第六周期的元素是55号Cs元素,某一核素中子数为82,则质量数是137,该核素符号是;
(4)
①氯化铝与过量氨水反应生成氢氧化铝沉淀和氯化铵,反应的化学方程式为;
②反应I是铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式是 。该反应中,水中氢元素化合价降低生成氢气,氧化剂是H2O。
③在酸性条件下,将转化为难溶于水的,同时得到一种难溶于水的弱碱是氢氧化铁,该反应的离子方程式为。
17. 0 氧的电负性比碳大,显负价,氢的电负性比碳小,显正价,根据化合价代数和为0,可知碳为0价 加成反应 甲醛能使蛋白质变性
【详解】(1)甲醛分子中所有原子都达到稳定结构,甲醛的电子式为,故答案为:;
(2)氧的电负性比碳大,显负价,氢的电负性比碳小,显正价,根据化合价代数和为0,可知碳为0,故答案为:0;氧的电负性比碳大,显负价,氢的电负性比碳小,显正价,根据化合价代数和为0,可知碳为0价;
(3)反应中键变成键,为加成反应,甲醛可使蛋白质变性,可用于动物标本的保存,故答案为:加成反应;甲醛能使蛋白质变性;
18. 第2周期ⅦA族 SiO2+4HF=SiF4↑+2H2O c(Na+)>c(F-)>c(OH-)>c(H+) 5 2HNF2 + 2Fe3+ = N2F4↑+ 2Fe2+ +2H+ B LiPF6+ H2O= POF3↑+ 2HF↑ + LiF
【详解】(1)氟是9号元素,核外9个电子,k、L层分别有2、7个电子,氟在元素周期表中的位置是第2周期ⅦA族。
(2)氢氟酸具有刻蚀玻璃的特性,与二氧化硅反应生成四氟化硅和水,该反应的化学方程式SiO2+4HF=SiF4↑+2H2O。
已知25℃时,氢氟酸的电离平衡常数Ka=3.6×10-4,说明HF为弱酸,pH=12的NaOH溶液,c(NaOH)=0.01 mol·L-1,若将0.01 mol·L-1的HF溶液与pH=12的NaOH溶液等体积混合,生成0.005mol·L-1NaF,F-离子水解生成HF和OH-,c(Na+)>c(F-),溶液呈碱性,c(OH-)>c(H+),则溶液中离子浓度由大到小的顺序为c(Na+)>c(F-)>c(OH-)>c(H+)。
(3)次氟酸(HOF)中心原子为O,分别与H和F各形成一个共价键,次氟酸的电子式为。
(4)四氟肼(N2F4)用作高能燃料的氧化剂,N2F4分子中有1个N-N,4个N-F,1 mol N2F4分子中含有的共价键数目是5NA。
N2F4气体可用Fe3+氧化二氟胺(HNF2)制得,生成Fe2+和H+,离子方程式:2HNF2 + 2Fe3+ = N2F4↑+ 2Fe2+ +2H+。
(5)A.反应①③都是氧化还原反应,②中元素化合价不变,故A错误;
B.反应③中U元素化合价由+4价升高为+6价,被氧化,故B正确;
C.反应①U3O8+2H2 →3UO2+2H2O 中U3O8是氧化剂,H2是还原剂的物质的量之比为1:2,故C错误;
故选B。
(6)LiPF6与极少量水反应可生成POF3、2HF、 LiF三种含氟化合物,该反应的化学方程式:LiPF6+ H2O= POF3↑+ 2HF↑ + LiF。
19. KMnO4 Cl2 MnCl2 0.5mol 5.6L 0.5mol n-5 7 3 K2O 2Al2O3 6SiO2 H2O
【分析】(1)①根据2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中化合价升降判断氧化剂、氧化产物和还原产物;②根据方程式可计算得失电子的数目进一步计算;
(2)A2+和B3-的电子层结构相同,又A的核电荷数为n,设B的质子数为x,根据n-2=x+3进行计算;
(3)根据1H216O、2H217O、2H218O、1H35Cl、1H37Cl找到不同的原子核元素;
(4)将硅酸盐携程盐氧化物的形式,金属氧化物在前,非金属氧化物在后,水写在最后面。
【详解】(1)根据2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O可知Mn从+7价降到+2价,化合价降低得电子,氧化剂是KMnO4,Cl从-1价升高到0价,化合价升高失电子,还原剂是HCl,氧化产物为Cl2,还原产物为MnCl2;②15.8gKMnO4的物质的量为0.1mol,2mol KMnO4发生反应电子转移10mol,那么0.1mol电子转移0.5mol,生成Cl2 0.25mol,体积为;
(2)A2+和B3-的电子层结构相同,又A的核电荷数为n,设B的质子数为x,则有n-2=x+3,解得x=n-5;
(3)根据1H216O、2H217O、2H218O、1H35Cl、1H37Cl可知,存在1H、2H两种氢原子,16O、17O、18O三种氧原子,35Cl、37Cl两种氯原子,因而共7种原子,3种元素
(4)将硅酸盐携程盐氧化物的形式,金属氧化物在前,非金属氧化物在后,水写在最后面,氧化物的形式为K2O 2Al2O3 6SiO2 H2O。
【点睛】本题的难点在于硅酸盐盐氧化物的书写,要注意根据金属活动性顺序表的顺序写出金属氧化物,再写非金属氧化物,最后写出水。
20. 3p 9 < 核电荷数较大 镁 A 不正确 熔化时不需要破坏化学键,破坏的是较弱的分子间作用力;金刚石熔化时需要破坏较强的共价键
【详解】(1) ①Cl原子核外电子数为17,基态原子核外电子排布为1S22S22P63S23P5,由此可得基态Cl原子中电子占据的最高能级符号为3P,该原子核外有3个s轨道、6个p轨道、共有9个原子轨道,即有9种空间运动状态,②元素的非金属性越强其电负性越大,非金属性最强的是H元素,其次是B元素,最小的是Li元素,所以Li、B、H元素的电负性由大到小的排列顺序为H> B>Li,故答案为:3P;9;;
(2)①核外电子排布相同的离子,核电荷数越大,其离子半径越小,和的电子层结构相同,锂元素的核电荷数大于氢元素,所以离子半径 <,②该元素的第三电离能剧增,则该元素属于第IIA族元素,而且该元素的原子核外电子数不少于5个,为Mg元素,AD微粒都是Mg原子失去一个电子后得到的,但是D微粒能量高于A,稳定性A > D,所以失电子能量A > D;BC都是原子,但是B是基态、C是激发态,能量:C> B,稳定性B > C;所以失去一个电子能量:B>C;A为Mg+、B为Mg原子,A再失去电子所需能量就是Mg原子失去2个电子的能量,为Mg原子的第二电离能,B失去一个电子的能量是Mg原子的第一电离能,其第二电离能大于第一电离能,所以电离最外层一个电子所需能量A> B,通过以上分析知,电离最外层一个电子所需能量最大的是A,故答案为:<;核电荷数较大;镁;A;
(3) 是分子晶体,分子间作用力弱,熔化时不破坏化学键,熔点低,而金刚石是原子晶体,原子间以较强的共价键结合,熔化时破坏共价键需要较大的能量,熔点高,所以晶体的熔点低于金刚石,故答案为:不正确;熔化时不需要破坏化学键,破坏的是较弱的分子间作用力;金刚石熔化时需要破坏较强的共价键;
21. 2s22p3 N、S CO2
【详解】(1) 反应所涉及元素有C、N、O、S、K,只有K元素易形成简单阳离子,K是19号元素,质子数为19,K+是K原子失去1个电子形成的,有18个电子,离子结构示意图是;N元素的原子核外电子中有三个未成对电子,N原子最外层电子排布式为2s22p3;O和S在同主族,最外层电子数相同,原子序数较小的元素为O元素,形成简单离子为O2-,电子式为;反应16KNO3+8C+S8=8K2S+16NO2↑+8CO2↑中,C元素的化合价由0价升为+4价,发生氧化反应,C原子的核外电子排布式为1s22s22p2,核外电子的轨道表示式为;
(2)反应16KNO3+8C+S8=8K2S+16NO2↑+8CO2↑中,N元素的化合价由+5价降为+4价,S元素的化合价由0价降为-2价,均被还原,因此被还原的元素是N和S;C元素的化合价由0价升为+4价,发生氧化反应,氧化产物为CO2;
(3)根据第(2)题的分析,16个N由+5价降为+4价,得16个电子,8个S由0价降为-2价,得16个电子,8个C由0价升为+4价,失32个电子,该反应的电子转移方向和数目可表示为;
22. AC 球 1 对称 3 能层 能层
【详解】(1)层只有、能级,层只有、、能级,故选AC,故答案为:AC;
(2)①轨道在三维空间分布的图形为球形,且每个s能级只有一个轨道;轨道空间分布的图形分别相对于x、y、z轴对称,每个p能级有3个轨道,故答案为:球;1;对称;3;
②原子轨道的半径与能层有关,并随能层升高而增大,故答案为:能层;能层。
23. > Al3++2+2Ba2++4OH﹣═2BaSO4↓++2H2O 1s22s22p63s23p634s1
【详解】明矾的化学式为KAl(SO4)2 12H2O,设明矾的物质的量为1mol,则明矾中含有1molAl3+,为2mol,若要使硫酸根离子完全沉淀,需加入Ba(OH)22mol。此时Al3+与4molOH-刚好完全反应生成,溶液显碱性,pH>7;离子反应总方程式:Al3++2+2Ba2++4OH﹣═2BaSO4↓++2H2O;K为19号元素,电子排布为2、8、8、1,所以电子排布式为1s22s22p63s23p634s1。答案为:>;Al3++2+2Ba2++4OH﹣═2BaSO4↓++2H2O;1s22s22p63s23p634s1。
答案第1页,共2页
答案第1页,共2页
