2.2.1化学反应中能量变化的本质及转化形式 课件(共77张PPT)鲁科版(2019)必修第二册
文档属性
| 名称 | 2.2.1化学反应中能量变化的本质及转化形式 课件(共77张PPT)鲁科版(2019)必修第二册 |  | |
| 格式 | ppt | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-01 08:46:48 | ||
图片预览










文档简介
(共77张PPT)
第2节 化学反应与能量转化
第1课时 化学反应中能量变化的本质及转化形式
一、实验探究化学变化中的能量变化
1.【活动探究】
实验操作 实验现象 有关化学方程式或结论
镁粉逐渐_____,
生成_____,反应
后溶液温度_____ ____________
__________;
反应是_____反应
溶解
气泡
升高
Mg+2HCl====
MgCl2+H2↑
放热
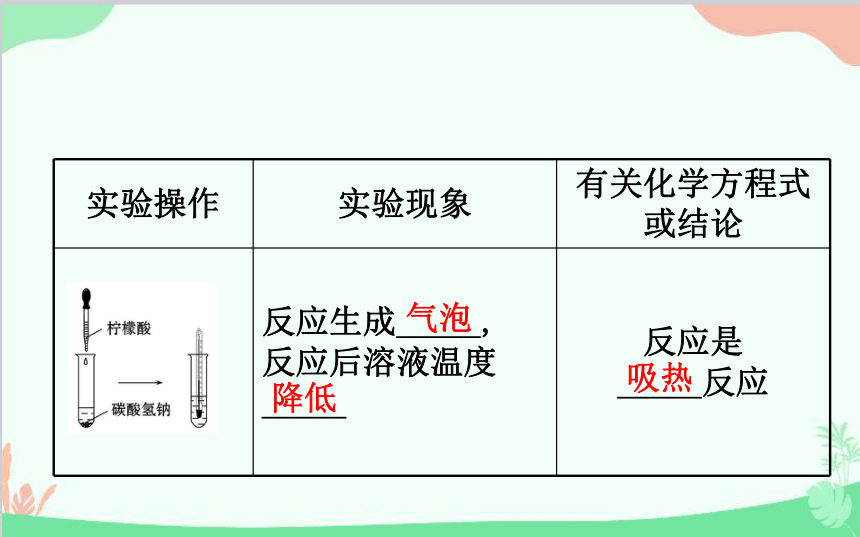
实验操作 实验现象 有关化学方程式或结论
反应生成_____,
反应后溶液温度
_____ 反应是
_____反应
气泡
降低
吸热
2.结论:每一个化学反应都伴随着能量的变化,有的反应
_____能量(放热反应),有的反应_____能量(吸热反应)。
释放
吸收
【情境·思考】
古诗《石灰吟》:
千锤万凿出深山,烈火焚烧若等闲。
粉骨碎身浑不怕,要留清白在人间。
是一首托物言志诗。作者以石灰作比喻,表达自己为国尽忠,不怕牺牲的意愿和坚守高洁的决心。通过古诗的描述,制取石灰的反应是放热反应还是吸热反应 石灰遇水的反应呢
提示:碳酸钙变为氧化钙的反应为吸热反应,氧化钙变为氢氧化钙的反应为放热反应。
二、化学反应中能量变化的实质和原因分析
1.化学反应的实质
2.化学反应中能量变化的原因
(1)能量变化的原因:旧化学键破坏时要_____能量(E1),
新化学键形成时要_____能量(E2)。
吸收
释放
(2)反应吸收能量和放出能量的原因:
①从化学键角度分析:若E1>E2,则反应_____能量;若E1
②从物质能量角度分析:若 ,则反
应_____能量;若 ,则反应_____能量。
吸收
释放
放出
吸收
3.能量转化的形式
化学能 _________、_________或_________等。
热能
电能
光能
4.计算
根据下列信息分析氢气燃烧生成水蒸气时能量的变化情况
(1)断裂1 mol H2和 mol O2中的化学键吸收的总能量:
_____________________。
(2)形成1 mol H2O时释放的总能量:_______。
(3)燃烧1 mol H2生成水蒸气时_____能量____kJ。
436 kJ+249 kJ=685 kJ
930 kJ
放出
245
【微思考】
是不是放热反应不需要加热就能发生 吸热反应需要加热才能发生
提示:不是。反应是放热反应还是吸热反应与反应的条件无关,如煤的燃烧是放热反应,但一般需要加热才能发生;氯化铵和氢氧化钙的反应是吸热反应,但不加热就能发生。
【巧判断】
(1)化学反应过程中不一定都有能量变化 ( )
提示:×。因为化学变化中需断裂的化学键与形成的化学键不同,所以一定伴随着能量的变化。
(2)镁带燃烧时,化学能全部转化为热能 ( )
提示:×。镁带燃烧时发出耀眼的白光,所以化学能一部分变为光能。
(3)有能量放出的变化都是放热反应,吸收能量的变化都是吸热反应 ( )
提示:×。物理变化也可能伴随着能量的变化。
知识点一 化学反应中能量的变化原因及计算
【重点释疑】
1.化学反应的能量变化分析:
(1)从化学键的角度:
①E1>E2:反应吸收能量(吸热反应)。
②E1可以总结为新大于旧,反应放热;旧大于新,反应吸热。
(2)从物质内部能量变化的角度——“两个过程”:
①可以看作是热能、电能或光能等物质外部的能量被“储存”起来的过程。
②可以看作是“储存”在物质内部的能量(化学能)转化成热能、光能或电能等释放出来的过程。
2.化学反应中能量计算的步骤
(1)根据化学方程式确定断键、成键的物质的量。
(2)确定断键吸收的总能量和成键释放的总能量。
(3)计算反应的能量变化:
①若反应释放能量。
E=成键时释放能量之和-断键时吸收能量之和
②若反应吸收能量。
E=断键时吸收能量之和-成键时释放能量之和
【易错提醒】分析化学反应中的能量变化时,应注意以下两点:
(1)物质所含能量越低越稳定。化学反应中的能量变化与化学键的断裂和形成有关,断裂化学键吸收的能量等于形成该化学键时释放的能量,能量值越大,化学键越牢固,物质本身越稳定,物质的能量越低。
(2)由于任何化学反应中都存在化学键的断裂与生成,因此,任何化学反应在发生物质变化的同时必然发生能量的变化。也就是说任何化学反应中反应物具有的总能量与生成物具有的总能量一定不相等。
【思考·讨论】
如图,若试管中的无色液体是稀硫酸,向其中加入镁条,可以观察到U形管中有什么现象 产生此现象的原因是什么
提示:看到U形管a端液面下降,b端液面上升。原因是镁条与稀硫酸反应放热,致使瓶内气压大于外界气压,从而将U形管中的红色墨水压往U形管的右侧。
【案例示范】
【典例】下表中的数据表示破坏1 mol化学键需消耗的
能量,根据表中数据计算以下反应生成1 mol CO2时的
热量变化 ( )
CH4(g)+2O2(g) CO2(g)+2H2O(g)
化学键 C—H O—O O=O C—O C=O H—O
能量(kJ) 415 138 498 343 798 465
A.放出热量800 kJ
B.放出热量1 520 kJ
C.吸收热量110 kJ
D.放出热量610 kJ
【思维建模】利用化学键计算反应中能量变化的解答思路如下:
【解析】选A。1个CH4中含4个C—H键,1个O2中含1个
O=O键,1个CO2中含2个C=O键,1个H2O中含2个H—O键。
生成1 mol CO2时,断裂4 mol C—H键和2 mol O=O键,
吸收的热量为Q吸=4EC-H+2 =4×415 kJ+2×498 kJ=
2 656 kJ。形成4 mol H—O键和2 mol C=O键,释放
的热量为Q放=4EO-H+2 =4×465 kJ+2×798 kJ=
3 456 kJ,因为Q放>Q吸,所以反应放热。放出的热量为ΔQ=Q放-Q吸=3 456 kJ-2 656 kJ=800 kJ。
【母题追问】(1)因为甲烷生成二氧化碳的反应是放热反应,能不能说甲烷具有的能量大于二氧化碳
提示:不可以。放热反应是指反应物总能量大于生成物总能量。
(2)当反应生成液态水时,反应放出的热量是变多还是变少
提示:变多。气态水变为液态水时放热。
【误区警示】(1)断裂化学键需要吸收的能量越多,物质内部的能量越低,物质越稳定,即能量越低越稳定。
(2)通过化学键的断裂、形成来计算化学反应中能量变化时,要注意物质内部化学键的数量。
【迁移·应用】
1.(2019·威海高一检测)已知1 g氢气完全燃烧生成水蒸气时放出能量121 kJ,且氧气中1 mol O=O键完全断裂时需要吸收能量496 kJ,水蒸气中1 mol H—O键形成时放出能量463 kJ,则氢气中1 mol H—H键断裂时吸收的能量为 ( )世纪金榜导学号
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
【解析】选C。由1 g H2完全燃烧生成水蒸气时放出能
量121 kJ可知:2 g H2(即含1 mol H—H键)完全燃烧生
成水蒸气时放出的能量为121 kJ×2=242 kJ。由化学
方程式:H2(g)+ O2(g) H2O(g),可设1 mol H—H键
断裂吸收的能量为Q,则:Q+ ×496 kJ-2×463 kJ=
-242 kJ,Q=436 kJ。
2.下列关于反应能量的说法中正确的是 ( )
A.化学反应中的能量变化,都表现为热量的变化
B.化学键的断裂和形成是化学反应中能量变化的主要原因
C.已知反应:Zn(s)+CuSO4(aq)====ZnSO4(aq)+Cu(s)为放热反应,则反应物总能量<生成物总能量
D.相同条件下,如果1 mol氢原子所具有的能量为E1,
1 mol氢分子的能量为E2,则2E1=E2
【解析】选B。化学反应中的能量变化,不是都表现为热量的变化,还可能有其他能量的变化,如光能等,A项错误;放热反应中反应物的总能量大于生成物的总能量,C项错误;分子变成原子需要破坏化学键,吸收能量,2E1>E2,D项错误。
【补偿训练】
(2019·南京高一检测)化学反应的发生必然伴随有能量的转化,其最根本的原因是 ( )
A.化学反应中一定有新物质生成
B.化学反应中旧的化学键断裂需要吸收能量,新的化学键生成需要放出能量
C.化学反应通常需要加热等条件才能发生
D.能量变化是化学反应的基本特征之一
【解析】选B。化学反应是吸热还是放热,取决于反应
过程中旧化学键断裂吸收的总能量与新化学键形成放
出的总能量的相对多少,或生成物具有的总能量与反应
物具有的总能量的相对大小。任何化学反应,反应物中
化学键与生成物中化学键均不可能相同,或者说反应物
与生成物不可能相同,故旧键断裂吸收的能量与新键形
成放出的能量不可能相等,反应物具有的能量与生成物具有的能量不可能相等。
【素养提升】
合成氨指由氮和氢在高温高压和催化剂条件下直接合
成的氨,为一种基本无机化工流程。合成氨工业在20世
纪初期形成,开始用氨作火炸药工业的原料,为战争服
务,第一次世界大战结束后,转向为农业、工业服务。
随着科学技术的发展,对氨的需求量日益增长。德国化
学家哈伯从1902年开始研究由氮气和氢气直接合成氨,
于1908年申请专利,即“循环法”。
氨的合成反应为N2+3H2 2NH3,1 mol N2完全
反应时放出的能量为92.4 kJ。若断开1 mol H—H键吸
收的能量为436 kJ,形成1 mol H—N键放出的能量为
391 kJ,请判断断开1 mol N≡N键需吸收的能量是多少
提示:945.6 kJ。设断开1 mol N≡N键需吸收的能量为x,根据反应放出的能量=形成新键放出的能量-断开旧键吸收的能量,代入数据:92.4 kJ=6×391 kJ-3×
436 kJ-x,x=945.6 kJ。
知识点二 放热反应和吸热反应的比较
【重点释疑】
放热反应和吸热反应的比较
类型
比较 放热反应 吸热反应
定 义 释放热量的化学反应 吸收热量的化学反应
类型比较 放热反应 吸热反应
形成
原因 反应物具有的总能量大于生成物具有的总能量 反应物具有的总能量小于生成物具有的总能量
图示
类型比较 放热反应 吸热反应
常见
类型 (1)大多数化合反应;
(2)酸碱中和反应;
(3)燃烧反应,如木炭、CH4、
H2、CO等在空气中的燃烧,
H2在Cl2中的燃烧等;
(4)金属与酸的反应;
(5)铝热反应;
(6)活泼金属氧化物与水反应 (1)大多数分解反
应,如CaCO3
CaO+CO2↑等;
(2)Ba(OH)2·8H2O
与NH4Cl固体反应;
(3)C与水蒸气反
应、C与CO2反应等
【易错提醒】化学反应中能量变化的“不一定”
(1)需加热才能发生的反应不一定是吸热反应,如碳和氧气的反应。
(2)放热反应常温下不一定容易发生,如铝热反应。
(3)吸热反应也不一定需要加热,如Ba(OH)2·8H2O晶体和NH4Cl晶体的反应。
(4)放热(或吸热)过程不一定是放热(或吸热)反应,如冰融化是吸热过程而不是吸热反应。
【思考·讨论】
如图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混合,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是什么
提示:遇到水放热的物质一般用生石灰。
【案例示范】
【典例】结合已知信息判断下列反应是吸热反应还是放热反应:
(1)通过反应物、产物能量的变化判断下列反应是吸热反应还是放热反应:
(2)通过计算判断反应H2+Cl2 2HCl是放热反应还是
吸热反应。
(3)如图通过实验现象判断反应是吸热反应还是放热反应。现象: 反应后发现沾有水的玻璃片和烧杯冻在一起。
(4)根据常见的放热反应和吸热反应判断下列反应哪些属于放热反应:①Al与Fe2O3的反应 ②Mg与CH3COOH溶液的反应 ③燃烧反应 ④中和反应 ⑤复分解反应
【解析】(1)反应A中反应物能量小于生成物能量,是吸热反应,反应B中反应物能量大于生成物能量是放热反应。
(2)断裂旧化学键吸收的总能量应该是断裂1 mol H—H键与1 mol Cl—Cl键所吸收的能量之和,即436 kJ+
243 kJ=679 kJ。形成新化学键放出的总能量应该是
形成2 mol H—Cl键所放出的能量,即2×431 kJ=
862 kJ。放出的能量大于吸收的能量,所以反应是放热反应。
(3)反应后水结冰,说明反应吸热,是吸热反应。
(4)常见的放热反应有:燃烧反应、酸碱中和反应、铝热反应、活泼金属与酸或H2O的反应
答案:(1)A吸热反应、B放热反应
(2)放热反应 (3)吸热反应 (4)①②③④
【迁移·应用】
(2018·天津合格考)下列反应过程中的能量变化符合如图所示的是 ( )
A.CH4的燃烧
B.CaCO3的分解
C.Mg和稀硫酸的反应
D.酸和碱的中和反应
【解析】选B。由图可知,反应物能量小于生成物能量,是吸热反应,碳酸钙分解是吸热反应。
【补偿训练】
1.下列反应符合图示的是 ( )
A.铝片与盐酸的反应
B.Ba(OH)2·8H2O与NH4Cl晶体的反应
C.酸碱中和反应
D.甲烷在氧气中的燃烧反应
【解析】选B。据图可知,该反应属于吸热反应。给出的四个反应中,活泼金属与酸反应、中和反应及燃烧反应均是放热反应,Ba(OH)2·8H2O与NH4Cl晶体的反应是吸热反应。
2.下列说法正确的是 ( )
A.化学反应都伴随着能量的变化,通常表现为热量的变化
B.需要加热的反应一定是吸收热量的反应
C.电解水生成氢气和氧气的反应是吸热反应,又是分解反应,所以分解反应一定是吸收热量的反应
D.放出热量的反应常温下易发生
【解析】选A。化学反应中的能量变化通常表现为热量
的变化,也可表现为光能或电能的变化,A项正确;反应是吸收还是放出热量,决定于反应物断键吸收的能量与形成生成物中的新键释放的能量的相对大小,与反应时是否加热或反应类型等无必然联系,B、C两项不正确;一个化学反应是否易发生与许多因素有关,放出热量的反应在常温下也不一定易发生,如燃烧反应等,D项不正确。
【规律方法】放热反应和吸热反应的判断方法
(1)根据反应物和生成物的总能量大小判断。
(2)根据化学键断裂和形成时能量变化大小关系判断。
(3)根据经验规律判断——用常见吸热和放热的反应类型来判断。
(4)根据生成物和反应物的相对稳定性判断——由稳定的物质生成不稳定的物质的反应为吸热反应,反之为放热反应。
【课堂回眸】
第2节 化学反应与能量转化
第1课时 化学反应中能量变化的本质及转化形式
一、实验探究化学变化中的能量变化
1.【活动探究】
实验操作 实验现象 有关化学方程式或结论
镁粉逐渐_____,
生成_____,反应
后溶液温度_____ ____________
__________;
反应是_____反应
溶解
气泡
升高
Mg+2HCl====
MgCl2+H2↑
放热
实验操作 实验现象 有关化学方程式或结论
反应生成_____,
反应后溶液温度
_____ 反应是
_____反应
气泡
降低
吸热
2.结论:每一个化学反应都伴随着能量的变化,有的反应
_____能量(放热反应),有的反应_____能量(吸热反应)。
释放
吸收
【情境·思考】
古诗《石灰吟》:
千锤万凿出深山,烈火焚烧若等闲。
粉骨碎身浑不怕,要留清白在人间。
是一首托物言志诗。作者以石灰作比喻,表达自己为国尽忠,不怕牺牲的意愿和坚守高洁的决心。通过古诗的描述,制取石灰的反应是放热反应还是吸热反应 石灰遇水的反应呢
提示:碳酸钙变为氧化钙的反应为吸热反应,氧化钙变为氢氧化钙的反应为放热反应。
二、化学反应中能量变化的实质和原因分析
1.化学反应的实质
2.化学反应中能量变化的原因
(1)能量变化的原因:旧化学键破坏时要_____能量(E1),
新化学键形成时要_____能量(E2)。
吸收
释放
(2)反应吸收能量和放出能量的原因:
①从化学键角度分析:若E1>E2,则反应_____能量;若E1
应_____能量;若 ,则反应_____能量。
吸收
释放
放出
吸收
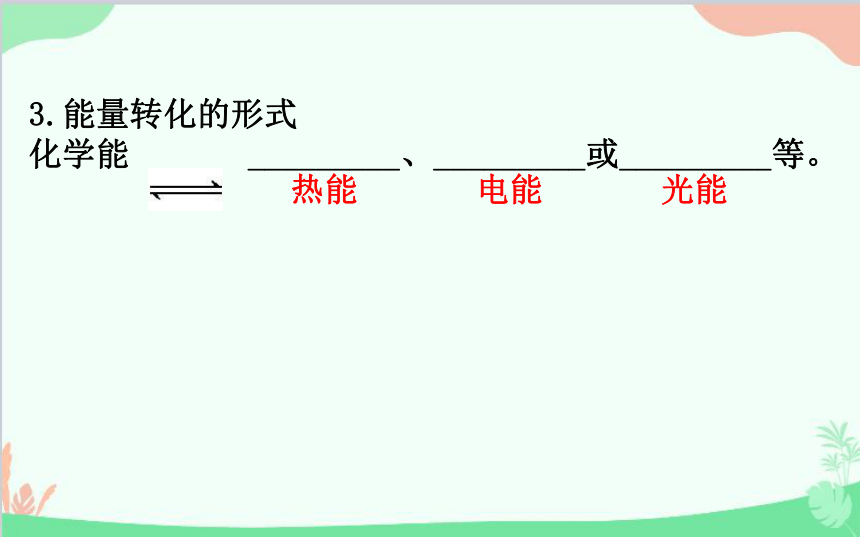
3.能量转化的形式
化学能 _________、_________或_________等。
热能
电能
光能
4.计算
根据下列信息分析氢气燃烧生成水蒸气时能量的变化情况
(1)断裂1 mol H2和 mol O2中的化学键吸收的总能量:
_____________________。
(2)形成1 mol H2O时释放的总能量:_______。
(3)燃烧1 mol H2生成水蒸气时_____能量____kJ。
436 kJ+249 kJ=685 kJ
930 kJ
放出
245
【微思考】
是不是放热反应不需要加热就能发生 吸热反应需要加热才能发生
提示:不是。反应是放热反应还是吸热反应与反应的条件无关,如煤的燃烧是放热反应,但一般需要加热才能发生;氯化铵和氢氧化钙的反应是吸热反应,但不加热就能发生。
【巧判断】
(1)化学反应过程中不一定都有能量变化 ( )
提示:×。因为化学变化中需断裂的化学键与形成的化学键不同,所以一定伴随着能量的变化。
(2)镁带燃烧时,化学能全部转化为热能 ( )
提示:×。镁带燃烧时发出耀眼的白光,所以化学能一部分变为光能。
(3)有能量放出的变化都是放热反应,吸收能量的变化都是吸热反应 ( )
提示:×。物理变化也可能伴随着能量的变化。
知识点一 化学反应中能量的变化原因及计算
【重点释疑】
1.化学反应的能量变化分析:
(1)从化学键的角度:
①E1>E2:反应吸收能量(吸热反应)。
②E1
(2)从物质内部能量变化的角度——“两个过程”:
①可以看作是热能、电能或光能等物质外部的能量被“储存”起来的过程。
②可以看作是“储存”在物质内部的能量(化学能)转化成热能、光能或电能等释放出来的过程。
2.化学反应中能量计算的步骤
(1)根据化学方程式确定断键、成键的物质的量。
(2)确定断键吸收的总能量和成键释放的总能量。
(3)计算反应的能量变化:
①若反应释放能量。
E=成键时释放能量之和-断键时吸收能量之和
②若反应吸收能量。
E=断键时吸收能量之和-成键时释放能量之和
【易错提醒】分析化学反应中的能量变化时,应注意以下两点:
(1)物质所含能量越低越稳定。化学反应中的能量变化与化学键的断裂和形成有关,断裂化学键吸收的能量等于形成该化学键时释放的能量,能量值越大,化学键越牢固,物质本身越稳定,物质的能量越低。
(2)由于任何化学反应中都存在化学键的断裂与生成,因此,任何化学反应在发生物质变化的同时必然发生能量的变化。也就是说任何化学反应中反应物具有的总能量与生成物具有的总能量一定不相等。
【思考·讨论】
如图,若试管中的无色液体是稀硫酸,向其中加入镁条,可以观察到U形管中有什么现象 产生此现象的原因是什么
提示:看到U形管a端液面下降,b端液面上升。原因是镁条与稀硫酸反应放热,致使瓶内气压大于外界气压,从而将U形管中的红色墨水压往U形管的右侧。
【案例示范】
【典例】下表中的数据表示破坏1 mol化学键需消耗的
能量,根据表中数据计算以下反应生成1 mol CO2时的
热量变化 ( )
CH4(g)+2O2(g) CO2(g)+2H2O(g)
化学键 C—H O—O O=O C—O C=O H—O
能量(kJ) 415 138 498 343 798 465
A.放出热量800 kJ
B.放出热量1 520 kJ
C.吸收热量110 kJ
D.放出热量610 kJ
【思维建模】利用化学键计算反应中能量变化的解答思路如下:
【解析】选A。1个CH4中含4个C—H键,1个O2中含1个
O=O键,1个CO2中含2个C=O键,1个H2O中含2个H—O键。
生成1 mol CO2时,断裂4 mol C—H键和2 mol O=O键,
吸收的热量为Q吸=4EC-H+2 =4×415 kJ+2×498 kJ=
2 656 kJ。形成4 mol H—O键和2 mol C=O键,释放
的热量为Q放=4EO-H+2 =4×465 kJ+2×798 kJ=
3 456 kJ,因为Q放>Q吸,所以反应放热。放出的热量为ΔQ=Q放-Q吸=3 456 kJ-2 656 kJ=800 kJ。
【母题追问】(1)因为甲烷生成二氧化碳的反应是放热反应,能不能说甲烷具有的能量大于二氧化碳
提示:不可以。放热反应是指反应物总能量大于生成物总能量。
(2)当反应生成液态水时,反应放出的热量是变多还是变少
提示:变多。气态水变为液态水时放热。
【误区警示】(1)断裂化学键需要吸收的能量越多,物质内部的能量越低,物质越稳定,即能量越低越稳定。
(2)通过化学键的断裂、形成来计算化学反应中能量变化时,要注意物质内部化学键的数量。
【迁移·应用】
1.(2019·威海高一检测)已知1 g氢气完全燃烧生成水蒸气时放出能量121 kJ,且氧气中1 mol O=O键完全断裂时需要吸收能量496 kJ,水蒸气中1 mol H—O键形成时放出能量463 kJ,则氢气中1 mol H—H键断裂时吸收的能量为 ( )世纪金榜导学号
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
【解析】选C。由1 g H2完全燃烧生成水蒸气时放出能
量121 kJ可知:2 g H2(即含1 mol H—H键)完全燃烧生
成水蒸气时放出的能量为121 kJ×2=242 kJ。由化学
方程式:H2(g)+ O2(g) H2O(g),可设1 mol H—H键
断裂吸收的能量为Q,则:Q+ ×496 kJ-2×463 kJ=
-242 kJ,Q=436 kJ。
2.下列关于反应能量的说法中正确的是 ( )
A.化学反应中的能量变化,都表现为热量的变化
B.化学键的断裂和形成是化学反应中能量变化的主要原因
C.已知反应:Zn(s)+CuSO4(aq)====ZnSO4(aq)+Cu(s)为放热反应,则反应物总能量<生成物总能量
D.相同条件下,如果1 mol氢原子所具有的能量为E1,
1 mol氢分子的能量为E2,则2E1=E2
【解析】选B。化学反应中的能量变化,不是都表现为热量的变化,还可能有其他能量的变化,如光能等,A项错误;放热反应中反应物的总能量大于生成物的总能量,C项错误;分子变成原子需要破坏化学键,吸收能量,2E1>E2,D项错误。
【补偿训练】
(2019·南京高一检测)化学反应的发生必然伴随有能量的转化,其最根本的原因是 ( )
A.化学反应中一定有新物质生成
B.化学反应中旧的化学键断裂需要吸收能量,新的化学键生成需要放出能量
C.化学反应通常需要加热等条件才能发生
D.能量变化是化学反应的基本特征之一
【解析】选B。化学反应是吸热还是放热,取决于反应
过程中旧化学键断裂吸收的总能量与新化学键形成放
出的总能量的相对多少,或生成物具有的总能量与反应
物具有的总能量的相对大小。任何化学反应,反应物中
化学键与生成物中化学键均不可能相同,或者说反应物
与生成物不可能相同,故旧键断裂吸收的能量与新键形
成放出的能量不可能相等,反应物具有的能量与生成物具有的能量不可能相等。
【素养提升】
合成氨指由氮和氢在高温高压和催化剂条件下直接合
成的氨,为一种基本无机化工流程。合成氨工业在20世
纪初期形成,开始用氨作火炸药工业的原料,为战争服
务,第一次世界大战结束后,转向为农业、工业服务。
随着科学技术的发展,对氨的需求量日益增长。德国化
学家哈伯从1902年开始研究由氮气和氢气直接合成氨,
于1908年申请专利,即“循环法”。
氨的合成反应为N2+3H2 2NH3,1 mol N2完全
反应时放出的能量为92.4 kJ。若断开1 mol H—H键吸
收的能量为436 kJ,形成1 mol H—N键放出的能量为
391 kJ,请判断断开1 mol N≡N键需吸收的能量是多少
提示:945.6 kJ。设断开1 mol N≡N键需吸收的能量为x,根据反应放出的能量=形成新键放出的能量-断开旧键吸收的能量,代入数据:92.4 kJ=6×391 kJ-3×
436 kJ-x,x=945.6 kJ。
知识点二 放热反应和吸热反应的比较
【重点释疑】
放热反应和吸热反应的比较
类型
比较 放热反应 吸热反应
定 义 释放热量的化学反应 吸收热量的化学反应
类型比较 放热反应 吸热反应
形成
原因 反应物具有的总能量大于生成物具有的总能量 反应物具有的总能量小于生成物具有的总能量
图示
类型比较 放热反应 吸热反应
常见
类型 (1)大多数化合反应;
(2)酸碱中和反应;
(3)燃烧反应,如木炭、CH4、
H2、CO等在空气中的燃烧,
H2在Cl2中的燃烧等;
(4)金属与酸的反应;
(5)铝热反应;
(6)活泼金属氧化物与水反应 (1)大多数分解反
应,如CaCO3
CaO+CO2↑等;
(2)Ba(OH)2·8H2O
与NH4Cl固体反应;
(3)C与水蒸气反
应、C与CO2反应等
【易错提醒】化学反应中能量变化的“不一定”
(1)需加热才能发生的反应不一定是吸热反应,如碳和氧气的反应。
(2)放热反应常温下不一定容易发生,如铝热反应。
(3)吸热反应也不一定需要加热,如Ba(OH)2·8H2O晶体和NH4Cl晶体的反应。
(4)放热(或吸热)过程不一定是放热(或吸热)反应,如冰融化是吸热过程而不是吸热反应。
【思考·讨论】
如图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混合,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是什么
提示:遇到水放热的物质一般用生石灰。
【案例示范】
【典例】结合已知信息判断下列反应是吸热反应还是放热反应:
(1)通过反应物、产物能量的变化判断下列反应是吸热反应还是放热反应:
(2)通过计算判断反应H2+Cl2 2HCl是放热反应还是
吸热反应。
(3)如图通过实验现象判断反应是吸热反应还是放热反应。现象: 反应后发现沾有水的玻璃片和烧杯冻在一起。
(4)根据常见的放热反应和吸热反应判断下列反应哪些属于放热反应:①Al与Fe2O3的反应 ②Mg与CH3COOH溶液的反应 ③燃烧反应 ④中和反应 ⑤复分解反应
【解析】(1)反应A中反应物能量小于生成物能量,是吸热反应,反应B中反应物能量大于生成物能量是放热反应。
(2)断裂旧化学键吸收的总能量应该是断裂1 mol H—H键与1 mol Cl—Cl键所吸收的能量之和,即436 kJ+
243 kJ=679 kJ。形成新化学键放出的总能量应该是
形成2 mol H—Cl键所放出的能量,即2×431 kJ=
862 kJ。放出的能量大于吸收的能量,所以反应是放热反应。
(3)反应后水结冰,说明反应吸热,是吸热反应。
(4)常见的放热反应有:燃烧反应、酸碱中和反应、铝热反应、活泼金属与酸或H2O的反应
答案:(1)A吸热反应、B放热反应
(2)放热反应 (3)吸热反应 (4)①②③④
【迁移·应用】
(2018·天津合格考)下列反应过程中的能量变化符合如图所示的是 ( )
A.CH4的燃烧
B.CaCO3的分解
C.Mg和稀硫酸的反应
D.酸和碱的中和反应
【解析】选B。由图可知,反应物能量小于生成物能量,是吸热反应,碳酸钙分解是吸热反应。
【补偿训练】
1.下列反应符合图示的是 ( )
A.铝片与盐酸的反应
B.Ba(OH)2·8H2O与NH4Cl晶体的反应
C.酸碱中和反应
D.甲烷在氧气中的燃烧反应
【解析】选B。据图可知,该反应属于吸热反应。给出的四个反应中,活泼金属与酸反应、中和反应及燃烧反应均是放热反应,Ba(OH)2·8H2O与NH4Cl晶体的反应是吸热反应。
2.下列说法正确的是 ( )
A.化学反应都伴随着能量的变化,通常表现为热量的变化
B.需要加热的反应一定是吸收热量的反应
C.电解水生成氢气和氧气的反应是吸热反应,又是分解反应,所以分解反应一定是吸收热量的反应
D.放出热量的反应常温下易发生
【解析】选A。化学反应中的能量变化通常表现为热量
的变化,也可表现为光能或电能的变化,A项正确;反应是吸收还是放出热量,决定于反应物断键吸收的能量与形成生成物中的新键释放的能量的相对大小,与反应时是否加热或反应类型等无必然联系,B、C两项不正确;一个化学反应是否易发生与许多因素有关,放出热量的反应在常温下也不一定易发生,如燃烧反应等,D项不正确。
【规律方法】放热反应和吸热反应的判断方法
(1)根据反应物和生成物的总能量大小判断。
(2)根据化学键断裂和形成时能量变化大小关系判断。
(3)根据经验规律判断——用常见吸热和放热的反应类型来判断。
(4)根据生成物和反应物的相对稳定性判断——由稳定的物质生成不稳定的物质的反应为吸热反应,反之为放热反应。
【课堂回眸】
