第五章化工生产中的重要非金属元素 测试题 (含答案)高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第五章化工生产中的重要非金属元素 测试题 (含答案)高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-01 22:02:44 | ||
图片预览


文档简介
第五章《化工生产中的重要非金属元素》测试题
一、单选题(共13题)
1.类推是化学学习和研究中常用的思维方法。下列类推正确的是
A.Mg和Al较活泼,必须通过电解熔融MgCl2和AlCl3制取
B.金属Mg着火不能用干冰灭火,金属Na着火也不能用干冰灭火
C.SO2能使品红溶液褪色,CO2也能使品红溶液褪色
D.F2、Cl2、Br2、I2的熔点依次升高,N2、P4、As、Sb、Bi的熔点也依次升高
2.化学知识与科技、生产、生活有密切的关系。下列叙述中错误的是
A.“天宫二号”空间运行的动力源泉——太阳能电池帆板,其核心材料为晶体硅
B.“天问一号”火星车使用的保温材料——纳米气凝胶,具有丁达尔效应
C.三星堆二号祭祀坑出土商代的铜人铜像填补了我国考古学、青铜文化史上的诸多空白。青铜器的出土表明我国商代已经掌握冶炼铜技术
D.“北斗系统”组网成功,北斗芯片中的半导体材料为二氧化硅
3.实验室合成乙酰苯胺的路线如图(部分反应条件略去),下列说法正确的是
已知:①酰胺键在通常情况下较难水解,在酸或碱的存在下加热时,则可加速反应
②—NH2可结合氢离子
③20℃时乙酰苯胺在乙醇中的溶解度为36.9g,乙酰苯胺在水中的溶解度如表:
温度/℃ 25 50 80 100
溶解度/g 0.56 0.84 3.5 5.5
A.制备硝基苯时,为了减少苯的挥发和硝酸分解,应用酒精灯小火加热
B.反应②中加入酸的量的多少不会影响乙酰苯胺产率
C.除去乙酰苯胺中的乙酸步骤:水洗→碱洗→水洗,检验乙酸是否除尽的方法是:取最后一次洗涤液用pH试纸测量溶液pH,看pH是否约为7
D.若要得到纯度更高的乙酰苯胺,可通过采用重结晶方法提纯,所用试剂为水
4.下列实验操作中正确的是
A.称量NaOH固体时,将NaOH固体放在垫有滤纸的托盘上
B.进行蒸发操作时,待有大量晶体析出时应停止加热,利用余热蒸干
C.进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
D.分液时,先从分液漏斗下口放出下层液体,再继续从下口放出上层液体
5.NA为阿伏加德罗常数的值。下列说法正确的是
A.一定条件下,分子总数为NA的ClO2和CO2混合气体中含有的氧原子数为2NA
B.常温常压下,活泼金属从盐酸中置换出22.4LH2,发生转移的电子数为2NA
C.在加热条件下,足量的铜与含2molH2SO4的浓硫酸充分反应,转移的电子数为2NA
D.常温常压下,36g18O2中所含的中子为16NA
6.下列关于元素及其化合物的性质说法不正确的是
A.金属单质Na、Mg、Fe在一定条件下与水反应都生成和相应的碱
B.氯气通入冷的石灰乳中制得漂白粉
C.铜与浓硝酸反应可产生红棕色的
D.工业上用焦炭还原石英砂可制得粗硅和CO
7.下列离子方程式书写正确的是
A.向氯化亚铁溶液中通入氯气:
B.向稀硝酸中加入少量亚硫酸钾溶液:
C.向碳酸氢铵溶液中加入过量石灰水并加热:
D.用稀硫酸除去铁锈:
8.下列除杂方法不正确的是
选项 物质(杂质) 除杂试剂 操作方法
A. CO2(SO2) 饱和碳酸氢钠溶液、浓硫酸 先通过饱和碳酸氢钠溶液洗气,再用浓硫酸干燥
B. H2O(Br2) CCl4 萃取、分液
C. FeCl3(CuCl2) 过量铁粉、氯气 向溶液中加入过量铁粉,过滤,向滤液中通入过量氯气
D. KNO3(KCl) AgNO3溶液 向溶液中滴加适量AgNO3溶液
A.A B.B C.C D.D
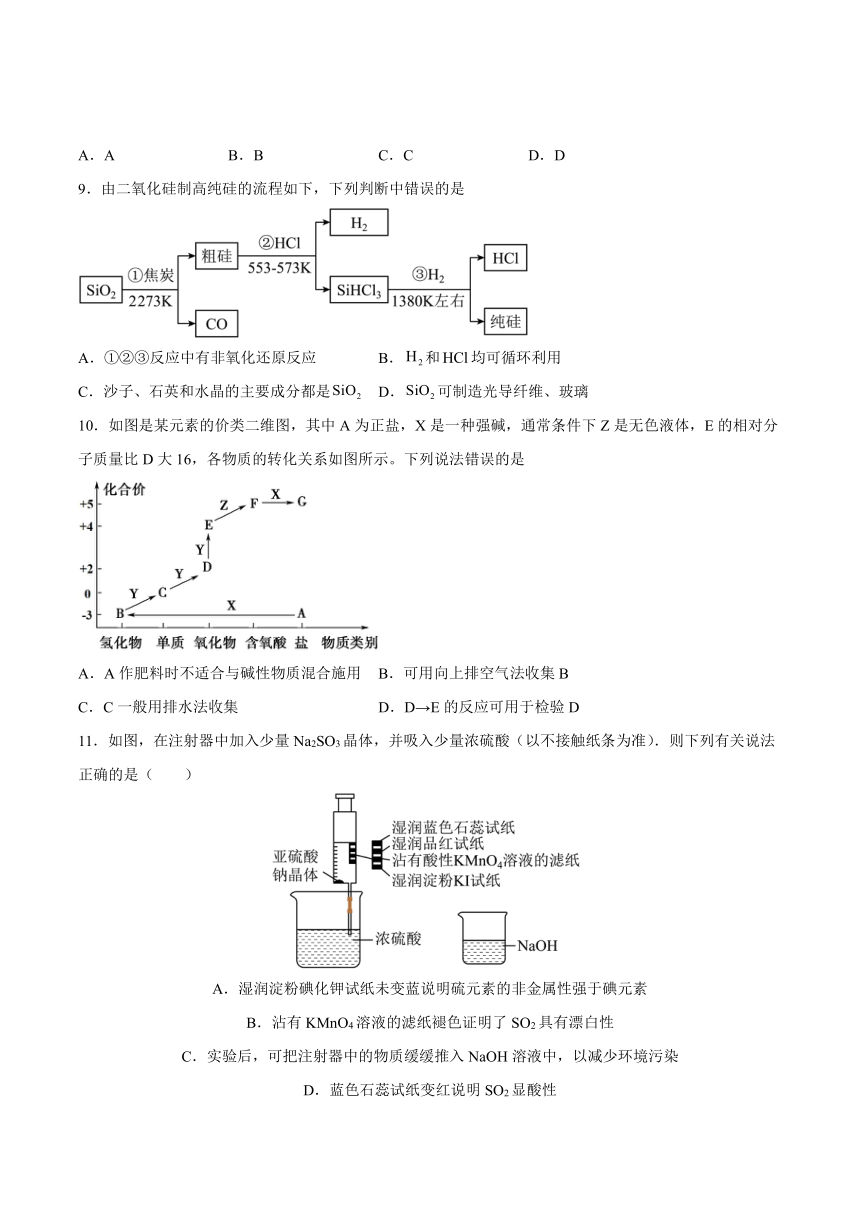
9.由二氧化硅制高纯硅的流程如下,下列判断中错误的是
A.①②③反应中有非氧化还原反应 B.和均可循环利用
C.沙子、石英和水晶的主要成分都是 D.可制造光导纤维、玻璃
10.如图是某元素的价类二维图,其中A为正盐,X是一种强碱,通常条件下Z是无色液体,E的相对分子质量比D大16,各物质的转化关系如图所示。下列说法错误的是
A.A作肥料时不适合与碱性物质混合施用 B.可用向上排空气法收集B
C.C一般用排水法收集 D.D→E的反应可用于检验D
11.如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
A.湿润淀粉碘化钾试纸未变蓝说明硫元素的非金属性强于碘元素
B.沾有KMnO4溶液的滤纸褪色证明了SO2具有漂白性
C.实验后,可把注射器中的物质缓缓推入NaOH溶液中,以减少环境污染
D.蓝色石蕊试纸变红说明SO2显酸性
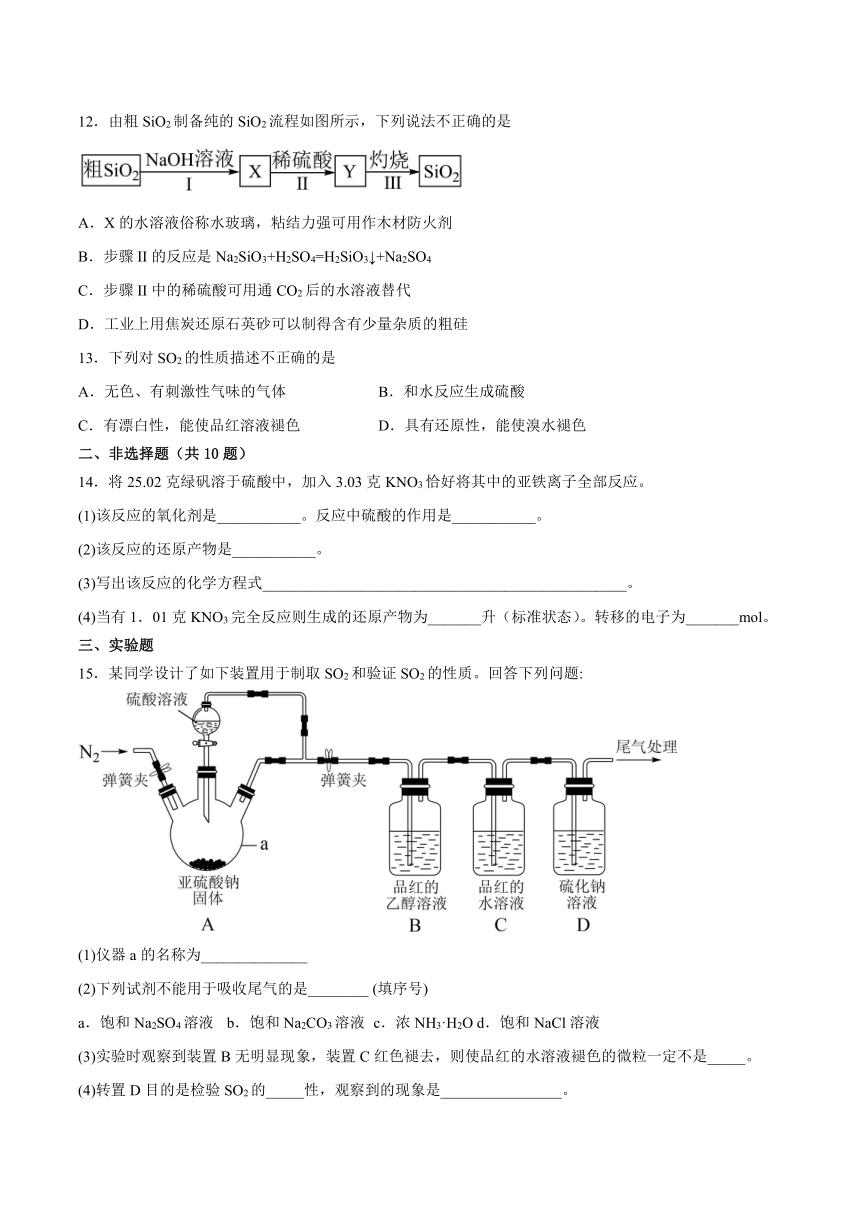
12.由粗SiO2制备纯的SiO2流程如图所示,下列说法不正确的是
A.X的水溶液俗称水玻璃,粘结力强可用作木材防火剂
B.步骤II的反应是Na2SiO3+H2SO4=H2SiO3↓+Na2SO4
C.步骤II中的稀硫酸可用通CO2后的水溶液替代
D.工业上用焦炭还原石英砂可以制得含有少量杂质的粗硅
13.下列对SO2的性质描述不正确的是
A.无色、有刺激性气味的气体 B.和水反应生成硫酸
C.有漂白性,能使品红溶液褪色 D.具有还原性,能使溴水褪色
二、非选择题(共10题)
14.将25.02克绿矾溶于硫酸中,加入3.03克KNO3恰好将其中的亚铁离子全部反应。
(1)该反应的氧化剂是___________。反应中硫酸的作用是___________。
(2)该反应的还原产物是___________。
(3)写出该反应的化学方程式________________________________________________。
(4)当有1.01克KNO3完全反应则生成的还原产物为_______升(标准状态)。转移的电子为_______mol。
三、实验题
15.某同学设计了如下装置用于制取SO2和验证SO2的性质。回答下列问题:
(1)仪器a的名称为______________
(2)下列试剂不能用于吸收尾气的是________ (填序号)
a.饱和Na2SO4溶液 b.饱和Na2CO3溶液 c.浓NH3·H2O d.饱和NaCl溶液
(3)实验时观察到装置B无明显现象,装置C红色褪去,则使品红的水溶液褪色的微粒一定不是_____。
(4)转置D目的是检验SO2的_____性,观察到的现象是________________。
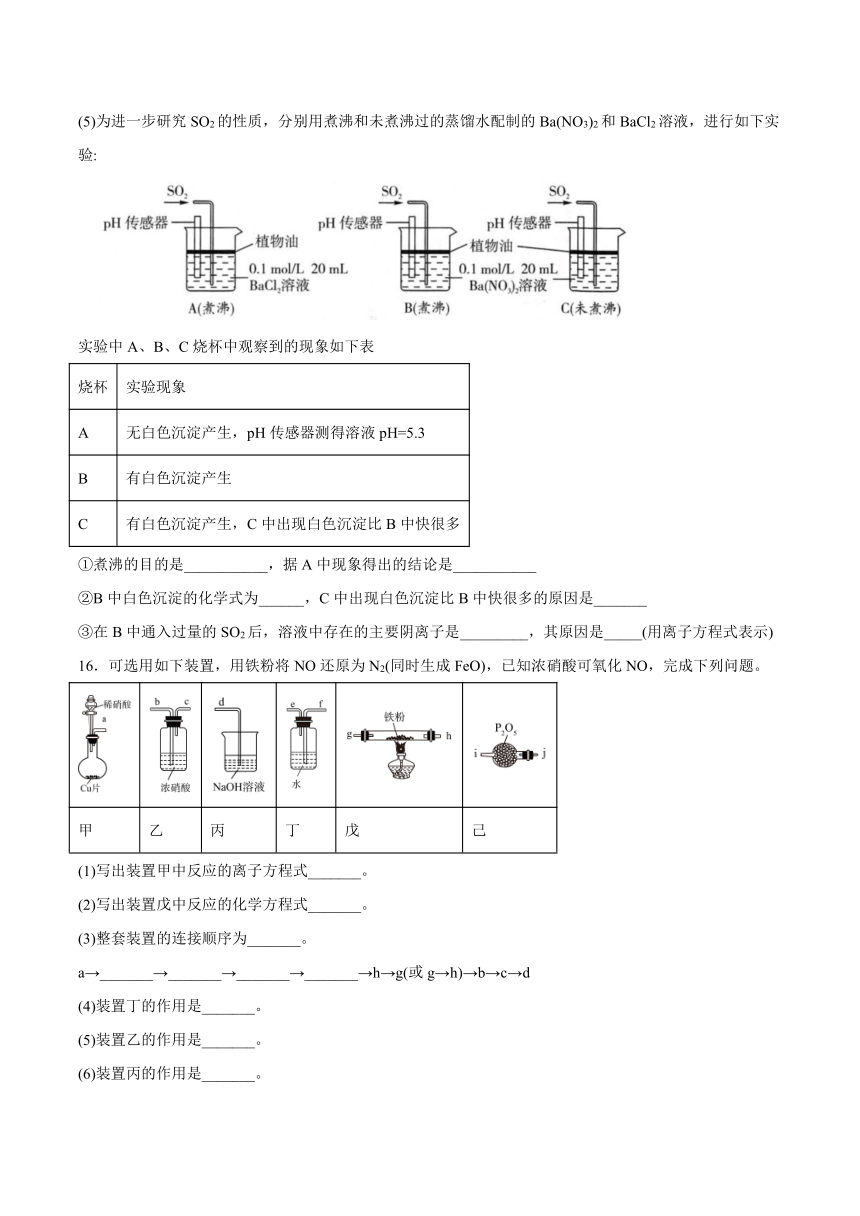
(5)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制的Ba(NO3)2和BaCl2溶液,进行如下实验:
实验中A、B、C烧杯中观察到的现象如下表
烧杯 实验现象
A 无白色沉淀产生,pH传感器测得溶液pH=5.3
B 有白色沉淀产生
C 有白色沉淀产生,C中出现白色沉淀比B中快很多
①煮沸的目的是___________,据A中现象得出的结论是___________
②B中白色沉淀的化学式为______,C中出现白色沉淀比B中快很多的原因是_______
③在B中通入过量的SO2后,溶液中存在的主要阴离子是_________,其原因是_____(用离子方程式表示)
16.可选用如下装置,用铁粉将NO还原为N2(同时生成FeO),已知浓硝酸可氧化NO,完成下列问题。
甲 乙 丙 丁 戊 己
(1)写出装置甲中反应的离子方程式_______。
(2)写出装置戊中反应的化学方程式_______。
(3)整套装置的连接顺序为_______。
a→_______→_______→_______→_______→h→g(或g→h)→b→c→d
(4)装置丁的作用是_______。
(5)装置乙的作用是_______。
(6)装置丙的作用是_______。
17.为探究的性质,采用下列实验装置制少量并进行相应的实验探究:
(1)装置A中盛放浓硫酸的仪器名称是___________。
(2)若B中的试剂是品红溶液,B中溶液红色褪去,表现的性质___________。
(3)若B中的试剂是酸性溶液,则B中的现象是___________,写出反应的离子方程式(被还原为)___________。
(4)装置C中倒置漏斗的作用是___________,反应的离子方程式为___________。
(5)已知:可还原某含碲物质(主要成分为)溶液可得到粗碲。具体实验操作为:取该溶液于烧瓶中,加入适量,加热到一定温度,持续通入,待反应一定时间,过滤得到粗碲。在一定条件下,碲沉淀率与温度、还原时间的变化曲线分别如图1、图2所示:
①由图可知,最适宜的温度和还原时间分别为___________。
②图1中80℃后,升高温度,碲沉淀率几乎不再升高,甚至有下降趋势。可能的原因是________。
四、计算题
18.将某浓度的NH4HSO4溶液,加入到50mLNaOH溶液中并加热,得气体标况下体积如下表:
V(NH4HSO4)/mL 30 60 90 120 150
产生气体体积/L 0.672 0.896 0.224 0 0
(1)等浓度的NH4HSO4与NaOH溶液,体积比为1:2混合并加热的离子方程式______。
(2)c(NaOH)=_______。
19.在标准状况下,用以下气体做喷泉实验,请根据情况,填写烧瓶中溶液的物质的量浓度(假设烧瓶中溶质不能扩散出来)。
(1)用HCl气体做喷泉实验,喷泉结束后,水充满烧瓶,则溶液的物质的量浓度为_______;
(2)用NH3做喷泉实验时,喷泉结束后,水充满烧瓶,则溶液的物质的量浓度为____________;
(3)用NO2做喷泉实验时,喷泉结束后,水充至烧瓶的处,则溶液的物质的量浓度为____________;
(4)用NO2和O2按4∶1体积比混合,喷泉结束后,水充满烧瓶,则溶液的物质的量浓度为________。
20.把40g含二氧化硅的碳酸钙固体在高温下加热到质量不再改变为止,冷却后称得质量为26.8g。求:
(1)生成的二氧化碳在标准状况下的体积为____升?
(2)原混合物中SiO2的质量为_____克?
21.A~F为初中化学常见的六种物质,且都含有一种相同元素,它们相互间的关系如图所示。已知A、B、C、D、E是不同类别的物质,C俗称纯碱,F是人体中含量最多的物质。(部分反应物、生成物及反应条件已略去)
请回答:
(1)写出B、D、F的化学式:B____,D____,F_____。
(2)写出B物质的一种用途_____,C与E反应的化学方程式是_________。
(3)图中物质相互间发生的反应。未涉及的基本反应类型是________。
22.Ⅰ.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C 外,另一产物是盐酸盐。
(1)A物质的化学式为_______,与A物质对应的酸式盐溶液与足量NaOH溶液加热条件下反应的离子方程式为_______ 。
(2)当X为强酸时,B的电子式为_______,B与D发生反应的化学方程式为_______。
(3)当X为强碱时,写出足量B与Cl2反应的化学方程式_______。
Ⅱ.金属铝在酸性或碱性溶液中均可与发生氧化还原反应,转化关系如下:
已知气体D和F反应可生成盐。请回答下列问题:
(4)气体D和A溶液反应生成白色沉淀,该反应的离子方程式为_______。
(5)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C或E都转化为无毒的气态单质,任意写出其中一个反应的化学方程式:_______。
(6)自来水中的对人类健康产生危害。为了降低自来水中的浓度,某研究人员提出在碱性条件下用Al粉还原,根据框图信息写出铝在碱性条件下与反应的离子方程式:_______。
(7)除去气体C中的杂质气体E的化学方法:_______(用化学方程式表示)。
23.化合物X是一种常用的食品抗氧化剂,某学习小组为探究X(仅含3种元素)的组成和性质,设计如下实验(假设各步反应均完全,生成的气体全部逸出)
已知:固体A的焰色试验呈黄色;气体C可使品红溶液褪色,且加热后品红恢复红色。
(1)白色沉淀B的化学式_______,组成X的3种元素_______。
(2)写出反应①的离子方程式_______。
(3)工业上可以用碳酸钠和气体C制备X,请写出相应的化学方程式_______。
参考答案:
1.B 2.D 3.D 4.B 5.A 6.A 7.A 8.D 9.A 10.B 11.C 12.C 13.B
14. KNO3 提供酸性环境 NO 6FeSO4+4H2SO4+ 2KNO3=3Fe2(SO4)3+K2SO4+4H2O+2NO↑ 0.224 0.03
15. 三颈烧瓶 ad SO2 氧化 有淡黄色沉淀产生 除去溶液中溶解的O2 SO2可溶于水,溶于水的二氧化硫部分与水反应生成亚硫酸使溶液呈酸性;SO2与BaCl2不能发生复分解反应 BaSO4 在水溶液中O2氧化SO2比NO氧化SO2活化能小 SO Ba2++2NO+3SO2+2H2O=BaSO4↓+2NO+2SO+4H+
16.(1)3Cu+8H++2NO=3Cu2++2NO↑+4H2O
(2)2NO+2Fe2FeO+N2
(3)a→f→e→j→i→h→g(或g→h)→b→c→d
(4)吸收HNO3,除去NO2
(5)将NO氧化成NO2,便于后续装置吸收
(6)除去尾气中的NO2,防止污染环境
17.(1)分液漏斗
(2)漂白性
(3) 酸性溶液褪色 5SO2+2+2H2O =5SO+2Mn2++4H+
(4) 防倒吸 SO2+2OH-=SO+H2O
(5) 80℃,2.0h SO2的溶解度随着温度的升高而降低,SO2浓度降低,粗碲的产率会降低
18.(1)+H++2OH-NH3↑+2H2O
(2)2mol/L
19. 0.045 mol·L-1 0.045 mol·L-1 0.045 mol·L-1 0.036 mol·L-1
20. 6.72 10
21. CO2 H2SO4或者HNO3 H2O 灭火 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 置换反应
22. (NH4)2S +HS-+2OH-NH3↑+2H2O+S2- 2H2S+SO2=3S+2H2O 8NH3+3Cl2=6NH4Cl+N2 Al3++3NH3+3H2O=Al(OH)3↓+3 6NO+4NH35N2+6H2O(或6NO2+8NH37N2+12H2O) 8Al+3+5OH-+2H2O=8+3NH3↑ 3NO2+H2O=2HNO3+NO
23.(1) BaSO4 Na、S、O(或钠、硫、氧)
(2)SO2+Cl2+2H2O=4H++SO+2Cl-
(3)Na2CO3+2SO2=Na2S2O5+CO2
一、单选题(共13题)
1.类推是化学学习和研究中常用的思维方法。下列类推正确的是
A.Mg和Al较活泼,必须通过电解熔融MgCl2和AlCl3制取
B.金属Mg着火不能用干冰灭火,金属Na着火也不能用干冰灭火
C.SO2能使品红溶液褪色,CO2也能使品红溶液褪色
D.F2、Cl2、Br2、I2的熔点依次升高,N2、P4、As、Sb、Bi的熔点也依次升高
2.化学知识与科技、生产、生活有密切的关系。下列叙述中错误的是
A.“天宫二号”空间运行的动力源泉——太阳能电池帆板,其核心材料为晶体硅
B.“天问一号”火星车使用的保温材料——纳米气凝胶,具有丁达尔效应
C.三星堆二号祭祀坑出土商代的铜人铜像填补了我国考古学、青铜文化史上的诸多空白。青铜器的出土表明我国商代已经掌握冶炼铜技术
D.“北斗系统”组网成功,北斗芯片中的半导体材料为二氧化硅
3.实验室合成乙酰苯胺的路线如图(部分反应条件略去),下列说法正确的是
已知:①酰胺键在通常情况下较难水解,在酸或碱的存在下加热时,则可加速反应
②—NH2可结合氢离子
③20℃时乙酰苯胺在乙醇中的溶解度为36.9g,乙酰苯胺在水中的溶解度如表:
温度/℃ 25 50 80 100
溶解度/g 0.56 0.84 3.5 5.5
A.制备硝基苯时,为了减少苯的挥发和硝酸分解,应用酒精灯小火加热
B.反应②中加入酸的量的多少不会影响乙酰苯胺产率
C.除去乙酰苯胺中的乙酸步骤:水洗→碱洗→水洗,检验乙酸是否除尽的方法是:取最后一次洗涤液用pH试纸测量溶液pH,看pH是否约为7
D.若要得到纯度更高的乙酰苯胺,可通过采用重结晶方法提纯,所用试剂为水
4.下列实验操作中正确的是
A.称量NaOH固体时,将NaOH固体放在垫有滤纸的托盘上
B.进行蒸发操作时,待有大量晶体析出时应停止加热,利用余热蒸干
C.进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
D.分液时,先从分液漏斗下口放出下层液体,再继续从下口放出上层液体
5.NA为阿伏加德罗常数的值。下列说法正确的是
A.一定条件下,分子总数为NA的ClO2和CO2混合气体中含有的氧原子数为2NA
B.常温常压下,活泼金属从盐酸中置换出22.4LH2,发生转移的电子数为2NA
C.在加热条件下,足量的铜与含2molH2SO4的浓硫酸充分反应,转移的电子数为2NA
D.常温常压下,36g18O2中所含的中子为16NA
6.下列关于元素及其化合物的性质说法不正确的是
A.金属单质Na、Mg、Fe在一定条件下与水反应都生成和相应的碱
B.氯气通入冷的石灰乳中制得漂白粉
C.铜与浓硝酸反应可产生红棕色的
D.工业上用焦炭还原石英砂可制得粗硅和CO
7.下列离子方程式书写正确的是
A.向氯化亚铁溶液中通入氯气:
B.向稀硝酸中加入少量亚硫酸钾溶液:
C.向碳酸氢铵溶液中加入过量石灰水并加热:
D.用稀硫酸除去铁锈:
8.下列除杂方法不正确的是
选项 物质(杂质) 除杂试剂 操作方法
A. CO2(SO2) 饱和碳酸氢钠溶液、浓硫酸 先通过饱和碳酸氢钠溶液洗气,再用浓硫酸干燥
B. H2O(Br2) CCl4 萃取、分液
C. FeCl3(CuCl2) 过量铁粉、氯气 向溶液中加入过量铁粉,过滤,向滤液中通入过量氯气
D. KNO3(KCl) AgNO3溶液 向溶液中滴加适量AgNO3溶液
A.A B.B C.C D.D
9.由二氧化硅制高纯硅的流程如下,下列判断中错误的是
A.①②③反应中有非氧化还原反应 B.和均可循环利用
C.沙子、石英和水晶的主要成分都是 D.可制造光导纤维、玻璃
10.如图是某元素的价类二维图,其中A为正盐,X是一种强碱,通常条件下Z是无色液体,E的相对分子质量比D大16,各物质的转化关系如图所示。下列说法错误的是
A.A作肥料时不适合与碱性物质混合施用 B.可用向上排空气法收集B
C.C一般用排水法收集 D.D→E的反应可用于检验D
11.如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
A.湿润淀粉碘化钾试纸未变蓝说明硫元素的非金属性强于碘元素
B.沾有KMnO4溶液的滤纸褪色证明了SO2具有漂白性
C.实验后,可把注射器中的物质缓缓推入NaOH溶液中,以减少环境污染
D.蓝色石蕊试纸变红说明SO2显酸性
12.由粗SiO2制备纯的SiO2流程如图所示,下列说法不正确的是
A.X的水溶液俗称水玻璃,粘结力强可用作木材防火剂
B.步骤II的反应是Na2SiO3+H2SO4=H2SiO3↓+Na2SO4
C.步骤II中的稀硫酸可用通CO2后的水溶液替代
D.工业上用焦炭还原石英砂可以制得含有少量杂质的粗硅
13.下列对SO2的性质描述不正确的是
A.无色、有刺激性气味的气体 B.和水反应生成硫酸
C.有漂白性,能使品红溶液褪色 D.具有还原性,能使溴水褪色
二、非选择题(共10题)
14.将25.02克绿矾溶于硫酸中,加入3.03克KNO3恰好将其中的亚铁离子全部反应。
(1)该反应的氧化剂是___________。反应中硫酸的作用是___________。
(2)该反应的还原产物是___________。
(3)写出该反应的化学方程式________________________________________________。
(4)当有1.01克KNO3完全反应则生成的还原产物为_______升(标准状态)。转移的电子为_______mol。
三、实验题
15.某同学设计了如下装置用于制取SO2和验证SO2的性质。回答下列问题:
(1)仪器a的名称为______________
(2)下列试剂不能用于吸收尾气的是________ (填序号)
a.饱和Na2SO4溶液 b.饱和Na2CO3溶液 c.浓NH3·H2O d.饱和NaCl溶液
(3)实验时观察到装置B无明显现象,装置C红色褪去,则使品红的水溶液褪色的微粒一定不是_____。
(4)转置D目的是检验SO2的_____性,观察到的现象是________________。
(5)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制的Ba(NO3)2和BaCl2溶液,进行如下实验:
实验中A、B、C烧杯中观察到的现象如下表
烧杯 实验现象
A 无白色沉淀产生,pH传感器测得溶液pH=5.3
B 有白色沉淀产生
C 有白色沉淀产生,C中出现白色沉淀比B中快很多
①煮沸的目的是___________,据A中现象得出的结论是___________
②B中白色沉淀的化学式为______,C中出现白色沉淀比B中快很多的原因是_______
③在B中通入过量的SO2后,溶液中存在的主要阴离子是_________,其原因是_____(用离子方程式表示)
16.可选用如下装置,用铁粉将NO还原为N2(同时生成FeO),已知浓硝酸可氧化NO,完成下列问题。
甲 乙 丙 丁 戊 己
(1)写出装置甲中反应的离子方程式_______。
(2)写出装置戊中反应的化学方程式_______。
(3)整套装置的连接顺序为_______。
a→_______→_______→_______→_______→h→g(或g→h)→b→c→d
(4)装置丁的作用是_______。
(5)装置乙的作用是_______。
(6)装置丙的作用是_______。
17.为探究的性质,采用下列实验装置制少量并进行相应的实验探究:
(1)装置A中盛放浓硫酸的仪器名称是___________。
(2)若B中的试剂是品红溶液,B中溶液红色褪去,表现的性质___________。
(3)若B中的试剂是酸性溶液,则B中的现象是___________,写出反应的离子方程式(被还原为)___________。
(4)装置C中倒置漏斗的作用是___________,反应的离子方程式为___________。
(5)已知:可还原某含碲物质(主要成分为)溶液可得到粗碲。具体实验操作为:取该溶液于烧瓶中,加入适量,加热到一定温度,持续通入,待反应一定时间,过滤得到粗碲。在一定条件下,碲沉淀率与温度、还原时间的变化曲线分别如图1、图2所示:
①由图可知,最适宜的温度和还原时间分别为___________。
②图1中80℃后,升高温度,碲沉淀率几乎不再升高,甚至有下降趋势。可能的原因是________。
四、计算题
18.将某浓度的NH4HSO4溶液,加入到50mLNaOH溶液中并加热,得气体标况下体积如下表:
V(NH4HSO4)/mL 30 60 90 120 150
产生气体体积/L 0.672 0.896 0.224 0 0
(1)等浓度的NH4HSO4与NaOH溶液,体积比为1:2混合并加热的离子方程式______。
(2)c(NaOH)=_______。
19.在标准状况下,用以下气体做喷泉实验,请根据情况,填写烧瓶中溶液的物质的量浓度(假设烧瓶中溶质不能扩散出来)。
(1)用HCl气体做喷泉实验,喷泉结束后,水充满烧瓶,则溶液的物质的量浓度为_______;
(2)用NH3做喷泉实验时,喷泉结束后,水充满烧瓶,则溶液的物质的量浓度为____________;
(3)用NO2做喷泉实验时,喷泉结束后,水充至烧瓶的处,则溶液的物质的量浓度为____________;
(4)用NO2和O2按4∶1体积比混合,喷泉结束后,水充满烧瓶,则溶液的物质的量浓度为________。
20.把40g含二氧化硅的碳酸钙固体在高温下加热到质量不再改变为止,冷却后称得质量为26.8g。求:
(1)生成的二氧化碳在标准状况下的体积为____升?
(2)原混合物中SiO2的质量为_____克?
21.A~F为初中化学常见的六种物质,且都含有一种相同元素,它们相互间的关系如图所示。已知A、B、C、D、E是不同类别的物质,C俗称纯碱,F是人体中含量最多的物质。(部分反应物、生成物及反应条件已略去)
请回答:
(1)写出B、D、F的化学式:B____,D____,F_____。
(2)写出B物质的一种用途_____,C与E反应的化学方程式是_________。
(3)图中物质相互间发生的反应。未涉及的基本反应类型是________。
22.Ⅰ.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C 外,另一产物是盐酸盐。
(1)A物质的化学式为_______,与A物质对应的酸式盐溶液与足量NaOH溶液加热条件下反应的离子方程式为_______ 。
(2)当X为强酸时,B的电子式为_______,B与D发生反应的化学方程式为_______。
(3)当X为强碱时,写出足量B与Cl2反应的化学方程式_______。
Ⅱ.金属铝在酸性或碱性溶液中均可与发生氧化还原反应,转化关系如下:
已知气体D和F反应可生成盐。请回答下列问题:
(4)气体D和A溶液反应生成白色沉淀,该反应的离子方程式为_______。
(5)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C或E都转化为无毒的气态单质,任意写出其中一个反应的化学方程式:_______。
(6)自来水中的对人类健康产生危害。为了降低自来水中的浓度,某研究人员提出在碱性条件下用Al粉还原,根据框图信息写出铝在碱性条件下与反应的离子方程式:_______。
(7)除去气体C中的杂质气体E的化学方法:_______(用化学方程式表示)。
23.化合物X是一种常用的食品抗氧化剂,某学习小组为探究X(仅含3种元素)的组成和性质,设计如下实验(假设各步反应均完全,生成的气体全部逸出)
已知:固体A的焰色试验呈黄色;气体C可使品红溶液褪色,且加热后品红恢复红色。
(1)白色沉淀B的化学式_______,组成X的3种元素_______。
(2)写出反应①的离子方程式_______。
(3)工业上可以用碳酸钠和气体C制备X,请写出相应的化学方程式_______。
参考答案:
1.B 2.D 3.D 4.B 5.A 6.A 7.A 8.D 9.A 10.B 11.C 12.C 13.B
14. KNO3 提供酸性环境 NO 6FeSO4+4H2SO4+ 2KNO3=3Fe2(SO4)3+K2SO4+4H2O+2NO↑ 0.224 0.03
15. 三颈烧瓶 ad SO2 氧化 有淡黄色沉淀产生 除去溶液中溶解的O2 SO2可溶于水,溶于水的二氧化硫部分与水反应生成亚硫酸使溶液呈酸性;SO2与BaCl2不能发生复分解反应 BaSO4 在水溶液中O2氧化SO2比NO氧化SO2活化能小 SO Ba2++2NO+3SO2+2H2O=BaSO4↓+2NO+2SO+4H+
16.(1)3Cu+8H++2NO=3Cu2++2NO↑+4H2O
(2)2NO+2Fe2FeO+N2
(3)a→f→e→j→i→h→g(或g→h)→b→c→d
(4)吸收HNO3,除去NO2
(5)将NO氧化成NO2,便于后续装置吸收
(6)除去尾气中的NO2,防止污染环境
17.(1)分液漏斗
(2)漂白性
(3) 酸性溶液褪色 5SO2+2+2H2O =5SO+2Mn2++4H+
(4) 防倒吸 SO2+2OH-=SO+H2O
(5) 80℃,2.0h SO2的溶解度随着温度的升高而降低,SO2浓度降低,粗碲的产率会降低
18.(1)+H++2OH-NH3↑+2H2O
(2)2mol/L
19. 0.045 mol·L-1 0.045 mol·L-1 0.045 mol·L-1 0.036 mol·L-1
20. 6.72 10
21. CO2 H2SO4或者HNO3 H2O 灭火 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 置换反应
22. (NH4)2S +HS-+2OH-NH3↑+2H2O+S2- 2H2S+SO2=3S+2H2O 8NH3+3Cl2=6NH4Cl+N2 Al3++3NH3+3H2O=Al(OH)3↓+3 6NO+4NH35N2+6H2O(或6NO2+8NH37N2+12H2O) 8Al+3+5OH-+2H2O=8+3NH3↑ 3NO2+H2O=2HNO3+NO
23.(1) BaSO4 Na、S、O(或钠、硫、氧)
(2)SO2+Cl2+2H2O=4H++SO+2Cl-
(3)Na2CO3+2SO2=Na2S2O5+CO2
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
