第1章 原子结构 元素周期律 检测题(含答案) 高一下学期化学鲁科版(2019)必修第二册
文档属性
| 名称 | 第1章 原子结构 元素周期律 检测题(含答案) 高一下学期化学鲁科版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 319.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-01 22:08:05 | ||
图片预览


文档简介
第1章《原子结构 元素周期律》检测题
一、单选题(共13题)
1.下列有关物质间不能发生反应的是
A.玻璃与氢氟酸 B.空气中的氮气与氧气
C.单质硅与浓硝酸 D.二氧化硅与生石灰
2.若某元素的某原子核内质子数为,中子数为,则下列说法中正确的是
A.不能由此确定该元素的相对原子质量
B.这种元素的近似相对原子质量为
C.该原子的质量为
D.该原子中子数的总质量一定小于质子的总质量
3.中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期。Y和M位于同主族,Y原子最外层电子数是电子层数的3倍。这五种元素组成一种离子化合物Q。取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生的沉淀质量与滴加氢氧化钠溶液体积的变化情况如图所示。下列说法不正确的是( )
A.简单离子半径:M>Y>Z
B.气态氢化物的热稳定性:Y>X
C.最高价氧化物对应水化物的酸性:M>Z
D.由R、X、Y、M四种元素只能组成二种盐
4.下列实验操作中错误的是( )
A.把几滴FeCl3饱和溶液滴入250mL的沸水中制取Fe(OH)3胶体
B.蒸馏时,温度计水银球应浸没在液体中
C.蒸发时,当蒸发皿中的水只残留少许时,停止加热,利用余热将剩余水分蒸干
D.溴水中萃取溴时,往分液漏斗中先后加入溴水和四氯化碳,充分振荡静置后分液
5.化学与生活密切相关。下列说法不正确的是
A.水泥、普通玻璃、陶瓷均属于硅酸盐制品
B.华为“麒麟980”手机芯片的主要成分是硅单质
C.“燃煤脱硫”、“汽车尾气催化净化”都能提高空气质量
D.高性能碳化硅属于有机合成材料
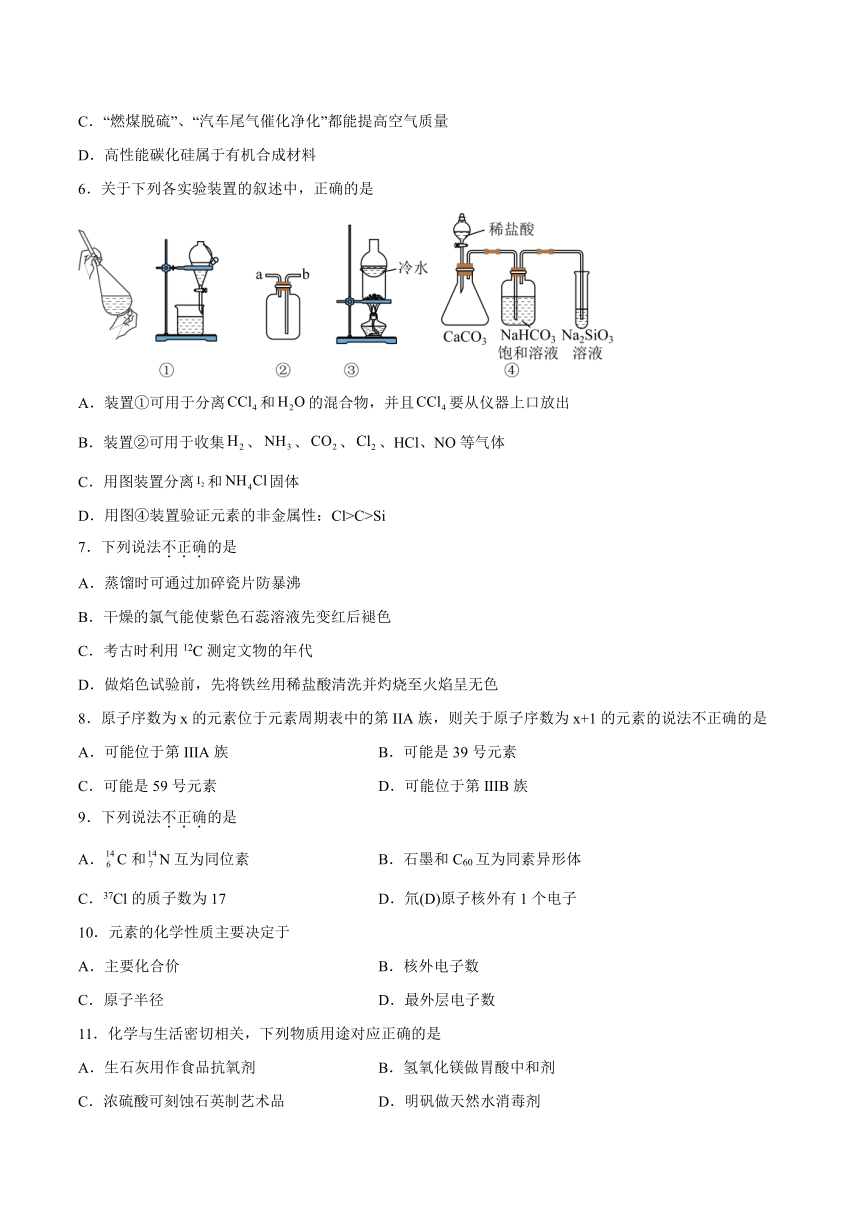
6.关于下列各实验装置的叙述中,正确的是
A.装置①可用于分离和的混合物,并且要从仪器上口放出
B.装置②可用于收集、、、、HCl、NO等气体
C.用图装置分离和固体
D.用图④装置验证元素的非金属性:Cl>C>Si
7.下列说法不正确的是
A.蒸馏时可通过加碎瓷片防暴沸
B.干燥的氯气能使紫色石蕊溶液先变红后褪色
C.考古时利用12C测定文物的年代
D.做焰色试验前,先将铁丝用稀盐酸清洗并灼烧至火焰呈无色
8.原子序数为x的元素位于元素周期表中的第IIA族,则关于原子序数为x+1的元素的说法不正确的是
A.可能位于第IIIA族 B.可能是39号元素
C.可能是59号元素 D.可能位于第IIIB族
9.下列说法不正确的是
A.C和N互为同位素 B.石墨和C60互为同素异形体
C.37Cl的质子数为17 D.氘(D)原子核外有1个电子
10.元素的化学性质主要决定于
A.主要化合价 B.核外电子数
C.原子半径 D.最外层电子数
11.化学与生活密切相关,下列物质用途对应正确的是
A.生石灰用作食品抗氧剂 B.氢氧化镁做胃酸中和剂
C.浓硫酸可刻蚀石英制艺术品 D.明矾做天然水消毒剂
12.我国“祝融号”火星车成功着陆火星,其矿脉中含有原子序数依次增大的短周期主族元素W、X、Y、Z。已知W、Z同主族,且Z的原子序数是W的2倍,X的氢化物可用于蚀刻玻璃,Y与Z最外层电子数之和等于8.下列说法正确的是
A.原子半径:Z>Y>W>X
B.简单氢化物的稳定性:X>W>Z
C.X与W可形成离子化合物
D.Y的氧化物为两性氧化物
13.下列有关物质性质和用途的说法,正确的是
A.可用于呼吸面具供氧 B.硅可以用来制备光导纤维
C.FeO常用作红色油漆和涂料 D.Ca(ClO)2可以做游泳池的消毒剂
二、非选择题(共10题)
14.1828年,德国化学家维勒通过蒸发氰酸铵(NH4CNO,一种无机化合物,由氯化铵和氰酸银反应制得)水溶液得到尿素[CO(NH2)2]。请回答下列问题:
制备氰酸铵的化学方程式-
是_______。
(2)氰酸铵和尿素之间的关系是_______(填字母代号)。
A.同位素B.同素异形体C.同分异构体D.同系物
(3)尿素在尿素酶的作用下能够水解生成碳酸铵,写出该反应的化学方程式_______。
(4)现代工业上用氨和二氧化碳在200个大气压和180℃时反应合成尿素,请写出该反应的化学方程式_______
15.硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。试回答:
(1)硅元素在元素周期表中位于第_______周期第_______族。
(2)下列属于晶体硅的用途的是_______(填序号)。
①半导体材料 ②制芯片 ③制太阳能电池 ④制光导纤维
(3)写出工业上制粗硅的化学方程式:_______。
三、实验题
16.探究无机盐 X(仅含三种短周期元素)的组成和性质,设计并完成如下实验:
请回答:
(1)X 的化学式是__________。
(2)白色粉末溶于氢氧化钠溶液的离子方程式是__________。
(3)白色沉淀用途广泛,请列举一例:__________。
17.高锰酸钾是常见的强氧化剂,其制备流程如图:
i.制取锰酸钾(K2MnO4)
碱熔:用托盘天平称取5.0gKOH固体、1.5gKClO3固体于坩埚中,混匀、小心加热,不断搅拌,待混合物完全熔融后,加入MnO2粉末3.5g,加热到颜色变为深绿色,用力搅拌到固体干涸、固化,再加热5min,并用铁棒将其尽量捣碎。
浸取:待物料冷却后,置于200mL烧杯中,用50mL蒸馏水浸取,过滤,得到绿色的溶液。
(1)碱熔过程中发生反应的化学方程式为____;加热中若不小心将液体溅到皮肤上,应____处理;加热时应选择____(填字母)。
a.瓷坩埚 b.铁坩埚 c.石英坩埚 d.氧化铝坩埚
ii.制取高锰酸钾(KMnO4)
在浸取液中通入CO2气体,至K2MnO4完全反应,用pH试纸测定溶液pH达到10~11时,停止通入CO2。然后把溶液加热,趁热用铺有尼龙布的布氏漏斗进行减压过滤,除去残渣……
已知:常温常压下,饱和碳酸钾溶液的pH为11.6;碳酸氢钾溶液的pH为8.3。
(2)通入CO2发生反应的离子方程式为____;判断此反应进行是否完全,也可以用玻璃棒蘸取溶液于滤纸上,若呈现____现象,停止通入CO2;过滤时不用滤纸而用尼龙布的原因:____;(填“能”或“不能”)____用加盐酸的方法代替通入CO2,其理由:____。
iii.重结晶提纯
(3)利用重结晶的方法对产品提纯,所得产品质量2.8g,则高锰酸钾的产率为____。(精确到0.1%)。
18.用于分离或提纯物质的方法有:A.蒸馏B.过滤C.结晶法D.分液E.萃取
下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号)
(1)淀粉溶液中含有泥沙___。
(2)分离四氯化碳与水的混合物___。
(3)分离汽油和煤油___。
(4)KNO3晶体中含有少量食盐___。
四、计算题
19.填空题
(1)含6.02×1023个中子的的质量是________g。
(2)4 g D2和20 g 18O2的单质化合时最多能生成__________________g D218O。
(3)若12.4 g Na2X中含有0.4 mol钠离子,Na2X的摩尔质量是________,X的相对原子质量是________。
20.某金属元素X原子的核外电子数等于核内中子数,取该元素的单质0.6 g与足量的氧气充分反应,可得到1.0 g氧化物XO。试通过计算推导出该元素在元素周期表中的位置。
21.把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量的水后,生成1.16 g白色沉淀。再向所得的悬浊液中逐滴加入1.00 mol/L 的盐酸溶液,加入盐酸溶液的体积与生成沉淀的关系如下图所示。试回答:
(1)写出A点到B点发生反应的离子方程式_______。
(2)写出B点到C点发生反应的离子方程式_______。
(3)C点加入盐酸溶液的体积为_______。
(4)原混合物中MgCl2的物质的量是_______,NaOH的质量是_______。
22.现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥E、C同主族,且E比C多两个电子层,E单质可与冷水反应生成氢气。
试回答:
(1)写出元素C、E的名称:C______;E______。
(2)画出A的原子结构示意图______,B的离子结构示意图______,D的单质分子的电子式______。
(3)写出B2A3分别与盐酸和氢氧化钠溶液反应的离子方程式:
____________________;___________________。
(4)比较B、C、E三种元素形成的简单离子半径的大小和氧化性的强弱(用离子符号表示):离子半径:_____________;氧化性:____________。
(5)写出E与冷水反应的化学方程式:_____________________。
23.现有部分短周期元素的性质或原子结构如下表:
元素编号 元素的性质或原子结构
T M层上的电子数是其原子核外电子层数的2倍
X 最外层电子数是次外层电子数的2倍
Y 常温下,单质为双原子分子,其氢化物的水溶液呈碱性
Z 元素的最高正化合价是+7
(1)元素T在元素周期表中的位置是第________周期第________族。
(2)元素X的一种同位素可测定文物的年代,这种同位素的符号是________。
(3)元素Y与氢元素形成一种分子YH3,该分子的化学式为____________________。
(4)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下,Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下,Z和T的单质都能与NaOH溶液反应
(5)T、X、Z三种元素的最高价氧化物对应的水化物的酸性由强到弱的顺序是______________(用化学式表示)。
参考答案:
1.C 2.A 3.D 4.B 5.D 6.B 7.C 8.C 9.A 10.D 11.B 12.B 13.D
14. C (3)
15.(1) 三 IV A
(2)①②③
(3)
16. Mg2SiO4 或 2MgO·SiO2 SiO2+2OH-=SiO32-+H2O 优良的阻燃剂等
17.(1) KClO3+6KOH+3MnO23K2MnO4+KCl+3H2O↑ 先用大量水冲洗,再涂上硼酸溶液 b
(2) 3MnO+2CO2=2MnO+MnO2↓+2CO 若完全呈现出紫红色斑点而无绿色痕迹 高锰酸钾会氧化滤纸中的有机物,造成滤纸堵塞 不能 盐酸有还原性,容易被高锰酸钾氧化
(3)73.8%
18. B D A C
19. 1.75 22 62 g/mol 16
20.第三周期ⅡA族
21.(1)+H++H2O= Al(OH)3↓
(2)Al(OH)3+3H+=Al3++3H2O、Mg(OH)2+2H+=Mg2++2H2O
(3)130 mL
(4) 0.02 mol 0.13 mol
22. 钾 铯 Al2O3+6H+=2Al3++3H2O Al2O3+2OH-=2AlO2-+H2O Cs+>K+>Al3+ Al3+>K+>Cs+ 2Cs+2H2O=2CsOH+H2↑
23. 三 ⅥA C NH3 Cl b HClO4>H2SO4>H2CO3
一、单选题(共13题)
1.下列有关物质间不能发生反应的是
A.玻璃与氢氟酸 B.空气中的氮气与氧气
C.单质硅与浓硝酸 D.二氧化硅与生石灰
2.若某元素的某原子核内质子数为,中子数为,则下列说法中正确的是
A.不能由此确定该元素的相对原子质量
B.这种元素的近似相对原子质量为
C.该原子的质量为
D.该原子中子数的总质量一定小于质子的总质量
3.中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期。Y和M位于同主族,Y原子最外层电子数是电子层数的3倍。这五种元素组成一种离子化合物Q。取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生的沉淀质量与滴加氢氧化钠溶液体积的变化情况如图所示。下列说法不正确的是( )
A.简单离子半径:M>Y>Z
B.气态氢化物的热稳定性:Y>X
C.最高价氧化物对应水化物的酸性:M>Z
D.由R、X、Y、M四种元素只能组成二种盐
4.下列实验操作中错误的是( )
A.把几滴FeCl3饱和溶液滴入250mL的沸水中制取Fe(OH)3胶体
B.蒸馏时,温度计水银球应浸没在液体中
C.蒸发时,当蒸发皿中的水只残留少许时,停止加热,利用余热将剩余水分蒸干
D.溴水中萃取溴时,往分液漏斗中先后加入溴水和四氯化碳,充分振荡静置后分液
5.化学与生活密切相关。下列说法不正确的是
A.水泥、普通玻璃、陶瓷均属于硅酸盐制品
B.华为“麒麟980”手机芯片的主要成分是硅单质
C.“燃煤脱硫”、“汽车尾气催化净化”都能提高空气质量
D.高性能碳化硅属于有机合成材料
6.关于下列各实验装置的叙述中,正确的是
A.装置①可用于分离和的混合物,并且要从仪器上口放出
B.装置②可用于收集、、、、HCl、NO等气体
C.用图装置分离和固体
D.用图④装置验证元素的非金属性:Cl>C>Si
7.下列说法不正确的是
A.蒸馏时可通过加碎瓷片防暴沸
B.干燥的氯气能使紫色石蕊溶液先变红后褪色
C.考古时利用12C测定文物的年代
D.做焰色试验前,先将铁丝用稀盐酸清洗并灼烧至火焰呈无色
8.原子序数为x的元素位于元素周期表中的第IIA族,则关于原子序数为x+1的元素的说法不正确的是
A.可能位于第IIIA族 B.可能是39号元素
C.可能是59号元素 D.可能位于第IIIB族
9.下列说法不正确的是
A.C和N互为同位素 B.石墨和C60互为同素异形体
C.37Cl的质子数为17 D.氘(D)原子核外有1个电子
10.元素的化学性质主要决定于
A.主要化合价 B.核外电子数
C.原子半径 D.最外层电子数
11.化学与生活密切相关,下列物质用途对应正确的是
A.生石灰用作食品抗氧剂 B.氢氧化镁做胃酸中和剂
C.浓硫酸可刻蚀石英制艺术品 D.明矾做天然水消毒剂
12.我国“祝融号”火星车成功着陆火星,其矿脉中含有原子序数依次增大的短周期主族元素W、X、Y、Z。已知W、Z同主族,且Z的原子序数是W的2倍,X的氢化物可用于蚀刻玻璃,Y与Z最外层电子数之和等于8.下列说法正确的是
A.原子半径:Z>Y>W>X
B.简单氢化物的稳定性:X>W>Z
C.X与W可形成离子化合物
D.Y的氧化物为两性氧化物
13.下列有关物质性质和用途的说法,正确的是
A.可用于呼吸面具供氧 B.硅可以用来制备光导纤维
C.FeO常用作红色油漆和涂料 D.Ca(ClO)2可以做游泳池的消毒剂
二、非选择题(共10题)
14.1828年,德国化学家维勒通过蒸发氰酸铵(NH4CNO,一种无机化合物,由氯化铵和氰酸银反应制得)水溶液得到尿素[CO(NH2)2]。请回答下列问题:
制备氰酸铵的化学方程式-
是_______。
(2)氰酸铵和尿素之间的关系是_______(填字母代号)。
A.同位素B.同素异形体C.同分异构体D.同系物
(3)尿素在尿素酶的作用下能够水解生成碳酸铵,写出该反应的化学方程式_______。
(4)现代工业上用氨和二氧化碳在200个大气压和180℃时反应合成尿素,请写出该反应的化学方程式_______
15.硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。试回答:
(1)硅元素在元素周期表中位于第_______周期第_______族。
(2)下列属于晶体硅的用途的是_______(填序号)。
①半导体材料 ②制芯片 ③制太阳能电池 ④制光导纤维
(3)写出工业上制粗硅的化学方程式:_______。
三、实验题
16.探究无机盐 X(仅含三种短周期元素)的组成和性质,设计并完成如下实验:
请回答:
(1)X 的化学式是__________。
(2)白色粉末溶于氢氧化钠溶液的离子方程式是__________。
(3)白色沉淀用途广泛,请列举一例:__________。
17.高锰酸钾是常见的强氧化剂,其制备流程如图:
i.制取锰酸钾(K2MnO4)
碱熔:用托盘天平称取5.0gKOH固体、1.5gKClO3固体于坩埚中,混匀、小心加热,不断搅拌,待混合物完全熔融后,加入MnO2粉末3.5g,加热到颜色变为深绿色,用力搅拌到固体干涸、固化,再加热5min,并用铁棒将其尽量捣碎。
浸取:待物料冷却后,置于200mL烧杯中,用50mL蒸馏水浸取,过滤,得到绿色的溶液。
(1)碱熔过程中发生反应的化学方程式为____;加热中若不小心将液体溅到皮肤上,应____处理;加热时应选择____(填字母)。
a.瓷坩埚 b.铁坩埚 c.石英坩埚 d.氧化铝坩埚
ii.制取高锰酸钾(KMnO4)
在浸取液中通入CO2气体,至K2MnO4完全反应,用pH试纸测定溶液pH达到10~11时,停止通入CO2。然后把溶液加热,趁热用铺有尼龙布的布氏漏斗进行减压过滤,除去残渣……
已知:常温常压下,饱和碳酸钾溶液的pH为11.6;碳酸氢钾溶液的pH为8.3。
(2)通入CO2发生反应的离子方程式为____;判断此反应进行是否完全,也可以用玻璃棒蘸取溶液于滤纸上,若呈现____现象,停止通入CO2;过滤时不用滤纸而用尼龙布的原因:____;(填“能”或“不能”)____用加盐酸的方法代替通入CO2,其理由:____。
iii.重结晶提纯
(3)利用重结晶的方法对产品提纯,所得产品质量2.8g,则高锰酸钾的产率为____。(精确到0.1%)。
18.用于分离或提纯物质的方法有:A.蒸馏B.过滤C.结晶法D.分液E.萃取
下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号)
(1)淀粉溶液中含有泥沙___。
(2)分离四氯化碳与水的混合物___。
(3)分离汽油和煤油___。
(4)KNO3晶体中含有少量食盐___。
四、计算题
19.填空题
(1)含6.02×1023个中子的的质量是________g。
(2)4 g D2和20 g 18O2的单质化合时最多能生成__________________g D218O。
(3)若12.4 g Na2X中含有0.4 mol钠离子,Na2X的摩尔质量是________,X的相对原子质量是________。
20.某金属元素X原子的核外电子数等于核内中子数,取该元素的单质0.6 g与足量的氧气充分反应,可得到1.0 g氧化物XO。试通过计算推导出该元素在元素周期表中的位置。
21.把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量的水后,生成1.16 g白色沉淀。再向所得的悬浊液中逐滴加入1.00 mol/L 的盐酸溶液,加入盐酸溶液的体积与生成沉淀的关系如下图所示。试回答:
(1)写出A点到B点发生反应的离子方程式_______。
(2)写出B点到C点发生反应的离子方程式_______。
(3)C点加入盐酸溶液的体积为_______。
(4)原混合物中MgCl2的物质的量是_______,NaOH的质量是_______。
22.现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥E、C同主族,且E比C多两个电子层,E单质可与冷水反应生成氢气。
试回答:
(1)写出元素C、E的名称:C______;E______。
(2)画出A的原子结构示意图______,B的离子结构示意图______,D的单质分子的电子式______。
(3)写出B2A3分别与盐酸和氢氧化钠溶液反应的离子方程式:
____________________;___________________。
(4)比较B、C、E三种元素形成的简单离子半径的大小和氧化性的强弱(用离子符号表示):离子半径:_____________;氧化性:____________。
(5)写出E与冷水反应的化学方程式:_____________________。
23.现有部分短周期元素的性质或原子结构如下表:
元素编号 元素的性质或原子结构
T M层上的电子数是其原子核外电子层数的2倍
X 最外层电子数是次外层电子数的2倍
Y 常温下,单质为双原子分子,其氢化物的水溶液呈碱性
Z 元素的最高正化合价是+7
(1)元素T在元素周期表中的位置是第________周期第________族。
(2)元素X的一种同位素可测定文物的年代,这种同位素的符号是________。
(3)元素Y与氢元素形成一种分子YH3,该分子的化学式为____________________。
(4)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下,Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下,Z和T的单质都能与NaOH溶液反应
(5)T、X、Z三种元素的最高价氧化物对应的水化物的酸性由强到弱的顺序是______________(用化学式表示)。
参考答案:
1.C 2.A 3.D 4.B 5.D 6.B 7.C 8.C 9.A 10.D 11.B 12.B 13.D
14. C (3)
15.(1) 三 IV A
(2)①②③
(3)
16. Mg2SiO4 或 2MgO·SiO2 SiO2+2OH-=SiO32-+H2O 优良的阻燃剂等
17.(1) KClO3+6KOH+3MnO23K2MnO4+KCl+3H2O↑ 先用大量水冲洗,再涂上硼酸溶液 b
(2) 3MnO+2CO2=2MnO+MnO2↓+2CO 若完全呈现出紫红色斑点而无绿色痕迹 高锰酸钾会氧化滤纸中的有机物,造成滤纸堵塞 不能 盐酸有还原性,容易被高锰酸钾氧化
(3)73.8%
18. B D A C
19. 1.75 22 62 g/mol 16
20.第三周期ⅡA族
21.(1)+H++H2O= Al(OH)3↓
(2)Al(OH)3+3H+=Al3++3H2O、Mg(OH)2+2H+=Mg2++2H2O
(3)130 mL
(4) 0.02 mol 0.13 mol
22. 钾 铯 Al2O3+6H+=2Al3++3H2O Al2O3+2OH-=2AlO2-+H2O Cs+>K+>Al3+ Al3+>K+>Cs+ 2Cs+2H2O=2CsOH+H2↑
23. 三 ⅥA C NH3 Cl b HClO4>H2SO4>H2CO3
