第一章 有机化合物的结构与性质--烃 检测题 (含答案)2022-2023学年高二下学期化学鲁科版(2019)选择性必修3
文档属性
| 名称 | 第一章 有机化合物的结构与性质--烃 检测题 (含答案)2022-2023学年高二下学期化学鲁科版(2019)选择性必修3 |  | |
| 格式 | docx | ||
| 文件大小 | 484.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-01 22:10:37 | ||
图片预览




文档简介
第一章《有机化合物的结构与性质—烃》检测题
一、单选题(共13题)
1.下列分子属于手性分子的是
A.CH3COOH B.CH3CH(OH)CH2OH
C.(CH3)2CHCH2Cl D.CH2=CHCH=CH2
2.下列关于有机化合物的叙述正确的是
A.甲苯能使酸性高锰酸钾溶液褪色,而烷烃则不能,说明苯环活化了甲基
B.沸点:戊烷,二甲基丙烷<己烷
C.乙炔使溴水褪色和苯与溴水混合振荡静置后水层变为无色,两者的原理相同
D.2,2,3,四甲基丁烷在光照下与氯气反应,只生成一种有机物
3.用如图装置可探究部分物质的性质,用下列各选项的药品不能得出相应结论的是
选项 a中药品 b中药品 c中药品 d中药品 结论
A 苯和液溴 铁粉 四氯化碳 硝酸银溶液 苯与液溴发生的是取代反应
B 硝酸 碳酸钠 饱和碳酸氢钠溶液 硅酸钠溶液 非金属性:
C 盐酸 碳酸钠 饱和碳酸氢钠溶液 次氯酸钠溶液 酸性:
D 浓盐酸 亚硫酸钠 品红溶液 氢氧化钠溶液 二氧化硫具有漂白性
A.A B.B C.C D.D
4.某种烷烃完全燃烧后生成了和,下列对于该烷烃的说法中错误的是
A.该烷烃的分子式为 B.该烷烃与氯气在光照时可以发生取代反应
C.该烷烃有两种不同的结构 D.该烷烃分子中只有极性键
5.下列说法正确的是
A. 的一溴代物和的一溴代物都有4种(不考虑立体异构)
B.分子中的4个碳原子在同一直线上,且存在顺反异构体
C.按系统命名法,化合物的名称是2,3,4-三甲基-2-乙基戊烷
D.由单烯烃和氢气加成制得,则对应的单烯烃有5种
6.下列有机化合物的命名正确的是
A.2,2-二甲基-4-乙基戊烷 B.2,4,5-三甲基己烷
C.3,4,4-三甲基己烷 D.2,3,3-三甲基己烷
7.甲基丙烯酸甲酯是合成有机玻璃的单体。
旧法合成的反应:
新法合成的反应:
下列说法错误的是(阿伏加德罗常数的值为NA)
A.HCN的电子式为
B.新法没有副产物产生,原子利用率高
C.甲基丙烯酸甲酯分子中含有两种官能团
D.原料都是无毒物质
8.下列化学用语表示正确的是
A.MgH2的电子式: B.2,2—二甲基戊烷的键线式:
C.中子数为18的氯原子:Cl D.的分子式:C10H17
9.二氧化碳与甲醇反应生成碳酸二甲酯是二氧化碳资源化利用的有效途径,原理如图:CO2+2CH3OH→ +H2O,下列说法错误的是
A.CO2与H2O的分子空间构型均为直线型
B.CO2中C的杂化方式反应后发生改变
C.CH3OH与水互溶的主要原因与氢键有关
D.碳酸二甲酯所有C、O原子可能在同一平面
10.下列关于烷烃同系物的说法中,错误的是
A.同系物有同一个通式
B.同系物的化学性质相似
C.同系物有相同的结构简式
D.两个相邻的同系物的相对分子质量之差为14
11.下列各项比较中,相等的是
A.相同物质的量的Na2O和Na2O2所含阴离子数
B.标准状况下,相同体积的乙炔和苯中所含的氢原子数
C.相同物质的量浓度的NH4Cl和NH3 H2O溶液中的c(NH)
D.相同质量的NO和NO2所含氮原子数
12.下列有关叙述正确的是
A.甲烷与氯气光照产物中物质的量最多的是CH3Cl
B.甲烷能使高锰酸钾溶液褪色
C.天然气主要成分是甲烷
D.甲烷的一氯代物有2种
13.下列叙述正确的是
A.组成元素相同,各元素质量分数也相同的不同物质属于同系物
B.分子式相同的不同物质一定是同分异构体
C.相对分子质量相同的不同物质一定是同分异构体
D.通式相同的不同物质一定属于同系物
二、非选择题(共10题)
14.填空。
(1)乙炔的电子式为_____________;芒硝的化学式为_______________。
(2)在日常生活中我们常使用冷敷袋有两种,第一种所盛装的物质为NH4NO3和水,第二种为过量NH4NO3和Na2CO3·10H2O,使用方法均为将两种原本隔开的物质混合即可降温,第二种还同时产生两种气体,请根据所学知识写出第二种冰袋中发生的化学方程式____________,解释其实现降温的原因______________。
15.常见的苯的同系物
甲苯:;乙苯:;邻二甲苯:;间二甲苯:;对二甲苯:。
若将苯环上的6个碳原子编号,某甲基所在碳原子为1号,选取最小位次号给另一碳原子编号,则二甲苯的三种同分异构体命名为邻二甲苯:_____,间二甲苯:_____,对二甲苯:_____。
三、实验题
16.下面是石蜡油在炽热碎瓷片的作用下产生C2H4并检验C2H4性质的实验。请回答下列问题:
(1)A中碎瓷片的作用是________________。
(2)B装置中反应的化学方程式为:______________________________。
(3)C装置中可观察到的现象是__________________。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置________(填字母)中的实验现象可判断该资料是否真实。
(5)通过上述实验探究,检验甲烷和乙烯的方法是________(选填字母,下同);除去甲烷中乙烯的方法是__________。
A.气体通入水中
B.气体通过盛溴水的洗气瓶
C.气体通过盛酸性高锰酸钾溶液的洗气瓶
D.气体通过氢氧化钠溶液
(6)下列物质中,不是通过乙烯加成反应得到的是______(填序号)。
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
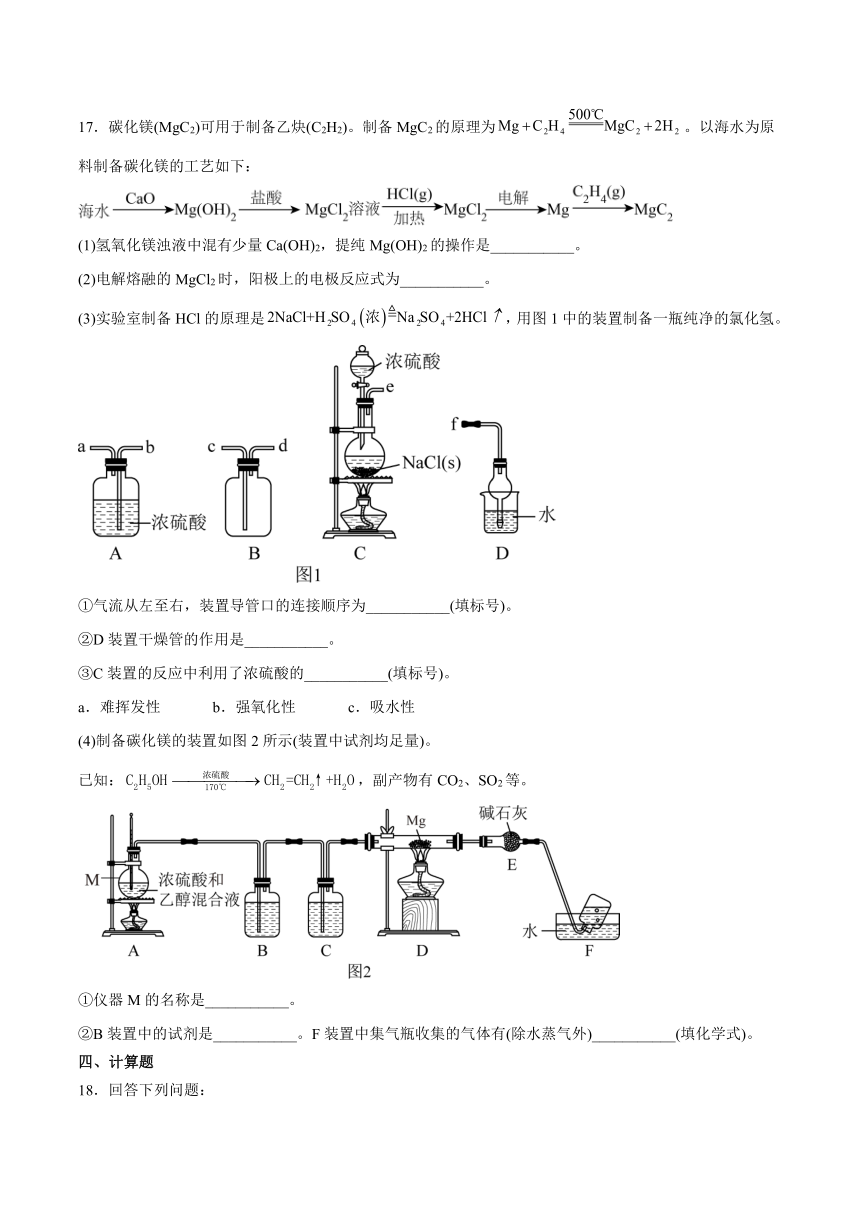
17.碳化镁(MgC2)可用于制备乙炔(C2H2)。制备MgC2的原理为。以海水为原料制备碳化镁的工艺如下:
(1)氢氧化镁浊液中混有少量Ca(OH)2,提纯Mg(OH)2的操作是___________。
(2)电解熔融的MgCl2时,阳极上的电极反应式为___________。
(3)实验室制备HCl的原理是,用图1中的装置制备一瓶纯净的氯化氢。
①气流从左至右,装置导管口的连接顺序为___________(填标号)。
②D装置干燥管的作用是___________。
③C装置的反应中利用了浓硫酸的___________(填标号)。
a.难挥发性 b.强氧化性 c.吸水性
(4)制备碳化镁的装置如图2所示(装置中试剂均足量)。
已知:,副产物有CO2、SO2等。
①仪器M的名称是___________。
②B装置中的试剂是___________。F装置中集气瓶收集的气体有(除水蒸气外)___________(填化学式)。
四、计算题
18.回答下列问题:
(1)分子式为C3H6的化合物X具有如下性质:X+溴的四氯化碳溶液→使溴的四氯化碳溶液褪色。 X所含官能团的名称_______,X与溴的四氯化碳溶液反应的化学方程式_______,X发生加聚反应的化学方程式为_______。
(2)标准状况下1mol某烃完全燃烧时,生成89.6LCO2,又知0.1mol此烃能与标准状况下4.48LH2加成,则此烃的结构简式可能是(两个碳碳双键连一起不稳定)_______。
(3)一种能使溴水褪色的烃,标准状况下5.6 L 完全燃烧时生成28L二氧化碳和22.5g水。则该烃的结构简式有_______种(不考虑顺反异构)。
(4)分子式为C6H14的化合物的同分异构体中,写出其中含有四个甲基的物质的结构简式为_______。
19.将11.2L(标准状况)乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了5.6g。求原气体混合物中乙烯与乙烷的物质的量之比和质量比。
20.某混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将56.0L混合气体通入足量溴水,溴水质量增重35.0g,通过计算回答:
(1)推出混合气体中气态烷烃的化学式:
依据题意知混合气体的平均相对分子质量为_____________,则烷烃一定为___________。
(2)混合气体中两种气体的物质的量之比:____________________。
(3)写出混合气体中气态烯烃可能的结构简式:__________________。
21.元素W、X、Y、Z的原子序数依次增加,p、q、r是由这些元素组成的二元化合物;m、n分别是元素Y、Z的单质,n通常为深红棕色液体,p为最简单的芳香烃,s通常是难溶于水、密度比水大的油状液体。上述物质的转化关系如图所示:
(1)q的溶液显______性(填“酸”“碱”或“中”),理由是:_________(用离子方程式说明)。
(2)s的化学式为______,Z在周期表中的位置为_____________。
(3)X、Y两种元素组成的化合物能溶于足量的浓硝酸,产生无色气体与红棕色气体的体积比为1:13,则该化合物的化学式为____________。
22.A、B、C、D、E五种短周期元素,A是周期表中原子半径最小的元素,其中B、C同周期,B、D同主族,原子半径E>D>B>C>A。D原子核内质子数等于B、C原子电子数之和,D原子最外层电子数是E原子最外层电子数的4倍。试回答:
(1)B与C形成的三原子分子甲的结构式是___________,C与E形成的原子个数比为1∶1的化合物乙的电子式是___________,乙物质中含有的共价键是___________(填“极性”或“非极性”)
(2)B的简单氢化物与氯气的第一步反应的方程式为___________;
(3)A和B可以形成一类化合物.这类化合物中,其中丙是一种重要的基本化工原料,其产量可以用来衡量一个国家的石油化工发展水平,写出由丙制得高聚物的反应方程式___________,该反应类型是___________;其中丁的相对分子质量为120,不能使溴的四氯化碳溶液褪色,其一氯代物只有两种结构,丁的结构简式为___________.
23.A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E的化合物焰色反应是黄色,F与G位置相邻,G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)D的简单阴离子的结构示意图是__________________。
(2)用电子式表示E2F的形成过程___________。
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是________。
(4)下列实验操作对应的实验现象中,不正确的是________(填字母)。
选项 实验操作 实验现象
a 将E单质投入到CuSO4溶液中 生成大量红色固体
b 向AlCl3溶液中通入过量C的气态氢化物 先生成白色沉淀,然后沉淀溶解
c 将G的单质通入到NaBr溶液中充分反应后,加入四氯化碳,振荡,静置 下层溶液变为橙色
d 将B的最高价氧化物通入到Na2SiO3溶液中 生成白色沉淀
(5)写出A与B形成的10电子分子的化学式___________,该物质与G的单质在光照下反应,一段时间后,下列装置示意图中能正确反映实验现象的是_________ (填字母)。
参考答案:
1.B 2.A 3.C 4.D 5.A 6.D 7.D 8.B 9.A 10.C 11.A 12.C 13.B
14.(1) Na2SO4·10H2O
(2) Na2CO3·10H2O+2NH4NO3=2NaNO3+2NH3↑+CO2↑+11H2O 该反应为吸热反应;过量NH4NO3溶于水也吸热
15. 1,2—二甲苯 1,3—二甲苯 1,4—二甲苯
16. 催化作用 CH2=CH2+Br2―→BrCH2—CH2Br 紫(红)色褪去 D BC B B
17.(1)在浊液中加入足量的MgCl2(或MgSO4等)溶液﹐搅拌、过滤
(2)
(3) ebacdf(或ebacdbaf) 防倒吸 a
(4) 圆底烧瓶 NaOH溶液 H2、C2H4
18.(1) 碳碳双键 CH3CH=CH2+Br2 n CH3CH=CH2
(2)HC≡CCH2CH3、CH3 C≡CCH3、CH2=CHCH=CH2
(3)5
(4)
19.(1)物质的量之比2:3
(2)质量之比28:45
20.(1) 26 CH4
(2)烷烃:烯烃=3:1
(3)CH2=CH-CH2CH3、CH3-CH=CH-CH3,、CH2=C(CH3)2
21. 酸 Fe3++3H2OFe(OH)3+3H+ C6H5Br 第四周期 VII A族 Fe3C
22.(1) O=C=O 非极性
(2)CH4+Cl2CH3Cl+HCl
(3) nCH2═CH2 加聚反应 、
23. S2->C1->Na+ ab CH4 D
一、单选题(共13题)
1.下列分子属于手性分子的是
A.CH3COOH B.CH3CH(OH)CH2OH
C.(CH3)2CHCH2Cl D.CH2=CHCH=CH2
2.下列关于有机化合物的叙述正确的是
A.甲苯能使酸性高锰酸钾溶液褪色,而烷烃则不能,说明苯环活化了甲基
B.沸点:戊烷,二甲基丙烷<己烷
C.乙炔使溴水褪色和苯与溴水混合振荡静置后水层变为无色,两者的原理相同
D.2,2,3,四甲基丁烷在光照下与氯气反应,只生成一种有机物
3.用如图装置可探究部分物质的性质,用下列各选项的药品不能得出相应结论的是
选项 a中药品 b中药品 c中药品 d中药品 结论
A 苯和液溴 铁粉 四氯化碳 硝酸银溶液 苯与液溴发生的是取代反应
B 硝酸 碳酸钠 饱和碳酸氢钠溶液 硅酸钠溶液 非金属性:
C 盐酸 碳酸钠 饱和碳酸氢钠溶液 次氯酸钠溶液 酸性:
D 浓盐酸 亚硫酸钠 品红溶液 氢氧化钠溶液 二氧化硫具有漂白性
A.A B.B C.C D.D
4.某种烷烃完全燃烧后生成了和,下列对于该烷烃的说法中错误的是
A.该烷烃的分子式为 B.该烷烃与氯气在光照时可以发生取代反应
C.该烷烃有两种不同的结构 D.该烷烃分子中只有极性键
5.下列说法正确的是
A. 的一溴代物和的一溴代物都有4种(不考虑立体异构)
B.分子中的4个碳原子在同一直线上,且存在顺反异构体
C.按系统命名法,化合物的名称是2,3,4-三甲基-2-乙基戊烷
D.由单烯烃和氢气加成制得,则对应的单烯烃有5种
6.下列有机化合物的命名正确的是
A.2,2-二甲基-4-乙基戊烷 B.2,4,5-三甲基己烷
C.3,4,4-三甲基己烷 D.2,3,3-三甲基己烷
7.甲基丙烯酸甲酯是合成有机玻璃的单体。
旧法合成的反应:
新法合成的反应:
下列说法错误的是(阿伏加德罗常数的值为NA)
A.HCN的电子式为
B.新法没有副产物产生,原子利用率高
C.甲基丙烯酸甲酯分子中含有两种官能团
D.原料都是无毒物质
8.下列化学用语表示正确的是
A.MgH2的电子式: B.2,2—二甲基戊烷的键线式:
C.中子数为18的氯原子:Cl D.的分子式:C10H17
9.二氧化碳与甲醇反应生成碳酸二甲酯是二氧化碳资源化利用的有效途径,原理如图:CO2+2CH3OH→ +H2O,下列说法错误的是
A.CO2与H2O的分子空间构型均为直线型
B.CO2中C的杂化方式反应后发生改变
C.CH3OH与水互溶的主要原因与氢键有关
D.碳酸二甲酯所有C、O原子可能在同一平面
10.下列关于烷烃同系物的说法中,错误的是
A.同系物有同一个通式
B.同系物的化学性质相似
C.同系物有相同的结构简式
D.两个相邻的同系物的相对分子质量之差为14
11.下列各项比较中,相等的是
A.相同物质的量的Na2O和Na2O2所含阴离子数
B.标准状况下,相同体积的乙炔和苯中所含的氢原子数
C.相同物质的量浓度的NH4Cl和NH3 H2O溶液中的c(NH)
D.相同质量的NO和NO2所含氮原子数
12.下列有关叙述正确的是
A.甲烷与氯气光照产物中物质的量最多的是CH3Cl
B.甲烷能使高锰酸钾溶液褪色
C.天然气主要成分是甲烷
D.甲烷的一氯代物有2种
13.下列叙述正确的是
A.组成元素相同,各元素质量分数也相同的不同物质属于同系物
B.分子式相同的不同物质一定是同分异构体
C.相对分子质量相同的不同物质一定是同分异构体
D.通式相同的不同物质一定属于同系物
二、非选择题(共10题)
14.填空。
(1)乙炔的电子式为_____________;芒硝的化学式为_______________。
(2)在日常生活中我们常使用冷敷袋有两种,第一种所盛装的物质为NH4NO3和水,第二种为过量NH4NO3和Na2CO3·10H2O,使用方法均为将两种原本隔开的物质混合即可降温,第二种还同时产生两种气体,请根据所学知识写出第二种冰袋中发生的化学方程式____________,解释其实现降温的原因______________。
15.常见的苯的同系物
甲苯:;乙苯:;邻二甲苯:;间二甲苯:;对二甲苯:。
若将苯环上的6个碳原子编号,某甲基所在碳原子为1号,选取最小位次号给另一碳原子编号,则二甲苯的三种同分异构体命名为邻二甲苯:_____,间二甲苯:_____,对二甲苯:_____。
三、实验题
16.下面是石蜡油在炽热碎瓷片的作用下产生C2H4并检验C2H4性质的实验。请回答下列问题:
(1)A中碎瓷片的作用是________________。
(2)B装置中反应的化学方程式为:______________________________。
(3)C装置中可观察到的现象是__________________。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置________(填字母)中的实验现象可判断该资料是否真实。
(5)通过上述实验探究,检验甲烷和乙烯的方法是________(选填字母,下同);除去甲烷中乙烯的方法是__________。
A.气体通入水中
B.气体通过盛溴水的洗气瓶
C.气体通过盛酸性高锰酸钾溶液的洗气瓶
D.气体通过氢氧化钠溶液
(6)下列物质中,不是通过乙烯加成反应得到的是______(填序号)。
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
17.碳化镁(MgC2)可用于制备乙炔(C2H2)。制备MgC2的原理为。以海水为原料制备碳化镁的工艺如下:
(1)氢氧化镁浊液中混有少量Ca(OH)2,提纯Mg(OH)2的操作是___________。
(2)电解熔融的MgCl2时,阳极上的电极反应式为___________。
(3)实验室制备HCl的原理是,用图1中的装置制备一瓶纯净的氯化氢。
①气流从左至右,装置导管口的连接顺序为___________(填标号)。
②D装置干燥管的作用是___________。
③C装置的反应中利用了浓硫酸的___________(填标号)。
a.难挥发性 b.强氧化性 c.吸水性
(4)制备碳化镁的装置如图2所示(装置中试剂均足量)。
已知:,副产物有CO2、SO2等。
①仪器M的名称是___________。
②B装置中的试剂是___________。F装置中集气瓶收集的气体有(除水蒸气外)___________(填化学式)。
四、计算题
18.回答下列问题:
(1)分子式为C3H6的化合物X具有如下性质:X+溴的四氯化碳溶液→使溴的四氯化碳溶液褪色。 X所含官能团的名称_______,X与溴的四氯化碳溶液反应的化学方程式_______,X发生加聚反应的化学方程式为_______。
(2)标准状况下1mol某烃完全燃烧时,生成89.6LCO2,又知0.1mol此烃能与标准状况下4.48LH2加成,则此烃的结构简式可能是(两个碳碳双键连一起不稳定)_______。
(3)一种能使溴水褪色的烃,标准状况下5.6 L 完全燃烧时生成28L二氧化碳和22.5g水。则该烃的结构简式有_______种(不考虑顺反异构)。
(4)分子式为C6H14的化合物的同分异构体中,写出其中含有四个甲基的物质的结构简式为_______。
19.将11.2L(标准状况)乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了5.6g。求原气体混合物中乙烯与乙烷的物质的量之比和质量比。
20.某混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将56.0L混合气体通入足量溴水,溴水质量增重35.0g,通过计算回答:
(1)推出混合气体中气态烷烃的化学式:
依据题意知混合气体的平均相对分子质量为_____________,则烷烃一定为___________。
(2)混合气体中两种气体的物质的量之比:____________________。
(3)写出混合气体中气态烯烃可能的结构简式:__________________。
21.元素W、X、Y、Z的原子序数依次增加,p、q、r是由这些元素组成的二元化合物;m、n分别是元素Y、Z的单质,n通常为深红棕色液体,p为最简单的芳香烃,s通常是难溶于水、密度比水大的油状液体。上述物质的转化关系如图所示:
(1)q的溶液显______性(填“酸”“碱”或“中”),理由是:_________(用离子方程式说明)。
(2)s的化学式为______,Z在周期表中的位置为_____________。
(3)X、Y两种元素组成的化合物能溶于足量的浓硝酸,产生无色气体与红棕色气体的体积比为1:13,则该化合物的化学式为____________。
22.A、B、C、D、E五种短周期元素,A是周期表中原子半径最小的元素,其中B、C同周期,B、D同主族,原子半径E>D>B>C>A。D原子核内质子数等于B、C原子电子数之和,D原子最外层电子数是E原子最外层电子数的4倍。试回答:
(1)B与C形成的三原子分子甲的结构式是___________,C与E形成的原子个数比为1∶1的化合物乙的电子式是___________,乙物质中含有的共价键是___________(填“极性”或“非极性”)
(2)B的简单氢化物与氯气的第一步反应的方程式为___________;
(3)A和B可以形成一类化合物.这类化合物中,其中丙是一种重要的基本化工原料,其产量可以用来衡量一个国家的石油化工发展水平,写出由丙制得高聚物的反应方程式___________,该反应类型是___________;其中丁的相对分子质量为120,不能使溴的四氯化碳溶液褪色,其一氯代物只有两种结构,丁的结构简式为___________.
23.A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E的化合物焰色反应是黄色,F与G位置相邻,G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)D的简单阴离子的结构示意图是__________________。
(2)用电子式表示E2F的形成过程___________。
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是________。
(4)下列实验操作对应的实验现象中,不正确的是________(填字母)。
选项 实验操作 实验现象
a 将E单质投入到CuSO4溶液中 生成大量红色固体
b 向AlCl3溶液中通入过量C的气态氢化物 先生成白色沉淀,然后沉淀溶解
c 将G的单质通入到NaBr溶液中充分反应后,加入四氯化碳,振荡,静置 下层溶液变为橙色
d 将B的最高价氧化物通入到Na2SiO3溶液中 生成白色沉淀
(5)写出A与B形成的10电子分子的化学式___________,该物质与G的单质在光照下反应,一段时间后,下列装置示意图中能正确反映实验现象的是_________ (填字母)。
参考答案:
1.B 2.A 3.C 4.D 5.A 6.D 7.D 8.B 9.A 10.C 11.A 12.C 13.B
14.(1) Na2SO4·10H2O
(2) Na2CO3·10H2O+2NH4NO3=2NaNO3+2NH3↑+CO2↑+11H2O 该反应为吸热反应;过量NH4NO3溶于水也吸热
15. 1,2—二甲苯 1,3—二甲苯 1,4—二甲苯
16. 催化作用 CH2=CH2+Br2―→BrCH2—CH2Br 紫(红)色褪去 D BC B B
17.(1)在浊液中加入足量的MgCl2(或MgSO4等)溶液﹐搅拌、过滤
(2)
(3) ebacdf(或ebacdbaf) 防倒吸 a
(4) 圆底烧瓶 NaOH溶液 H2、C2H4
18.(1) 碳碳双键 CH3CH=CH2+Br2 n CH3CH=CH2
(2)HC≡CCH2CH3、CH3 C≡CCH3、CH2=CHCH=CH2
(3)5
(4)
19.(1)物质的量之比2:3
(2)质量之比28:45
20.(1) 26 CH4
(2)烷烃:烯烃=3:1
(3)CH2=CH-CH2CH3、CH3-CH=CH-CH3,、CH2=C(CH3)2
21. 酸 Fe3++3H2OFe(OH)3+3H+ C6H5Br 第四周期 VII A族 Fe3C
22.(1) O=C=O 非极性
(2)CH4+Cl2CH3Cl+HCl
(3) nCH2═CH2 加聚反应 、
23. S2->C1->Na+ ab CH4 D
