第八章化学与可持续发展测试题(含解析) 高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第八章化学与可持续发展测试题(含解析) 高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-01 22:57:17 | ||
图片预览




文档简介
第八章《化学与可持续发展》测试题
一、单选题(共12题)
1.下列有关化学发展历史的说法错误的是
A.伏打电堆的发明,促进了新元素的发现、研究及电学的进一步发展
B.门捷列夫将元素按照相对原子质量由小到大依次排列,编制了第一张元素周期表
C.侯德榜发明了以食盐、氨、二氧化碳为原料制取碳酸钠的制碱方法,为我国化工事业的发展作出了卓越贡献
D.我国科学家从传统中药提取出青蒿素,并对其进行结构修饰和改造,得到了一系列抗疟疾新药
2.下列说法正确的是
A.氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色
B.煤的干馏、石油的分馏、油脂硬化均属于物理变化
C.与互为同分异构体,谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用来鉴别
D.按系统命名法,化合物的名称为甲基,二乙基己烷
3.实验室从海带中提取碘的操作过程,仪器选用不正确的是
A.称取3.000g的干海带——电子天平
B.灼烧干海带至完全变成灰烬——蒸发皿
C.过滤煮沸后的海带灰水混合液——普通漏斗
D.用四氯化碳从氧化后的海带灰浸取液中提取碘——分液漏斗
4.下列说法不正确的是
A.臭氧具有强氧化性,可用于饮用水消毒
B.在高温下用焦炭还原二氧化硅可制得粗硅
C.工业上电解熔融的氧化镁以得到金属镁
D.镁合金密度较小,可用于制造火箭、导弹和飞机的部件等
5.随着人们生活节奏的加快,小包装食品已被广泛接受,为了防止食品氧化变质,延长食品的保质期,在包装袋中常放入抗氧化物质。下列不属于抗氧化物质的是( )
A.铁粉 B.亚硫酸钠(Na2SO3)
C.生石灰 D.硫酸亚铁(FeSO4)
6.古诗词是我国传统文化的瑰宝。下列诗词解读不正确的是
A.宋·陈鼓年《广韵》中有“酢浆也,醋也”,食醋的主要成分醋酸为弱电解质
B.“此即地霜也。所在山泽,冬月地上有霜,扫取以水淋汁,后乃煎炼而成。”对硝酸钾的提取涉及溶解、蒸发、结晶操作
C.“章山之铜,所谓丹阳铜也。今世有白铜,盖点化为之,非其本质。”纯铜比白铜硬度大、熔点低
D.《诗经》有“周原膴膴(wu),堇荼如饴(麦芽糖)”,麦芽糖属于二糖
7.化学与生活关系密切。下列说法正确的是
A.为实现“碳中和、碳达峰”目标,应禁止使用含碳燃料
B.打印机使用的墨粉中含铁的氧化物,其主要成分为氧化铁
C.大规模开采可燃冰作为新能源,有利于促进碳中和
D.垃圾分类利国利民,食品包装塑料袋属于可回收垃圾
8.中华民族文明源远流长,众多珍贵文物折射出五千年璀璨文明。下列文物的主要成分属于无机非金属材料的是
文物
选项 A.西汉素纱禅衣 B.清紫檀雕花宝座 C.五羊方尊 D.青玉交龙钮玉玺
A.A B.B C.C D.D
9.下列叙述正确的是
A.工业上氯、溴、碘、钠、镁、铁等单质都是直接利用海水来提取的
B.从碘水中萃取碘时,往分液漏斗中加入碘水和酒精,充分静置后分液
C.镁合金密度小,强度高,大量用于制造火箭、飞机等的部件
D.蒸馏过程中发现忘加沸石,可直接补加
10.从化学看生活,你认为下列说法合理的是
A.绿色食品就是指颜色为绿色的食品
B.“煤改气”“煤改电”等清洁燃料改造工程有利于减少雾霾的形成
C.汽车尾气中的氮氧化物主要是汽油燃烧的产物
D.燃料电池是一种高效、环境友好型的发电装置,其能量转化率可达100%
11.实验室提供的玻璃仪器有烧杯、普通漏斗、酒精灯、蒸发皿、玻璃棒、试管、蒸馏烧瓶,非玻璃仪器任选,选用上述仪器能完成的实验是
A.配制一定浓度和体积的NaOH溶液 B.石油分馏
C.重结晶法提纯苯甲酸 D.从海带灰中提取碘单质
12.合金有着广泛的应用。下列物质不属于合金的是
A.硬铝 B.黄铜 C.钢铁 D.水银
二、非选择题(共10题)
13.地球的表面积为5.1亿平方公里,其中海洋的面积为3.67亿平方公里,占整个地球表面积的70.8 %。海洋是一个巨大的化学资源宝库,下面根据海水资源综合利用,请回答下列问题:
(1)淡化海水的方法有________________(写一种合理方法即可)。由海水提取的粗盐中含有Ca2+、Mg2+、SO42-等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、________(填化学式),之后________(填操作名称),再加入适量________(填试剂名称)。将所得溶液加热浓缩、冷却结晶,得到精盐。
(2)由无水MgCl2制取金属镁的常用工业方法是__________________。
(3)向苦卤中通入Cl2置换出Br2,再用空气吹出溴并用SO2吸收,转化为Br-,反复多次,以达到富集溴的目的。由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由强到弱的顺序是__________。
(4)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时放出CO2,写出反应的离子方程式____________。再H2SO4处理所得溶液重新得到Br2,其反应的离子方程式为_______________。
14.材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础。材料种类很多,通常可分为金属材料、无机非金属材料(包括硅酸盐材料)、高分子合成材料和复合材料。
(1)玻璃、陶瓷、水泥的生产原料不需要使用石灰石的是____。塑料制品给人类带来很多方便,但塑料制品造成的“白色污染”已成为社会的一大公害,请你提出一项防治“白色污染”的有效措施:____。
(2)金属腐蚀会造成巨大的经济损失,钢铁在潮湿的空气中更容易被腐蚀,主要原因是钢铁里的铁和碳构成许多微小的____,发生电化腐蚀。
15.海洋植物如海带.海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海洋植物中提取碘的流程如图:
某化学兴趣小组将上述流程②③设计成如图所示。
已知氯水中含有Cl2,②中发生反应的化学方程式为:Cl2+2KI=2KCl+I2
回答下列问题:
(1)写出提取过程①③中实验操作的名称:①___,③___。
(2)四氯化碳是___色的液体,F中下层液体的颜色为___色,上层液体中溶质的主要成分的化学式为___。
(3)从F中得到固态碘还需进行的操作是___。
(4)在灼烧过程中,将使用到的(除泥三角外)实验仪器有___(填字母)
A.试管 B.瓷坩埚 C.蒸发皿 D.坩埚钳 E.酒精灯
16.海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
(1)实验室焙烧海带,需要下列仪器中的________(填序号)。
a 试管 b 烧杯 c 坩埚 d 泥三角 e 铁三脚架 f 酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①__________,③________。
(3)提取碘的过程中,可选择的有机试剂是( )
A 甲苯、酒精 B 四氯化碳、苯
C 汽油、乙酸 D 汽油、甘油
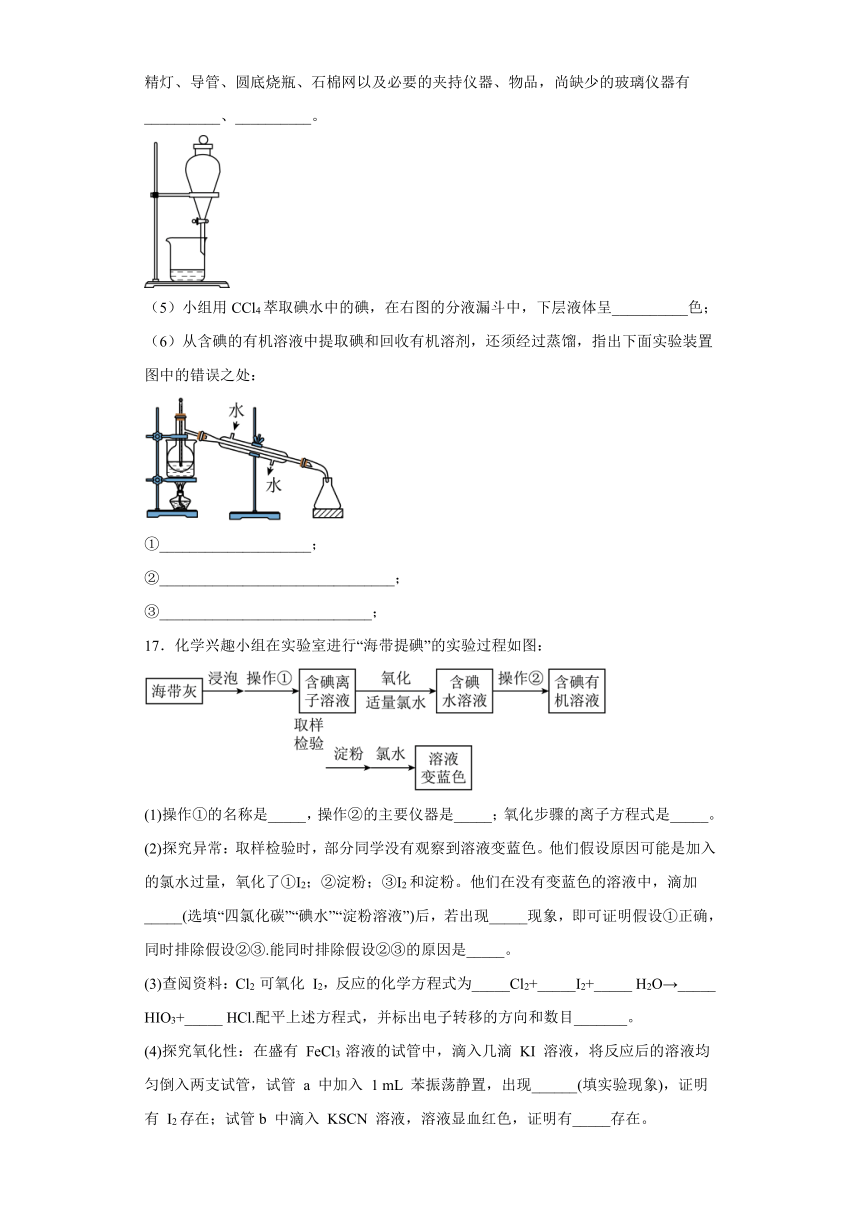
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有__________、__________。
(5)小组用CCl4萃取碘水中的碘,在右图的分液漏斗中,下层液体呈__________色;
(6)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处:
①____________________;
②_______________________________;
③____________________________;
17.化学兴趣小组在实验室进行“海带提碘”的实验过程如图:
(1)操作①的名称是_____,操作②的主要仪器是_____;氧化步骤的离子方程式是_____。
(2)探究异常:取样检验时,部分同学没有观察到溶液变蓝色。他们假设原因可能是加入的氯水过量,氧化了①I2;②淀粉;③I2和淀粉。他们在没有变蓝色的溶液中,滴加_____(选填“四氯化碳”“碘水”“淀粉溶液”)后,若出现_____现象,即可证明假设①正确,同时排除假设②③.能同时排除假设②③的原因是_____。
(3)查阅资料:Cl2 可氧化 I2,反应的化学方程式为_____Cl2+_____I2+_____ H2O→_____ HIO3+_____ HCl.配平上述方程式,并标出电子转移的方向和数目_______。
(4)探究氧化性:在盛有 FeCl3 溶液的试管中,滴入几滴 KI 溶液,将反应后的溶液均匀倒入两支试管,试管 a 中加入 1 mL 苯振荡静置,出现______(填实验现象),证明有 I2存在;试管b 中滴入 KSCN 溶液,溶液显血红色,证明有_____存在。
(5)比较氧化性:综合上述实验,可以得出的结论是氧化性:Cl2>FeCl3,理由是_____。
18.由铝和某些金属氧化物组成的混合物在化学上称为铝热剂,该混合物在高温条件下能发生置换反应。为确定某铝热剂样品(铝和氧化铁)的组成,分别进行下列实验:
(1)若取10.7g该样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为aL。反应的化学方程式是__,样品中铝的质量分数是__(用含a的表达式表示)。
(2)若取同质量的样品,在高温下使其恰好反应,则a=__L;该反应的化学方程式是__。
19.现有一包铝热剂是铝粉和氧化铁粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(计算pH时假定溶液体积没有变化):
①向其中一份固体中加入100 mL2.0 mol/L的NaOH溶液,加热使其充分反应后过滤,测得滤液的pH=14。
②向另一份固体中加入140 mL 4.0 mol/L的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且pH=0。
(1)写出该铝热反应的化学方程式_____________________________
(2)这包铝热剂中铝粉的质量为_________ , 氧化铁粉末的质量______________
20.下面是某地市场上销售的一种加碘食盐包装袋上的部分文字说明。
配料 氯化钠(NaCl)、碘酸钾()
含碘量
保质期 18个月
食用方法 勿长时间炖炒
贮藏指南 避热、避光、密封、防潮
(1)加碘盐不能长时间炖炒,且应避热、避光保存,你认为可能的原因是什么?_______
(2)实验分析发现,某批加碘盐中的含量为。试计算每千克该加碘盐中的物质的量和碘的质量。_______
(3)若成人每天需摄入碘才能满足人体健康的需要,试通过计算说明成人平均每天食用6.0g这种加碘盐能否获得所需要的碘。 _______
21.某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:
据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是__。
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式
固体B__;沉淀C__;沉淀D__;溶液E___。
(3)写出①、②、③、④四个反应的化学方程式或离子方程式
①__;
②___;
③___;
④__。
22.(某混合物甲中含有明矾[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。在一定条件下由甲可实现如图所示的物质之间的转化:
请回答下列问题:
(1)写出A、B的化学式:A___,B___。
(2)试剂a最好选用下列试剂中的( )
A.NaOH溶液 B.稀盐酸 C.二氧化碳 D.氨水
写出相应的离子方程式___。
(3)写出反应②(生成溶液C和沉淀)的离子方程式___。
(4)固体D可以作为复合性的化学肥料,D中所含物质的化学式为___。
参考答案:
1.C
侯氏制碱法优化了索尔维制碱法,提高了NaCl利用率,减少无用的副产品CaCl2排放,转成有用的化肥NH4Cl,节约成本并提高了经济效益,C选项错误;
A、B、D选项说法正确;
答案选C。
2.D
【解析】A.聚乙烯不含碳碳双键;
B.煤的干馏、油脂硬化均为化学变化;
C.二者含有的氢原子的种类、相应的数目相同,但是各种氢原子的具体位置不同;
D.最长碳链含6个C,且2号C上有甲基,3、4号C上有乙基。
A. 聚乙烯不含碳碳双键,不能使酸性高锰钾溶液褪色,故A错误;
B. 煤的干馏、油脂硬化均为化学变化,而石油的分馏为物理变化,故B错误;
C. 二者含有的氢原子的种类、相应的数目相同,但是各种氢原子的具体位置不同,能用来鉴别,故C错误;
D. 最长碳链含6个C,且2号C上有甲基,3、4号C上有乙基,名称为甲基,二乙基己烷,故D正确;
答案选D。
【点睛】本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的难点,题目难度不大。
3.B
A. 称取3.000g的干海带,需要使用精确度高的电子天平,精确度为0.0001g,故A正确;
B. 灼烧固体应在坩埚中进行,而加热液体可用蒸发皿,故B错误;
C. 过滤煮沸后的海带灰水混合液可用漏斗分离,故C正确;
D. 萃取分液要用分液漏斗,故D正确;
答案选B。
4.C
A.臭氧有强氧化性,还原产物为水,可用于饮用水消毒,故正确;
B.碳和二氧化硅高温下反应生成硅和一氧化碳,故正确;
C.工业上用电解熔融的氯化镁制取金属镁,故错误;
D.镁合金密度小,可以制造火箭等部件,故正确。
故选C。
5.C
抗氧化剂具有较强的还原性,据此分析。
A. 铁粉具有较强的还原性,反应中Fe的化合价升高,能防止食物被氧化而变质,A项正确,不符合题意;
B. 亚硫酸钠具有较强的还原性,在反应中S的的化合价升高,能防止食物被氧化而变质,B项正确,不符合题意;
C. 生石灰具有吸水性,一般用作干燥剂,它不能防止食物被氧化,C项错误,符合题意;
D. 硫酸亚铁具有较强的还原性,反应中Fe的化合价升高,能防止食物被氧化而变质,D项正确,不符合题意;
答案选C。
【点睛】解答本题时要注意抗氧化剂的概念和其作用:抗氧化剂是阻止氧气不良影响的物质,是指能防止或延缓食品氧化,提高食品的稳定性和延长贮存期的食品添加剂;抗氧化剂的正确使用不仅可以延长食品的贮存期、货架期,给生产者、消费者带来良好的经济效益,而且给消费者带来更好的食品安全。
6.C
A.醋酸是弱酸,属于弱电解质,A正确;
B.提纯硝酸钾,先溶解、再蒸发浓缩,降温结晶,B正确;
C.纯铜是纯金属,白铜是铜的合金,合金的硬度比组分单质高,熔点比组分单质低,故纯铜的硬度小于白铜,熔点高于白铜,C错误;
D.麦芽糖水解得到两分子葡萄糖,属于二糖,D正确;
故选C。
7.D
A.采取节能低碳生活方式,不能禁止使用含碳燃料,只能尽量使用新能源代替含碳燃料,A错误;
B.氧化铁为红色,而油墨呈黑色,故墨粉中含铁的氧化物主要成分不可能是氧化铁,B错误;
C.可燃冰是甲烷的结晶水合物,大量开采使用,会产生CO2,不利于碳中和,C错误;
D.将垃圾分类处理,将垃圾进行资源化,可以节约能源、绿色环保,利国利民,可回收垃圾是指,适宜回收利用和资源化利用的生活废弃物,如废纸张、废塑料、废玻璃制品、废金属、废织物等,故食品包装塑料袋属于可回收垃圾,D正确;
故答案为:D。
8.D
A.它西汉素纱禅衣主要成分为蛋白质,属于天然有机高分子材料,A项不符合题意;
B.清紫檀雕花宝座主要成分为纤维素,属于天然有机高分子材料,B项不符合题意;
C.五羊方尊主要成分为合金,属于金属材料,C项不符合题意;
D.青玉交龙钮玉玺由玉雕刻而成,玉的主要成分是硅酸盐,属于无机非金属材料,D项符合题意;
故选D。
9.C
A.从海水中提取NaCl、MgCl2等,电解熔融状态下的NaCl、MgCl2等得到Na、Mg等活泼金属,溴、碘也是从海水中提取的,氯气用电解饱和食盐水的方法获得,铁单质从铁矿石(如赤铁矿、磁铁矿等)中提取,A错误;
B.酒精与水互溶,不能用酒精萃取碘水中的碘,B错误;
C.制作火箭、飞机的材料应密度小、强度高等,这样才能省燃料、抗压能力强等,镁合金密度小,强度高,大量用于制造火箭、飞机等的部件,C正确;
D.蒸馏过程中发现忘加沸石,要停止加热,待冷却后补加,D错误;
选C。
10.B
A.绿色食品是没有经过人为添加化学试剂的食品,而不是单指颜色,故A错误;
B.“煤改气”,“煤改电”等清洁燃料改造工程,能减少空气中的灰尘颗粒,废气等污染物排放,有利于减少雾霾天气,故B正确;
C.汽车尾气燃烧的主要产物为碳氧化物,不是氮氧化物,故C错误;
D.燃料电池的能量转化率高,能量转换率可达80%,但是不可能达到100%,故D错误;
故选B。
11.C
A.缺少一定体积的容量瓶和胶头滴管等仪器,故A实验不能完成;
B.缺少冷凝管、锥形瓶、牛角管等仪器,故B实验不能完成;
C.重结晶法提纯苯甲酸需要用到蒸发浓缩仪器——酒精灯、蒸发皿、玻璃棒,过滤仪器——烧杯、普通漏斗、玻璃棒,故C实验能完成;
D.提取碘需要分液装置,缺少分液漏斗,故D实验不能完成;
综上所答案为C。
12.D
A. 硬铝的成分是指铝合金中以Cu为主要合金元素的(含2.2-4.9%Cu、0.2-1.8%Mg、0.3-0.9%Mn、少量的硅,其余部分是铝)一类铝合金,A项错误;
B. 黄铜是由铜和锌所组成的合金,所以黄铜是合金,B项错误;
C. 钢铁是含碳的铁,所以是合金,C项错误;
D. 水银是汞,是金属单质,所以不是合金,D项正确;
答案选D。
13. 蒸馏法 Na2CO3 过滤 盐酸 电解法 SO2>Br->Cl- 3CO32-+3Br2=5Br-+BrO3-+3CO2↑ 5Br-+BrO3-+6H+=3Br2+3H2O
分析:(1)海水淡化水,应将水与盐分离,可用蒸馏、电渗析或离子交换法等,以此解答;氯化钡除去SO42-离子,粗盐中的镁离子可以加入氢氧化钠来除去;加Na2CO3溶液既可以除去溶液中的钙离子还可以除去溶液中多余的钡离子;过滤后加入盐酸可以除去过量的碳酸钠和氢氧化钠;
(2)用无水MgCl2制取Mg,电解熔融状态的氯化镁可以得到镁和氯气;
(3)在自发进行的氧化还原反应中,还原剂的还原性大于还原产物的还原性;
(4)根据化合价升降总数相等和质量守恒书写;生成溴化钠和溴酸钠,在酸溶液中会反应归中反应。
详解:(1)目前淡化海水的方法有多种,如:蒸馏法、结晶法、淡化膜法等,其中最常用的是蒸馏法;氯化钡除去SO42-离子,粗盐中的镁离子可以加入氢氧化钠来除去;加Na2CO3溶液既可以除去溶液中的钙离子还可以除去溶液中多余的钡离子,需要依次加入稍过量的NaOH、BaCl2、Na2CO3,过滤后,在滤液中加入盐酸至不再有气体生成,将所得溶液加热浓缩、冷却结晶,得到精盐;
(2)金属镁属于活泼金属,无水氯化镁在熔融状态下,通过电解MgCl2Mg+Cl2↑得到金属镁;
(3)在自发进行的氧化还原反应中,还原剂的还原性大于还原产物的还原性,Cl2+2Br-=Br2+2Cl-中还原性为Br->Cl-,SO2+2H2O+Br2=H2SO4+2HBr中还原性为SO2>Br-,所以还原性强弱顺序是SO2>Br->Cl-;
(4)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成物有溴化钠和溴酸钠及无色气体二氧化碳放出,离子反应方程式为3CO32-+3Br2=5Br-+BrO3-+3CO2↑;生成溴化钠和溴酸钠,最后再用H2SO4处理得到Br2,溴离子和溴酸根离子在酸溶液中发生氧化还原反应生成溴单质,反应的离子方程式为5Br-+BrO3-+6H+=3Br2+3H2O。
点睛:本题考查较综合,涉及粗盐提纯、氧化还原反应等,掌握实验的原理、物质的性质差异和操作方法是解答本题的关键,注意氧化还原反应的强弱规律应用,归中反应的应用以及歧化反应的应用等,题目难度中等。
14. 陶瓷 开发研制降解塑料 原电池
( 1 )根据制备各种物种的原料以及塑料的使用注意事项进行分析;
( 2 )根据铁和碳构成许多微小的原电池进行解答。
(1) 生产原料不需要使用石灰石是陶瓷;塑料难于降解,容易造成白色污染,所以开发研制降解塑料可以防治“白色污染”, 故答案为陶瓷;开发研制降解塑料;
(2 )铁和碳构成许多微小的原电池,发生电化学铁被腐蚀,故答案为原电池。
15. 过滤 萃取 无色 紫色 KCl 分液 BDE
(1)分离固体与液体混合物用过滤;碘在有机溶剂中溶解度远大于水,用萃取法从碘水中提取碘;
(2)依据四氯化碳是无色的、密度大于水的液体,是良好的有机溶剂,碘易溶于四氯化碳;CCl4萃取碘水中的碘后,上层液体为KCl溶液,注意不含Cl2和I2;
(3)分离相互不溶的两种液体,应用分液法,然后蒸馏得到碘单质;
(4)物质的灼烧用到的核心仪器是坩埚,据此分析物质的灼烧用到仪器。
(1)操作①前为悬浊液,后为溶液,可知为分离固体与液体的操作,即过滤;碘在有机溶剂中溶解度远大于水,用萃取法从碘水中提取碘,所以操作③为萃取;
(2)四氯化碳不溶于水,四氯化碳是无色的、密度大于水的液体,是良好的有机溶剂,碘易溶于四氯化碳,所以F中现象为:溶液分层,下层液体的颜色为紫色,上层液体中溶质的主要成分为氯化钾(KCl);
(3)F中为相互不溶的两种液体,可用分液分离,分液后得到碘的CCl4溶液,然后用蒸馏的方法得到I2;
故答案为:分液;
(4)给固体物质加热灼烧时用泥三角、坩埚、坩埚钳和酒精灯、三脚架、玻璃棒,故答案为:BDE。
16. cdef 过滤 萃取、分液 B 分液漏斗 普通漏斗 紫红 缺石棉网 温度计插到了液体中 冷凝管进出水的方向颠倒
此实验从海藻中制备碘单质,先将海藻晒干、灼烧成海藻灰,然后浸泡出含有碘离子的溶液,利用碘离子具有较强的还原性,采用适量的氧化剂,将碘离子氧化成碘单质,然后用有机溶剂萃取,分液,最终制得碘单质。
(1)灼烧海带需要的仪器有:酒精灯、三脚架、泥三角及坩埚,故选cdef;
(2)分离难溶性固体和溶液采用过滤方法,从碘水中分离出含碘有机溶液采用分液方法,所以①的操作名称是过滤,③的操作名称是萃取、分液,故答案为过滤;萃取、分液;
(3)A.酒精和水互溶,所以不能作萃取剂,故A错误;
B.四氯化碳、苯符合萃取剂条件,所以能作萃取剂,故B正确;
C.乙酸和水互溶,所以乙酸不能作萃取剂,故C错误;
D.甘油和水互溶,所以甘油不能作萃取剂,故D错误;
故答案为B;
(4)①的操作是过滤还需要普通漏斗;③的操作是萃取、分液,需要分液漏斗,故答案为普通漏斗;分液漏斗;
(5)四氯化碳的密度大于水且和水不互溶,四氯化碳能萃取碘,所以有机层在下方、水在上方,碘的四氯化碳溶液呈紫红色,故答案为紫红;
(6)温度计测量馏分温度,所以温度计水银球应该位于蒸馏烧瓶支管口处;冷凝管中的水应遵循“下进上出”原则;加热烧瓶需要垫石棉网,否则烧瓶受热不均匀,故答案为缺石棉网;温度计插到了液体中;冷凝管进出水的方向颠倒。
17. 过滤 分液漏斗 Cl2+2I﹣=I2+2Cl﹣ 碘水 变蓝 加入碘水溶液变蓝,说明溶液中没有碘、有淀粉,即氯水氧化了碘没有氧化淀粉,所以可以同时排除假设②③ 5 1 6 2 10 分层现象,且上层为紫红色、下层几乎无色 Fe3+ 由探究(4)可知Fe3+和I2可以共存,由此可知Fe3+不能氧化I2,而由(3)可知Cl2能氧化I2,所以氧化性Cl2>FeCl3
(1)根据流程图,结合物质提纯与分离的基本操作分析;通入氯水将碘离子氧化为碘单质;
(2)碘单质与淀粉变蓝,若碘被氧化,则蓝色消失,淀粉恢复原来的颜色,结合碘单质遇淀粉变蓝的性质分析;
(3)反应中Cl2中的Cl元素由0价变为-1价,碘元素由0价变为+5价,结合化合价升降总数相等以及质量守恒配平;
(4)苯可以溶解碘单质,溶液分层;三价铁遇KSCN 溶液变为血红色;
(5)由结合探究(4)和(3)三种反应氧化剂与氧化产物氧化性强弱分析。
(1)海带灰中部分可溶物浸泡后经过操作①得到含碘离子的溶液,则操作①为过滤;将碘单质从水溶液中经过操作②转移至有机溶剂中,则操作②为萃取,主要是用的仪器为分液漏斗;氧化步骤中是向含碘离子溶液中加入氯水,将碘离子氧化为碘单质,离子反应为:Cl2+2I-=I2+2Cl-;
(2) 没有观察到溶液变蓝色,有两种可能,一是溶液中没有碘单质,二是淀粉被转化为其他物质,要证明①是正确的,则只需要在溶液中加入碘水,若溶液变蓝,说明溶液中没有碘、有淀粉,即氯水氧化了碘没有氧化淀粉,所以可以同时排除假设②③
(3)反应中Cl2中的Cl元素由0价变为-1价,碘元素由0价变为+5价,结合化合价升降总数相等以及质量守恒,则方程式为5Cl2+I2+ 6H2O=2HIO3+10HCl,电子转移的方向和数目表示为: ;
(4) FeCl3 溶液中铁离子具有氧化性,KI中碘离子具有还原性,FeCl3与碘化钾发生氧化还原反应,加入试管 a 中加入 1 mL 苯,苯的密度小于水,若溶液分层且上层为紫红色、下层几乎无色,证明反应中生成I2;KSCN 溶液可检验铁离子,加入KSCN溶液变为红色,说明溶液中含有Fe3+;
(5)由探究(4)可知Fe3+和I2可以共存,由此可知Fe3+不能氧化I2,而由(3)可知Cl2能氧化I2,所以氧化性Cl2>FeCl3。
18. 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 或0.075a 3.36 2Al+Fe2O32Fe+Al2O3
(1)铝与氢氧化钠反应生成偏铝酸钠和氢气,根据氢气的物质的量计算铝的质量分数;
(2)高温下恰好发生反应2Al+Fe2O32Fe+Al2O3,则Al、Fe2O3的物质的量比为2:1。
(1) 铝与氢氧化钠反应生成偏铝酸钠和氢气,铝和NaOH反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
n(H2)==mol,
设铝的物质的量是n
=,
m(Al)=27g·mol-1×=g,
ω(Al)=×100%=0.075a。
(2)取同质量的样品,在高温下使其恰好反应,反应方程式为:2Al+Fe2O32Fe+Al2O3,设混合物中含有xmol Al,ymol Fe2O3,
则有:
解之得:x=0.1,y=0.05,
根据铝和氢氧化钠溶液反应的化学方程式:↑,可知生成氢气的体积为a= =3.36L。
【点睛】本题考查铝热反应以及化学方程式的计算,关键是知道铝能与氢氧化钠反应放出氢气,铁和氢氧化钠溶液不反应;本题注意铝热反应的原理。
19.(1)2Al+Fe2O32Fe+Al2O3
(2) 5.4g 9.6g
(1)铝与氧化铁发生铝热反应的化学方程式为2Al+Fe2O32Fe+Al2O3;故答案为:2Al+Fe2O32Fe+Al2O3;
(2)①中反应后氢氧根离子的物质的量为:1mol/L×0.1L=0.1mol,反应中消耗的氢氧化钠的物质的量为:2mol/L×0.1L-0.1mol=0.1mol,氢氧化钠与铝反应生成偏铝酸钠,则偏铝酸钠的物质的量为0.1mol,根据铝原子守恒可知原混合物中金属铝的物质的量0.2mol,质量是0.2mol×27g/mol=5.4g;
②中反应后pH=0,则反应后氢离子的物质的量是0.14mol,由①可知,在第二个反应中Al3+的物质的量是0.1mol,氯离子的物质的量是0.56mol,所以根据氯离子守恒可知亚铁离子的物质的量为:(0.56-0.14-0.1×3)mol÷2=0.06mol;由Fe元素守恒可知,每份铝热剂中氧化铁的物质的量是0.03mol,则整包铝热剂中氧化铁的物质的量是0.06mol,质量是0.06mol×160g/mol=9.6g。故答案为:5.4g;9.6g;
【点睛】明确反应原理、发生的反应是解答的关键,注意守恒法的灵活应用。常见的守恒关系有:①反应前后元素种类和某种原子总数不变的原子守恒;②电解质溶液中的电荷守恒;③氧化还原反应中得失电子数守恒、原电池或电解池中两极通过的电子总数相等;④从守恒思想出发还可延伸出多步反应中的关系式,运用关系式法等计算技巧巧妙解题。
20.(1)KIO3在热或光作用下会分解
(2)加碘盐中的物质的量为2.5×10-4mol,碘的质量3.175×10-2g(31.75mg)
(3)6.0g食盐中含碘0.1905mg,可以获得需要的碘
(1)加碘盐的配料为氯化钠、碘酸钾,其中碘酸钾的性质与氯酸钾相似,在热或光的作用下易分解,故为防止碘酸钾的分解,加碘盐不能长时间炖炒,且应避热、避光保存;
(2)每千克加碘盐中KIO3的质量为53.5 mg,n(KIO3)== 2.5×10-4mol,m(I)=53.5mg×=31.75mg。
(3)根据第(2)问可知,每千克加碘盐中KIO3的质量为53.5 mg,则6.0g加碘盐中含碘量最小为:53.5mg/kg×0.006kg=0.321mg,则含有碘元素的质量为:,在0.15~0.20mg范围内,可以获得需要的碘。
21. 过滤 Al2O3 Al2O3、Fe2O3 Fe2O3 K2SO4、(NH4)2SO4 Al2O3+2NaOH=2NaAlO2+H2O Al3++3NH3·H2O=Al(OH)3↓+3NH4+ NaAlO2+HCl+H2O=Al(OH)3↓+NaCl 2Al(OH)3Al2O3+3H2O
KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀C为Al2O3和Fe2O3;由转化关系图可知,向沉淀C中加NaOH溶液,Fe2O3不反应,沉淀D为Fe2O3,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成固体B为Al2O3;向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中E为K2SO4、(NH4)2SO4,经过蒸发、结晶,得到K2SO4和(NH4)2SO4,然后结合物质的性质及化学用语来解答。
(1)溶液和沉淀的分离利用过滤;
(2)由上述分析可知B为Al2O3,C为Al2O3、Fe2O3,D为Fe2O3溶液E为K2SO4、(NH4)2SO4;
(3)反应①为Al2O3+2NaOH=2NaAlO2+H2O;
反应②为Al3++3NH3 H2O=Al(OH)3↓+3NH4+;
反应③为NaAlO2+HCl+H2O=Al(OH)3↓+NaCl;
反应④为2Al(OH)3Al2O3+3H2O。
22. Fe2O3 Al2O3 D Al3++3NH3·H2O=Al(OH)3↓+3NH4+ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- K2SO4和(NH4)2SO4
KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物甲加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3和Fe2O3;向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,A Fe2O3,为向NaAlO2溶液中通入过量CO2可得Al(OH)3沉淀和碳酸氢钠,Al(OH)3受热分解生成B为Al2O3;向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4 和(NH4)2SO4,经过蒸发、结晶,得到的是K2SO4和(NH4)2SO4,以此来解答。
(1)由上述分析可知,A为Fe2O3,B为Al2O3,
故答案为:Fe2O3;Al2O3;
(2)依据流程分析,向溶液中加入的试剂a应沉淀铝离子,应向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,反应方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+,
A. NaOH溶液若加入过量会使氢氧化铝沉淀溶解,故A错误;
B. 加稀盐酸不能得到氢氧化铝沉淀,故B错误;
C. 通入二氧化碳不能得到氢氧化铝沉淀,故C错误;
D. 加入氨水可生成氢氧化铝沉淀,且过量氨水不与氢氧化铝反应,故D正确;
故答案为:D;Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
(3)反应②中二氧化碳过量,反应生成沉淀和碳酸氢钠,向NaAlO2溶液中通入过量CO2可得Al(OH)3沉淀和碳酸氢钠,其离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)向溶液中加入的试剂a应沉淀铝离子,应向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4和(NH4)2SO4,经过蒸发、结晶,得到的是K2SO4和(NH4)2SO4;固体D可以作为复合性的化学肥料,D中所含物质的化学式为K2SO4和(NH4)2SO4;
故答案为:K2SO4和(NH4)2SO4。
一、单选题(共12题)
1.下列有关化学发展历史的说法错误的是
A.伏打电堆的发明,促进了新元素的发现、研究及电学的进一步发展
B.门捷列夫将元素按照相对原子质量由小到大依次排列,编制了第一张元素周期表
C.侯德榜发明了以食盐、氨、二氧化碳为原料制取碳酸钠的制碱方法,为我国化工事业的发展作出了卓越贡献
D.我国科学家从传统中药提取出青蒿素,并对其进行结构修饰和改造,得到了一系列抗疟疾新药
2.下列说法正确的是
A.氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色
B.煤的干馏、石油的分馏、油脂硬化均属于物理变化
C.与互为同分异构体,谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用来鉴别
D.按系统命名法,化合物的名称为甲基,二乙基己烷
3.实验室从海带中提取碘的操作过程,仪器选用不正确的是
A.称取3.000g的干海带——电子天平
B.灼烧干海带至完全变成灰烬——蒸发皿
C.过滤煮沸后的海带灰水混合液——普通漏斗
D.用四氯化碳从氧化后的海带灰浸取液中提取碘——分液漏斗
4.下列说法不正确的是
A.臭氧具有强氧化性,可用于饮用水消毒
B.在高温下用焦炭还原二氧化硅可制得粗硅
C.工业上电解熔融的氧化镁以得到金属镁
D.镁合金密度较小,可用于制造火箭、导弹和飞机的部件等
5.随着人们生活节奏的加快,小包装食品已被广泛接受,为了防止食品氧化变质,延长食品的保质期,在包装袋中常放入抗氧化物质。下列不属于抗氧化物质的是( )
A.铁粉 B.亚硫酸钠(Na2SO3)
C.生石灰 D.硫酸亚铁(FeSO4)
6.古诗词是我国传统文化的瑰宝。下列诗词解读不正确的是
A.宋·陈鼓年《广韵》中有“酢浆也,醋也”,食醋的主要成分醋酸为弱电解质
B.“此即地霜也。所在山泽,冬月地上有霜,扫取以水淋汁,后乃煎炼而成。”对硝酸钾的提取涉及溶解、蒸发、结晶操作
C.“章山之铜,所谓丹阳铜也。今世有白铜,盖点化为之,非其本质。”纯铜比白铜硬度大、熔点低
D.《诗经》有“周原膴膴(wu),堇荼如饴(麦芽糖)”,麦芽糖属于二糖
7.化学与生活关系密切。下列说法正确的是
A.为实现“碳中和、碳达峰”目标,应禁止使用含碳燃料
B.打印机使用的墨粉中含铁的氧化物,其主要成分为氧化铁
C.大规模开采可燃冰作为新能源,有利于促进碳中和
D.垃圾分类利国利民,食品包装塑料袋属于可回收垃圾
8.中华民族文明源远流长,众多珍贵文物折射出五千年璀璨文明。下列文物的主要成分属于无机非金属材料的是
文物
选项 A.西汉素纱禅衣 B.清紫檀雕花宝座 C.五羊方尊 D.青玉交龙钮玉玺
A.A B.B C.C D.D
9.下列叙述正确的是
A.工业上氯、溴、碘、钠、镁、铁等单质都是直接利用海水来提取的
B.从碘水中萃取碘时,往分液漏斗中加入碘水和酒精,充分静置后分液
C.镁合金密度小,强度高,大量用于制造火箭、飞机等的部件
D.蒸馏过程中发现忘加沸石,可直接补加
10.从化学看生活,你认为下列说法合理的是
A.绿色食品就是指颜色为绿色的食品
B.“煤改气”“煤改电”等清洁燃料改造工程有利于减少雾霾的形成
C.汽车尾气中的氮氧化物主要是汽油燃烧的产物
D.燃料电池是一种高效、环境友好型的发电装置,其能量转化率可达100%
11.实验室提供的玻璃仪器有烧杯、普通漏斗、酒精灯、蒸发皿、玻璃棒、试管、蒸馏烧瓶,非玻璃仪器任选,选用上述仪器能完成的实验是
A.配制一定浓度和体积的NaOH溶液 B.石油分馏
C.重结晶法提纯苯甲酸 D.从海带灰中提取碘单质
12.合金有着广泛的应用。下列物质不属于合金的是
A.硬铝 B.黄铜 C.钢铁 D.水银
二、非选择题(共10题)
13.地球的表面积为5.1亿平方公里,其中海洋的面积为3.67亿平方公里,占整个地球表面积的70.8 %。海洋是一个巨大的化学资源宝库,下面根据海水资源综合利用,请回答下列问题:
(1)淡化海水的方法有________________(写一种合理方法即可)。由海水提取的粗盐中含有Ca2+、Mg2+、SO42-等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、________(填化学式),之后________(填操作名称),再加入适量________(填试剂名称)。将所得溶液加热浓缩、冷却结晶,得到精盐。
(2)由无水MgCl2制取金属镁的常用工业方法是__________________。
(3)向苦卤中通入Cl2置换出Br2,再用空气吹出溴并用SO2吸收,转化为Br-,反复多次,以达到富集溴的目的。由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由强到弱的顺序是__________。
(4)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时放出CO2,写出反应的离子方程式____________。再H2SO4处理所得溶液重新得到Br2,其反应的离子方程式为_______________。
14.材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础。材料种类很多,通常可分为金属材料、无机非金属材料(包括硅酸盐材料)、高分子合成材料和复合材料。
(1)玻璃、陶瓷、水泥的生产原料不需要使用石灰石的是____。塑料制品给人类带来很多方便,但塑料制品造成的“白色污染”已成为社会的一大公害,请你提出一项防治“白色污染”的有效措施:____。
(2)金属腐蚀会造成巨大的经济损失,钢铁在潮湿的空气中更容易被腐蚀,主要原因是钢铁里的铁和碳构成许多微小的____,发生电化腐蚀。
15.海洋植物如海带.海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海洋植物中提取碘的流程如图:
某化学兴趣小组将上述流程②③设计成如图所示。
已知氯水中含有Cl2,②中发生反应的化学方程式为:Cl2+2KI=2KCl+I2
回答下列问题:
(1)写出提取过程①③中实验操作的名称:①___,③___。
(2)四氯化碳是___色的液体,F中下层液体的颜色为___色,上层液体中溶质的主要成分的化学式为___。
(3)从F中得到固态碘还需进行的操作是___。
(4)在灼烧过程中,将使用到的(除泥三角外)实验仪器有___(填字母)
A.试管 B.瓷坩埚 C.蒸发皿 D.坩埚钳 E.酒精灯
16.海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
(1)实验室焙烧海带,需要下列仪器中的________(填序号)。
a 试管 b 烧杯 c 坩埚 d 泥三角 e 铁三脚架 f 酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①__________,③________。
(3)提取碘的过程中,可选择的有机试剂是( )
A 甲苯、酒精 B 四氯化碳、苯
C 汽油、乙酸 D 汽油、甘油
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有__________、__________。
(5)小组用CCl4萃取碘水中的碘,在右图的分液漏斗中,下层液体呈__________色;
(6)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处:
①____________________;
②_______________________________;
③____________________________;
17.化学兴趣小组在实验室进行“海带提碘”的实验过程如图:
(1)操作①的名称是_____,操作②的主要仪器是_____;氧化步骤的离子方程式是_____。
(2)探究异常:取样检验时,部分同学没有观察到溶液变蓝色。他们假设原因可能是加入的氯水过量,氧化了①I2;②淀粉;③I2和淀粉。他们在没有变蓝色的溶液中,滴加_____(选填“四氯化碳”“碘水”“淀粉溶液”)后,若出现_____现象,即可证明假设①正确,同时排除假设②③.能同时排除假设②③的原因是_____。
(3)查阅资料:Cl2 可氧化 I2,反应的化学方程式为_____Cl2+_____I2+_____ H2O→_____ HIO3+_____ HCl.配平上述方程式,并标出电子转移的方向和数目_______。
(4)探究氧化性:在盛有 FeCl3 溶液的试管中,滴入几滴 KI 溶液,将反应后的溶液均匀倒入两支试管,试管 a 中加入 1 mL 苯振荡静置,出现______(填实验现象),证明有 I2存在;试管b 中滴入 KSCN 溶液,溶液显血红色,证明有_____存在。
(5)比较氧化性:综合上述实验,可以得出的结论是氧化性:Cl2>FeCl3,理由是_____。
18.由铝和某些金属氧化物组成的混合物在化学上称为铝热剂,该混合物在高温条件下能发生置换反应。为确定某铝热剂样品(铝和氧化铁)的组成,分别进行下列实验:
(1)若取10.7g该样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为aL。反应的化学方程式是__,样品中铝的质量分数是__(用含a的表达式表示)。
(2)若取同质量的样品,在高温下使其恰好反应,则a=__L;该反应的化学方程式是__。
19.现有一包铝热剂是铝粉和氧化铁粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(计算pH时假定溶液体积没有变化):
①向其中一份固体中加入100 mL2.0 mol/L的NaOH溶液,加热使其充分反应后过滤,测得滤液的pH=14。
②向另一份固体中加入140 mL 4.0 mol/L的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且pH=0。
(1)写出该铝热反应的化学方程式_____________________________
(2)这包铝热剂中铝粉的质量为_________ , 氧化铁粉末的质量______________
20.下面是某地市场上销售的一种加碘食盐包装袋上的部分文字说明。
配料 氯化钠(NaCl)、碘酸钾()
含碘量
保质期 18个月
食用方法 勿长时间炖炒
贮藏指南 避热、避光、密封、防潮
(1)加碘盐不能长时间炖炒,且应避热、避光保存,你认为可能的原因是什么?_______
(2)实验分析发现,某批加碘盐中的含量为。试计算每千克该加碘盐中的物质的量和碘的质量。_______
(3)若成人每天需摄入碘才能满足人体健康的需要,试通过计算说明成人平均每天食用6.0g这种加碘盐能否获得所需要的碘。 _______
21.某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:
据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是__。
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式
固体B__;沉淀C__;沉淀D__;溶液E___。
(3)写出①、②、③、④四个反应的化学方程式或离子方程式
①__;
②___;
③___;
④__。
22.(某混合物甲中含有明矾[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。在一定条件下由甲可实现如图所示的物质之间的转化:
请回答下列问题:
(1)写出A、B的化学式:A___,B___。
(2)试剂a最好选用下列试剂中的( )
A.NaOH溶液 B.稀盐酸 C.二氧化碳 D.氨水
写出相应的离子方程式___。
(3)写出反应②(生成溶液C和沉淀)的离子方程式___。
(4)固体D可以作为复合性的化学肥料,D中所含物质的化学式为___。
参考答案:
1.C
侯氏制碱法优化了索尔维制碱法,提高了NaCl利用率,减少无用的副产品CaCl2排放,转成有用的化肥NH4Cl,节约成本并提高了经济效益,C选项错误;
A、B、D选项说法正确;
答案选C。
2.D
【解析】A.聚乙烯不含碳碳双键;
B.煤的干馏、油脂硬化均为化学变化;
C.二者含有的氢原子的种类、相应的数目相同,但是各种氢原子的具体位置不同;
D.最长碳链含6个C,且2号C上有甲基,3、4号C上有乙基。
A. 聚乙烯不含碳碳双键,不能使酸性高锰钾溶液褪色,故A错误;
B. 煤的干馏、油脂硬化均为化学变化,而石油的分馏为物理变化,故B错误;
C. 二者含有的氢原子的种类、相应的数目相同,但是各种氢原子的具体位置不同,能用来鉴别,故C错误;
D. 最长碳链含6个C,且2号C上有甲基,3、4号C上有乙基,名称为甲基,二乙基己烷,故D正确;
答案选D。
【点睛】本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的难点,题目难度不大。
3.B
A. 称取3.000g的干海带,需要使用精确度高的电子天平,精确度为0.0001g,故A正确;
B. 灼烧固体应在坩埚中进行,而加热液体可用蒸发皿,故B错误;
C. 过滤煮沸后的海带灰水混合液可用漏斗分离,故C正确;
D. 萃取分液要用分液漏斗,故D正确;
答案选B。
4.C
A.臭氧有强氧化性,还原产物为水,可用于饮用水消毒,故正确;
B.碳和二氧化硅高温下反应生成硅和一氧化碳,故正确;
C.工业上用电解熔融的氯化镁制取金属镁,故错误;
D.镁合金密度小,可以制造火箭等部件,故正确。
故选C。
5.C
抗氧化剂具有较强的还原性,据此分析。
A. 铁粉具有较强的还原性,反应中Fe的化合价升高,能防止食物被氧化而变质,A项正确,不符合题意;
B. 亚硫酸钠具有较强的还原性,在反应中S的的化合价升高,能防止食物被氧化而变质,B项正确,不符合题意;
C. 生石灰具有吸水性,一般用作干燥剂,它不能防止食物被氧化,C项错误,符合题意;
D. 硫酸亚铁具有较强的还原性,反应中Fe的化合价升高,能防止食物被氧化而变质,D项正确,不符合题意;
答案选C。
【点睛】解答本题时要注意抗氧化剂的概念和其作用:抗氧化剂是阻止氧气不良影响的物质,是指能防止或延缓食品氧化,提高食品的稳定性和延长贮存期的食品添加剂;抗氧化剂的正确使用不仅可以延长食品的贮存期、货架期,给生产者、消费者带来良好的经济效益,而且给消费者带来更好的食品安全。
6.C
A.醋酸是弱酸,属于弱电解质,A正确;
B.提纯硝酸钾,先溶解、再蒸发浓缩,降温结晶,B正确;
C.纯铜是纯金属,白铜是铜的合金,合金的硬度比组分单质高,熔点比组分单质低,故纯铜的硬度小于白铜,熔点高于白铜,C错误;
D.麦芽糖水解得到两分子葡萄糖,属于二糖,D正确;
故选C。
7.D
A.采取节能低碳生活方式,不能禁止使用含碳燃料,只能尽量使用新能源代替含碳燃料,A错误;
B.氧化铁为红色,而油墨呈黑色,故墨粉中含铁的氧化物主要成分不可能是氧化铁,B错误;
C.可燃冰是甲烷的结晶水合物,大量开采使用,会产生CO2,不利于碳中和,C错误;
D.将垃圾分类处理,将垃圾进行资源化,可以节约能源、绿色环保,利国利民,可回收垃圾是指,适宜回收利用和资源化利用的生活废弃物,如废纸张、废塑料、废玻璃制品、废金属、废织物等,故食品包装塑料袋属于可回收垃圾,D正确;
故答案为:D。
8.D
A.它西汉素纱禅衣主要成分为蛋白质,属于天然有机高分子材料,A项不符合题意;
B.清紫檀雕花宝座主要成分为纤维素,属于天然有机高分子材料,B项不符合题意;
C.五羊方尊主要成分为合金,属于金属材料,C项不符合题意;
D.青玉交龙钮玉玺由玉雕刻而成,玉的主要成分是硅酸盐,属于无机非金属材料,D项符合题意;
故选D。
9.C
A.从海水中提取NaCl、MgCl2等,电解熔融状态下的NaCl、MgCl2等得到Na、Mg等活泼金属,溴、碘也是从海水中提取的,氯气用电解饱和食盐水的方法获得,铁单质从铁矿石(如赤铁矿、磁铁矿等)中提取,A错误;
B.酒精与水互溶,不能用酒精萃取碘水中的碘,B错误;
C.制作火箭、飞机的材料应密度小、强度高等,这样才能省燃料、抗压能力强等,镁合金密度小,强度高,大量用于制造火箭、飞机等的部件,C正确;
D.蒸馏过程中发现忘加沸石,要停止加热,待冷却后补加,D错误;
选C。
10.B
A.绿色食品是没有经过人为添加化学试剂的食品,而不是单指颜色,故A错误;
B.“煤改气”,“煤改电”等清洁燃料改造工程,能减少空气中的灰尘颗粒,废气等污染物排放,有利于减少雾霾天气,故B正确;
C.汽车尾气燃烧的主要产物为碳氧化物,不是氮氧化物,故C错误;
D.燃料电池的能量转化率高,能量转换率可达80%,但是不可能达到100%,故D错误;
故选B。
11.C
A.缺少一定体积的容量瓶和胶头滴管等仪器,故A实验不能完成;
B.缺少冷凝管、锥形瓶、牛角管等仪器,故B实验不能完成;
C.重结晶法提纯苯甲酸需要用到蒸发浓缩仪器——酒精灯、蒸发皿、玻璃棒,过滤仪器——烧杯、普通漏斗、玻璃棒,故C实验能完成;
D.提取碘需要分液装置,缺少分液漏斗,故D实验不能完成;
综上所答案为C。
12.D
A. 硬铝的成分是指铝合金中以Cu为主要合金元素的(含2.2-4.9%Cu、0.2-1.8%Mg、0.3-0.9%Mn、少量的硅,其余部分是铝)一类铝合金,A项错误;
B. 黄铜是由铜和锌所组成的合金,所以黄铜是合金,B项错误;
C. 钢铁是含碳的铁,所以是合金,C项错误;
D. 水银是汞,是金属单质,所以不是合金,D项正确;
答案选D。
13. 蒸馏法 Na2CO3 过滤 盐酸 电解法 SO2>Br->Cl- 3CO32-+3Br2=5Br-+BrO3-+3CO2↑ 5Br-+BrO3-+6H+=3Br2+3H2O
分析:(1)海水淡化水,应将水与盐分离,可用蒸馏、电渗析或离子交换法等,以此解答;氯化钡除去SO42-离子,粗盐中的镁离子可以加入氢氧化钠来除去;加Na2CO3溶液既可以除去溶液中的钙离子还可以除去溶液中多余的钡离子;过滤后加入盐酸可以除去过量的碳酸钠和氢氧化钠;
(2)用无水MgCl2制取Mg,电解熔融状态的氯化镁可以得到镁和氯气;
(3)在自发进行的氧化还原反应中,还原剂的还原性大于还原产物的还原性;
(4)根据化合价升降总数相等和质量守恒书写;生成溴化钠和溴酸钠,在酸溶液中会反应归中反应。
详解:(1)目前淡化海水的方法有多种,如:蒸馏法、结晶法、淡化膜法等,其中最常用的是蒸馏法;氯化钡除去SO42-离子,粗盐中的镁离子可以加入氢氧化钠来除去;加Na2CO3溶液既可以除去溶液中的钙离子还可以除去溶液中多余的钡离子,需要依次加入稍过量的NaOH、BaCl2、Na2CO3,过滤后,在滤液中加入盐酸至不再有气体生成,将所得溶液加热浓缩、冷却结晶,得到精盐;
(2)金属镁属于活泼金属,无水氯化镁在熔融状态下,通过电解MgCl2Mg+Cl2↑得到金属镁;
(3)在自发进行的氧化还原反应中,还原剂的还原性大于还原产物的还原性,Cl2+2Br-=Br2+2Cl-中还原性为Br->Cl-,SO2+2H2O+Br2=H2SO4+2HBr中还原性为SO2>Br-,所以还原性强弱顺序是SO2>Br->Cl-;
(4)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成物有溴化钠和溴酸钠及无色气体二氧化碳放出,离子反应方程式为3CO32-+3Br2=5Br-+BrO3-+3CO2↑;生成溴化钠和溴酸钠,最后再用H2SO4处理得到Br2,溴离子和溴酸根离子在酸溶液中发生氧化还原反应生成溴单质,反应的离子方程式为5Br-+BrO3-+6H+=3Br2+3H2O。
点睛:本题考查较综合,涉及粗盐提纯、氧化还原反应等,掌握实验的原理、物质的性质差异和操作方法是解答本题的关键,注意氧化还原反应的强弱规律应用,归中反应的应用以及歧化反应的应用等,题目难度中等。
14. 陶瓷 开发研制降解塑料 原电池
( 1 )根据制备各种物种的原料以及塑料的使用注意事项进行分析;
( 2 )根据铁和碳构成许多微小的原电池进行解答。
(1) 生产原料不需要使用石灰石是陶瓷;塑料难于降解,容易造成白色污染,所以开发研制降解塑料可以防治“白色污染”, 故答案为陶瓷;开发研制降解塑料;
(2 )铁和碳构成许多微小的原电池,发生电化学铁被腐蚀,故答案为原电池。
15. 过滤 萃取 无色 紫色 KCl 分液 BDE
(1)分离固体与液体混合物用过滤;碘在有机溶剂中溶解度远大于水,用萃取法从碘水中提取碘;
(2)依据四氯化碳是无色的、密度大于水的液体,是良好的有机溶剂,碘易溶于四氯化碳;CCl4萃取碘水中的碘后,上层液体为KCl溶液,注意不含Cl2和I2;
(3)分离相互不溶的两种液体,应用分液法,然后蒸馏得到碘单质;
(4)物质的灼烧用到的核心仪器是坩埚,据此分析物质的灼烧用到仪器。
(1)操作①前为悬浊液,后为溶液,可知为分离固体与液体的操作,即过滤;碘在有机溶剂中溶解度远大于水,用萃取法从碘水中提取碘,所以操作③为萃取;
(2)四氯化碳不溶于水,四氯化碳是无色的、密度大于水的液体,是良好的有机溶剂,碘易溶于四氯化碳,所以F中现象为:溶液分层,下层液体的颜色为紫色,上层液体中溶质的主要成分为氯化钾(KCl);
(3)F中为相互不溶的两种液体,可用分液分离,分液后得到碘的CCl4溶液,然后用蒸馏的方法得到I2;
故答案为:分液;
(4)给固体物质加热灼烧时用泥三角、坩埚、坩埚钳和酒精灯、三脚架、玻璃棒,故答案为:BDE。
16. cdef 过滤 萃取、分液 B 分液漏斗 普通漏斗 紫红 缺石棉网 温度计插到了液体中 冷凝管进出水的方向颠倒
此实验从海藻中制备碘单质,先将海藻晒干、灼烧成海藻灰,然后浸泡出含有碘离子的溶液,利用碘离子具有较强的还原性,采用适量的氧化剂,将碘离子氧化成碘单质,然后用有机溶剂萃取,分液,最终制得碘单质。
(1)灼烧海带需要的仪器有:酒精灯、三脚架、泥三角及坩埚,故选cdef;
(2)分离难溶性固体和溶液采用过滤方法,从碘水中分离出含碘有机溶液采用分液方法,所以①的操作名称是过滤,③的操作名称是萃取、分液,故答案为过滤;萃取、分液;
(3)A.酒精和水互溶,所以不能作萃取剂,故A错误;
B.四氯化碳、苯符合萃取剂条件,所以能作萃取剂,故B正确;
C.乙酸和水互溶,所以乙酸不能作萃取剂,故C错误;
D.甘油和水互溶,所以甘油不能作萃取剂,故D错误;
故答案为B;
(4)①的操作是过滤还需要普通漏斗;③的操作是萃取、分液,需要分液漏斗,故答案为普通漏斗;分液漏斗;
(5)四氯化碳的密度大于水且和水不互溶,四氯化碳能萃取碘,所以有机层在下方、水在上方,碘的四氯化碳溶液呈紫红色,故答案为紫红;
(6)温度计测量馏分温度,所以温度计水银球应该位于蒸馏烧瓶支管口处;冷凝管中的水应遵循“下进上出”原则;加热烧瓶需要垫石棉网,否则烧瓶受热不均匀,故答案为缺石棉网;温度计插到了液体中;冷凝管进出水的方向颠倒。
17. 过滤 分液漏斗 Cl2+2I﹣=I2+2Cl﹣ 碘水 变蓝 加入碘水溶液变蓝,说明溶液中没有碘、有淀粉,即氯水氧化了碘没有氧化淀粉,所以可以同时排除假设②③ 5 1 6 2 10 分层现象,且上层为紫红色、下层几乎无色 Fe3+ 由探究(4)可知Fe3+和I2可以共存,由此可知Fe3+不能氧化I2,而由(3)可知Cl2能氧化I2,所以氧化性Cl2>FeCl3
(1)根据流程图,结合物质提纯与分离的基本操作分析;通入氯水将碘离子氧化为碘单质;
(2)碘单质与淀粉变蓝,若碘被氧化,则蓝色消失,淀粉恢复原来的颜色,结合碘单质遇淀粉变蓝的性质分析;
(3)反应中Cl2中的Cl元素由0价变为-1价,碘元素由0价变为+5价,结合化合价升降总数相等以及质量守恒配平;
(4)苯可以溶解碘单质,溶液分层;三价铁遇KSCN 溶液变为血红色;
(5)由结合探究(4)和(3)三种反应氧化剂与氧化产物氧化性强弱分析。
(1)海带灰中部分可溶物浸泡后经过操作①得到含碘离子的溶液,则操作①为过滤;将碘单质从水溶液中经过操作②转移至有机溶剂中,则操作②为萃取,主要是用的仪器为分液漏斗;氧化步骤中是向含碘离子溶液中加入氯水,将碘离子氧化为碘单质,离子反应为:Cl2+2I-=I2+2Cl-;
(2) 没有观察到溶液变蓝色,有两种可能,一是溶液中没有碘单质,二是淀粉被转化为其他物质,要证明①是正确的,则只需要在溶液中加入碘水,若溶液变蓝,说明溶液中没有碘、有淀粉,即氯水氧化了碘没有氧化淀粉,所以可以同时排除假设②③
(3)反应中Cl2中的Cl元素由0价变为-1价,碘元素由0价变为+5价,结合化合价升降总数相等以及质量守恒,则方程式为5Cl2+I2+ 6H2O=2HIO3+10HCl,电子转移的方向和数目表示为: ;
(4) FeCl3 溶液中铁离子具有氧化性,KI中碘离子具有还原性,FeCl3与碘化钾发生氧化还原反应,加入试管 a 中加入 1 mL 苯,苯的密度小于水,若溶液分层且上层为紫红色、下层几乎无色,证明反应中生成I2;KSCN 溶液可检验铁离子,加入KSCN溶液变为红色,说明溶液中含有Fe3+;
(5)由探究(4)可知Fe3+和I2可以共存,由此可知Fe3+不能氧化I2,而由(3)可知Cl2能氧化I2,所以氧化性Cl2>FeCl3。
18. 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 或0.075a 3.36 2Al+Fe2O32Fe+Al2O3
(1)铝与氢氧化钠反应生成偏铝酸钠和氢气,根据氢气的物质的量计算铝的质量分数;
(2)高温下恰好发生反应2Al+Fe2O32Fe+Al2O3,则Al、Fe2O3的物质的量比为2:1。
(1) 铝与氢氧化钠反应生成偏铝酸钠和氢气,铝和NaOH反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
n(H2)==mol,
设铝的物质的量是n
=,
m(Al)=27g·mol-1×=g,
ω(Al)=×100%=0.075a。
(2)取同质量的样品,在高温下使其恰好反应,反应方程式为:2Al+Fe2O32Fe+Al2O3,设混合物中含有xmol Al,ymol Fe2O3,
则有:
解之得:x=0.1,y=0.05,
根据铝和氢氧化钠溶液反应的化学方程式:↑,可知生成氢气的体积为a= =3.36L。
【点睛】本题考查铝热反应以及化学方程式的计算,关键是知道铝能与氢氧化钠反应放出氢气,铁和氢氧化钠溶液不反应;本题注意铝热反应的原理。
19.(1)2Al+Fe2O32Fe+Al2O3
(2) 5.4g 9.6g
(1)铝与氧化铁发生铝热反应的化学方程式为2Al+Fe2O32Fe+Al2O3;故答案为:2Al+Fe2O32Fe+Al2O3;
(2)①中反应后氢氧根离子的物质的量为:1mol/L×0.1L=0.1mol,反应中消耗的氢氧化钠的物质的量为:2mol/L×0.1L-0.1mol=0.1mol,氢氧化钠与铝反应生成偏铝酸钠,则偏铝酸钠的物质的量为0.1mol,根据铝原子守恒可知原混合物中金属铝的物质的量0.2mol,质量是0.2mol×27g/mol=5.4g;
②中反应后pH=0,则反应后氢离子的物质的量是0.14mol,由①可知,在第二个反应中Al3+的物质的量是0.1mol,氯离子的物质的量是0.56mol,所以根据氯离子守恒可知亚铁离子的物质的量为:(0.56-0.14-0.1×3)mol÷2=0.06mol;由Fe元素守恒可知,每份铝热剂中氧化铁的物质的量是0.03mol,则整包铝热剂中氧化铁的物质的量是0.06mol,质量是0.06mol×160g/mol=9.6g。故答案为:5.4g;9.6g;
【点睛】明确反应原理、发生的反应是解答的关键,注意守恒法的灵活应用。常见的守恒关系有:①反应前后元素种类和某种原子总数不变的原子守恒;②电解质溶液中的电荷守恒;③氧化还原反应中得失电子数守恒、原电池或电解池中两极通过的电子总数相等;④从守恒思想出发还可延伸出多步反应中的关系式,运用关系式法等计算技巧巧妙解题。
20.(1)KIO3在热或光作用下会分解
(2)加碘盐中的物质的量为2.5×10-4mol,碘的质量3.175×10-2g(31.75mg)
(3)6.0g食盐中含碘0.1905mg,可以获得需要的碘
(1)加碘盐的配料为氯化钠、碘酸钾,其中碘酸钾的性质与氯酸钾相似,在热或光的作用下易分解,故为防止碘酸钾的分解,加碘盐不能长时间炖炒,且应避热、避光保存;
(2)每千克加碘盐中KIO3的质量为53.5 mg,n(KIO3)== 2.5×10-4mol,m(I)=53.5mg×=31.75mg。
(3)根据第(2)问可知,每千克加碘盐中KIO3的质量为53.5 mg,则6.0g加碘盐中含碘量最小为:53.5mg/kg×0.006kg=0.321mg,则含有碘元素的质量为:,在0.15~0.20mg范围内,可以获得需要的碘。
21. 过滤 Al2O3 Al2O3、Fe2O3 Fe2O3 K2SO4、(NH4)2SO4 Al2O3+2NaOH=2NaAlO2+H2O Al3++3NH3·H2O=Al(OH)3↓+3NH4+ NaAlO2+HCl+H2O=Al(OH)3↓+NaCl 2Al(OH)3Al2O3+3H2O
KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀C为Al2O3和Fe2O3;由转化关系图可知,向沉淀C中加NaOH溶液,Fe2O3不反应,沉淀D为Fe2O3,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成固体B为Al2O3;向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中E为K2SO4、(NH4)2SO4,经过蒸发、结晶,得到K2SO4和(NH4)2SO4,然后结合物质的性质及化学用语来解答。
(1)溶液和沉淀的分离利用过滤;
(2)由上述分析可知B为Al2O3,C为Al2O3、Fe2O3,D为Fe2O3溶液E为K2SO4、(NH4)2SO4;
(3)反应①为Al2O3+2NaOH=2NaAlO2+H2O;
反应②为Al3++3NH3 H2O=Al(OH)3↓+3NH4+;
反应③为NaAlO2+HCl+H2O=Al(OH)3↓+NaCl;
反应④为2Al(OH)3Al2O3+3H2O。
22. Fe2O3 Al2O3 D Al3++3NH3·H2O=Al(OH)3↓+3NH4+ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- K2SO4和(NH4)2SO4
KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物甲加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3和Fe2O3;向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,A Fe2O3,为向NaAlO2溶液中通入过量CO2可得Al(OH)3沉淀和碳酸氢钠,Al(OH)3受热分解生成B为Al2O3;向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4 和(NH4)2SO4,经过蒸发、结晶,得到的是K2SO4和(NH4)2SO4,以此来解答。
(1)由上述分析可知,A为Fe2O3,B为Al2O3,
故答案为:Fe2O3;Al2O3;
(2)依据流程分析,向溶液中加入的试剂a应沉淀铝离子,应向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,反应方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+,
A. NaOH溶液若加入过量会使氢氧化铝沉淀溶解,故A错误;
B. 加稀盐酸不能得到氢氧化铝沉淀,故B错误;
C. 通入二氧化碳不能得到氢氧化铝沉淀,故C错误;
D. 加入氨水可生成氢氧化铝沉淀,且过量氨水不与氢氧化铝反应,故D正确;
故答案为:D;Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
(3)反应②中二氧化碳过量,反应生成沉淀和碳酸氢钠,向NaAlO2溶液中通入过量CO2可得Al(OH)3沉淀和碳酸氢钠,其离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)向溶液中加入的试剂a应沉淀铝离子,应向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4和(NH4)2SO4,经过蒸发、结晶,得到的是K2SO4和(NH4)2SO4;固体D可以作为复合性的化学肥料,D中所含物质的化学式为K2SO4和(NH4)2SO4;
故答案为:K2SO4和(NH4)2SO4。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
