二氧化硫性质及其性质比较
图片预览




文档简介
(共29张PPT)
2014年9月
SO2性质及其性质比较
分析比较法是处理和解决问题的一种重要方法,更是化学学习中一种常见的方法。比较法有“同中求异”和“异中求同”:
同中求异——将同类问题或事件进行横向比较,找到其不同点
异中求同——将异类问题或事件进行纵向比较,找到其相同点
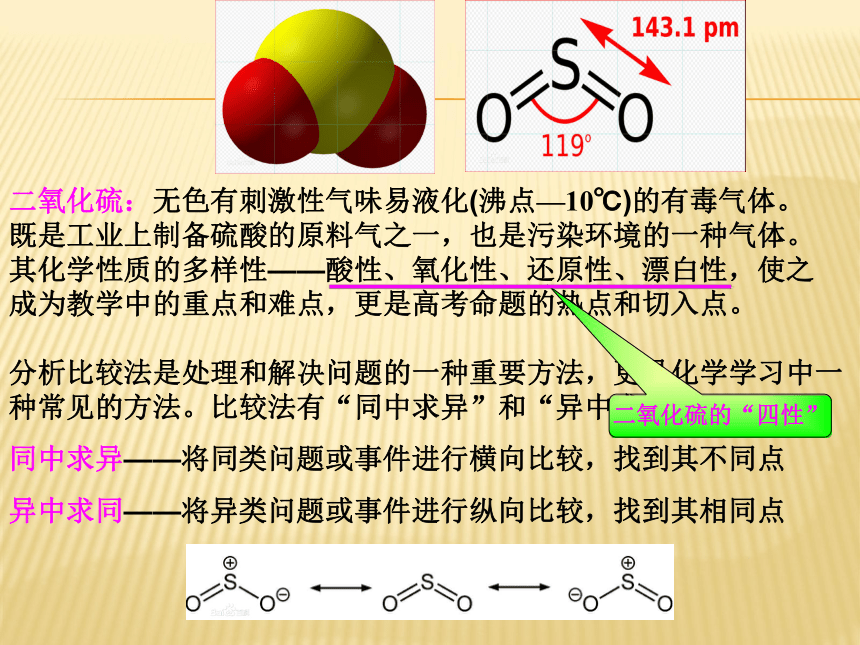
二氧化硫:无色有刺激性气味易液化(沸点—10℃)的有毒气体。
既是工业上制备硫酸的原料气之一,也是污染环境的一种气体。其化学性质的多样性——酸性、氧化性、还原性、漂白性,使之成为教学中的重点和难点,更是高考命题的热点和切入点。
二氧化硫的“四性”
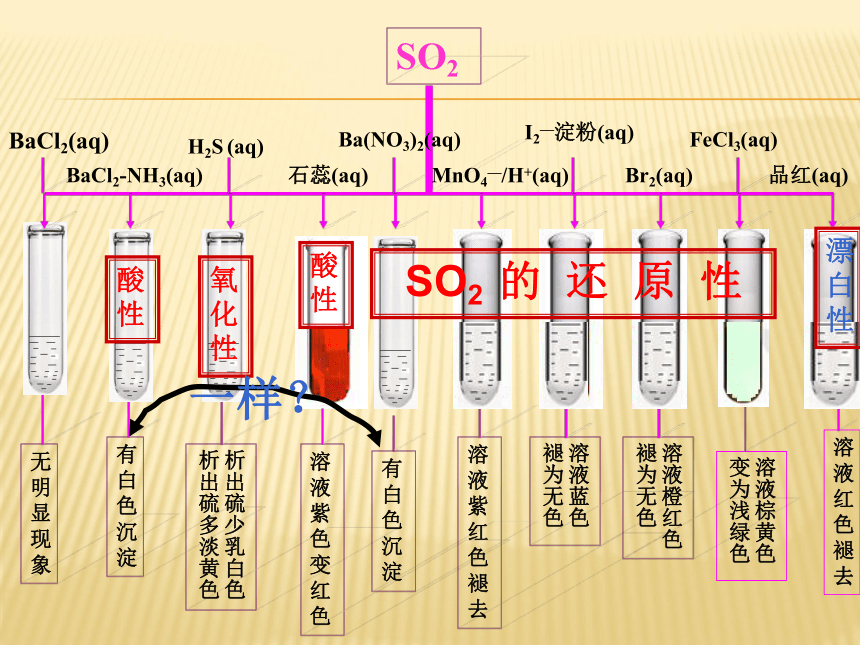
SO2
BaCl2(aq)
BaCl2-NH3(aq)
Ba(NO3)2(aq)
MnO4—/H+(aq)
Br2(aq)
FeCl3(aq)
品红(aq)
H2S (aq)
溶液棕黄色变为浅绿色
溶液紫红色褪去
析出硫少乳白色析出硫多淡黄色
无明显现象
有白色沉淀
有白色沉淀
溶液红色褪去
石蕊(aq)
氧化性
I2—淀粉(aq)
溶液紫色变红色
溶液蓝色褪为无色
溶液橙红色褪为无色
SO2 的 还 原 性
酸性
酸性
漂白性
一样?
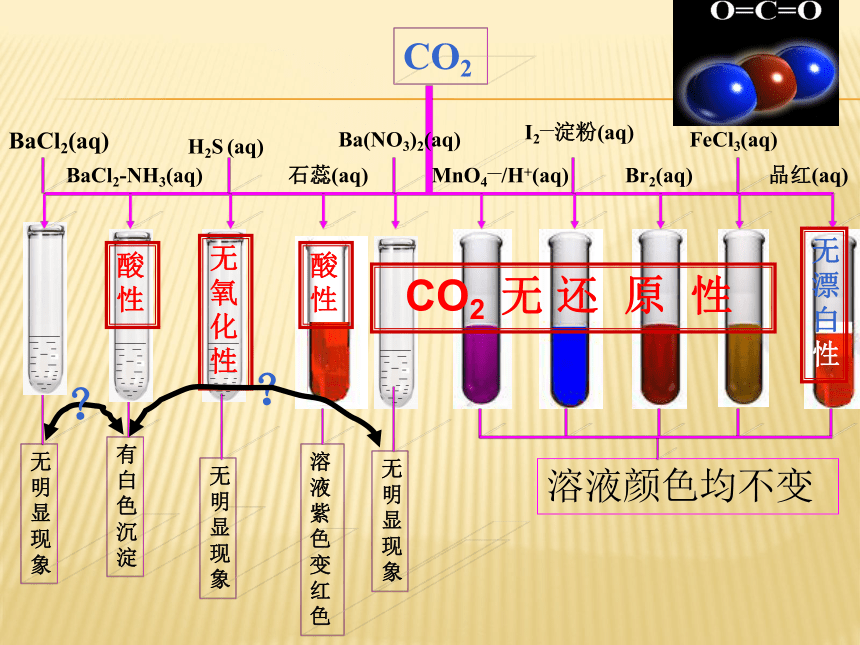
BaCl2(aq)
BaCl2-NH3(aq)
Ba(NO3)2(aq)
MnO4—/H+(aq)
Br2(aq)
FeCl3(aq)
品红(aq)
H2S (aq)
无明显现象
有白色沉淀
溶液颜色均不变
石蕊(aq)
无氧化性
无漂白性
I2—淀粉(aq)
溶液紫色变红色
?
CO2 无 还 原 性
CO2
无明显现象
无明显现象
?
酸性
酸性
结论
一、相同点
SO2和CO2都是酸性氧化物
(1)与水反应生成H2SO3和H2CO3;
(2)都能使紫色石蕊溶液或潮湿的蓝色石蕊试纸变红;
(3)都能与碱反应(都可使澄清石灰水变浑浊,过量又变澄清);
(4)与BaCl2和CaCl2溶液都不反应
此外与碱性氧化物都生成盐
二、不同点
漂白性、氧化性、还原性:SO2有CO2无(常温或水溶液中)
(活泼金属在加热或点燃条件下与CO2反应,CO2表现为氧化性)
SO2漂白性辨析
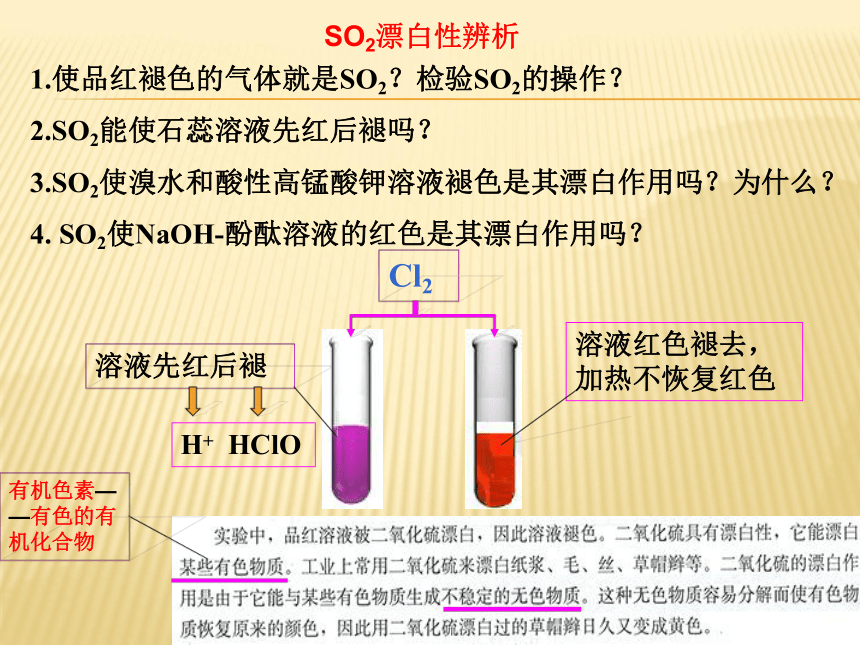
1.使品红褪色的气体就是SO2?检验SO2的操作?
2.SO2能使石蕊溶液先红后褪吗?
3.SO2使溴水和酸性高锰酸钾溶液褪色是其漂白作用吗?为什么?
4. SO2使NaOH-酚酞溶液的红色是其漂白作用吗?
Cl2
溶液红色褪去,加热不恢复红色
溶液先红后褪
有机色素——有色的有机化合物
H+ HClO
漂白与脱色原理
氧化漂白 加合漂白 吸附脱色
物质 HClO、H2O2、O3、Na2O2 SO2、H2SO3、HSO3— 活性炭、硅胶、
氢氧化铝胶体
原理 化学反应 物理吸附
不可逆,不复原 可逆,返色
漂白:有机色素 脱色:有机色素和有色无机化合物
等物质的量的Cl2和SO2混合遇湿润的有机色素失去漂白作用
Cl2+SO2+2H2O==4H++2Cl—+SO42—
H2O2
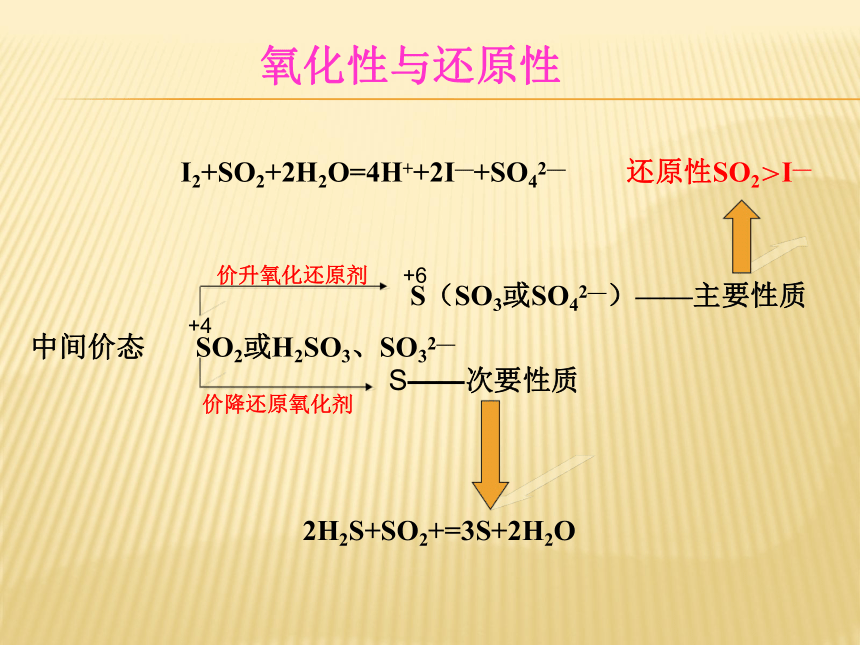
S(SO3或SO42—)——主要性质
中间价态 SO2或H2SO3、SO32—
+4
+6
价升氧化还原剂
价降还原氧化剂
S——次要性质
I2+SO2+2H2O=4H++2I—+SO42— 还原性SO2>I—
2H2S+SO2+=3S+2H2O
氧化性与还原性
遇到氧化剂,勿忘还原性
SO2的还原性
SO2分别通入Ba(NO3)2溶液、Ca(ClO)2溶液
3SO2+2NO3—+2H2O==3SO42—+2NO↑+4H+
Ba2++SO42—== BaSO4↓
SO2+ClO—+H2O==SO42—+Cl—+2H+
Ca2++SO42—== CaSO4↓
SO2量少:Ca2++2ClO—+SO2+H2O==CaSO4 ↓ + Cl—+HClO+H+
SO2量多:Ca2++2ClO—+2SO2+2H2O==CaSO4 ↓ +2Cl—+SO42—+ 4H+
SO2量少:ClO—+ H+==HClO
显性与隐性
HNO3 HClO
Ba2++2NO3—+3SO2+2H2O==BaSO4 ↓+2SO42—+ 4H+ +2NO↑
28.2013年北京卷(15分)
某学生对SO2与漂粉精的反应进行实验探究:
操 作 现 象
取4 g漂粉精固体,加入100 mL水 部分固体溶解,溶液略有颜色
过滤,测漂粉精溶液的pH pH试纸先变蓝(约为12),后褪色
i. 液面上方出现白雾;
ii. 稍后,出现浑浊,溶液变为黄绿色;
iii. 稍后,产生大量白色沉淀,黄绿色褪去
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是_______________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是__________。
耐人寻味的两年北京高考题
① 实验a目的是_____________________。
②由实验a、b不能判断白雾中含有HCl,理由是____________。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl—发生反应。通过进一步实验确认了这种可能性,其实验方案是__________________________。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HCl,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是________________。
②用离子方程式解释现象iii中黄绿色褪去的原因:_____________
____________________________。
(3)向水中持续通入SO2,未观察到白雾。
推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
【答案】
(1)
(2)碱性、漂白性
(3)①检验白雾中是否Cl2,排除Cl2干扰
②白雾中含有SO2,SO2可以使酸化的AgNO3溶液产生白色的Ag2SO4 沉淀
(4)向漂白精溶液中逐滴滴入硫酸,观察溶液颜色是否变为黄绿色
(5)①CaSO4
②
【解析】
(1)Cl2和Ca(OH)2生成氯化钙、次氯酸钙与水
(2)pH试纸先变蓝(约为12),说明溶液呈碱性,后颜色褪去,说明具有漂白性
(3)①反应中生成Cl2,用湿润的碘化钾淀粉试纸检验白雾中是否Cl2,排除Cl2干扰
②白雾中含有SO2,可以被硝酸(酸化的AgNO3溶液)氧化为硫酸,故SO2可以使酸化的AgNO3溶液产生白色沉淀——Ag2SO4
3SO2+2NO3— +2H2O==3SO42—+2NO↑+4H+
(4)向漂白精溶液中逐滴滴入硫酸,观察溶液颜色是否变为黄绿色——ClO—+Cl—+2H+==Cl2↑+H2O
(5)①取上层清液,加入BaCl2溶液,产生白色沉淀,说明SO2被氧化为SO42—,故沉淀X为CaSO4
②溶液呈黄绿色,有Cl2生成,Cl2与SO2反应生成盐酸与硫酸
一、氯元素及其化合物性质
1.Cl2的颜色、氧化性(与淀粉—KI和SO2的反应);与Ca(OH)2反应;
2.ClO—的水解、强氧化性(与SO2、酸性时的Cl—反应——ClO—与Cl—的共存条件)
二、硫元素及其化合物性质
1.SO2与水作用形成酸雾
2.H2SO3的酸性(提供H+,使ClO—与Cl—发生反应)
3.SO2的还原性(被NO3—/H+和ClO—氧化为SO42—而形成Ag2SO4、CaSO4沉淀)
知 识 网
微溶
Ag2SO4
SO2+H2O H2SO3 H++HSO3—
ClO—
Cl—
Cl2
+
+
SO42—
白雾
CaSO4
NO3—/H+
BaSO4
I2遇淀粉变蓝
湿润淀粉-KI
Ca2+或Ba2+
不形成CaSO3或BaSO3沉淀
能 力 层 次
1、
2、辨认装置图
再现,复述,辨认
3、测漂粉精溶液的pH
分析实验现象并得出结论
4、分析现象ii中溶液变为黄绿色的可能原因
分析实验现象、评价筛选试剂,设计化学实验并得出结论
6、推测现象i:白雾由HCl小液滴形成
对比实验,推理(Ca(ClO)2与SO2反应可能放热,产生白雾)
5、向水中持续通入SO2,未观察到白雾
提出推测,设计实验验证
(2)酸化的AgNO3溶液检验白雾
综合分析:酸化的AgNO3溶液中的H+和NO3—具有强氧化性,SO2的强还原性,SO2被氧化为SO42—,进而生成微溶的Ag2SO4 ——从试题提供的新信息中,准确地提取实质性内容,并经与已有知识块整合,重组为新知识块的能力
7、由实验a、b不能判断白雾中含有HCl
实验a、b确能证明白雾中含HCl,但设问说“不能”,引发认知冲突,另求突破
(1)用湿润的碘化钾淀粉试纸检验白雾,无变化
排除Cl2的干扰
8、过滤除去沉淀X的上层清液,加入BaCl2溶液,产生白色沉淀
CaSO4微溶,BaSO4难溶——运用科学的方法,初步了解化学变化规律,并对化学现象提出科学合理的解释
9、用离子方程式解释现象iii中黄绿色褪去的原因
黄绿色的物质是什么?先为什么生成了?后又为什么褪去了?且经检验白雾中无Cl2,这又引发思维冲撞——溶液中有白雾中无。分析出Cl2与SO2的反应,而又要求运用正确的化学用语表达出离子方程式——将实际问题分解,通过运用相关知识,采用分析、综合的方法解决简单化学问题的能力。
知识
心境
能力
成败
2011年北京卷(15分)甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
实验操作和现象:
操 作 现 象
关闭弹簧夹,滴加一定量浓硫酸,加热 A中有白雾生成,铜片表面产生气泡
B中有气泡冒出,产生大量白色沉淀
C中产生白色沉淀,液面上方略显浅棕色并逐渐消失
打开弹簧夹,通入N2,停止加热,一段时间后关闭
从B、C中分别取少量白色沉淀,加稀盐酸 均未发现白色沉淀溶解
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是 ;
乙在A、B间增加洗气瓶D,D中盛放的试剂是 。
②进行实验,B中现象:
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因: 。
⑸合并⑷中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是 。
甲 大量白色沉淀
乙 少量白色沉淀
⑴A中反应的化学方程式是 。
⑵C中白色沉淀是 ,该沉淀的生成表明SO2具有 性。
⑶C中液面上方生成浅棕色气体的化学方程式是 。
⑷分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
根据背景材料和题设问题,调用已有的知识铜与浓硫酸反应的实验;SO2的还原性;BaSO3、BaSO4的难溶性和生成条件;O2和HNO3的氧化性等知识,仔细观察实验装置图并认真分析A、B、C中的实验现象,其中C的实验现象说明了SO2进入Ba(NO3)3溶液中溶解呈酸性,在酸性条件下SO2被NO3—氧化:
3SO2+2NO3—+2H2O==3SO42—+2NO↑+4H+
Ba2++SO42—== BaSO4↓
2NO+O2==2NO2
无色 红棕色
第(4)题属实验探究,要求根据白雾提出假设、设计实验验证假设,根据实验现象进行分析推论,需要运用比较归纳等研究方法——白雾中的成分、甲乙现象的差异(大量与少量)进行系统分析,得出正确结论。如果落入“硫酸是高沸点(难挥发性)酸”的死结中,就钻进了难解的死胡同。
第(5)题是第(4)题的延续,层层递进多轮次探究,强化高级思维品质的考查。
甲为了排除装置内空气,在原有装置之前增加一步操作,可先通一段时间的N2;
乙同学为除去白雾或SO2中的H2SO4、SO3,可在A、B间增加一个盛放浓硫酸或饱和NaHSO3溶液的洗气瓶;
在甲、乙的两个实验中,B中仍出现不溶于稀盐酸的白色沉淀且白色沉淀都是BaSO4,由于甲同学没有排除白雾的干扰,故有:
SO42-+Ba2+== BaSO4↓;乙同学没有排除空气的干扰,故有:
2Ba2++2SO2+O2+2H2O == 2BaSO4↓+4H+
合并甲、乙方案进行实验时(即通N2排完装置内空气,又在A、B间增加一个盛放浓硫酸或饱和NaHSO3溶液的洗气瓶),B中无沉淀生成, 虽然C中有BaSO4白色沉淀,但不是BaSO3,这就说明了SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀。
注意:答题时必须强调BaSO3,否则将词不达意!
⑴Cu+2H2SO4 (浓) === CuSO4+SO2↑+2H2O
⑵BaSO4 还原
⑶2NO+O2==2NO2
⑷①通 N2一段时间,排除装置中的空气
饱和NaHSO3溶液或浓H2SO4
②甲:SO42-+Ba2+==BaSO4↓,
乙:2Ba2++2SO2+O2+2H2O==2BaSO4↓+4H+
白雾的量远多于装置中O2的量?
⑸SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀
△
答 案
答案的不足
1.答案“白雾的量远多于装置中O2的量?”显然不妥,SO2与O2反应的速率慢,即使O2远远多于白雾,也不会有大量白色沉淀
2.吸收SO2 ,除用饱和亚硫酸钠溶液还可用浓硫酸
试题的拓展
虽然在有限的时间内和试题的赋分情况下,不可能设置过多的设问,但是试题所赋予的内涵肯定还有不少。如:
1.C中液面上方浅棕色消失的原因——2013年再现;
2.将“乙在A、B间增加洗气瓶D,D中盛放的试剂是”改为“乙为了验证自己的观点正确,在上图中增加一个装置,画出此装置并指明所用试剂和连接部位”
(三)2012年安徽卷(15分)
亚硫酸盐是一种常见食品添加剂。为检验某食品中亚硫酸盐含量
(通常以1 kg样品中含SO2的质量计),某研究小组设计了如下两种实验流程:
样
品
足量稀硫酸
边通N2,边煮沸
气体
A
甲 方 案 流 程
①H2O2溶液充分吸收
H2SO4
溶液
②NaOH标准溶液滴定
数据
处理
乙 方 案 流 程
溶液
B
数据
处理
碱液充分吸收
用盐酸调节至弱酸性
I2标准溶液
滴 定
(1)气体A的主要成分是________。为防止煮沸时发生暴沸,必须先向烧瓶中加入______;通入N2的目的是____________。
(2)写出甲方案第①步反应的离子方程式:__________。
(3)甲方案第②步滴定前,滴定管需用NaOH标准溶液润洗,其操作方法是_________。
(4)若用盐酸代替稀硫酸处理样品,则按乙方案实验测定的结果_______(填“偏高”、“偏低”或“无影响”)。
(5)若取样品w g,按乙方案测得消耗0.01000 mol·L—1 I2溶液V mL,则1 kg样品中含SO2的质量是______g(用含w、V的代数式表示)。
(三)2012年北京卷
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是___________________。
(3)吸收液吸收SO2的过程中,pH随n(SO32—)︰n(HSO3—)的变化关系如下表:
n(SO32—)︰n(HSO3—) 91︰9 1︰1 9︰91
pH 8.2 7.2 6.2
①由上表判断,Na2HSO3溶液显________性,用化学平衡原理解释:______________。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母): _______________。
a. c(Na+)=2c(SO32—)+c(HSO3—)
b. c(Na+>c(HSO3—)>c(SO32—)>c(H+)>=c(OH—)
c. c(Na+)+c(H+)=c(SO32—)+c(HSO3—)+c(OH—)
(4)当吸收液的pH降至约为6时,满送至电解槽再生。再生示意图如下:
①HSO3—在阳极放电的电极反应式是_____________________。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:____________。
谢 谢
恭贺同学们——
学业进步
学有所成
2014年9月
SO2性质及其性质比较
分析比较法是处理和解决问题的一种重要方法,更是化学学习中一种常见的方法。比较法有“同中求异”和“异中求同”:
同中求异——将同类问题或事件进行横向比较,找到其不同点
异中求同——将异类问题或事件进行纵向比较,找到其相同点
二氧化硫:无色有刺激性气味易液化(沸点—10℃)的有毒气体。
既是工业上制备硫酸的原料气之一,也是污染环境的一种气体。其化学性质的多样性——酸性、氧化性、还原性、漂白性,使之成为教学中的重点和难点,更是高考命题的热点和切入点。
二氧化硫的“四性”
SO2
BaCl2(aq)
BaCl2-NH3(aq)
Ba(NO3)2(aq)
MnO4—/H+(aq)
Br2(aq)
FeCl3(aq)
品红(aq)
H2S (aq)
溶液棕黄色变为浅绿色
溶液紫红色褪去
析出硫少乳白色析出硫多淡黄色
无明显现象
有白色沉淀
有白色沉淀
溶液红色褪去
石蕊(aq)
氧化性
I2—淀粉(aq)
溶液紫色变红色
溶液蓝色褪为无色
溶液橙红色褪为无色
SO2 的 还 原 性
酸性
酸性
漂白性
一样?
BaCl2(aq)
BaCl2-NH3(aq)
Ba(NO3)2(aq)
MnO4—/H+(aq)
Br2(aq)
FeCl3(aq)
品红(aq)
H2S (aq)
无明显现象
有白色沉淀
溶液颜色均不变
石蕊(aq)
无氧化性
无漂白性
I2—淀粉(aq)
溶液紫色变红色
?
CO2 无 还 原 性
CO2
无明显现象
无明显现象
?
酸性
酸性
结论
一、相同点
SO2和CO2都是酸性氧化物
(1)与水反应生成H2SO3和H2CO3;
(2)都能使紫色石蕊溶液或潮湿的蓝色石蕊试纸变红;
(3)都能与碱反应(都可使澄清石灰水变浑浊,过量又变澄清);
(4)与BaCl2和CaCl2溶液都不反应
此外与碱性氧化物都生成盐
二、不同点
漂白性、氧化性、还原性:SO2有CO2无(常温或水溶液中)
(活泼金属在加热或点燃条件下与CO2反应,CO2表现为氧化性)
SO2漂白性辨析
1.使品红褪色的气体就是SO2?检验SO2的操作?
2.SO2能使石蕊溶液先红后褪吗?
3.SO2使溴水和酸性高锰酸钾溶液褪色是其漂白作用吗?为什么?
4. SO2使NaOH-酚酞溶液的红色是其漂白作用吗?
Cl2
溶液红色褪去,加热不恢复红色
溶液先红后褪
有机色素——有色的有机化合物
H+ HClO
漂白与脱色原理
氧化漂白 加合漂白 吸附脱色
物质 HClO、H2O2、O3、Na2O2 SO2、H2SO3、HSO3— 活性炭、硅胶、
氢氧化铝胶体
原理 化学反应 物理吸附
不可逆,不复原 可逆,返色
漂白:有机色素 脱色:有机色素和有色无机化合物
等物质的量的Cl2和SO2混合遇湿润的有机色素失去漂白作用
Cl2+SO2+2H2O==4H++2Cl—+SO42—
H2O2
S(SO3或SO42—)——主要性质
中间价态 SO2或H2SO3、SO32—
+4
+6
价升氧化还原剂
价降还原氧化剂
S——次要性质
I2+SO2+2H2O=4H++2I—+SO42— 还原性SO2>I—
2H2S+SO2+=3S+2H2O
氧化性与还原性
遇到氧化剂,勿忘还原性
SO2的还原性
SO2分别通入Ba(NO3)2溶液、Ca(ClO)2溶液
3SO2+2NO3—+2H2O==3SO42—+2NO↑+4H+
Ba2++SO42—== BaSO4↓
SO2+ClO—+H2O==SO42—+Cl—+2H+
Ca2++SO42—== CaSO4↓
SO2量少:Ca2++2ClO—+SO2+H2O==CaSO4 ↓ + Cl—+HClO+H+
SO2量多:Ca2++2ClO—+2SO2+2H2O==CaSO4 ↓ +2Cl—+SO42—+ 4H+
SO2量少:ClO—+ H+==HClO
显性与隐性
HNO3 HClO
Ba2++2NO3—+3SO2+2H2O==BaSO4 ↓+2SO42—+ 4H+ +2NO↑
28.2013年北京卷(15分)
某学生对SO2与漂粉精的反应进行实验探究:
操 作 现 象
取4 g漂粉精固体,加入100 mL水 部分固体溶解,溶液略有颜色
过滤,测漂粉精溶液的pH pH试纸先变蓝(约为12),后褪色
i. 液面上方出现白雾;
ii. 稍后,出现浑浊,溶液变为黄绿色;
iii. 稍后,产生大量白色沉淀,黄绿色褪去
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是_______________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是__________。
耐人寻味的两年北京高考题
① 实验a目的是_____________________。
②由实验a、b不能判断白雾中含有HCl,理由是____________。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl—发生反应。通过进一步实验确认了这种可能性,其实验方案是__________________________。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HCl,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是________________。
②用离子方程式解释现象iii中黄绿色褪去的原因:_____________
____________________________。
(3)向水中持续通入SO2,未观察到白雾。
推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
【答案】
(1)
(2)碱性、漂白性
(3)①检验白雾中是否Cl2,排除Cl2干扰
②白雾中含有SO2,SO2可以使酸化的AgNO3溶液产生白色的Ag2SO4 沉淀
(4)向漂白精溶液中逐滴滴入硫酸,观察溶液颜色是否变为黄绿色
(5)①CaSO4
②
【解析】
(1)Cl2和Ca(OH)2生成氯化钙、次氯酸钙与水
(2)pH试纸先变蓝(约为12),说明溶液呈碱性,后颜色褪去,说明具有漂白性
(3)①反应中生成Cl2,用湿润的碘化钾淀粉试纸检验白雾中是否Cl2,排除Cl2干扰
②白雾中含有SO2,可以被硝酸(酸化的AgNO3溶液)氧化为硫酸,故SO2可以使酸化的AgNO3溶液产生白色沉淀——Ag2SO4
3SO2+2NO3— +2H2O==3SO42—+2NO↑+4H+
(4)向漂白精溶液中逐滴滴入硫酸,观察溶液颜色是否变为黄绿色——ClO—+Cl—+2H+==Cl2↑+H2O
(5)①取上层清液,加入BaCl2溶液,产生白色沉淀,说明SO2被氧化为SO42—,故沉淀X为CaSO4
②溶液呈黄绿色,有Cl2生成,Cl2与SO2反应生成盐酸与硫酸
一、氯元素及其化合物性质
1.Cl2的颜色、氧化性(与淀粉—KI和SO2的反应);与Ca(OH)2反应;
2.ClO—的水解、强氧化性(与SO2、酸性时的Cl—反应——ClO—与Cl—的共存条件)
二、硫元素及其化合物性质
1.SO2与水作用形成酸雾
2.H2SO3的酸性(提供H+,使ClO—与Cl—发生反应)
3.SO2的还原性(被NO3—/H+和ClO—氧化为SO42—而形成Ag2SO4、CaSO4沉淀)
知 识 网
微溶
Ag2SO4
SO2+H2O H2SO3 H++HSO3—
ClO—
Cl—
Cl2
+
+
SO42—
白雾
CaSO4
NO3—/H+
BaSO4
I2遇淀粉变蓝
湿润淀粉-KI
Ca2+或Ba2+
不形成CaSO3或BaSO3沉淀
能 力 层 次
1、
2、辨认装置图
再现,复述,辨认
3、测漂粉精溶液的pH
分析实验现象并得出结论
4、分析现象ii中溶液变为黄绿色的可能原因
分析实验现象、评价筛选试剂,设计化学实验并得出结论
6、推测现象i:白雾由HCl小液滴形成
对比实验,推理(Ca(ClO)2与SO2反应可能放热,产生白雾)
5、向水中持续通入SO2,未观察到白雾
提出推测,设计实验验证
(2)酸化的AgNO3溶液检验白雾
综合分析:酸化的AgNO3溶液中的H+和NO3—具有强氧化性,SO2的强还原性,SO2被氧化为SO42—,进而生成微溶的Ag2SO4 ——从试题提供的新信息中,准确地提取实质性内容,并经与已有知识块整合,重组为新知识块的能力
7、由实验a、b不能判断白雾中含有HCl
实验a、b确能证明白雾中含HCl,但设问说“不能”,引发认知冲突,另求突破
(1)用湿润的碘化钾淀粉试纸检验白雾,无变化
排除Cl2的干扰
8、过滤除去沉淀X的上层清液,加入BaCl2溶液,产生白色沉淀
CaSO4微溶,BaSO4难溶——运用科学的方法,初步了解化学变化规律,并对化学现象提出科学合理的解释
9、用离子方程式解释现象iii中黄绿色褪去的原因
黄绿色的物质是什么?先为什么生成了?后又为什么褪去了?且经检验白雾中无Cl2,这又引发思维冲撞——溶液中有白雾中无。分析出Cl2与SO2的反应,而又要求运用正确的化学用语表达出离子方程式——将实际问题分解,通过运用相关知识,采用分析、综合的方法解决简单化学问题的能力。
知识
心境
能力
成败
2011年北京卷(15分)甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
实验操作和现象:
操 作 现 象
关闭弹簧夹,滴加一定量浓硫酸,加热 A中有白雾生成,铜片表面产生气泡
B中有气泡冒出,产生大量白色沉淀
C中产生白色沉淀,液面上方略显浅棕色并逐渐消失
打开弹簧夹,通入N2,停止加热,一段时间后关闭
从B、C中分别取少量白色沉淀,加稀盐酸 均未发现白色沉淀溶解
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是 ;
乙在A、B间增加洗气瓶D,D中盛放的试剂是 。
②进行实验,B中现象:
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因: 。
⑸合并⑷中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是 。
甲 大量白色沉淀
乙 少量白色沉淀
⑴A中反应的化学方程式是 。
⑵C中白色沉淀是 ,该沉淀的生成表明SO2具有 性。
⑶C中液面上方生成浅棕色气体的化学方程式是 。
⑷分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
根据背景材料和题设问题,调用已有的知识铜与浓硫酸反应的实验;SO2的还原性;BaSO3、BaSO4的难溶性和生成条件;O2和HNO3的氧化性等知识,仔细观察实验装置图并认真分析A、B、C中的实验现象,其中C的实验现象说明了SO2进入Ba(NO3)3溶液中溶解呈酸性,在酸性条件下SO2被NO3—氧化:
3SO2+2NO3—+2H2O==3SO42—+2NO↑+4H+
Ba2++SO42—== BaSO4↓
2NO+O2==2NO2
无色 红棕色
第(4)题属实验探究,要求根据白雾提出假设、设计实验验证假设,根据实验现象进行分析推论,需要运用比较归纳等研究方法——白雾中的成分、甲乙现象的差异(大量与少量)进行系统分析,得出正确结论。如果落入“硫酸是高沸点(难挥发性)酸”的死结中,就钻进了难解的死胡同。
第(5)题是第(4)题的延续,层层递进多轮次探究,强化高级思维品质的考查。
甲为了排除装置内空气,在原有装置之前增加一步操作,可先通一段时间的N2;
乙同学为除去白雾或SO2中的H2SO4、SO3,可在A、B间增加一个盛放浓硫酸或饱和NaHSO3溶液的洗气瓶;
在甲、乙的两个实验中,B中仍出现不溶于稀盐酸的白色沉淀且白色沉淀都是BaSO4,由于甲同学没有排除白雾的干扰,故有:
SO42-+Ba2+== BaSO4↓;乙同学没有排除空气的干扰,故有:
2Ba2++2SO2+O2+2H2O == 2BaSO4↓+4H+
合并甲、乙方案进行实验时(即通N2排完装置内空气,又在A、B间增加一个盛放浓硫酸或饱和NaHSO3溶液的洗气瓶),B中无沉淀生成, 虽然C中有BaSO4白色沉淀,但不是BaSO3,这就说明了SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀。
注意:答题时必须强调BaSO3,否则将词不达意!
⑴Cu+2H2SO4 (浓) === CuSO4+SO2↑+2H2O
⑵BaSO4 还原
⑶2NO+O2==2NO2
⑷①通 N2一段时间,排除装置中的空气
饱和NaHSO3溶液或浓H2SO4
②甲:SO42-+Ba2+==BaSO4↓,
乙:2Ba2++2SO2+O2+2H2O==2BaSO4↓+4H+
白雾的量远多于装置中O2的量?
⑸SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀
△
答 案
答案的不足
1.答案“白雾的量远多于装置中O2的量?”显然不妥,SO2与O2反应的速率慢,即使O2远远多于白雾,也不会有大量白色沉淀
2.吸收SO2 ,除用饱和亚硫酸钠溶液还可用浓硫酸
试题的拓展
虽然在有限的时间内和试题的赋分情况下,不可能设置过多的设问,但是试题所赋予的内涵肯定还有不少。如:
1.C中液面上方浅棕色消失的原因——2013年再现;
2.将“乙在A、B间增加洗气瓶D,D中盛放的试剂是”改为“乙为了验证自己的观点正确,在上图中增加一个装置,画出此装置并指明所用试剂和连接部位”
(三)2012年安徽卷(15分)
亚硫酸盐是一种常见食品添加剂。为检验某食品中亚硫酸盐含量
(通常以1 kg样品中含SO2的质量计),某研究小组设计了如下两种实验流程:
样
品
足量稀硫酸
边通N2,边煮沸
气体
A
甲 方 案 流 程
①H2O2溶液充分吸收
H2SO4
溶液
②NaOH标准溶液滴定
数据
处理
乙 方 案 流 程
溶液
B
数据
处理
碱液充分吸收
用盐酸调节至弱酸性
I2标准溶液
滴 定
(1)气体A的主要成分是________。为防止煮沸时发生暴沸,必须先向烧瓶中加入______;通入N2的目的是____________。
(2)写出甲方案第①步反应的离子方程式:__________。
(3)甲方案第②步滴定前,滴定管需用NaOH标准溶液润洗,其操作方法是_________。
(4)若用盐酸代替稀硫酸处理样品,则按乙方案实验测定的结果_______(填“偏高”、“偏低”或“无影响”)。
(5)若取样品w g,按乙方案测得消耗0.01000 mol·L—1 I2溶液V mL,则1 kg样品中含SO2的质量是______g(用含w、V的代数式表示)。
(三)2012年北京卷
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是___________________。
(3)吸收液吸收SO2的过程中,pH随n(SO32—)︰n(HSO3—)的变化关系如下表:
n(SO32—)︰n(HSO3—) 91︰9 1︰1 9︰91
pH 8.2 7.2 6.2
①由上表判断,Na2HSO3溶液显________性,用化学平衡原理解释:______________。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母): _______________。
a. c(Na+)=2c(SO32—)+c(HSO3—)
b. c(Na+>c(HSO3—)>c(SO32—)>c(H+)>=c(OH—)
c. c(Na+)+c(H+)=c(SO32—)+c(HSO3—)+c(OH—)
(4)当吸收液的pH降至约为6时,满送至电解槽再生。再生示意图如下:
①HSO3—在阳极放电的电极反应式是_____________________。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:____________。
谢 谢
恭贺同学们——
学业进步
学有所成
