2.4化学反应的调控同步练习题(含解析)高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.4化学反应的调控同步练习题(含解析)高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-02 10:27:33 | ||
图片预览


文档简介
2.4化学反应的调控同步练习题
一、选择题
1.工业上可以利用硫()与为原料制备,受热分解成气态,发生反应: △H。一定条件下,与反应中的转化率、分解产生的体积分数随温度的变化曲线如图所示。
下列说法正确的是
A.△H>0
B.图中a点所示条件下,延长反应时间不能提高转化率
C.在恒温密闭容器中,与按物质的量之比为2:1投料,当的体积分数为15%时,的转化率为45%(该温度下,完全分解成气态。)
D.工业上生产,温度越高越好
2.氨在催化剂作用下发生反应:。若在时,向密闭容器中充入和,测得氨的转化率随时间变化如图所示。下列说法正确的是
A.在内 B.d点时改变的条件可能是降温、加压
C.时,平衡时容器压强是反应前的倍 D.正反应的速率:
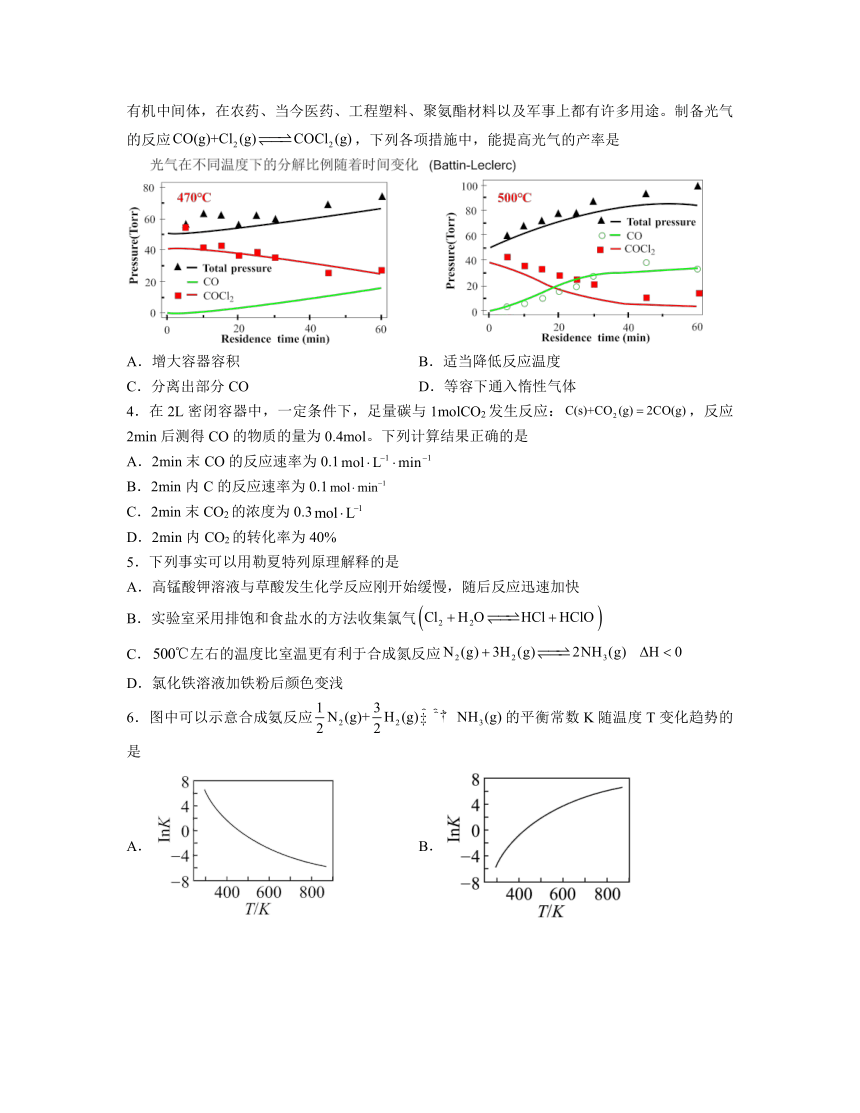
3.下图是光气在不同温度下的分解图象。光气,又称碳酰氯,化学式为,是一种重要的有机中间体,在农药、当今医药、工程塑料、聚氨酯材料以及军事上都有许多用途。制备光气的反应,下列各项措施中,能提高光气的产率是
A.增大容器容积 B.适当降低反应温度
C.分离出部分CO D.等容下通入惰性气体
4.在2L密闭容器中,一定条件下,足量碳与1molCO2发生反应:,反应2min后测得CO的物质的量为0.4mol。下列计算结果正确的是
A.2min末CO的反应速率为0.1
B.2min内C的反应速率为0.1
C.2min末CO2的浓度为0.3
D.2min内CO2的转化率为40%
5.下列事实可以用勒夏特列原理解释的是
A.高锰酸钾溶液与草酸发生化学反应刚开始缓慢,随后反应迅速加快
B.实验室采用排饱和食盐水的方法收集氯气
C.左右的温度比室温更有利于合成氮反应
D.氯化铁溶液加铁粉后颜色变浅
6.图中可以示意合成氨反应的平衡常数K随温度T变化趋势的是
A. B.
C. D.
7.下列说法正确的是
A.保持温度压强不变,反应 N2(g)+3H2(g) 2NH3(g)达平衡后通入O2,平衡向右移动
B.2NO2N2O4,其他条件不变,加压后颜色变浅
C.A(s)+3B(g) 2C(g)+D(g) △H<0,平衡升温后,混合气的平均摩尔质量变大
D.已知CO2(g)+H2(g) CO(g)+H2O(g)在800℃ K=0.9,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol/L,c(H2)为1.5mol/L,c(CO)为1mol/L,c(H2O)为3mol/L,此时v正 < v逆
8.工业利用反应N2(g)+3H2(g)2NH3(g) △H<0合成氨,下列关于工业合成氨的说法错误的是
A.液化分离出氨气,循环利用N2和H2,能提高平衡混合物中氨的含量
B.在500℃下合成氨的原因是该温度下催化剂活性最强
C.原料气要净化,防止催化剂“中毒”
D.使用热交换器可节约能源,降低成本
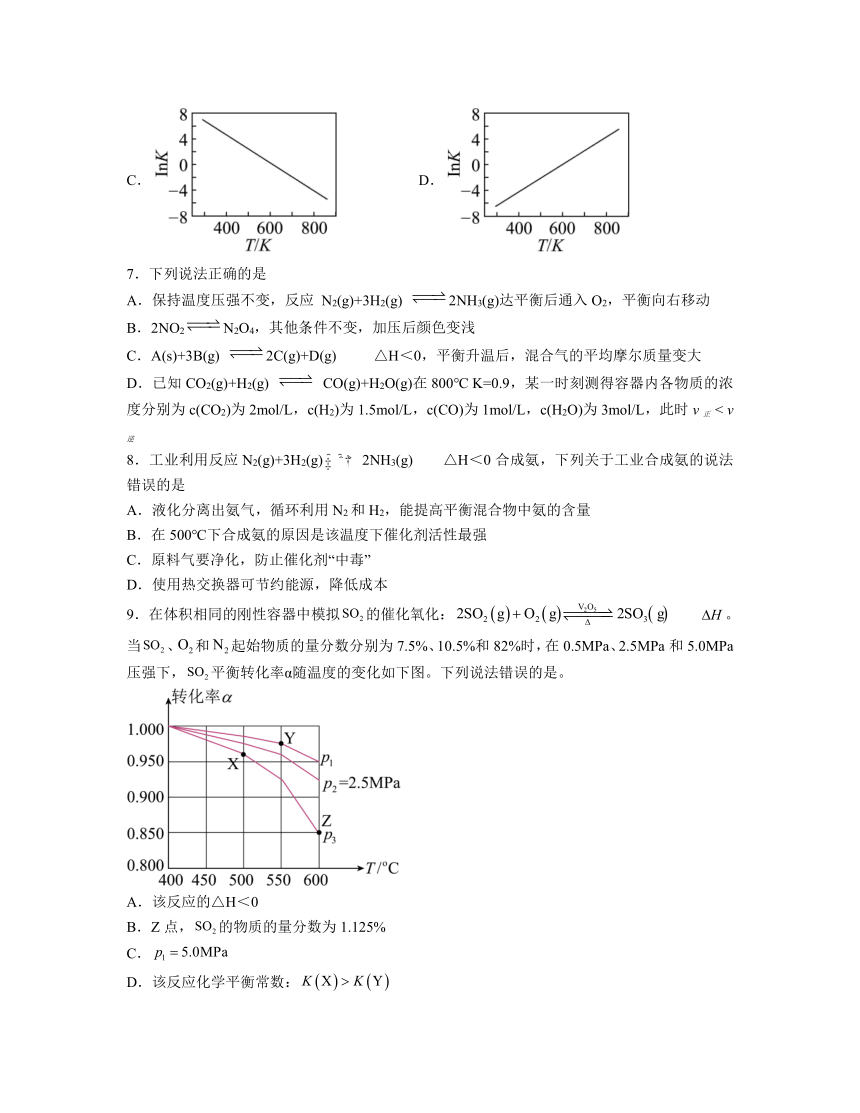
9.在体积相同的刚性容器中模拟的催化氧化: 。当、和起始物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,平衡转化率α随温度的变化如下图。下列说法错误的是。
A.该反应的△H<0
B.Z点,的物质的量分数为1.125%
C.
D.该反应化学平衡常数:
10.℃时,向图1中带隔板的密闭容器两侧各充入1 mol H2(g)与1 mol I2(g),抽出隔板发生反应:(△H绝对值很小,以下简称“该反应”),反应过程中自由能G(由体系的焓、熵与温度共同决定:△G=△H-T△S)随体系中氢气的体积分数x(H2)变化的示意图如图2所示,其中P点为曲线最低点。则下列说法中错误的是
A.自由能G由M下降到N是抽出隔板时H2(g)与I2(g)混合造成的
B.t℃时,在P点该反应达到进行的限度
C.由R点→P点过程中△G<0,故该反应在Q点满足:
D.若t℃时该反应的平衡常数值为64,则x‘=0.1
11.中国首条“生态马路”在上海复兴路隧道建成,它运用了“光触媒”技术,在路面涂上一种光催化剂涂料,可将汽车尾气中45%的NO和CO转化成和:,下列对此反应的叙述中正确的是
A.降低温度,有效碰撞频率降低,不利于该反应的正向进行
B.增大压强能使该反应的化学平衡常数K增大
C.NO和CO分子间只要有合理取向的碰撞就能发生化学反应
D.使用光催化剂能降低反应的活化能,增大活化分子的百分数
12.在催化剂条件下可被还原为无害物质,反应为: 。下列说法正确的是
A.上述反应
B.上述反应平衡常数
C.上述反应中生成,转移电子的数目为
D.上述反应中,充入水蒸气增大压强可以提高平衡转化率
13.当可逆反应2SO2(g)+O2(g)2SO3(g)达平衡后,通入18O2气体再次达到平衡时18O存在于
A.SO3中 B.O2中 C.SO2、O2、SO3中 D.O2、SO3中
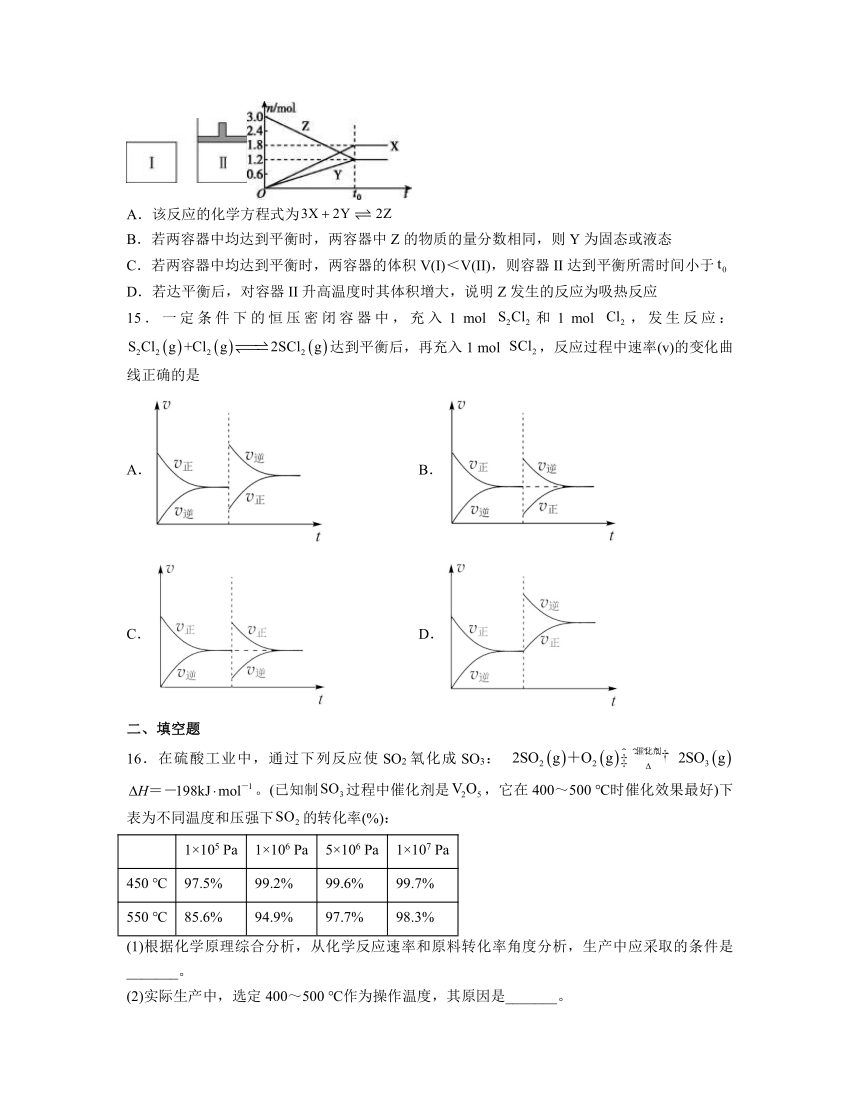
14.在一定温度下,将等量的气体分别通入起始体积相同的密闭容器I和II中,使其发生反应,时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是
A.该反应的化学方程式为
B.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
C.若两容器中均达到平衡时,两容器的体积V(I)<V(II),则容器II达到平衡所需时间小于
D.若达平衡后,对容器II升高温度时其体积增大,说明Z发生的反应为吸热反应
15.一定条件下的恒压密闭容器中,充入1 mol 和1 mol ,发生反应:达到平衡后,再充入1 mol ,反应过程中速率(v)的变化曲线正确的是
A. B.
C. D.
二、填空题
16.在硫酸工业中,通过下列反应使SO2氧化成SO3: 。(已知制过程中催化剂是,它在400~500 ℃时催化效果最好)下表为不同温度和压强下的转化率(%):
1×105 Pa 1×106 Pa 5×106 Pa 1×107 Pa
450 ℃ 97.5% 99.2% 99.6% 99.7%
550 ℃ 85.6% 94.9% 97.7% 98.3%
(1)根据化学原理综合分析,从化学反应速率和原料转化率角度分析,生产中应采取的条件是_______。
(2)实际生产中,选定400~500 ℃作为操作温度,其原因是_______。
(3)实际生产中,采用的压强为1×105 Pa,其原因是_______。
(4)在生产中,通入过量空气的目的是_______。
(5)尾气中有SO2必须回收是为了_______。
17.某可逆反应在某体积为5L的密闭容器中进行,在从0﹣3分钟各物质的量的变化情况如图所示(A、B、C均为气体):
(1)该反应的化学方程式为______________;
(2)反应开始至2分钟时,A的平均反应速率为___________.
(3)不能说明该反应已达到平衡状态的是____________.
a.v逆(A)=v正(B)b.容器内压强保持不变
c.v(A)=2v(B)d.容器内混合气体的密度保持不变
(4)由如图求得A的平衡时的转化率为______.
(5)在密闭容器里,通入amolA(g)、bmolB(g)、cmolC(g),发生上述反应,当改变条件时,反应速率会减小的是_____(填序号)。
①增大容器体积②加入催化剂③降低温度
18.在80℃时,将0.4mol的N2O4气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
c(mol/L)时间(s) 0 20 40 60 80 100
c(N2O4) 0.20 a 0.10 c d e
c(NO2) 0.00 0.12 b 0.22 0.22 0.22
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为___________,该反应的 H___________0(填“<”、“=”、“>”)。
(2)20s时,N2O4的的浓度为___________mol·L-1,0~20s内N2O4的平均反应速率为___________;
(3)该反应的平衡常数表达式K=___________,在80℃时该反应的平衡常数K值为:___________(保留到小数点后2位)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时___________。
a.N2O4的转化率越高 b.NO2的产量越大
c.N2O4与NO2的浓度之比越大 d.正反应进行的程度越大
三、计算题
19.研究NOx之间的转化具有重要意义。已知:N2O4(g) 2NO2(g) ΔH>0 将一定量N2O4气体充入恒容的密闭容器中,控制反应温度为T1。t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为75%,则反应N2O4(g) 2NO2(g)的平衡常数Kp=_______(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
20.二氧化氮在火箭燃料中可用作氧化剂,在亚硝基法生严流酸甲可用作催化剂,但直接将二氧化氮排放会造成环境污染。已知反应CH4(g) +2NO2(g)N2(g) +CO2(g) + 2H2O(g),起始时向体积为V的恒容密闭容器中通入2mol CH4和3mol NO2,测得CH4.、N2、H2O的物质的量浓度与时间的关系如图所示。
(1)容器体积V=_______L。
(2)图中表示H2O的物质的量浓度与时间关系的是曲线___________. (填“甲”“乙"或"丙")。
(3)0 ~5min内,用N2表示的化学反应速率为____________________mol·L-1·min-1。
(4)a、b、c三点中达到平衡的点是______。达到平衡时,NO2的转化率是___________(物质平衡转化=转化的物质的量/起始的物质的量×100%)。
(5)a点时,c(CO2) =__________mol·L-1(保留两位小数),n( CH4):n(NO2) =_________________。
四、实验题
21.无色碘化钾溶液露置在空气中容易变为黄色,某兴趣小组进行如下实验探究。
实验试剂:1mol·L-1 KI溶液、0.2mol·L-1 H2SO4溶液、蒸馏水
实验仪器:试管、试剂瓶、胶头滴管、温度计
I.针对冬夏季节不同,KI溶液变色快慢不同,小组成员进行以下实验:
实验编号 ① ② ③ ④ ⑤
温度/℃ 30 40 50 60 70
显色时间/s 160 80 40 20 10
回答下列问题:
(1)该实验的目的是探究________ 对反应速率的影响。
(2)该实验除上述试剂和仪器外,还需要的仪器是_____,试剂是_____。
(3)分析上述实验记录结果,可得出的结论是:温度每升高10℃,反应速率增大为原来的______倍。
Ⅱ.为探究溶液的酸性强弱对KI溶液变色速率的影响,小组成员进行以下实验:
第①步:分别取1mL 1mol·L﹣1 KI溶液于两支试管中,并分别滴加两滴指示剂;
第②步:向其中一支试管中加入1mL蒸馏水和1mL 0.2mol·L-1 H2SO4溶液,同时在另一支试管中加入………………;
第③步:记录KI溶液变色的时间。
实验结论:溶液酸性越强,KI溶液变色越快。
回答下列问题:
(4)该探究实验中KI溶液变色反应的离子方程式为_________________ 。
(5)该实验操作中必须控制不变的是____________。
a.温度 b.试剂添加的顺序 c.试剂的用量(体积)
(6)用所给试剂将第②步补充完整。___________________________ 。
【参考答案】
一、选择题
1.C
解析:A.根据转化率与温度的图像,平衡后,温度升高,的转化率下降,说明升温平衡左移,则正反应放热、△H<0,A不正确;
B.a点没有达到平衡状态,延长反应时间使消耗的量增多,导致转化率提高,B不正确;
C.设与物质的量分别为2mol、1mol,发生反应,设消耗甲烷x mol,生成x mol,由化学方程式知反应前后气体总物质的量之和不变、为3mol,同温同压下不同气体的体积分数等于其物质的量分数,的体积分数为15%,即,得x=4.5,则甲烷的转化率,C正确;
D.从图像看出,生产,并不是温度越高越好,D不正确;
选C。
2.C
解析:A.在时,,则,,故,A项错误;
B.在时,氨的转化率下降,降低温度平衡正向移动,增大,B项错误;
C.在下,平衡时,则,根据化学方程式,列三段式可得:
在容器体积不变条件下,压强比=物质的量之比,故,C项正确;
D.a、b、c三点正反应速率逐渐减小,d点采取措施可能是加压、升温或者增大的浓度,上述条件均可以使正反应速率增大,故正确顺序为,D项错误。
故选C。
3.B
解析:A.该反应是气体体积减小,增大容器的容积,压强减小,平衡向逆反应方向进行,COCl2产率降低,故A不符合题意;
B.根据图象,制备光气的反应属于放热反应,降低温度,平衡向正反应方向进行,COCl2产率增大,故B符合题意;
C.分离出CO,减少反应物的浓度,平衡逆向进行,COCl2产率降低,故C不符合题意;
D.等容下,通入惰性气体,组分浓度不变,反应速率不变,平衡不移动,故D不符合题意;
答案为B。
4.A
【分析】由题意列出三段式:
解析:A.2min末CO的反应速率为=0.1,A正确;
B.2min内C的反应速率为=0.05,且B项单位错误,B错误;
C.2min末CO2的浓度为==0.4,C错误;
D.2min内CO2的转化率为=20%,D错误;
故答案选A。
5.B
解析:A.高锰酸钾溶液与草酸反应是放热反应,所以刚开始反应缓慢,随着反应的进行,温度升高,且生成的锰离子其催化作用,所以反应迅速加快,不能用勒夏特列原理解释,故A错误;
B.氯气中溶液中存在,在饱和食盐水中,氯离子浓度大,平衡左移、抑制了氯气的溶解,所以能够用勒夏特列原理解释,故B正确;
C.该反应正反应为放热反应,采用500℃的高温,利有用平衡向逆反应进行,反应物转化率与产物的产率降低,选择500℃主要考虑反应速率与催化剂活性,不能用勒夏特列原理解释,故C错误;
D.棕黄色氯化铁溶液加铁粉后生成浅绿色的氯化亚铁、故颜色变浅,不能用勒夏特列原理解释,故D错误。
故选B。
6.A
解析:合成氨的反应是放热反应,升高温度,平衡向左移动,平衡常数变小,B、D错误,对K求对数不是直线,C错误,故A项正确。
7.D
解析:A.恒温恒压下,达到平衡时,充入氧气,氧气不参与反应,容器体积增大,组分浓度减小,根据勒夏特列原理,平衡向左移动,故A错误;
B.其他条件不变,加压,缩小容器体积,加压瞬间,组分浓度变大,气体颜色加深,根据勒夏特列原理,平衡向正反应方向移动,气体颜色变浅,但比原平衡颜色深,故B错误;
C.根据,该反应为放热反应,升温后,平衡向逆反应反应进行,A为固体,气体总质量减小,气体总物质的量不变,因此混合气体平均摩尔质量减小,故C错误;
D.某时刻Qc==1>K,平衡向逆反应方向进行,即v正<v逆,故D正确;
答案为D。
8.A
解析:A.循环利用和只能提高和的转化率,并不能提高平衡混合物中氨的含量,项错误;
B.500℃催化剂活性最强,B项正确;
C.为防止混有的杂质导致催化剂“中毒”,原料气需净化,C项正确;
D.热交换器能利用反应放出的热量,节约能源,D项正确。
故答案为:A。
9.B
解析:A.由图可知,随着温度升高转化率降低,平衡逆向移动,则该反应为放热反应,△H<0,A正确;
B.设、和起始物质的量分别为7.5mol、10.5 mol和82 mol,Z点时平衡转化率为0.85,则平衡时、和起始物质的量分别为1.125mol、7.3125 mol和88.375 mol,此时的物质的量分数为1.162%,B错误;
C.温度相同时压强越高,二氧化硫的转化率越高,故P1的压强最高,即P1MPa,C正确;
D.该反应为放热反应,温度越高,平衡常数越小,故平衡常数,D正确;
故选B。
10.C
解析:A.由于图二中M、N横坐标相同,可知此时反应并未发生,故自由能G减小是由体系熵增引起的,A正确;
B.化学反应总是向着体系的自由能减小的方向进行,直到体系达到平衡,B正确;
C.R→P过程中,x(H2)增大,给定的是可逆反应的化学平衡逆向移动,故正、逆反应速率之比,C错误;
D.根据化学平衡常数的含义可知该反应的化学平衡常数K==64,解得x’=0.1,D正确;
故合理选项是C。
11.D
解析:A.反应是放热反应,降低温度反应向正方向移动,A错误;
B.K值与温度有关,压强不影响K值,B错误;
C.有效碰撞的前提是具有一定的能量,C错误;
D.使用光催化剂能降低反应的活化能,增大活化分子的百分数,D正确;
故选D。
12.B
解析:A.由方程式可知,该反应是一个气体分子数减小的反应,即熵减的反应,反应,故A错误;
B.由方程式可知,反应平衡常数,故B正确;
C.由方程式可知,生成时,转移电子的数目为,故C错误;
D.充入水蒸气会增大水蒸气浓度,平衡逆向移动,NO转化率减小,故D错误;
故答案为:B。
13.C
解析:可逆反应是在一定条件下既能向正反应方向进行又可以向负反应方向进行。反应达到平衡再通入通入18O2气体时,化学平衡向正向移动,生成的SO3中存在18O,但是同时SO3通过分解反应,故18O会存在于SO2、O2中,综上所述,答案选C。
14.B
解析:A.由图可知,X、Y的物质的量增大,为生成物,Z的物质的量减小,为反应物。达到平衡时,X生成1.8mol,Y生成1.2mol,Z反应3.0-1.2=1.8mol,可知X、Y、Z的化学计量数之比为,则反应的化学方程式为,A错误;
B.若两容器中均达到平衡时,Z的物质的量分数相同,说明达到相同的平衡状态,所以反应是前后气体体积不变的反应,则Y为固态或液态,B正确;
C.反应的化学方程式为,若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡的过程是体积增大、压强不变的过程,达到平衡所需时间大于,C错误;
D.容器Ⅱ是恒压容器,若达平衡后,升高温度时其体积增大,不能说明平衡正向进行,Z发生的反应不一定为吸热反应,故D错误。
故选B。
15.B
解析:恒压密闭容器中反应达到平衡后,再充入1 mol SCl2,体积增大到2倍,反应物浓度减小为1/2,正反应速率减小,SCl2浓度不变,逆反应速率增大;新平衡和旧平衡互为等效平衡,各物质的物质的量浓度相等,故新、旧反应速率相等,B正确;
故选B。
二、填空题
16.(1)450 ℃、常压、催化剂
(2)在此温度下催化剂的活性最高
(3)在常压下,的转化率达到97.5%,已经很高了,增大压强虽然平衡向右移动,但对的转化率影响不大,且高压下对设备的要求更高,成本高,得不偿失;
(4)增大了反应物氧气的浓度,提高了的转化率;
(5)防止污染环境
解析:(1)根据表中数据,在450 ℃时,1×105 Pa(常压)下,的转化率达到97.5%,已经很高了,增大压强和温度,对设备的要求更高,成本高,且该反应为放热反应,升高温度,不利于的转化,且催化剂,它在400~500 ℃时催化效果最好,所以生产中应采取的条件是450 ℃、常压、催化剂,故填450 ℃、常压、催化剂;
(2)根据题意,制过程中催化剂是,它在400~500 ℃时催化效果最好,即在此温度下催化剂的活性最高,故填在此温度下催化剂的活性最高;
(3)根据表中数据分析,在常压下,的转化率达到97.5%,已经很高了,增大压强虽然平衡向右移动,但对的转化率影响不大,且高压下对设备的要求更高,成本高,得不偿失,故填在常压下,的转化率达到97.5%,已经很高了,增大压强虽然平衡向右移动,但对的转化率影响不大,且高压下对设备的要求更高,成本高,得不偿失;
(4)对于反应,通入过量的空气,增大了反应物氧气的浓度,该平衡向正向移动, 提高了的转化率,故填增大了反应物氧气的浓度,提高了的转化率;
(5)是空气污染物,不能随意排放,所以尾气中有必须回收是为了防止污染环境,故填防止污染环境。
17. 2A+B2C 0.2mol/(L·min) acd 40% ①③
解析:(1)据图可知A、B的物质的量减小,C的物质的量增大,则A、B为反应物,C为生成物,最终三种物质共存说明为可逆反应,2min时Δn(A):Δn(B):Δn(C)=2mol:1mol:2mol=2:1:2,则反应方程式三种物质的计量数之比为2:1:2,则反应的化学方程式为2A+B2C;
(2)据图可知反应开始至2min时,Δn(A)=2mol,容器体积为5L,所以A的平均反应速率为=0.2mol/(L·min);
(3)a.若v逆(A)=v正(B),则2v逆(B)=v正(B),正逆反应速率不相等,反应未平衡,故a符合题意;
b.该反应前后气体系数之和不相等,所以未平衡时气体总物质的量会发生变化,容器恒容,则压强会变,当压强不变时说明反应平衡,故b不符合题意;
c.反应平衡时正逆反应速率相等,但选项未注明是正反应速率还是逆反应速率,不能说明反应平衡,故c符合题意;
d.反应物和生成物均为气体,则气体的总质量不变,容器恒容,所以密度一直为定值,密度不变不能说明反应平衡,故d符合题意;
综上所述答案为acd;
(4)据图可知A的初始投料为5mol,2min后各物质的物质的量不再改变反应达到平衡,平衡时Δn(A)=2mol,所以A的平衡转化率为=40%;
(5)①增大容器体积各物质的浓度减小,反应速率减慢,故①符合题意;
②催化剂一般可以增大反应速率,故②不符合题意;
③降低温度,活化分子百分数减少,反应速率减慢,故③符合题意;
综上所述答案为①③。
18. (1) N2O42NO2 >
(2) 0.14 0.003mol/(L·s)
(3) 0.54
(4)abd
解析: (1)N2O4转化为NO2反应的化学方程式为:N2O4 2NO2,反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅,说明反应逆向进行,逆向是放热反应,正向是吸热反应, H>0。
(2)20s时,c(NO2)= 0.12mol/L,则c(N2O4)= 0.06mol/L ,则20s时,N2O4的的浓度为0.20mol/L -0.06mol/L =0.14mol/L;0~20s内N2O4的平均反应速率。
(3)该反应的方程式为N2O4 2NO2,则平衡常数表达式;
80°C平衡状态和60s是相同的平衡状态,平衡浓度c(NO2)=0.22mol/L,c(N2O4)=0.09mol/L,则平衡常数。
(4)化学平衡常数是指反应达到平衡时,反应物浓度幂之积与生成物浓度幂之积的比值,故在其他条件相同时,该反应的K值越大,表明建立平衡时N2O4的转化率越高,正反应进行的程度越大,NO2的产量越大,N2O4与NO2的浓度之比越小,故选abd。
三、计算题
19.p
解析:设起始N2O4的物质的量为1mol,N2O4气体的平衡转化率为75%,则N2O4的转化量为0.75mol,列三段式:
由三段式数据可知,N2O4的平衡分压为×p=,NO2的平衡分压为×p=,则平衡常数Kp==。
20.甲 0.1 c 80% 或0.8 0.33 4:5
【分析】依据图象,根据反应物、生成物反应前后物质的量变化之比等于物质的量之比确定甲、乙、丙三条曲线分别代表CH4.、N2、H2O中的哪种物质;依据单位时间内浓度的变化,计算出0 ~5min内,用N2表示的化学反应速率;达到平衡时的判断依据。
解析:(1)起始时向体积为V的恒容密闭容器中通入2 mol CH4和3 mol NO2,测得CH4.、N2、H2O的物质的量浓度与时间的关系如图所示,CH4是反应物,即起始时的物质的量浓度为1.0mol·L-1,依据c=,得V===2L;
(2)由(1)可知,丙代表CH4,从开始到平衡时,甲代表的物质的物质的量浓度增加量:1.2mol·L-1,乙代表的物质的物质的量浓度增加量:0.6mol·L-1,故从开始到平衡时,甲代表的物质的物质的量浓度增加量:1.2mol·L-1×2L=2.4mol;故从开始到平衡时,乙代表的物质的物质的量浓度增加量:0.6mol·L-1×2L=1.2mol,根据反应物、生成物反应前后物质的量变化之比等于物质的量之比,故甲代表H2O的物质的量浓度与时间关系,乙代表N2的物质的量浓度与时间关系;
(3)乙代表N2的物质的量浓度与时间关系,0 ~5 min内,N2的物质的量浓度变化量为:0.5mol·L-1 - 0=0.5mol·L-1,v(N2)==0.1mol·L-1·min -1;
(4)当达到平衡时反应物、生成物的浓度不再随着时间的变化而变化,故a、b、c三点中达到平衡的点是c;达到平衡时,c(N2)=0.6mol·L-1,即从开始平衡,N2的物质的量增加了:0.6mol·L-1×2L=1.2mol,CH4(g) +2NO2(g)N2(g) +CO2(g) + 2H2O(g) ,依据方程式中反应物、生成物的物质的量的变化量之比等于化学计量数之比,即从开始到平衡,NO2的物质的量变化量为:1.2mol×2=2.4mol,故达到平衡时, NO2的转化率是 =80%;
(5)设a点时的浓度为xmol·L-1,CH4(g) +2NO2(g)N2(g) +CO2(g) + 2H2O(g) ,依据方程式中反应物、生成物的物质的量的变化量之比等于化学计量数之比,(1.0-x):x=1:2,x=0.67,=0.67mol·L-1×2L=1.34mol,=1:2:1:1:2,a点时,=0.67mol,c(CO2) ==0.33mol·L-1;=0.67mol,=1.34mol,故a点时,n( CH4):n(NO2)=(2mol-0.67mol):(3mol-1.34mol)=4:5。
四、实验题
21. 温度 秒表 淀粉溶液 2 4I﹣+4H++O2=2I2+2H2O abc 2mL 0.2mol·L-1 H2SO4溶液
【分析】I.该实验探究其他条件相同时,温度对反应速率的影响,由表格数据可知,温度每升高10℃,反应速率增大为原来的2倍;
Ⅱ.该实验探究温度不变时, 溶液的酸性强弱对KI溶液变色速率的影响,由实验设计可知,溶液酸性越强,KI溶液变色越快。
解析:(1)由题意可知,该实验探究其他条件相同时,温度对反应速率的影响,故答案为:温度;
(2)碘化钾溶液被空气中氧气氧化生成单质碘,单质碘遇淀粉溶液变蓝色,由题给实验试剂和实验仪器可知,实验时,还缺少测定显色时间所用的仪器秒表和显色反应快慢的试剂淀粉溶液,故答案为:秒表;淀粉溶液;
(3) 由题意可知,碘化钾溶液变色的反应为酸性条件下,碘离子与氧气反应生成单质碘和水,反应的离子方程式为4I﹣+4H++O2=2I2+2H2O,故答案为:4I﹣+4H++O2=2I2+2H2O;
(4) 该实验探究温度不变时, 溶液的酸性强弱对KI溶液变色速率的影响,由变量唯一化可知,实验操作中必须控制温度、试剂的用量(体积)和试剂添加的顺序保持不变,故答案为:abc;
(5) 由变量唯一化可知,实验时应保证其他条件不变,在溶液总体积不变的条件下,通过加入蒸馏水改变0.2mol·L-1 H2SO4溶液溶液中的氢离子浓度,则实验时,应向其中一支试管中加入1mL蒸馏水和1mL 0.2mol·L-1 H2SO4溶液,同时在另一支试管中加入2mL 0.2mol·L-1 H2SO4溶液,故答案为:2mL 0.2mol·L-1 H2SO4溶液。
一、选择题
1.工业上可以利用硫()与为原料制备,受热分解成气态,发生反应: △H。一定条件下,与反应中的转化率、分解产生的体积分数随温度的变化曲线如图所示。
下列说法正确的是
A.△H>0
B.图中a点所示条件下,延长反应时间不能提高转化率
C.在恒温密闭容器中,与按物质的量之比为2:1投料,当的体积分数为15%时,的转化率为45%(该温度下,完全分解成气态。)
D.工业上生产,温度越高越好
2.氨在催化剂作用下发生反应:。若在时,向密闭容器中充入和,测得氨的转化率随时间变化如图所示。下列说法正确的是
A.在内 B.d点时改变的条件可能是降温、加压
C.时,平衡时容器压强是反应前的倍 D.正反应的速率:
3.下图是光气在不同温度下的分解图象。光气,又称碳酰氯,化学式为,是一种重要的有机中间体,在农药、当今医药、工程塑料、聚氨酯材料以及军事上都有许多用途。制备光气的反应,下列各项措施中,能提高光气的产率是
A.增大容器容积 B.适当降低反应温度
C.分离出部分CO D.等容下通入惰性气体
4.在2L密闭容器中,一定条件下,足量碳与1molCO2发生反应:,反应2min后测得CO的物质的量为0.4mol。下列计算结果正确的是
A.2min末CO的反应速率为0.1
B.2min内C的反应速率为0.1
C.2min末CO2的浓度为0.3
D.2min内CO2的转化率为40%
5.下列事实可以用勒夏特列原理解释的是
A.高锰酸钾溶液与草酸发生化学反应刚开始缓慢,随后反应迅速加快
B.实验室采用排饱和食盐水的方法收集氯气
C.左右的温度比室温更有利于合成氮反应
D.氯化铁溶液加铁粉后颜色变浅
6.图中可以示意合成氨反应的平衡常数K随温度T变化趋势的是
A. B.
C. D.
7.下列说法正确的是
A.保持温度压强不变,反应 N2(g)+3H2(g) 2NH3(g)达平衡后通入O2,平衡向右移动
B.2NO2N2O4,其他条件不变,加压后颜色变浅
C.A(s)+3B(g) 2C(g)+D(g) △H<0,平衡升温后,混合气的平均摩尔质量变大
D.已知CO2(g)+H2(g) CO(g)+H2O(g)在800℃ K=0.9,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol/L,c(H2)为1.5mol/L,c(CO)为1mol/L,c(H2O)为3mol/L,此时v正 < v逆
8.工业利用反应N2(g)+3H2(g)2NH3(g) △H<0合成氨,下列关于工业合成氨的说法错误的是
A.液化分离出氨气,循环利用N2和H2,能提高平衡混合物中氨的含量
B.在500℃下合成氨的原因是该温度下催化剂活性最强
C.原料气要净化,防止催化剂“中毒”
D.使用热交换器可节约能源,降低成本
9.在体积相同的刚性容器中模拟的催化氧化: 。当、和起始物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,平衡转化率α随温度的变化如下图。下列说法错误的是。
A.该反应的△H<0
B.Z点,的物质的量分数为1.125%
C.
D.该反应化学平衡常数:
10.℃时,向图1中带隔板的密闭容器两侧各充入1 mol H2(g)与1 mol I2(g),抽出隔板发生反应:(△H绝对值很小,以下简称“该反应”),反应过程中自由能G(由体系的焓、熵与温度共同决定:△G=△H-T△S)随体系中氢气的体积分数x(H2)变化的示意图如图2所示,其中P点为曲线最低点。则下列说法中错误的是
A.自由能G由M下降到N是抽出隔板时H2(g)与I2(g)混合造成的
B.t℃时,在P点该反应达到进行的限度
C.由R点→P点过程中△G<0,故该反应在Q点满足:
D.若t℃时该反应的平衡常数值为64,则x‘=0.1
11.中国首条“生态马路”在上海复兴路隧道建成,它运用了“光触媒”技术,在路面涂上一种光催化剂涂料,可将汽车尾气中45%的NO和CO转化成和:,下列对此反应的叙述中正确的是
A.降低温度,有效碰撞频率降低,不利于该反应的正向进行
B.增大压强能使该反应的化学平衡常数K增大
C.NO和CO分子间只要有合理取向的碰撞就能发生化学反应
D.使用光催化剂能降低反应的活化能,增大活化分子的百分数
12.在催化剂条件下可被还原为无害物质,反应为: 。下列说法正确的是
A.上述反应
B.上述反应平衡常数
C.上述反应中生成,转移电子的数目为
D.上述反应中,充入水蒸气增大压强可以提高平衡转化率
13.当可逆反应2SO2(g)+O2(g)2SO3(g)达平衡后,通入18O2气体再次达到平衡时18O存在于
A.SO3中 B.O2中 C.SO2、O2、SO3中 D.O2、SO3中
14.在一定温度下,将等量的气体分别通入起始体积相同的密闭容器I和II中,使其发生反应,时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是
A.该反应的化学方程式为
B.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
C.若两容器中均达到平衡时,两容器的体积V(I)<V(II),则容器II达到平衡所需时间小于
D.若达平衡后,对容器II升高温度时其体积增大,说明Z发生的反应为吸热反应
15.一定条件下的恒压密闭容器中,充入1 mol 和1 mol ,发生反应:达到平衡后,再充入1 mol ,反应过程中速率(v)的变化曲线正确的是
A. B.
C. D.
二、填空题
16.在硫酸工业中,通过下列反应使SO2氧化成SO3: 。(已知制过程中催化剂是,它在400~500 ℃时催化效果最好)下表为不同温度和压强下的转化率(%):
1×105 Pa 1×106 Pa 5×106 Pa 1×107 Pa
450 ℃ 97.5% 99.2% 99.6% 99.7%
550 ℃ 85.6% 94.9% 97.7% 98.3%
(1)根据化学原理综合分析,从化学反应速率和原料转化率角度分析,生产中应采取的条件是_______。
(2)实际生产中,选定400~500 ℃作为操作温度,其原因是_______。
(3)实际生产中,采用的压强为1×105 Pa,其原因是_______。
(4)在生产中,通入过量空气的目的是_______。
(5)尾气中有SO2必须回收是为了_______。
17.某可逆反应在某体积为5L的密闭容器中进行,在从0﹣3分钟各物质的量的变化情况如图所示(A、B、C均为气体):
(1)该反应的化学方程式为______________;
(2)反应开始至2分钟时,A的平均反应速率为___________.
(3)不能说明该反应已达到平衡状态的是____________.
a.v逆(A)=v正(B)b.容器内压强保持不变
c.v(A)=2v(B)d.容器内混合气体的密度保持不变
(4)由如图求得A的平衡时的转化率为______.
(5)在密闭容器里,通入amolA(g)、bmolB(g)、cmolC(g),发生上述反应,当改变条件时,反应速率会减小的是_____(填序号)。
①增大容器体积②加入催化剂③降低温度
18.在80℃时,将0.4mol的N2O4气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
c(mol/L)时间(s) 0 20 40 60 80 100
c(N2O4) 0.20 a 0.10 c d e
c(NO2) 0.00 0.12 b 0.22 0.22 0.22
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为___________,该反应的 H___________0(填“<”、“=”、“>”)。
(2)20s时,N2O4的的浓度为___________mol·L-1,0~20s内N2O4的平均反应速率为___________;
(3)该反应的平衡常数表达式K=___________,在80℃时该反应的平衡常数K值为:___________(保留到小数点后2位)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时___________。
a.N2O4的转化率越高 b.NO2的产量越大
c.N2O4与NO2的浓度之比越大 d.正反应进行的程度越大
三、计算题
19.研究NOx之间的转化具有重要意义。已知:N2O4(g) 2NO2(g) ΔH>0 将一定量N2O4气体充入恒容的密闭容器中,控制反应温度为T1。t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为75%,则反应N2O4(g) 2NO2(g)的平衡常数Kp=_______(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
20.二氧化氮在火箭燃料中可用作氧化剂,在亚硝基法生严流酸甲可用作催化剂,但直接将二氧化氮排放会造成环境污染。已知反应CH4(g) +2NO2(g)N2(g) +CO2(g) + 2H2O(g),起始时向体积为V的恒容密闭容器中通入2mol CH4和3mol NO2,测得CH4.、N2、H2O的物质的量浓度与时间的关系如图所示。
(1)容器体积V=_______L。
(2)图中表示H2O的物质的量浓度与时间关系的是曲线___________. (填“甲”“乙"或"丙")。
(3)0 ~5min内,用N2表示的化学反应速率为____________________mol·L-1·min-1。
(4)a、b、c三点中达到平衡的点是______。达到平衡时,NO2的转化率是___________(物质平衡转化=转化的物质的量/起始的物质的量×100%)。
(5)a点时,c(CO2) =__________mol·L-1(保留两位小数),n( CH4):n(NO2) =_________________。
四、实验题
21.无色碘化钾溶液露置在空气中容易变为黄色,某兴趣小组进行如下实验探究。
实验试剂:1mol·L-1 KI溶液、0.2mol·L-1 H2SO4溶液、蒸馏水
实验仪器:试管、试剂瓶、胶头滴管、温度计
I.针对冬夏季节不同,KI溶液变色快慢不同,小组成员进行以下实验:
实验编号 ① ② ③ ④ ⑤
温度/℃ 30 40 50 60 70
显色时间/s 160 80 40 20 10
回答下列问题:
(1)该实验的目的是探究________ 对反应速率的影响。
(2)该实验除上述试剂和仪器外,还需要的仪器是_____,试剂是_____。
(3)分析上述实验记录结果,可得出的结论是:温度每升高10℃,反应速率增大为原来的______倍。
Ⅱ.为探究溶液的酸性强弱对KI溶液变色速率的影响,小组成员进行以下实验:
第①步:分别取1mL 1mol·L﹣1 KI溶液于两支试管中,并分别滴加两滴指示剂;
第②步:向其中一支试管中加入1mL蒸馏水和1mL 0.2mol·L-1 H2SO4溶液,同时在另一支试管中加入………………;
第③步:记录KI溶液变色的时间。
实验结论:溶液酸性越强,KI溶液变色越快。
回答下列问题:
(4)该探究实验中KI溶液变色反应的离子方程式为_________________ 。
(5)该实验操作中必须控制不变的是____________。
a.温度 b.试剂添加的顺序 c.试剂的用量(体积)
(6)用所给试剂将第②步补充完整。___________________________ 。
【参考答案】
一、选择题
1.C
解析:A.根据转化率与温度的图像,平衡后,温度升高,的转化率下降,说明升温平衡左移,则正反应放热、△H<0,A不正确;
B.a点没有达到平衡状态,延长反应时间使消耗的量增多,导致转化率提高,B不正确;
C.设与物质的量分别为2mol、1mol,发生反应,设消耗甲烷x mol,生成x mol,由化学方程式知反应前后气体总物质的量之和不变、为3mol,同温同压下不同气体的体积分数等于其物质的量分数,的体积分数为15%,即,得x=4.5,则甲烷的转化率,C正确;
D.从图像看出,生产,并不是温度越高越好,D不正确;
选C。
2.C
解析:A.在时,,则,,故,A项错误;
B.在时,氨的转化率下降,降低温度平衡正向移动,增大,B项错误;
C.在下,平衡时,则,根据化学方程式,列三段式可得:
在容器体积不变条件下,压强比=物质的量之比,故,C项正确;
D.a、b、c三点正反应速率逐渐减小,d点采取措施可能是加压、升温或者增大的浓度,上述条件均可以使正反应速率增大,故正确顺序为,D项错误。
故选C。
3.B
解析:A.该反应是气体体积减小,增大容器的容积,压强减小,平衡向逆反应方向进行,COCl2产率降低,故A不符合题意;
B.根据图象,制备光气的反应属于放热反应,降低温度,平衡向正反应方向进行,COCl2产率增大,故B符合题意;
C.分离出CO,减少反应物的浓度,平衡逆向进行,COCl2产率降低,故C不符合题意;
D.等容下,通入惰性气体,组分浓度不变,反应速率不变,平衡不移动,故D不符合题意;
答案为B。
4.A
【分析】由题意列出三段式:
解析:A.2min末CO的反应速率为=0.1,A正确;
B.2min内C的反应速率为=0.05,且B项单位错误,B错误;
C.2min末CO2的浓度为==0.4,C错误;
D.2min内CO2的转化率为=20%,D错误;
故答案选A。
5.B
解析:A.高锰酸钾溶液与草酸反应是放热反应,所以刚开始反应缓慢,随着反应的进行,温度升高,且生成的锰离子其催化作用,所以反应迅速加快,不能用勒夏特列原理解释,故A错误;
B.氯气中溶液中存在,在饱和食盐水中,氯离子浓度大,平衡左移、抑制了氯气的溶解,所以能够用勒夏特列原理解释,故B正确;
C.该反应正反应为放热反应,采用500℃的高温,利有用平衡向逆反应进行,反应物转化率与产物的产率降低,选择500℃主要考虑反应速率与催化剂活性,不能用勒夏特列原理解释,故C错误;
D.棕黄色氯化铁溶液加铁粉后生成浅绿色的氯化亚铁、故颜色变浅,不能用勒夏特列原理解释,故D错误。
故选B。
6.A
解析:合成氨的反应是放热反应,升高温度,平衡向左移动,平衡常数变小,B、D错误,对K求对数不是直线,C错误,故A项正确。
7.D
解析:A.恒温恒压下,达到平衡时,充入氧气,氧气不参与反应,容器体积增大,组分浓度减小,根据勒夏特列原理,平衡向左移动,故A错误;
B.其他条件不变,加压,缩小容器体积,加压瞬间,组分浓度变大,气体颜色加深,根据勒夏特列原理,平衡向正反应方向移动,气体颜色变浅,但比原平衡颜色深,故B错误;
C.根据,该反应为放热反应,升温后,平衡向逆反应反应进行,A为固体,气体总质量减小,气体总物质的量不变,因此混合气体平均摩尔质量减小,故C错误;
D.某时刻Qc==1>K,平衡向逆反应方向进行,即v正<v逆,故D正确;
答案为D。
8.A
解析:A.循环利用和只能提高和的转化率,并不能提高平衡混合物中氨的含量,项错误;
B.500℃催化剂活性最强,B项正确;
C.为防止混有的杂质导致催化剂“中毒”,原料气需净化,C项正确;
D.热交换器能利用反应放出的热量,节约能源,D项正确。
故答案为:A。
9.B
解析:A.由图可知,随着温度升高转化率降低,平衡逆向移动,则该反应为放热反应,△H<0,A正确;
B.设、和起始物质的量分别为7.5mol、10.5 mol和82 mol,Z点时平衡转化率为0.85,则平衡时、和起始物质的量分别为1.125mol、7.3125 mol和88.375 mol,此时的物质的量分数为1.162%,B错误;
C.温度相同时压强越高,二氧化硫的转化率越高,故P1的压强最高,即P1MPa,C正确;
D.该反应为放热反应,温度越高,平衡常数越小,故平衡常数,D正确;
故选B。
10.C
解析:A.由于图二中M、N横坐标相同,可知此时反应并未发生,故自由能G减小是由体系熵增引起的,A正确;
B.化学反应总是向着体系的自由能减小的方向进行,直到体系达到平衡,B正确;
C.R→P过程中,x(H2)增大,给定的是可逆反应的化学平衡逆向移动,故正、逆反应速率之比,C错误;
D.根据化学平衡常数的含义可知该反应的化学平衡常数K==64,解得x’=0.1,D正确;
故合理选项是C。
11.D
解析:A.反应是放热反应,降低温度反应向正方向移动,A错误;
B.K值与温度有关,压强不影响K值,B错误;
C.有效碰撞的前提是具有一定的能量,C错误;
D.使用光催化剂能降低反应的活化能,增大活化分子的百分数,D正确;
故选D。
12.B
解析:A.由方程式可知,该反应是一个气体分子数减小的反应,即熵减的反应,反应,故A错误;
B.由方程式可知,反应平衡常数,故B正确;
C.由方程式可知,生成时,转移电子的数目为,故C错误;
D.充入水蒸气会增大水蒸气浓度,平衡逆向移动,NO转化率减小,故D错误;
故答案为:B。
13.C
解析:可逆反应是在一定条件下既能向正反应方向进行又可以向负反应方向进行。反应达到平衡再通入通入18O2气体时,化学平衡向正向移动,生成的SO3中存在18O,但是同时SO3通过分解反应,故18O会存在于SO2、O2中,综上所述,答案选C。
14.B
解析:A.由图可知,X、Y的物质的量增大,为生成物,Z的物质的量减小,为反应物。达到平衡时,X生成1.8mol,Y生成1.2mol,Z反应3.0-1.2=1.8mol,可知X、Y、Z的化学计量数之比为,则反应的化学方程式为,A错误;
B.若两容器中均达到平衡时,Z的物质的量分数相同,说明达到相同的平衡状态,所以反应是前后气体体积不变的反应,则Y为固态或液态,B正确;
C.反应的化学方程式为,若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡的过程是体积增大、压强不变的过程,达到平衡所需时间大于,C错误;
D.容器Ⅱ是恒压容器,若达平衡后,升高温度时其体积增大,不能说明平衡正向进行,Z发生的反应不一定为吸热反应,故D错误。
故选B。
15.B
解析:恒压密闭容器中反应达到平衡后,再充入1 mol SCl2,体积增大到2倍,反应物浓度减小为1/2,正反应速率减小,SCl2浓度不变,逆反应速率增大;新平衡和旧平衡互为等效平衡,各物质的物质的量浓度相等,故新、旧反应速率相等,B正确;
故选B。
二、填空题
16.(1)450 ℃、常压、催化剂
(2)在此温度下催化剂的活性最高
(3)在常压下,的转化率达到97.5%,已经很高了,增大压强虽然平衡向右移动,但对的转化率影响不大,且高压下对设备的要求更高,成本高,得不偿失;
(4)增大了反应物氧气的浓度,提高了的转化率;
(5)防止污染环境
解析:(1)根据表中数据,在450 ℃时,1×105 Pa(常压)下,的转化率达到97.5%,已经很高了,增大压强和温度,对设备的要求更高,成本高,且该反应为放热反应,升高温度,不利于的转化,且催化剂,它在400~500 ℃时催化效果最好,所以生产中应采取的条件是450 ℃、常压、催化剂,故填450 ℃、常压、催化剂;
(2)根据题意,制过程中催化剂是,它在400~500 ℃时催化效果最好,即在此温度下催化剂的活性最高,故填在此温度下催化剂的活性最高;
(3)根据表中数据分析,在常压下,的转化率达到97.5%,已经很高了,增大压强虽然平衡向右移动,但对的转化率影响不大,且高压下对设备的要求更高,成本高,得不偿失,故填在常压下,的转化率达到97.5%,已经很高了,增大压强虽然平衡向右移动,但对的转化率影响不大,且高压下对设备的要求更高,成本高,得不偿失;
(4)对于反应,通入过量的空气,增大了反应物氧气的浓度,该平衡向正向移动, 提高了的转化率,故填增大了反应物氧气的浓度,提高了的转化率;
(5)是空气污染物,不能随意排放,所以尾气中有必须回收是为了防止污染环境,故填防止污染环境。
17. 2A+B2C 0.2mol/(L·min) acd 40% ①③
解析:(1)据图可知A、B的物质的量减小,C的物质的量增大,则A、B为反应物,C为生成物,最终三种物质共存说明为可逆反应,2min时Δn(A):Δn(B):Δn(C)=2mol:1mol:2mol=2:1:2,则反应方程式三种物质的计量数之比为2:1:2,则反应的化学方程式为2A+B2C;
(2)据图可知反应开始至2min时,Δn(A)=2mol,容器体积为5L,所以A的平均反应速率为=0.2mol/(L·min);
(3)a.若v逆(A)=v正(B),则2v逆(B)=v正(B),正逆反应速率不相等,反应未平衡,故a符合题意;
b.该反应前后气体系数之和不相等,所以未平衡时气体总物质的量会发生变化,容器恒容,则压强会变,当压强不变时说明反应平衡,故b不符合题意;
c.反应平衡时正逆反应速率相等,但选项未注明是正反应速率还是逆反应速率,不能说明反应平衡,故c符合题意;
d.反应物和生成物均为气体,则气体的总质量不变,容器恒容,所以密度一直为定值,密度不变不能说明反应平衡,故d符合题意;
综上所述答案为acd;
(4)据图可知A的初始投料为5mol,2min后各物质的物质的量不再改变反应达到平衡,平衡时Δn(A)=2mol,所以A的平衡转化率为=40%;
(5)①增大容器体积各物质的浓度减小,反应速率减慢,故①符合题意;
②催化剂一般可以增大反应速率,故②不符合题意;
③降低温度,活化分子百分数减少,反应速率减慢,故③符合题意;
综上所述答案为①③。
18. (1) N2O42NO2 >
(2) 0.14 0.003mol/(L·s)
(3) 0.54
(4)abd
解析: (1)N2O4转化为NO2反应的化学方程式为:N2O4 2NO2,反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅,说明反应逆向进行,逆向是放热反应,正向是吸热反应, H>0。
(2)20s时,c(NO2)= 0.12mol/L,则c(N2O4)= 0.06mol/L ,则20s时,N2O4的的浓度为0.20mol/L -0.06mol/L =0.14mol/L;0~20s内N2O4的平均反应速率。
(3)该反应的方程式为N2O4 2NO2,则平衡常数表达式;
80°C平衡状态和60s是相同的平衡状态,平衡浓度c(NO2)=0.22mol/L,c(N2O4)=0.09mol/L,则平衡常数。
(4)化学平衡常数是指反应达到平衡时,反应物浓度幂之积与生成物浓度幂之积的比值,故在其他条件相同时,该反应的K值越大,表明建立平衡时N2O4的转化率越高,正反应进行的程度越大,NO2的产量越大,N2O4与NO2的浓度之比越小,故选abd。
三、计算题
19.p
解析:设起始N2O4的物质的量为1mol,N2O4气体的平衡转化率为75%,则N2O4的转化量为0.75mol,列三段式:
由三段式数据可知,N2O4的平衡分压为×p=,NO2的平衡分压为×p=,则平衡常数Kp==。
20.甲 0.1 c 80% 或0.8 0.33 4:5
【分析】依据图象,根据反应物、生成物反应前后物质的量变化之比等于物质的量之比确定甲、乙、丙三条曲线分别代表CH4.、N2、H2O中的哪种物质;依据单位时间内浓度的变化,计算出0 ~5min内,用N2表示的化学反应速率;达到平衡时的判断依据。
解析:(1)起始时向体积为V的恒容密闭容器中通入2 mol CH4和3 mol NO2,测得CH4.、N2、H2O的物质的量浓度与时间的关系如图所示,CH4是反应物,即起始时的物质的量浓度为1.0mol·L-1,依据c=,得V===2L;
(2)由(1)可知,丙代表CH4,从开始到平衡时,甲代表的物质的物质的量浓度增加量:1.2mol·L-1,乙代表的物质的物质的量浓度增加量:0.6mol·L-1,故从开始到平衡时,甲代表的物质的物质的量浓度增加量:1.2mol·L-1×2L=2.4mol;故从开始到平衡时,乙代表的物质的物质的量浓度增加量:0.6mol·L-1×2L=1.2mol,根据反应物、生成物反应前后物质的量变化之比等于物质的量之比,故甲代表H2O的物质的量浓度与时间关系,乙代表N2的物质的量浓度与时间关系;
(3)乙代表N2的物质的量浓度与时间关系,0 ~5 min内,N2的物质的量浓度变化量为:0.5mol·L-1 - 0=0.5mol·L-1,v(N2)==0.1mol·L-1·min -1;
(4)当达到平衡时反应物、生成物的浓度不再随着时间的变化而变化,故a、b、c三点中达到平衡的点是c;达到平衡时,c(N2)=0.6mol·L-1,即从开始平衡,N2的物质的量增加了:0.6mol·L-1×2L=1.2mol,CH4(g) +2NO2(g)N2(g) +CO2(g) + 2H2O(g) ,依据方程式中反应物、生成物的物质的量的变化量之比等于化学计量数之比,即从开始到平衡,NO2的物质的量变化量为:1.2mol×2=2.4mol,故达到平衡时, NO2的转化率是 =80%;
(5)设a点时的浓度为xmol·L-1,CH4(g) +2NO2(g)N2(g) +CO2(g) + 2H2O(g) ,依据方程式中反应物、生成物的物质的量的变化量之比等于化学计量数之比,(1.0-x):x=1:2,x=0.67,=0.67mol·L-1×2L=1.34mol,=1:2:1:1:2,a点时,=0.67mol,c(CO2) ==0.33mol·L-1;=0.67mol,=1.34mol,故a点时,n( CH4):n(NO2)=(2mol-0.67mol):(3mol-1.34mol)=4:5。
四、实验题
21. 温度 秒表 淀粉溶液 2 4I﹣+4H++O2=2I2+2H2O abc 2mL 0.2mol·L-1 H2SO4溶液
【分析】I.该实验探究其他条件相同时,温度对反应速率的影响,由表格数据可知,温度每升高10℃,反应速率增大为原来的2倍;
Ⅱ.该实验探究温度不变时, 溶液的酸性强弱对KI溶液变色速率的影响,由实验设计可知,溶液酸性越强,KI溶液变色越快。
解析:(1)由题意可知,该实验探究其他条件相同时,温度对反应速率的影响,故答案为:温度;
(2)碘化钾溶液被空气中氧气氧化生成单质碘,单质碘遇淀粉溶液变蓝色,由题给实验试剂和实验仪器可知,实验时,还缺少测定显色时间所用的仪器秒表和显色反应快慢的试剂淀粉溶液,故答案为:秒表;淀粉溶液;
(3) 由题意可知,碘化钾溶液变色的反应为酸性条件下,碘离子与氧气反应生成单质碘和水,反应的离子方程式为4I﹣+4H++O2=2I2+2H2O,故答案为:4I﹣+4H++O2=2I2+2H2O;
(4) 该实验探究温度不变时, 溶液的酸性强弱对KI溶液变色速率的影响,由变量唯一化可知,实验操作中必须控制温度、试剂的用量(体积)和试剂添加的顺序保持不变,故答案为:abc;
(5) 由变量唯一化可知,实验时应保证其他条件不变,在溶液总体积不变的条件下,通过加入蒸馏水改变0.2mol·L-1 H2SO4溶液溶液中的氢离子浓度,则实验时,应向其中一支试管中加入1mL蒸馏水和1mL 0.2mol·L-1 H2SO4溶液,同时在另一支试管中加入2mL 0.2mol·L-1 H2SO4溶液,故答案为:2mL 0.2mol·L-1 H2SO4溶液。
