第二章 分子结构与性质 测试题(含解析) 2022-2023学年高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 第二章 分子结构与性质 测试题(含解析) 2022-2023学年高二下学期化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 455.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-03 20:19:32 | ||
图片预览




文档简介
第二章 分子结构与性质 测试题
一、选择题
1.下列关于化学键和分子间作用力的说法正确的是
A.和中的化学键类型完全相同
B.中含有极性共价键和非极性共价键
C.比稳定是因为分子间作用力前者强于后者
D.干冰升华时克服了共价键和分子间作用力
2.下表表示周期表的一部分,下列说法不正确的是
A.C、D气态氢化物稳定性强弱和沸点高低顺序均为
B.A、B、C对应的简单氢化物的还原性
C.AD3和ED4两分子的中心原子均为杂化,但两者的键角大小不同
D.ED4分子中各原子均达8电子稳定结构,与四氯化碳互为等电子体
3.羟胺易溶于水,其水溶液是比肼还弱的碱溶液。羟胺可与形成,已知反应:。下列有关说法正确的是
A.很稳定是因为分子间含有氢键
B.的空间结构为平面三角形
C.与中的键角相同
D.、与的VSEPR模型相同
4.下列分子或离子的空间结构相同的是
A.BeCl2和SO2
B.BF3和PCl3
C.和
D.SO3和ClO
5.下列有关物质性质说法中,正确的是
A.s-sσ键与s-p σ键的电子云形状相同
B.热稳定性:HF>HI>HBr>HCl
C.具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4,原子半径最大的是①
D.某元素气态基态原子的逐级电离能(kJ mol-1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+,其最高正价为+5价
6.以下关于化学键的说法中不正确的是
A.键和π键都可单独存在
B.由两种元素组成的化合物中可既含有极性键,又含有非极性键
C.CO2分子中有两个键和两个π键
D.空气中N2的化学性质比O2稳定是由于N2分子中化学键的键能大于O2分子中的化学键键能
7.下列物质互为等电子体的一组是
A.和 B.和 C.和 D.和
8.关于氢键,下列说法正确的是
A.分子中有N、O、F原子,分子间就存在氢键
B.因为氢键的缘故, 比 熔沸点低
C.极易溶于水,形成的溶液中存在的氢键类型有4种
D.“可燃冰”——甲烷水合物()中与之间存在氢键
9.下列分子或离子的中心原子为杂化,且杂化轨道容纳1对孤电子对的是
A.、、 B.、、
C.、、 D.、、
10.下列物质的性质中,与氢键无关的是
A.甲醇极易溶于水
B.乙酸的熔点比乙酸乙酯高
C.氨气易液化
D.碘易溶于四氯化碳
11.X、Y、Z、W、R属于周期表中前20号主族元素,且原子序数依次增大。基态X原子中有3个未成对电子,Z是元素周期表中电负性最大的元素,Y和W同主族,常温下0.01mol L-1R的最高价氧化物对应的水化物溶液的pH=12。下列说法正确的是
A.Z的简单氢化物分子间能形成氢键 B.简单离子半径:r(R)>r(W)
C.简单气态氢化物的热稳定性:W>Y D.第一电离能:I1(X)>I1(Y)>I1(Z)
12.2022年3月23日,“天宫课堂”第二课开讲,太空“冰雪”实验带来神奇现象。小苏打和白醋混合可得乙酸钠溶液,过饱和乙酸钠溶液只要遇到一丁点的结晶或颗粒就会析出晶体,从而在太空“点水成冰”。下列说法错误的是
A.的俗称是苏打 B.纯净的乙酸又称冰醋酸
C.结晶析出为放热熵减过程 D.中只有离子键和极性共价键
13.下列说法正确的是
A.键的强度均大于键 B.金属元素的电负性均小于1.8
C.预测第八周期有32种元素 D.第一电离能:
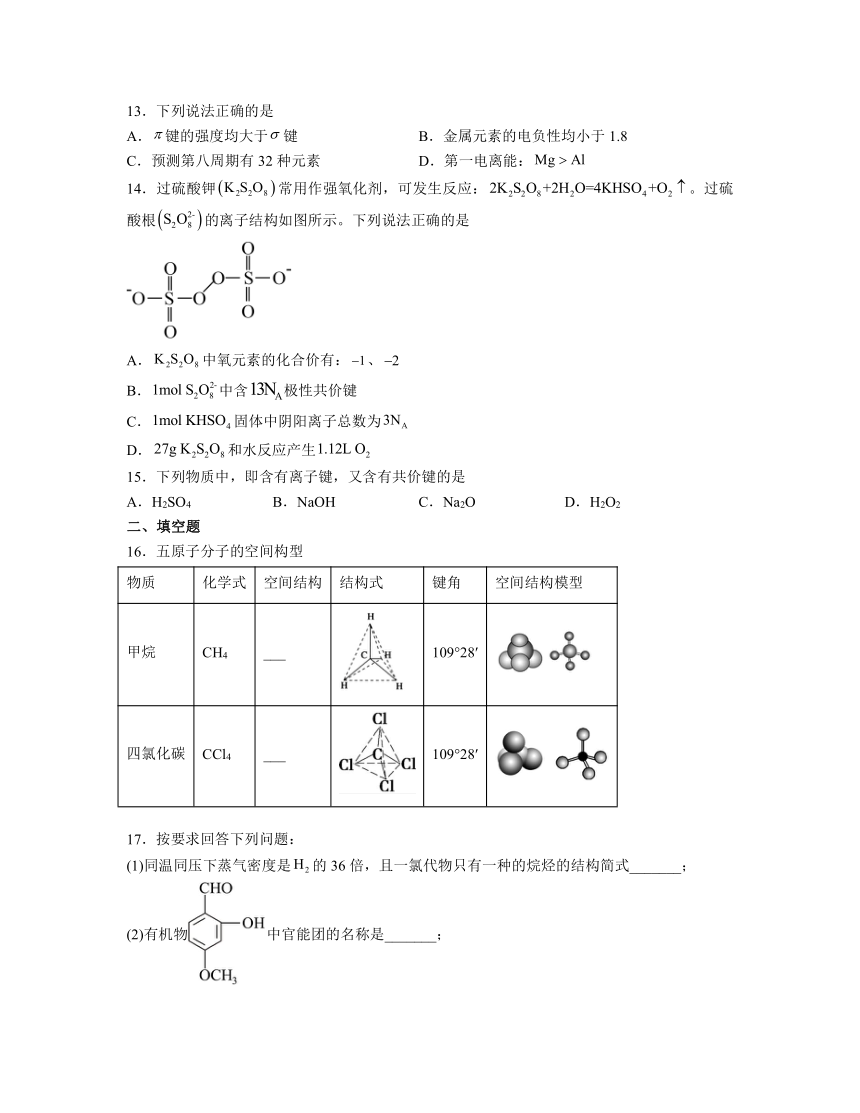
14.过硫酸钾常用作强氧化剂,可发生反应:。过硫酸根的离子结构如图所示。下列说法正确的是
A.中氧元素的化合价有:、
B.中含极性共价键
C.固体中阴阳离子总数为
D.和水反应产生
15.下列物质中,即含有离子键,又含有共价键的是
A.H2SO4 B.NaOH C.Na2O D.H2O2
二、填空题
16.五原子分子的空间构型
物质 化学式 空间结构 结构式 键角 空间结构模型
甲烷 CH4 ___ 109°28′
四氯化碳 CCl4 ___ 109°28′
17.按要求回答下列问题:
(1)同温同压下蒸气密度是的36倍,且一氯代物只有一种的烷烃的结构简式_______;
(2)有机物中官能团的名称是_______;
(3)有机物的系统命名为_______;
(4)有机物的系统命名法_______;
(5)试从氢键的角度分析造成醋酸(熔点16.6℃)、硝酸(熔点-42℃)2种相对分子质量相近的分子熔点相差较大的可能原因_______。
18.现有①H2O2;②CO2;③NH3; ④Ba(OH)2 四种物质,回答下列问题:
(1)属于离子化合物的是_______ (填编号,下同); 属于共价化合物且中心原子杂化类型为sp3杂化的是_______,其中分子空间构型为三角锥形的是_______。
(2)含有非极性键的是_______ (填编号,下同);既有σ键又有π键的是_______。
(3)Ba(OH)2中第一电离能最小的元素是_______ (填元素符号)。 .
(4)上述四种物质中涉及的所有元素的电负性由大到小顺序排列为_______。
(5)写出下列物质的电子式:N2________;H2O2________;NaOH________。
19.利用杂化轨道理论填写下表。
分子 中心原子杂化类型 空间结构
____ ____
____ ____
____ ____
苯 ____ ____
20.砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。部分元素在周期表中位置如图:
Al Si P
Ga Ge As
回答下列问题:
(1)六种元素中,非金属性最强的元素是:____,其在元素周期表中的位置是___;写出As原子的最外层的电子排布式____,As原子核外有____个未成对电子。
(2)根据元素周期律,可判断原子半径Ga____As。(选填“>”、“<”或“=”)。
(3)根据元素周期律,可判断PH3的分子构型是____,属于____分子(填“极性”或“非极性”)。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,可能的原因是___。
21.(1)在元素周期表中全部是金属元素的区域为______;按电子排布分区,属于p区的是______。
a.A b.B c.C d.D
(2)科学家常用“等电子体”来预测不同物质的结构,例如CH4与NH有相同的电子数和立体构型。依此原理在下表空格中填出相应的化学式:①_; ②_;③_______。
CH4 ① ③
NH ② N2
(3)某些共价键的键能数据如下表(单位:kJ·mol-1):
共价键 H—H Cl—Cl Br—Br H—Cl H—I I—I N≡N H—O H—N
键能 436 243 194 432 299 153 946 463 391
①把1 mol Cl2分解为气态原子时,需要__(填“吸收”或“放出”)___kJ能量。
②由表中所列化学键形成的单质分子中,最稳定的是___,最不稳定的是___;形成的化合物分子中最稳定的是___,最不稳定的是___。
22.在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O,根据等电子原理,CO分子的结构式为___________,1molCO2中含有的σ键数目为___________
三、元素或物质推断题
23.现有部分元素的性质与原子(或分子)结构的相关信息如表所示:
元素编号 元素性质与原子(或分子)结构的相关信息
T 最外层电子数是次外层电子数的 3 倍
X 常温下单质分子为双原子分子,分子中含有 3 对共用电子对
Y M 层比K 层少 1 个电子
Z 其离子是第三周期金属元素的离子中半径最小的
(1)T、X、Y、Z 形成的简单离子半径由大到小的顺序是_____。(用离子符号表示)
(2)元素 Y 与元素 Z 相比,金属性较强的是_____(用元素符号表示),下列表述中能 证明这一事实的是_____(填字母序号)。
a.Y 单质的熔点比 Z 单质的低
b.Y 的化合价比Z 的低
c.常温下Y 单质与水反应的程度很剧烈,而Z 单质在加热条件下才能与水反应
d.Y 最高价氧化物对应的水化物的碱性比 Z 的强
(3)T、X、Y、Z 中有两种元素能形成既含离子键又含非极性共价键的常见化合物,写出该化合物的电子式:________,元素 X 与氢元素以原子个数比 1∶2 化合形成常用于火箭燃料的化合物 W,写出 W 的电子式_______
(4)元素 T 和氢元素以原子个数比 1∶1 化合形成化合物 Q, Q 能与 W 发生氧化还原反应, 生成X 的单质和T 的另一种氢化物,写出该反应的化学方程式:_______
【参考答案】
一、选择题
1.A
解析:A.和均是仅由离子键构成的离子化合物,A正确;
B.中只有C-H极性共价键,B错误;
C.与的稳定性与分子内化学键强弱有关,与分子间作用力无关,C错误;
D.干冰升华为物理变化,克服的是分子间作用力,不克服共价键,D错误;
答案选A。
2.A
【分析】根据题目所给图象可推得,A为N元素、B为O元素、C为F元素、D为Cl元素、E为Si元素。
解析:A.同主族从上到下元素非金属性递减,非金属性越强,简单氢化物越稳定,则F、Cl元素气态氢化物稳定性HCl < HF,HF分子间有氢键,沸点比HCl高,A错误;
B.同周期从左到右主族元素非金属性递增,非金属性越强,对应阴离子的还原性越弱,N、O、F对应的简单氢化物的还原性HF < H2O < NH3,B正确;
C.中心原子价电子对数,中心原子价电子对数,则两分子的中心原子均为即杂化,但中有孤电子对,两者的键角大小不同,C正确;
D.分子中各原子均达8电子稳定结构,具有相同价电子数和相同原子数的分子或离子互为等电子体,则与CCl4互为等电子体,D正确;
综上,本题选A。
3.D
解析:A.很稳定是因为氧元素非金属性强,与氢结合的化学键较稳定,氢键是影响水的熔沸点,故A错误;
B.中心原子采用杂化,含有一对孤电子对,则其空间结构为V形,故B错误;
C.根据价层电子对互斥理论,的空间结构为正四面体形,键角为109°28′,中N原子采用杂化,中心原子有1对孤电子对,孤对电子对成对电子排斥力大于成对电子对成对电子的排斥力,因此键的键角小于109°28′,故C错误;
D.价层电子对数为2+2=4,、价层电子对数为4+0=4,中心原子价层电子对数为3+1=4,它们的VSEPR模型都是四面体形,故D正确。
综上所述,答案为D。
4.C
解析:A.分子中中心原子σ键数为2,孤电子对数为,空间结构为直线形,SO2分子中中心原子σ键数为2,孤电子对数为,空间结构为V形,故A错误;
B.分子中中心原子σ键数为3,孤电子对数为,空间结构为平面三角形,分子中中心原子σ键数为3,孤电子对数为,空间结构为三角锥形,故B错误;
C.中中心原子原子σ键数为4,孤电子对数为,空间结构为正四面体形,中中心原子σ键数为4,孤电子对数为,空间结构为正四面体形,故C正确;
D.分子中中心原子σ键数为3,孤电子对数为,空间结构为平面三角形,中中心原子σ键数为3,孤电子对数为,空间结构为三角锥形,故D错误;
故答案选C。
5.C
解析:A.s能级电子云形状是球形,p能级电子云形状是哑铃形,所以s-sσ键与s-pσ键的电子云形状不同,A错误;
B.已知电负性F>Cl>Br>I,故热稳定性:HF> HCl > HBr >HI,B错误;
C.具有下列电子排布式的原子中,①1s22s22p63s23p2即Si,②1s22s22p3即N,③1s22s22p2即C,④1s22s22p63s23p4即S,根据同一周期从左往右原子半径依次减小,同一主族从上往下原子半径依次增大可知,原子半径最大的是①,C正确;
D.根据逐级电离能数据,该元素的第三电离能剧增,说明最外层有2个电子,为第ⅡA族元素,与氯气反应时易失去最外层2个电子,形成X2+离子,其最高正价为+2价,D错误;
故答案为:C。
6.A
解析:A.键是电子云头对头形成的共价键,而π键是电子云肩并肩形成的共价键,键可以在分子中单独存在,但π键是与键同时出现的,不可单独存在,故A错误;
B.由两种元素组成的化合物中可既含有极性键,又含有非极性键,如H-C≡C-H分子中含有碳氢极性键和碳碳非极性键,故B正确;
C.二氧化碳分子的结构式为O=C=O,由结构式可知二氧化碳分子中含有两个键和两个π键,故C正确;
D.键能越大,其稳定性越强,氮气分子中含有氮氮三键,氧气分子中含有氧氧双键,氮氮三键的键能比氧氧双键的键能大,则氮气比氧气稳定,故D正确;
故选A。
7.A
解析:等电子体要具备两个条件:一是微粒的原子数相同,二是微粒的价电子数相同。分析可知A项正确,原子数均是5个,价电子数均是8个,C项中和Mg的价电子数不同,B、D项中的原子数不相同。
答案选A。
8.C
解析:A.与N、O、F以共价键相连的H能与N、O、F形成氢键,含有N、O、F原的分子不一定能形成分子间氢键,如氮气分子与氢气不能形成分子间氢键,选项A错误;
B.对羟基苯甲醛形成分子间氢键,而邻羟基苯甲醛形成分子内氢键,所以对羟基苯甲醛熔沸点高于邻羟基苯甲醛,选项B错误;
C.氨水中有4种氢键,氢键类型及其键能分别是:O—HN、O—HO、N-HN、N-HO,选项C正确;
D.甲烷分子中碳元素的非金属性弱,不能与水分子形成分子间氢键,所以甲烷水合物中甲烷与水之间不存在氢键,选项D错误;
答案选C。
9.D
【分析】分子或离子的中心原子为sp3杂化,且杂化轨道容纳1对孤电子对,中心原子的价电子数为3+1=4。
解析:A.CH4、NH3、H2O的中心原子价层电子对数都是4,都采用sp3杂化,CH4、NH3、H2O的中心原子上的孤电子对数分别是0、1、2,故A错误;
B.CO2、BBr3、中的中心原子价层电子对数分别是2、3、4,且CO2、BBr3、中孤电子对数分别是0、0、1,故B错误;
C.C2H4、SO2、BeCl2中的中心原子价层电子对数分别是3、3、2,且C2H4、SO2、BeCl2中孤电子对数分别是0、1、0,故C错误;
D.NH3、PCl3、H3O+的中心原子价层电子对数都是4,采用sp3杂化,中心原子上的孤电子对数都是1,故D正确;
故答案选D。
10.D
解析:A.甲醇能和水分子形成氢键,导致极易溶于水,故A不符合题意;
B.乙酸能形成氢键,导致其熔点比乙酸乙酯高,故B不符合题意;
C.氨分子间存在氢键,导致其沸点较高,故氨气易液化,故C不符合题意;
D.碘为非极性分子易溶于非极性溶剂四氯化碳,与氢键无关,故D符合题意;
故选D。
11.A
【分析】Z是元素周期表中电负性最大的元素,则Z为F。基态X原子中有3个未成对电子且其原子序数小于9,则X为N。根据原子序数大小关系,可判断Y为O。Y和W同主族,则W为S。常温下的最高价氧化物对应的水化物溶液的pH=12,说明R的最高价氧化物对应的水化物为强碱,R为K。
解析:A.Z为F,简单氢化物为HF,分子之间能形成氢键,A正确;
B.简单离子半径r(S2-)>r(K+),B错误;
C.O的非金属性大于S,简单氢化物的稳定性:H2O>H2S,C错误;
D.同周期从左往右第一电离能呈增大趋势,N为半充满电子排布,其第一电离能大于O,则第一电离能:,D错误;
故选A。
12.D
解析:A.碳酸钠俗称纯碱或苏打,A正确;
B.纯净的乙酸在温度较低时会由液态变为冰状固态,故又称冰醋酸,B正确;
C.结晶过程自由离子由相对无序状态转化为相对有序状态,混乱程度下降同时释放能量,C正确;
D.中与间存在离子键,C与H、C与O、H与O间存在极性共价键,C与C间存在非极性共价键,D错误;
故选D。
13.D
解析:A.大多数σ键比π键强度大,但是有个别反例,A错误;
B.金属元素的电负性一般小于1.8,非金属元素的电负性一般大于1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,B错误;
C.第八周期元素原子核外有8个电子层,根据排布规律,最后一种元素各层电子数为2、8、18、32、50、32、18、8,原子序数为168;第七周期元素原子核外有7个电子层,根据排布规律,最后一种元素各层电子数为2、8、18、32、32、18、8,原子序数为118,则第八周期元素种类数为168-118=50,C错误;
D.同一周期随着原子序数变大,第一电离能变大,但是镁原子价电子为3s2全满稳定状态,电离能大于相邻元素,故第一电离能:,D正确;
故选D。
14.A
解析:A.由结构可知,分子结构的中间存在过氧根,过氧根中氧为-1价氧,与每个硫相连的其它氧为-2价氧, A正确;
B.过氧根中氧氧键为非极性键,1个过硫酸根中含有12个极性共价键,中含极性共价键,B错误;
C.固体中含有K+和HSO两种离子,则固体中阴阳离子总数为,C错误;
D.没有说明是否为标况,不能计算生成氧气的体积,D错误;
故选A。
15.B
解析:A.H2SO4只有共价键,A错误;
B.NaOH既含有离子键,又含有共价键,B正确;
C.Na2O只有离子键,C错误;
D.H2O2只有共价键,D错误。
答案选B。
二、填空题
16. 正四面体 正四面体
解析:略
17.(1)
(2)羟基、醛基、醚键
(3)2,4—二甲基—3—乙基己烷
(4)4—甲基—2—乙基—1—戊烯
(5)醋酸分子能形成分子间氢键使分子间作用力增大,而硝酸分子间形成分子内氢键使分子间作用力减小,所以相对分子质量相近的醋酸分子和硝酸分子熔点相差较大
解析:(1)由同温同压下烷烃的蒸气密度是氢气的36可知,烷烃的相对分子质量为36×2=72,设烷烃的分子式为CnH2n+2,由相对分子质量可得:14n+2=72,解得n=5,则烷烃为戊烷,一氯代物只有一种的结构简式为,故答案为:;
(2)由结构简式可知,有机物分子中的官能团为羟基、醛基、醚键,故答案为:羟基、醛基、醚键;
(3)由结构简式可知,烷烃分子中最长碳链含有6个碳原子,侧链为2个甲基和1个乙基,名称为2,4—二甲基—3—乙基己烷,故答案为:2,4—二甲基—3—乙基己烷;
(4)由键线式可知,烯烃分子中含有碳碳双键的最长碳链含有5个碳原子,侧链为1个甲基和1个乙基,名称为4—甲基—2—乙基—1—戊烯,故答案为:4—甲基—2—乙基—1—戊烯;
(5)醋酸和硝酸都能形成氢键,醋酸分子能形成分子间氢键使分子间作用力增大,而硝酸分子间形成分子内氢键使分子间作用力减小,所以相对分子质量相近的醋酸分子和硝酸分子熔点相差较大,故答案为:醋酸分子能形成分子间氢键使分子间作用力增大,而硝酸分子间形成分子内氢键使分子间作用力减小,所以相对分子质量相近的醋酸分子和硝酸分子熔点相差较大。
18.(1) ④ ①③ ③
(2) ① ②
(3)B
(4)O>N>C>H>Ba
(5)
解析:(1)④中含有离子键和共价键,属于离子化合物;①②③中只含共价键,属于共价化合物,①③中中心原子采用sp3杂化,②中C原子采用sp杂化;中心原子价层电子对数是4且含有1个孤电子对的微粒分子空间构型是三角锥形,双氧水分子为书页形分子、二氧化碳分子为直线形分子、氨气分子为三角锥形分子,故答案为:④;①③;③;
(2)同种非金属元素之间存在非极性键,双氧水分子中存在O-O非极性键;共价单键为σ键,共价双键或三键中含有σ键和π键,二氧化碳的结构式为O=C=O,存在σ键和π键,故答案为:①;②;
(3)金属的第一电离能最小,该化合物中含有的元素是H、O、Ba,Ba易失电子,其第一电离能最小,故答案为:B;
(4)元素的非金属性越强,其电负性越大,这几种元素中非金属性强弱顺序是O>N>C>H>Ba,所以电负性大小顺序是O>N>C>H>Ba,故答案为:O>N>C>H>Ba;
(5)氮气分子中氮原子之间共用3对电子,电子式为;H2O2中结构式为H-O-O-H,电子式为;NaOH中存在钠离子和氢氧根离子,电子式为,故答案为:;;。
19. 直线形 正四面体形 平面三角形 平面正六边形
解析:中C原子有2对键电子对,孤电子对数为,则C原子采取杂化,为直线形分子。中原子有4对键电子对,孤电子对数为,则原子采取杂化,为正四面体形分子。中B原子有3对键电子对,孤电子对数为,则B原子采取杂化,为平面三角形分子。苯中每个C原子有3对键电子对,不含孤电子对,碳原子采取杂化,苯为平面正六边形分子。
20.(1) P 第三周期第ⅤA族 4s24p3 3
(2)>
(3) 三角锥型 极性
(4)GaF3是离子晶体,熔化时破坏的是离子键,键能较大,故熔点较高,而GaCl3是分子晶体,熔化时破坏的是分子间作用力,比较弱,故熔点较低
解析:(1)同一周期主族元素从左向右非金属性逐渐增强,同一主族元素从上向下非金属性逐渐减弱,因此非金属性最强的为P,位于元素周期表第三周期第ⅤA族;As的原子序数是33,其基态原子核外电子排布式为:1s22s22p63s23p63d104s24p3,最外层的电子排布式为:4s24p3,原子核外有3个未成对电子;
(2)同一周期主族元素从左向右原子半径逐渐减小,因此Ga的原子半径大于As;
(3)PH3的价层电子对数为,中心原子P采取sp3杂化,但有一对孤对电子,因此PH3的分子构型是三角锥型,而其正负电荷重心不重合,因此为极性分子;
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,可能的原因是:GaF3是离子晶体,熔化时破坏的是离子键,键能较大,故熔点较高,而GaCl3是分子晶体,熔化时破坏的是分子间作用力,比较弱,故熔点较低。
21. b cd C2H6 CO 吸收 243 N2 I2 H2O HI
解析:(1)在元素周期表中全部是金属元素的区域为B区;按电子排布分区,属于p区的是CD区;
故答案为:b;cd;
(2)含8个原子,电子对数为22,C2H6与其互为等电子体;含4个原子,电子数为32,与其互为等电子体;N2含2个原子,电子数为14,CO与其互为等电子体;
故答案为:C2H6;;CO;
(3)①化学键断裂要吸收能量,由表中数据可知把1mol Cl2分解为气态原子时,需要吸收243kJ的能量;
②键能越大,化学键越稳定,化学性质越稳定,所以最稳定的单质是N2;最不稳定的单质是I2;最稳定的化合物是H2O;最不稳定的化合物是HI。
22. C≡O 2NA
解析:N2与CO为等电子体,二者结构相似,N2的结构为N≡N,则CO的结构为C≡O,故答案为:C≡O;CO2的结构式为O=C=O,分子中C形成2个σ键,则1molCO2中含有的σ键数目为2×6.02×1023个,故答案为:2×6.02×1023(或2NA)。
三、元素或物质推断题
23. N3->O2->Na+>Al3+ Na cd 2H2O2+N2H4=N2+4H2O
【分析】T最外层电子数是次外层电子数的 3 倍,T为氧元素;X常温下单质分子为双原子分子,分子中含有 3 对共用电子对,X为氮元素;Y 的原子结构中M 层比K 层少 1 个电子,Y为钠元素;Z的离子是第三周期金属元素的离子中半径最小的,Z为铝元素。
解析:(1)根据元素周期律,电子层数相同时,序数小的离子半径大,则T、X、Y、Z 形成的简单离子半径由大到小的顺序是N3->O2->Na+>Al3+,故答案为:N3->O2->Na+>Al3+;
(2)根据元素周期律,同周期元素,金属性从左到右逐渐减弱,则钠的金属性比铝的金属性强;
a.熔点为物理性质,不能用熔点大小来比较金属性强弱,故a错误;
b.化合价可以衡量得失电子的数目,但不能用来说明是否容易得失电子,则不能通过钠和铝的化合价来说明钠和铝的金属性强弱,故b错误;
c.通过比较钠和铝与水反应的剧烈程度,可知钠比铝活泼,即钠的金属性强于铝,故c正确;
d.根据元素周期律,金属性强的元素对应的碱的碱性也强,故d正确;
综上所述,故答案为:Na;cd;
(3)由两种元素形成的既含有离子键又含有共价键的化合物为过氧化钠,其电子式为;氮元素与氢元素形成的化合物W为N2H4,可用于作火箭的燃料,其电子式为,故答案为:;;
(4)化合形成化合物 Q为双氧水,化合物W为N2H4,二者发生氧化还原反应生成氮气和水,其反应的化学方程式为2H2O2+N2H4=N2+4H2O,故答案为:2H2O2+N2H4=N2+4H2O
一、选择题
1.下列关于化学键和分子间作用力的说法正确的是
A.和中的化学键类型完全相同
B.中含有极性共价键和非极性共价键
C.比稳定是因为分子间作用力前者强于后者
D.干冰升华时克服了共价键和分子间作用力
2.下表表示周期表的一部分,下列说法不正确的是
A.C、D气态氢化物稳定性强弱和沸点高低顺序均为
B.A、B、C对应的简单氢化物的还原性
C.AD3和ED4两分子的中心原子均为杂化,但两者的键角大小不同
D.ED4分子中各原子均达8电子稳定结构,与四氯化碳互为等电子体
3.羟胺易溶于水,其水溶液是比肼还弱的碱溶液。羟胺可与形成,已知反应:。下列有关说法正确的是
A.很稳定是因为分子间含有氢键
B.的空间结构为平面三角形
C.与中的键角相同
D.、与的VSEPR模型相同
4.下列分子或离子的空间结构相同的是
A.BeCl2和SO2
B.BF3和PCl3
C.和
D.SO3和ClO
5.下列有关物质性质说法中,正确的是
A.s-sσ键与s-p σ键的电子云形状相同
B.热稳定性:HF>HI>HBr>HCl
C.具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4,原子半径最大的是①
D.某元素气态基态原子的逐级电离能(kJ mol-1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+,其最高正价为+5价
6.以下关于化学键的说法中不正确的是
A.键和π键都可单独存在
B.由两种元素组成的化合物中可既含有极性键,又含有非极性键
C.CO2分子中有两个键和两个π键
D.空气中N2的化学性质比O2稳定是由于N2分子中化学键的键能大于O2分子中的化学键键能
7.下列物质互为等电子体的一组是
A.和 B.和 C.和 D.和
8.关于氢键,下列说法正确的是
A.分子中有N、O、F原子,分子间就存在氢键
B.因为氢键的缘故, 比 熔沸点低
C.极易溶于水,形成的溶液中存在的氢键类型有4种
D.“可燃冰”——甲烷水合物()中与之间存在氢键
9.下列分子或离子的中心原子为杂化,且杂化轨道容纳1对孤电子对的是
A.、、 B.、、
C.、、 D.、、
10.下列物质的性质中,与氢键无关的是
A.甲醇极易溶于水
B.乙酸的熔点比乙酸乙酯高
C.氨气易液化
D.碘易溶于四氯化碳
11.X、Y、Z、W、R属于周期表中前20号主族元素,且原子序数依次增大。基态X原子中有3个未成对电子,Z是元素周期表中电负性最大的元素,Y和W同主族,常温下0.01mol L-1R的最高价氧化物对应的水化物溶液的pH=12。下列说法正确的是
A.Z的简单氢化物分子间能形成氢键 B.简单离子半径:r(R)>r(W)
C.简单气态氢化物的热稳定性:W>Y D.第一电离能:I1(X)>I1(Y)>I1(Z)
12.2022年3月23日,“天宫课堂”第二课开讲,太空“冰雪”实验带来神奇现象。小苏打和白醋混合可得乙酸钠溶液,过饱和乙酸钠溶液只要遇到一丁点的结晶或颗粒就会析出晶体,从而在太空“点水成冰”。下列说法错误的是
A.的俗称是苏打 B.纯净的乙酸又称冰醋酸
C.结晶析出为放热熵减过程 D.中只有离子键和极性共价键
13.下列说法正确的是
A.键的强度均大于键 B.金属元素的电负性均小于1.8
C.预测第八周期有32种元素 D.第一电离能:
14.过硫酸钾常用作强氧化剂,可发生反应:。过硫酸根的离子结构如图所示。下列说法正确的是
A.中氧元素的化合价有:、
B.中含极性共价键
C.固体中阴阳离子总数为
D.和水反应产生
15.下列物质中,即含有离子键,又含有共价键的是
A.H2SO4 B.NaOH C.Na2O D.H2O2
二、填空题
16.五原子分子的空间构型
物质 化学式 空间结构 结构式 键角 空间结构模型
甲烷 CH4 ___ 109°28′
四氯化碳 CCl4 ___ 109°28′
17.按要求回答下列问题:
(1)同温同压下蒸气密度是的36倍,且一氯代物只有一种的烷烃的结构简式_______;
(2)有机物中官能团的名称是_______;
(3)有机物的系统命名为_______;
(4)有机物的系统命名法_______;
(5)试从氢键的角度分析造成醋酸(熔点16.6℃)、硝酸(熔点-42℃)2种相对分子质量相近的分子熔点相差较大的可能原因_______。
18.现有①H2O2;②CO2;③NH3; ④Ba(OH)2 四种物质,回答下列问题:
(1)属于离子化合物的是_______ (填编号,下同); 属于共价化合物且中心原子杂化类型为sp3杂化的是_______,其中分子空间构型为三角锥形的是_______。
(2)含有非极性键的是_______ (填编号,下同);既有σ键又有π键的是_______。
(3)Ba(OH)2中第一电离能最小的元素是_______ (填元素符号)。 .
(4)上述四种物质中涉及的所有元素的电负性由大到小顺序排列为_______。
(5)写出下列物质的电子式:N2________;H2O2________;NaOH________。
19.利用杂化轨道理论填写下表。
分子 中心原子杂化类型 空间结构
____ ____
____ ____
____ ____
苯 ____ ____
20.砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。部分元素在周期表中位置如图:
Al Si P
Ga Ge As
回答下列问题:
(1)六种元素中,非金属性最强的元素是:____,其在元素周期表中的位置是___;写出As原子的最外层的电子排布式____,As原子核外有____个未成对电子。
(2)根据元素周期律,可判断原子半径Ga____As。(选填“>”、“<”或“=”)。
(3)根据元素周期律,可判断PH3的分子构型是____,属于____分子(填“极性”或“非极性”)。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,可能的原因是___。
21.(1)在元素周期表中全部是金属元素的区域为______;按电子排布分区,属于p区的是______。
a.A b.B c.C d.D
(2)科学家常用“等电子体”来预测不同物质的结构,例如CH4与NH有相同的电子数和立体构型。依此原理在下表空格中填出相应的化学式:①_; ②_;③_______。
CH4 ① ③
NH ② N2
(3)某些共价键的键能数据如下表(单位:kJ·mol-1):
共价键 H—H Cl—Cl Br—Br H—Cl H—I I—I N≡N H—O H—N
键能 436 243 194 432 299 153 946 463 391
①把1 mol Cl2分解为气态原子时,需要__(填“吸收”或“放出”)___kJ能量。
②由表中所列化学键形成的单质分子中,最稳定的是___,最不稳定的是___;形成的化合物分子中最稳定的是___,最不稳定的是___。
22.在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O,根据等电子原理,CO分子的结构式为___________,1molCO2中含有的σ键数目为___________
三、元素或物质推断题
23.现有部分元素的性质与原子(或分子)结构的相关信息如表所示:
元素编号 元素性质与原子(或分子)结构的相关信息
T 最外层电子数是次外层电子数的 3 倍
X 常温下单质分子为双原子分子,分子中含有 3 对共用电子对
Y M 层比K 层少 1 个电子
Z 其离子是第三周期金属元素的离子中半径最小的
(1)T、X、Y、Z 形成的简单离子半径由大到小的顺序是_____。(用离子符号表示)
(2)元素 Y 与元素 Z 相比,金属性较强的是_____(用元素符号表示),下列表述中能 证明这一事实的是_____(填字母序号)。
a.Y 单质的熔点比 Z 单质的低
b.Y 的化合价比Z 的低
c.常温下Y 单质与水反应的程度很剧烈,而Z 单质在加热条件下才能与水反应
d.Y 最高价氧化物对应的水化物的碱性比 Z 的强
(3)T、X、Y、Z 中有两种元素能形成既含离子键又含非极性共价键的常见化合物,写出该化合物的电子式:________,元素 X 与氢元素以原子个数比 1∶2 化合形成常用于火箭燃料的化合物 W,写出 W 的电子式_______
(4)元素 T 和氢元素以原子个数比 1∶1 化合形成化合物 Q, Q 能与 W 发生氧化还原反应, 生成X 的单质和T 的另一种氢化物,写出该反应的化学方程式:_______
【参考答案】
一、选择题
1.A
解析:A.和均是仅由离子键构成的离子化合物,A正确;
B.中只有C-H极性共价键,B错误;
C.与的稳定性与分子内化学键强弱有关,与分子间作用力无关,C错误;
D.干冰升华为物理变化,克服的是分子间作用力,不克服共价键,D错误;
答案选A。
2.A
【分析】根据题目所给图象可推得,A为N元素、B为O元素、C为F元素、D为Cl元素、E为Si元素。
解析:A.同主族从上到下元素非金属性递减,非金属性越强,简单氢化物越稳定,则F、Cl元素气态氢化物稳定性HCl < HF,HF分子间有氢键,沸点比HCl高,A错误;
B.同周期从左到右主族元素非金属性递增,非金属性越强,对应阴离子的还原性越弱,N、O、F对应的简单氢化物的还原性HF < H2O < NH3,B正确;
C.中心原子价电子对数,中心原子价电子对数,则两分子的中心原子均为即杂化,但中有孤电子对,两者的键角大小不同,C正确;
D.分子中各原子均达8电子稳定结构,具有相同价电子数和相同原子数的分子或离子互为等电子体,则与CCl4互为等电子体,D正确;
综上,本题选A。
3.D
解析:A.很稳定是因为氧元素非金属性强,与氢结合的化学键较稳定,氢键是影响水的熔沸点,故A错误;
B.中心原子采用杂化,含有一对孤电子对,则其空间结构为V形,故B错误;
C.根据价层电子对互斥理论,的空间结构为正四面体形,键角为109°28′,中N原子采用杂化,中心原子有1对孤电子对,孤对电子对成对电子排斥力大于成对电子对成对电子的排斥力,因此键的键角小于109°28′,故C错误;
D.价层电子对数为2+2=4,、价层电子对数为4+0=4,中心原子价层电子对数为3+1=4,它们的VSEPR模型都是四面体形,故D正确。
综上所述,答案为D。
4.C
解析:A.分子中中心原子σ键数为2,孤电子对数为,空间结构为直线形,SO2分子中中心原子σ键数为2,孤电子对数为,空间结构为V形,故A错误;
B.分子中中心原子σ键数为3,孤电子对数为,空间结构为平面三角形,分子中中心原子σ键数为3,孤电子对数为,空间结构为三角锥形,故B错误;
C.中中心原子原子σ键数为4,孤电子对数为,空间结构为正四面体形,中中心原子σ键数为4,孤电子对数为,空间结构为正四面体形,故C正确;
D.分子中中心原子σ键数为3,孤电子对数为,空间结构为平面三角形,中中心原子σ键数为3,孤电子对数为,空间结构为三角锥形,故D错误;
故答案选C。
5.C
解析:A.s能级电子云形状是球形,p能级电子云形状是哑铃形,所以s-sσ键与s-pσ键的电子云形状不同,A错误;
B.已知电负性F>Cl>Br>I,故热稳定性:HF> HCl > HBr >HI,B错误;
C.具有下列电子排布式的原子中,①1s22s22p63s23p2即Si,②1s22s22p3即N,③1s22s22p2即C,④1s22s22p63s23p4即S,根据同一周期从左往右原子半径依次减小,同一主族从上往下原子半径依次增大可知,原子半径最大的是①,C正确;
D.根据逐级电离能数据,该元素的第三电离能剧增,说明最外层有2个电子,为第ⅡA族元素,与氯气反应时易失去最外层2个电子,形成X2+离子,其最高正价为+2价,D错误;
故答案为:C。
6.A
解析:A.键是电子云头对头形成的共价键,而π键是电子云肩并肩形成的共价键,键可以在分子中单独存在,但π键是与键同时出现的,不可单独存在,故A错误;
B.由两种元素组成的化合物中可既含有极性键,又含有非极性键,如H-C≡C-H分子中含有碳氢极性键和碳碳非极性键,故B正确;
C.二氧化碳分子的结构式为O=C=O,由结构式可知二氧化碳分子中含有两个键和两个π键,故C正确;
D.键能越大,其稳定性越强,氮气分子中含有氮氮三键,氧气分子中含有氧氧双键,氮氮三键的键能比氧氧双键的键能大,则氮气比氧气稳定,故D正确;
故选A。
7.A
解析:等电子体要具备两个条件:一是微粒的原子数相同,二是微粒的价电子数相同。分析可知A项正确,原子数均是5个,价电子数均是8个,C项中和Mg的价电子数不同,B、D项中的原子数不相同。
答案选A。
8.C
解析:A.与N、O、F以共价键相连的H能与N、O、F形成氢键,含有N、O、F原的分子不一定能形成分子间氢键,如氮气分子与氢气不能形成分子间氢键,选项A错误;
B.对羟基苯甲醛形成分子间氢键,而邻羟基苯甲醛形成分子内氢键,所以对羟基苯甲醛熔沸点高于邻羟基苯甲醛,选项B错误;
C.氨水中有4种氢键,氢键类型及其键能分别是:O—HN、O—HO、N-HN、N-HO,选项C正确;
D.甲烷分子中碳元素的非金属性弱,不能与水分子形成分子间氢键,所以甲烷水合物中甲烷与水之间不存在氢键,选项D错误;
答案选C。
9.D
【分析】分子或离子的中心原子为sp3杂化,且杂化轨道容纳1对孤电子对,中心原子的价电子数为3+1=4。
解析:A.CH4、NH3、H2O的中心原子价层电子对数都是4,都采用sp3杂化,CH4、NH3、H2O的中心原子上的孤电子对数分别是0、1、2,故A错误;
B.CO2、BBr3、中的中心原子价层电子对数分别是2、3、4,且CO2、BBr3、中孤电子对数分别是0、0、1,故B错误;
C.C2H4、SO2、BeCl2中的中心原子价层电子对数分别是3、3、2,且C2H4、SO2、BeCl2中孤电子对数分别是0、1、0,故C错误;
D.NH3、PCl3、H3O+的中心原子价层电子对数都是4,采用sp3杂化,中心原子上的孤电子对数都是1,故D正确;
故答案选D。
10.D
解析:A.甲醇能和水分子形成氢键,导致极易溶于水,故A不符合题意;
B.乙酸能形成氢键,导致其熔点比乙酸乙酯高,故B不符合题意;
C.氨分子间存在氢键,导致其沸点较高,故氨气易液化,故C不符合题意;
D.碘为非极性分子易溶于非极性溶剂四氯化碳,与氢键无关,故D符合题意;
故选D。
11.A
【分析】Z是元素周期表中电负性最大的元素,则Z为F。基态X原子中有3个未成对电子且其原子序数小于9,则X为N。根据原子序数大小关系,可判断Y为O。Y和W同主族,则W为S。常温下的最高价氧化物对应的水化物溶液的pH=12,说明R的最高价氧化物对应的水化物为强碱,R为K。
解析:A.Z为F,简单氢化物为HF,分子之间能形成氢键,A正确;
B.简单离子半径r(S2-)>r(K+),B错误;
C.O的非金属性大于S,简单氢化物的稳定性:H2O>H2S,C错误;
D.同周期从左往右第一电离能呈增大趋势,N为半充满电子排布,其第一电离能大于O,则第一电离能:,D错误;
故选A。
12.D
解析:A.碳酸钠俗称纯碱或苏打,A正确;
B.纯净的乙酸在温度较低时会由液态变为冰状固态,故又称冰醋酸,B正确;
C.结晶过程自由离子由相对无序状态转化为相对有序状态,混乱程度下降同时释放能量,C正确;
D.中与间存在离子键,C与H、C与O、H与O间存在极性共价键,C与C间存在非极性共价键,D错误;
故选D。
13.D
解析:A.大多数σ键比π键强度大,但是有个别反例,A错误;
B.金属元素的电负性一般小于1.8,非金属元素的电负性一般大于1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,B错误;
C.第八周期元素原子核外有8个电子层,根据排布规律,最后一种元素各层电子数为2、8、18、32、50、32、18、8,原子序数为168;第七周期元素原子核外有7个电子层,根据排布规律,最后一种元素各层电子数为2、8、18、32、32、18、8,原子序数为118,则第八周期元素种类数为168-118=50,C错误;
D.同一周期随着原子序数变大,第一电离能变大,但是镁原子价电子为3s2全满稳定状态,电离能大于相邻元素,故第一电离能:,D正确;
故选D。
14.A
解析:A.由结构可知,分子结构的中间存在过氧根,过氧根中氧为-1价氧,与每个硫相连的其它氧为-2价氧, A正确;
B.过氧根中氧氧键为非极性键,1个过硫酸根中含有12个极性共价键,中含极性共价键,B错误;
C.固体中含有K+和HSO两种离子,则固体中阴阳离子总数为,C错误;
D.没有说明是否为标况,不能计算生成氧气的体积,D错误;
故选A。
15.B
解析:A.H2SO4只有共价键,A错误;
B.NaOH既含有离子键,又含有共价键,B正确;
C.Na2O只有离子键,C错误;
D.H2O2只有共价键,D错误。
答案选B。
二、填空题
16. 正四面体 正四面体
解析:略
17.(1)
(2)羟基、醛基、醚键
(3)2,4—二甲基—3—乙基己烷
(4)4—甲基—2—乙基—1—戊烯
(5)醋酸分子能形成分子间氢键使分子间作用力增大,而硝酸分子间形成分子内氢键使分子间作用力减小,所以相对分子质量相近的醋酸分子和硝酸分子熔点相差较大
解析:(1)由同温同压下烷烃的蒸气密度是氢气的36可知,烷烃的相对分子质量为36×2=72,设烷烃的分子式为CnH2n+2,由相对分子质量可得:14n+2=72,解得n=5,则烷烃为戊烷,一氯代物只有一种的结构简式为,故答案为:;
(2)由结构简式可知,有机物分子中的官能团为羟基、醛基、醚键,故答案为:羟基、醛基、醚键;
(3)由结构简式可知,烷烃分子中最长碳链含有6个碳原子,侧链为2个甲基和1个乙基,名称为2,4—二甲基—3—乙基己烷,故答案为:2,4—二甲基—3—乙基己烷;
(4)由键线式可知,烯烃分子中含有碳碳双键的最长碳链含有5个碳原子,侧链为1个甲基和1个乙基,名称为4—甲基—2—乙基—1—戊烯,故答案为:4—甲基—2—乙基—1—戊烯;
(5)醋酸和硝酸都能形成氢键,醋酸分子能形成分子间氢键使分子间作用力增大,而硝酸分子间形成分子内氢键使分子间作用力减小,所以相对分子质量相近的醋酸分子和硝酸分子熔点相差较大,故答案为:醋酸分子能形成分子间氢键使分子间作用力增大,而硝酸分子间形成分子内氢键使分子间作用力减小,所以相对分子质量相近的醋酸分子和硝酸分子熔点相差较大。
18.(1) ④ ①③ ③
(2) ① ②
(3)B
(4)O>N>C>H>Ba
(5)
解析:(1)④中含有离子键和共价键,属于离子化合物;①②③中只含共价键,属于共价化合物,①③中中心原子采用sp3杂化,②中C原子采用sp杂化;中心原子价层电子对数是4且含有1个孤电子对的微粒分子空间构型是三角锥形,双氧水分子为书页形分子、二氧化碳分子为直线形分子、氨气分子为三角锥形分子,故答案为:④;①③;③;
(2)同种非金属元素之间存在非极性键,双氧水分子中存在O-O非极性键;共价单键为σ键,共价双键或三键中含有σ键和π键,二氧化碳的结构式为O=C=O,存在σ键和π键,故答案为:①;②;
(3)金属的第一电离能最小,该化合物中含有的元素是H、O、Ba,Ba易失电子,其第一电离能最小,故答案为:B;
(4)元素的非金属性越强,其电负性越大,这几种元素中非金属性强弱顺序是O>N>C>H>Ba,所以电负性大小顺序是O>N>C>H>Ba,故答案为:O>N>C>H>Ba;
(5)氮气分子中氮原子之间共用3对电子,电子式为;H2O2中结构式为H-O-O-H,电子式为;NaOH中存在钠离子和氢氧根离子,电子式为,故答案为:;;。
19. 直线形 正四面体形 平面三角形 平面正六边形
解析:中C原子有2对键电子对,孤电子对数为,则C原子采取杂化,为直线形分子。中原子有4对键电子对,孤电子对数为,则原子采取杂化,为正四面体形分子。中B原子有3对键电子对,孤电子对数为,则B原子采取杂化,为平面三角形分子。苯中每个C原子有3对键电子对,不含孤电子对,碳原子采取杂化,苯为平面正六边形分子。
20.(1) P 第三周期第ⅤA族 4s24p3 3
(2)>
(3) 三角锥型 极性
(4)GaF3是离子晶体,熔化时破坏的是离子键,键能较大,故熔点较高,而GaCl3是分子晶体,熔化时破坏的是分子间作用力,比较弱,故熔点较低
解析:(1)同一周期主族元素从左向右非金属性逐渐增强,同一主族元素从上向下非金属性逐渐减弱,因此非金属性最强的为P,位于元素周期表第三周期第ⅤA族;As的原子序数是33,其基态原子核外电子排布式为:1s22s22p63s23p63d104s24p3,最外层的电子排布式为:4s24p3,原子核外有3个未成对电子;
(2)同一周期主族元素从左向右原子半径逐渐减小,因此Ga的原子半径大于As;
(3)PH3的价层电子对数为,中心原子P采取sp3杂化,但有一对孤对电子,因此PH3的分子构型是三角锥型,而其正负电荷重心不重合,因此为极性分子;
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,可能的原因是:GaF3是离子晶体,熔化时破坏的是离子键,键能较大,故熔点较高,而GaCl3是分子晶体,熔化时破坏的是分子间作用力,比较弱,故熔点较低。
21. b cd C2H6 CO 吸收 243 N2 I2 H2O HI
解析:(1)在元素周期表中全部是金属元素的区域为B区;按电子排布分区,属于p区的是CD区;
故答案为:b;cd;
(2)含8个原子,电子对数为22,C2H6与其互为等电子体;含4个原子,电子数为32,与其互为等电子体;N2含2个原子,电子数为14,CO与其互为等电子体;
故答案为:C2H6;;CO;
(3)①化学键断裂要吸收能量,由表中数据可知把1mol Cl2分解为气态原子时,需要吸收243kJ的能量;
②键能越大,化学键越稳定,化学性质越稳定,所以最稳定的单质是N2;最不稳定的单质是I2;最稳定的化合物是H2O;最不稳定的化合物是HI。
22. C≡O 2NA
解析:N2与CO为等电子体,二者结构相似,N2的结构为N≡N,则CO的结构为C≡O,故答案为:C≡O;CO2的结构式为O=C=O,分子中C形成2个σ键,则1molCO2中含有的σ键数目为2×6.02×1023个,故答案为:2×6.02×1023(或2NA)。
三、元素或物质推断题
23. N3->O2->Na+>Al3+ Na cd 2H2O2+N2H4=N2+4H2O
【分析】T最外层电子数是次外层电子数的 3 倍,T为氧元素;X常温下单质分子为双原子分子,分子中含有 3 对共用电子对,X为氮元素;Y 的原子结构中M 层比K 层少 1 个电子,Y为钠元素;Z的离子是第三周期金属元素的离子中半径最小的,Z为铝元素。
解析:(1)根据元素周期律,电子层数相同时,序数小的离子半径大,则T、X、Y、Z 形成的简单离子半径由大到小的顺序是N3->O2->Na+>Al3+,故答案为:N3->O2->Na+>Al3+;
(2)根据元素周期律,同周期元素,金属性从左到右逐渐减弱,则钠的金属性比铝的金属性强;
a.熔点为物理性质,不能用熔点大小来比较金属性强弱,故a错误;
b.化合价可以衡量得失电子的数目,但不能用来说明是否容易得失电子,则不能通过钠和铝的化合价来说明钠和铝的金属性强弱,故b错误;
c.通过比较钠和铝与水反应的剧烈程度,可知钠比铝活泼,即钠的金属性强于铝,故c正确;
d.根据元素周期律,金属性强的元素对应的碱的碱性也强,故d正确;
综上所述,故答案为:Na;cd;
(3)由两种元素形成的既含有离子键又含有共价键的化合物为过氧化钠,其电子式为;氮元素与氢元素形成的化合物W为N2H4,可用于作火箭的燃料,其电子式为,故答案为:;;
(4)化合形成化合物 Q为双氧水,化合物W为N2H4,二者发生氧化还原反应生成氮气和水,其反应的化学方程式为2H2O2+N2H4=N2+4H2O,故答案为:2H2O2+N2H4=N2+4H2O
