第三章 铁 金属材料 测试题(含解析) 高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 第三章 铁 金属材料 测试题(含解析) 高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-03 20:44:33 | ||
图片预览



文档简介
第三章《铁金属材料》测试题
一、单选题(共12题)
1.实验室采用硫铁矿焙烧取硫后的烧渣(主要成分为、、,不考虑其他杂质)制取七水合硫酸亚铁(),其流程如图所示:
已知:①部分氢氧化物沉淀的如下表。
氢氧化物
开始沉淀的 2.7 6.4 3.7
完全沉淀的 3.7 8.4 4.7
②在时开始溶解,时完全溶解。
下列说法错误的是
A.操作③为将溶液2加热至有晶膜出现时,停止加热
B.加试剂X和加溶液控制,两步顺序不可以互换
C.操作①、②用到的玻璃仪器为烧杯、玻璃棒、漏斗
D.操作②中所调溶液的范围为
2.分别进行下表所示实验,实验现象和结论均正确的是( )
选项 实验操作 现象 结论
A 测量熔融状态下NaHSO4的导电性 能导电 熔融状态下NaHSO4能电离出Na+、H+、SO
B 向某溶液中先加入氯水,再滴加KSCN溶液 溶液变红色 溶液中含有Fe2+
C 向浓度均为0.1mol/L的MgSO4、CuSO4的混合溶液中逐滴加入NaOH溶液 先看到蓝色沉淀生成 Ksp[Cu(OH)2]D 将AlCl3溶液加热蒸干 得到白色固体 白色固体成分为纯净的AlCl3
A.A B.B C.C D.D
3.化学反应除了物质转化外还伴随着能量变化,下列实验现象正确的是
操作 现象
A 向装有碳酸氢钠固体的试管中滴加几滴水,将温度计插入其中,取出温度计,滴加2滴酚酞溶液 温度降低,酚酞溶液变浅红色
B 向装有少量Na2O2的试管中滴加水,触摸试管外壁,并立即将带火星的木条伸入试管 试管发热,有尖锐爆鸣声
C 将一块绿豆大小的钠投入预热的坩埚中,加热至钠熔化后,撤掉酒精灯 火焰呈黄绿色,生成黄色固体
D 向分别装有少量稀盐酸和NaOH溶液的两支试管中加入两片未打磨的铝片,触摸试管外壁,用点燃的木条放在试管口 两支试管外壁都发热,只有装稀盐酸的试管看到气泡,产生可燃的气体
A.A B.B C.C D.D
4.下列有关说法不正确的是( )
A.南朝·《竹林七贤与启荣期》砖画的砖块的主要成分是硅酸盐
B.《本草纲目》中“凡酸坏之酒,皆可蒸烧”,该实验方法可用于分离乙酸和乙酸乙酯
C.古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢是铁的合金
D.《本草经集注》中“以火烧之,紫青烟起,乃真硝石也”,对硝酸钾的鉴定过程中利用了硝酸钾的化学性质
5.将40.8gFe、FeO混合物置于纯氧中加热,迅速被氧化生成46.4g Fe3O4,则Fe、FeO的物质的量之比为
A.1:3 B.1:2 C.1:1 D.2:1
6.下列有关物质的性质与用途不具有对应关系的是
A.FeCl3溶液能与Cu反应,可用于蚀刻印刷电路
B.NaHCO3受热易分解,可用于制胃酸中和剂
C.C1O2具有氧化性,可用于自来水的杀菌消毒
D.液氨气化时吸收大的热,可用作制冷剂
7.16.8g NaHCO3和7.8gNa2O2在密闭容器中灼烧,充分反应后,将密闭容器保持温度为500℃,最后容器内物质是
A.Na2CO3,CO2,O2 B.Na2CO3,O2,水蒸气
C.Na2CO3,CO2,O2,水蒸气 D.NaHCO3,Na2CO3,O2
8.几种铁的氧化物的混合物加入100mL、7mol L-1的盐酸中。氧化物恰好完全溶解,在所得的溶液中通入0.56L(标况)氯气时,恰好使溶液中的Fe2+完全转化为Fe3+,则该混合物中铁元素的质量分数为
A.72.4% B.71.4% C.79.0% D.63.6%
9.化学与生产、生活和科学技术的发展有着密切的联系,下列说法正确的是
A.冬奥火炬中加入钠盐因发生化学变化而产生美丽的焰色,这是利用了金属元素的焰色试验
B.“司南之杓(勺),投之于地,其柢(勺柄)指南”,司南的“杓”中含有Fe3O4
C.活性炭净水的原理和“84”消毒液消毒的原理相同
D.用红外线照射Fe(OH)3胶体时,可以看到一条光亮的“通路”,这种现象叫做丁达尔效应
10.下图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系,下列说法不正确的是
A.铁与高温水蒸气的反应可实现上述转化①
B.FeO是一种黑色粉末,不稳定,在空气中受热,迅速转化成
C.由图可预测:高铁酸盐()具有强氧化性,可用于消毒。与水反应最终可生成胶体,从而吸附水中的悬浮物,故高铁酸盐可用作净水剂
D.加热发生转化⑥
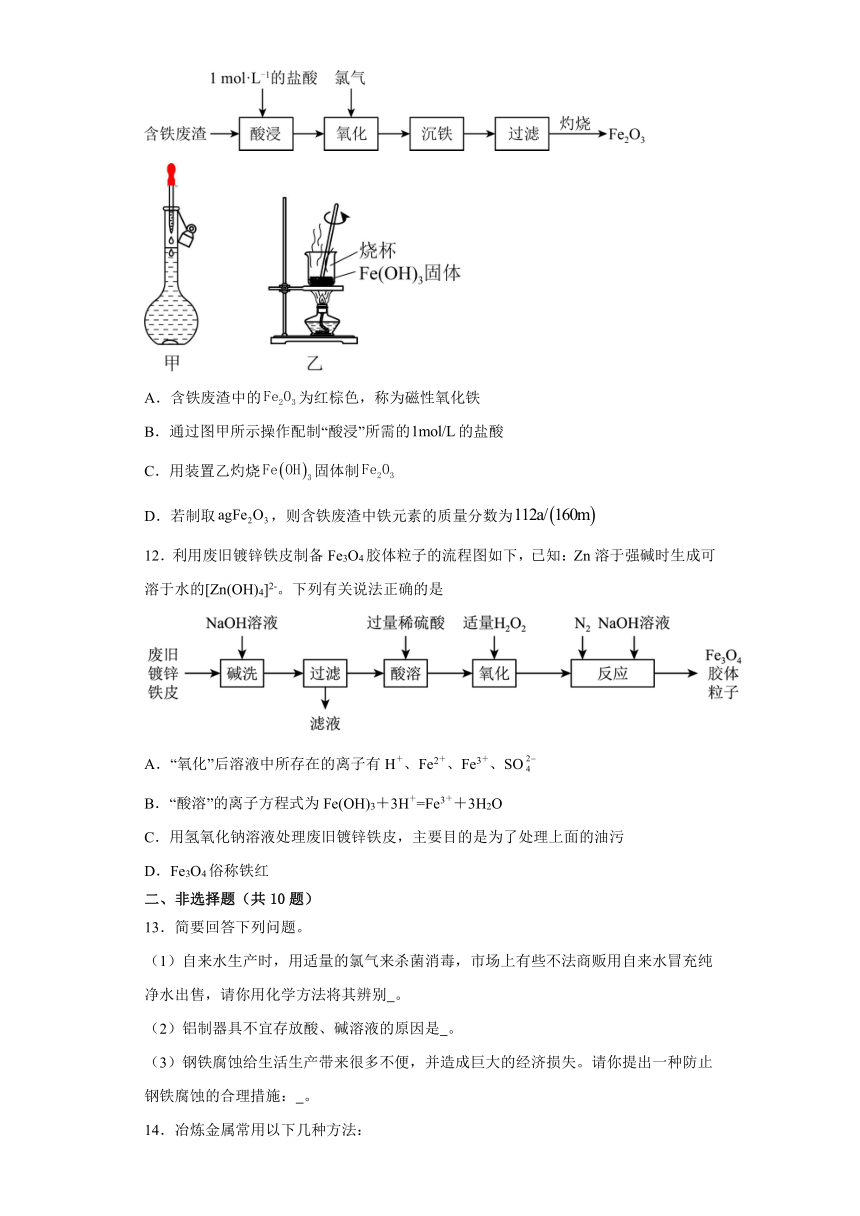
11.以含铁废渣(主要成分为,还含有等杂质)为原料制备的一种实验流程如图所示,下列说法正确的是
A.含铁废渣中的为红棕色,称为磁性氧化铁
B.通过图甲所示操作配制“酸浸”所需的的盐酸
C.用装置乙灼烧固体制
D.若制取,则含铁废渣中铁元素的质量分数为
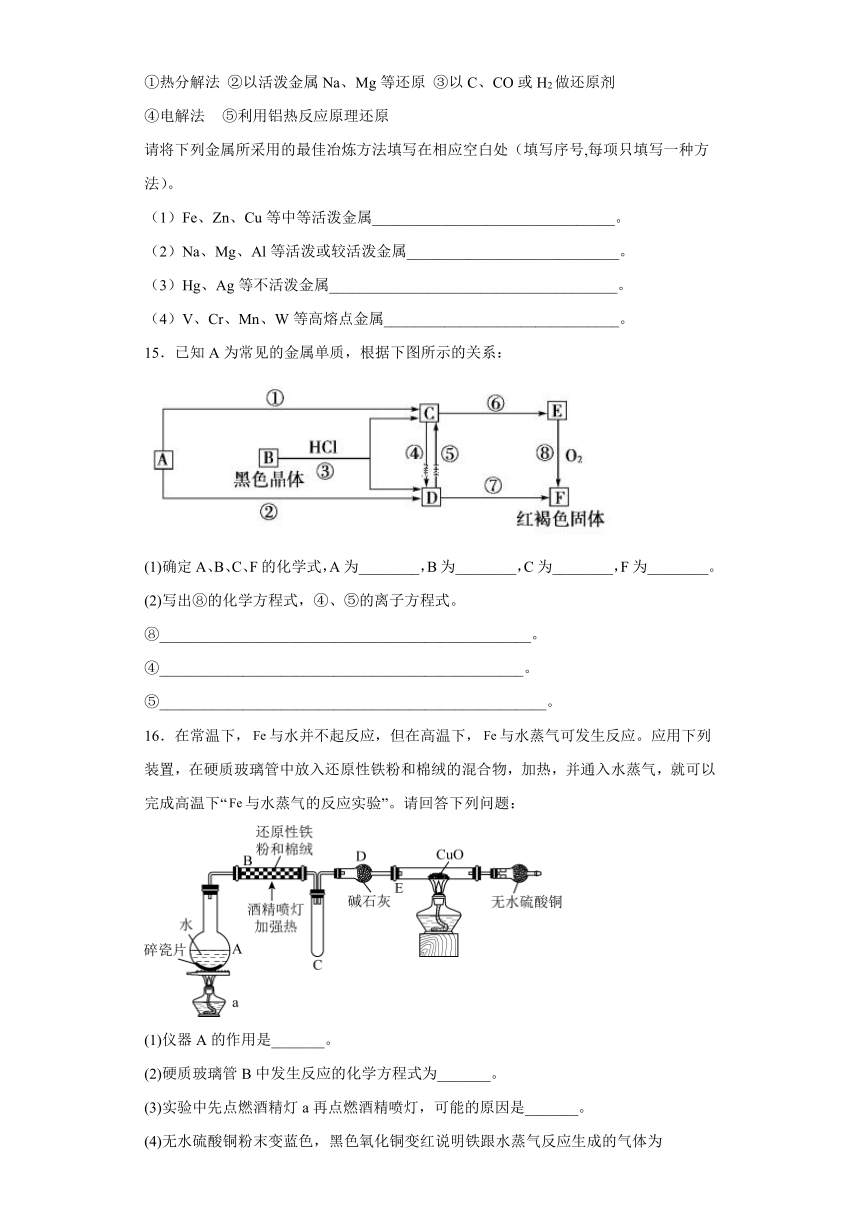
12.利用废旧镀锌铁皮制备Fe3O4胶体粒子的流程图如下,已知:Zn溶于强碱时生成可溶于水的[Zn(OH)4]2-。下列有关说法正确的是
A.“氧化”后溶液中所存在的离子有H+、Fe2+、Fe3+、SO
B.“酸溶”的离子方程式为Fe(OH)3+3H+=Fe3++3H2O
C.用氢氧化钠溶液处理废旧镀锌铁皮,主要目的是为了处理上面的油污
D.Fe3O4俗称铁红
二、非选择题(共10题)
13.简要回答下列问题。
(1)自来水生产时,用适量的氯气来杀菌消毒,市场上有些不法商贩用自来水冒充纯净水出售,请你用化学方法将其辨别 。
(2)铝制器具不宜存放酸、碱溶液的原因是 。
(3)钢铁腐蚀给生活生产带来很多不便,并造成巨大的经济损失。请你提出一种防止钢铁腐蚀的合理措施: 。
14.冶炼金属常用以下几种方法:
①热分解法 ②以活泼金属Na、Mg等还原 ③以C、CO或H2做还原剂
④电解法 ⑤利用铝热反应原理还原
请将下列金属所采用的最佳冶炼方法填写在相应空白处(填写序号,每项只填写一种方法)。
(1)Fe、Zn、Cu等中等活泼金属________________________________。
(2)Na、Mg、Al等活泼或较活泼金属____________________________。
(3)Hg、Ag等不活泼金属______________________________________。
(4)V、Cr、Mn、W等高熔点金属_______________________________。
15.已知A为常见的金属单质,根据下图所示的关系:
(1)确定A、B、C、F的化学式,A为________,B为________,C为________,F为________。
(2)写出⑧的化学方程式,④、⑤的离子方程式。
⑧_________________________________________________。
④________________________________________________。
⑤___________________________________________________。
16.在常温下,与水并不起反应,但在高温下,与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原性铁粉和棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“与水蒸气的反应实验”。请回答下列问题:
(1)仪器A的作用是_______。
(2)硬质玻璃管B中发生反应的化学方程式为_______。
(3)实验中先点燃酒精灯a再点燃酒精喷灯,可能的原因是_______。
(4)无水硫酸铜粉末变蓝色,黑色氧化铜变红说明铁跟水蒸气反应生成的气体为_______(填化学式)。
(5)某同学利用反应后的固体物质进行如下实验:
①某同学发现实验中加入过量新制氯水,放置一段时间后,深红色会逐渐褪去,褪色后的溶液中继续滴加溶液,又出现红色,则褪色的原因可能是_______。
②该同学想用高锰酸钾酸性溶液检验淡黄色溶液中是否含有离子,写出检验反应的离子方程式_______。
③该同学想用淡黄色溶液制溶液,可加入过量的_______,写出该反应离子反应方程式_______。
(6)以物质的类别为横坐标,化合价为纵坐标绘制的图象叫价类图。如下图是铁的价类图,Y物质为_______,写出Y在潮湿的空气中转化为图中同类别物质的化学方程式_______。
17.某研究性学习小组请你参与“铁及其化合物”有关性质的实验探究,并共同解答下列问题:
探究一
(1)将FeCl3溶液滴入沸水可以制得Fe(OH)3胶体,写出其离子反应__。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式__。
工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
根据上述设计方案并结合所学知识回答以下问题。
(3)检验滤液E中金属阳离子的方法是__。
(4)通入F发生反应的离子方程式为__。
探究二
FeBr2是一种黄绿色鳞片状的固体,某研究性小组需要90mL0.10mol·L-1FeBr2溶液,回答下列问题:
(1)配制FeBr2溶液除烧杯、量筒、玻璃棒、胶头滴管外还需的玻璃仪器是__。
(2)用托盘天平称量FeBr2的质量为__g。
(3)下列有关配制过程中说法正确的是__(填序号)。
a.用“左码右物”的称量方法称量固体质量(使用游码)会偏大
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
C.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
探究三
制备Fe(OH)2,在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂来制备。
(1)实验开始时(活塞f关闭),止水夹e是__(填“打开”或“关闭”)的。
(2)如何检验装置内空气已经排尽?__。
(3)排尽装置内空气后,为了制得白色Fe(OH)2沉淀,操作步骤是__。
(4)开启活塞f放掉约液体,此时装置B中试剂瓶中发生的化学反应方程式为__。
(5)下列各图示中__(填序号)能较长时间看到Fe(OH)2白色沉淀。
18.铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
氯化铁:熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。氯化亚铁:熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁(铁粉足量)。请回答下列问题:
(1)在装置A中,用与浓盐酸反应制取氯气,写出反应的离子方程式_______。
(2)B装置的作用_______。
(3)D中装的药品是_______,其作用是吸收未反应的,防止污染环境;同时防止空气中的水进入装置C,使潮解。
(4)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有,可用下列试剂中的_______(只能选取一种试剂,填序号)进行检测。
①溶液 ②酸性溶液 ③溶液 ④淀粉溶液
(5)定量分析。取装置C中的产物,按以下步骤进行测定:
①称取产品溶于过量的稀盐酸中;
②加入足量溶液;
③再加入足量溶液;
④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为。
则该样品中铁元素的质量分数为_______%(结果精确到小数点后两位)。
(6)由(5)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量_______(填“相等”“偏高”或“偏低”),说明含有杂质。
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是_______。
19.将7.8g Na2O2投入一定量的水中,完全反应后得到溶液的体积为500mL,计算:
(1)生成气体在标准状况下的体积____
(2)反应后溶液的物质的量浓度(本题要求写出计算过程)_____
20.Ⅰ.已知1.28 g某气体氧化物(化学式为RO2)在标准状况下的体积为448mL。
(1)该氧化物的摩尔质量为____。
(2)R的相对原子质量为___。
(3)与3.6 g 水含有相同数目氧原子的该气体在标准状况下的体积为____。
Ⅱ.一氧化碳和二氧化碳的混合气体18g,完全燃烧后测得二氧化碳的体积为11.2L(标准状况)。试求:
(1)混合气体中一氧化碳的质量。___
(2)混合气体中二氧化碳在标准状况下的体积。(请写出计算过程)___
21.将70克由Na2O2和Na2O组成的混合物跟98克H2O充分反应后,所得NaOH溶液中溶质的质量分数为50%。(注意:无计算过程不给分)
(1)求原混合物中过氧化钠和氧化钠的质量___________;
(2)产生的气体标况下体积___________。
22.由短周期元素组成的三种单质A、B、C和甲、乙、丙、丁四种化合物有下图所示转化关系,甲是典型的两性氧化物,也是工业上制取A的主要原料。
请回答:
(1)写出下列物质的化学式:单质C__________,化合物甲___________。
(2)写出A与NaOH溶液反应生成乙和C的化学方程式____________。
(3)写出丁与氨水反应的离子方程式_____________。
(4)写出上述反应中既属于氧化还原反应,又属于化合反应的反应方程式,并表示出电子转移的方向和数目_____________。
参考答案:
1.A
烧渣先与稀硫酸反应,其中的二氧化硅不反应,过滤之后进入到固体1,氧化铁和氧化铝反应生成了硫酸铁和硫酸铝,过滤之后进入溶液1,向溶液1中加入单质铁,将硫酸铁反应生成硫酸亚铁,再加入氢氧化钠控制pH除去铝离子,最后经过加热浓缩、降温结晶、过滤制得硫酸亚铁晶体。
A. 操作③为蒸发浓缩、降温结晶、过滤,故A错误;
B.因亚铁离子与氢氧化钠溶液反应生成沉淀,则加试剂X和氢氧化钠溶液控制pH,两步顺序不可以互换,B正确;
C.操作①、②都为过滤,用到的玻璃仪器为烧杯、玻璃棒、漏斗,C正确;
D. 保证铝离子全部沉淀,且氢氧化铝在pH=7.8时开始溶解,则操作②中所调节的溶液pH范围为4.7≤pH<7.8,D正确;
故选A。
2.C
A.化合物受热融化,只能破坏离子键,不能破坏共价键,硫酸氢钠是离子化合物,熔融状态下硫酸氢钠电离产生钠离子和硫酸氢根离子,故A错误;
B.向某溶液中先加入氯水,再滴加KSCN溶液,溶液变红色,说明滴加氯水后的溶液中含有铁离子,不能证明溶液中铁离子是原来就含有还是亚铁离子反应产生的,故B错误;
C.氢氧化镁、氢氧化铁的类型相同,向浓度均为0.1mol/L的硫酸镁、硫酸铜的混合溶液中逐滴加入氢氧化钠溶液,首先看到产生蓝色沉淀,说明,故C正确;
D.氯化铝是强酸弱碱盐,铝离子在溶液中水解生成氢氧化铝和氯化氢,将溶液加热蒸干,氯化氢受热挥发,水解平衡向正反应方向移动,最后得到的固体为氢氧化铝固体,故D错误;
故选C。
3.A
A.碳酸氢钠溶于水吸热,且呈碱性,现象正确,A项正确;
B.过氧化钠和水反应生成氧气,将带火星的木条伸入试管后,木条复燃,没有尖锐的爆鸣声,B项错误;
C.钠在空气中燃烧,产物为过氧化钠,火焰为黄色,生成淡黄色固体,C项错误;
D.未打磨的铝片上层为氧化铝,和盐酸,氢氧化钠反应,先生成水,三氧化二铝反应完后,铝片和盐酸,氢氧化钠反应,产生氢气,D项错误;
答案选A。
4.D
A.砖是由黏土等烧制而成的,主要成分为硅酸盐,故A正确;
B.由“皆可蒸烧”可知,与混合物的沸点有关,用到的实验操作方法是蒸馏,而分离乙酸和乙酸乙酯的操作为蒸馏,故B正确;
C.由“以剂钢为刃,柔铁为茎干”可知,主要成分为Fe,则剂钢指的是铁的合金,故C正确;
D.“以火烧之,紫青烟起,乃真硝石也”利用钾元素的焰色反应鉴定KNO3,焰色反应是物理变化,体现硝酸钾的物理性质,故D错误;
故答案为D。
5.A
46.4g Fe3O4中,n(Fe3O4)==0.2mol,则n(Fe)=0.6mol;40.8gFe、FeO混合物中,n(Fe)=0.6mol,m(Fe)=0.6mol×56g/mol=33.6g,m(O)=40.8g-33.6g=7.2g,n(FeO)=n(O)==0.45mol,则n(Fe)=0.6mol-0.45mol=0.15mol,Fe、FeO的物质的量之比为0.15mol : 0.45mol=1 : 3,故选A。
6.B
A.FeCl3溶液能与Cu反应生成氯化亚铁和氯化铜,可用于蚀刻印刷电路,A正确;
B.NaHCO3受热易分解,且水溶液呈弱碱性,可用于制胃酸中和剂是因为水溶液呈弱碱性而不是受热易分解,B错误;
C.一般具有强氧化性的物质可以杀菌消毒,C1O2具有氧化性,可用于自来水的杀菌消毒,C正确;
D.液氨气化时需要吸收大的热,故可用作制冷剂,D正确;
答案选B。
7.B
设反应生成二氧化碳xg,水蒸气yg;根据反应:2NaHCO3Na2CO3+CO2↑+H2O反应可知:,解之得到:x=4.4g,y=1.8g;根据2CO2+2Na2O2=2Na2CO3+O2反应可知:88:156=4.4:7.8,即7.8gNa2O2恰好与NaHCO3分解产生的4.4g二氧化碳完全反应生成碳酸钠和氧气,还有剩余的水蒸气,所以最后容器内物质是Na2CO3,O2,水蒸气;
故选B。
8.B
铁的氧化物和盐酸恰好反应生成氯化物,根据电荷守恒,氧化物中氧原子的物质的量=0.1×7/2=0.35摩尔,氯气的物质的量为0.56/22.4=0.025摩尔,根据电子守恒,混合物中的+2价铁的物质的量为0.025×2/1=0.05摩尔,根据电荷守恒分析,混合物中+3价铁的物质的量为(0.35×2-0.05×2)/3=0.2摩尔,则混合物中铁元素的质量分数=(0.05+0.2)×56/[(0.05+0.2)×56+0.35×16]=71.4%,选B。
9.B
A.金属元素的焰色试验是物理变化,没有发生化学变化,A错误;
B.“司南之杓(勺),投之于地,其柢(勺柄)指南”,司南的“杓”中含有磁性Fe3O4,B正确;
C.活性炭净水是利用活性炭的吸附性,“84”消毒液消毒是利用次氯酸的强氧化性,二者原理不同,C错误;
D.红外线是不可见光,无法看到一条光亮的“通路”,D错误;
故选:B。
10.A
A.铁与高温水蒸气的反应生成Fe3O4,故A错误;
B.FeO是一种黑色粉末,它不稳定,在空气中加热,就迅速被氧化成四氧化三铁,故B正确;
C.由图可知,高铁酸盐()具有强氧化性,可用于消毒。与水反应最终可生成胶体,从而吸附水中的悬浮物,故高铁酸盐可用作净水剂,故C正确;
D.加热生成Fe2O3,故D正确;
故选A。
11.D
含铁废渣中加入1mol/L的盐酸酸浸,FeO、Fe2O3、Al2O3分别与盐酸反应生成Fe2+、Fe3+、Cu2+,然后通入氯气氧化,Fe2+被氧化为Fe3+,再加入过量的氢氧化钠溶液沉铁,Fe3+转化为Fe(OH)3沉淀,而不沉淀Cu2+,过滤得到氢氧化铁,最后灼烧Fe(OH)3获得Fe2O3,以此分析解答。
A.磁性氧化铁为Fe3O4,故A错误;
B.定容时胶头滴管不能伸入容量瓶中,图示操作方法不合理,故B错误;
C.灼烧Fe(OH)3固体制Fe2O3时需要坩埚中进行,不能在烧杯中灼烧,图示操作方法不合理,故C错误;
D.的物质的量为,m(Fe)= n(Fe) M=,根据铁元素质量守恒,mg铁废渣中铁元素的质量分数为,故D正确;
故选:D。
12.A
废旧镀锌铁皮中含有Zn、Fe,经过氢氧化钠溶液碱洗后,Zn溶于强碱时生成[Zn(OH)4]2-,Fe不溶解,过滤后向滤渣中加入过量稀硫酸生成FeSO4,加入适量H2O2溶液,部分Fe2+被氧化为Fe3+,然后向溶液中通入N2,并加入NaOH溶液,经过反应得到Fe3O4胶体粒子。
A.“氧化”过程中部分Fe2+被氧化为Fe3+,“酸溶”过程中所加硫酸过量,因此“氧化”后溶液中所存在的离子有:H+、Fe2+、Fe3+、SO,故A正确;
B.“酸溶”时,Fe与稀硫酸生成FeSO4,反应的离子方程式为Fe+2H+=Fe2++H2↑,故B错误;
C.经过氢氧化钠溶液碱洗后,Zn溶于强碱时生成[Zn(OH)4]2-,Fe不溶解,故用氢氧化钠溶液处理废旧镀锌铁皮,主要目的是便于分离提纯铁,故C错误;
D.Fe2O3俗称铁红,故D错误;
故答案为A。
13.(1)取少量市售纯净水,滴加硝酸银溶液,若无白色浑浊生成,则为纯净水;若有白色浑浊生成,则为假冒纯净水。(其他合理答案也给分)
(2)酸、碱与铝表面的氧化膜反应,使金属溶解
(3)涂油漆、镀上保护层、制成不锈钢等
试题分析:
(1)自来水生产时,用适量的氯气来杀菌消毒,则水中会产生氯离子,加入硝酸银溶液可产生白色沉淀,则辨别方法是:取少量市售纯净水,滴加硝酸银溶液,若无白色浑浊生成,则为纯净水;若有白色浑浊生成,则为假冒纯净水。
(2)铝制器具存放酸、碱溶液,酸、碱与铝表面的氧化膜反应,使金属溶解。
(3)防止钢铁腐蚀的合理措施:涂油漆、镀上保护层、制成不锈钢等。
考点:化学在生活中的应用
14. ③ ④ ① ⑤
(1)Fe、Zn、Cu等中等活泼金属一般采用以C、CO或H2做还原剂,即答案选③;
(2)Na、Mg、Al等活泼或较活泼金属,采用电解法,答案选④;
(3)Hg、Ag等不活泼金属,采用热分解法,答案是①;
(4)V、Cr、Mn、W等高熔点金属,采用铝热反应,答案选⑤。
15. Fe Fe3O4 FeCl2 Fe(OH)3 4Fe(OH)2+O2+2H2O===4Fe(OH)3 2Fe2++Cl2===2Cl-+2Fe3+ Fe+2Fe3+===3Fe2+
红褐色固体为氢氧化铁,说明转化关系中含有铁元素,则A为铁。B为黑色晶体,为四氧化三铁。结合转化关系图解答。
红褐色固体为氢氧化铁,说明转化关系中含有铁元素,则A为铁。B为黑色晶体,为四氧化三铁,B和盐酸反应生成氯化亚铁和氯化铁,根据转化关系分析,D为氯化铁,C为氯化亚铁,E为氢氧化亚铁。则
(1)根据以上分析,A为Fe,B为Fe3O4,C为FeCl2,F为Fe(OH)3;
(2)反应⑧为氢氧化亚铁和氧气、水反应生成氢氧化铁,方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
反应④为亚铁离子被氯气氧化生成铁离子,离子方程式为:2Fe2++Cl2=2Fe3++2Cl—;
反应⑤为铁离子变成亚铁离子,离子方程式为:2Fe3++Fe=3Fe2+。
16.(1)为B中的反应提供水蒸气
(2)
(3)防止铁粉被装置中的空气(或氧气)氧化
(4)
(5) 被过量的氯水氧化 铁粉
(6)
根据实验铁粉与水蒸气在高温下反应生成Fe3O4和H2,A装置水蒸气的产生装置,B为铁粉与水蒸气反应的装置,C安全瓶,D为氢气的干燥装置,E和无水硫酸铜,为氢气的检验装置,以此来解析;
(1)仪器A的名称为圆底烧瓶;
(2)硬质玻璃管B中发生的反应为铁与水蒸气的反应生成Fe3O4和H2,反应方程式为3Fe+4H2O(g)Fe3O4+4H2(g);
(3)加热时铁能够与氧气反应,反应前应该先将装置内的空气排尽;
(4)无水硫酸铜粉末变蓝色,说明反应产生了水,黑色氧化铜变红,说明有还原性性气体参与反应,根据元素守恒可知铁跟水蒸气反应生成的气体为H2;
(5)①褪色后的溶液中继续滴加KSCN溶液,又出现红色,说明三价铁离子仍然存在,褪色的原因是硫氰化钾具有还原性,能够被氯气氧化;
②酸性高锰酸钾与亚铁离子发生氧化还原反应生成铁离子和锰离子,根据锰的化合价由+7价降低为+2价,铁的化合价由+2价升高为+3价,根据化合价升降守恒和原子守恒和电荷守恒配平的离子方程式为:5Fe2++MnO+8H+=5Fe3++Mn2++4H2O;
③淡黄色溶液为铁离子,铁离子的化合价为+3价,变为二价铁,化合价降低,需要加还原价,加入铁,反应的离子方程式为:2Fe3++Fe=3Fe2+;
(6)根据铁的价类图,Y物质为碱且为+2价,且为铁,所以为Fe(OH)2;Fe(OH)2在潮湿的空气中转化为同类别的物质只能为Fe(OH)3,铁的化合价由+2价变为+3价,化合价升高,需要氧化剂,潮湿的空气中有氧气氧化,反应的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
17. Fe3++3H2OFe(OH)3(胶体)+3H+ 2Fe3++Cu=2Fe2++Cu2+ 取少量滤液E于试管中,先加KSCN溶液,无现象,再加新制氯水,溶液变为血红色,则滤液E中含有Fe2+ 2Fe2++Cl2=2Fe3++2Cl- 100mL容量瓶 2.2 C 打开 检验B装置导管出口处排出的氢气的纯度,当排出的H2纯净时,空气已排尽 关闭e 4Fe(OH)2+O2+2H2O=4Fe(OH)3 ①②③
探究一(1)将FeCl3溶液滴入沸水可以生成Fe(OH)3胶体和氯化氢,反应离子方程式是Fe3++3H2OFe(OH)3(胶体)+3H+;
(2)FeCl3溶液与铜反应生成氯化亚铁和氯化铜,反应的离子方程式是2Fe3++Cu=2Fe2++Cu2+;
(3)根据分析,滤液E中的溶质是氯化亚铁,检验滤液E中亚铁离子的方法是:取少量滤液E于试管中,先加KSCN溶液,无现象,再加新制氯水,溶液变为血红色,则滤液E中含有Fe2+;
(4)氯化亚铁溶液通入氯气生成氯化铁,发生反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-。
探究二:(1)配制90mL0.10mol·L-1FeBr2溶液,需要选用规格为100mL的容量瓶,用天平称取一定质量的溴化亚铁,在烧杯中溶解,并用玻璃棒搅拌,冷却后用玻璃棒引流转移到100mL的容量瓶中,洗涤烧杯、玻璃棒2~3次,并把洗涤液转移到容量瓶,向容量瓶中加水,液面离刻度线1~2cm时改用胶头滴管加水至刻度线,摇匀,配制过程中需要使用的仪器为:烧杯、玻璃棒、胶头滴管,还缺少的仪器为100mL容量瓶;
(2)配制90mL0.10mol·L-1FeBr2溶液,需要选用规格为100mL的容量瓶,m=0.10mol·L-1×0.1L×216g/mol≈2.2g,用托盘天平称量FeBr2的质量为2.2g;
(3)a.根据“左=右+游”,用“左码右物”的称量方法称量固体质量(使用游码)会偏小,故a错误;
b.将称量的FeBr2放入烧杯中,加少量蒸馏水溶解,故b错误;
c.为保证溴化亚铁完全移入容量瓶,洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中,故c正确;
d.容量瓶不能长期保存配制好的溶液,故d错误;
e.定容时,仰视容量瓶刻度线,溶液体积偏大,会使配制的FeBr2溶液浓度偏低,故e错误;选c;
探究三:(1)实验开始时要用氢气排出B中的空气,(活塞f关闭),所以止水夹e是打开的。
(2)检验B装置导管出口处排出的氢气的纯度,当排出的H2纯净时,空气已排尽。
(3)排尽装置内空气后,关闭e,A中的硫酸亚铁被压入B,与氢氧化钠反应生成氢氧化亚铁沉淀 ;
(4)开启活塞f放掉约液体,空气进入B,氢氧化亚铁被氧化为氢氧化铁,此时装置B中发生反应的方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(5)①试管内生成氢气排出空气,氢氧化亚铁与空气隔绝,能较长时间看到Fe(OH)2白色沉淀;②试管A内生成氢气排出B中的空气,氢氧化亚铁与空气隔绝,能较长时间看到Fe(OH)2白色沉淀;③苯隔绝空气,氢氧化亚铁与氧气隔绝,能较长时间看到Fe(OH)2白色沉淀;故选①②③。
18.(1)
(2)干燥氯气
(3)碱石灰
(4)②
(5)35.74
(6) 偏高 在AB装置间增加一个盛有饱和食盐水的洗气瓶,除去Cl2中的HCl
(1)用与浓盐酸反应制取氯气,离子方程式为:;
(2)氯化铁易吸收空气中的水分而潮解,需除去Cl2中的水蒸气,所以装置B中浓硫酸的作用是干燥氯气;
(3)D中装的药品是碱石灰,碱石灰主要成分是固体氢氧化钠和氧化钙,可用于吸收未反应的氯气,同时防止空气中水蒸气进入装置C中,使氯化铁潮解;
(4)具有还原性,能使酸性高锰酸钾溶液褪色,故可以用酸性高锰酸钾溶液检验产物中是否混有,答案选②;
(5)红棕色固体为Fe2O3,,则该样品中铁元素的质量分数为;
(6)①氯化铁中铁元素的质量分数小于氯化亚铁中铁元素的质量分数,用题目所给的装置制得的产物中若铁元素含量偏高,说明含有氯化亚铁;
②炽热铁粉与氯化氢反应生成氯化亚铁,要得到较纯净的无水氯化铁,故需除去Cl2中的HCl,改进措施是在AB装置间增加一个盛有饱和食盐水的洗气瓶,除去Cl2中的HCl。
19. 1.12L 0.4 mol·L-1
(1)Na2O2投入一定量的水中,反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,7.8gNa2O2的物质的量为,则生成0.05molO2,在标准状况下的体积为0.05mol×22.4L/mol=1.12L;
(2)反应后溶液的溶质为NaOH,物质的量为0.2mol,则溶液的物质的量浓度c=。
20. 64g·mol-1 32 2.24L 7g 5.6L
Ⅰ.(1)标准状况下448mL气体的物质的量为0.02mol,则该气体氧化物的摩尔质量为:1.28g/0.02mol=64g/mol。
(2)R的相对原子质量为64-2×16=32。
(3)3.6g水的物质的量为3.6g/18g·mol-1=0.2mol。含有的氧原子的物质的量为0.2moL。含有0.2mol氧原子的RO2的物质的量为0.1mol,在标准状况下的体积为0.1mol×22.4L/mol=2.24L。
Ⅱ.标准状况下11.2L二氧化碳的物质的量为0.5moL。设原混合气中二氧化碳的物质的量为x,一氧化碳的物质的量为y。则有x+y=0.5,44x+28y=18。解得x=0.25,y=0.25。
(1)0.25molCO的质量为0.25mol×28g/mol=7g。
(2)0.25molCO2在标准状况下的体积为0.25mol×22.4L/mol=5.6L。故答案为标准状况下11.2L二氧化碳的物质的量为0.5moL。设原混合气中二氧化碳的物质的量为x,一氧化碳的物质的量为y。则有x+y=0.5,44x+28y=18。解得x=0.25,y=0.25。0.25molCO2在标准状况下的体积为0.25mol×22.4L/mol=5.6L。
21. m(Na2O2)=39g,m(Na2O)=31g 5.6L
解:设混合物中Na2O2和Na2O的物质的量各为x、y,则
所以有x×78g/mol+y×62g/mol=70g、×100%=50%
解得:x=05mol、y=05mol。
因此(1)m(Na2O2)=05mol×78g/mol=39g,m(Na2O)=05mol×62g/mol=31g。
(2)n(O2)=0.25mol,则V(O2)=0.25mol×22.4L/mol=5.6L。
22. H2 Al2O3 2Al+2H2O+2NaOH=2NaAlO2+3H2↑ Al3+ +3NH3·H2O=Al(OH)3 ↓ +3NH4+
甲是典型的两性氧化物,甲既能与酸反应又能与碱反应,则甲为Al2O3,甲与氢氧化钠反应生成乙,则乙为NaAlO2,甲也是工业上制取A的主要原料,而A能与NaOH反应生成乙和C,故C为H2,A为Al,A与B反应生成氧化铝,则B为O2,甲与硫酸反应生成丁为AlCl3,丁与过量氨水反应生成丙为Al(OH)3。
(1)根据以上分析可知C是H2,甲是Al2O3;
(2)铝与氢氧化钠溶液反应的离子方程式为2Al+2H2O+2NaOH=2NaAlO2+3H2↑;
(3)丁与过量氨水反应的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
(4)上述反应中既属于氧化还原反应,又属于化合反应的是铝在氧气中燃烧生成氧化铝,可表示为。
一、单选题(共12题)
1.实验室采用硫铁矿焙烧取硫后的烧渣(主要成分为、、,不考虑其他杂质)制取七水合硫酸亚铁(),其流程如图所示:
已知:①部分氢氧化物沉淀的如下表。
氢氧化物
开始沉淀的 2.7 6.4 3.7
完全沉淀的 3.7 8.4 4.7
②在时开始溶解,时完全溶解。
下列说法错误的是
A.操作③为将溶液2加热至有晶膜出现时,停止加热
B.加试剂X和加溶液控制,两步顺序不可以互换
C.操作①、②用到的玻璃仪器为烧杯、玻璃棒、漏斗
D.操作②中所调溶液的范围为
2.分别进行下表所示实验,实验现象和结论均正确的是( )
选项 实验操作 现象 结论
A 测量熔融状态下NaHSO4的导电性 能导电 熔融状态下NaHSO4能电离出Na+、H+、SO
B 向某溶液中先加入氯水,再滴加KSCN溶液 溶液变红色 溶液中含有Fe2+
C 向浓度均为0.1mol/L的MgSO4、CuSO4的混合溶液中逐滴加入NaOH溶液 先看到蓝色沉淀生成 Ksp[Cu(OH)2]
A.A B.B C.C D.D
3.化学反应除了物质转化外还伴随着能量变化,下列实验现象正确的是
操作 现象
A 向装有碳酸氢钠固体的试管中滴加几滴水,将温度计插入其中,取出温度计,滴加2滴酚酞溶液 温度降低,酚酞溶液变浅红色
B 向装有少量Na2O2的试管中滴加水,触摸试管外壁,并立即将带火星的木条伸入试管 试管发热,有尖锐爆鸣声
C 将一块绿豆大小的钠投入预热的坩埚中,加热至钠熔化后,撤掉酒精灯 火焰呈黄绿色,生成黄色固体
D 向分别装有少量稀盐酸和NaOH溶液的两支试管中加入两片未打磨的铝片,触摸试管外壁,用点燃的木条放在试管口 两支试管外壁都发热,只有装稀盐酸的试管看到气泡,产生可燃的气体
A.A B.B C.C D.D
4.下列有关说法不正确的是( )
A.南朝·《竹林七贤与启荣期》砖画的砖块的主要成分是硅酸盐
B.《本草纲目》中“凡酸坏之酒,皆可蒸烧”,该实验方法可用于分离乙酸和乙酸乙酯
C.古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢是铁的合金
D.《本草经集注》中“以火烧之,紫青烟起,乃真硝石也”,对硝酸钾的鉴定过程中利用了硝酸钾的化学性质
5.将40.8gFe、FeO混合物置于纯氧中加热,迅速被氧化生成46.4g Fe3O4,则Fe、FeO的物质的量之比为
A.1:3 B.1:2 C.1:1 D.2:1
6.下列有关物质的性质与用途不具有对应关系的是
A.FeCl3溶液能与Cu反应,可用于蚀刻印刷电路
B.NaHCO3受热易分解,可用于制胃酸中和剂
C.C1O2具有氧化性,可用于自来水的杀菌消毒
D.液氨气化时吸收大的热,可用作制冷剂
7.16.8g NaHCO3和7.8gNa2O2在密闭容器中灼烧,充分反应后,将密闭容器保持温度为500℃,最后容器内物质是
A.Na2CO3,CO2,O2 B.Na2CO3,O2,水蒸气
C.Na2CO3,CO2,O2,水蒸气 D.NaHCO3,Na2CO3,O2
8.几种铁的氧化物的混合物加入100mL、7mol L-1的盐酸中。氧化物恰好完全溶解,在所得的溶液中通入0.56L(标况)氯气时,恰好使溶液中的Fe2+完全转化为Fe3+,则该混合物中铁元素的质量分数为
A.72.4% B.71.4% C.79.0% D.63.6%
9.化学与生产、生活和科学技术的发展有着密切的联系,下列说法正确的是
A.冬奥火炬中加入钠盐因发生化学变化而产生美丽的焰色,这是利用了金属元素的焰色试验
B.“司南之杓(勺),投之于地,其柢(勺柄)指南”,司南的“杓”中含有Fe3O4
C.活性炭净水的原理和“84”消毒液消毒的原理相同
D.用红外线照射Fe(OH)3胶体时,可以看到一条光亮的“通路”,这种现象叫做丁达尔效应
10.下图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系,下列说法不正确的是
A.铁与高温水蒸气的反应可实现上述转化①
B.FeO是一种黑色粉末,不稳定,在空气中受热,迅速转化成
C.由图可预测:高铁酸盐()具有强氧化性,可用于消毒。与水反应最终可生成胶体,从而吸附水中的悬浮物,故高铁酸盐可用作净水剂
D.加热发生转化⑥
11.以含铁废渣(主要成分为,还含有等杂质)为原料制备的一种实验流程如图所示,下列说法正确的是
A.含铁废渣中的为红棕色,称为磁性氧化铁
B.通过图甲所示操作配制“酸浸”所需的的盐酸
C.用装置乙灼烧固体制
D.若制取,则含铁废渣中铁元素的质量分数为
12.利用废旧镀锌铁皮制备Fe3O4胶体粒子的流程图如下,已知:Zn溶于强碱时生成可溶于水的[Zn(OH)4]2-。下列有关说法正确的是
A.“氧化”后溶液中所存在的离子有H+、Fe2+、Fe3+、SO
B.“酸溶”的离子方程式为Fe(OH)3+3H+=Fe3++3H2O
C.用氢氧化钠溶液处理废旧镀锌铁皮,主要目的是为了处理上面的油污
D.Fe3O4俗称铁红
二、非选择题(共10题)
13.简要回答下列问题。
(1)自来水生产时,用适量的氯气来杀菌消毒,市场上有些不法商贩用自来水冒充纯净水出售,请你用化学方法将其辨别 。
(2)铝制器具不宜存放酸、碱溶液的原因是 。
(3)钢铁腐蚀给生活生产带来很多不便,并造成巨大的经济损失。请你提出一种防止钢铁腐蚀的合理措施: 。
14.冶炼金属常用以下几种方法:
①热分解法 ②以活泼金属Na、Mg等还原 ③以C、CO或H2做还原剂
④电解法 ⑤利用铝热反应原理还原
请将下列金属所采用的最佳冶炼方法填写在相应空白处(填写序号,每项只填写一种方法)。
(1)Fe、Zn、Cu等中等活泼金属________________________________。
(2)Na、Mg、Al等活泼或较活泼金属____________________________。
(3)Hg、Ag等不活泼金属______________________________________。
(4)V、Cr、Mn、W等高熔点金属_______________________________。
15.已知A为常见的金属单质,根据下图所示的关系:
(1)确定A、B、C、F的化学式,A为________,B为________,C为________,F为________。
(2)写出⑧的化学方程式,④、⑤的离子方程式。
⑧_________________________________________________。
④________________________________________________。
⑤___________________________________________________。
16.在常温下,与水并不起反应,但在高温下,与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原性铁粉和棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“与水蒸气的反应实验”。请回答下列问题:
(1)仪器A的作用是_______。
(2)硬质玻璃管B中发生反应的化学方程式为_______。
(3)实验中先点燃酒精灯a再点燃酒精喷灯,可能的原因是_______。
(4)无水硫酸铜粉末变蓝色,黑色氧化铜变红说明铁跟水蒸气反应生成的气体为_______(填化学式)。
(5)某同学利用反应后的固体物质进行如下实验:
①某同学发现实验中加入过量新制氯水,放置一段时间后,深红色会逐渐褪去,褪色后的溶液中继续滴加溶液,又出现红色,则褪色的原因可能是_______。
②该同学想用高锰酸钾酸性溶液检验淡黄色溶液中是否含有离子,写出检验反应的离子方程式_______。
③该同学想用淡黄色溶液制溶液,可加入过量的_______,写出该反应离子反应方程式_______。
(6)以物质的类别为横坐标,化合价为纵坐标绘制的图象叫价类图。如下图是铁的价类图,Y物质为_______,写出Y在潮湿的空气中转化为图中同类别物质的化学方程式_______。
17.某研究性学习小组请你参与“铁及其化合物”有关性质的实验探究,并共同解答下列问题:
探究一
(1)将FeCl3溶液滴入沸水可以制得Fe(OH)3胶体,写出其离子反应__。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式__。
工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
根据上述设计方案并结合所学知识回答以下问题。
(3)检验滤液E中金属阳离子的方法是__。
(4)通入F发生反应的离子方程式为__。
探究二
FeBr2是一种黄绿色鳞片状的固体,某研究性小组需要90mL0.10mol·L-1FeBr2溶液,回答下列问题:
(1)配制FeBr2溶液除烧杯、量筒、玻璃棒、胶头滴管外还需的玻璃仪器是__。
(2)用托盘天平称量FeBr2的质量为__g。
(3)下列有关配制过程中说法正确的是__(填序号)。
a.用“左码右物”的称量方法称量固体质量(使用游码)会偏大
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
C.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
探究三
制备Fe(OH)2,在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂来制备。
(1)实验开始时(活塞f关闭),止水夹e是__(填“打开”或“关闭”)的。
(2)如何检验装置内空气已经排尽?__。
(3)排尽装置内空气后,为了制得白色Fe(OH)2沉淀,操作步骤是__。
(4)开启活塞f放掉约液体,此时装置B中试剂瓶中发生的化学反应方程式为__。
(5)下列各图示中__(填序号)能较长时间看到Fe(OH)2白色沉淀。
18.铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
氯化铁:熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。氯化亚铁:熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁(铁粉足量)。请回答下列问题:
(1)在装置A中,用与浓盐酸反应制取氯气,写出反应的离子方程式_______。
(2)B装置的作用_______。
(3)D中装的药品是_______,其作用是吸收未反应的,防止污染环境;同时防止空气中的水进入装置C,使潮解。
(4)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有,可用下列试剂中的_______(只能选取一种试剂,填序号)进行检测。
①溶液 ②酸性溶液 ③溶液 ④淀粉溶液
(5)定量分析。取装置C中的产物,按以下步骤进行测定:
①称取产品溶于过量的稀盐酸中;
②加入足量溶液;
③再加入足量溶液;
④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为。
则该样品中铁元素的质量分数为_______%(结果精确到小数点后两位)。
(6)由(5)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量_______(填“相等”“偏高”或“偏低”),说明含有杂质。
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是_______。
19.将7.8g Na2O2投入一定量的水中,完全反应后得到溶液的体积为500mL,计算:
(1)生成气体在标准状况下的体积____
(2)反应后溶液的物质的量浓度(本题要求写出计算过程)_____
20.Ⅰ.已知1.28 g某气体氧化物(化学式为RO2)在标准状况下的体积为448mL。
(1)该氧化物的摩尔质量为____。
(2)R的相对原子质量为___。
(3)与3.6 g 水含有相同数目氧原子的该气体在标准状况下的体积为____。
Ⅱ.一氧化碳和二氧化碳的混合气体18g,完全燃烧后测得二氧化碳的体积为11.2L(标准状况)。试求:
(1)混合气体中一氧化碳的质量。___
(2)混合气体中二氧化碳在标准状况下的体积。(请写出计算过程)___
21.将70克由Na2O2和Na2O组成的混合物跟98克H2O充分反应后,所得NaOH溶液中溶质的质量分数为50%。(注意:无计算过程不给分)
(1)求原混合物中过氧化钠和氧化钠的质量___________;
(2)产生的气体标况下体积___________。
22.由短周期元素组成的三种单质A、B、C和甲、乙、丙、丁四种化合物有下图所示转化关系,甲是典型的两性氧化物,也是工业上制取A的主要原料。
请回答:
(1)写出下列物质的化学式:单质C__________,化合物甲___________。
(2)写出A与NaOH溶液反应生成乙和C的化学方程式____________。
(3)写出丁与氨水反应的离子方程式_____________。
(4)写出上述反应中既属于氧化还原反应,又属于化合反应的反应方程式,并表示出电子转移的方向和数目_____________。
参考答案:
1.A
烧渣先与稀硫酸反应,其中的二氧化硅不反应,过滤之后进入到固体1,氧化铁和氧化铝反应生成了硫酸铁和硫酸铝,过滤之后进入溶液1,向溶液1中加入单质铁,将硫酸铁反应生成硫酸亚铁,再加入氢氧化钠控制pH除去铝离子,最后经过加热浓缩、降温结晶、过滤制得硫酸亚铁晶体。
A. 操作③为蒸发浓缩、降温结晶、过滤,故A错误;
B.因亚铁离子与氢氧化钠溶液反应生成沉淀,则加试剂X和氢氧化钠溶液控制pH,两步顺序不可以互换,B正确;
C.操作①、②都为过滤,用到的玻璃仪器为烧杯、玻璃棒、漏斗,C正确;
D. 保证铝离子全部沉淀,且氢氧化铝在pH=7.8时开始溶解,则操作②中所调节的溶液pH范围为4.7≤pH<7.8,D正确;
故选A。
2.C
A.化合物受热融化,只能破坏离子键,不能破坏共价键,硫酸氢钠是离子化合物,熔融状态下硫酸氢钠电离产生钠离子和硫酸氢根离子,故A错误;
B.向某溶液中先加入氯水,再滴加KSCN溶液,溶液变红色,说明滴加氯水后的溶液中含有铁离子,不能证明溶液中铁离子是原来就含有还是亚铁离子反应产生的,故B错误;
C.氢氧化镁、氢氧化铁的类型相同,向浓度均为0.1mol/L的硫酸镁、硫酸铜的混合溶液中逐滴加入氢氧化钠溶液,首先看到产生蓝色沉淀,说明,故C正确;
D.氯化铝是强酸弱碱盐,铝离子在溶液中水解生成氢氧化铝和氯化氢,将溶液加热蒸干,氯化氢受热挥发,水解平衡向正反应方向移动,最后得到的固体为氢氧化铝固体,故D错误;
故选C。
3.A
A.碳酸氢钠溶于水吸热,且呈碱性,现象正确,A项正确;
B.过氧化钠和水反应生成氧气,将带火星的木条伸入试管后,木条复燃,没有尖锐的爆鸣声,B项错误;
C.钠在空气中燃烧,产物为过氧化钠,火焰为黄色,生成淡黄色固体,C项错误;
D.未打磨的铝片上层为氧化铝,和盐酸,氢氧化钠反应,先生成水,三氧化二铝反应完后,铝片和盐酸,氢氧化钠反应,产生氢气,D项错误;
答案选A。
4.D
A.砖是由黏土等烧制而成的,主要成分为硅酸盐,故A正确;
B.由“皆可蒸烧”可知,与混合物的沸点有关,用到的实验操作方法是蒸馏,而分离乙酸和乙酸乙酯的操作为蒸馏,故B正确;
C.由“以剂钢为刃,柔铁为茎干”可知,主要成分为Fe,则剂钢指的是铁的合金,故C正确;
D.“以火烧之,紫青烟起,乃真硝石也”利用钾元素的焰色反应鉴定KNO3,焰色反应是物理变化,体现硝酸钾的物理性质,故D错误;
故答案为D。
5.A
46.4g Fe3O4中,n(Fe3O4)==0.2mol,则n(Fe)=0.6mol;40.8gFe、FeO混合物中,n(Fe)=0.6mol,m(Fe)=0.6mol×56g/mol=33.6g,m(O)=40.8g-33.6g=7.2g,n(FeO)=n(O)==0.45mol,则n(Fe)=0.6mol-0.45mol=0.15mol,Fe、FeO的物质的量之比为0.15mol : 0.45mol=1 : 3,故选A。
6.B
A.FeCl3溶液能与Cu反应生成氯化亚铁和氯化铜,可用于蚀刻印刷电路,A正确;
B.NaHCO3受热易分解,且水溶液呈弱碱性,可用于制胃酸中和剂是因为水溶液呈弱碱性而不是受热易分解,B错误;
C.一般具有强氧化性的物质可以杀菌消毒,C1O2具有氧化性,可用于自来水的杀菌消毒,C正确;
D.液氨气化时需要吸收大的热,故可用作制冷剂,D正确;
答案选B。
7.B
设反应生成二氧化碳xg,水蒸气yg;根据反应:2NaHCO3Na2CO3+CO2↑+H2O反应可知:,解之得到:x=4.4g,y=1.8g;根据2CO2+2Na2O2=2Na2CO3+O2反应可知:88:156=4.4:7.8,即7.8gNa2O2恰好与NaHCO3分解产生的4.4g二氧化碳完全反应生成碳酸钠和氧气,还有剩余的水蒸气,所以最后容器内物质是Na2CO3,O2,水蒸气;
故选B。
8.B
铁的氧化物和盐酸恰好反应生成氯化物,根据电荷守恒,氧化物中氧原子的物质的量=0.1×7/2=0.35摩尔,氯气的物质的量为0.56/22.4=0.025摩尔,根据电子守恒,混合物中的+2价铁的物质的量为0.025×2/1=0.05摩尔,根据电荷守恒分析,混合物中+3价铁的物质的量为(0.35×2-0.05×2)/3=0.2摩尔,则混合物中铁元素的质量分数=(0.05+0.2)×56/[(0.05+0.2)×56+0.35×16]=71.4%,选B。
9.B
A.金属元素的焰色试验是物理变化,没有发生化学变化,A错误;
B.“司南之杓(勺),投之于地,其柢(勺柄)指南”,司南的“杓”中含有磁性Fe3O4,B正确;
C.活性炭净水是利用活性炭的吸附性,“84”消毒液消毒是利用次氯酸的强氧化性,二者原理不同,C错误;
D.红外线是不可见光,无法看到一条光亮的“通路”,D错误;
故选:B。
10.A
A.铁与高温水蒸气的反应生成Fe3O4,故A错误;
B.FeO是一种黑色粉末,它不稳定,在空气中加热,就迅速被氧化成四氧化三铁,故B正确;
C.由图可知,高铁酸盐()具有强氧化性,可用于消毒。与水反应最终可生成胶体,从而吸附水中的悬浮物,故高铁酸盐可用作净水剂,故C正确;
D.加热生成Fe2O3,故D正确;
故选A。
11.D
含铁废渣中加入1mol/L的盐酸酸浸,FeO、Fe2O3、Al2O3分别与盐酸反应生成Fe2+、Fe3+、Cu2+,然后通入氯气氧化,Fe2+被氧化为Fe3+,再加入过量的氢氧化钠溶液沉铁,Fe3+转化为Fe(OH)3沉淀,而不沉淀Cu2+,过滤得到氢氧化铁,最后灼烧Fe(OH)3获得Fe2O3,以此分析解答。
A.磁性氧化铁为Fe3O4,故A错误;
B.定容时胶头滴管不能伸入容量瓶中,图示操作方法不合理,故B错误;
C.灼烧Fe(OH)3固体制Fe2O3时需要坩埚中进行,不能在烧杯中灼烧,图示操作方法不合理,故C错误;
D.的物质的量为,m(Fe)= n(Fe) M=,根据铁元素质量守恒,mg铁废渣中铁元素的质量分数为,故D正确;
故选:D。
12.A
废旧镀锌铁皮中含有Zn、Fe,经过氢氧化钠溶液碱洗后,Zn溶于强碱时生成[Zn(OH)4]2-,Fe不溶解,过滤后向滤渣中加入过量稀硫酸生成FeSO4,加入适量H2O2溶液,部分Fe2+被氧化为Fe3+,然后向溶液中通入N2,并加入NaOH溶液,经过反应得到Fe3O4胶体粒子。
A.“氧化”过程中部分Fe2+被氧化为Fe3+,“酸溶”过程中所加硫酸过量,因此“氧化”后溶液中所存在的离子有:H+、Fe2+、Fe3+、SO,故A正确;
B.“酸溶”时,Fe与稀硫酸生成FeSO4,反应的离子方程式为Fe+2H+=Fe2++H2↑,故B错误;
C.经过氢氧化钠溶液碱洗后,Zn溶于强碱时生成[Zn(OH)4]2-,Fe不溶解,故用氢氧化钠溶液处理废旧镀锌铁皮,主要目的是便于分离提纯铁,故C错误;
D.Fe2O3俗称铁红,故D错误;
故答案为A。
13.(1)取少量市售纯净水,滴加硝酸银溶液,若无白色浑浊生成,则为纯净水;若有白色浑浊生成,则为假冒纯净水。(其他合理答案也给分)
(2)酸、碱与铝表面的氧化膜反应,使金属溶解
(3)涂油漆、镀上保护层、制成不锈钢等
试题分析:
(1)自来水生产时,用适量的氯气来杀菌消毒,则水中会产生氯离子,加入硝酸银溶液可产生白色沉淀,则辨别方法是:取少量市售纯净水,滴加硝酸银溶液,若无白色浑浊生成,则为纯净水;若有白色浑浊生成,则为假冒纯净水。
(2)铝制器具存放酸、碱溶液,酸、碱与铝表面的氧化膜反应,使金属溶解。
(3)防止钢铁腐蚀的合理措施:涂油漆、镀上保护层、制成不锈钢等。
考点:化学在生活中的应用
14. ③ ④ ① ⑤
(1)Fe、Zn、Cu等中等活泼金属一般采用以C、CO或H2做还原剂,即答案选③;
(2)Na、Mg、Al等活泼或较活泼金属,采用电解法,答案选④;
(3)Hg、Ag等不活泼金属,采用热分解法,答案是①;
(4)V、Cr、Mn、W等高熔点金属,采用铝热反应,答案选⑤。
15. Fe Fe3O4 FeCl2 Fe(OH)3 4Fe(OH)2+O2+2H2O===4Fe(OH)3 2Fe2++Cl2===2Cl-+2Fe3+ Fe+2Fe3+===3Fe2+
红褐色固体为氢氧化铁,说明转化关系中含有铁元素,则A为铁。B为黑色晶体,为四氧化三铁。结合转化关系图解答。
红褐色固体为氢氧化铁,说明转化关系中含有铁元素,则A为铁。B为黑色晶体,为四氧化三铁,B和盐酸反应生成氯化亚铁和氯化铁,根据转化关系分析,D为氯化铁,C为氯化亚铁,E为氢氧化亚铁。则
(1)根据以上分析,A为Fe,B为Fe3O4,C为FeCl2,F为Fe(OH)3;
(2)反应⑧为氢氧化亚铁和氧气、水反应生成氢氧化铁,方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
反应④为亚铁离子被氯气氧化生成铁离子,离子方程式为:2Fe2++Cl2=2Fe3++2Cl—;
反应⑤为铁离子变成亚铁离子,离子方程式为:2Fe3++Fe=3Fe2+。
16.(1)为B中的反应提供水蒸气
(2)
(3)防止铁粉被装置中的空气(或氧气)氧化
(4)
(5) 被过量的氯水氧化 铁粉
(6)
根据实验铁粉与水蒸气在高温下反应生成Fe3O4和H2,A装置水蒸气的产生装置,B为铁粉与水蒸气反应的装置,C安全瓶,D为氢气的干燥装置,E和无水硫酸铜,为氢气的检验装置,以此来解析;
(1)仪器A的名称为圆底烧瓶;
(2)硬质玻璃管B中发生的反应为铁与水蒸气的反应生成Fe3O4和H2,反应方程式为3Fe+4H2O(g)Fe3O4+4H2(g);
(3)加热时铁能够与氧气反应,反应前应该先将装置内的空气排尽;
(4)无水硫酸铜粉末变蓝色,说明反应产生了水,黑色氧化铜变红,说明有还原性性气体参与反应,根据元素守恒可知铁跟水蒸气反应生成的气体为H2;
(5)①褪色后的溶液中继续滴加KSCN溶液,又出现红色,说明三价铁离子仍然存在,褪色的原因是硫氰化钾具有还原性,能够被氯气氧化;
②酸性高锰酸钾与亚铁离子发生氧化还原反应生成铁离子和锰离子,根据锰的化合价由+7价降低为+2价,铁的化合价由+2价升高为+3价,根据化合价升降守恒和原子守恒和电荷守恒配平的离子方程式为:5Fe2++MnO+8H+=5Fe3++Mn2++4H2O;
③淡黄色溶液为铁离子,铁离子的化合价为+3价,变为二价铁,化合价降低,需要加还原价,加入铁,反应的离子方程式为:2Fe3++Fe=3Fe2+;
(6)根据铁的价类图,Y物质为碱且为+2价,且为铁,所以为Fe(OH)2;Fe(OH)2在潮湿的空气中转化为同类别的物质只能为Fe(OH)3,铁的化合价由+2价变为+3价,化合价升高,需要氧化剂,潮湿的空气中有氧气氧化,反应的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
17. Fe3++3H2OFe(OH)3(胶体)+3H+ 2Fe3++Cu=2Fe2++Cu2+ 取少量滤液E于试管中,先加KSCN溶液,无现象,再加新制氯水,溶液变为血红色,则滤液E中含有Fe2+ 2Fe2++Cl2=2Fe3++2Cl- 100mL容量瓶 2.2 C 打开 检验B装置导管出口处排出的氢气的纯度,当排出的H2纯净时,空气已排尽 关闭e 4Fe(OH)2+O2+2H2O=4Fe(OH)3 ①②③
探究一(1)将FeCl3溶液滴入沸水可以生成Fe(OH)3胶体和氯化氢,反应离子方程式是Fe3++3H2OFe(OH)3(胶体)+3H+;
(2)FeCl3溶液与铜反应生成氯化亚铁和氯化铜,反应的离子方程式是2Fe3++Cu=2Fe2++Cu2+;
(3)根据分析,滤液E中的溶质是氯化亚铁,检验滤液E中亚铁离子的方法是:取少量滤液E于试管中,先加KSCN溶液,无现象,再加新制氯水,溶液变为血红色,则滤液E中含有Fe2+;
(4)氯化亚铁溶液通入氯气生成氯化铁,发生反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-。
探究二:(1)配制90mL0.10mol·L-1FeBr2溶液,需要选用规格为100mL的容量瓶,用天平称取一定质量的溴化亚铁,在烧杯中溶解,并用玻璃棒搅拌,冷却后用玻璃棒引流转移到100mL的容量瓶中,洗涤烧杯、玻璃棒2~3次,并把洗涤液转移到容量瓶,向容量瓶中加水,液面离刻度线1~2cm时改用胶头滴管加水至刻度线,摇匀,配制过程中需要使用的仪器为:烧杯、玻璃棒、胶头滴管,还缺少的仪器为100mL容量瓶;
(2)配制90mL0.10mol·L-1FeBr2溶液,需要选用规格为100mL的容量瓶,m=0.10mol·L-1×0.1L×216g/mol≈2.2g,用托盘天平称量FeBr2的质量为2.2g;
(3)a.根据“左=右+游”,用“左码右物”的称量方法称量固体质量(使用游码)会偏小,故a错误;
b.将称量的FeBr2放入烧杯中,加少量蒸馏水溶解,故b错误;
c.为保证溴化亚铁完全移入容量瓶,洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中,故c正确;
d.容量瓶不能长期保存配制好的溶液,故d错误;
e.定容时,仰视容量瓶刻度线,溶液体积偏大,会使配制的FeBr2溶液浓度偏低,故e错误;选c;
探究三:(1)实验开始时要用氢气排出B中的空气,(活塞f关闭),所以止水夹e是打开的。
(2)检验B装置导管出口处排出的氢气的纯度,当排出的H2纯净时,空气已排尽。
(3)排尽装置内空气后,关闭e,A中的硫酸亚铁被压入B,与氢氧化钠反应生成氢氧化亚铁沉淀 ;
(4)开启活塞f放掉约液体,空气进入B,氢氧化亚铁被氧化为氢氧化铁,此时装置B中发生反应的方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(5)①试管内生成氢气排出空气,氢氧化亚铁与空气隔绝,能较长时间看到Fe(OH)2白色沉淀;②试管A内生成氢气排出B中的空气,氢氧化亚铁与空气隔绝,能较长时间看到Fe(OH)2白色沉淀;③苯隔绝空气,氢氧化亚铁与氧气隔绝,能较长时间看到Fe(OH)2白色沉淀;故选①②③。
18.(1)
(2)干燥氯气
(3)碱石灰
(4)②
(5)35.74
(6) 偏高 在AB装置间增加一个盛有饱和食盐水的洗气瓶,除去Cl2中的HCl
(1)用与浓盐酸反应制取氯气,离子方程式为:;
(2)氯化铁易吸收空气中的水分而潮解,需除去Cl2中的水蒸气,所以装置B中浓硫酸的作用是干燥氯气;
(3)D中装的药品是碱石灰,碱石灰主要成分是固体氢氧化钠和氧化钙,可用于吸收未反应的氯气,同时防止空气中水蒸气进入装置C中,使氯化铁潮解;
(4)具有还原性,能使酸性高锰酸钾溶液褪色,故可以用酸性高锰酸钾溶液检验产物中是否混有,答案选②;
(5)红棕色固体为Fe2O3,,则该样品中铁元素的质量分数为;
(6)①氯化铁中铁元素的质量分数小于氯化亚铁中铁元素的质量分数,用题目所给的装置制得的产物中若铁元素含量偏高,说明含有氯化亚铁;
②炽热铁粉与氯化氢反应生成氯化亚铁,要得到较纯净的无水氯化铁,故需除去Cl2中的HCl,改进措施是在AB装置间增加一个盛有饱和食盐水的洗气瓶,除去Cl2中的HCl。
19. 1.12L 0.4 mol·L-1
(1)Na2O2投入一定量的水中,反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,7.8gNa2O2的物质的量为,则生成0.05molO2,在标准状况下的体积为0.05mol×22.4L/mol=1.12L;
(2)反应后溶液的溶质为NaOH,物质的量为0.2mol,则溶液的物质的量浓度c=。
20. 64g·mol-1 32 2.24L 7g 5.6L
Ⅰ.(1)标准状况下448mL气体的物质的量为0.02mol,则该气体氧化物的摩尔质量为:1.28g/0.02mol=64g/mol。
(2)R的相对原子质量为64-2×16=32。
(3)3.6g水的物质的量为3.6g/18g·mol-1=0.2mol。含有的氧原子的物质的量为0.2moL。含有0.2mol氧原子的RO2的物质的量为0.1mol,在标准状况下的体积为0.1mol×22.4L/mol=2.24L。
Ⅱ.标准状况下11.2L二氧化碳的物质的量为0.5moL。设原混合气中二氧化碳的物质的量为x,一氧化碳的物质的量为y。则有x+y=0.5,44x+28y=18。解得x=0.25,y=0.25。
(1)0.25molCO的质量为0.25mol×28g/mol=7g。
(2)0.25molCO2在标准状况下的体积为0.25mol×22.4L/mol=5.6L。故答案为标准状况下11.2L二氧化碳的物质的量为0.5moL。设原混合气中二氧化碳的物质的量为x,一氧化碳的物质的量为y。则有x+y=0.5,44x+28y=18。解得x=0.25,y=0.25。0.25molCO2在标准状况下的体积为0.25mol×22.4L/mol=5.6L。
21. m(Na2O2)=39g,m(Na2O)=31g 5.6L
解:设混合物中Na2O2和Na2O的物质的量各为x、y,则
所以有x×78g/mol+y×62g/mol=70g、×100%=50%
解得:x=05mol、y=05mol。
因此(1)m(Na2O2)=05mol×78g/mol=39g,m(Na2O)=05mol×62g/mol=31g。
(2)n(O2)=0.25mol,则V(O2)=0.25mol×22.4L/mol=5.6L。
22. H2 Al2O3 2Al+2H2O+2NaOH=2NaAlO2+3H2↑ Al3+ +3NH3·H2O=Al(OH)3 ↓ +3NH4+
甲是典型的两性氧化物,甲既能与酸反应又能与碱反应,则甲为Al2O3,甲与氢氧化钠反应生成乙,则乙为NaAlO2,甲也是工业上制取A的主要原料,而A能与NaOH反应生成乙和C,故C为H2,A为Al,A与B反应生成氧化铝,则B为O2,甲与硫酸反应生成丁为AlCl3,丁与过量氨水反应生成丙为Al(OH)3。
(1)根据以上分析可知C是H2,甲是Al2O3;
(2)铝与氢氧化钠溶液反应的离子方程式为2Al+2H2O+2NaOH=2NaAlO2+3H2↑;
(3)丁与过量氨水反应的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
(4)上述反应中既属于氧化还原反应,又属于化合反应的是铝在氧气中燃烧生成氧化铝,可表示为。
